Đáp án
1B
2D
3B
4B
5A
6C
7A
8C
9A
10B
11D
12A
13B
14A
15C
16C
17C
18D
19B
20D
21A
22B
23A
24D
25D
26C
27D
28C
29B
30A
31D
32A
33B
34D
35B
36B
37C
38B
39C
40C
Đáp án Đề minh họa số 23 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [311160]: Dung dịch NaOH phản ứng được với dung dịch của chất nào sau đây?
A, BaCl2.
B, NaHCO3.
C, NaNO3.
D, K2SO4.
Giải: Ta có phản ứng: NaHCO3 + NaOH → Na2CO3 + H2O ⇒ Chọn B
Câu 2 [983257]: Số nguyên tử cacbon trong phân tử axit panmitic là
A, 17.
B, 18.
C, 19.
D, 16.
HD: Cấu tạo 3D axit panmitic:

⇝ Tương ứng công thức phân tử: C16H32O2
⇝ Số nguyên tử cacbon trong phân tử axit panmitic là 16.

⇝ Tương ứng công thức phân tử: C16H32O2
⇝ Số nguyên tử cacbon trong phân tử axit panmitic là 16.
Câu 3 [256261]: Công thức cấu tạo thu gọn của anđehit axetic là
A, OHC–CHO.
B, CH3–CHO.
C, HCHO.
D, CH2=CH–CHO.
HD: Phân tích các đáp án:
| Công thức | A. OHC–CHO. | B. CH3CHO. | C. HCHO. | D. CH2=CH–CHO. |
| Tên gọi | anđehit oxalic | anđehit axetic (✔️) | anđehit fomic | anđehit acrylic |
Câu 4 [982762]: Số nguyên tử oxi trong phân tử valin là
A, 3.
B, 2.
C, 4.
D, 1.
HD: Cấu tạo của valin: 
⇒ Số nguyên tử oxi trong phân tử valin là 2 ⇝ Chọn đáp án B. ♦

⇒ Số nguyên tử oxi trong phân tử valin là 2 ⇝ Chọn đáp án B. ♦
Câu 5 [60160]: Nước cứng là nước chứa nhiều ion
A, Ca2+, Mg2+.
B, Mg2+, Na+.
C, Ca2+, Ba2+.
D, Ca2+, K+.

Câu 6 [983246]: Ở nhiệt độ thường kim loại Al tan hoàn toàn trong lượng dư dung dịch nào sau đây?
A, NaNO3.
B, Na2SO4.
C, KOH.
D, KCl.
HD: ► Al là một kim loại vừa tác dụng được với axit mạnh, vừa tác dụng được bazơ mạnh:
• 2Al + 6HCl → 2AlCl3 + 3H2↑.
• 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑.
⇒ Trong 4 phương án, thoả mãn là đáp án C. KOH.
• 2Al + 6HCl → 2AlCl3 + 3H2↑.
• 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑.
⇒ Trong 4 phương án, thoả mãn là đáp án C. KOH.
Câu 7 [57665]: Cặp kim loại nào sau đây có nhiệt độ nóng chảy cao nhất và thấp nhất?
A, W, Hg.
B, Au, W.
C, Fe, Hg.
D, Cu, Hg.
Giải: – Kim loại có nhiệt độ nóng chảy thấp nhất và cao nhất là Hg và W.
– Kim loại có khối lượng riêng thấp nhất và cao nhất là Li và Os.
– Kim loại độ cứng thấp nhất và cao nhất là Cs và Cr.
⇒ chọn A.
– Kim loại có khối lượng riêng thấp nhất và cao nhất là Li và Os.
– Kim loại độ cứng thấp nhất và cao nhất là Cs và Cr.
⇒ chọn A.
Câu 8 [60469]: Thành phần chính của loại quặng nào sau đây không chứa sắt?
A, Manhetit.
B, Hematit.
C, Apatit.
D, Xiđêrit.
HD:
☆ Quặng apatit là một nhóm các khoáng vật photphat bao gồm hiđroxylapatit, floroapatit và cloroapatit. Công thức chung của apatit được biểu diễn theo dạng nhóm thành phần như Ca5(PO4)3(OH, F, Cl), hoặc theo công thức riêng của từng loại riêng lẻ tương ứng như: Ca5(PO4)3(OH), Ca5(PO4)3F và Ca5(PO4)3Cl.
| Quặng | A. Manhetit. | B. Hematit. | C. Apatit. | D. Xiđêrit. |
| Thành phần chính | Fe3O4 | Fe2O3 | Ca5(PO4)3(OH, F, Cl) | FeCO3 |
Câu 9 [57710]: Khi đốt nóng, khí clo không tác dụng trực tiếp với
A, khí O2.
B, kim loại Na.
C, kim loại Fe.
D, kim loại Al.
HD: Khí clo (Cl2) không tác dụng trực tiếp với khí O2.
► Cl2 tác dụng được với các kim loại thu được muối clorua tương ứng:
☑ 2Na + Cl2 → 2NaCl.
☑ 2Fe + 3Cl2 → 2FeCl3.
☑ 2Al + 3Cl2 → 2AlCl3 . ❒
► Cl2 tác dụng được với các kim loại thu được muối clorua tương ứng:
☑ 2Na + Cl2 → 2NaCl.
☑ 2Fe + 3Cl2 → 2FeCl3.
☑ 2Al + 3Cl2 → 2AlCl3 . ❒
Câu 10 [906833]: Chất X có công thức Fe(OH)2. Tên gọi của X là
A, sắt (III) hiđroxit.
B, sắt (II) hiđroxit.
C, sắt (III) oxit.
D, sắt (II) oxit.
HD: Phân tích các đáp án:
| Tên gọi | sắt (III) hiđroxit. | sắt (II) hiđroxit. | sắt (III) oxit. | sắt (II) oxit. |
| Cấu tạo | Fe(OH)3 | Fe(OH)2 | Fe2O3 | FeO |
| ❌ | ✔️ | ❌ | ❌ |
Câu 11 [15080]: Một amin có trong cây thuốc lá rất độc, nó là tác nhân chính gây ra bệnh viêm phổi, ho lao. Amin đó là
A, benzylamin.
B, anilin.
C, trimetylamin.
D, nicotin.
HD: Nicotin là amin có trong cây thuốc lá rất độc, nó là tác nhân chính gây ra bệnh viêm phổi, ho lao ⇝ Chọn đáp án D. ♠


Câu 12 [233837]: Ở trạng thái cơ bản, số electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A, 2.
B, 4.
C, 1.
D, 3.
HD: kim loại kiềm thổ thuộc nhóm IIA, lớp ngoài cùng của nguyên tử chỉ có 2 electron.
Câu 13 [982756]: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A, NaCl.
B, NaOH.
C, KHSO4.
D, KNO3.
HD: dung dịch NaCl, KNO3 có môi trường trung tính, pH = 7, không làm quỳ tím đổi màu.
Dung dịch NaOH có môi trường bazơ, pH > 7, làm quỳ tím hóa xanh.
Dung dịch KHSO4 có môi trường axit, pH < 7, làm quỳ tím hóa đỏ.
Dung dịch NaOH có môi trường bazơ, pH > 7, làm quỳ tím hóa xanh.
Dung dịch KHSO4 có môi trường axit, pH < 7, làm quỳ tím hóa đỏ.
Câu 14 [229110]: Cho các kim loại: Al, Cu, Fe, K. Kim loại dễ bị oxi hóa nhất là
A, K.
B, Al.
C, Cu.
D, Fe.
Đáp án: A
Câu 15 [973507]: Xà phòng hóa CH3COOC2H5 trong dung dịch NaOH đun nóng, thu được muối có công thức là
A, C2H5ONa.
B, C2H5COONa.
C, CH3COONa.
D, HCOONa.
HD: Phản ứng xảy ra:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH. ⇝ Chọn đáp án C. ♣
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH. ⇝ Chọn đáp án C. ♣
Câu 16 [906744]: Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
A, Poli(vinyl clorua).
B, Polietilen.
C, Poli(hexametylen ađipamit).
D, Polibutađien.
HD: Bài học phân loại tổng hợp polime:
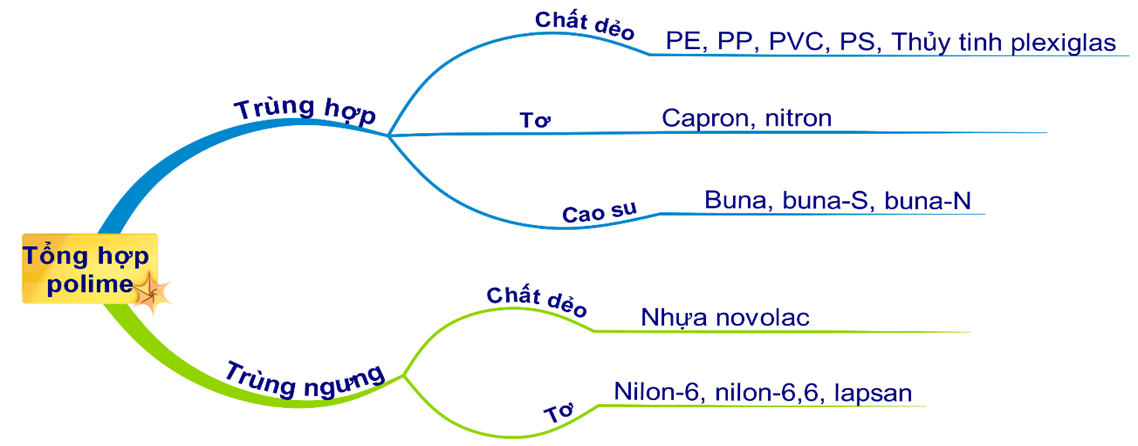
⇒ Poli(hexametylen ađipamit) được điều chế bằng phản ứng trùng ngưng:


⇒ Poli(hexametylen ađipamit) được điều chế bằng phản ứng trùng ngưng:

Câu 17 [61477]: Dù bị khuyến cáo là ảnh hưởng tiêu cực đến sức khỏe người tiêu dùng nhưng trong thực tế người ta vẫn thường ủ trái cây với đất đèn để trái cây mau chín và chín đều. Thành phần hóa học chính của đất đèn có
A, C2H2.
B, CaCO3.
C, CaC2.
D, C2H4
Giải: ● CaC2 là thành phần hóa học chính của đất đèn ||⇒ chọn C.
CaC2 + H2O → Ca(OH)2 + C2H2 ||⇒ C2H2 là thành phần chính của khí đất đèn.
CaC2 + H2O → Ca(OH)2 + C2H2 ||⇒ C2H2 là thành phần chính của khí đất đèn.
Câu 18 [59328]: Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
A, Na.
B, Al.
C, Mg.
D, Fe.
HD: ☆ Phương pháp nhiệt luyện: dùng điều chế các kim loại có độ hoạt động trung bình như Zn, Fe, Sn, Pb,… bằng cách sử dụng các chất khử như C, CO, H2 hoặc các kim loại hoạt động như Al để khử ion kim loại trong hợp chất ở nhiệt độ cao |⇝ Na, Mg, Al không thể điều chế bằng phương pháp nhiệt luyện. ❒
Câu 19 [906831]: Kim loại nào sau đây là kim loại kiềm?
A, Ca.
B, Na.
C, Zn.
D, Ba.
HD: Mẹo nhớ: Lính nào không rượu cà fê (hay Lâu nay không rảnh cà fê)
⇝ Tương ứng với dãy kim loại kiềm: Li Na K Rb Cs Fr ⇝ Chọn đáp án B. ♦
⇝ Tương ứng với dãy kim loại kiềm: Li Na K Rb Cs Fr ⇝ Chọn đáp án B. ♦
Câu 20 [911586]: Glucozơ là một loại monosaccarit có nhiều trong quả nho chín. Công thức phân tử của glucozơ là
A, C2H4O2.
B, (C6H10O5)n.
C, C12H22O11.
D, C6H12O6.
HD: Glucozơ: CH2OH[CHOH]4CHO ⇝ CTPT của glucozơ là C6H12O6.
Câu 21 [11895]: Dãy gồm các chất đều có khả năng tham gia phản ứng tráng bạc là
A, glucozơ, fructozơ và axit fomic.
B, fructozơ, glixerol và anđehit axetic.
C, glucozơ, glixerol và axit fomic.
D, glucozơ, fructozơ và saccarozơ.
HD: glixerol và saccarozơ không có khả năng tráng bạc → loại B, C, D.
⇒ đáp án A đúng. Các chất: glucozơ, fructozơ và axit fomic đều tráng bạc được:
• glucozơ:![567001[LG2].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567001[LG2].png)
•![567369[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567369[LG].png)
•![567404[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567404[LG].png)
⇒ đáp án A đúng. Các chất: glucozơ, fructozơ và axit fomic đều tráng bạc được:
• glucozơ:
![567001[LG2].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567001[LG2].png)
•
•
![567404[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567404[LG].png)
Câu 22 [506948]: Este X có công thức phân tử C3H6O2. Xà phòng hóa X bằng NaOH thu được m gam muối và thoát ra 5,75 gam etanol. Giá trị của m là
A, 6,8.
B, 8,5.
C, 7,6.
D, 7,2.
Thủy phân X có công thức C3H6O2 thu được etanol → X có công thức HCOOC2H5
HCOOC2H5 + NaOH → HCOONa + C2H5OH
Có nC2H5OH = nHCOONa = 0,125 mol → m= 8,5 gam
Đáp án B.
HCOOC2H5 + NaOH → HCOONa + C2H5OH
Có nC2H5OH = nHCOONa = 0,125 mol → m= 8,5 gam
Đáp án B.
Câu 23 [679861]: Hỗn hợp FeO và Fe2O3 tác dụng với lượng dư dung dịch nào sau đây không thu được muối sắt(II)?
A, HNO3 đặc, nóng.
B, HCl.
C, H2SO4 loãng.
D, NaHSO4.
HD: HNO3 có tính oxi hoá mạnh, sẽ oxi hoá FeO thành muối sắt(III):
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
Còn Fe2O3 + 6HNO3 → Fe(NO3)3 + 3H2O.
⇒ Hỗn hợp FeO và Fe2O3 tác dụng với lượng dư dung dịch HNO3 chỉ thu được muối sắt(III).
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
Còn Fe2O3 + 6HNO3 → Fe(NO3)3 + 3H2O.
⇒ Hỗn hợp FeO và Fe2O3 tác dụng với lượng dư dung dịch HNO3 chỉ thu được muối sắt(III).
Câu 24 [12417]: Để thu được 59,4 gam xenlulozơ trinitrat cần phải lấy bao nhiêu mol HNO3, biết hiệu suất phản ứng đạt 80%?
A, 0,60.
B, 2,48.
C, 0,80.
D, 0,75.
HD: Tỉ lệ phản ứng xảy ra:
![567230[LG].png](https://ai.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567230[LG].png)
⇒ nHNO3 = nmắt xích C6H7O2(ONO2)3 = 3 × 59,4 ÷ 297 = 0,6 mol.
► Thật chú ý có hiệu suất 80% nên lượng HNO3 cần dùng là 0,6 ÷ 0,8 = 0,75 mol ⇝ Chọn đáp án D. ♠
![567230[LG].png](https://ai.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567230[LG].png)
⇒ nHNO3 = nmắt xích C6H7O2(ONO2)3 = 3 × 59,4 ÷ 297 = 0,6 mol.
► Thật chú ý có hiệu suất 80% nên lượng HNO3 cần dùng là 0,6 ÷ 0,8 = 0,75 mol ⇝ Chọn đáp án D. ♠
Câu 25 [906762]: Hòa tan hết 1,68 gam kim loại R (hóa trị II) trong dung dịch H2SO4 loãng thu được 0,07 mol H2. Kim loại R là
A, Zn.
B, Fe.
C, Ba.
D, Mg.
HD: Phản ứng: R + H2SO4 → RSO4 (R có hoá trị II) + H2↑.
Giả thiết nH2 = 0,07 mol ⇒ nR = 0,07 mol.
Lại có mR = 1,68 gam ⇒ R = 1,68 ÷ 0,07 = 24 cho biết R là Mg.
Giả thiết nH2 = 0,07 mol ⇒ nR = 0,07 mol.
Lại có mR = 1,68 gam ⇒ R = 1,68 ÷ 0,07 = 24 cho biết R là Mg.
Câu 26 [24614]: Cho một peptit X được tạo nên bởi n gốc alanin có khối lượng phân tử là 302 đvC. Peptit X thuộc loại
A, pentapepit.
B, đipetit.
C, tetrapeptit.
D, tripetit.
Giải: nAla → Peptit (Alan) + (n - 1)H2O. Bảo toàn khối lượng:
89n = 302 + 18 × (n - 1) ⇒ n = 4 ⇒ X là tetrapeptit ⇒ chọn C.
89n = 302 + 18 × (n - 1) ⇒ n = 4 ⇒ X là tetrapeptit ⇒ chọn C.
Câu 27 [679455]: Cho các polime: poli(vinyl clorua), xenlulozơ, policaproamit, polistiren, xenlulozơ triaxetat, nilon-6,6. Số polime tổng hợp là
A, 5.
B, 2.
C, 3.
D, 4.
HD: Bài học phân loại polime:

⇒ Số polime tổng hợp gồm poli(vinyl clorua), policaproamit, polistiren, nilon-6,6.

⇒ Số polime tổng hợp gồm poli(vinyl clorua), policaproamit, polistiren, nilon-6,6.
Câu 28 [62495]: Thí nghiệm hóa học không sinh ra chất khí là
A, Cho kim loại Ba vào dung dịch CuSO4.
B, Nhiệt phân hoàn toàn KMnO4.
C, Sục khí H2S vào dung dịch CuSO4.
D, Cho Na2CO3 vào lượng dư dung dịch H2SO4.

Câu 29 [311876]: Để sản xuất 100,8 kg vôi sống từ một loại đá vôi (chứa 80% CaCO3 về khối lượng, còn lại là tạp chất trơ), người ta phải nung m kg đá vôi đến khối lượng không đổi. Biết hiệu suất phản ứng nhiệt phân CaCO3 là 100%, giá trị của m là
A, 180.
B, 225.
C, 144.
D, 230.
HD: Vôi sống là CaO ⇝ 100,8 kg ⇄ 1,8 (kmol).
☆ Phản ứng: CaCO3 –––to–→ CaO + CO2.
⇒ nCaCO3 cần = 1,8 kmol ⇒ mCaCO3 cần = 1,8 × 100 = 180 kg.
⇒ mđá vôi chứa 80% CaCO3 = 180 ÷ 0,8 = 225 kg. ❒
☆ Phản ứng: CaCO3 –––to–→ CaO + CO2.
⇒ nCaCO3 cần = 1,8 kmol ⇒ mCaCO3 cần = 1,8 × 100 = 180 kg.
⇒ mđá vôi chứa 80% CaCO3 = 180 ÷ 0,8 = 225 kg. ❒
Câu 30 [679325]: Phát biểu nào sau đây sai?
A, Thủy phân etyl axetat thu được ancol metylic.
B, Etyl fomat có phản ứng tráng bạc.
C, Triolein phản ứng được với nước brom.
D, Ở điều kiện thường, tristearin là chất rắn.
HD: Phân tích các phát biểu:
❌ A. sai. Phản ứng: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (ancol etylic).
✔️ B. đúng. Vì este etyl fomat có dạng ankyl fomat
→ có khả năng tham gia phản ứng tráng bạc.
✔️ C. đúng vì triolein (C17H33COO)3C3H5 có nối đôi C=C → phản ứng được với Br2.
✔️ D. đúng vì tristearin (C17H35COO)3C3H5 là chất béo no → chất rắn ở điều kiện thường.
❌ A. sai. Phản ứng: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (ancol etylic).
✔️ B. đúng. Vì este etyl fomat có dạng ankyl fomat

→ có khả năng tham gia phản ứng tráng bạc.
✔️ C. đúng vì triolein (C17H33COO)3C3H5 có nối đôi C=C → phản ứng được với Br2.
✔️ D. đúng vì tristearin (C17H35COO)3C3H5 là chất béo no → chất rắn ở điều kiện thường.
Câu 31 [52601]: Hòa tan hết 20,0 gam hỗn hợp X gồm Cu và các oxit sắt (trong hỗn hợp X oxi chiếm 16,8% về khối lượng) bằng dung dịch A chứa hỗn hợp b mol HCl và 0,2 mol HNO3 (vừa đủ) thu được 1,344 lít NO (đktc, là sản phẩm khử duy nhất của N+5 ) và dung dịch Y. Cho dung dịch Y tác dụng với một lượng vừa đủ dung dịch AgNO3 thu được m gam kết tủa và dung dịch Z. Cho dung dịch Z tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa, nung đến khối lượng không đổi thu được 22,4 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A, 83,29.
B, 76,81.
C, 70,33.
D, 78,97.
HD: Gộp quá trình và xử lí sơ bộ qua sơ đồ có:

Đầu tiên, ghép cụm nH2O = 2nNO + nO trong oxit đầu = 0,33 mol → nHCl = 0,46 mol (theo bảo toàn H)
Quan sát đầu cuối → ∑nNO3– = 2nO trong oxit cuối = (22,4 – 16,64) ÷ 16 = 0,72 mol.
bảo toàn N ||→ ∑nAgNO3 = 0,58 mol. Theo đó, m gam tủa gồm 0,58 mol Ag và 0,46 mol Cl.
||→ Yêu cầu m = 0,58 × 108 + 0,46 × 35,5 = 78,97 gam. Chọn D. ♠.
p/s: việc quan sát quá trình + sử dụng đặc trưng dạng Ag, Fe, Cl giúp chúng ta giải nhanh + liền mạch bài tập trên.!

Đầu tiên, ghép cụm nH2O = 2nNO + nO trong oxit đầu = 0,33 mol → nHCl = 0,46 mol (theo bảo toàn H)
Quan sát đầu cuối → ∑nNO3– = 2nO trong oxit cuối = (22,4 – 16,64) ÷ 16 = 0,72 mol.
bảo toàn N ||→ ∑nAgNO3 = 0,58 mol. Theo đó, m gam tủa gồm 0,58 mol Ag và 0,46 mol Cl.
||→ Yêu cầu m = 0,58 × 108 + 0,46 × 35,5 = 78,97 gam. Chọn D. ♠.
p/s: việc quan sát quá trình + sử dụng đặc trưng dạng Ag, Fe, Cl giúp chúng ta giải nhanh + liền mạch bài tập trên.!
Câu 32 [982297]: Cho các phát biểu sau:
(a) Amilopectin là polime có mạch không phân nhánh.
(b) Đường glucozơ ngọt hơn đường saccarozơ.
(c) Dùng phản ứng màu biure phân biệt được Gly-Ala với Gly-Ala-Gly.
(d) Cồn 70° có tác dụng diệt virut nên được dùng làm nước rửa tay ngăn ngừa COVID-19.
(e) Trong cơ thể người, chất béo bị oxi hóa chậm thành CO2, H2O và cung cấp năng lượng.
Số phát biểu đúng là
(a) Amilopectin là polime có mạch không phân nhánh.
(b) Đường glucozơ ngọt hơn đường saccarozơ.
(c) Dùng phản ứng màu biure phân biệt được Gly-Ala với Gly-Ala-Gly.
(d) Cồn 70° có tác dụng diệt virut nên được dùng làm nước rửa tay ngăn ngừa COVID-19.
(e) Trong cơ thể người, chất béo bị oxi hóa chậm thành CO2, H2O và cung cấp năng lượng.
Số phát biểu đúng là
A, 3.
B, 5.
C, 4.
D, 2.
HD: Phân tích các đáp án:
❌ (a) sai. Rất ít polime học có mạch phân nhánh nên dễ nhớ amilopectin có mạch phân nhánh.
❌ (b) sai. Thứ tự độ ngọt các đường học: fructozơ > saccarozơ > glucozơ.
✔️ (c) đúng. tripeptit có phản ứng màu biure, tạo phức tan màu tím đặc trưng, còn đipeptit thì không ⇝ phân biệt được.
✔️ (d) đúng theo ứng dụng của ancol etylic.
✔️ (e) đúng. Xem kiến thức lại kiến thức sinh học, chuyển hoá chất béo trong cơ thể.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
❌ (a) sai. Rất ít polime học có mạch phân nhánh nên dễ nhớ amilopectin có mạch phân nhánh.
❌ (b) sai. Thứ tự độ ngọt các đường học: fructozơ > saccarozơ > glucozơ.
✔️ (c) đúng. tripeptit có phản ứng màu biure, tạo phức tan màu tím đặc trưng, còn đipeptit thì không ⇝ phân biệt được.
✔️ (d) đúng theo ứng dụng của ancol etylic.
✔️ (e) đúng. Xem kiến thức lại kiến thức sinh học, chuyển hoá chất béo trong cơ thể.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
Câu 33 [311300]: Cho các phản ứng xảy ra theo sơ đồ sau :
X1 + H2O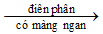 X2 + X3↑ + H2↑
X2 + X3↑ + H2↑
X2 + X4 → BaCO3↓ + K2CO3 + H2O.
Chất X2, X4 lần lượt là
X1 + H2O
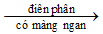 X2 + X3↑ + H2↑
X2 + X3↑ + H2↑X2 + X4 → BaCO3↓ + K2CO3 + H2O.
Chất X2, X4 lần lượt là
A, NaOH, Ba(HCO3)2.
B, KOH, Ba(HCO3)2.
C, KHCO3, Ba(OH)2.
D, NaHCO3, Ba(OH)2.
HD: X2 + X4 thu sản phẩm không có Na nên loại A và D.
X2 là sản phẩm điện phân X1 + H2O (có màng ngăn) nên X2 là KOH. Theo đó, quá trình:
(1) (X1) 2KCl + 2H2O ––đpddcmn→ 2KOH + Cl2↑ + H2↑
(2) 2KOH + Ba(HCO3)2 → BaCO3↓ + K2CO3 + H2O. ❒
X2 là sản phẩm điện phân X1 + H2O (có màng ngăn) nên X2 là KOH. Theo đó, quá trình:
(1) (X1) 2KCl + 2H2O ––đpddcmn→ 2KOH + Cl2↑ + H2↑
(2) 2KOH + Ba(HCO3)2 → BaCO3↓ + K2CO3 + H2O. ❒
Câu 34 [138829]: Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
| Thời gian điện phân (giây) | t | t + 2895 | 2t |
| Tổng số mol khí ở hai điện cực | a | a + 0,03 | 2,125a |
| Số mol Cu ở catot | b | b + 0,02 | b + 0,02 |
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
A, Tăng 0,032 gam.
B, Giảm 0,256 gam.
C, Giảm 0,56 gam.
D, Giảm 0,304 gam.
HD: ☆ Phân tích thời gian:
• Thời gian t giây thu được a mol khí ở hai điện cực và b mol Cu.
• Thêm 2895 giây ⇒ ne trao đổi thêm = It ÷ 96500 = 0,06 mol.
☆ Điện phân CuSO4 + 2NaCl → Cu↓ + Cl2↑ + Na2SO4 (1).
⇒ vì 0,02 × 2 < 0,06 nên tại (t + 2895) giây thì Cu2+ hết, H2O bị điện phân tạo khí H2.
⇒ nH2 thoát ra bên catot = (0,06 – 0,02 × 2) ÷ 2 = 0,01 mol ⇒ nkhí thêm bên anot = 0,02 mol.
Gọi nCl2 thêm = x mol; nO2 thêm = y mol ⇒ x + y = 0,02 mol.
Và ne trao đổi thêm bên anot = 2x + 4y = 0,06 ⇒ Giải: x = y = 0,01 mol.
⇒ Do đó, sau t giây đầu thì chỉ xảy ra quá trình (1) ⇒ a = b.
• Thời gian 2t giây: ne trao đổi = 2a × 2 = 4a ⇒ nH2 ra bên catot = [4a – (b + 0,02) × 2] ÷ 2 = a – 0,02 mol.
Bên anot, tổng Cl2 ra là (a + 0,01) mol ⇒ O2 thoát ra [4a – 2 × (a + 0,01)] ÷ 4 = 0,5a – 0,005 mol.
Theo đó: ∑nkhí thoát ra 2 cực là (a + 0,01) + (0,5a – 0,005) + (a – 0,02) = 2,125a ⇒ a = 0,04 mol.
⇝ đọc ra dung dịch ban đầu gồm 0,06 mol CuSO4 và 0,1 mol NaCl.
☆ Xét tại t = 5404 giây thì ne trao đổi = 0,112 mol ⇒ đọc dung dịch ra: 0,05 mol CuCl2; 0,006 mol CuO
⇒ dung dịch sau điện phân thu được gồm 0,05 mol Na2SO4; 0,006 mol H2SO4 và 0,004 mol CuSO4.
Nhúng thanh sắt vào thì: Fe + CuSO4 → FeSO4 + Cu || Fe + H2SO4 → FeSO4 + H2↑.
⇒ Δmthanh sắt tăng = 0,004 × (64 – 56) – 0,006 × 56 = – 0,304 gam.
⇄ khối lượng thanh sắt giảm 0,304 gam. ❒
• Thời gian t giây thu được a mol khí ở hai điện cực và b mol Cu.
• Thêm 2895 giây ⇒ ne trao đổi thêm = It ÷ 96500 = 0,06 mol.
☆ Điện phân CuSO4 + 2NaCl → Cu↓ + Cl2↑ + Na2SO4 (1).
⇒ vì 0,02 × 2 < 0,06 nên tại (t + 2895) giây thì Cu2+ hết, H2O bị điện phân tạo khí H2.
⇒ nH2 thoát ra bên catot = (0,06 – 0,02 × 2) ÷ 2 = 0,01 mol ⇒ nkhí thêm bên anot = 0,02 mol.
Gọi nCl2 thêm = x mol; nO2 thêm = y mol ⇒ x + y = 0,02 mol.
Và ne trao đổi thêm bên anot = 2x + 4y = 0,06 ⇒ Giải: x = y = 0,01 mol.
⇒ Do đó, sau t giây đầu thì chỉ xảy ra quá trình (1) ⇒ a = b.
• Thời gian 2t giây: ne trao đổi = 2a × 2 = 4a ⇒ nH2 ra bên catot = [4a – (b + 0,02) × 2] ÷ 2 = a – 0,02 mol.
Bên anot, tổng Cl2 ra là (a + 0,01) mol ⇒ O2 thoát ra [4a – 2 × (a + 0,01)] ÷ 4 = 0,5a – 0,005 mol.
Theo đó: ∑nkhí thoát ra 2 cực là (a + 0,01) + (0,5a – 0,005) + (a – 0,02) = 2,125a ⇒ a = 0,04 mol.
⇝ đọc ra dung dịch ban đầu gồm 0,06 mol CuSO4 và 0,1 mol NaCl.
☆ Xét tại t = 5404 giây thì ne trao đổi = 0,112 mol ⇒ đọc dung dịch ra: 0,05 mol CuCl2; 0,006 mol CuO
⇒ dung dịch sau điện phân thu được gồm 0,05 mol Na2SO4; 0,006 mol H2SO4 và 0,004 mol CuSO4.
Nhúng thanh sắt vào thì: Fe + CuSO4 → FeSO4 + Cu || Fe + H2SO4 → FeSO4 + H2↑.
⇒ Δmthanh sắt tăng = 0,004 × (64 – 56) – 0,006 × 56 = – 0,304 gam.
⇄ khối lượng thanh sắt giảm 0,304 gam. ❒
Câu 35 [982030]: Cho E, Z, F, T đều là các hợp chất hữu cơ no, mạch hở và thỏa mãn sơ đồ các phản ứng:
(1) E + NaOH → X + Y + Z
(2) X + HCl → F + NaCl
(3) Y + HCl → T + NaCl
Biết E chỉ chứa nhóm chức este và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; ME < 168; MZ < MF < MT.
Cho các phát biểu sau:
(a) Chất F được dùng để điều chế khí CO trong phòng thí nghiệm.
(b) 1 mol chất T phản ứng với kim loại Na dư, thu được tối đa 1 mol H2.
(c) Nhiệt độ sôi của Z cao hơn nhiệt độ sôi của C2H5OH.
(d) Có hai công thức cấu tạo của E thỏa mãn sơ đồ trên.
(e) Trong phân tử Z và F đều không có liên kết pi.
Số phát biểu đúng là
(1) E + NaOH → X + Y + Z
(2) X + HCl → F + NaCl
(3) Y + HCl → T + NaCl
Biết E chỉ chứa nhóm chức este và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; ME < 168; MZ < MF < MT.
Cho các phát biểu sau:
(a) Chất F được dùng để điều chế khí CO trong phòng thí nghiệm.
(b) 1 mol chất T phản ứng với kim loại Na dư, thu được tối đa 1 mol H2.
(c) Nhiệt độ sôi của Z cao hơn nhiệt độ sôi của C2H5OH.
(d) Có hai công thức cấu tạo của E thỏa mãn sơ đồ trên.
(e) Trong phân tử Z và F đều không có liên kết pi.
Số phát biểu đúng là
A, 1.
B, 2.
C, 4.
D, 3.
HD: Nhận xét: E có số C = số O. mà 6 × (CO) = 6 × 28 = 168 nên số CE = số CO < 6.
Lại có E là este no, mạch hở, E + NaOH → X + Y + Z nên E đa chức.
⇒ E chỉ có thể có công thức là C4H6O4.
Cũng từ E + NaOH → X + Y + Z; và X và Y đều là muối.
⇒ Nếu Z là ancol 2 chức thì CZ ≥ 2; CX ≥ 1 ⇒ từ CY > CX ⇒ CY ≥ 2 ⇒ C E ≥ 2 + 1 + 2 = 5.
Vậy Z là ancol đơn chức ⇝ E chỉ có thể là dạng este nối: HCOOCH2COOCH3.
⇒ Tương ứng: X là HCOONa → F: HCOOH; Y là HOCH2COONa → T: HOCH2COOH; Z là CH3OH. Phân tích các phát biểu:
✔️ (a) HCOOH = CO.H2O –––H2SO4 đặc to–→ CO + H2O (H2SO4 đặc háo nước).
✔️ (b) đúng vì 1HOCH2COOH + 2Na → NaOCH2COONa + 1H2↑.
❌ (c) sai vì nhiệt độ sôi tăng khi số C tăng ⇝ toCH3OH < toC2H5OH.
❌ (d) sai vì như phân tích trên, chỉ có duy nhất một cấu tạo E thoả mãn.
❌ (e) sai vì Z không có liên kết π nhưng trong nhóm COOH của F có nối đôi C=O chứa liên kết π.
⇝ Số phát biểu đúng là 2/5 ⇝ Chọn đáp án B. ♦
Lại có E là este no, mạch hở, E + NaOH → X + Y + Z nên E đa chức.
⇒ E chỉ có thể có công thức là C4H6O4.
Cũng từ E + NaOH → X + Y + Z; và X và Y đều là muối.
⇒ Nếu Z là ancol 2 chức thì CZ ≥ 2; CX ≥ 1 ⇒ từ CY > CX ⇒ CY ≥ 2 ⇒ C E ≥ 2 + 1 + 2 = 5.
Vậy Z là ancol đơn chức ⇝ E chỉ có thể là dạng este nối: HCOOCH2COOCH3.
⇒ Tương ứng: X là HCOONa → F: HCOOH; Y là HOCH2COONa → T: HOCH2COOH; Z là CH3OH. Phân tích các phát biểu:
✔️ (a) HCOOH = CO.H2O –––H2SO4 đặc to–→ CO + H2O (H2SO4 đặc háo nước).
✔️ (b) đúng vì 1HOCH2COOH + 2Na → NaOCH2COONa + 1H2↑.
❌ (c) sai vì nhiệt độ sôi tăng khi số C tăng ⇝ toCH3OH < toC2H5OH.
❌ (d) sai vì như phân tích trên, chỉ có duy nhất một cấu tạo E thoả mãn.
❌ (e) sai vì Z không có liên kết π nhưng trong nhóm COOH của F có nối đôi C=O chứa liên kết π.
⇝ Số phát biểu đúng là 2/5 ⇝ Chọn đáp án B. ♦
Câu 36 [679559]: Thực hiện các thí nghiệm sau:
(a) Sục khí CO2 vào dung dịch NaOH dư.
(b) Cho kim loại Cu vào dung dịch FeCl3 dư.
(c) Cho dung dịch HCl vào dung dịch NaAlO2 dư.
(d) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
(e) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
(a) Sục khí CO2 vào dung dịch NaOH dư.
(b) Cho kim loại Cu vào dung dịch FeCl3 dư.
(c) Cho dung dịch HCl vào dung dịch NaAlO2 dư.
(d) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
(e) Cho dung dịch NaHCO3 vào dung dịch Ca(OH)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
A, 5.
B, 3.
C, 4.
D, 2.
HD: Các phản ứng xảy ra khi tiến hành các thí nghiệm:
❌ (a) CO2 + 2NaOH (dư) → Na2CO3 + H2O.
❌ (b) Cu + 2FeCl3 (dư) → CuCl2 + 2FeCl2.
✔️ (c) HCl + NaAlO2 + H2O → NaCl + Al(OH)3↓ + H2O.
► Chú ý nếu HCl dư thì kết tủa Al(OH)3 mới bị hoà tan, còn ở đây dùng dư NaAlO2.
✔️ (d) Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3.
✔️ (e) NaHCO3 + Ca(OH)2 → NaOH + CaCO3↓ + H2O.
⇝ Có 3/5 thí nghiệm thoả mãn yêu cầu ⇝ Chọn đáp án B. ♦
❌ (a) CO2 + 2NaOH (dư) → Na2CO3 + H2O.
❌ (b) Cu + 2FeCl3 (dư) → CuCl2 + 2FeCl2.
✔️ (c) HCl + NaAlO2 + H2O → NaCl + Al(OH)3↓ + H2O.
► Chú ý nếu HCl dư thì kết tủa Al(OH)3 mới bị hoà tan, còn ở đây dùng dư NaAlO2.
✔️ (d) Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3.
✔️ (e) NaHCO3 + Ca(OH)2 → NaOH + CaCO3↓ + H2O.
⇝ Có 3/5 thí nghiệm thoả mãn yêu cầu ⇝ Chọn đáp án B. ♦
Câu 37 [255815]: Cho X là axit cacboxylic đơn chức, mạch hở; Y là ancol no, đa chức, mạch hở. Đun hỗn hợp gồm 2,5 mol X, 1 mol Y với xúc tác H2SO4 đặc (giả sử chỉ xảy ra phản ứng este hoá giữa X và Y) thu được 2 mol hỗn hợp E gồm X, Y và các sản phẩm hữu cơ (trong đó có chất Z chỉ chứa nhóm chức este). Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho 0,4 mol E tác dụng với Na dư, sau phản ứng hoàn toàn thu được 0,25 mol khí H2.
Thí nghiệm 2: Cho 0,4 mol E vào dung dịch brom dư thì có tối đa 1,0 mol Br2 tham gia phản ứng cộng.
Thí nghiệm 3: Đốt cháy hoàn toàn 0,4 mol E cần vừa đủ 1,95 mol khí O2 thu được CO2 và H2O.
Biết có 12% axit X ban đầu đã chuyển thành Z. Phần trăm khối lượng của Z trong E là
Thí nghiệm 1: Cho 0,4 mol E tác dụng với Na dư, sau phản ứng hoàn toàn thu được 0,25 mol khí H2.
Thí nghiệm 2: Cho 0,4 mol E vào dung dịch brom dư thì có tối đa 1,0 mol Br2 tham gia phản ứng cộng.
Thí nghiệm 3: Đốt cháy hoàn toàn 0,4 mol E cần vừa đủ 1,95 mol khí O2 thu được CO2 và H2O.
Biết có 12% axit X ban đầu đã chuyển thành Z. Phần trăm khối lượng của Z trong E là
A, 12,09%.
B, 8,17%.
C, 10,33%.
D, 6,92%.
HD: Đồng nhất số liệu: gấp 5 tất cả các số liệu ở mỗi thí nghiệm.!
Chú ý tỉ lệ este hoá: –COOH (1 chức axit) + –OH (1 chức ancol) → COO (1 chức este) + H2O (1 nước).
Có hai chú ý đặc biệt ở hệ phản ứng este hoá này:
•1: số mol các chất trước và sau bảo toàn: naxit + nancol = neste + nH2O.
•2: xét phản ứng với Na của hỗn hợp (axit - ancol) tạo 1 mol thì (este; nước) chỉ tạo 0,5 mol ⇒ ta nói cứ 1 mol H2O được tạo thành thì số mol H2 sinh ra giảm một nửa.
► E phức tạp ⇝ tư duy quy đổi về xử lý hỗn hợp axit - ancol ban đầu.
☆ Sử dụng •1: số mol H2Oeste hoá = 2,5 + 1 – 2 = 1,5 mol.
☆ Sử dụng •2: do có 1,5 mol H2O nên nếu để 2,5 mol X và 1 mol Y tác dụng với Na thì số mol H2 sinh ra là 1,25 + 1,5 = 2,75 mol.
Axit dạng CnH?O2 và ancol dạng CmH2m + 2O??.
⇒ nH2↑ = 2,5 ÷ 2 + ?? ÷ 2 = 2,75 ⇒ ?? = 3.
☆ TN2: nBr2 = 5 ⇒ số πC=C = 5 ÷ 2,5 = 2 ⇒ ? = 2n – 4.
☆ Đốt (2,5 mol X + 1 mol Y) hay đốt 2 mol E cần cùng 9,75 mol O2.
⇒ Giải đốt: 2,5 mol CnH2n – 4O2 + 1 mol CmH2m + 2O3 + 9,75 mol O2 → a mol CO2 + b mol H2O.
Tương quan đốt: a – b = ∑nCO2 – ∑nH2O = 2,5 × 2 – 1 = 4.
Lại theo bảo toàn O: 2a + b = 2,5 × 2 + 1 × 3 + 9,75 × 2.
Giải hệ các phương trình có: a = 10,5 và b = 6,5 ⇒ xây dựng phương trình nghiệm nguyên:
2,5n + m = 10,5 ⇒ 5n + 2m = 21 ⇒ Thoả mãn là m = n = 3.
⇒ axit tương ứng: HC≡C-COOH và ancol là C3H5(OH)3.
Z chỉ chứa chức este ⇒ cấu tạo: (HC≡C-COO)3C3H5.
naxit tạo Z = 2,5 × 0,12 = 0,3 mol ⇒ nZ = 0,1 mol.
mE = mX + mY – mH2O = 240 gam.
⇒ Yêu cầu C%mZ/E = 0,1 × 248 ÷ 240 × 100% ≈ 10,33%. ⇝ Chọn đáp án C. ♣
Chú ý tỉ lệ este hoá: –COOH (1 chức axit) + –OH (1 chức ancol) → COO (1 chức este) + H2O (1 nước).
Có hai chú ý đặc biệt ở hệ phản ứng este hoá này:
•1: số mol các chất trước và sau bảo toàn: naxit + nancol = neste + nH2O.
•2: xét phản ứng với Na của hỗn hợp (axit - ancol) tạo 1 mol thì (este; nước) chỉ tạo 0,5 mol ⇒ ta nói cứ 1 mol H2O được tạo thành thì số mol H2 sinh ra giảm một nửa.
► E phức tạp ⇝ tư duy quy đổi về xử lý hỗn hợp axit - ancol ban đầu.
☆ Sử dụng •1: số mol H2Oeste hoá = 2,5 + 1 – 2 = 1,5 mol.
☆ Sử dụng •2: do có 1,5 mol H2O nên nếu để 2,5 mol X và 1 mol Y tác dụng với Na thì số mol H2 sinh ra là 1,25 + 1,5 = 2,75 mol.
Axit dạng CnH?O2 và ancol dạng CmH2m + 2O??.
⇒ nH2↑ = 2,5 ÷ 2 + ?? ÷ 2 = 2,75 ⇒ ?? = 3.
☆ TN2: nBr2 = 5 ⇒ số πC=C = 5 ÷ 2,5 = 2 ⇒ ? = 2n – 4.
☆ Đốt (2,5 mol X + 1 mol Y) hay đốt 2 mol E cần cùng 9,75 mol O2.
⇒ Giải đốt: 2,5 mol CnH2n – 4O2 + 1 mol CmH2m + 2O3 + 9,75 mol O2 → a mol CO2 + b mol H2O.
Tương quan đốt: a – b = ∑nCO2 – ∑nH2O = 2,5 × 2 – 1 = 4.
Lại theo bảo toàn O: 2a + b = 2,5 × 2 + 1 × 3 + 9,75 × 2.
Giải hệ các phương trình có: a = 10,5 và b = 6,5 ⇒ xây dựng phương trình nghiệm nguyên:
2,5n + m = 10,5 ⇒ 5n + 2m = 21 ⇒ Thoả mãn là m = n = 3.
⇒ axit tương ứng: HC≡C-COOH và ancol là C3H5(OH)3.
Z chỉ chứa chức este ⇒ cấu tạo: (HC≡C-COO)3C3H5.
naxit tạo Z = 2,5 × 0,12 = 0,3 mol ⇒ nZ = 0,1 mol.
mE = mX + mY – mH2O = 240 gam.
⇒ Yêu cầu C%mZ/E = 0,1 × 248 ÷ 240 × 100% ≈ 10,33%. ⇝ Chọn đáp án C. ♣
Câu 38 [982296]: Hỗn hợp E gồm hai triglixerit X và Y có tỉ lệ mol tương ứng là 2 : 3. Xà phòng hóa hoàn toàn E bằng dung dịch NaOH dư, thu được hỗn hợp muối gồm C15H31COONa, C17H31COONa và C17H33COONa. Khi cho m gam E tác dụng với H2 dư (xúc tác Ni, t°) thì số mol H2 phản ứng tối đa là 0,07 mol. Mặt khác, đốt cháy hoàn toàn m gam E, thu được 2,65 mol CO2 và 2,48 mol H2O. Khối lượng của X trong m gam E là
A, 24,96 gam.
B, 16,60 gam.
C, 17,12 gam.
D, 16,12 gam.
HD: ☆ Giải đốt E + O2 ––to→ 2,65 mol CO2 + 2,48 mol H2O.
► Tương quan đốt: ∑nCO2 – ∑nH2O = 2nE + nH2 làm no E ⇒ nE = 0,05 mol.
Gọi tổng số mol các gốc axit béo trong E: C15H31COO; C17H31COO và C17H33COO lần lượt là a, b, c mol.
Ta có: a + b + c = 3nE = 0,15 mol và 2b + c = nH2 làm no E = 0,07 mol.
Lại có 0,05 mol E dạng (RCOO)3C3H5 ⇒ ∑nC trong các gốc axit = 2,65 – 0,05 × 3 = 2,5
⇒ 16a + 18b + 18c = 2,5 ⇒ Giải các phương trình có: a = 0,1; b = 0,02 và c = 0,03 mol.
Tỉ lệ nX : nY = 2 : 3 nên nX = 0,02 mol và nY = 0,03 mol.
⇝ vừa đẹp X chứa 1 gốc linoleat; 2 gốc panmitat còn Y chứa 1 gốc oleat và 2 gốc panmitat.
⇒ MX = 890 – 4 – 2 × 28 = 830 ⇒ mX = 0,02 × 830 = 16,6 gam.
► Tương quan đốt: ∑nCO2 – ∑nH2O = 2nE + nH2 làm no E ⇒ nE = 0,05 mol.
Gọi tổng số mol các gốc axit béo trong E: C15H31COO; C17H31COO và C17H33COO lần lượt là a, b, c mol.
Ta có: a + b + c = 3nE = 0,15 mol và 2b + c = nH2 làm no E = 0,07 mol.
Lại có 0,05 mol E dạng (RCOO)3C3H5 ⇒ ∑nC trong các gốc axit = 2,65 – 0,05 × 3 = 2,5
⇒ 16a + 18b + 18c = 2,5 ⇒ Giải các phương trình có: a = 0,1; b = 0,02 và c = 0,03 mol.
Tỉ lệ nX : nY = 2 : 3 nên nX = 0,02 mol và nY = 0,03 mol.
⇝ vừa đẹp X chứa 1 gốc linoleat; 2 gốc panmitat còn Y chứa 1 gốc oleat và 2 gốc panmitat.
⇒ MX = 890 – 4 – 2 × 28 = 830 ⇒ mX = 0,02 × 830 = 16,6 gam.
Câu 39 [679461]: Đốt cháy hoàn toàn m gam hiđrocacbon mạch hở X (28 < MX < 56), thu được 5,28 gam CO2. Mặt khác, m gam X phản ứng tối đa với 19,2 gam Br2 trong dung dịch. Giá trị của m là
A, 2,00.
B, 3,00.
C, 1,50.
D, 1,52.
HD: 28 < MX < 56 ⇒ Hiđrocacbon X có số C là 3 hoặc 4.
☆ Giả thiết: đốt m gam X → 0,12 mol CO2. Phản ứng m gam X + 0,12 mol Br2.
• Nếu CX = 3 ⇒ nX = 0,12 : 3 = 0,04. Tỉ lệ 1X + 3Br2 suy ra X là C3H2 (không có cấu tạo thỏa mãn).
• Nếu CX = 4 ⇒ nX = 0,12 : 4 = 0,03. Tỉ lệ 1X + 4Br2 suy ra X là C4H2 (HC≡C–C≡CH).
Theo đó, m = mX = 0,03 × 50 = 1,50 gam.
☆ Giả thiết: đốt m gam X → 0,12 mol CO2. Phản ứng m gam X + 0,12 mol Br2.
• Nếu CX = 3 ⇒ nX = 0,12 : 3 = 0,04. Tỉ lệ 1X + 3Br2 suy ra X là C3H2 (không có cấu tạo thỏa mãn).
• Nếu CX = 4 ⇒ nX = 0,12 : 4 = 0,03. Tỉ lệ 1X + 4Br2 suy ra X là C4H2 (HC≡C–C≡CH).
Theo đó, m = mX = 0,03 × 50 = 1,50 gam.
Câu 40 [233865]: Dẫn 0,35 mol hỗn hợp gồm khí CO2 và hơi nước qua cacbon nung đỏ thu được 0,62 mol hỗn hợp X gồm CO, H2 và CO2. Cho toàn bộ X vào dung dịch chứa 0,1 mol NaOH và a mol Ba(OH)2, sau phản ứng hoàn toàn thu được kết tủa và dung dịch Y. Nhỏ từ từ từng giọt cho đến hết Y vào 100 ml dung dịch HCl 0,5M thu được 0,01 mol khí CO2. Giá trị của a là
A, 0,05.
B, 0,08.
C, 0,06.
D, 0,10.
Đáp án: C