Đáp án
1D
2B
3D
4A
5D
6D
7D
8B
9A
10B
11B
12B
13A
14B
15C
16A
17A
18D
19B
20A
21B
22D
23
24B
25C
26A
27C
28D
29
30D
31D
32C
33C
34B
35C
36B
37D
38B
39B
40D
Đáp án Đề minh họa số 24 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [62466]: Hóa chất NaOH rắn có thể làm khô các khí nào trong số các khí sau
A, H2S.
B, SO2.
C, CO2.
D, NH3.
HD: NaOH rắn hút ẩm, nhưng phản ứng được với H2S, SO2, CO2. Vì vậy NaOH rắn chỉ làm khô được khí NH3 trong các khí trên.
Câu 2 [679712]: Công thức của triolein là
A, (HCOO)3C3H5.
B, (C17H33COO)3C3H5.
C, (C2H5COO)3C3H5.
D, (CH3COO)3C3H5.
HD: Tất cả các đáp án đều là trieste của glixerol nhưng chỉ có đáp án B thoả mãn là các gốc axit béo, bởi:

⇝ Chọn đáp án B. ♦

⇝ Chọn đáp án B. ♦
Câu 3 [228671]: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A, CH2CH2CH2OH, C2H5OH.
B, CH3OCH3, CH3CHO.
C, C4H10, C6H6.
D, C2H5OH, CH3OCH3.
HD: Đồng = cùng; phân = công thức phân tử ⇝ đồng phân là những hợp chất có cùng công thức phân tử.
► Phân tích các đáp án:
❌ A. sai vì C3H8O ≠ C2H6O
❌ B. sai vì C2H6O ≠ C2H4O.
❌ C. sai vì C4H10 ≠ C6H6.
✔️ D. thoả mãn vì C2H5OH và CH3OCH3 cùng CTPT là C2H6O.
► Phân tích các đáp án:
❌ A. sai vì C3H8O ≠ C2H6O
❌ B. sai vì C2H6O ≠ C2H4O.
❌ C. sai vì C4H10 ≠ C6H6.
✔️ D. thoả mãn vì C2H5OH và CH3OCH3 cùng CTPT là C2H6O.
Câu 4 [24599]: Peptit nào sau đây không có phản ứng màu biure?
A, Gly-Ala.
B, Ala-Ala-Ala.
C, Gly-Gly-Gly.
D, Gly-Ala-Gly.
HD: Đipeptit không có phản ứng màu biure ⇒ Chọn A.
Câu 5 [679600]: Dung dịch nào sau đây được dùng để xử lí lớp cặn CaCO3 bám vào ấm đun nước?
A, Muối ăn.
B, Cồn.
C, Nước vôi trong.
D, Giấm ăn.
HD: Giấm ăn chứa axit axetic: CH3COOH có khả năng hoà tan CaCO3 (thêm nữa là ấm nước dùng để sinh hoạt ăn uống nên cần hoá chất an toàn với sức khoẻ chúng ta, dùng giấm ăn hoặc chanh,... là hợp lý nhất).
Phản ứng xảy ra: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O.
Phản ứng xảy ra: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O.
Câu 6 [60263]: Kim loại Al không tan trong dung dịch nào sau đây?
A, NaHSO4.
B, Ca(OH)2.
C, NaOH.
D, NH3.
HD:
Al tan được trong dung dịch axit hoặc dung dịch kiềm, Al không phản ứng với dd NH3 (bazơ yếu).
Al tan được trong dung dịch axit hoặc dung dịch kiềm, Al không phản ứng với dd NH3 (bazơ yếu).
Câu 7 [57701]: Kim loại có khả năng dẫn điện tốt nhất và kim loại có độ cứng cao nhất lần lượt là
A, Ag và W.
B, Al và Cu.
C, Cu và Cr.
D, Ag và Cr.
Kim loại có khả năng dẫn điện tốt nhất là Ag, kim loại có độ cứng nhất là Cr.
Đáp án D.
Đáp án D.
Câu 8 [60586]: Dung dịch Fe2(SO4)3 không phản ứng với chất nào sau đây?
A, NaOH.
B, Ag.
C, BaCl2.
D, Fe.
HD: Phân tích các phương án:
✔️ A. 6NaOH + Fe2(SO4)3 → 2Fe(OH)3↓ + 3Na2SO4.
❌ B. Ag + Fe2(SO4)3 không xảy ra phản ứng do
✔️ C. 3BaCl2 + Fe2(SO4)3 → 2FeCl3 + 3BaSO4↓.
✔️ D. Fe + Fe2(SO4)3 → 3FeSO4.
✔️ A. 6NaOH + Fe2(SO4)3 → 2Fe(OH)3↓ + 3Na2SO4.
❌ B. Ag + Fe2(SO4)3 không xảy ra phản ứng do

✔️ C. 3BaCl2 + Fe2(SO4)3 → 2FeCl3 + 3BaSO4↓.
✔️ D. Fe + Fe2(SO4)3 → 3FeSO4.
Câu 9 [60676]: Phi kim tác dụng được với crom ở nhiệt độ thường là
A, flo.
B, clo.
C, oxi.
D, lưu huỳnh.
HD: Flo (F2) là phi kim có tính oxi hóa mạnh nhất, tác dụng được với tất cả các kim loại (kể cả Au, Pt).
☆ F2 có thể tác dụng được với crom ở nhiệt độ thường: 2Cr + 3F2 → 2CrF3. ❒
☆ F2 có thể tác dụng được với crom ở nhiệt độ thường: 2Cr + 3F2 → 2CrF3. ❒
Câu 10 [981808]: Số oxi hóa của sắt trong FeS là
A, +3.
B, +2.
C, –3.
D, –2.
HD: Ta có:  ⇒ Số oxi hóa của sắt trong FeS là + 2.
⇒ Số oxi hóa của sắt trong FeS là + 2.
 ⇒ Số oxi hóa của sắt trong FeS là + 2.
⇒ Số oxi hóa của sắt trong FeS là + 2.
Câu 11 [14683]: Công thức cấu tạo thu gọn của etylamin là
A, CH3NHCH3.
B, CH3CH2NH2.
C, (CH3)3N.
D, CH3NH2.
HD: Phân tích danh pháp: etyl là tên gốc ankyl CH3CH2–
amin là chức NH2 ⇝ cấu tạo tương ứng là CH3CH2NH2. ❒
amin là chức NH2 ⇝ cấu tạo tương ứng là CH3CH2NH2. ❒
Câu 12 [679852]: Thành phần chính của vỏ các loài ốc, sò, hến là
A, Ca(NO3)2.
B, CaCO3.
C, NaCl.
D, Na2CO3.
HD: Thành phần chính của vỏ các loài ốc, sò, hến là CaCO3.
► NaCl: muối ăn; Na2CO3: sođa.
► NaCl: muối ăn; Na2CO3: sođa.
Câu 13 [62041]: Dung dịch nào sau đây có pH > 7 và làm phenolphtalein chuyển màu hồng?
A, Ca(OH)2.
B, HCl.
C, K2SO4.
D, NaNO3.
HD: pH > 7 và làm phenolphtalein chuyển màu hồng ⇒ dung dịch cho môi trường bazơ ⇒ chỉ có Ca(OH)2 thỏa mãn.
Câu 14 [58601]: Ion kim loại nào sau đây có tính oxi hóa yếu nhất?
A, Fe3+.
B, Al3+.
C, Ag+.
D, Cu2+.
HD: Thứ tự tính oxi hóa tăng dần: Al3+, Cu2+, Fe3+, Ag+.
Câu 15 [982222]: Este X được tạo bởi ancol etylic và axit fomic. Công thức của X là
A, HCOOCH3.
B, CH3COOCH3.
C, HCOOC2H5.
D, CH3COOC2H5.
HD: ancol etylic: C2H5OH; axit fomic: HCOOH.
⇒ Phản ứng este hoá: HCOOH + C2H5OH ⇄ HCOOC2H5 + H2O.
⇒ Este tương ứng tạo thành là HCOOC2H5: etyl fomat ⇝ Chọn đáp án C. ♣
⇒ Phản ứng este hoá: HCOOH + C2H5OH ⇄ HCOOC2H5 + H2O.
⇒ Este tương ứng tạo thành là HCOOC2H5: etyl fomat ⇝ Chọn đáp án C. ♣
Câu 16 [679227]: Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
A, Poli(etylen terephtalat).
B, Poliacrilonitrin.
C, Polistiren.
D, Poli(metyl metacrylat).
HD: Chọn đáp án A.
Poli(etylen terephtalat) dùng để sản xuất tơ lapsan được điều chế bằng phản ứng đồng trùng ngưng etylen glicol và axit terephtalic:

Poli(etylen terephtalat) dùng để sản xuất tơ lapsan được điều chế bằng phản ứng đồng trùng ngưng etylen glicol và axit terephtalic:

Câu 17 [906826]: Khi núi lửa hoạt động có sinh ra khí hiđro sunfua gây ô nhiễm không khí. Công thức của hiđro sunfua là
A, H2S.
B, SO2.
C, NH3.
D, NO2.
HD: Phân tích các đáp án:
| Công thức | A. H2S. | B. SO2. | C. NH3. | D. NO2. |
| Tên gọi | hiđro sunfua (✔️) | lưu huỳnh đioxit | amoniac | nitơ đioxit |
Câu 18 [906743]: Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện?
A, Na.
B, Ba.
C, Mg.
D, Ag.
HD: Phương pháp thuỷ luyện: dùng kim loại tự do có tính khử mạnh hơn để khử ion kim loại khác trong dung dịch muối. Phương pháp này thường được dùng trong phòng thí nghiệm để điều chế các kim loại có tính khử yếu như Pb, Cu, Ag,… Trong công nghiệp được dùng để điều chế các kim loại quý như Ag, Au. ⇝ Chọn đáp án D. ♠
Câu 19 [59814]: Trong các kim loại Li, Na, K, Cs, kim loại có tính khử mạnh nhất là
A, K.
B, Cs.
C, Li.
D, Na.
Trong nhóm IA đi từ Li đến Cs bán kính nguyên tử kim loại tăng dần, độ bền liên kết kim loại giảm dần nên tính khử tăng dần theo chiều tăng dần độ tăng điện tích hạt nhân.
Kim loại có tính khử mạnh nhất là Cs. Đáp án B.
Kim loại có tính khử mạnh nhất là Cs. Đáp án B.
Câu 20 [911543]: Xenlulozơ thuộc loại polisaccarit, là thành phần chính tạo nên màng tế bào thực vật, có nhiều trong gỗ, bông nõn. Công thức của xenlulozơ là
A, (C6H10O5)n.
B, C12H22O11.
C, C6H12O6.
D, C2H4O2.
HD: Công thức của xenlulozơ là (C6H10O5)n trong đó n có thể nằm trong khoảng 5000-14000 ⇝ Chọn đáp án A. ♥
Câu 21 [12273]: Thủy phân hoàn toàn tinh bột, thu được monosaccarit X. Cho X tác dụng với dung dịch AgNO3 trong NH3 đun nóng, thu được chất hữu cơ Y. Hai chất X, Y lần lượt là
A, Glucozơ, axit gluconic.
B, Glucozơ, amoni gluconat.
C, Saccarozơ, glucozơ.
D, Fructozơ, amoni gluconat.
HD: Các phản ứng xảy ra lần lượt là:


⇒ Hai chất X, Y lần lượt là glucozơ và amoni gluconat.


⇒ Hai chất X, Y lần lượt là glucozơ và amoni gluconat.
Câu 22 [507084]: Đốt cháy hoàn toàn 14,8 gam este X thu được 13,44 lít CO2 (đktc) và 10,8 H2O gam. Công thức phân tử của X là
A, C2H4O2.
B, C4H8O2.
C, C5H10O2.
D, C3H6O2.
HD: Giải đốt: 14,8 gam X + O2 ––to→ 0,6 mol CO2 + 0,6 mol H2O.
► Nhận xét: nCO2 = nH2O ⇒ este X no, đơn chức, mạch hở dạng CnH2nO2.
Tách 14,8 gam X về 0,6 mol cụm CH2 + a mol O2 ⇒ a = (14,8 – 0,6 × 14) ÷ 32 = 0,2 mol.
⇒ n = nCO2 : a = 0,6 : 0,2 = 3 ⇒ X là C3H6O2 ⇝ Chọn đáp án D. ♠
► Nhận xét: nCO2 = nH2O ⇒ este X no, đơn chức, mạch hở dạng CnH2nO2.
Tách 14,8 gam X về 0,6 mol cụm CH2 + a mol O2 ⇒ a = (14,8 – 0,6 × 14) ÷ 32 = 0,2 mol.
⇒ n = nCO2 : a = 0,6 : 0,2 = 3 ⇒ X là C3H6O2 ⇝ Chọn đáp án D. ♠
Câu 23 [353447]: Hòa tan hoàn toàn hỗn hợp gồm FeO và Fe2O3 trong lượng dư dung dịch H2SO4 (đặc, nóng), sau phản ứng thu được dung dịch chứa muối nào sau đây?
Đáp án:
Câu 24 [310866]: Đun nóng 100 gam dung dịch glucozơ 18% với lượng dư dung dịch AgNO3 trong NH3 đến khi phản ứng xảy ra hoàn toàn thu được m gam Ag. Giá trị của m là
A, 16,2.
B, 21,6.
C, 10,8.
D, 32,4.
HD: ☆ Sơ đồ phản ứng tráng bạc của glucozơ:

Giả thiết số mol glucozơ là 100 × 0,18 : 180 = 0,1 mol.
⇝ Từ tỉ lệ phản ứng ⇒ nAg = 0,2 mol ⇒ m = 0,2 × 108 = 21,6 gam. ❒

Giả thiết số mol glucozơ là 100 × 0,18 : 180 = 0,1 mol.
⇝ Từ tỉ lệ phản ứng ⇒ nAg = 0,2 mol ⇒ m = 0,2 × 108 = 21,6 gam. ❒
Câu 25 [679253]: Hòa tan hoàn toàn 1,15 gam kim loại X vào nước, thu được dung dịch Y. Để trung hòa Y cần vừa đủ 50 gam dung dịch HCl 3,65%. Kim loại X là
A, Ca.
B, Ba.
C, Na.
D, K.
Chọn đáp án C.
Phản ứng trung hòa: OH– + H+ → H2O.
Số mol axit dùng là 0,05 mol ⇝ dung dịch Y chứa 0,05 mol số mol OH–.
Kết quả 1,15 ÷ 0,05 = 23 = 23 ÷ 1 cho biết X là kim loại natri (hóa trị I).
Phản ứng trung hòa: OH– + H+ → H2O.
Số mol axit dùng là 0,05 mol ⇝ dung dịch Y chứa 0,05 mol số mol OH–.
Kết quả 1,15 ÷ 0,05 = 23 = 23 ÷ 1 cho biết X là kim loại natri (hóa trị I).
Câu 26 [312139]: Để phản ứng hoàn toàn với dung dịch chứa 11,7 gam valin (HOOCCH(NH2)CH(CH3)2) cần vừa đủ V ml dung dịch HCl 1M. Giá trị của V là
A, 100.
B, 150.
C, 200.
D, 50.
HD: Phản ứng HCl "nhập" vào phân tử valin → tạo muối:
(CH3)2CHCH(NH2)COOH + HCl → (CH3)2CHCH(NH3Cl)COOH.
Đơn giản hơn, nHCl = nVal = 11,7 ÷ 117 = 0,1 mol ⇒ V = 0,1 ÷ 1 = 0,1 lít ⇄ 100 ml. ❒
(CH3)2CHCH(NH2)COOH + HCl → (CH3)2CHCH(NH3Cl)COOH.
Đơn giản hơn, nHCl = nVal = 11,7 ÷ 117 = 0,1 mol ⇒ V = 0,1 ÷ 1 = 0,1 lít ⇄ 100 ml. ❒
Câu 27 [21768]: Trong các ứng dụng sau của các loại polime, ứng dụng nào không đúng?
A, Polibutađien được dùng làm cao su.
B, Poli(metyl metacrylat) được dùng làm thủy tinh hữu cơ.
C, Tơ nilon-6,6 được dùng làm túi nilon.
D, Poli(vinyl clorua) được dùng làm ống nước.
HD: ☆ Bài học ứng dụng của các loại polime.
Tơ nilon-6,6 là sợi dệt vải, đan - bện - dệt - may mặc,... chứ không phải là nilon trong túi nilon. Để làm túi nilon thì cần sử dụng các polime là chất dẻo như PE, PP,... ⇝ Phát biểu C sai. ❒
Tơ nilon-6,6 là sợi dệt vải, đan - bện - dệt - may mặc,... chứ không phải là nilon trong túi nilon. Để làm túi nilon thì cần sử dụng các polime là chất dẻo như PE, PP,... ⇝ Phát biểu C sai. ❒
Câu 28 [62491]: Thí nghiệm nào sau đây không có sự hòa tan chất rắn?
A, Cho Al(OH)3 vào dung dịch HNO3.
B, Cho Fe vào dung dịch H2SO4 loãng, nóng.
C, Cho NaCl vào H2O.
D, Cho Al vào dung dịch H2SO4 đặc, nguội.
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Fe + H2SO4 → FeSO4 + H2
NaCl + H2O: quá trình hoà tan vật lý
Al + H2SO4 đặc nguội : không phản ứng
Đáp án D.
Fe + H2SO4 → FeSO4 + H2
NaCl + H2O: quá trình hoà tan vật lý
Al + H2SO4 đặc nguội : không phản ứng
Đáp án D.
Câu 29 [353448]: Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,12 lít H2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là
Đáp án:
Câu 30 [6614]: Este X (chứa vòng benzen) có công thức phân tử C8H8O2. Số công thức cấu tạo thỏa mãn của X là
A, 3.
B, 4.
C, 5.
D, 6.
HD: Este X (chứa vòng benzen) có công thức phân tử C8H8O2,
các công thức cấu tạo thỏa mãn của X gồm: C6H5COOCH3 (metyl benzoat);
HCOOCH2C6H5 (benzyl fomat); CH3COOC6H5 (phenyl axetat);
và HCOOC6H4CH3 (có 3 đồng phân o, p, m-metylphenyl fomat)
Tổng có 6 chất → chọn đáp án D. ♠.
các công thức cấu tạo thỏa mãn của X gồm: C6H5COOCH3 (metyl benzoat);
HCOOCH2C6H5 (benzyl fomat); CH3COOC6H5 (phenyl axetat);
và HCOOC6H4CH3 (có 3 đồng phân o, p, m-metylphenyl fomat)
Tổng có 6 chất → chọn đáp án D. ♠.
Câu 31 [228301]: Cho m gam hỗn hợp X gồm Fe(OH)2, CuO, Fe2O3 và FeS2 (trong đó oxi chiếm 20,645% về khối lượng) vào bình kín (thể tích không đổi) chứa 1,875 mol khí O2 (dư). Nung nóng bình đến khi các phản ứng xảy ra hoàn toàn rồi đưa về nhiệt độ ban đầu. Sau khi ngưng tụ toàn bộ hơi nước, áp suất trong bình bằng 90% so với áp suất ban đầu (coi thể tích chất rắn thay đổi không đáng kể). Mặt khác, hòa tan hoàn toàn m gam X bằng lượng dư dung dịch H2SO4 đặc, đun nóng thì thu được 1,575 mol SO2 (sản phẩm khử duy nhất) và dung dịch Y chứa 332m/155 gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
A, 82.
B, 80.
C, 75.
D, 77.
HD: • Giải đốt X, chú ý Fe2O3 và CuO không tham gia. Còn lại:
4FeS2 + 11O2 –––to–→ 2Fe2O3 + 8SO2.
4Fe(OH)2 + O2 –––to–→ 2Fe2O3 + 4H2O.
Cùng điều kiện nên p ~ số mol ⇒ Δ(số mol khí giảm) = 0,1 × 1,875 = 0,1875 mol.
Gọi nFeS2 = a mol; nFe(OH)2 = b mol ⇒ Δ(số mol khí giảm) = ∑nO2 phản ứng – nSO2
⇒ 0,75a + 0,25b = 0,1875 mol (do H2O bị ngưng tụ, không ảnh hưởng áp suất nữa).
☆ Giải X + H2SO4 đặc nóng (CuO và Fe2O3 không thay đổi số oxi hoá).
⇒ Bảo toàn electron ta có: 15nFeS2 + nFe(OH)2 = 2nSO2 ⇒ 15a + b = 2 × 1,575.
Giải hệ các phương trình ta được: a = 0,2 mol và b = 0,15 mol.
► Tinh tế xử lý: gọi tổng số mol O trong Fe2O3 và CuO là c.
Trong phản ứng với H2SO4: O + 2H → H2O.
⇒ tăng giảm khối lượng: m muối sinh tương ứng = mhai oxit + 80 × c.
Mặt khác: 0,2 mol FeS2 + 0,15 mol Fe(OH)2 (tổng hai chất nặng 37,5 gam) và sinh ra 70,0 gam Fe2(SO4)3.
Vậy: m = mhai oxit + 37,5 gam và 332m/155 = ∑mmuối = (mhai oxit + 80c) + 70,0.
⇒ Biến đổi: (70,0 + 80c) – 37,5 = 177m/155.
Lại theo giả thiết: (c + 0,15 × 2) × 16 ÷ m = %mO trong X = 0,20645.
⇒ Giải hệ được m = 77,49 và c = 0,7 ⇝ Chọn đáp án D. ♠
4FeS2 + 11O2 –––to–→ 2Fe2O3 + 8SO2.
4Fe(OH)2 + O2 –––to–→ 2Fe2O3 + 4H2O.
Cùng điều kiện nên p ~ số mol ⇒ Δ(số mol khí giảm) = 0,1 × 1,875 = 0,1875 mol.
Gọi nFeS2 = a mol; nFe(OH)2 = b mol ⇒ Δ(số mol khí giảm) = ∑nO2 phản ứng – nSO2
⇒ 0,75a + 0,25b = 0,1875 mol (do H2O bị ngưng tụ, không ảnh hưởng áp suất nữa).
☆ Giải X + H2SO4 đặc nóng (CuO và Fe2O3 không thay đổi số oxi hoá).
⇒ Bảo toàn electron ta có: 15nFeS2 + nFe(OH)2 = 2nSO2 ⇒ 15a + b = 2 × 1,575.
Giải hệ các phương trình ta được: a = 0,2 mol và b = 0,15 mol.
► Tinh tế xử lý: gọi tổng số mol O trong Fe2O3 và CuO là c.
Trong phản ứng với H2SO4: O + 2H → H2O.
⇒ tăng giảm khối lượng: m muối sinh tương ứng = mhai oxit + 80 × c.
Mặt khác: 0,2 mol FeS2 + 0,15 mol Fe(OH)2 (tổng hai chất nặng 37,5 gam) và sinh ra 70,0 gam Fe2(SO4)3.
Vậy: m = mhai oxit + 37,5 gam và 332m/155 = ∑mmuối = (mhai oxit + 80c) + 70,0.
⇒ Biến đổi: (70,0 + 80c) – 37,5 = 177m/155.
Lại theo giả thiết: (c + 0,15 × 2) × 16 ÷ m = %mO trong X = 0,20645.
⇒ Giải hệ được m = 77,49 và c = 0,7 ⇝ Chọn đáp án D. ♠
Câu 32 [679622]: Cho các phát biểu sau:
(a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
(b) Trong công nghiệp, glucozơ được dùng để tráng ruột phích.
(c) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(d) Dùng giấm ăn hoặc chanh khử được mùi tanh trong cá do amin gây ra.
(e) Có thể dùng nhiệt để hàn và uốn ống nhựa PVC.
Số phát biểu đúng là
(a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
(b) Trong công nghiệp, glucozơ được dùng để tráng ruột phích.
(c) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(d) Dùng giấm ăn hoặc chanh khử được mùi tanh trong cá do amin gây ra.
(e) Có thể dùng nhiệt để hàn và uốn ống nhựa PVC.
Số phát biểu đúng là
A, 3.
B, 4.
C, 5.
D, 2.
HD: Phân tích các phát biểu:
✔️ (a) đúng, ứng dụng của este - một số mùi este thông dụng.
✔️ (b) đúng, nguyên liệu là saccarozơ, thuỷ phân thu được glucozơ và fructozơ là chất dùng tráng gương, tráng ruột phích.
✔️ (c) đúng: 6nCO2 + 5nH2O –––ánh sáng, diệp lục–→ (C6H10O5)n + 6nO2.
✔️ (d) đúng vì chanh hay giấm chua do axit, sẽ phản ứng trung hoà với amin (có tính bazơ) - nguyên nhân gây mùi tanh ⇒ khử được mùi tanh.
✔️ (e) đúng. Do PVC là chất dẻo, vật liệu có tính dẻo.
⇒ Có tất cả 5/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
✔️ (a) đúng, ứng dụng của este - một số mùi este thông dụng.
✔️ (b) đúng, nguyên liệu là saccarozơ, thuỷ phân thu được glucozơ và fructozơ là chất dùng tráng gương, tráng ruột phích.
✔️ (c) đúng: 6nCO2 + 5nH2O –––ánh sáng, diệp lục–→ (C6H10O5)n + 6nO2.
✔️ (d) đúng vì chanh hay giấm chua do axit, sẽ phản ứng trung hoà với amin (có tính bazơ) - nguyên nhân gây mùi tanh ⇒ khử được mùi tanh.
✔️ (e) đúng. Do PVC là chất dẻo, vật liệu có tính dẻo.
⇒ Có tất cả 5/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Câu 33 [311673]: Cho sơ đồ phản ứng sau:
(a) X + Y → Al(OH)3↓ + Z
(b) X + T → Z + AlCl3
(c) AlCl3 + Y → Al(OH)3↓ + T
Các chất X, Y, Z và T tương ứng là
(a) X + Y → Al(OH)3↓ + Z
(b) X + T → Z + AlCl3
(c) AlCl3 + Y → Al(OH)3↓ + T
Các chất X, Y, Z và T tương ứng là
A, Al2(SO4)3, Ba(OH)2, BaCO3 và BaCl2.
B, Al2(SO4)3, NaOH, Na2CO3 và H2SO4.
C, Al2(SO4)3, Ba(OH)2, BaSO4 và BaCl2.
D, Al(NO3)3, NaNO3, BaCl2 và khí Cl2.
HD: Sơ đồ các phản ứng sau:
(a) X + Y → Al(OH)3↓ + Z. (b) X + T → Z + AlCl3. (c) AlCl3 + Y → Al(OH)3↓ + T.
☆ Phân tích + nhận xét ⇝ loại trừ nhanh các đáp án không thỏa mãn:
☒ Loại đáp án D: Al(NO3)3 (X) không phản ứng với NaNO3 (Y) ⇝ không thỏa mãn (a).
☒ Loại đáp án B: Al2(SO4)3 (X) không phản ứng với H2SO4 (T) ⇝ không thỏa mãn (b).
⇝ Chỉ còn đáp án A hoặc C đúng ⇝ tương ứng biết được X, Y và T; chỉ có Z khác nhau.
Mà Al2(SO4)3 (X) + 3Ba(OH)2 (Y) ⇝ 2Al(OH)3 + 3BaSO4 nên rõ Z là BaSO4.
Vậy, đáp án thỏa mãn là C, tương ứng: Al2(SO4)3 (X), Ba(OH)2 (Y), BaSO4 (Z) và BaCl2 (T). ❒
(a) X + Y → Al(OH)3↓ + Z. (b) X + T → Z + AlCl3. (c) AlCl3 + Y → Al(OH)3↓ + T.
☆ Phân tích + nhận xét ⇝ loại trừ nhanh các đáp án không thỏa mãn:
☒ Loại đáp án D: Al(NO3)3 (X) không phản ứng với NaNO3 (Y) ⇝ không thỏa mãn (a).
☒ Loại đáp án B: Al2(SO4)3 (X) không phản ứng với H2SO4 (T) ⇝ không thỏa mãn (b).
⇝ Chỉ còn đáp án A hoặc C đúng ⇝ tương ứng biết được X, Y và T; chỉ có Z khác nhau.
Mà Al2(SO4)3 (X) + 3Ba(OH)2 (Y) ⇝ 2Al(OH)3 + 3BaSO4 nên rõ Z là BaSO4.
Vậy, đáp án thỏa mãn là C, tương ứng: Al2(SO4)3 (X), Ba(OH)2 (Y), BaSO4 (Z) và BaCl2 (T). ❒
Câu 34 [233859]: Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ, có màng ngăn xốp, hiệu suất điện phân là 100%). Lượng khí sinh ra từ quá trình điện phân và khối lượng Al2O3 bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở bảng dưới đây:
Biết: tại catotion Cu2+ điện phân hết thành Cu trước khi H+ điện phân tạo thành khí H2; cường độ dòng điện bằng nhau và không đổi trong các thí nghiệm trên. Tổng giá trị (x + y + z) bằng
| TN 1 | TN 2 | TN 3 | |
| Thời gian điện phân (giây) | t | 2t | 3t |
| Lượng khí sinh ra từ bình điện phân (mol) | 0,32 | 0,80 | 1,20 |
| Khối lượng Al2O3 bị hoà tan tối đa (gam) | 8,16 | 8,16 |
Biết: tại catotion Cu2+ điện phân hết thành Cu trước khi H+ điện phân tạo thành khí H2; cường độ dòng điện bằng nhau và không đổi trong các thí nghiệm trên. Tổng giá trị (x + y + z) bằng
A, 1,8.
B, 1,6.
C, 2,0.
D, 2,2.
HD: ☆ Thứ tự catot bị điện phân: Cu2+ → H+axit → H2O.
☆ Thứ tự anot bị điện phân: Cl– → H2O.
• Bắt đầu từ thí nghiệm 2: dung dịch sau điện phân không phản ứng với Al2O3.
⇒ Dung dịch chỉ chứa Na2SO4 hoặc (Na2SO4 và NaCl).
► Nếu chỉ chứa Na2SO4 thì thời gian 3t sau đó dung dịch sau phản ứng cũng chỉ chứa Na2SO4 ⇒ làm sao hòa tan được Al2O3? (bởi thực chất chỉ là quá trình điện phân nước).
► Như vậy, dung dịch chứa Na2SO4 và NaCl, thời gian 3t sau đó NaCl điện phân tạo NaOH hòa tan 0,08 mol Al2O3 tạo 0,16 mol NaAlO2 ⇒ số mol NaCl là 0,16 mol.
► Như vậy, ở thí nghiệm 1, hòa tan 0,08 mol Al2O3 là do 0,48 mol H+.
☆ Xét TH1: t giây chưa thoát ra khí H2 ⇒ nCl2 = ∑nkhí = 0,32 mol
⇒ số mol e trao đổi (t giây) là 0,64 mol.
• 2t giây tương ứng có số mol e trao đổi (2t giây) là 1,28 mol và anot ra 0,64 mol Cl2.
Tổng khí 2 cực là 0,80 mol ⇒ số mol H2 ra bên catot là 0,16 mol ⇒ y = 0,16.
Bên catot ra x mol Cu và 0,16 mol H2 ⇒ 2x + 0,16 × 2 = 1,28 ⇒ x = 0,48.
Nhận xét: 2t giây ra 0,64 mol Cl2; còn 0,16 mol NaCl trong dung dịch.
⇒ Tổng số mol Cl bằng 0,64 × 2 + 0,16 = 1,44 mol ⇒ z = 1,44.
• 3t giây tương ứng có số mol e trao đổi (3t giây) là 1,92 mol
⇒ anot ra 0,72 mol Cl2 và (1,92 – 0,72 × 2) ÷ 4 = 0,12 mol O2.
Bên catot ra 0,48 mol Cu và (1,92 – 0,48 × 2) ÷ 2 = 0,48 mol.
⇒ Tổng mol khí thu được sau 3t giây là 0,72 + 0,12 + 0,48 = 1,32 mol (không thoả mãn)
☆ Xét TH2: t (giây) đã có khí H2 thoát ra bên catot.
⇒ từ t (giây) ⇝ 2t (giây) chỉ xảy ra điện phân 2HCl → H2 + Cl2.
⇒ khí tăng 0,8 – 0,32 = 0,48 mol ⇒ ne trao đổi t (giây) = 0,48 mol.
⇒• t (giây) đầu: bên anot ra 0,24 mol Cl2 ⇒ nH2 = 0,08 mol ⇒ nCu = 0,16 mol ⇒ x = 0,16.
⇒• 2t (giây): trao đổi 0,96 mol e ⇒ bên anot ra 0,48 mol Cl2 ⇒ nH2 = 0,32 mol ⇒ y = 0,32.
⇒ z = ∑nCl = 0,48 × 2 + 0,16(trong NaCl) = 1,12 mol.
⇒• 3t (giây): trao đổi 1,44 mol e; ⇒ anot ra 0,56 mol Cl2 và 0,08 mol O2.
catot ra 0,16 mol Cu và 0,56 mol H2 ⇒ ∑nkhí = 0,56 + 0,08 + 0,56 = 1,2 (không thoả mãn).
||⇒ Yêu cầu tổng giá trị (x + y + z) là 0,16 + 0,32 + 1,12 = 1,6.
☆ Thứ tự anot bị điện phân: Cl– → H2O.
• Bắt đầu từ thí nghiệm 2: dung dịch sau điện phân không phản ứng với Al2O3.
⇒ Dung dịch chỉ chứa Na2SO4 hoặc (Na2SO4 và NaCl).
► Nếu chỉ chứa Na2SO4 thì thời gian 3t sau đó dung dịch sau phản ứng cũng chỉ chứa Na2SO4 ⇒ làm sao hòa tan được Al2O3? (bởi thực chất chỉ là quá trình điện phân nước).
► Như vậy, dung dịch chứa Na2SO4 và NaCl, thời gian 3t sau đó NaCl điện phân tạo NaOH hòa tan 0,08 mol Al2O3 tạo 0,16 mol NaAlO2 ⇒ số mol NaCl là 0,16 mol.
► Như vậy, ở thí nghiệm 1, hòa tan 0,08 mol Al2O3 là do 0,48 mol H+.
☆ Xét TH1: t giây chưa thoát ra khí H2 ⇒ nCl2 = ∑nkhí = 0,32 mol
⇒ số mol e trao đổi (t giây) là 0,64 mol.
• 2t giây tương ứng có số mol e trao đổi (2t giây) là 1,28 mol và anot ra 0,64 mol Cl2.
Tổng khí 2 cực là 0,80 mol ⇒ số mol H2 ra bên catot là 0,16 mol ⇒ y = 0,16.
Bên catot ra x mol Cu và 0,16 mol H2 ⇒ 2x + 0,16 × 2 = 1,28 ⇒ x = 0,48.
Nhận xét: 2t giây ra 0,64 mol Cl2; còn 0,16 mol NaCl trong dung dịch.
⇒ Tổng số mol Cl bằng 0,64 × 2 + 0,16 = 1,44 mol ⇒ z = 1,44.
• 3t giây tương ứng có số mol e trao đổi (3t giây) là 1,92 mol
⇒ anot ra 0,72 mol Cl2 và (1,92 – 0,72 × 2) ÷ 4 = 0,12 mol O2.
Bên catot ra 0,48 mol Cu và (1,92 – 0,48 × 2) ÷ 2 = 0,48 mol.
⇒ Tổng mol khí thu được sau 3t giây là 0,72 + 0,12 + 0,48 = 1,32 mol (không thoả mãn)
☆ Xét TH2: t (giây) đã có khí H2 thoát ra bên catot.
⇒ từ t (giây) ⇝ 2t (giây) chỉ xảy ra điện phân 2HCl → H2 + Cl2.
⇒ khí tăng 0,8 – 0,32 = 0,48 mol ⇒ ne trao đổi t (giây) = 0,48 mol.
⇒• t (giây) đầu: bên anot ra 0,24 mol Cl2 ⇒ nH2 = 0,08 mol ⇒ nCu = 0,16 mol ⇒ x = 0,16.
⇒• 2t (giây): trao đổi 0,96 mol e ⇒ bên anot ra 0,48 mol Cl2 ⇒ nH2 = 0,32 mol ⇒ y = 0,32.
⇒ z = ∑nCl = 0,48 × 2 + 0,16(trong NaCl) = 1,12 mol.
⇒• 3t (giây): trao đổi 1,44 mol e; ⇒ anot ra 0,56 mol Cl2 và 0,08 mol O2.
catot ra 0,16 mol Cu và 0,56 mol H2 ⇒ ∑nkhí = 0,56 + 0,08 + 0,56 = 1,2 (không thoả mãn).
||⇒ Yêu cầu tổng giá trị (x + y + z) là 0,16 + 0,32 + 1,12 = 1,6.
Câu 35 [276503]: Este E là este no, mạch hở có công thức phân tử C7HmOm–4. Cho E tác dung với dung dung dịch NaOH dư sau phản ứng hoàn toàn thu được hai muối X, Y (đều là muối của axit cacboxylic, MX < MY) và một ancol Z. Cho các phát biểu sau:
(a) Có 2 công thức cấu tạo phù hợp tính chất của E.
(b) X là muối của axit cacboxylic có khả năng tham gia phản ứng tráng bạc.
(c) Trong phân tử Z thì số nguyên tử cacbon bằng số nhóm -OH.
(d) Nung muối Y với hỗn hợp vôi tôi-xút thu được khí H2.
(e) Phân tử Y hơn phân tử X một nhóm CH2.
Số phát biểu đúng là
(a) Có 2 công thức cấu tạo phù hợp tính chất của E.
(b) X là muối của axit cacboxylic có khả năng tham gia phản ứng tráng bạc.
(c) Trong phân tử Z thì số nguyên tử cacbon bằng số nhóm -OH.
(d) Nung muối Y với hỗn hợp vôi tôi-xút thu được khí H2.
(e) Phân tử Y hơn phân tử X một nhóm CH2.
Số phát biểu đúng là
A, 5.
B, 2.
C, 4.
D, 3.
HD: Este no có dạng CnH2n + 2 – 2zO2z.
Theo đó, este E là este no, mạch hở có công thức phân tử C7HmOm – 4.
⇒ Ta có: m = 2 × 7 + 2 – (m – 4) ⇒ m = 10. Vậy E là C7H10O6.
Phản ứng: E + NaOH → (2 muối) + (1 ancol Z) ⇒ Z là ancol 3 chức.
Hai muối đơn chức, đọc nhẩm: 7 = 3 + 4 = 4 + 3 = 5 + 2.
Nếu CZ = 4 hay 5 thì không có cặp axit thoả mãn.
Theo đó Z là C3H5(OH)3; X là HCOONa và Y là CH3COONa.
Cấu tạo của E là (HCOO)2(CH3COO)C3H5 (tương ứng 2 đồng phân).
☆ Phân tích các phát biểu:
✔️ (a) đúng, 2 cấu tạo là HCOOCH2-CH(OOCH)-CH2OOCCH3 và HCOOCH2-CH(OOCCH3)-CH2OOCH (đảo vị trí HCOO và CH3COO vào C ở giữa của gốc C3H5).
✔️ (b) đúng vì HCOONa có hình dạng nhóm chức anđehit nên có phản ứng tráng bạc.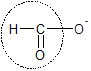
✔️ (c) đúng, Z là C3H5(OH)3 có 3C và 3 nhóm OH.
❌(d) sai vì CH3COONa + NaOH ––CaO, to→ CH4↑ + Na2CO3 (điều chế khí metan trong PTN).
✔️ (e) đúng vì CH3COONa – HCOONa = CH2.
⇝ có 4/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Theo đó, este E là este no, mạch hở có công thức phân tử C7HmOm – 4.
⇒ Ta có: m = 2 × 7 + 2 – (m – 4) ⇒ m = 10. Vậy E là C7H10O6.
Phản ứng: E + NaOH → (2 muối) + (1 ancol Z) ⇒ Z là ancol 3 chức.
Hai muối đơn chức, đọc nhẩm: 7 = 3 + 4 = 4 + 3 = 5 + 2.
Nếu CZ = 4 hay 5 thì không có cặp axit thoả mãn.
Theo đó Z là C3H5(OH)3; X là HCOONa và Y là CH3COONa.
Cấu tạo của E là (HCOO)2(CH3COO)C3H5 (tương ứng 2 đồng phân).
☆ Phân tích các phát biểu:
✔️ (a) đúng, 2 cấu tạo là HCOOCH2-CH(OOCH)-CH2OOCCH3 và HCOOCH2-CH(OOCCH3)-CH2OOCH (đảo vị trí HCOO và CH3COO vào C ở giữa của gốc C3H5).
✔️ (b) đúng vì HCOONa có hình dạng nhóm chức anđehit nên có phản ứng tráng bạc.

✔️ (c) đúng, Z là C3H5(OH)3 có 3C và 3 nhóm OH.
❌
✔️ (e) đúng vì CH3COONa – HCOONa = CH2.
⇝ có 4/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Câu 36 [679771]: Thực hiện các thí nghiệm sau:
(a) Nung nóng KMnO4.
(b) Điện phân dung dịch CuCl2 với điện cực trơ.
(c) Cho dung dịch NH3 vào dung dịch AlCl3 dư.
(d) Nung nóng NaHCO3.
(e) Cho dung dịch CuCl2 vào dung dịch NaOH.
Sau khi các phản ứng kết thúc, số thí nghiệm sinh ra chất khí là
(a) Nung nóng KMnO4.
(b) Điện phân dung dịch CuCl2 với điện cực trơ.
(c) Cho dung dịch NH3 vào dung dịch AlCl3 dư.
(d) Nung nóng NaHCO3.
(e) Cho dung dịch CuCl2 vào dung dịch NaOH.
Sau khi các phản ứng kết thúc, số thí nghiệm sinh ra chất khí là
A, 5.
B, 3.
C, 2.
D, 4.
HD: Các phản ứng xảy ra khi tiến hành các thí nghiệm:
✔️ (a) 2KMnO4 –––to–→ K2MnO4 + MnO2 + O2↑ (điều chế O2 trong PTN).
✔️ (b) CuCl2 –––điện phân dung dịch–→ Cu↓ (catot) + Cl2↑ (anot).
❌ (c) 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl.
✔️ (d) 2NaHCO3 –––to–→ Na2CO3 + CO2↑ + H2O.
❌ (e) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
⇝ Có 3/5 thí nghiệm thoả mãn thu được chất khí ⇝ Chọn đáp án B. ♦
✔️ (a) 2KMnO4 –––to–→ K2MnO4 + MnO2 + O2↑ (điều chế O2 trong PTN).
✔️ (b) CuCl2 –––điện phân dung dịch–→ Cu↓ (catot) + Cl2↑ (anot).
❌ (c) 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl.
✔️ (d) 2NaHCO3 –––to–→ Na2CO3 + CO2↑ + H2O.
❌ (e) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
⇝ Có 3/5 thí nghiệm thoả mãn thu được chất khí ⇝ Chọn đáp án B. ♦
Câu 37 [7527]: Hỗn hợp E có khối lượng m gam gồm axit cacboxylic đơn chức X, axit cacboxylic hai chức Y (X và Y đều mạch hở, có cùng số liên kết π; phân tử cùng số nguyên tử hiđro) và hai ancol đơn chức Z, T thuộc cùng dãy đồng đẳng (MZ < MT). Chia E thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một thu được 1,8 mol CO2 và 2 mol H2O. Thực hiện phản ứng este hóa phần hai (giả sử hiệu suất các phản ứng là 100%), thu được 40,6 gam sản phẩm hữu cơ chỉ chứa este. Phần trăm khối lượng của T trong hỗn hợp E có giá trị lớn nhất là
A, 42,0%.
B, 35,0%.
C, 14,5%.
D, 37,1%.
HD: chỉ thu được este ⇒ chức ancol = chức axit = x mol.
ancol + axit → este + nước ||⇒ BTKL: 1,8 × 12 + 4 + 48x = 40,6 + 18x ⇒ x = 0,5 mol.
Giả sử hai axit có cùng kπ, số mol là a thì 0,5 – a(k – 1) = 0,2 ⇒ k = 2; a = 0,3.
X và Y cùng số π và số H nên có cùng số nguyên tử C là m; gọi số C trung bình ancol là n thì:
0,3m + 0,5n = 1,8; vì n > 1 nên m < 4,33333 ⇒ m = 3 hoặc m = 4.
• Ứng với m = 4 thì có 0,4 mol CH3OH và 0,1 mol C2H5OH → %yêu cầu = 9,3%.
• Ứng với m = 3 thì có 0,1 mol CH3OH và 0,4 mol C2H5OH → %yêu cầu = 37,1%.
Theo đó, giá trị lớn nhất cần chọn đương nhiên là 37,1%.
ancol + axit → este + nước ||⇒ BTKL: 1,8 × 12 + 4 + 48x = 40,6 + 18x ⇒ x = 0,5 mol.
Giả sử hai axit có cùng kπ, số mol là a thì 0,5 – a(k – 1) = 0,2 ⇒ k = 2; a = 0,3.
X và Y cùng số π và số H nên có cùng số nguyên tử C là m; gọi số C trung bình ancol là n thì:
0,3m + 0,5n = 1,8; vì n > 1 nên m < 4,33333 ⇒ m = 3 hoặc m = 4.
• Ứng với m = 4 thì có 0,4 mol CH3OH và 0,1 mol C2H5OH → %yêu cầu = 9,3%.
• Ứng với m = 3 thì có 0,1 mol CH3OH và 0,4 mol C2H5OH → %yêu cầu = 37,1%.
Theo đó, giá trị lớn nhất cần chọn đương nhiên là 37,1%.
Câu 38 [982251]: Hỗn hợp E gồm axit oleic, axit panmitic và triglixerit X (tỉ lệ mol tương ứng là 4 : 3 : 2). Đốt cháy hoàn toàn m gam E cần vừa đủ 3,26 mol O2, thu được CO2 và H2O. Mặt khác, cho m gam E tác dụng hết với lượng dư dung dịch NaOH đun nóng, thu được sản phẩm hữu cơ gồm glixerol và 38,22 gam hỗn hợp hai muối. Phần trăm khối lượng của X trong E là
A, 45,95%.
B, 47,51%.
C, 48,25%.
D, 46,74%.
HD: Triglixerit dạng (RCOO)3C3H5 = 3RCOOH.C3H2 → Quy đổi hỗn hợp ban đầu:
m gam E gồm a mol C15H31COOH; b mol C17H33COOH và c mol C3H2.
Từ tỉ lệ giả thiết: ∑(gốc axit) : ∑(gốc C3H5) = (4 + 3 + 2 × 3) ÷ 2 ⇒ a + b = 6,5c.
• Giải đốt E thu được (16a + 18b + 3c) mol CO2 và (16a + 17b + c) mol H2O.
⇒ bảo toàn nguyên tố O: 2a + 2b + 3,26 × 2 = 2 × (16a + 18b + 3c) + (16a + 17b + c).
• Giải thuỷ phân, mmuối = 278a + 304b = 38,22 gam.
Giải hệ các phương trình ta được a = 0,05; b = 0,08 và c = 0,02.
⇝ E quy đổi gồm 0,02 mol C3H2 + 0,05 mol C15H31COOH + 0,08 mol C17H33COOH.
Ghép lại E gồm 0,02 mol (C15H31COO)(C17H33COO)2C3H5 + 0,03 mol C15H31COOH và 0,04 mol C17H33COOH (đúng tỉ lệ 2 : 3 : 4).
⇒ m = mE = 0,02 × 858 + 0,03 × 256 + 0,04 × 282 = 36,12 gam.
⇒ Yêu cầu %mX/E = 0,02 × 858 ÷ 36,12 × 100% ≈ 47,51%.
m gam E gồm a mol C15H31COOH; b mol C17H33COOH và c mol C3H2.
Từ tỉ lệ giả thiết: ∑(gốc axit) : ∑(gốc C3H5) = (4 + 3 + 2 × 3) ÷ 2 ⇒ a + b = 6,5c.
• Giải đốt E thu được (16a + 18b + 3c) mol CO2 và (16a + 17b + c) mol H2O.
⇒ bảo toàn nguyên tố O: 2a + 2b + 3,26 × 2 = 2 × (16a + 18b + 3c) + (16a + 17b + c).
• Giải thuỷ phân, mmuối = 278a + 304b = 38,22 gam.
Giải hệ các phương trình ta được a = 0,05; b = 0,08 và c = 0,02.
⇝ E quy đổi gồm 0,02 mol C3H2 + 0,05 mol C15H31COOH + 0,08 mol C17H33COOH.
Ghép lại E gồm 0,02 mol (C15H31COO)(C17H33COO)2C3H5 + 0,03 mol C15H31COOH và 0,04 mol C17H33COOH (đúng tỉ lệ 2 : 3 : 4).
⇒ m = mE = 0,02 × 858 + 0,03 × 256 + 0,04 × 282 = 36,12 gam.
⇒ Yêu cầu %mX/E = 0,02 × 858 ÷ 36,12 × 100% ≈ 47,51%.
Câu 39 [255813]: Cho hỗn hợp E gồm các hiđrocacbon mạch hở có cùng số nguyên tử hiđro. Tỉ khối của E đối với H2 là 13. Đốt cháy hoàn toàn a mol E càn vừa đủ 1,36 mol O2 thu được CO2 và H2O. Mặt khác, a mol E tác dụng tối đa với x mol Br2 trong dung dịch. Giá trị của x là
A, 0,35.
B, 0,40.
C, 0,32.
D, 0,25.
HD: ME = 26 nên E chứa CH4 (M = 16).
Theo đó các hđc đều có dạng CnH4; ME = 26 ⇒ n = 11/6.
Giải đốt a mol C11/6H4 + 1,36 mol O2 → CO2 + H2O.
⇒ a = 0,48 mol; số mol πtrong E = 0,48 × (2 × 11/6 + 2 – 4) ÷ 2 = 0,4 mol.
Theo đó các hđc đều có dạng CnH4; ME = 26 ⇒ n = 11/6.
Giải đốt a mol C11/6H4 + 1,36 mol O2 → CO2 + H2O.
⇒ a = 0,48 mol; số mol πtrong E = 0,48 × (2 × 11/6 + 2 – 4) ÷ 2 = 0,4 mol.
Câu 40 [134652]: Cho hơi nước đi qua than nóng đỏ thu được 17,92 lít hỗn hợp X khí gồm CO, H2 và CO2 có tỉ khối so với H2 bằng 7,875. Dẫn toàn bộ X qua ống sứ nung nóng chứa Fe2O3 (dư), hỗn hợp khí và hơi thoát ra khỏi ống sứ hấp thụ vào 200 gam dung dịch H2SO4 a% thu được dung dịch H2SO4 76,555%. Biết các phản ứng xảy ra hoàn toàn và CO2 không tan trong nước. Giá trị của a là
A, 72.
B, 98.
C, 85.
D, 80.
HD: x mol C + y mol H2O ––to→ 0,8 mol X {CO; H2; CO2}.
• Bảo toàn khối lượng: 12x + 18y = mX = 0,8 × 7,875 × 2.
• Bảo toàn số mol nguyên tố: nC = ∑nCO; CO2; nH2O = nH2
|⇝ có phương trình: x + y = nX = 0,8 ||⇒ Giải: x = 0,3 và y = 0,5.
Dẫn X qua Fe2O3 dư, phản ứng hoàn toàn nên cuối cùng,
sản phẩm hơi và khí thu được là 0,3 mol CO2 và 0,5 mol H2O.
☆ Giải: hấp thụ 0,5 mol H2O vào 200 gam dung dịch H2SO4 a%
Coi H2O là dung dịch H2SO4 nồng độ 0%. Dùng sơ đồ chéo:
![134652[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/SACHID/134652[LG].png)
⇒ 200(a – 76,555) = 9 × 76,555 ⇒ a = 80. ❒
• Bảo toàn khối lượng: 12x + 18y = mX = 0,8 × 7,875 × 2.
• Bảo toàn số mol nguyên tố: nC = ∑nCO; CO2; nH2O = nH2
|⇝ có phương trình: x + y = nX = 0,8 ||⇒ Giải: x = 0,3 và y = 0,5.
Dẫn X qua Fe2O3 dư, phản ứng hoàn toàn nên cuối cùng,
sản phẩm hơi và khí thu được là 0,3 mol CO2 và 0,5 mol H2O.
☆ Giải: hấp thụ 0,5 mol H2O vào 200 gam dung dịch H2SO4 a%
Coi H2O là dung dịch H2SO4 nồng độ 0%. Dùng sơ đồ chéo:
![134652[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/SACHID/134652[LG].png)
⇒ 200(a – 76,555) = 9 × 76,555 ⇒ a = 80. ❒