Đáp án
1A
2C
3B
4B
5C
6C
7D
8C
9B
10A
11B
12A
13C
14D
15C
16B
17B
18A
19D
20D
21A
22A
23A
24D
25A
26A
27A
28C
29B
30C
31A
32B
33C
34D
35A
36C
37B
38D
39B
40C
Đáp án Đề minh họa số 29 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [906817]: Dung dịch nào sau đây tác dụng được với Al(OH)3?
A, KOH.
B, KCl.
C, NaNO3.
D, Na2SO4.
HD: Al(OH)3 có tính lưỡng tính, vừa tác dụng được với dung dịch axit mạnh, vừa tác dụng được với dung dịch bazơ mạnh:
• Al(OH)3 + 3HCl → AlCl3 + 3H2O.
• Al(OH)3 + KOH → KAlO2 + 2H2O.
⇒ trong 4 phương án, thoả mãn là đáp án A. KOH.
• Al(OH)3 + 3HCl → AlCl3 + 3H2O.
• Al(OH)3 + KOH → KAlO2 + 2H2O.
⇒ trong 4 phương án, thoả mãn là đáp án A. KOH.
Câu 2 [911549]: Số oxi hóa của crom trong hợp chất K2Cr2O7 là
A, +2.
B, +3.
C, +6.
D, +4.
HD: Gọi số oxi hóa của Cr trong hợp chất là a; ta biết K là +1; O là –2 nên: 2 × (+1) + 2 × (a) + 7 × (–2) = 0 ⇒ a = +6 ⇝ Chọn đáp án B. ♦
Câu 3 [982217]: Kim loại nào sau đây là kim loại kiềm thổ?
A, Fe.
B, Ca.
C, Cu.
D, Ag.
HD: Mẹo nhỏ: Bé Mang Cá Sang Bà Rán.
⇒ Nhớ dãy kiềm thổ: Be Mg Ca Sr Ba Ra.
⇒ Ca là kim loại thoả mãn trong 4 phương án.
⇒ Nhớ dãy kiềm thổ: Be Mg Ca Sr Ba Ra.
⇒ Ca là kim loại thoả mãn trong 4 phương án.
Câu 4 [60316]: Chất rắn không tan trong dung dịch NaOH là
A, Al2O3.
B, Mg.
C, Al.
D, Al(OH)3.
HD: Phân tích các đáp án:
✔️ A. Al2O3 + 2NaOH → 2NaAlO2 + H2O.
❌ B. Mg + NaOH → phản ứng không xảy ra ⇝ Mg không tan.
✔️ C. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑.
✔️ D. Al(OH)3 + NaOH → NaAlO2 + 2H2O.
✔️ A. Al2O3 + 2NaOH → 2NaAlO2 + H2O.
❌ B. Mg + NaOH → phản ứng không xảy ra ⇝ Mg không tan.
✔️ C. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑.
✔️ D. Al(OH)3 + NaOH → NaAlO2 + 2H2O.
Câu 5 [906828]: Natri clorua là gia vị quan trọng trong thức ăn của con người. Công thức của natri clorua là
A, NaNO3.
B, KNO3.
C, NaCl.
D, KCl.
HD: Phân tích các đáp án:
| Công thức | A. NaNO3. | B. KNO3. | C. NaCl. | D. KCl. |
| Tên gọi | natri nitrat | kali nitrat | natri clorua | kali clorua |
Câu 6 [58596]: Trong các kim loại sau đây, kim loại nào có tính khử yếu nhất?
A, Al.
B, Mg.
C, Ag.
D, Fe.
Giải: Theo dãy hoạt động hóa học của các kim loại thì tính khử giảm dần.
⇒ Tính khử giảm dần từ Mg > Al > Fe > Ag.
⇒ Chọn C
⇒ Tính khử giảm dần từ Mg > Al > Fe > Ag.
⇒ Chọn C
Câu 7 [257720]: Monome được dùng để điều chế poliacrilonitrin là
A, C6H5CH=CH2.
B, CH2=CHCH=CH2.
C, CH3CH=CH2.
D, CH2=CHCN.
Đáp án: D
Câu 8 [982235]: Dung dịch chất nào sau đây không làm đổi màu quỳ tím?
A, Axit glutamic.
B, Metylamin.
C, Glyxin.
D, Lysin.
HD: Phân tích các đáp án:
| Hợp chất | axit glutamic | metylamin | Glyxin | Lysin |
| pH dung dịch | < 7 | > 7 | ≈ 7 | > 7 |
| Quỳ tím | hoá đỏ (❌) | hoá xanh (❌) | không đổi (✔️) | hoá xanh (❌) |
Câu 9 [679314]: Dung dịch nào sau đây có pH > 7?
A, NaCl.
B, NaOH.
C, HNO3.
D, H2SO4.

Câu 10 [20975]: Công thức phân tử của tristearin là
A, C57H110O6.
B, C54H110O6.
C, C54H104O6.
D, C51H98O6.
HD: tristearin có 3 gốc stearat (C17H35COO) kết hợp với gốc hiđrocacbon của glixerol là C3H5
||→ công thức của tristearin là (C17H35COO)3C3H5 → CTPT là C57H110O6. Chọn A. ♥.
||→ công thức của tristearin là (C17H35COO)3C3H5 → CTPT là C57H110O6. Chọn A. ♥.
Câu 11 [310882]: Nước thải công nghiệp chế biến cafe, chế biến giấy, chứa hàm lượng chất hữu cơ cao ở dạng hạt lơ lửng. Trong quá trình xử lý loại nước thải này, để làm cho các hạt lơ lửng này keo tụ lại thành khối lớn, dễ dàng tách ra khỏi nước (làm trong nước) người ta thêm vào nước thải một lượng
A, giấm ăn.
B, phèn chua.
C, muối ăn.
D, amoniac.
HD: Phèn chua có công thức: K2SO4.Al2(SO4)3.24H2O khi hòa tan vào nước sẽ xảy ra phản ứng thủy phân tạo kết tủa keo Al(OH)3 kéo các chất bẩn lắng xuống:
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42– + 24H2O
☆ Sau đó: Al3+ + 3H2O ⇄ Al(OH)3↓ + 3H+. ❒
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42– + 24H2O
☆ Sau đó: Al3+ + 3H2O ⇄ Al(OH)3↓ + 3H+. ❒
Câu 12 [310373]: Kim loại Al không tan trong dung dịch nào sau đây?
A, H2SO4 đặc, nguội.
B, NaOH.
C, H2SO4 loãng.
D, HCl.
Giải: Fe, Al, Cr là những kim loại bị thụ động hóa
trong H2SO4 đặc nguội và HNO3 đặc nguội ⇒ Chọn A
trong H2SO4 đặc nguội và HNO3 đặc nguội ⇒ Chọn A
Câu 13 [679594]: Etylamin (C2H5NH2) tác dụng được với chất nào sau đây trong dung dịch?
A, K2SO4.
B, NaOH.
C, HCl.
D, KCl.
HD: etylamin: C2H5NH2 có tính chất của một bazơ ⇒ tác dụng được với axit HCl. Sản phẩm tạo thành C2H5NH3Cl là tinh thể muối nhưng có khối lượng rất bé nên lơ lửng giống như đám khói. Phản ứng xảy ra: C2H5NH2 + HCl → C2H5NH3Cl.


Câu 14 [257722]: Trong phân tử hợp chất nào sau đây có số nguyên tử oxi nhỏ hơn cacbon?
A, Glucozơ.
B, Fructozơ.
C, Glyxerol.
D, Saccarozơ.
HD: Phân tích các đáp án:
| Hợp chất | A. Glucozơ. | B. Fructozơ. | C. Glyxerol. | D. Saccarozơ. |
| Công thức phân tử | C6H12O6 | C6H12O6 | C3H8O3 | C12H22O11 |
Câu 15 [61747]: Kim loại được sử dụng rộng rãi chế tạo các bản cực ăc quy và các thiết bị chống tia phóng xạ là
A, Sn.
B, Ni.
C, Pb.
D, Zn.
Giải:
Pb được sử dụng rộng rãi chế tạo các bản cực ắc quy và các thiết bị chống tia phóng xạ.
Đáp án C
Pb được sử dụng rộng rãi chế tạo các bản cực ắc quy và các thiết bị chống tia phóng xạ.
Đáp án C
Câu 16 [981918]: Muối Fe2(SO4)3 dễ tan trong nước, khi kết tinh thường ở dạng ngậm nước như Fe2(SO4)3.9H2O. Tên gọi của Fe2(SO4)3 là
A, sắt(II) sunfua.
B, sắt(III) sunfat.
C, sắt(II) sunfat.
D, sắt(II) sunfit.
HD: Phân tích các đáp án:
| Tên gọi | A. sắt(II) sunfua. | B. sắt(III) sunfat. | C. sắt(II) sunfat. | D. sắt(II) sunfit. |
| Công thức | FeS | Fe2(SO4)3 (✔️) | FeSO4 | FeSO3 |
Câu 17 [908861]: Este X được tạo bởi ancol metylic và axit fomic. Công thức của X là
A, HCOOC2H5.
B, HCOOCH3.
C, CH3COOC2H5.
D, CH3COOCH3.
HD: Phản ứng este hoá giữa ancol metylic (CH3OH) và axit fomic (HCOOH) là:
HCOOH + CH3OH ⇄ HCOOCH3 (metyl fomat) + H2O.
⇝ Công thức của X là HCOOCH3 ⇝ Chọn đáp án B. ♦
HCOOH + CH3OH ⇄ HCOOCH3 (metyl fomat) + H2O.
⇝ Công thức của X là HCOOCH3 ⇝ Chọn đáp án B. ♦
Câu 18 [59360]: Các kim loại nào trong dãy sau đây được điều chế bằng phương pháp thủy luyện?
A, Cu, Ag.
B, Al, Ag.
C, Na, Mg.
D, Cu, Al.
HD: ☆ Phương pháp thuỷ luyện: dùng kim loại tự do có tính khử mạnh hơn để khử ion kim loại khác trong dung dịch muối. ► Phương pháp này thường được dùng trong phòng thí nghiệm để điều chế các kim loại có tính khử yếu như Pb, Cu, Ag,… Trong công nghiệp, phương pháp thủy luyện được dùng để điều chế các kim loại quý như Ag, Au ⇝ Chọn đáp án A. ♥
Câu 19 [311828]: Hiện nay, trong số hơn 110 nguyên tố hóa học đã biết, có gần 90 nguyên tố là kim loại. Tính chất hóa học đặc trưng của các kim loại là
A, tính dẫn điện.
B, tính dẻo.
C, tính dẫn nhiệt.
D, tính khử.
HD: Kim loại: M → Mn+ + ne
⇝ tính khử là tính chất hóa học đặc trưng của kim loại. ❒
⇝ tính khử là tính chất hóa học đặc trưng của kim loại. ❒
Câu 20 [147786]: Chất nào sau đây không phải hợp chất hữu cơ?
A, CH4.
B, CCl4.
C, C6H12O6.
D, Al4C3.
HD: Bài học về đại cương hoá hữu cơ:

⇒ Al4C3 là muối cacbua, không phải hợp chất hữu cơ.

⇒ Al4C3 là muối cacbua, không phải hợp chất hữu cơ.
Câu 21 [24978]: Cho 15 gam glyxin tác dụng vừa đủ với 8,9 gam alanin thu được m gam hỗn hợp tripeptit mạch hở. Giá trị của m là
A, 20,3.
B, 18,5.
C, 23,9.
D, 22,1.
HD: Tổng quát phản ứng tạo tripeptit: 3.(amino axit) → 1.tripeptit + 2.H2O.
☆ Giả thiết: nglyxin = 0,2 mol; nalanin = 0,1 mol ⇒ ∑namino axit = 0,3 mol ⇒ nH2O = 0,2 mol.
⇒ BTKL có ngay: 15 + 8,9 = m + 0,2 × 18 ⇒ m = 20,3 gam ⇝ Chọn đáp án A. ♥
☆ Giả thiết: nglyxin = 0,2 mol; nalanin = 0,1 mol ⇒ ∑namino axit = 0,3 mol ⇒ nH2O = 0,2 mol.
⇒ BTKL có ngay: 15 + 8,9 = m + 0,2 × 18 ⇒ m = 20,3 gam ⇝ Chọn đáp án A. ♥
Câu 22 [983263]: Cho 15,9 gam Na2CO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2. Giá trị của V là
A, 3,36.
B, 4,48.
C, 1,12.
D, 2,24.
HD: Phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
Giả thiết nNa2CO3 = 15,9 ÷ 106 = 0,15 mol ⇒ nCO2 = 0,15 mol
⇝ Yêu cầu V = 0,15 × 22,4 = 3,36 lít ⇝ Chọn đáp án A. ♥
Giả thiết nNa2CO3 = 15,9 ÷ 106 = 0,15 mol ⇒ nCO2 = 0,15 mol
⇝ Yêu cầu V = 0,15 × 22,4 = 3,36 lít ⇝ Chọn đáp án A. ♥
Câu 23 [983265]: Thủy phân hoàn toàn m gam tinh bột thành glucozơ. Cho toàn bộ glucozơ tham gia phản ứng tráng bạc (hiệu suất 100%), thu được 38,88 gam Ag. Giá trị của m là
A, 29,16.
B, 64,80.
C, 32,40.
D, 58,32.
HD: Tỉ lệ phản ứng tráng bạc:

Giả thiết: nAg = 0,36 mol ⇒ nglucozơ = 0,18 mol.
Lại có tỉ lệ phản ứng thuỷ phân tinh bột:

⇒ Yêu cầu: m = mtinh bột = 0,18 × 162 = 29,16 gam.

Giả thiết: nAg = 0,36 mol ⇒ nglucozơ = 0,18 mol.
Lại có tỉ lệ phản ứng thuỷ phân tinh bột:

⇒ Yêu cầu: m = mtinh bột = 0,18 × 162 = 29,16 gam.
Câu 24 [334116]: Tìm phát biểu sai?
A, Tơ tằm là tơ thiên nhiên.
B, Tơ nilon-6,6 là tơ tổng hợp.
C, Tơ hóa học gồm 2 loại là tơ nhân tạo và tơ tổng hợp.
D, Tơ visco là tơ thiên nhiên vì xuất xứ từ xenlulozơ.
HD: Phân loại tơ:
![577864[LG].png](https://ai.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/577864[LG].png)
⇒ các phát biểu A, B, C tương ứng đúng. D sai vì tơ visco là tơ nhân tạo (bán tổng hợp).
![577864[LG].png](https://ai.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/577864[LG].png)
⇒ các phát biểu A, B, C tương ứng đúng. D sai vì tơ visco là tơ nhân tạo (bán tổng hợp).
Câu 25 [13132]: Cho các chất: (1) triolein, (2) xenlulozơ, (3) saccarozơ, (4) tinh bột. Số chất bị thủy phân trong môi trường axit là
A, 4.
B, 3.
C, 2.
D, 1.
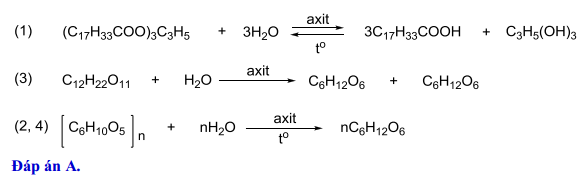
Câu 26 [906838]: Hòa tan hết 1,2 gam kim loại R (hoá trị II) trong dung dịch H2SO4 loãng, thu được 0,05 mol H2. Kim loại R là
A, Mg.
B, Fe.
C, Ca.
D, Zn.
HD: R hoá trị II nên bảo toàn electron ta có nR = nH2 = 0,05 mol.
⇒ MR = 1,2 ÷ 0,05 = 24 ⇝ cho biết R là kim loại Mg ⇝ Chọn đáp án A. ♥
⇒ MR = 1,2 ÷ 0,05 = 24 ⇝ cho biết R là kim loại Mg ⇝ Chọn đáp án A. ♥
Câu 27 [906748]: Thuỷ phân tripanmitin có công thức (C15H31COO)3C3H5 trong dung dịch NaOH thu được glixerol và muối X. Công thức của X là
A, C15H31COONa.
B, C17H33COONa.
C, HCOONa.
D, CH3COONa.
HD: Phản ứng xà phòng hoá:
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3.
Muối X thu được là natri panmitat: C15H31COONa ⇝ Chọn đáp án A. ♥
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3.
Muối X thu được là natri panmitat: C15H31COONa ⇝ Chọn đáp án A. ♥
Câu 28 [225761]: Dung dịch HNO3 đặc, nóng tác dụng với chất nào sau đây sinh ra khí?
A, Fe2O3.
B, Fe(OH)3.
C, Fe(OH)2.
D, Fe2(SO4)3.
Các PTHH xảy ra như sau:
Fe2O3 + HNO3 → Fe(NO3)3 + H2O
Fe(OH)3 + HNO3 → Fe(NO3)3 + H2O
Fe(OH)2 + 4HNO3→ Fe(NO3)3 + NO2 + 3H2O
Fe2(SO4)3 không tham gia phản ứng.
Lưu ý: Các hợp chất của Fe(III) trong đó Fe đã có số oxi hóa cao nhất là +3 nên khi phản ứng với các chất có tính oxi hóa mạnh như HNO3, H2SO4 đặc nóng sẽ không xảy ra phản ứng oxi hóa khử.
Fe2O3 + HNO3 → Fe(NO3)3 + H2O
Fe(OH)3 + HNO3 → Fe(NO3)3 + H2O
Fe(OH)2 + 4HNO3→ Fe(NO3)3 + NO2 + 3H2O
Fe2(SO4)3 không tham gia phản ứng.
Lưu ý: Các hợp chất của Fe(III) trong đó Fe đã có số oxi hóa cao nhất là +3 nên khi phản ứng với các chất có tính oxi hóa mạnh như HNO3, H2SO4 đặc nóng sẽ không xảy ra phản ứng oxi hóa khử.
Câu 29 [982248]: Nung nóng một lượng butan trong bình kín (với xúc tác thích hợp), thu được 0,40 mol hỗn hợp X gồm H2 và các hiđrocacbon mạch hở (CH4, C2H4, C2H6, C3H6, C4H8, C4H10). Cho toàn bộ X vào bình chứa dung dịch Br2 dư thì có tối đa a mol Br2 phản ứng, khối lượng bình tăng 8,12 gam và thoát ra hỗn hợp khí Y. Đốt cháy hoàn toàn Y cần vừa đủ 0,30 mol O2, thu được CO2 và H2O. Giá trị của a là
A, 0,18.
B, 0,22.
C, 0,19.
D, 0,20.
HD: ► Phản ứng với Br2 và làm bình tăng là các anken.
Tinh tế quy 8,12 gam anken tương ứng với 0,58 mol cụm CH2.
☆ Giải đốt 0,58 mol CH2 cần 0,58 × 1,5 = 0,87 mol O2.
Lại có đốt Y cần 0,3 mol O2 và butan ––to→ (CH2) + Y
⇒ đốt C4H10 ban đầu cần 1,17 mol O2 ⇒ nC4H10 ban đầu = 1,17 ÷ (4 + 10 ÷ 4) = 0,18 mol.
Ta có ∑nH2 + ankan trong X = nC4H10 ban đầu = 0,18 mol
⇒ ∑nanken còn lại trong X = 0,4 – 0,18 = 0,22 mol ⇒ a = 0,22 ⇝ Chọn đáp án B. ♦
Tinh tế quy 8,12 gam anken tương ứng với 0,58 mol cụm CH2.
☆ Giải đốt 0,58 mol CH2 cần 0,58 × 1,5 = 0,87 mol O2.
Lại có đốt Y cần 0,3 mol O2 và butan ––to→ (CH2) + Y
⇒ đốt C4H10 ban đầu cần 1,17 mol O2 ⇒ nC4H10 ban đầu = 1,17 ÷ (4 + 10 ÷ 4) = 0,18 mol.
Ta có ∑nH2 + ankan trong X = nC4H10 ban đầu = 0,18 mol
⇒ ∑nanken còn lại trong X = 0,4 – 0,18 = 0,22 mol ⇒ a = 0,22 ⇝ Chọn đáp án B. ♦
Câu 30 [229064]: Cho sơ đồ chuyển hoá:

(Biết CO và Y dùng dư, các phản ứng xẩy ra hoàn toàn). Cặp chất X, Y có thể là

(Biết CO và Y dùng dư, các phản ứng xẩy ra hoàn toàn). Cặp chất X, Y có thể là
A, BaCO3, Na2CO3.
B, Fe(NO3)2, AgNO3.
C, Fe(NO3)3, AgNO3.
D, FeCO3, NaHCO3.
HD: Phân tích các đáp án:
❌ A. Nếu X là BaCO3 thì BaCO3 ––to→ BaO + CO2.
⇒ X1 là BaO hay CO2 thì đều không phản ứng với CO ⇝ loại.
► Nếu là B, C, D thì đều thu được oxit sắt (Fe; O); sau đó CO dư sẽ khử oxit sắt để thu được tương ứng X2 là kim loại Fe. Tiếp theo Fe + FeCl3 thu được X3 là FeCl2.
• FeCl2 + 2NaHCO3 → Fe(OH)2↓ + NaCl + 2CO2↑.
• FeCl2 + 3AgNO3 (dùng dư) → Fe(NO3)3 (X) + 2AgCl↓ + Ag↓.
⇝ theo đó, đáp án thoả mãn là C do X là Fe(NO3)3.
❌ A. Nếu X là BaCO3 thì BaCO3 ––to→ BaO + CO2.
⇒ X1 là BaO hay CO2 thì đều không phản ứng với CO ⇝ loại.
► Nếu là B, C, D thì đều thu được oxit sắt (Fe; O); sau đó CO dư sẽ khử oxit sắt để thu được tương ứng X2 là kim loại Fe. Tiếp theo Fe + FeCl3 thu được X3 là FeCl2.
• FeCl2 + 2NaHCO3 → Fe(OH)2↓ + NaCl + 2CO2↑.
• FeCl2 + 3AgNO3 (dùng dư) → Fe(NO3)3 (X) + 2AgCl↓ + Ag↓.
⇝ theo đó, đáp án thoả mãn là C do X là Fe(NO3)3.
Câu 31 [982795]: Hỗn hợp X gồm triglixerit Y và axit béo Z. Cho m gam X phản ứng hoàn toàn với dung dịch NaOH dư, thu được sản phẩm hữu cơ gồm C15H31COONa; C17HxCOONa và 13,8 gam glixerol. Nếu đốt cháy hết m gam X thì cần vừa đủ 13,925 mol O2, thu được 9,85 mol CO2 và 9,25 mol H2O. Phần trăm khối lượng của Y trong m gam X là
A, 83,41%.
B, 16,59%.
C, 86,24%.
D, 13,76%.
HD: triglixerit dạng (RCOO)3C3H5 = (RCOOH)3.C3H2
⇒ Quy hỗn hợp X về gồm a mol C15H31COOH + b mol C17HxCOOH + 0,15 mol C3H2.
☆ Giải đốt m gam X + 13,925 mol O2 → 9,85 mol CO2 + 9,25 mol H2O.
Bảo toàn nguyên tố O ta có: 2a + 2b = 9,85 × 2 + 9,25 – 13,925 × 2
Lại theo bảo toàn nguyên tố C: 16a + 18b + 0,15 × 3 = 9,85.
⇒ Giải hệ các phương trình ta được: a = 0,25 và b = 0,3.
Bảo toàn nguyên tố H ⇒ x = 33 ⇝ gốc panmitat và gốc oleat.
Ghép tạo Y chỉ có thể là (C17H33COO)2(C15H31COO)C3H5.
m gam X gồm 0,15 mol (C17H33COO)2(C15H31COO)C3H5 + 0,1 mol C15H31COOH.
⇒ m = 128,7 + 25,6 = 154,3 gam ⇝ Yêu cầu %mY/X = 128,7 ÷ 154,3 × 100% ≈ 83,41% ⇝ Chọn đáp án A. ♥
⇒ Quy hỗn hợp X về gồm a mol C15H31COOH + b mol C17HxCOOH + 0,15 mol C3H2.
☆ Giải đốt m gam X + 13,925 mol O2 → 9,85 mol CO2 + 9,25 mol H2O.
Bảo toàn nguyên tố O ta có: 2a + 2b = 9,85 × 2 + 9,25 – 13,925 × 2
Lại theo bảo toàn nguyên tố C: 16a + 18b + 0,15 × 3 = 9,85.
⇒ Giải hệ các phương trình ta được: a = 0,25 và b = 0,3.
Bảo toàn nguyên tố H ⇒ x = 33 ⇝ gốc panmitat và gốc oleat.
Ghép tạo Y chỉ có thể là (C17H33COO)2(C15H31COO)C3H5.
m gam X gồm 0,15 mol (C17H33COO)2(C15H31COO)C3H5 + 0,1 mol C15H31COOH.
⇒ m = 128,7 + 25,6 = 154,3 gam ⇝ Yêu cầu %mY/X = 128,7 ÷ 154,3 × 100% ≈ 83,41% ⇝ Chọn đáp án A. ♥
Câu 32 [982037]: Hỗn hợp E gồm amin X (no, đơn chức, mạch hở) và ankan Y (X và Y đều có số nguyên tử cacbon lớn hơn 1). Đốt cháy hoàn toàn 0,07 mol E cần dùng vừa đủ 0,3725 mol O2, thu được N2, CO2 và 0,305 mol H2O. Phần trăm khối lượng của X trong hỗn hợp E là
A, 23,68%.
B, 36,78%.
C, 49,05%.
D, 50,85%.
HD: E gồm a mol amin X dạng CnH2n + 3N và b mol ankan Y dạng CmH2m + 2.
⇒ Theo giả thiết: a + b = nE = 0,07 mol (1).
Giải đốt 0,07 mol E + 0,3725 mol O2 ––to→ 0,22 mol CO2 + H2O + N2.
⇒ Bảo toàn nguyên tố O có ngay số mol H2O là 0,305 mol.
⇒ Tương quan đốt: ∑nH2O – ∑nCO2 = 1,5namin + nankan
Thay số có 1,5a + b = 0,085; kết hợp (1) giải ra: a = 0,03 và b = 0,04.
Theo đó: ∑nC = 0,03n + 0,04m = 0,22 ⇄ 3n + 4m = 22.
Điều kiện m, n nguyên và m > 1; n > 1 thì chỉ cặp n = 2 và m = 4 thoả mãn.
Vậy E gồm 0,03 mol C2H7N và 0,04 mol C4H10 ⇒ mE = 3,67 gam.
⇒ Yêu cầu %mX trong E = 0,03 × 45 ÷ 3,67 × 100% ≈ 36,78%.
⇒ Theo giả thiết: a + b = nE = 0,07 mol (1).
Giải đốt 0,07 mol E + 0,3725 mol O2 ––to→ 0,22 mol CO2 + H2O + N2.
⇒ Bảo toàn nguyên tố O có ngay số mol H2O là 0,305 mol.
⇒ Tương quan đốt: ∑nH2O – ∑nCO2 = 1,5namin + nankan
Thay số có 1,5a + b = 0,085; kết hợp (1) giải ra: a = 0,03 và b = 0,04.
Theo đó: ∑nC = 0,03n + 0,04m = 0,22 ⇄ 3n + 4m = 22.
Điều kiện m, n nguyên và m > 1; n > 1 thì chỉ cặp n = 2 và m = 4 thoả mãn.
Vậy E gồm 0,03 mol C2H7N và 0,04 mol C4H10 ⇒ mE = 3,67 gam.
⇒ Yêu cầu %mX trong E = 0,03 × 45 ÷ 3,67 × 100% ≈ 36,78%.
Câu 33 [305341]: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vài giọt dung dịch iot (màu vàng nhạt) vào ống nghiệm đựng sẵn 2 ml dung dịch hồ tinh bột (không màu) và để trong thời gian 2 phút ở nhiệt độ thường.
Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồn (không để sôi) khoảng 1– 2 phút.
Bước 3: Ngâm ống nghiệm trong cốc nước nguội khoảng 5 – 6 phút.
Phát biểu nào sau đây đúng?
Bước 1: Cho vài giọt dung dịch iot (màu vàng nhạt) vào ống nghiệm đựng sẵn 2 ml dung dịch hồ tinh bột (không màu) và để trong thời gian 2 phút ở nhiệt độ thường.
Bước 2: Đun nóng ống nghiệm trên ngọn lửa đèn cồn (không để sôi) khoảng 1– 2 phút.
Bước 3: Ngâm ống nghiệm trong cốc nước nguội khoảng 5 – 6 phút.
Phát biểu nào sau đây đúng?
A, Ở bước 1, sau khi để hỗn hợp trong thời gian 2 phút thì dung dịch bắt đầu xuất hiện màu xanh tím.
B, Sau bước 2, trong ống nghiệm xuất hiện kết tủa iot màu tím đen.
C, Sau bước 1 và bước 3, dung dịch đều có màu xanh tím.
D, Sau bước 2, dung dịch bị mất màu do iot bị thăng hoa hoàn toàn.
HD: Phân tích thí nghiệm tiến hành:
• Bước 1: dung dịch I2 là dung dịch có màu vàng nhạt, khi tương tác với hồ tinh bột sẽ tạo thành màu xanh tím đặc trưng. Giải thích: phân tử tinh bột có tạo mạch ở dạng xoắn có lỗ rỗng (giống như lò xo):

⇝ các phân tử iot có thể chui vào và bị hấp phụ, tạo “hợp chất” màu xanh tím.
• Bước 2: khi đun nóng, các phân tử tinh bột sẽ duỗi xoắn, không thể hấp phụ được iot nữa
⇝ màu xanh tím bị mất đi. Chú ý, bước 2 không làm iot bay hơi, thăng hoa hoàn toàn được.
• Bước 3: khi làm nguội, phân tử tinh bột trở lại dạng xoắn, các phân tử iot lại bị hấp phụ, chui vào lỗ rỗng xoắn thu được “hợp chất” màu xanh tím như sau bước 1. ❒
• Bước 1: dung dịch I2 là dung dịch có màu vàng nhạt, khi tương tác với hồ tinh bột sẽ tạo thành màu xanh tím đặc trưng. Giải thích: phân tử tinh bột có tạo mạch ở dạng xoắn có lỗ rỗng (giống như lò xo):

⇝ các phân tử iot có thể chui vào và bị hấp phụ, tạo “hợp chất” màu xanh tím.
• Bước 2: khi đun nóng, các phân tử tinh bột sẽ duỗi xoắn, không thể hấp phụ được iot nữa
⇝ màu xanh tím bị mất đi. Chú ý, bước 2 không làm iot bay hơi, thăng hoa hoàn toàn được.
• Bước 3: khi làm nguội, phân tử tinh bột trở lại dạng xoắn, các phân tử iot lại bị hấp phụ, chui vào lỗ rỗng xoắn thu được “hợp chất” màu xanh tím như sau bước 1. ❒
Câu 34 [311685]: Nung hỗn hợp gồm 0,15 mol Al; 0,06 mol Fe3O4 và 0,08 mol Fe2O3 sau một thời gian thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được a mol khí H2 và dung dịch Y. Cô cạn dung dịch Y, hoà tan chất rắn thu được vào nước thành dung dịch Z. Cho dung dịch Z tác dụng với dung dịch AgNO3 dư thu được 205,62 gam kết tủa. Giá trị của a là
A, 0,19.
B, 0,17.
C, 0,14.
D, 0,18.
HD: Đọc quá trình, gộp thành sơ đồ với các giả thiết như sau:

Dễ thấy ∑nAgNO3 = 3nAl(NO3)3 + 3nFe(NO3)3 = 1,47 mol theo bảo toàn gốc NO3.
Theo đó 205,62 gam kết tủa gồm 1,47 mol nguyên tố Ag và 1,32 mol nguyên tố Cl.
⇒ ∑nHCl phản ứng = 1,32 mol ⇒ nH2 + nH2O = 0,66 mol (bảo toàn H).
⇝ Yêu cầu: a = 0,66 – 0,48 = 0,18 mol ⇝ Chọn đáp án D. ♠

Dễ thấy ∑nAgNO3 = 3nAl(NO3)3 + 3nFe(NO3)3 = 1,47 mol theo bảo toàn gốc NO3.
Theo đó 205,62 gam kết tủa gồm 1,47 mol nguyên tố Ag và 1,32 mol nguyên tố Cl.
⇒ ∑nHCl phản ứng = 1,32 mol ⇒ nH2 + nH2O = 0,66 mol (bảo toàn H).
⇝ Yêu cầu: a = 0,66 – 0,48 = 0,18 mol ⇝ Chọn đáp án D. ♠
Câu 35 [679780]: Hỗn hợp E gồm ba este mạch hở đều tạo bởi axit cacboxylic với ancol: X (no, đơn chức), Y (không no, đơn chức, phân tử có hai liên kết pi) và Z (no, hai chức). Cho 0,2 mol E phản ứng vừa đủ với dung dịch NaOH, thu được 12,88 gam hỗn hợp ba ancol cùng dãy đồng đẳng và 24,28 gam hỗn hợp T gồm ba muối của ba axit cacboxylic. Đốt cháy toàn bộ T cần vừa đủ 0,175 mol O2, thu được Na2CO3, CO2 và 0,055 mol H2O. Phần trăm khối lượng của X trong E có giá trị gần nhất với giá trị nào sau đây?
A, 9.
B, 12.
C, 5.
D, 6.
HD: Đốt T có đủ 3 giả thiết số ⇒ giải được bài toán đốt cháy muối.!
☆ 24,28 gam T + 0,175 mol O2 ––to→ a mol Na2CO3 + b mol CO2 + 0,055 mol H2O.
► Nhận xét: có a mol Na2CO3 ⇄ 2a mol COONa ⇒ nO/T = 4a mol.
⇒ Bảo toàn nguyên tố O: 4a + 0,175 × 2 = 3a + 2b + 0,055.
Lại theo bảo toàn khối lượng: 24,28 + 0,175 × 32 = 106a + 44b + 0,055 × 18.
⇒ Giải hệ các phương trình trên ta được a = 0,175 và b = 0,235.
► có 2a = 0,35 mol COONa ⇒ nOH ancol = 0,35 mol.
X no, đơn, hở nên ba ancol cùng thuộc dãy đồng đẳng no, đơn, hở.
⇒ 12,88 gam dạng CkH2k + 2O = kCH2.H2O ⇒ nCH2 = (12,88 – 0,35 × 18) ÷ 14 = 0,47 mol.
⇒ Bảo toàn nguyên tố C có ngay ∑nC trong E = ∑nC trong T + ∑nC ancol = (0,175 + 0,235) + 0,47 = 0,88 mol.
Tương tự, bảo toàn nguyên tố H có ∑nH trong E = ∑nH trong T + ∑nH ancol – nH trong NaOH = 1,4 mol.
0,2 mol E gồm x mol X dạng CnH2nO2; y mol Y dạng CmH2m – 2O2 và z mol Z dạng CpH2p – 2O4.
⇒ x + y + z = 0,2; số mol chức este: x + y + 2z = nNaOH = 0,35.
Lại theo tương quan đốt E: ∑nCO2 – ∑nH2O = 0,88 – 0,7 = y + z.
⇒ Giải hệ các phương trình trên có: x = 0,02; y = 0,03 và z = 0,15 mol.
☆ Phương trình nghiệm nguyên: 0,02n + 0,03m + 0,15p = 0,88 (bảo toàn C).
⇒ 2n + 3m + 15p = 88 với điều kiện n ≥ 2; m ≥ 4; p ≥ 4.
⇒ p ≤ (88 – 2 × 2 – 3 × 4) ÷ 15 = 4,8 ⇒ p = 4 ⇒ 2n + 3m = 28.
Các cặp nghiệm thoả mãn: (n; m) = (8; 4); (5; 6); (2; 8).
► Lại nhận xét, p = 4 thì chỉ có duy nhất cấu tạo (COOCH3)3 thoả mãn ⇒ để thu được 3 ancol thì hai este đơn chức còn lại được tạo từ 2 ancol C2H5OH và C3H7OH ⇒ n ≥ 3; m ≥ 5 ⇒ chỉ có cặp nghiệm n = 5 và m = 6 thoả mãn mà thôi.
mE = mmuối + mancol – mNaOH = 24,28 + 12,88 – 0,35 × 40 = 23,16 gam.
⇒ thông tin về X: có 0,02 mol C5H10O2 ⇒ %mX/E ≈ 8,81%.
☆ 24,28 gam T + 0,175 mol O2 ––to→ a mol Na2CO3 + b mol CO2 + 0,055 mol H2O.
► Nhận xét: có a mol Na2CO3 ⇄ 2a mol COONa ⇒ nO/T = 4a mol.
⇒ Bảo toàn nguyên tố O: 4a + 0,175 × 2 = 3a + 2b + 0,055.
Lại theo bảo toàn khối lượng: 24,28 + 0,175 × 32 = 106a + 44b + 0,055 × 18.
⇒ Giải hệ các phương trình trên ta được a = 0,175 và b = 0,235.
► có 2a = 0,35 mol COONa ⇒ nOH ancol = 0,35 mol.
X no, đơn, hở nên ba ancol cùng thuộc dãy đồng đẳng no, đơn, hở.
⇒ 12,88 gam dạng CkH2k + 2O = kCH2.H2O ⇒ nCH2 = (12,88 – 0,35 × 18) ÷ 14 = 0,47 mol.
⇒ Bảo toàn nguyên tố C có ngay ∑nC trong E = ∑nC trong T + ∑nC ancol = (0,175 + 0,235) + 0,47 = 0,88 mol.
Tương tự, bảo toàn nguyên tố H có ∑nH trong E = ∑nH trong T + ∑nH ancol – nH trong NaOH = 1,4 mol.
0,2 mol E gồm x mol X dạng CnH2nO2; y mol Y dạng CmH2m – 2O2 và z mol Z dạng CpH2p – 2O4.
⇒ x + y + z = 0,2; số mol chức este: x + y + 2z = nNaOH = 0,35.
Lại theo tương quan đốt E: ∑nCO2 – ∑nH2O = 0,88 – 0,7 = y + z.
⇒ Giải hệ các phương trình trên có: x = 0,02; y = 0,03 và z = 0,15 mol.
☆ Phương trình nghiệm nguyên: 0,02n + 0,03m + 0,15p = 0,88 (bảo toàn C).
⇒ 2n + 3m + 15p = 88 với điều kiện n ≥ 2; m ≥ 4; p ≥ 4.
⇒ p ≤ (88 – 2 × 2 – 3 × 4) ÷ 15 = 4,8 ⇒ p = 4 ⇒ 2n + 3m = 28.
Các cặp nghiệm thoả mãn: (n; m) = (8; 4); (5; 6); (2; 8).
► Lại nhận xét, p = 4 thì chỉ có duy nhất cấu tạo (COOCH3)3 thoả mãn ⇒ để thu được 3 ancol thì hai este đơn chức còn lại được tạo từ 2 ancol C2H5OH và C3H7OH ⇒ n ≥ 3; m ≥ 5 ⇒ chỉ có cặp nghiệm n = 5 và m = 6 thoả mãn mà thôi.
mE = mmuối + mancol – mNaOH = 24,28 + 12,88 – 0,35 × 40 = 23,16 gam.
⇒ thông tin về X: có 0,02 mol C5H10O2 ⇒ %mX/E ≈ 8,81%.
Câu 36 [678563]: Hòa tan hết 3,2 gam một oxit dạng M2On trong lượng vừa đủ dung dịch H2SO4 10% thu được dung dịch muối có nồng độ 12,9%. Sau phản ứng đem cô cạn bớt dung dịch và làm lạnh nó thu được 7,868 gam tinh thể muối X với hiệu suất 70%. Phần trăm khối lượng của nguyên tố oxi trong X gần nhất với giá trị nào sau đây?
A, 48%
B, 58%.
C, 60%.
D, 56%.
HD: Phản ứng: M2On + nH2SO4 → M2(SO4)n + nH2O.
"Chọn lại giả thiết" để thuận lợi cho giải nhanh + gọn toán nồng độ:
⇝ lấy m gam oxit M2On + 1 mol H2SO4 vừa đủ.
⇒ mdung dịch H2SO4 = 980 gam ⇒ mdung dịch muối = (980 + m) gam.
BTKL có m + 98 = mmuối + 18 ⇒ mmuối = (m + 80) gam.
⇝ C%mmuối = (m + 80) ÷ (m + 980) = 12,9% ⇒ giải ra m = 53,3.
⇒ 53,3 gam M2On gồm 1 mol O và 37,3 gam M
⇒ Tỉ lệ mM ÷ ne trao đổi = 37,3 ÷ (1 × 2) = 18,65 = 55,95 ÷ 3
⇝ cho biết kim loại là Fe trong oxit Fe2O3. Quay lại bài toán ban đầu:
Hoà tan 3,2 gam Fe2O3 ⇝ thu được 62 gam dung dịch chứa 0,02 mol Fe2(SO4)3.
Tinh thể muối X dạng Fe2(SO4)3.nH2O nặng 7,868 gam.
Với hiệu suất cô cạn 70% ⇒ nX = 0,02 × 0,7 = 0,014 mol
⇒ 0,014 × (400 + 18n) = 7,868 ⇒ n = 9 cho biết X là Fe2(SO4)3.9H2O.
⇝ Yêu cầu %mO trong X = 16 × 21 ÷ 562 × 100% ≈ 59,79%.
"Chọn lại giả thiết" để thuận lợi cho giải nhanh + gọn toán nồng độ:
⇝ lấy m gam oxit M2On + 1 mol H2SO4 vừa đủ.
⇒ mdung dịch H2SO4 = 980 gam ⇒ mdung dịch muối = (980 + m) gam.
BTKL có m + 98 = mmuối + 18 ⇒ mmuối = (m + 80) gam.
⇝ C%mmuối = (m + 80) ÷ (m + 980) = 12,9% ⇒ giải ra m = 53,3.
⇒ 53,3 gam M2On gồm 1 mol O và 37,3 gam M
⇒ Tỉ lệ mM ÷ ne trao đổi = 37,3 ÷ (1 × 2) = 18,65 = 55,95 ÷ 3
⇝ cho biết kim loại là Fe trong oxit Fe2O3. Quay lại bài toán ban đầu:
Hoà tan 3,2 gam Fe2O3 ⇝ thu được 62 gam dung dịch chứa 0,02 mol Fe2(SO4)3.
Tinh thể muối X dạng Fe2(SO4)3.nH2O nặng 7,868 gam.
Với hiệu suất cô cạn 70% ⇒ nX = 0,02 × 0,7 = 0,014 mol
⇒ 0,014 × (400 + 18n) = 7,868 ⇒ n = 9 cho biết X là Fe2(SO4)3.9H2O.
⇝ Yêu cầu %mO trong X = 16 × 21 ÷ 562 × 100% ≈ 59,79%.
Câu 37 [26077]: Cho các phát biểu sau:
(a) Đường mía bị hóa đen khi tiếp xúc với axit sunfuric đặc.
(b) Sợi bông, sợi đay đều là tơ thiên nhiên có nguồn gốc thực vật.
(c) Axit α-aminoglutaric là hợp chất hữu cơ tạp chức, có tính lưỡng tính.
(d) Dầu ăn và mỡ động vật đều có thành phần chính là chất béo.
(e) Trùng hợp etilen và stiren đều thu được polime có tính dẻo.
Số phát biểu đúng là
(a) Đường mía bị hóa đen khi tiếp xúc với axit sunfuric đặc.
(b) Sợi bông, sợi đay đều là tơ thiên nhiên có nguồn gốc thực vật.
(c) Axit α-aminoglutaric là hợp chất hữu cơ tạp chức, có tính lưỡng tính.
(d) Dầu ăn và mỡ động vật đều có thành phần chính là chất béo.
(e) Trùng hợp etilen và stiren đều thu được polime có tính dẻo.
Số phát biểu đúng là
A, 2.
B, 5.
C, 3.
D, 4.
HD: Phân tích các phát biểu:
✔️ (a) đúng. saccarozơ là một hợp chất cacbohiđrat dạng C12(H2O)11 ⇝ H2SO4 đặc háo nước sẽ lấy dần phần nước ⇝ phần còn lại là cacbon (C) màu đen, ngoài ra một phần C sinh ra phản ứng với H2SO4 tạo các khí SO2 và CO2 nên có hiện tượng cột đen cao dần lên trong cốc:
✔️ (b) đúng, bông đay có nguồn gốc từ xenlulozơ là một polime thiên nhiên.
✔️ (c) đúng vì cấu tạo axit α-aminoglutaric là H2NC3H5(COOH)2 ⇒ tạp chức amin (bazơ) - axit và có tính chất lưỡng tính.
✔️ (d) đúng vì thành phần chính của dầu ăn (lỏng) và mỡ động vật (rắn) chính là các chất béo.
✔️ (e) đúng, trùng hợp etilen thu được polietilen (PE) và stiren thu được polistiren (PS) là các chất dẻo.

⇝ Tất cả 5/5 phát biểu đều đúng ⇝ Chọn đáp án B. ♦
✔️ (a) đúng. saccarozơ là một hợp chất cacbohiđrat dạng C12(H2O)11 ⇝ H2SO4 đặc háo nước sẽ lấy dần phần nước ⇝ phần còn lại là cacbon (C) màu đen, ngoài ra một phần C sinh ra phản ứng với H2SO4 tạo các khí SO2 và CO2 nên có hiện tượng cột đen cao dần lên trong cốc:
✔️ (b) đúng, bông đay có nguồn gốc từ xenlulozơ là một polime thiên nhiên.
✔️ (c) đúng vì cấu tạo axit α-aminoglutaric là H2NC3H5(COOH)2 ⇒ tạp chức amin (bazơ) - axit và có tính chất lưỡng tính.
✔️ (d) đúng vì thành phần chính của dầu ăn (lỏng) và mỡ động vật (rắn) chính là các chất béo.
✔️ (e) đúng, trùng hợp etilen thu được polietilen (PE) và stiren thu được polistiren (PS) là các chất dẻo.

⇝ Tất cả 5/5 phát biểu đều đúng ⇝ Chọn đáp án B. ♦
Câu 38 [906810]: Cho các sơ đồ phản ứng:
E + NaOH X + Y;
X + Y;
F + NaOH X + Z;
X + Z;
X + HCl T + NaCl.
T + NaCl.
Biết: E, F đều là các hợp chất hữu cơ no, mạch hở, chỉ chứa nhóm chức este (được tạo thành từ axit cacboxylic và ancol) và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; E và Z có cùng số nguyên tử cacbon; ME < MF < 175. Cho các phát biểu sau:
(a) Có một công thức cấu tạo của F thỏa mãn sơ đồ trên.
(b) Chất Z hòa tan được Cu(OH)2 trong môi trường kiềm.
(c) Hai chất E và T có cùng công thức đơn giản nhất.
(d) Từ Y điều chế trực tiếp được CH3COOH.
(e) Nhiệt độ sôi của E cao hơn nhiệt độ sôi của CH3COOH.
Số phát biểu đúng là
E + NaOH
 X + Y;
X + Y;F + NaOH
 X + Z;
X + Z; X + HCl
 T + NaCl.
T + NaCl.Biết: E, F đều là các hợp chất hữu cơ no, mạch hở, chỉ chứa nhóm chức este (được tạo thành từ axit cacboxylic và ancol) và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi; E và Z có cùng số nguyên tử cacbon; ME < MF < 175. Cho các phát biểu sau:
(a) Có một công thức cấu tạo của F thỏa mãn sơ đồ trên.
(b) Chất Z hòa tan được Cu(OH)2 trong môi trường kiềm.
(c) Hai chất E và T có cùng công thức đơn giản nhất.
(d) Từ Y điều chế trực tiếp được CH3COOH.
(e) Nhiệt độ sôi của E cao hơn nhiệt độ sôi của CH3COOH.
Số phát biểu đúng là
A, 2.
B, 5.
C, 4.
D, 3.
HD: ☆ Phân tích: este no, hở, thuần chức, số C = số O lần lượt là C2H4O2; C4H6O4; C6H8O6;…
Thấy, từ C6 trở đi thì có phân tử khối 176 > 175 rồi nên chỉ có thể E là C2H4O2 và F là C4H6O4.
E chỉ có duy nhất một cấu tạo este là HCOOCH3 → X là HCOONa và Y là CH3OH.
Theo đó, ancol Z là C2H4(OH)2 và cấu tạo F là (HCOO)2C2H4.
☆ Xem xét các phát biểu:
✔️ (a) đúng vì như phân tích trên, F chỉ có duy nhất một cấu tạo thoả mãn.
✔️ (b) đúng vì Z là etylen glicol C2H4(OH)2 có 2 nhóm OH liền kề..
❌ (c) sai vì CTĐGN của E là CH2O ≠ CTĐGN của T là CH2O2.
✔️ (d) đúng vì đây là pp hiện đại: CH3OH + CO –––xúc tác, to–→ CH3COOH.
❌ (e) sai vì E là HCOOCH3 (este, không có liên kết hiđro liên phân tử) nên nhiệt độ sôi thấp hơn so với axit cacboxylic CH3COOH (có cùng số C).
⇝ Tổng có 3/5 phát biểu đúng ⇝ Chọn đáp án D. ♠
Thấy, từ C6 trở đi thì có phân tử khối 176 > 175 rồi nên chỉ có thể E là C2H4O2 và F là C4H6O4.
E chỉ có duy nhất một cấu tạo este là HCOOCH3 → X là HCOONa và Y là CH3OH.
Theo đó, ancol Z là C2H4(OH)2 và cấu tạo F là (HCOO)2C2H4.
☆ Xem xét các phát biểu:
✔️ (a) đúng vì như phân tích trên, F chỉ có duy nhất một cấu tạo thoả mãn.
✔️ (b) đúng vì Z là etylen glicol C2H4(OH)2 có 2 nhóm OH liền kề..
❌ (c) sai vì CTĐGN của E là CH2O ≠ CTĐGN của T là CH2O2.
✔️ (d) đúng vì đây là pp hiện đại: CH3OH + CO –––xúc tác, to–→ CH3COOH.
❌ (e) sai vì E là HCOOCH3 (este, không có liên kết hiđro liên phân tử) nên nhiệt độ sôi thấp hơn so với axit cacboxylic CH3COOH (có cùng số C).
⇝ Tổng có 3/5 phát biểu đúng ⇝ Chọn đáp án D. ♠
Câu 39 [134715]: Hòa tan hết 22,16 gam hỗn hợp gồm Fe và các oxit Fe trong 240 gam dung dịch HNO3 31,5% thu được dung dịch X. Cho từ từ đến hết 680 ml dung dịch NaOH 1,5M vào dung dịch X thu được 32,1 gam kết tủa duy nhất. Mặt khác hòa tan hết 22,16 gam hỗn hợp trên cần dùng dung dịch chứa HCl 1M và H2SO4 0,5M thu được dung dịch Y chứa 49,09 gam muối và 1,792 lít khí H2 (đktc). Nồng độ C% của muối sắt có trong dung dịch X gần nhất với
A, 28,5%.
B, 29,2%.
C, 28,8%.
D, 29,5%.
HD: Bài tập này chỉ là ghép của 2 dạng bài đã học.! Chia nó ra và xử lí:
§1 kim loại, oxit + HCl, H2SO4 loãng: quan sát + xử lí nhanh quá trình:

BTKL có: 22,16 + 73x + 98x = 49,09 + 0,08 × 2 + 18 × (2x – 0,08) → x = 0,19 mol.
||→ nH2O = 2x – 0,08 = 0,3 mol ||→ quan tâm: nO trong oxit = 0,3 mol và ∑nFe = 0,31 mol.
§2 kim loại, oxit + HNO3 và dùng NaOH xử lí dung dịch sau phản ứng → xứ lí sơ đồ luôn:

♦ BTKL cho sơ đồ HNO3 ||→ mspk = 5,46 gam → mdung dịch X = 240 + 22,16 – 5,46 = 256,7 gam.
||→ Yêu cầu: C%mmuối Fe(NO3)3 trong X = 0,31 × 242 ÷ 256,7 ≈ 29,22 %. Chọn B. ♦.
§1 kim loại, oxit + HCl, H2SO4 loãng: quan sát + xử lí nhanh quá trình:

BTKL có: 22,16 + 73x + 98x = 49,09 + 0,08 × 2 + 18 × (2x – 0,08) → x = 0,19 mol.
||→ nH2O = 2x – 0,08 = 0,3 mol ||→ quan tâm: nO trong oxit = 0,3 mol và ∑nFe = 0,31 mol.
§2 kim loại, oxit + HNO3 và dùng NaOH xử lí dung dịch sau phản ứng → xứ lí sơ đồ luôn:

♦ BTKL cho sơ đồ HNO3 ||→ mspk = 5,46 gam → mdung dịch X = 240 + 22,16 – 5,46 = 256,7 gam.
||→ Yêu cầu: C%mmuối Fe(NO3)3 trong X = 0,31 × 242 ÷ 256,7 ≈ 29,22 %. Chọn B. ♦.
Câu 40 [981802]: Cho các phát biểu sau:
(a) Khi trộn khí NH3 với khí HCl thì xuất hiện “khói” trắng.
(b) Đun nóng dung dịch Ca(HCO3)2 sinh ra khí và kết tủa.
(c) Dung dịch HCl đặc tác dụng được với kim loại Cu sinh ra khí H2.
(d) Sắt tây là sắt được tráng thiếc, lớp thiếc có vai trò bảo vệ sắt khỏi bị ăn mòn.
Số phát biểu đúng là
(a) Khi trộn khí NH3 với khí HCl thì xuất hiện “khói” trắng.
(b) Đun nóng dung dịch Ca(HCO3)2 sinh ra khí và kết tủa.
(c) Dung dịch HCl đặc tác dụng được với kim loại Cu sinh ra khí H2.
(d) Sắt tây là sắt được tráng thiếc, lớp thiếc có vai trò bảo vệ sắt khỏi bị ăn mòn.
Số phát biểu đúng là
A, 1.
B, 4.
C, 3.
D, 2.
HD: Phân tích các phát biểu:
✔️ (a) đúng vì NH3 + HCl → NH4Cl (muối kết tinh màu trắng ⇝ tạo cảm giác như "khói")
✔️ (b) Ca(HCO3)2 –––to–→ CaCO3 + CO2↑ + H2O.
❌ (c) Cu không tác dụng với HCl dù cho ở điều kiện đặc nóng (► chú ý, nhưng chỉ cần có mặt O2 thì lại khác nhé.!)
✔️ (d) đúng, Sn bền bảo vệ sắt theo phương pháp bảo vệ bề mặt (► và cần chú ý không được làm xước, rách lớp thiếc, nếu không sau đó rất dễ xảy ra ăn mòn điện hoá, phá huỷ sắt sau đó).
⇝ có 3/4 phát biểu thoả mãn yêu cầu ⇝ Chọn đáp án C. ♣
✔️ (a) đúng vì NH3 + HCl → NH4Cl (muối kết tinh màu trắng ⇝ tạo cảm giác như "khói")
✔️ (b) Ca(HCO3)2 –––to–→ CaCO3 + CO2↑ + H2O.
❌ (c) Cu không tác dụng với HCl dù cho ở điều kiện đặc nóng (► chú ý, nhưng chỉ cần có mặt O2 thì lại khác nhé.!)
✔️ (d) đúng, Sn bền bảo vệ sắt theo phương pháp bảo vệ bề mặt (► và cần chú ý không được làm xước, rách lớp thiếc, nếu không sau đó rất dễ xảy ra ăn mòn điện hoá, phá huỷ sắt sau đó).
⇝ có 3/4 phát biểu thoả mãn yêu cầu ⇝ Chọn đáp án C. ♣