Đáp án
1C
2B
3C
4D
5B
6A
7D
8A
9C
10C
11B
12D
13A
14D
15C
16D
17B
18B
19C
20B
21C
22B
23A
24A
25C
26A
27D
28A
29A
30A
31B
32C
33C
34B
35D
36C
37C
38A
39C
40A
Đáp án Đề minh họa số 36 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [982034]: Nguyên tố phổ biến thứ hai ở vỏ trái đất là
A, oxi.
B, cacbon.
C, silic.
D, sắt.
HD: ► Nguyên tố phổ biến thì đứng thứ 2 là Si (silic).
► Nếu hỏi kim loại phổ biến thứ 2 thì đó là Fe (sắt).
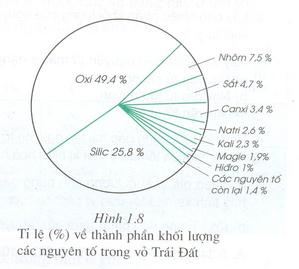
► Nếu hỏi kim loại phổ biến thứ 2 thì đó là Fe (sắt).

Câu 2 [982274]: Chất nào sau đây là thành phần chính của bông nõn?
A, Saccarozơ.
B, Xenlulozơ.
C, Glucozơ.
D, Tinh bột.
HD: Thành phần chính của bông nõn là xenlulozơ (chiếm khoảng 98%).


Câu 3 [310947]: Công thức của oxit sắt từ là
A, Fe2O3.
B, FeO.
C, Fe3O4.
D, FeS2.
HD: Công thức của oxit sắt từ là Fe3O4. ❒
Câu 4 [59727]: Nguyên tố hóa học nào sau đây không phải kim loại nhóm B?
A, Cr.
B, Fe.
C, Cu.
D, Al.
HD: Cr thuộc nhóm VIB; Fe nhóm VIIIB; Cu nhóm IB (chúng đều có e phân bố ở phân lớp d)
Chỉ riêng Al nhóm IIIA (phân lớp chính); không có e phân bố vào lớp d. Chọn D. ♠.
Chỉ riêng Al nhóm IIIA (phân lớp chính); không có e phân bố vào lớp d. Chọn D. ♠.
Câu 5 [60921]: Kim loại Cu phản ứng được với dung dịch
A, KNO3.
B, AgNO3.
C, HCl.
D, FeSO4.
HD: Dãy điện hoá: 
⇝ Cu chỉ đẩy được Ag+, xảy ra phản ứng hoá học tương ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓.
⇝ Chọn đáp án B. ♦

⇝ Cu chỉ đẩy được Ag+, xảy ra phản ứng hoá học tương ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓.
⇝ Chọn đáp án B. ♦
Câu 6 [57736]: Hai kim loại nào sau đây đều tác dụng mãnh liệt với nước ở điều kiện thường?
A, K và Na.
B, Mg và Al.
C, Cu và Fe.
D, Mg và Fe.
HD: Bài học kim loại tác dụng với nước:

⇝ 2 kim loại thoả mãn là K và Na ⇝ Chọn đáp án A. ♥

⇝ 2 kim loại thoả mãn là K và Na ⇝ Chọn đáp án A. ♥
Câu 7 [982764]: Khi phân hủy canxi cacbonat ở nhiệt độ khoảng 1000oC thì thu được sản phẩm gồm CO2 và chất nào sau đây?
A, Ca(OH)2.
B, Ca.
C, O2.
D, CaO.
HD: Phản ứng nhiệt phân: CaCO3 –––to–→ CaO + CO2↑.
⇝ Ngoài CO2, chất còn lại là CaO.
⇝ Ngoài CO2, chất còn lại là CaO.
Câu 8 [15093]: Nhúng đũa thủy tinh vào dung dịch axit HCl đặc rồi đưa vào miệng bình chứa khí A thấy có "khói trắng". Khí A là
A, etylamin.
B, anilin.
C, amoniclorua.
D, hiđroclorua.
HD: A là khí nên loại đáp án B. anilin (chất lỏng). Loại tiếp đáp án C và D vì NH4Cl và HCl không phản ứng với HCl tạo khói trắng ⇝ Chọn đáp án A. ♥
Phản ứng xảy ra: C2H5NH2 + HCl → C2H5NH3Cl.
tinh thể muối sinh ra nhưng với khối lượng rất bé nên lơ lửng giống như đám khói.

Phản ứng xảy ra: C2H5NH2 + HCl → C2H5NH3Cl.
tinh thể muối sinh ra nhưng với khối lượng rất bé nên lơ lửng giống như đám khói.

Câu 9 [60409]: Ở điều kiện thường, Fe không khử được ion kim loại nào sau đây trong dung dịch muối?
A, Ag+.
B, Cu2+.
C, Mg2+.
D, Fe3+.
HD: ☆ Dãy sắp xếp các cặp oxi hóa khử kim loại theo dãy điện hóa:
Mg2+/Mg > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+.
⇝ Fe không khử được ion Mg2+. ❒
Mg2+/Mg > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+.
⇝ Fe không khử được ion Mg2+. ❒
Câu 10 [20944]: Chất nào sau đây không làm mất màu nước brom?
A, Triolein.
B, Phenol.
C, Axit panmitic.
D, Vinyl axetat.
HD: Axit béo panmitic no, không có phản ứng với Br2/H2O ⇝ không làm mất màu ⇝ Chọn đáp án C. ♣
Còn lại, có phản ứng xảy ra và làm mất màu dung dịch:
✔️ A. Triolein: (C17H33COO)3C3H5 + 3Br2 → (CH3[CH2]7CHBr–CHBr[CH2]7COO)3C3H5.
✔️ B. Phenol:

✔️ D. Vinyl axetat: CH3COOCH=CH2 + Br2 → CH3COOCHBr–CH2Br.
Còn lại, có phản ứng xảy ra và làm mất màu dung dịch:
✔️ A. Triolein: (C17H33COO)3C3H5 + 3Br2 → (CH3[CH2]7CHBr–CHBr[CH2]7COO)3C3H5.
✔️ B. Phenol:

✔️ D. Vinyl axetat: CH3COOCH=CH2 + Br2 → CH3COOCHBr–CH2Br.
Câu 11 [973512]: Tơ nào sau đây thuộc loại tơ thiên nhiên?
A, Tơ nitron.
B, Tơ tằm.
C, Tơ nilon-6,6.
D, Tơ nilon-6.
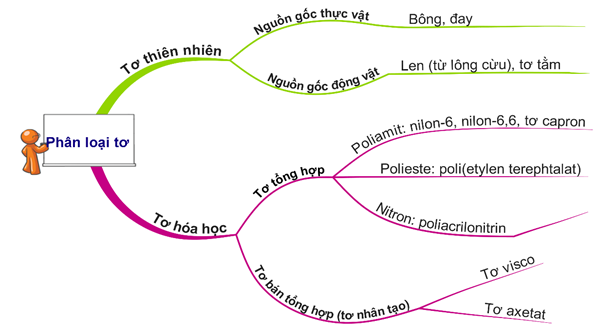
⇝ Tơ thiên nhiên trong 4 phương án là B. Tơ tằm.
Câu 12 [60315]: Chất rắn nào sau đây không tan được vào dung dịch KOH?
A, Al(OH)3.
B, Si.
C, K2CO3.
D, BaCO3.
HD: ☆ Yêu cầu: "tan - không tan trong dung dịch KOH"?
☑ A. tan vì Al(OH)3 + KOH → KAlO2 + 2H2O.
☑ B. tan vì Si + 2KOH + H2O → K2SiO3 + 2H2↑.
☑ C. tan vì đơn giản K2CO3 tan trong nước của dung dịch.
☑ D. không tan vì BaCO3 là kết tủa, không tan trong nước, cũng không có phản ứng với KOH. ❒
☑ A. tan vì Al(OH)3 + KOH → KAlO2 + 2H2O.
☑ B. tan vì Si + 2KOH + H2O → K2SiO3 + 2H2↑.
☑ C. tan vì đơn giản K2CO3 tan trong nước của dung dịch.
☑ D. không tan vì BaCO3 là kết tủa, không tan trong nước, cũng không có phản ứng với KOH. ❒
Câu 13 [679607]: Cặp dung dịch chất nào sau đây phản ứng với nhau tạo ra kết tủa?
A, Na2CO3 và Ba(HCO3)2.
B, KOH và H2SO4.
C, CuSO4 và HCl.
D, NaHCO3 và HCl.
HD: Phân tích các đáp án, phản ứng xảy ra:
✔️ A. Na2CO3 + Ba(HCO3)2 → BaCO3↓ + 2NaHCO3.
❌ B. 2KOH + H2SO4 → K2SO4 + 2H2O.
❌ C. CuSO4 + HCl → không xảy ra phản ứng.
❌ D. NaHCO3 + HCl → NaCl + CO2↑ + H2O.
✔️ A. Na2CO3 + Ba(HCO3)2 → BaCO3↓ + 2NaHCO3.
❌ B. 2KOH + H2SO4 → K2SO4 + 2H2O.
❌ C. CuSO4 + HCl → không xảy ra phản ứng.
❌ D. NaHCO3 + HCl → NaCl + CO2↑ + H2O.
Câu 14 [7153]: Thủy phân hoàn toàn este nào sau đây trong dung dịch NaOH (đun nóng) không thu được ancol?
A, etyl axetat.
B, metyl acrylat.
C, anlyl fomat.
D, vinyl axetat.
HD: Các phản ứng thủy phân các chất xảy ra như sau:
• etyl axetat: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (ancol etylic).
• metyl acrylat: CH2=CHCOOCH3 + NaOH → CH2=CHCOONa + CH3OH (ancol metylic).
• anlyl fomat: HCOOCH2CH=CH2 + NaOH → HCOONa + CH2=CHCH2OH (ancol anlylic).
• vinyl axetat: CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO (axetanđehit).
→ TH không thu được anol là đáp án D. ♠.
• etyl axetat: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (ancol etylic).
• metyl acrylat: CH2=CHCOOCH3 + NaOH → CH2=CHCOONa + CH3OH (ancol metylic).
• anlyl fomat: HCOOCH2CH=CH2 + NaOH → HCOONa + CH2=CHCH2OH (ancol anlylic).
• vinyl axetat: CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO (axetanđehit).
→ TH không thu được anol là đáp án D. ♠.
Câu 15 [311875]: Ion kim loại X khi vào cơ thể sẽ gây nguy hiểm với sự phát triển cả về trí tuệ và thể chất con người. Ở các làng nghề tái chế ăc qui cũ, nhiều người bị ung thư, trẻ em chậm phát triển trí tuệ, còi cọc vì nhiễm độc ion kim loại này. Kim loại X là
A, đồng.
B, magie.
C, chì.
D, sắt.
HD: Các cực ắc qui cũ được làm bằng chì (Pb) ⇝ hệ quả từ việc xử lí rác cũng như lượng chì tồn đọng theo thời gian gây ảnh hưởng nghiêm trọng đến sức khỏe của trẻ em,... ❒
Câu 16 [679608]: Cho vào ống nghiệm 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3 giọt dung dịch NaOH 10%. Tiếp tục nhỏ 2 – 3 giọt dung dịch chất X vào ống nghiệm, lắc nhẹ, thu được dung dịch màu xanh lam. Chất X không thể là
A, glixerol.
B, saccarozơ.
C, etylen glicol.
D, etanol.
HD: Bài học:

⇒ Không thoả mãn là etanol ⇝ Chọn đáp án D. ♠

⇒ Không thoả mãn là etanol ⇝ Chọn đáp án D. ♠
Câu 17 [982499]: Đốt cháy hoàn toàn 2,45 gam tripeptit Gly-Ala-Val thu được a mol hỗn hợp sản phẩm hơi và khí gồm CO2; H2O; N2. Giá trị của a là
A, 0,25.
B, 0,21.
C, 0,18.
D, 0,30.
HD: Gly-Ala-Val là tripeptit nên công thức tổng quát dạng CnH2n – 1N3O4.
Ở đây, n = ∑số C = 2 + 3 + 5 = 10 ⇒ công thức phân tử tương ứng là C10H19N3O4.
☆ Giải đốt: 4C10H19N3O4 + 51O2 ––to→ 40CO2 + 38H2O + 6N2.
MGly-Ala-Val = 75 + 89 + 117 – 2 × 18 = 245 ⇒ 2,45 gam tương ứng 0,01 mol.
⇒ Sản phẩm cháy thu được gồm 0,1 mol CO2 + 0,095 mol H2O và 0,015 mol N2
⇒ a = 0,1 + 0,095 + 0,015 = 0,21 ⇝ Chọn đáp án B. ♦
Ở đây, n = ∑số C = 2 + 3 + 5 = 10 ⇒ công thức phân tử tương ứng là C10H19N3O4.
☆ Giải đốt: 4C10H19N3O4 + 51O2 ––to→ 40CO2 + 38H2O + 6N2.
MGly-Ala-Val = 75 + 89 + 117 – 2 × 18 = 245 ⇒ 2,45 gam tương ứng 0,01 mol.
⇒ Sản phẩm cháy thu được gồm 0,1 mol CO2 + 0,095 mol H2O và 0,015 mol N2
⇒ a = 0,1 + 0,095 + 0,015 = 0,21 ⇝ Chọn đáp án B. ♦
Câu 18 [12051]: Lên men 45 kg glucozơ với hiệu suất là 80%, thu được V lít ancol etylic (có khối lượng riêng là 0,8 g/ml). Giá trị của V là
A, 36,0.
B, 23,0.
C, 18,0.
D, 11,5.
HD:
C6H12O6 → 2CO2 + 2C2H5OH.
nC6H12O6 = 0,25 (kmol) ⇒ nC2H5OH = 2nC6H12O6.H% = 2.0,25.0,8 = 0,4 (kmol).
mC6H12O6 = 18,4 kg ⇒ VC6H12O6 = = 23 lít.
= 23 lít.
Chọn B.
C6H12O6 → 2CO2 + 2C2H5OH.
nC6H12O6 = 0,25 (kmol) ⇒ nC2H5OH = 2nC6H12O6.H% = 2.0,25.0,8 = 0,4 (kmol).
mC6H12O6 = 18,4 kg ⇒ VC6H12O6 =
 = 23 lít.
= 23 lít.Chọn B.
Câu 19 [60546]: Phản ứng nào sau đây tạo ra muối sắt(II)?
A, Fe(OH)3 tác dụng với dung dịch HCl.
B, Fe2O3 tác dụng với dung dịch HCl.
C, Fe tác dụng với dung dịch HCl.
D, FeO tác dụng với dung dịch HNO3 loãng.
HD: Các phương trình phản ứng xảy ra tương ứng:
☒ A. Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
☒ B. Fe2O3 + 6HCl → 2FeCl3 + 3H2O.
☑ C. Fe + 2HCl → FeCl2 + H2↑.
☒ D. 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O. ❒
☒ A. Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
☒ B. Fe2O3 + 6HCl → 2FeCl3 + 3H2O.
☑ C. Fe + 2HCl → FeCl2 + H2↑.
☒ D. 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O. ❒
Câu 20 [39841]: Cho dung dịch HCl vào dung dịch Ca(HCO3)2, hiện tượng quan sát được là
A, có kết tủa trắng rồi tan dần.
B, có bọt khí thoát ra.
C, có kết tủa trắng.
D, có kết tủa trắng và bọt khí.
HD: Phản ứng xảy ra khi tiến hành thí nghiệm:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O.
|⇝ chỉ có hiện tượng bọt khí thoát ra. ❒
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O.
|⇝ chỉ có hiện tượng bọt khí thoát ra. ❒
Câu 21 [981937]: Hòa tan hoàn toàn 5,10 gam Al2O3 trong lượng dư dung dịch HCl, thu được dung dịch chứa m gam muối. Giá trị của m là
A, 26,70.
B, 21,36.
C, 13,35.
D, 16,02.
HD: Phản ứng: Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Giả thiết cho nAl2O3 = 5,1 ÷ 102 = 0,05 mol ⇒ nmuối AlCl3 = 0,05 × 2 = 0,01 mol.
⇒ Yêu cầu giá trị của m = mmuối = 0,01 × 133,5 = 13,35 gam ⇝ Chọn đáp án C. ♣
Giả thiết cho nAl2O3 = 5,1 ÷ 102 = 0,05 mol ⇒ nmuối AlCl3 = 0,05 × 2 = 0,01 mol.
⇒ Yêu cầu giá trị của m = mmuối = 0,01 × 133,5 = 13,35 gam ⇝ Chọn đáp án C. ♣
Câu 22 [911585]: Khi nhựa PVC cháy sinh ra nhiều khí độc, trong đó có khí X. Biết khí X tác dụng với dung dịch AgNO3, thu được kết tủa trắng. Công thức của khí X là
A, C2H4.
B, HCl.
C, CO2.
D, CH4.
Công thức của PVC:
Vậy chất tạo kết tủa với AgNO3 có chứa nguyên tố Cl, đáp án B.

Vậy chất tạo kết tủa với AgNO3 có chứa nguyên tố Cl, đáp án B.
Câu 23 [338814]: Trong máu người luôn có nồng độ gluxit X không đổi là 0,1%. Nếu lượng X trong máu giảm đi thì người đó mắc bệnh suy nhược. Ngược lại nếu lượng X trong máu tăng lên thì đó là người mắc bệnh tiểu đường hay đường huyết. Chất X là
A, glucozơ.
B, mantozơ.
C, saccarozơ.
D, fructozơ.
HD: Chất X được nhắc đến chính là glucozơ:


Câu 24 [679856]: Phát biểu nào sau đây sai?
A, Dung dịch lysin không làm đổi màu quỳ tím.
B, Metylamin là chất khí tan nhiều trong nước.
C, Protein đơn giản chứa các gốc α-amino axit.
D, Phân tử Gly-Ala-Val có ba nguyên tử nitơ.
HD: Phân tích các phát biểu:
❌ A. sai vì cấu tạo lysin: (H2N)2C5H9COOH có 2 nhóm NH2 > 1 nhóm COOH nên dung dịch có môi trường bazơ, làm quỳ tím hoá xanh.
✔️ B. đúng, chú ý có 4 amin là chất khí ở điều kiện thường: metyl-; đimetyl-; trimetyl-; etylamin.
✔️ C. đúng theo định nghĩa protein đơn giản chứa các gốc α-amino axit.
✔️ D. đúng, phân tử Gly-Ala-Val là C5H9N3O4 ⇝ có 3 nguyên tử nitơ.
❌ A. sai vì cấu tạo lysin: (H2N)2C5H9COOH có 2 nhóm NH2 > 1 nhóm COOH nên dung dịch có môi trường bazơ, làm quỳ tím hoá xanh.
✔️ B. đúng, chú ý có 4 amin là chất khí ở điều kiện thường: metyl-; đimetyl-; trimetyl-; etylamin.
✔️ C. đúng theo định nghĩa protein đơn giản chứa các gốc α-amino axit.
✔️ D. đúng, phân tử Gly-Ala-Val là C5H9N3O4 ⇝ có 3 nguyên tử nitơ.
Câu 25 [101106]: Hoà tan 19,2 gam Cu bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A, 2,24.
B, 3,36.
C, 4,48.
D, 8,96.
HD: Phản ứng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Hoặc theo bảo toàn electron: 2nCu = 3nNO
⇒ từ giả thiết nCu = 0,3 mol ⇒ nNO = 0,2 mol
⇒ V = 0,2 × 22,4 = 4,48 lít ⇝ Chọn đáp án C. ♣
Hoặc theo bảo toàn electron: 2nCu = 3nNO
⇒ từ giả thiết nCu = 0,3 mol ⇒ nNO = 0,2 mol
⇒ V = 0,2 × 22,4 = 4,48 lít ⇝ Chọn đáp án C. ♣
Câu 26 [679866]: Dẫn 0,04 mol hỗn hợp gồm hơi nước và khí CO2 qua cacbon nung đỏ, thu được 0,07 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng 20 gam hỗn hợp gồm Fe2O3 và CuO (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
A, 19,04.
B, 18,56.
C, 19,52.
D, 18,40.
HD: Tổng ôn hoá tập 1:

⇒ nC = 0,07 – 0,04 = 0,03 mol ⇒ ∑nCO; H2 = 0,03 × 2 = 0,06 mol.
⇒ nO trong oxit bị lấy = 0,06 mol ⇒ m = 20 – 0,06 × 16 = 19,04 gam. ⇝ Chọn đáp án A. ♥

⇒ nC = 0,07 – 0,04 = 0,03 mol ⇒ ∑nCO; H2 = 0,03 × 2 = 0,06 mol.
⇒ nO trong oxit bị lấy = 0,06 mol ⇒ m = 20 – 0,06 × 16 = 19,04 gam. ⇝ Chọn đáp án A. ♥
Câu 27 [679564]: Cho sơ đồ các phản ứng sau:
(a) X1 + H2O X2 + X3↑ + H2↑
X2 + X3↑ + H2↑
(b) X2 + X4 → BaCO3 + K2CO3 + H2O
(c) X2 + X3 → X1 + X5 + H2O
(d) X4 + X6 → BaSO4 + K2SO4 + CO2 + H2O
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
(a) X1 + H2O
 X2 + X3↑ + H2↑
X2 + X3↑ + H2↑(b) X2 + X4 → BaCO3 + K2CO3 + H2O
(c) X2 + X3 → X1 + X5 + H2O
(d) X4 + X6 → BaSO4 + K2SO4 + CO2 + H2O
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
A, KClO, H2SO4.
B, Ba(HCO3)2, KHSO4.
C, Ba(HCO3)2, H2SO4.
D, KClO, KHSO4.
HD: Tư duy nhanh từ việc quan sát 4 đáp án: từ (d) nếu X6 là H2SO4 thì X4 phải đồng thời chứa K và Ba? ⇒ loại ngay đáp án A và C. Còn lại B và D ⇒ X6 là KHSO4 ⇒ X4 là hợp chất của Ba ⇒ X2 là hợp chất của K; X3 là khí ⇒ X5 không thể là hợp chất của Ba được → loại B. Vậy chỉ có thể là đáp án D đúng, tương ứng với X5 là KClO; X6 là KHSO4 ||⇒ lần lượt suy ngược lại: X3 là Cl2; X4 là Ba(HCO3)2, X1 là KCl.
Các phản ứng diễn ra lần lượt như sau:
(a) 2KCl ––đpnc→ 2KOH (X2) + Cl2 (X3) + H2↑.
(b) 2KOH + Ba(HCO3)2 (X4) → K2CO3 + BaCO3↓ + 2H2O.
(c) 2KOH + Cl2 → KCl (X1) + KClO (X5) + H2O.
(d) Ba(HCO3)2 + 2KHSO4 (X6) → BaSO4 + K2SO4 + 2CO2↑ + 2H2O.
Các phản ứng diễn ra lần lượt như sau:
(a) 2KCl ––đpnc→ 2KOH (X2) + Cl2 (X3) + H2↑.
(b) 2KOH + Ba(HCO3)2 (X4) → K2CO3 + BaCO3↓ + 2H2O.
(c) 2KOH + Cl2 → KCl (X1) + KClO (X5) + H2O.
(d) Ba(HCO3)2 + 2KHSO4 (X6) → BaSO4 + K2SO4 + 2CO2↑ + 2H2O.
Câu 28 [273491]: Một khoáng chất có thành phần về khối lượng là: 14,81% Mg; 47,41% O; 0,25% H còn lại là Ca và Si. Phần trăm khối lượng của Ca trong khoáng chất là
A, 9,90%.
B, 17,78%.
C, 27,63%.
D, 37,53%.
Giả sử ta có 100 gam quặng loại này.
Tính lần lượt số mol các chất đã biết:
Trong quặng, thì các nguyên tố sẽ có các số oxi hóa tương ứng Ca 2+, Mg 2+, O 2-, H +, Si 4+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ:

 Đáp án A
Đáp án A
Tính lần lượt số mol các chất đã biết:

Trong quặng, thì các nguyên tố sẽ có các số oxi hóa tương ứng Ca 2+, Mg 2+, O 2-, H +, Si 4+. Ngoài ra, các số oxi hóa này phải đảm bảo cân bằng giữa tổng số oxi hóa âm và dương.
Tóm lại, ta có hệ:


 Đáp án A
Đáp án A
Câu 29 [310874]: Dẫn V lít (đktc) hỗn hợp X gồm C2H2 và H2 đi qua ống sứ đựng bột Ni nung nóng thu được khí Y. Dẫn Y vào lượng dư dung dịch AgNO3 trong dung dịch NH3 thu được 12 gam kết tủa. Khí đi ra khỏi dung dịch phản ứng vừa đủ với dung dịch chứa 16 gam Br2 và còn lại khí Z. Đốt cháy hoàn toàn khí Z được 2,24 lít CO2 (đktc) và 4,5 gam H2O. Giá trị của V là
A, 11,20.
B, 13,44.
C, 5,60.
D, 8,96.

Câu 30 [906853]: Cho các phát biểu sau:
(a) Nước quả chanh khử được mùi tanh của cá.
(b) Fructozơ là monosaccarit duy nhất có trong mật ong.
(c) Nhỏ vài giọt dung dịch I2 vào xenlulozơ, xuất hiện màu xanh tím.
(d) Một số este hòa tan tốt nhiều chất hữu cơ nên được dùng làm dung môi.
(e) Vải làm từ nilon-6 sẽ nhanh hỏng khi ngâm lâu trong nước xà phòng có tính kiềm.
Số phát biểu đúng là
(a) Nước quả chanh khử được mùi tanh của cá.
(b) Fructozơ là monosaccarit duy nhất có trong mật ong.
(c) Nhỏ vài giọt dung dịch I2 vào xenlulozơ, xuất hiện màu xanh tím.
(d) Một số este hòa tan tốt nhiều chất hữu cơ nên được dùng làm dung môi.
(e) Vải làm từ nilon-6 sẽ nhanh hỏng khi ngâm lâu trong nước xà phòng có tính kiềm.
Số phát biểu đúng là
A, 3.
B, 4.
C, 5.
D, 2.
HD: Phân tích các phát biểu:
✔️ (a) đúng. Quả chanh chua chứa axit phản ứng trung hoà với các amin (là nguyên nhân chính gây nên mùi tanh của cá) ⇝ khử được mùi tanh.
❌ (b) sai vì thành phần mật ong chứa khoảng 40% fructozơ; 30% glucozơ; 20% saccarozơ,...
❌ (c) sai vì I2 phản ứng màu với hồ tinh bột, xenlulozơ thì không.
✔️ (d) đúng theo ứng dụng của este.
✔️ (e) đúng vì nilon-6 chứa liên kết amit CO–NH kém bền trong môi trường axit, bazơ (tính kiềm).
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
✔️ (a) đúng. Quả chanh chua chứa axit phản ứng trung hoà với các amin (là nguyên nhân chính gây nên mùi tanh của cá) ⇝ khử được mùi tanh.
❌ (b) sai vì thành phần mật ong chứa khoảng 40% fructozơ; 30% glucozơ; 20% saccarozơ,...
❌ (c) sai vì I2 phản ứng màu với hồ tinh bột, xenlulozơ thì không.
✔️ (d) đúng theo ứng dụng của este.
✔️ (e) đúng vì nilon-6 chứa liên kết amit CO–NH kém bền trong môi trường axit, bazơ (tính kiềm).
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
Câu 31 [679867]: Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearat và natri oleat. Đốt cháy hoàn toàn m gam X cần vừa đủ 3,22 mol O2, thu được H2O và 2,28 mol CO2. Mặt khác, m gam X tác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
A, 0,04.
B, 0,08.
C, 0,20.
D, 0,16.
HD: ► Từ sản phẩm thuỷ phân ⇒ nhận xét: các gốc là stearat hay oleat đều có cùng 18C
⇒ công thức phân tử X dạng C57H?O6 ⇒ nX = 2,28 ÷ 57 = 0,04 mol.
Giải đốt: 0,04 mol C55H?O6 + 3,22 mol O2 –––to–→ 2,28 mol CO2 + ? mol H2O.
Bảo toàn nguyên tố O có ngay nH2O = 2,12 mol.
Tương quan đốt: ∑nCO2 – ∑nH2O = nBr2 phản ứng + 2nX
⇒ a + 2 × 0,04 = 2,28 – 2,12 ⇒ a = 0,08 ⇝ Chọn đáp án B. ♦
⇒ công thức phân tử X dạng C57H?O6 ⇒ nX = 2,28 ÷ 57 = 0,04 mol.
Giải đốt: 0,04 mol C55H?O6 + 3,22 mol O2 –––to–→ 2,28 mol CO2 + ? mol H2O.
Bảo toàn nguyên tố O có ngay nH2O = 2,12 mol.
Tương quan đốt: ∑nCO2 – ∑nH2O = nBr2 phản ứng + 2nX
⇒ a + 2 × 0,04 = 2,28 – 2,12 ⇒ a = 0,08 ⇝ Chọn đáp án B. ♦
Câu 32 [679330]: Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ), thu được khí H2 ở catot.
(b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có xuất hiện ăn mòn điện hóa.
(d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag.
(e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl.
Số phát biểu đúng là
(a) Điện phân dung dịch NaCl (điện cực trơ), thu được khí H2 ở catot.
(b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có xuất hiện ăn mòn điện hóa.
(d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag.
(e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl.
Số phát biểu đúng là
A, 2.
B, 3.
C, 4.
D, 5.
HD: Phân tích các phát biểu:
✔ (a) đúng. Điện phân dung dịch: 2NaCl + 2H2O → 2NaOH + Cl2 (anot)↑ + H2 (catot)↑.
✘ (b) sai. Vì oxit nhôm Al2O3 không bị khử bởi CO, H2 thành kim loại Al.
✔ (c) đúng. Đầu tiên Zn + CuSO4 → Cu + ZnSO4; lúc này tạo cặp điện cực Cu-Zn, tiếp xúc nhau trong dung dịch chất điện li là H2SO4 → xảy ra ăn mòn điện hóa.
✔ (d) đúng. Hg có nhiệt độ nóng chảy thấp nhất (–39oC), còn cao như ta biết là wonfram (W).
Ag là kim loại dẫn điện tốt nhất, sau đó là Cu, Al, Fe, …
✔ (e) đúng. Phản ứng: FeCl2 + 3AgNO3 (dư) → Fe(NO3)3 + Ag↓ + AgCl↓.
Như vậy, chỉ có phát biểu (b) sai, còn lại 4 phát biểu đều đúng.
✔ (a) đúng. Điện phân dung dịch: 2NaCl + 2H2O → 2NaOH + Cl2 (anot)↑ + H2 (catot)↑.
✘ (b) sai. Vì oxit nhôm Al2O3 không bị khử bởi CO, H2 thành kim loại Al.
✔ (c) đúng. Đầu tiên Zn + CuSO4 → Cu + ZnSO4; lúc này tạo cặp điện cực Cu-Zn, tiếp xúc nhau trong dung dịch chất điện li là H2SO4 → xảy ra ăn mòn điện hóa.
✔ (d) đúng. Hg có nhiệt độ nóng chảy thấp nhất (–39oC), còn cao như ta biết là wonfram (W).
Ag là kim loại dẫn điện tốt nhất, sau đó là Cu, Al, Fe, …
✔ (e) đúng. Phản ứng: FeCl2 + 3AgNO3 (dư) → Fe(NO3)3 + Ag↓ + AgCl↓.
Như vậy, chỉ có phát biểu (b) sai, còn lại 4 phát biểu đều đúng.
Câu 33 [310647]: Cho các sơ đồ phản ứng theo đúng tỉ lệ mol:

Cho biết: X là hợp chất hữu cơ có công thức phân tử C9H8O4; X1, X2, X3, X4, X5 là các hợp chất hữu cơ khác nhau. Phân tử khối của X5 là

Cho biết: X là hợp chất hữu cơ có công thức phân tử C9H8O4; X1, X2, X3, X4, X5 là các hợp chất hữu cơ khác nhau. Phân tử khối của X5 là
A, 90.
B, 222.
C, 194.
D, 118.

Câu 34 [508322]: Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho 5 giọt dung dịch CuSO4 5% và khoảng 1 ml dung dịch NaOH 10% vào ống nghiệm.
Lắc nhẹ, gạn bỏ lớp dung dịch giữ lại kết tủa Cu(OH)2. Rót thêm 2 ml dung dịch glucozơ vào ống nghiệm chứa Cu(OH)2, lắc nhẹ.
Thí nghiệm 2: Cho vào ống nghiệm 1 ml lòng trắng trứng 10% (protein), 1 ml dung dịch NaOH 30% và 1 giọt dung dịch CuSO4 2%. Lắc nhẹ ống nghiệm.
Cho các phát biểu sau:
(a) Thí nghiệm 1 chứng tỏ glucozơ có chứa nhóm –CHO.
(b) Thí nghiệm 2 thu được sản phẩm màu tím.
(c) Phân tử glucozơ và protein đều có nhiều nhóm –OH kề nhau nên hòa tan được Cu(OH)2.
(d) Cả hai thí nghiệm đều xảy ra phản ứng oxi hoá - khử.
(e) Trong cả 2 thí nghiệm đều dùng lượng dư NaOH.
Số phát biểu đúng là
Thí nghiệm 1: Cho 5 giọt dung dịch CuSO4 5% và khoảng 1 ml dung dịch NaOH 10% vào ống nghiệm.
Lắc nhẹ, gạn bỏ lớp dung dịch giữ lại kết tủa Cu(OH)2. Rót thêm 2 ml dung dịch glucozơ vào ống nghiệm chứa Cu(OH)2, lắc nhẹ.
Thí nghiệm 2: Cho vào ống nghiệm 1 ml lòng trắng trứng 10% (protein), 1 ml dung dịch NaOH 30% và 1 giọt dung dịch CuSO4 2%. Lắc nhẹ ống nghiệm.
Cho các phát biểu sau:
(a) Thí nghiệm 1 chứng tỏ glucozơ có chứa nhóm –CHO.
(b) Thí nghiệm 2 thu được sản phẩm màu tím.
(c) Phân tử glucozơ và protein đều có nhiều nhóm –OH kề nhau nên hòa tan được Cu(OH)2.
(d) Cả hai thí nghiệm đều xảy ra phản ứng oxi hoá - khử.
(e) Trong cả 2 thí nghiệm đều dùng lượng dư NaOH.
Số phát biểu đúng là
A, 4.
B, 2.
C, 3.
D, 1.
HD: Phân tích hai thí nghiệm:
• TN1: glucozơ phản ứng với Cu(OH)2/OH– tạo dung dịch màu xanh lam đặc trưng:
2.png)
⇝ Thí nghiệm chứng minh glucozơ có nhiều nhóm OH (ít nhất 2 nhóm OH liền kề).
• TN2: dung dịch protein phản ứng với Cu(OH)2/OH– tạo dung dịch màu tím đặc trưng
⇝ chứng minh protein có phản ứng màu biure.
☆ Phân tích các phát biểu:
❌ (a) sai theo phân tích thí nghiệm 1 trên.
✔️ (b) đúng theo phân tích thí nghiệm 2 trên.
❌ (c) sai vì protein là phản ứng màu biure, tính chất của liên kết peptit CO–NH chứ không phải do OH.
❌ (d) sai, cả 2 phản ứng không phải là phản ứng oxi hoá khử.
✔️ (e) đúng, tác nhân phản ứng là Cu(OH)2 cần trong môi trường kiềm.
⇝ có 2/5 phát biểu đúng ⇝ Chọn đáp án B. ♦
• TN1: glucozơ phản ứng với Cu(OH)2/OH– tạo dung dịch màu xanh lam đặc trưng:
⇝ Thí nghiệm chứng minh glucozơ có nhiều nhóm OH (ít nhất 2 nhóm OH liền kề).
• TN2: dung dịch protein phản ứng với Cu(OH)2/OH– tạo dung dịch màu tím đặc trưng
⇝ chứng minh protein có phản ứng màu biure.
☆ Phân tích các phát biểu:
❌ (a) sai theo phân tích thí nghiệm 1 trên.
✔️ (b) đúng theo phân tích thí nghiệm 2 trên.
❌ (c) sai vì protein là phản ứng màu biure, tính chất của liên kết peptit CO–NH chứ không phải do OH.
❌ (d) sai, cả 2 phản ứng không phải là phản ứng oxi hoá khử.
✔️ (e) đúng, tác nhân phản ứng là Cu(OH)2 cần trong môi trường kiềm.
⇝ có 2/5 phát biểu đúng ⇝ Chọn đáp án B. ♦
Câu 35 [602122]: Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị dưới đây:

Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là

Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là
A, 31,1.
B, 29,5.
C, 31,3.
D, 30,4.
HD: Quan sát đồ thị dốc lên – thoải xuống – lại dốc lên nên đồ thi biểu diễn quá trình TH1.

Chọn I = 2 × 96500. Ta có MH = OH = a; IN = ½IM = a; PK = 1,5NK = 1,5a
⇒ 0,35 = MH + IN + PK = a + a + 1,5a ⇒ a = 0,1.
Tại điểm M, Cl2 ra hết 0,1 mol ⇒ ban đầu có 0,2 mol NaCl.
Tại điểm N, Cu2+ điện phân hết (ra theo CuCl2 và CuO; mà có 0,1 mol Cl2 và 0,1 mol O2 ⇒ ∑nCu2+ = 0,3 mol) ⇒ ban đầu có 0,3 mol Cu(NO3)2.
☆ Thời gian điện phân 3,5a giây: dung dịch ra 0,1 mol CuCl2 + 0,2 mol CuO + 0,05 mol H2O.
⇝ Yêu cầu m = 0,1 × 135 + 0,2 × 80 + 0,05 × 18 = 30,4 gam ⇝ Chọn đáp án D. ♠

Chọn I = 2 × 96500. Ta có MH = OH = a; IN = ½IM = a; PK = 1,5NK = 1,5a
⇒ 0,35 = MH + IN + PK = a + a + 1,5a ⇒ a = 0,1.
Tại điểm M, Cl2 ra hết 0,1 mol ⇒ ban đầu có 0,2 mol NaCl.
Tại điểm N, Cu2+ điện phân hết (ra theo CuCl2 và CuO; mà có 0,1 mol Cl2 và 0,1 mol O2 ⇒ ∑nCu2+ = 0,3 mol) ⇒ ban đầu có 0,3 mol Cu(NO3)2.
☆ Thời gian điện phân 3,5a giây: dung dịch ra 0,1 mol CuCl2 + 0,2 mol CuO + 0,05 mol H2O.
⇝ Yêu cầu m = 0,1 × 135 + 0,2 × 80 + 0,05 × 18 = 30,4 gam ⇝ Chọn đáp án D. ♠
Câu 36 [679456]: Dung dịch X gồm KHCO3 1M và Na2CO3 1M. Dung dịch Y gồm H2SO4 1M và HCl 1M. Nhỏ từ từ 100 ml dung dịch Y vào 200 ml dung dịch X, thu được V lít khí CO2 và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào E, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và V lần lượt là
A, 82,4 và 1,12.
B, 59,1 và 1,12.
C, 82,4 và 2,24.
D, 59,1 và 2,24.
HD: ☆ Quan tâm: 200 ml dung dịch X chứa 0,2 mol CO32– và 0,2 mol HCO3–.
100 ml dung dịch Y chứa 0,3 mol H+ và 0,1 mol SO42–.
Cho từ từ dung dịch Y vào dung dịch X xảy ra lần lượt như sau:

Tỉ lệ phản ứng và số liệu quan tâm ⇒ kết thúc thu được 0,1 mol CO2 ⇒ V = 2,24 lít.
☆ Đồng thời, sau phản ứng trên, trong dung dịch E chứa 0,3 mol HCO3– và 0,1 mol SO42–.
Khi cho Ba(OH)2 tới dư vào thu được m gam kết tủa gồm 0,3 mol BaCO3 và 0,1 mol BaSO4.
⇒ Giá trị của m = 0,3 × 197 + 0,1 × 233 = 82,4 gam.
100 ml dung dịch Y chứa 0,3 mol H+ và 0,1 mol SO42–.
Cho từ từ dung dịch Y vào dung dịch X xảy ra lần lượt như sau:

Tỉ lệ phản ứng và số liệu quan tâm ⇒ kết thúc thu được 0,1 mol CO2 ⇒ V = 2,24 lít.
☆ Đồng thời, sau phản ứng trên, trong dung dịch E chứa 0,3 mol HCO3– và 0,1 mol SO42–.
Khi cho Ba(OH)2 tới dư vào thu được m gam kết tủa gồm 0,3 mol BaCO3 và 0,1 mol BaSO4.
⇒ Giá trị của m = 0,3 × 197 + 0,1 × 233 = 82,4 gam.
Câu 37 [906807]: Khi thủy phân hết 3,42 gam hỗn hợp X gồm hai este đơn chức, mạch hở thì cần vừa đủ 0,05 mol NaOH, thu được một muối và hỗn hợp Y gồm hai ancol cùng dãy đồng đẳng. Đốt cháy hết Y trong O2 dư, thu được CO2 và m gam H2O. Giá trị của m là
A, 3,78.
B, 1,44.
C, 2,34.
D, 1,89.
HD: ☆ Nhận xét: este đơn chức, mạch hở ⇝ không cần để ý trường hợp este của phenol.!
Ta có nX = nNaOH = 0,05 mol ⇒ MX = 3,42 ÷ 0,05 = 68,4 ⇒ X chứa HCOOCH3.
⇒ este còn lại dạng HCOOCnH2n + 1 ⇒ X có công thức trung bình C2,6H5,2O2.
☆ Thủy phân: X dạng C2,6H5,2O2 + NaOH → HCOONa + C1,6H5,2O (Y).
Theo đó, khi đốt Y sẽ thu được 0,05 × 2,6 = 0,13 mol H2O ⇒ m = 2,34 gam.
Ta có nX = nNaOH = 0,05 mol ⇒ MX = 3,42 ÷ 0,05 = 68,4 ⇒ X chứa HCOOCH3.
⇒ este còn lại dạng HCOOCnH2n + 1 ⇒ X có công thức trung bình C2,6H5,2O2.
☆ Thủy phân: X dạng C2,6H5,2O2 + NaOH → HCOONa + C1,6H5,2O (Y).
Theo đó, khi đốt Y sẽ thu được 0,05 × 2,6 = 0,13 mol H2O ⇒ m = 2,34 gam.
Câu 38 [133362]: Hòa tan hết 14,3 gam hỗn hợp X gồm Al(NO3)3, MgO, Mg và Al vào dung dịch gồm 0,03 mol KNO3 và 0,5 mol H2SO4 (đun nóng). Sau khi kết thúc phản ứng thu được dung dịch Y chỉ chứa 59,85 gam muối và 3,584 lít (đktc) hỗn hợp khí Z gồm NO và H2 có tỉ khối so với H2 bằng 4,5. Dung dịch Y tác dụng tối đa với dung dịch chứa 1,11 mol KOH, lấy kết tủa nung ngoài không khí tới khối lượng không đổi thu được 10 gam rắn. Phần trăm khối lượng của Al có trong X là
A, 22,66%.
B, 28,50%.
C, 42,80%.
D, 52,88%.
HD: Xử lý nhanh các giả thiết số mol → đọc quá trình, có sơ đồ:

Bảo toàn khối lượng cả sơ đồ: mH2O = 5,04 gam ⇄ nH2O = 0,28 mol.
⇝ Bảo toàn nguyên tố H có nNH4+ = 0,05 mol.
☆ Trong dung dịch Y, bảo toàn điện tích và khối lượng giải nMg2+ = 0,25 mol; nAl3+ = 0,14 mol.
Bảo toàn nguyên tố N, ta có nAl(NO3)3 = 0,02 mol ⇒ nAl trong X = 0,12 mol.
Vậy, yêu cầu %mAl trong X = 0,12 × 27 ÷ 14,3 × 100% ≈ 22,66%. ❒

Bảo toàn khối lượng cả sơ đồ: mH2O = 5,04 gam ⇄ nH2O = 0,28 mol.
⇝ Bảo toàn nguyên tố H có nNH4+ = 0,05 mol.
☆ Trong dung dịch Y, bảo toàn điện tích và khối lượng giải nMg2+ = 0,25 mol; nAl3+ = 0,14 mol.
Bảo toàn nguyên tố N, ta có nAl(NO3)3 = 0,02 mol ⇒ nAl trong X = 0,12 mol.
Vậy, yêu cầu %mAl trong X = 0,12 × 27 ÷ 14,3 × 100% ≈ 22,66%. ❒
Câu 39 [679571]: Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxi không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,025 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 ml dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 8,6 ml.
Giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí lần lượt là
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 ml dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 8,6 ml.
Giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí lần lượt là
A, 11,12 và 57%.
B, 6,95 và 7%.
C, 6,95 và 14%.
D, 11,12 và 43%.
Giải: Nhân 5 số liệu lên (tức xét trong 100 ml dung dịch Y).
– TN1: BT gốc SO4 ⇒ nFeSO4.7H2O = 0,05 – 0,025 = 0,025 mol ⇒ m = 6,95 gam.
– TN2: BTe ⇒ nFeSO4 = 5nKMnO4 = 0,0215 mol.
⇒ %nFe(II) bị oxh = (0,025 – 0,0215) ÷ 0,025 × 100 = 14%.
– TN1: BT gốc SO4 ⇒ nFeSO4.7H2O = 0,05 – 0,025 = 0,025 mol ⇒ m = 6,95 gam.
– TN2: BTe ⇒ nFeSO4 = 5nKMnO4 = 0,0215 mol.
⇒ %nFe(II) bị oxh = (0,025 – 0,0215) ÷ 0,025 × 100 = 14%.
Câu 40 [679627]: Hỗn hợp X gồm ba este mạch hở đều tạo bởi axit cacboxylic với ancol, trong đó hai este có cùng số nguyên tử cacbon trong phân tử. Xà phòng hóa hoàn toàn 9,16 gam X bằng dung dịch NaOH vừa đủ thu được hỗn hợp Y gồm hai ancol đơn chức, kế tiếp trong dãy đồng đẳng và hỗn hợp Z gồm hai muối. Cho toàn bộ Y vào bình đựng kim loại Na dư, sau phản ứng có khí thoát ra và khối lượng bình tăng 5,12 gam. Đốt cháy hoàn toàn Z cần vừa đủ 0,12 mol O2, thu được Na2CO3 và 6,2 gam hỗn hợp CO2 và H2O. Phần trăm khối lượng của este có phân tử khối lớn nhất trong X là
A, 19,21%.
B, 38,43%.
C, 13,10%.
D, 80,79%.
HD: Phản ứng thuỷ phân chức este: –COO– + NaOH → –COONa + –OH.
Sau đó: –OH + Na → –ONa + ½H2↑. Gọi a = nOH = n–COO– = nNaOH = n–COONa.
Ta có mbình natri tăng = mancol – mH2↑ = 5,12 ⇒ mancol = (5,12 + a) gam.
BTKL phản ứng thuỷ phân este: 9,16 + 40a = mmuối + mancol ⇒ mmuối = (4,04 + 39a) gam.
☆ Giải đốt (4,04 + 39a) gam Z + 0,12 mol O2 –––to–→ 0,5a mol Na2CO3 + 6,2 gam (CO2 + H2O).
⇒ BTKL có ngay: (4,04 + 39a) + 0,12 × 32 = 53a + 6,2 ⇒ a = 0,12 mol.
♦ Giải 5,24 gam hai ancol với số mol 0,12 ⇒ Mtrung bình = 43,67
⇒ cho biết có 0,02 mol CH3OH và 0,1 mol C2H5OH.
♦ Đốt 8,72 gam Z + 0,12 mol O2 –––to–→ 0,06 mol Na2CO3 + 4,96 gam (CO2 + H2O).
Z chứa 0,12 mol chức COONa ⇒ nO trong Z = 0,24 mol
⇒ bảo toàn O có 2nCO2 + nH2O = 0,3 mol.
Lại có mCO2 + mH2O = 6,2 gam nên giải ra nCO2 = nH2O = 0,1 mol.
► Chú ý: tương quan đốt muối nCO2 = nH2O ⇒ hai muối đều là muối của axit cacboxylic no, đơn chức, mạch hở.
Mtrung bình = 8,72 ÷ 0,12 = 72,667 cho biết có một muối là HCOONa (68).
Lại để ý có hai este cùng số cacbon nên hai muối hơn kém nhau 1C
⇒ muối còn lại là CH3COONa ⇒ giải hệ số mol có nHCOONa = 0,08 mol; nCH3COONa = 0,04 mol.
Ghép X: có 0,02 mol CH3COOCH3; 0,08 mol HCOOC2H5 và 0,02 mol CH3COOC2H5.
⇒ yêu cầu C%mCH3COOC2H5/X = 0,02 × 88 ÷ 9,16 × 100% ≈ 19,21%.
Sau đó: –OH + Na → –ONa + ½H2↑. Gọi a = nOH = n–COO– = nNaOH = n–COONa.
Ta có mbình natri tăng = mancol – mH2↑ = 5,12 ⇒ mancol = (5,12 + a) gam.
BTKL phản ứng thuỷ phân este: 9,16 + 40a = mmuối + mancol ⇒ mmuối = (4,04 + 39a) gam.
☆ Giải đốt (4,04 + 39a) gam Z + 0,12 mol O2 –––to–→ 0,5a mol Na2CO3 + 6,2 gam (CO2 + H2O).
⇒ BTKL có ngay: (4,04 + 39a) + 0,12 × 32 = 53a + 6,2 ⇒ a = 0,12 mol.
♦ Giải 5,24 gam hai ancol với số mol 0,12 ⇒ Mtrung bình = 43,67
⇒ cho biết có 0,02 mol CH3OH và 0,1 mol C2H5OH.
♦ Đốt 8,72 gam Z + 0,12 mol O2 –––to–→ 0,06 mol Na2CO3 + 4,96 gam (CO2 + H2O).
Z chứa 0,12 mol chức COONa ⇒ nO trong Z = 0,24 mol
⇒ bảo toàn O có 2nCO2 + nH2O = 0,3 mol.
Lại có mCO2 + mH2O = 6,2 gam nên giải ra nCO2 = nH2O = 0,1 mol.
► Chú ý: tương quan đốt muối nCO2 = nH2O ⇒ hai muối đều là muối của axit cacboxylic no, đơn chức, mạch hở.
Mtrung bình = 8,72 ÷ 0,12 = 72,667 cho biết có một muối là HCOONa (68).
Lại để ý có hai este cùng số cacbon nên hai muối hơn kém nhau 1C
⇒ muối còn lại là CH3COONa ⇒ giải hệ số mol có nHCOONa = 0,08 mol; nCH3COONa = 0,04 mol.
Ghép X: có 0,02 mol CH3COOCH3; 0,08 mol HCOOC2H5 và 0,02 mol CH3COOC2H5.
⇒ yêu cầu C%mCH3COOC2H5/X = 0,02 × 88 ÷ 9,16 × 100% ≈ 19,21%.