Đáp án
1B
2D
3D
4C
5B
6C
7C
8D
9B
10D
11D
12D
13C
14D
15C
16A
17A
18B
19A
20A
21D
22C
23D
24B
25D
26A
27D
28C
29A
30C
31A
32C
33D
34D
35D
36C
37A
38A
39B
40B
Đáp án Đề minh họa số 38 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [341995]: Cacbon monooxit thuộc loại oxit nào?
A, Oxit axit.
B, Oxit trung tính.
C, Oxit bazơ.
D, Oxit lưỡng tính.
HD: Cacbon monooxit: CO là một oxit trung tính.
Câu 2 [257324]: Tinh bột là hỗn hợp không tách rời nhau của amilopectin và
A, glucozơ.
B, glicogen.
C, xenlulozơ.
D, amilozơ.
HD: Tinh bột là hỗn hợp không tách rời của amilopectin và amilozơ. Amilozơ tan trong nước còn amilopectin thì không. Nhưng cần chú ý cấu tạo mỗi hạt tinh bột là amilopectin là vỏ bao bọc nhân amilozơ. Amilopectin trong nước nóng trương lên thành hồ ► tính chất này quyết định đến tính dẻo của hạt có tinh bột.


Câu 3 [982227]: Sắt(III) oxit là chất rắn màu đỏ nâu. Công thức của sắt(III) oxit là
A, FeS2.
B, Fe3O4.
C, FeCO3.
D, Fe2O3.
HD: Phân tích các đáp án:
| Công thức | FeS2 | Fe3O4 | FeCO3 | Fe2O3 |
| Tên gọi | pirit sắt | oxit sắt từ | sắt(II) cacbonat | sắt(III) oxit |
| ❌ | ❌ | ❌ | ✔️ |
Câu 4 [60920]: Chất nào sau đây không phản ứng với dung dịch CuSO4?
A, H2S.
B, BaCl2.
C, Fe2O3.
D, NaOH.
HD:
H2S + CuSO4 → CuS↓ + H2SO4.
BaCl2 + CuSO4 → CuCl2 + BaSO4↓.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4.
CuSO4 không phản ứng với Fe2O3.
*** Lưu ý: muối sunfua (S2–) được chia 3 loại:
- Loại 1: Na2S, CaS... tan trong nước và tan trong axit.
- Loại 2: ZnS, FeS... không tan trong nước nhưng tan trong axit.
- Loại 3: CuS, Ag2S... không tan trong nước và cũng không tan trong axit.
Do vậy nên có phản ứng: H2S + CuSO4 → CuS↓ + H2SO4;
và phản ứng: FeS + H2SO4 → FeSO4 + H2S.
H2S + CuSO4 → CuS↓ + H2SO4.
BaCl2 + CuSO4 → CuCl2 + BaSO4↓.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4.
CuSO4 không phản ứng với Fe2O3.
*** Lưu ý: muối sunfua (S2–) được chia 3 loại:
- Loại 1: Na2S, CaS... tan trong nước và tan trong axit.
- Loại 2: ZnS, FeS... không tan trong nước nhưng tan trong axit.
- Loại 3: CuS, Ag2S... không tan trong nước và cũng không tan trong axit.
Do vậy nên có phản ứng: H2S + CuSO4 → CuS↓ + H2SO4;
và phản ứng: FeS + H2SO4 → FeSO4 + H2S.
Câu 5 [229099]: Trong bảng tuần hoàn, nguyên tố Fe ở nhóm
A, IA.
B, VIIIB.
C, IIA.
D, IIIA.
- Cấu hình electron nguyên tử sắt là 1s22s22p63s23p63d64s2.
Viết gọn: [Ar]3d64s2. Electron cuối cùng điền vào phân lớp d nên nguyên tố Fe thuộc nhóm VIIIB.
Viết gọn: [Ar]3d64s2. Electron cuối cùng điền vào phân lớp d nên nguyên tố Fe thuộc nhóm VIIIB.
Câu 6 [973508]: Kim loại Fe bị thụ động bởi dung dịch
A, H2SO4 loãng.
B, HCl đặc, nguội.
C, HNO3 đặc, nguội.
D, HCl loãng.
HD: Al, Cr, Fe bị thụ động hoá bởi dung dịch HNO3 đặc nguội hoặc H2SO4 đặc nguội ⇝ Chọn đáp án C. ♣
Câu 7 [224892]: Kali nitrat (KNO3) là những tinh thể không màu, bền trong không khí, tan nhiều trong nước. Khi đun nóng ở nhiệt độ cao hơn nhiệt độ nóng chảy (333°C), KNO3 bắt đầu bị phân huỷ thành khí X và KNO2. Chất X là
A, CO.
B, NO2.
C, O2.
D, H2.
HD: Bài học nhiệt phân muối nitrat:

⇝ Nhiệt phân: 2KNO3 ––to→ 2KNO2 + O2↑.
Vậy chất X là khí O2 ⇝ Chọn đáp án C. ♣

⇝ Nhiệt phân: 2KNO3 ––to→ 2KNO2 + O2↑.
Vậy chất X là khí O2 ⇝ Chọn đáp án C. ♣
Câu 8 [679788]: Dung dịch chất nào sau đây làm quỳ tím chuyển màu xanh?
A, Anilin.
B, Glyxin.
C, Valin.
D, Metylamin.
HD: Phân tích các đáp án:
| Dung dịch chất | A. Anilin. | B. Glyxin. | C. Valin. | D. Metylamin. |
| Cấu tạo chất | C6H5NH2 | H2NCH2COOH | H2NC4H8COOH | CH3NH2 |
| Quỳ tím | không đổi | không đổi | không đổi | hoá xanh |
Câu 9 [973543]: Kim loại nào sau đây có tính khử mạnh nhất?
A, Fe.
B, K.
C, Mg.
D, Al.
HD: Thứ tự các kim loại theo dãy điện hoá: K > Mg > Al > Fe.
⇒ Kim loại K có tính khử mạnh nhất trong các đáp án.
⇒ Kim loại K có tính khử mạnh nhất trong các đáp án.
Câu 10 [339233]: Axit panmitic trong phân tử có tỉ lệ số nguyên tử H: số nguyên tử C là
A, 31: 15.
B, 33: 17.
C, 31 : 17.
D, 2: 1.
Công thức của axit panmitic: C15H31COOH.
Số nguyên tử H: 32; Số nguyên tử C = 16.
Tỉ lệ số nguyên tử H : số nguyên tử C = 32 : 16 = 2 : 1
Số nguyên tử H: 32; Số nguyên tử C = 16.
Tỉ lệ số nguyên tử H : số nguyên tử C = 32 : 16 = 2 : 1
Câu 11 [679745]: Tơ nào sau đây thuộc loại tơ tổng hợp?
A, Tơ tằm.
B, Tơ visco.
C, Tơ xenlulozơ axetat.
D, Tơ nilon-6,6.
HD: bài học phân loại tơ:
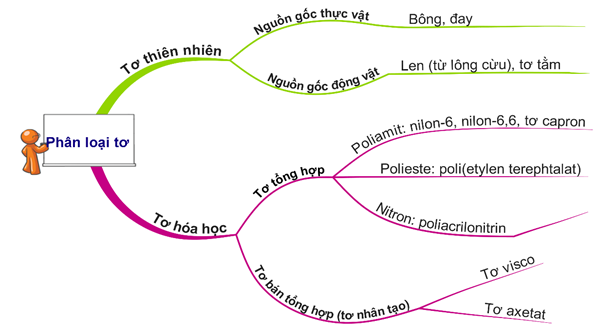
⇒ Tơ nilon-6,6 thuộc loại tơ tổng hợp ⇝ Chọn đáp án D. ♠

⇒ Tơ nilon-6,6 thuộc loại tơ tổng hợp ⇝ Chọn đáp án D. ♠
Câu 12 [911507]: Chất nào sau đây tác dụng được với dung dịch HCl?
A, MgCl2.
B, BaCl2.
C, Al(NO3)3.
D, Al(OH)3.
HD: Trong dãy các phương án, MgCl2; BaCl2 và Al(NO3)3 đều không tác dụng được với HCl. Chỉ có Al(OH)3 là hợp chất lưỡng tính có khả năng tác dụng được với HCl, phản ứng xảy ra:
Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Câu 13 [613371]: Phương trình hóa học nào sau đây không đúng
A, 4Cr + 3O2 → 2Cr2O3
B, 2Al + Fe2O3 → Al2O3 + 2Fe
C, 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
D, Ca + 2H2O → Ca(OH)2 + H2
Fe tác dụng với dung dịch H2SO4 loãng chỉ tạo muối sắt II.
Câu 14 [6943]: Chất nào sau đây không tác dụng với dung dịch NaOH?
A, Metyl axetat.
B, Phenol.
C, Axit acrylic.
D, Ancol metylic.
HD: Phân tích các đáp án:
✔️ A. Metyl axetat: CH3COOCH3 + NaOH → CH3COONa + CH3OH.
✔️ B. Phenol: C6H5OH + NaOH → C6H5ONa + H2O.
✔️ C. Axit acrylic: CH2=CHCOOH + NaOH → CH2=CHCOONa + H2O.
❌ D. Ancol metylic: CH3OH + NaOH → không xảy ra phản ứng.
✔️ A. Metyl axetat: CH3COOCH3 + NaOH → CH3COONa + CH3OH.
✔️ B. Phenol: C6H5OH + NaOH → C6H5ONa + H2O.
✔️ C. Axit acrylic: CH2=CHCOOH + NaOH → CH2=CHCOONa + H2O.
❌ D. Ancol metylic: CH3OH + NaOH → không xảy ra phản ứng.
Câu 15 [311953]: Ở Việt Nam, xăng E5 hiện đang được sử dụng rộng rãi làm nhiên liệu cho ô tô, xe máy, đó là loại xăng có chứa 5% thể tích ancol nào sau đây?
A, Metanol.
B, Etylen glicol.
C, Etanol.
D, Glixerol.
HD: Xăng E5 còn gọi là xăng sinh học E5 được tạo nên từ việc pha trộn xăng khoáng thông thường – xăng A92 – với nhiên liệu sinh học theo tỷ lệ phần trăm 95%: 5%. Nhiên liệu sinh học bio- etanol được sản xuất phần lớn từ các loại lương thực như ngô, sắn, ngũ cốc và củ cải đường. Thông qua quá trình lên men các sản phẩm hữu cơ như tinh bột, xenlulozơ, linoxenlulozơ, người ta thu được etanol.
Câu 16 [507902]: Cho vào ống nghiệm vài viên canxi cacbua. Rót nhanh khoảng 1 ml nước vào ống nghiệm và đậy nhanh bằng nút có ống dẫn khí. Gần như ngay lập tức xuất hiện khí X. Khí X là
A, axetilen.
B, etilen.
C, metan.
D, etan.
HD: Canxi cacbua là CaC2 (đất đèn) ⇝ Phản ứng xảy ra:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑ (axetilen - khí đất đèn).
Quan sát video thí nghiệm:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑ (axetilen - khí đất đèn).
Quan sát video thí nghiệm:
Câu 17 [311801]: Cho 8,9 gam amino axit X (phân tử có một nhóm NH2 và một nhóm COOH) tác dụng vừa đủ với 100 ml dung dịch NaOH aM, thu được 11,1 gam muối. Giá trị của a là
A, 1,0M.
B, 1,5M.
C, 2,0M.
D, 0,8M.
HD: Phân tử X dạng H2NRCOOH (R là gốc hiđrocacbon).
Phản ứng: H2NRCOOH + NaOH → H2NRCOONa + H2O.
8,9 gam giảm so với 11,1 gam là do 1H bị thay bởi 1Na.
⇒ nNaOH = (11,1 – 8,9) ÷ (23 – 1) = 0,1 mol ⇝ a = 1,0M. ❒
Phản ứng: H2NRCOOH + NaOH → H2NRCOONa + H2O.
8,9 gam giảm so với 11,1 gam là do 1H bị thay bởi 1Na.
⇒ nNaOH = (11,1 – 8,9) ÷ (23 – 1) = 0,1 mol ⇝ a = 1,0M. ❒
Câu 18 [12059]: Lên men m gam glucozơ thành ancol etylic với hiệu suất 50%, thu được 9,2 gam ancol etylic. Giá trị của m là
A, 32,4.
B, 36,0.
C, 18,0.
D, 16,2.
Giải: m = 9,2 ÷ 46 ÷ 2 ÷ 0,5 × 180 = 36 gam ⇒ chọn B.
Câu 19 [679613]: Thí nghiệm nào sau đây thu được muối sắt(III) sau khi phản ứng kết thúc?
A, Cho Fe vào dung dịch HNO3 loãng, dư.
B, Cho FeO vào dung dịch H2SO4 loãng.
C, Cho Fe(OH)2 vào dung dịch HCl dư.
D, Cho Fe vào dung dịch CuCl2.
HD: Các phản ứng xảy ra khi tiến hành các thí nghiệm:
✔️ A. Fe + 4HNO3 dư → Fe(NO3)3 (sắt(III) nitrat) + NO + 2H2O.
❌ B. FeO + H2SO4 → FeSO4 (sắt(II) sunfat) + H2O.
❌ C. Fe(OH)2 + 2HCl → FeCl2 (sắt(II) clorua) + 2H2O.
❌ D. Fe + CuCl2 → FeCl2 (sắt(II) clorua) + Cu↓.
✔️ A. Fe + 4HNO3 dư → Fe(NO3)3 (sắt(III) nitrat) + NO + 2H2O.
❌ B. FeO + H2SO4 → FeSO4 (sắt(II) sunfat) + H2O.
❌ C. Fe(OH)2 + 2HCl → FeCl2 (sắt(II) clorua) + 2H2O.
❌ D. Fe + CuCl2 → FeCl2 (sắt(II) clorua) + Cu↓.
Câu 20 [312141]: Cho dung dịch Ca(OH)2 dư vào dung dịch NaHCO3, hiện tượng quan sát được là
A, có kết tủa trắng.
B, có bọt khí bay ra.
C, có sủi bọt khí và có kết tủa.
D, không xuất hiện kết tủa.
HD: Phản ứng: Ca(OH)2 + NaHCO3 → CaCO3↓ + NaOH + H2O.
⇒ hiện tượng quan sát được là có kết tủa CaCO3 màu trắng. ❒
⇒ hiện tượng quan sát được là có kết tủa CaCO3 màu trắng. ❒
Câu 21 [311799]: Đốt cháy hoàn toàn m gam bột Al trong bình Cl2 dư, thu được 26,7 gam AlCl3. Giá trị của m là
A, 2,70.
B, 3,24.
C, 4,05.
D, 5,40.
HD: Phản ứng: 2Al + 3Cl2 –––to–→ 2AlCl3.
Giả thiết mAlCl3 = 26,7 gam ⇒ nAlCl3 = 0,2 mol.
Tương ứng theo tỉ lệ có 0,2 mol Al ⇒ m = 0,2 × 27 = 5,4 gam. ❒
Giả thiết mAlCl3 = 26,7 gam ⇒ nAlCl3 = 0,2 mol.
Tương ứng theo tỉ lệ có 0,2 mol Al ⇒ m = 0,2 × 27 = 5,4 gam. ❒
Câu 22 [311824]: Trồng dâu, nuôi tằm là một nghề vất vả đã được dân gian đúc kết trong câu: “Nuôi lợn ăn cơm nằm, nuôi tằm ăn cơm đứng”. Con tằm sau khi nhả tơ tạo thành kén tằm được sử dụng để dệt thành những tấm tơ lụa có giá trị kinh tế cao, đẹp và mềm mại. Tơ tằm thuộc loại tơ nào sau đây?
A, Tơ tổng hợp.
B, Tơ nhân tạo.
C, Tơ thiên nhiên.
D, Tơ hóa học.
HD: Bài học phân loại tơ:
![577864[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/577864[LG].png)
⇒ Tơ tằm thuộc loại tơ thiên nhiên. ❒
![577864[LG].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/577864[LG].png)
⇒ Tơ tằm thuộc loại tơ thiên nhiên. ❒
Câu 23 [12394]: Hợp chất hữu cơ X có trong tự nhiên, khi tác dụng với hỗn hợp HNO3 và H2SO4 đặc, đun nóng tạo ra hợp chất hữu cơ Y rất dễ cháy, nổ mạnh có ứng dụng làm thuốc súng không khói. Vậy X là
A, Toluen.
B, Tinh bột.
C, Phenol.
D, Xenlulozơ.
Chất hữu cơ Y là xenlulozơ trinitrat (sản phẩm của xenlulozơ và HNO3)chất dễ cháy nổ, ứng dụng làm thuốc súng không khói.
[C6H7O2(OH)3]n + 3nHNO3 (đặc) [C6H7O2(ONO2)3]n+ 3nH2O.
[C6H7O2(ONO2)3]n+ 3nH2O.
→ Đáp án D.
[C6H7O2(OH)3]n + 3nHNO3 (đặc)
 [C6H7O2(ONO2)3]n+ 3nH2O.
[C6H7O2(ONO2)3]n+ 3nH2O. → Đáp án D.
Câu 24 [679800]: Phát biểu nào sau đây đúng?
A, Anilin là chất khí tan nhiều trong nước.
B, Gly-Ala-Ala có phản ứng màu biure.
C, Phân tử Gly-Ala có bốn nguyên tử oxi.
D, Dung dịch glyxin làm quỳ tím chuyển màu đỏ.
HD: Phân tích các đáp án:
❌ A. sai vì anilin là chất lỏng và tan ít trong nước.
✔️ B. đúng Gly-Ala-Ala là một tripeptit ⇝ có phản ứng màu biure.
❌ C. sai vì phân tử Gly-Ala: H2NCH2CO–NHCH(CH3)COOH chỉ có ba nguyên tử oxi thôi.
❌ D. sai vì cấu tạo glyxin: H2NCH2COOH có số nhóm NH2 bằng COOH nên không làm quỳ tím đổi màu.
❌ A. sai vì anilin là chất lỏng và tan ít trong nước.
✔️ B. đúng Gly-Ala-Ala là một tripeptit ⇝ có phản ứng màu biure.
❌ C. sai vì phân tử Gly-Ala: H2NCH2CO–NHCH(CH3)COOH chỉ có ba nguyên tử oxi thôi.
❌ D. sai vì cấu tạo glyxin: H2NCH2COOH có số nhóm NH2 bằng COOH nên không làm quỳ tím đổi màu.
Câu 25 [312108]: Cho m gam Mg tan hoàn toàn trong dung dịch H2SO4 loãng, dư. Sau khi kết thúc phản ứng, thu được 2,8 lít khí H2 (ở đktc). Giá trị của m là
A, 2,4.
B, 4,0.
C, 3,6.
D, 3,0.
HD: Phản ứng: Mg + H2SO4 → MgSO4 + H2↑.
Giả thiết nH2 = 2,8 ÷ 22,4 = 0,125 mol ⇒ theo tỉ lệ: nMg = 0,125 mol.
⇝ yêu cầu: m = mMg = 0,125 × 24 = 3,0 gam. ❒
Giả thiết nH2 = 2,8 ÷ 22,4 = 0,125 mol ⇒ theo tỉ lệ: nMg = 0,125 mol.
⇝ yêu cầu: m = mMg = 0,125 × 24 = 3,0 gam. ❒
Câu 26 [679729]: Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A, 9,85.
B, 15,76.
C, 29,55.
D, 19,70.
HD: Nhắc lại kiến thức và cách xử lý nhanh + tinh tế hệ khí than ướt:

⇒ nC = Δntăng = 0,95 – 0,55 = 0,40 mol.
⇒ ∑(nCO + nH2) = 2nC = 0,8 mol ⇒ nCO2 trong Y = 0,95 – 0,8 = 0,15 mol.
☆ Giải 0,15 mol CO2 + 0,1 mol BaCO3 → 0,05 mol BaCO3↓ + 0,05 mol Ba(HCO3)2
⇒ Yêu cầu m gam kết tủa thu được tương ứng là 0,05 mol BaCO3 ⇒ m = 9,85 gam.

⇒ nC = Δntăng = 0,95 – 0,55 = 0,40 mol.
⇒ ∑(nCO + nH2) = 2nC = 0,8 mol ⇒ nCO2 trong Y = 0,95 – 0,8 = 0,15 mol.
☆ Giải 0,15 mol CO2 + 0,1 mol BaCO3 → 0,05 mol BaCO3↓ + 0,05 mol Ba(HCO3)2
⇒ Yêu cầu m gam kết tủa thu được tương ứng là 0,05 mol BaCO3 ⇒ m = 9,85 gam.
Câu 27 [679388]: Cho các sơ đồ phản ứng sau:
(a) X (dư) + Ba(OH)2 → Y + Z;
(b) X + Ba(OH)2 (dư) → Y + T + H2O.
Biết các phản ứng đều xảy ra trong dung dịch và chất Y tác dụng được với dung dịch H2SO4 loãng. Hai chất nào sau đây đều thỏa mãn tính chất của X?
(a) X (dư) + Ba(OH)2 → Y + Z;
(b) X + Ba(OH)2 (dư) → Y + T + H2O.
Biết các phản ứng đều xảy ra trong dung dịch và chất Y tác dụng được với dung dịch H2SO4 loãng. Hai chất nào sau đây đều thỏa mãn tính chất của X?
A, AlCl3, Al2(SO4)3.
B, Al(NO3)3, Al2(SO4)3.
C, Al(NO3)3, Al(OH)3.
D, AlCl3, Al(NO3)3.
HD: Phân tích các đáp án:
► Loại nhanh C vì Al(OH)3 chỉ tác dụng với Ba(OH)2 theo một phản ứng:
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 2H2O.
► Loại nhanh A và B vì Al2(SO4)3 tác dụng với Ba(OH)2 như sau:
• Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3↓.
• Al2(SO4)3 + 4Ba(OH)2 → 3BaSO4 + Ba(AlO2)2 + H2O.
||⇒ Y là BaSO4 không thoả mãn vì Y tác dụng được với dung dịch H2SO4 loãng.
⇝ Chọn đáp án C. ♣
► Loại nhanh C vì Al(OH)3 chỉ tác dụng với Ba(OH)2 theo một phản ứng:
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 2H2O.
► Loại nhanh A và B vì Al2(SO4)3 tác dụng với Ba(OH)2 như sau:
• Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3↓.
• Al2(SO4)3 + 4Ba(OH)2 → 3BaSO4 + Ba(AlO2)2 + H2O.
||⇒ Y là BaSO4 không thoả mãn vì Y tác dụng được với dung dịch H2SO4 loãng.
⇝ Chọn đáp án C. ♣
Câu 28 [679562]: Nung nóng 0,1 mol C4H10 có xúc tác thích hợp, thu được hỗn hợp X gồm: H2, CH4, C2H4, C2H6, C3H6, C4H8 và C4H10. Dẫn X qua bình đựng dung dịch Br2 dư, sau khi phản ứng hoàn toàn khối lượng bình tăng 3,64 gam và có hỗn hợp khí Y thoát ra. Đốt cháy hoàn toàn Y cần vừa đủ V lít khí O2. Giá trị của V là
A, 5,376.
B, 6,048.
C, 5,824.
D, 6,272.
HD: 3,64 gam bình brom tăng chính là các anken ⇒ Tinh tế xử lý quy đổi thành 0,26 mol cụm CH2.
Giải đốt 0,1 mol C4H10 cần (0,1 × 4 + 0,1 × 10 ÷ 4) = 0,65 mol O2.
Giải đốt 0,26 mol cụm CH2 cần 0,26 × 1,5 = 0,39 mol O2.
Mà 0,1 mol C4H10 cracking tạo a mol CH2 + Y.
⇒ đốt cháy hoàn toàn Y cần (0,65 – 0,39 = 0,26) mol O2 ⇄ 5,824 lít ⇝ Chọn đáp án C. ♣
Giải đốt 0,1 mol C4H10 cần (0,1 × 4 + 0,1 × 10 ÷ 4) = 0,65 mol O2.
Giải đốt 0,26 mol cụm CH2 cần 0,26 × 1,5 = 0,39 mol O2.
Mà 0,1 mol C4H10 cracking tạo a mol CH2 + Y.
⇒ đốt cháy hoàn toàn Y cần (0,65 – 0,39 = 0,26) mol O2 ⇄ 5,824 lít ⇝ Chọn đáp án C. ♣
Câu 29 [352955]: Dẫn 1,2 mol hỗn hợp X (gồm khí CO2 và hơi nước) qua than nung đỏ thu được 1,4a mol hỗn hợp khí Y (gồm CO2, CO và H2) trong đó có x mol CO2. Hấp thụ từ từ toàn bộ khí CO2 trong Y vào dung dịch có chứa 0,06b mol Ca(OH)2, khối lượng kết tủa phụ thuộc vào số mol khí CO2 được ghi ở bảng sau:

Giá trị của a có thể là

Giá trị của a có thể là
A, 1,00.
B, 1,36.
C, 1,40.
D, 0,28.
Xét trường hợp kết tủa chưa bị hòa tan.
 = x = 0,05b (1)
= x = 0,05b (1)
Khi = x + 0,4 thì
= x + 0,4 thì  = 0,03b và
= 0,03b và  = 0,03b
= 0,03b
=> x + 0,4 = 0,03b + 0,03b.2 (2)
Từ (1)(2) => x = 0,5; b = 10
Khi = y mol thì
= y mol thì  = 0,2 và
= 0,2 và = 0,4
= 0,4
Bảo toàn nguyên tố C => = 1
= 1
nC = nY – nX = 1,4a – 1,2
Bảo toàn electron: 4nC = 2nCO + 2nH2
=> 2nCO + 2nH2 = 2,8a – 2,4
=> nY = 2,8a – 2,4 + 1 = 1,4a
=> a = 1
 = x = 0,05b (1)
= x = 0,05b (1)
Khi
 = x + 0,4 thì
= x + 0,4 thì  = 0,03b và
= 0,03b và  = 0,03b
= 0,03b
=> x + 0,4 = 0,03b + 0,03b.2 (2)
Từ (1)(2) => x = 0,5; b = 10
Khi
 = y mol thì
= y mol thì  = 0,2 và
= 0,2 và = 0,4
= 0,4
Bảo toàn nguyên tố C =>
 = 1
= 1
nC = nY – nX = 1,4a – 1,2
Bảo toàn electron: 4nC = 2nCO + 2nH2
=> 2nCO + 2nH2 = 2,8a – 2,4
=> nY = 2,8a – 2,4 + 1 = 1,4a
=> a = 1
Câu 30 [24863]: Cho các phát biểu sau:
(a) Thủy phân hoàn toàn vinyl axetat bằng NaOH thu được natri axetat và anđehit fomic
(b) Polietilen được điều chế bằng phản ứng trùng ngưng.
(c) Ở điều kiện thường anilin là chất lỏng tan tốt trong nước.
(d) Amilozơ thuộc loại polisaccarit.
(e) Ở điều kiện thích hợp triolein tham gia phản ứng cộng hợp H2.
Số phát biểu đúng là
(a) Thủy phân hoàn toàn vinyl axetat bằng NaOH thu được natri axetat và anđehit fomic
(b) Polietilen được điều chế bằng phản ứng trùng ngưng.
(c) Ở điều kiện thường anilin là chất lỏng tan tốt trong nước.
(d) Amilozơ thuộc loại polisaccarit.
(e) Ở điều kiện thích hợp triolein tham gia phản ứng cộng hợp H2.
Số phát biểu đúng là
A, 5.
B, 3.
C, 2.
D, 4.
HD: Phân tích các phát biểu:
❌ (a) sai vì CH3COOCH=CH2 + NaOH ––to→ CH3COONa + CH3CHO (anđehit axetic ≠ anđehit fomic HCHO).
❌ (b) sai vì polietilen (PE) –[CH2–CH2–]n– được điều chế bằng phản ứng trùng hợp ≠ trùng ngưng.
❌ (c) sai vì anilin (C6H5NH2) ít tan trong nước.
✔️ (d) đúng. amilozơ và amilopectin là hai thành phân của tinh bột, chúng là các polisaccarit.
✔️ (e) đúng vì các gốc oleat: CH3[CH2]7CH=CH[CH2]7COO không no, xảy ra:
(C17H33COO)3C3H5 + 3H2 ––NI, to→ (C17H35COO)3C3H5 (tristearin) + 3H2.
⇝ có 2/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
❌ (a) sai vì CH3COOCH=CH2 + NaOH ––to→ CH3COONa + CH3CHO (anđehit axetic ≠ anđehit fomic HCHO).
❌ (b) sai vì polietilen (PE) –[CH2–CH2–]n– được điều chế bằng phản ứng trùng hợp ≠ trùng ngưng.
❌ (c) sai vì anilin (C6H5NH2) ít tan trong nước.
✔️ (d) đúng. amilozơ và amilopectin là hai thành phân của tinh bột, chúng là các polisaccarit.
✔️ (e) đúng vì các gốc oleat: CH3[CH2]7CH=CH[CH2]7COO không no, xảy ra:
(C17H33COO)3C3H5 + 3H2 ––NI, to→ (C17H35COO)3C3H5 (tristearin) + 3H2.
⇝ có 2/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Câu 31 [679457]: Đốt cháy hoàn toàn 0,06 mol hỗn hợp X gồm ba triglixerit cần vừa đủ 4,77 mol O2, thu được 3,14 mol H2O. Mặt khác, hiđro hóa hoàn toàn 78,9 gam X (xúc tác Ni, to), thu được hỗn hợp Y. Đun nóng Y với dung dịch KOH vừa đủ, thu được glixerol và m gam muối. Giá trị của m là
A, 86,10.
B, 57,40.
C, 83,82.
D, 57,16.
HD: Giải đốt 0,06 mol triglixerit dạng C?H??O6 + 4,77 mol O2 –––to–→ ??? mol CO2 + 3,14 mol H2O.
⇒ Bảo toàn nguyên tố O có nCO2 = 3,38 mol.
Tương quan đốt: ∑nCO2 – ∑nH2O = (k – 1).nX ⇒ k = 5 mol.
Mà số πC=O/X luôn là 3 ⇒ số πC=C/X = 2.
||⇝ Phản ứng làm no X: 0,06 mol X + 0,12 mol H2 → Y.
Lại có mX = mC + mH + mO = 52,6 gam ⇒ mY = 52,84 gam.
☆ Thuỷ phân 0,06 mol Y + 0,18 mol KOH → muối + 0,06 mol C3H5(OH)3.
⇒ BTKL ta có mmuối = 52,84 + 0,18 × 56 – 0,06 × 92 = 57,40 gam.
Lập tỉ lệ: 52,6 gam X ⇝ m = 57,40 gam
⇒ khi dùng 78,9 gam X thì tương ứng m = 86,10 gam.
⇒ Bảo toàn nguyên tố O có nCO2 = 3,38 mol.
Tương quan đốt: ∑nCO2 – ∑nH2O = (k – 1).nX ⇒ k = 5 mol.
Mà số πC=O/X luôn là 3 ⇒ số πC=C/X = 2.
||⇝ Phản ứng làm no X: 0,06 mol X + 0,12 mol H2 → Y.
Lại có mX = mC + mH + mO = 52,6 gam ⇒ mY = 52,84 gam.
☆ Thuỷ phân 0,06 mol Y + 0,18 mol KOH → muối + 0,06 mol C3H5(OH)3.
⇒ BTKL ta có mmuối = 52,84 + 0,18 × 56 – 0,06 × 92 = 57,40 gam.
Lập tỉ lệ: 52,6 gam X ⇝ m = 57,40 gam
⇒ khi dùng 78,9 gam X thì tương ứng m = 86,10 gam.
Câu 32 [911528]: Cho các phát biểu sau:
(a) Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
(b) Cho kim loại Ba tác dụng với dung dịch CuSO4, thu được kim loại Cu.
(c) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag.
(d) Để gang trong không khí ẩm lâu ngày có xảy ra ăn mòn điện hóa học.
(e) Dùng bột lưu huỳnh để xử lí thủy ngân khi nhiệt kế bị vỡ.
Số phát biểu đúng là
(a) Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
(b) Cho kim loại Ba tác dụng với dung dịch CuSO4, thu được kim loại Cu.
(c) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag.
(d) Để gang trong không khí ẩm lâu ngày có xảy ra ăn mòn điện hóa học.
(e) Dùng bột lưu huỳnh để xử lí thủy ngân khi nhiệt kế bị vỡ.
Số phát biểu đúng là
A, 4.
B, 2.
C, 3.
D, 5.
HD: Phân tích các phát biểu:
✔️ (a) đúng, H2 khử các oxit trung bình yếu thu được kim loại:
H2 + CuO ––to→ Cu + H2O || 3H2 + Fe2O3 ––to→ 2Fe + 3H2O.
❌ (b) sai vì Ba có tính khử rất mạnh: Ba + 2H2O → Ba(OH)2 + H2↑;
sau đó: Ba(OH)2 + CuSO4 → BaSO4↓ + Cu(OH)2↓ chứ không thu được Cu.
❌ (c) sai vì xảy ra phản ứng: 3AgNO3 + FeCl3 → 3AgCl↓ + Fe(NO3)3.
✔️ (d) đúng vì gang chứa cặp cực Fe-C tiếp xúc nhau, trong môi trường không khí ẩm là chất điện li ⇝ xảy ra ăn mòn điện hoá.
✔️ (e) đúng vì ở ngay nhiệt độ thường: Hg + S → HgS giúp ta thu hồi thuỷ ngân.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
✔️ (a) đúng, H2 khử các oxit trung bình yếu thu được kim loại:
H2 + CuO ––to→ Cu + H2O || 3H2 + Fe2O3 ––to→ 2Fe + 3H2O.
❌ (b) sai vì Ba có tính khử rất mạnh: Ba + 2H2O → Ba(OH)2 + H2↑;
sau đó: Ba(OH)2 + CuSO4 → BaSO4↓ + Cu(OH)2↓ chứ không thu được Cu.
❌ (c) sai vì xảy ra phản ứng: 3AgNO3 + FeCl3 → 3AgCl↓ + Fe(NO3)3.
✔️ (d) đúng vì gang chứa cặp cực Fe-C tiếp xúc nhau, trong môi trường không khí ẩm là chất điện li ⇝ xảy ra ăn mòn điện hoá.
✔️ (e) đúng vì ở ngay nhiệt độ thường: Hg + S → HgS giúp ta thu hồi thuỷ ngân.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Câu 33 [679372]: Cho các sơ đồ phản ứng theo đúng tỉ lệ mol:
(a) X + 2NaOH X1 + 2X2;
X1 + 2X2;
(b) X1 + H2SO4 → X3 + Na2SO4
(c) nX3 + nX4 poli(etylen terephtalat) + 2nH2O
poli(etylen terephtalat) + 2nH2O
(d) X2 + CO X5
X5
(e) X4 + 2X5 X6 + 2H2O
X6 + 2H2O
Cho biết: X là este có công thức phân tử C10H10O4; X1, X2, X3, X4, X5, X6 là các hợp chất hữu cơ khác nhau. Phân tử khối của X6 là
(a) X + 2NaOH
 X1 + 2X2;
X1 + 2X2;
(b) X1 + H2SO4 → X3 + Na2SO4
(c) nX3 + nX4
 poli(etylen terephtalat) + 2nH2O
poli(etylen terephtalat) + 2nH2O
(d) X2 + CO
 X5
X5
(e) X4 + 2X5
 X6 + 2H2O
X6 + 2H2OCho biết: X là este có công thức phân tử C10H10O4; X1, X2, X3, X4, X5, X6 là các hợp chất hữu cơ khác nhau. Phân tử khối của X6 là
A, 118.
B, 132.
C, 104.
D, 146.
HD: (c) phản ứng trùng ngưng điều chế poli(etylen terephtalat) (tơ lapsan):

Kết hợp (b) ta nhận ra X3 là axit terephtalic C6H4(COOH)2 ⇒ X1 là muối C6H4(COONa)2.
Quay lại phản ứng (a): C10H10O4 + 2NaOH ––to→ C6H4(COONa)2 + 2X2.
Với đúng tỉ lệ mol nên suy ra được X2 là CH3OH (ancol metylic). Tiếp theo:
(d) CH3OH + CO ––xúc tác, to→ CH3COOH (X5). Mà X4 là etylen glicol C2H4(OH)2 nên:
(e) HOCH2CH2OH + 2CH3COOH (CH3COO)2C2H4 (X6) + 2H2O.
(CH3COO)2C2H4 (X6) + 2H2O.
⇒ Yêu cầu phân tử khối của X6 là 146.

Kết hợp (b) ta nhận ra X3 là axit terephtalic C6H4(COOH)2 ⇒ X1 là muối C6H4(COONa)2.
Quay lại phản ứng (a): C10H10O4 + 2NaOH ––to→ C6H4(COONa)2 + 2X2.
Với đúng tỉ lệ mol nên suy ra được X2 là CH3OH (ancol metylic). Tiếp theo:
(d) CH3OH + CO ––xúc tác, to→ CH3COOH (X5). Mà X4 là etylen glicol C2H4(OH)2 nên:
(e) HOCH2CH2OH + 2CH3COOH
 (CH3COO)2C2H4 (X6) + 2H2O.
(CH3COO)2C2H4 (X6) + 2H2O.
⇒ Yêu cầu phân tử khối của X6 là 146.
Câu 34 [507913]: Thực hiện thí nghiệm theo các bước như sau:
Bước 1: Thêm 4 ml ancol isoamylic và 4 ml axit axetic kết tinh và khoảng 2 ml H2SO4 đặc vào ống nghiệm khô. Lắc đều.
Bước 2: Đưa ống nghiệm vào nồi nước sôi từ 10-15 phút. Sau đó lấy ra và làm lạnh.
Bước 3: Cho hỗn hợp trong ống nghiệm vào một ống nghiệm lớn hơn chứa 10 ml nước lạnh.
Cho các phát biểu sau:
(a) Tại bước 2 xảy ra phản ứng este hóa.
(b) Sau bước 3, hỗn hợp chất lỏng tách thành hai lớp.
(c) Có thể thay nước lạnh trong cốc 3 bằng dung dịch NaCl bão hòa.
(d) Sau bước 3, hỗn hợp chất lỏng thu được có mùi chuối chín.
(e) H2SO4 đặc đóng vai trò chất xúc tác và hút nước để chuyển dịch cân bằng.
Số phát biểu đúng là
Bước 1: Thêm 4 ml ancol isoamylic và 4 ml axit axetic kết tinh và khoảng 2 ml H2SO4 đặc vào ống nghiệm khô. Lắc đều.
Bước 2: Đưa ống nghiệm vào nồi nước sôi từ 10-15 phút. Sau đó lấy ra và làm lạnh.
Bước 3: Cho hỗn hợp trong ống nghiệm vào một ống nghiệm lớn hơn chứa 10 ml nước lạnh.
Cho các phát biểu sau:
(a) Tại bước 2 xảy ra phản ứng este hóa.
(b) Sau bước 3, hỗn hợp chất lỏng tách thành hai lớp.
(c) Có thể thay nước lạnh trong cốc 3 bằng dung dịch NaCl bão hòa.
(d) Sau bước 3, hỗn hợp chất lỏng thu được có mùi chuối chín.
(e) H2SO4 đặc đóng vai trò chất xúc tác và hút nước để chuyển dịch cân bằng.
Số phát biểu đúng là
A, 4.
B, 3.
C, 2.
D, 5.
HD: Bố trí và giải thích thí nghiệm:
• Bước 1: chuẩn bị hoá chất.
• Bước 2: Xảy ra phản ứng este hoá:
CH3COOH + (CH3)2CHCH2CH2OH ⇄ CH3COOCH2CH2CH(CH3)2 + H2O.
• Bước 3: thu sản phẩm, este CH3COOCH2CH2CH(CH3)2 tan ít nên sử dụng nước lạnh để hạn chế tối đa este tan; dung dịch thu được phân lớp, phần nhẹ hơn là este nổi lên.
☆ Phân tích các phát biểu:
✔️ (a) đúng. Bước (2) xảy ra phản ứng este như trên.
✔️ (b) đúng, este thu được tan rất ít trong nước lạnh nên phân lớp.
✔️ (c) đúng, NaCl bão hoà càng tốt, bởi nó sẽ hạn chế tối đa phần este tan vào dung dịch ⇝ thu được càng nhiều sản phẩm.
✔️ (d) đúng. sản phẩm là este isomayl axetat có mùi chuối chín.
✔️ (e) đúng, H2SO4 đặc là chất xúc tác, thêm nữa vì có tính háo nước, H2SO4 làm giảm số lượng H2O trong cân bằng ⇝ làm cân bằng chuyển dịch theo chiều thuận (tạo este) ⇝ tăng hiệu suất phản ứng este hoá.
⇝ Tất cả 5/5 phát biểu đều đúng ⇝ Chọn đáp án D. ♠
• Bước 1: chuẩn bị hoá chất.
• Bước 2: Xảy ra phản ứng este hoá:
CH3COOH + (CH3)2CHCH2CH2OH ⇄ CH3COOCH2CH2CH(CH3)2 + H2O.
• Bước 3: thu sản phẩm, este CH3COOCH2CH2CH(CH3)2 tan ít nên sử dụng nước lạnh để hạn chế tối đa este tan; dung dịch thu được phân lớp, phần nhẹ hơn là este nổi lên.
☆ Phân tích các phát biểu:
✔️ (a) đúng. Bước (2) xảy ra phản ứng este như trên.
✔️ (b) đúng, este thu được tan rất ít trong nước lạnh nên phân lớp.
✔️ (c) đúng, NaCl bão hoà càng tốt, bởi nó sẽ hạn chế tối đa phần este tan vào dung dịch ⇝ thu được càng nhiều sản phẩm.
✔️ (d) đúng. sản phẩm là este isomayl axetat có mùi chuối chín.
✔️ (e) đúng, H2SO4 đặc là chất xúc tác, thêm nữa vì có tính háo nước, H2SO4 làm giảm số lượng H2O trong cân bằng ⇝ làm cân bằng chuyển dịch theo chiều thuận (tạo este) ⇝ tăng hiệu suất phản ứng este hoá.
⇝ Tất cả 5/5 phát biểu đều đúng ⇝ Chọn đáp án D. ♠
Câu 35 [679737]: Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và NaCl vào nước, thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên dưới (đồ thị gấp khúc tại các điểm M, N).

Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là

Giả sử hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của m là
A, 17,84.
B, 11,08.
C, 13,42.
D, 15,76.
HD: Giải theo hai cách:
☆ Cách 1: Quan sát đồ thị dốc lên – dốc lên nữa – thoải xuống nên đồ thị biểu diễn quá trình TH2. Khi đó tại M ứng với a (giây) và khí ra là 0,04 mol Cl2 ⇒ ne trao đổi (M) = 0,04 × 2 = 0,08 mol.
Tại điểm P ứng với thời gian 3,5a (giây) thì ne trao đổi (P) = 0,08 × 3,5 = 0,28 mol.
Đoạn MN thoát ra x mol H2 và x mol Cl2.
Đoạn NP thoát ra 2y mol H2 và y mol O2.
⇒ Tổng khí thu được ở 3,5a giây là: 0,04 + 2x + 3y = 0,21 mol.
Cũng tại đó, anot ra (x + 0,04) mol Cl2 và y mol O2 ⇒ ne trao đổi = 2(x + 0,04) + 4y = 0,28.
Giải hệ các phương trình ta có: x = 0,04 và y = 0,03.
Từ đó đọc ra m gam hỗn hợp ban đầu gồm 0,04 mol CuSO4 và 0,16 mol NaCl ⇒ m = 15,76 gam.
☆ Cách 2: Sử dụng tỉ lệ đồ thị, chọn I = 96500.

Ta có ngay OH = MH ⇒ a = 0,04. Đặt IM = b, ta có IN = 2IM = 2b. Theo đó :
NK = 3,5a – IM – OH = 0,1 – b và PK = 0,21 – IN – MH = 0,17 – 2b.
Lại có PK = 1,5NK ⇒ tương ứng: 0,17 – 2b = 1,5 × (0,1 – b) ⇒ b = 0,04.
⇒ Tại N dung dịch ra : 0,04 mol CuCl2 và 0,08 mol HCl ⇒ nCu = 0,04 mol.
Vậy, m gam hỗn hợp ban đầu gồm 0,04 mol CuSO4 và 0,16 mol NaCl ⇒ m = 15,76 gam.
☆ Cách 1: Quan sát đồ thị dốc lên – dốc lên nữa – thoải xuống nên đồ thị biểu diễn quá trình TH2. Khi đó tại M ứng với a (giây) và khí ra là 0,04 mol Cl2 ⇒ ne trao đổi (M) = 0,04 × 2 = 0,08 mol.
Tại điểm P ứng với thời gian 3,5a (giây) thì ne trao đổi (P) = 0,08 × 3,5 = 0,28 mol.
Đoạn MN thoát ra x mol H2 và x mol Cl2.
Đoạn NP thoát ra 2y mol H2 và y mol O2.
⇒ Tổng khí thu được ở 3,5a giây là: 0,04 + 2x + 3y = 0,21 mol.
Cũng tại đó, anot ra (x + 0,04) mol Cl2 và y mol O2 ⇒ ne trao đổi = 2(x + 0,04) + 4y = 0,28.
Giải hệ các phương trình ta có: x = 0,04 và y = 0,03.
Từ đó đọc ra m gam hỗn hợp ban đầu gồm 0,04 mol CuSO4 và 0,16 mol NaCl ⇒ m = 15,76 gam.
☆ Cách 2: Sử dụng tỉ lệ đồ thị, chọn I = 96500.

Ta có ngay OH = MH ⇒ a = 0,04. Đặt IM = b, ta có IN = 2IM = 2b. Theo đó :
NK = 3,5a – IM – OH = 0,1 – b và PK = 0,21 – IN – MH = 0,17 – 2b.
Lại có PK = 1,5NK ⇒ tương ứng: 0,17 – 2b = 1,5 × (0,1 – b) ⇒ b = 0,04.
⇒ Tại N dung dịch ra : 0,04 mol CuCl2 và 0,08 mol HCl ⇒ nCu = 0,04 mol.
Vậy, m gam hỗn hợp ban đầu gồm 0,04 mol CuSO4 và 0,16 mol NaCl ⇒ m = 15,76 gam.
Câu 36 [311819]: Hòa tan hoàn toàn 21,24 gam hỗn hợp E gồm muối hiđrocacbonat X và muối cacbonat Y vào nước thu được 200 ml dung dịch Z. Cho từ từ 200 ml dung dịch KHSO4 0,3M và HCl 0,45M vào 200 ml dung dịch Z, thu được 1,344 lít khí CO2 (đktc) và dung dịch T. Cho dung dịch Ba(OH)2 dư vào T, thu được 49,44 gam kết tủa. Biết X là muối của kim loại kiềm. Phần trăm khối lượng của Y trong E là
A, 59,32%.
B, 57,63%.
C, 40,68%.
D, 42,37%.
Giải: ► nBaSO4 = nKHSO4 = 0,06 mol ⇒ mBaSO4 = 13,98(g) < 49,44(g).
⇒ ↓ còn chứa BaCO3 ⇒ nBaCO3 = 0,18 mol || Do T + Ba(OH)2 tạo BaCO3.
⇒ T chứa HCO3– ⇒ nCO32–/Z = ∑nH+ – nCO2 = 0,09 mol ⇒ nY = 0,09 mol.
Bảo toàn nguyên tố Cacbon: nX = 0,06 + 0,18 – 0,09 = 0,15 mol.
► Đặt CT cho X và Y lần lượt là MHCO3 và M'2CO3.
⇒ mE = 0,15.(M + 61) + 0,09.(2M' + 60) = 21,24(g) ⇒ 0,15M + 0,18M' = 6,69.
⇒ 5M + 6M' = 223 ⇒ M = 23 (Na) và M' = 18 (NH4) ⇒ %mY = 40,68% ⇒ chọn C.
⇒ ↓ còn chứa BaCO3 ⇒ nBaCO3 = 0,18 mol || Do T + Ba(OH)2 tạo BaCO3.
⇒ T chứa HCO3– ⇒ nCO32–/Z = ∑nH+ – nCO2 = 0,09 mol ⇒ nY = 0,09 mol.
Bảo toàn nguyên tố Cacbon: nX = 0,06 + 0,18 – 0,09 = 0,15 mol.
► Đặt CT cho X và Y lần lượt là MHCO3 và M'2CO3.
⇒ mE = 0,15.(M + 61) + 0,09.(2M' + 60) = 21,24(g) ⇒ 0,15M + 0,18M' = 6,69.
⇒ 5M + 6M' = 223 ⇒ M = 23 (Na) và M' = 18 (NH4) ⇒ %mY = 40,68% ⇒ chọn C.
Câu 37 [140700]: [PHV-FC]: Đốt cháy hoàn toàn 0,1 mol hỗn hơp gồm anhiđrit fomic ((HCO)2O), axit malonic (CH2(COOH)2), axit malic (HOOC-CH2-CH(OH)-COOH) và glixerol trifomat cần dùng 0,2 mol O2 (đktc). Sản phẩm cháy dẫn qua bình đựng dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
A, 30.
B, 25.
C, 35.
D, 20.
HD: 0,1 mol hỗn hợp X gồm C2H2O3 (là (HCO)2O); C3H4O4; C4H6O5 và C6H8O6.
Đọc: giả thiết có O2 cần đốt ||→ tìm cách vứt bỏ H2O hoặc CO2 trong các chất đem đốt.
yêu cầu liên quan đến CaCO3 ⇄ quan tâm đến số mol CO2 mà thôi.
Kết hợp 2 cái trên ||→ tìm cách loại bỏ hết nước rồi đến CO2 xem như thế nào?
C2H2O3 = C.H2O.CO2 || C3H4O4 = 2C.H4O2.CO2.
C4H6O5 = 3C.H6O3.CO2 || C6H8O6 = 5C.H8O4.CO2.
À, thấy rồi, YTHH 01: quy X về 0,1 mol CO2; y mol H2O và x mol C.
0,2 mol O2 chỉ dùng để đốt x mol C ||→ x = 0,2 mol ||→ ∑nCO2 thu được = 0,2 + 0,1 = 0,3 mol.
Theo đó, giá trị của m = 30 gam. Chọn đáp án A. ♥.
Đọc: giả thiết có O2 cần đốt ||→ tìm cách vứt bỏ H2O hoặc CO2 trong các chất đem đốt.
yêu cầu liên quan đến CaCO3 ⇄ quan tâm đến số mol CO2 mà thôi.
Kết hợp 2 cái trên ||→ tìm cách loại bỏ hết nước rồi đến CO2 xem như thế nào?
C2H2O3 = C.H2O.CO2 || C3H4O4 = 2C.H4O2.CO2.
C4H6O5 = 3C.H6O3.CO2 || C6H8O6 = 5C.H8O4.CO2.
À, thấy rồi, YTHH 01: quy X về 0,1 mol CO2; y mol H2O và x mol C.
0,2 mol O2 chỉ dùng để đốt x mol C ||→ x = 0,2 mol ||→ ∑nCO2 thu được = 0,2 + 0,1 = 0,3 mol.
Theo đó, giá trị của m = 30 gam. Chọn đáp án A. ♥.
Câu 38 [679348]: Hòa tan hoàn toàn 15,6 gam hỗn hợp gồm Fe, Fe3O4, Fe2O3, Mg, MgO và CuO vào 200 gam dung dịch H2SO4 và NaNO3, thu được dung dịch X chỉ chứa muối sunfat trung hòa của kim loại, hỗn hợp khí Y gồm 0,01 mol N2O và 0,02 mol NO. Cho X phản ứng với dung dịch Ba(OH)2 dư, thu được 89,15 gam kết tủa. Lọc kết tủa nung trong không khí đến khối lượng không đổi, thu được 84,386 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X có giá trị gần nhất với giá trị nào sau đây?
A, 0,85.
B, 1,06.
C, 1,45.
D, 1,86.
HD: “Giá như” Fe là kim loại không thay đổi hóa trị như Mg, Cu
⇒ Ta có thể gọi M là công thức tổng quát cho hỗn hợp kim loại ⇒ Sơ đồ quá trình:

Bảo toàn nguyên tố N có ngay 0,04 mol NaNO3. Gọi x là số mol O trong oxit ban đầu.
► Bảo toàn “cụm SO4” ở sơ đồ ⇒ Bảo toàn nguyên tố O có (x + 0,09) mol H2O.
⇒ “bật” ngược lại số mol H2SO4 là (x + 0,09) mol ⇒ 89,15 gam kết tủa gồm:
(15,6 – 16x) gam M và (2x + 0,09 × 2 – 0,04) mol OH và (x + 0,09) mol BaSO4.
(Cần chú ý số mol OH trong kết tủa tính theo gốc SO4 và trừ đi một lượng trong NaOH).
Giải ra x = 0,2 mol. Xét tiếp phản ứng nung 89,15 gam kết tủa với điều kiện “giá như”:
2M(OH)n → M2On + nH2O (nhìn đơn giản: 2OH → 1O + 1H2O).
→ chất rắn sau nung là 89,15 – 0,27 × 18 = 84,29 gam < 84,386 theo giả thiết.!
► Lí do ở đây là không có “giá như” mà FeSO4 → Fe(OH)2 → Fe2O3
⇒ việc tăng 84,386 so với 84,29 là sự chênh lệch O của 2FeO + O → Fe2O3.
⇒ số mol FeSO4 bằng FeO và bằng 2 × (84,386 – 84,29) ÷ 16 = 0,012 mol.
Thêm nữa khối lượng dung dịch X bằng 15,6 + 200 – 0,01 × 44 – 0,02 × 30 = 214,56 gam.
⇒ C%mFeSO4 trong X = 0,012 × 152 ÷ 214,56 × 100% ≈ 0,85%.
⇒ Ta có thể gọi M là công thức tổng quát cho hỗn hợp kim loại ⇒ Sơ đồ quá trình:

Bảo toàn nguyên tố N có ngay 0,04 mol NaNO3. Gọi x là số mol O trong oxit ban đầu.
► Bảo toàn “cụm SO4” ở sơ đồ ⇒ Bảo toàn nguyên tố O có (x + 0,09) mol H2O.
⇒ “bật” ngược lại số mol H2SO4 là (x + 0,09) mol ⇒ 89,15 gam kết tủa gồm:
(15,6 – 16x) gam M và (2x + 0,09 × 2 – 0,04) mol OH và (x + 0,09) mol BaSO4.
(Cần chú ý số mol OH trong kết tủa tính theo gốc SO4 và trừ đi một lượng trong NaOH).
Giải ra x = 0,2 mol. Xét tiếp phản ứng nung 89,15 gam kết tủa với điều kiện “giá như”:
2M(OH)n → M2On + nH2O (nhìn đơn giản: 2OH → 1O + 1H2O).
→ chất rắn sau nung là 89,15 – 0,27 × 18 = 84,29 gam < 84,386 theo giả thiết.!
► Lí do ở đây là không có “giá như” mà FeSO4 → Fe(OH)2 → Fe2O3
⇒ việc tăng 84,386 so với 84,29 là sự chênh lệch O của 2FeO + O → Fe2O3.
⇒ số mol FeSO4 bằng FeO và bằng 2 × (84,386 – 84,29) ÷ 16 = 0,012 mol.
Thêm nữa khối lượng dung dịch X bằng 15,6 + 200 – 0,01 × 44 – 0,02 × 30 = 214,56 gam.
⇒ C%mFeSO4 trong X = 0,012 × 152 ÷ 214,56 × 100% ≈ 0,85%.
Câu 39 [311864]: Trong một ca sản xuất ở nhà máy, không khí được thổi vào lò chứa than nung đỏ, có 1500 kg than đã phản ứng, thu được hỗn hợp khí than khô X gồm CO, CO2, O2 và N2. Tỉ khối của X so với H2 bằng 14,16. Lấy 3,92 lít (đktc) hỗn hợp X sục vào nước vôi trong (dư), thu được 0,3 gam kết tủa. Giả thiết: than chứa 84,8% cacbon về khối lượng (còn lại là tạp chất trơ), thành phần không khí gồm 20% O2 và 80% N2 về thể tích. Nếu nhà máy bán hết lượng khí than khô X để làm nhiên liệu với giá 12000 đồng/m3 thì thu được bao nhiêu tiền?
A, 47 triệu đồng.
B, 94 triệu đồng.
C, 40 triệu đồng.
D, 80 triệu đồng.
HD: Phản ứng xảy ra và số liệu xử lí cơ bản:

⇝ Giải X: nX = 5a + 0,5b = 0,175 và mX = 144a + 12 × (b + 0,003) = 4,956
⇒ có kết quả: a = 0,03 mol và b = 0,05 mol. Lập tương quan tỉ lệ:
12 × (b + 0,003) ÷ 0,848 = 0,75 gam than sản xuất được 3,92 lít khí than khô X
Tương ứng: 0,75 kg than ⇝ 3,92 m3 khí X (1 kg = 1000 gam; 1m3 = 1000 lít).
Theo đó, 1500 kg than sản xuất được 7840 m3 khí X, với giá 12.000 đồng/m3
⇒ số tiền thu được khi bán hết lượng khí này là 7840 × 12.000 = 94.080.000 đồng. ❒

⇝ Giải X: nX = 5a + 0,5b = 0,175 và mX = 144a + 12 × (b + 0,003) = 4,956
⇒ có kết quả: a = 0,03 mol và b = 0,05 mol. Lập tương quan tỉ lệ:
12 × (b + 0,003) ÷ 0,848 = 0,75 gam than sản xuất được 3,92 lít khí than khô X
Tương ứng: 0,75 kg than ⇝ 3,92 m3 khí X (1 kg = 1000 gam; 1m3 = 1000 lít).
Theo đó, 1500 kg than sản xuất được 7840 m3 khí X, với giá 12.000 đồng/m3
⇒ số tiền thu được khi bán hết lượng khí này là 7840 × 12.000 = 94.080.000 đồng. ❒
Câu 40 [679820]: Hỗn hợp X gồm ba este mạch hở đều tạo bởi axit cacboxylic với ancol no, trong đó có hai este đơn chức và một este hai chức. Đốt cháy hoàn toàn 3,82 gam X trong O2, thu được H2O và 0,16 mol CO2. Mặt khác, cho 3,82 gam X phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp Y gồm hai ancol đồng đẳng kế tiếp và dung dịch chứa 3,38 gam hỗn hợp muối. Đun nóng toàn bộ Y với H2SO4 đặc, thu được tối đa 1,99 gam hỗn hợp ba ete. Phần trăm khối lượng của este có phân tử khối nhỏ nhất trong X là
A, 23,04%.
B, 38,74%.
C, 33,33%.
D, 58,12%.
HD: Gọi số mol hai ancol đơn chức là a ⇒ nNaOH = a mol.
☆ Để ý cái cơ bản của phản ứng ete hóa: 2R'OH → R'OR' + H2O. (công thức đọc nhẩm là cứ hai ancol mất một nước để tạo một ete) ⇒ mancol = (1,99 + 9a) gam.
☆ Thuỷ phân: 3,82 gam X + a mol NaOH → 3,38 gam muối + (1,99 + 9a) gam ancol.
⇒ BTKL: 3,82 + 40a = 3,38 + (1,99 + 9a) ⇒ a = 0,05 mol.
có 0,05 mol chức este COO ⇒ nO trong X = 0,05 × 2 = 0,1 mol.
☆ Giải đốt: 3,82 gam X + O2 ––to→ 0,16 mol CO2 + ? mol H2O.
Trong X, ta có mC + mH + mO = 3,82 ⇒ mH = 0,3 gam ⇒ nH = 0,3 mol.
• Mhai ancol = 2,44 ÷ 0,05 = 48,8 cho biết hai ancol là C2H5OH (0,04 mol) và C3H7OH (0,01 mol).
• Bảo toàn nguyên tố C ⇒ nC muối = nC/X – nC ancol = 0,16 – (0,04 × 2 + 0,01 × 3) = 0,05 mol.
► Điểm đặc biệt nC trong muối = nchức muối COONa = 0,05 mol; nghĩa là C chỉ nằm trong chức ⇒ chỉ có thể là HCOONa và (COONa)2.
⇒ Giải hỗn hợp muối gồm 0,03 mol HCOONa và 0,01 mol (COONa)2.
► Ghép este: nếu có 0,01 mol C2H5OOCCOOC3H7 thì chỉ còn một este là 0,03 mol HCOOC2H5 nữa mà thôi ⇝ trái giả thiết hỗn hợp 3 este.
⇒ este hai chức chỉ có thể là 0,01 mol (COOC2H5)2 ⇒ còn lại 0,01 mol HCOOC3H7 và 0,02 mol HCOOC2H5.
⇒ este có PTK nhỏ nhất là HCOOC2H5 chiếm 0,02 × 74 ÷ 3,82 × 100% ≈ 38,74%.
☆ Để ý cái cơ bản của phản ứng ete hóa: 2R'OH → R'OR' + H2O. (công thức đọc nhẩm là cứ hai ancol mất một nước để tạo một ete) ⇒ mancol = (1,99 + 9a) gam.
☆ Thuỷ phân: 3,82 gam X + a mol NaOH → 3,38 gam muối + (1,99 + 9a) gam ancol.
⇒ BTKL: 3,82 + 40a = 3,38 + (1,99 + 9a) ⇒ a = 0,05 mol.
có 0,05 mol chức este COO ⇒ nO trong X = 0,05 × 2 = 0,1 mol.
☆ Giải đốt: 3,82 gam X + O2 ––to→ 0,16 mol CO2 + ? mol H2O.
Trong X, ta có mC + mH + mO = 3,82 ⇒ mH = 0,3 gam ⇒ nH = 0,3 mol.
• Mhai ancol = 2,44 ÷ 0,05 = 48,8 cho biết hai ancol là C2H5OH (0,04 mol) và C3H7OH (0,01 mol).
• Bảo toàn nguyên tố C ⇒ nC muối = nC/X – nC ancol = 0,16 – (0,04 × 2 + 0,01 × 3) = 0,05 mol.
► Điểm đặc biệt nC trong muối = nchức muối COONa = 0,05 mol; nghĩa là C chỉ nằm trong chức ⇒ chỉ có thể là HCOONa và (COONa)2.
⇒ Giải hỗn hợp muối gồm 0,03 mol HCOONa và 0,01 mol (COONa)2.
► Ghép este: nếu có 0,01 mol C2H5OOCCOOC3H7 thì chỉ còn một este là 0,03 mol HCOOC2H5 nữa mà thôi ⇝ trái giả thiết hỗn hợp 3 este.
⇒ este hai chức chỉ có thể là 0,01 mol (COOC2H5)2 ⇒ còn lại 0,01 mol HCOOC3H7 và 0,02 mol HCOOC2H5.
⇒ este có PTK nhỏ nhất là HCOOC2H5 chiếm 0,02 × 74 ÷ 3,82 × 100% ≈ 38,74%.