Đáp án
1A
2B
3B
4D
5B
6C
7C
8C
9A
10C
11D
12B
13B
14D
15B
16C
17B
18B
19B
20A
21B
22C
23C
24C
25B
26B
27C
28B
29A
30A
31B
32D
33A
34C
35B
36C
37B
38D
39C
40B
Đáp án Đề minh họa số 40 thi Tốt Nghiệp Trung học Phổ Thông 2024 môn Hóa học
Câu 1 [59879]: Chất vừa tác dụng với dung dịch NaOH, vừa tác dụng với dung dịch HCl là
A, NaHCO3.
B, (NH4)2SO4.
C, AlCl3.
D, Na2CO3.
A. Thỏa mãn vì:

B. Loại vì không tác dụng được với HCl: (NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O.
C. Loại vì không tác dụng được với HCl: AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓.
(Nếu NaOH dư thì Al(OH)3 + NaOH → NaAlO2 + 2H2O).
D. Loại vì không tác dụng được với NaOH: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
||⇒ chọn A.

B. Loại vì không tác dụng được với HCl: (NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O.
C. Loại vì không tác dụng được với HCl: AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓.
(Nếu NaOH dư thì Al(OH)3 + NaOH → NaAlO2 + 2H2O).
D. Loại vì không tác dụng được với NaOH: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
||⇒ chọn A.
Câu 2 [14362]: Bệnh nhân phải tiếp đường (tiêm hoặc chuyền dung dịch đường vào tĩnh mạch), đó là loại đường nào?
A, Saccarozơ.
B, Glucozơ.
C, Đường hoá học.
D, Fructozơ.
HD: Suy luận theo kiến thức: tinh bột hay các đường đisaccarit như mantozơ hay saccarozơ khi vào cơ thể, để hấp thụ được cần thủy phân bởi enzim tạo các đường đơn là glucozơ rồi nhờ máu truyền đi khắp cơ thể. Với bệnh nhân, do cần trực tiếp nhận đường nên sẽ được tiêm, truyền thẳng vào tĩnh mạch để máu vận chuyển ⇝ đường truyền phải là loại cơ thể hấp thụ được chính là đường đơn glucozơ trên.
☆ Chuyên sâu, có thể tham khảo kiến thức về dung dịch đường tiêm tĩnh mạch
☆ Chuyên sâu, có thể tham khảo kiến thức về dung dịch đường tiêm tĩnh mạch
Câu 3 [679702]: Công thức hóa học của sắt(II) oxit là
A, Fe(OH)3.
B, FeO.
C, Fe2O3.
D, Fe(OH)2.
HD: Phân tích các đáp án:
| Công thức | A. Fe(OH)3. | B. FeO. | C. Fe2O3. | D. Fe(OH)2. |
| Tên gọi | sắt(III) hiđroxit | sắt(II) oxit (✔️) | sắt(III) oxit | sắt(II) hiđroxit |
Câu 4 [228268]: Dung dịch chất nào sau đây hòa tan được Cu?
A, HCl.
B, NaCl.
C, Ca(OH)2.
D, HNO3.
Đáp án: D
Câu 5 [57686]: Kim loại có khả năng dẫn điện tốt nhất và khối lượng riêng cao nhất lần lượt là
A, Ag và W.
B, Ag và Os.
C, Au và W.
D, Au và Os.
Thứ tự độ dẫn điện của kim loại giảm dần theo Ag, Cu, Au, Al, Fe
Kim loại có khối lượng riêng lớn nhất là Os (22,7 g/cm3)
Đáp án B.
Kim loại có khối lượng riêng lớn nhất là Os (22,7 g/cm3)
Đáp án B.
Câu 6 [60065]: Cho Ba vào dung dịch MgSO4 thu được kết tủa là
A, BaSO4.
B, Mg(OH)2
C, BaSO4 và Mg(OH)2
D, Mg và BaSO4
HD: Phương trình các phản ứng xảy ra:
Ba + 2H2O → Ba(OH)2 + H2.
MgSO4 + Ba(OH)2 → BaSO4↓ + Mg(OH)2↓.
Ba + 2H2O → Ba(OH)2 + H2.
MgSO4 + Ba(OH)2 → BaSO4↓ + Mg(OH)2↓.
Câu 7 [311892]: Nước muối sinh lí (có tác dụng diệt khuẩn, sát trùng trong y học) là dung dịch có nồng độ 0,9% của muối nào sau đây?
A, NaNO3.
B, Na2CO3.
C, NaCl.
D, Na2SO4.
HD: Nước muối sinh lí (có tác dụng diệt khuẩn, sát trùng trong y học) là dung dịch natri clorua (NaCl) 0,9%.


Câu 8 [983254]: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu xanh?
A, Alanin.
B, Glyxin.
C, Lysin.
D, Valin.
HD: Phân tích các đáp án:
| Dung dịch | A. Alanin. | B. Glyxin. | C. Lysin. | D. Valin. |
| Cấu tạo chất | H2NCH(CH3)COOH | H2NCH2COOH | (H2N)2C5H9COOH | H2NC4H8COOH |
| Quỳ tím | không đổi | không đổi | hoá xanh (✔️) | không đổi |
Câu 9 [679752]: Kim loại nào sau đây có tính khử yếu nhất?
A, Ag.
B, Na.
C, Al.
D, Fe.
HD: Sắp xếp các kim loại theo dãy điện hoá: Na > Al > Fe > Ag.
⇒ Tương ứng kim loại có tính khử yếu nhất là Ag.
⇒ Tương ứng kim loại có tính khử yếu nhất là Ag.
Câu 10 [973595]: Chất nào sau đây không phản ứng với H2 (xúc tác Ni, t°)?
A, Triolein.
B, Glucozơ.
C, Tripanmitin.
D, Vinyl axetat.
HD: tripanmitin (C15H31COO)3C3H5 là một chất béo no nên không có khả năng phản ứng với H2(Ni, to) ⇝ Chọn đáp án C. ♣
Còn lại, các chất ở các phương án khác đều có khả năng cộng H2:
✔️ A. Triolein: (C17H33COO)3C3H5 + 3H2 ––Ni, to→ (C17H35COO)3C3H5.
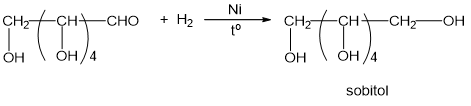
✔️ B. Glucozơ + H2 ––Ni, to→ sobitol.
✔️ D. Vinyl axetat: CH3COOCH=CH2 + H2 ––Ni, to→ CH3COOCH2CH3.
Còn lại, các chất ở các phương án khác đều có khả năng cộng H2:
✔️ A. Triolein: (C17H33COO)3C3H5 + 3H2 ––Ni, to→ (C17H35COO)3C3H5.
✔️ B. Glucozơ + H2 ––Ni, to→ sobitol.

✔️ D. Vinyl axetat: CH3COOCH=CH2 + H2 ––Ni, to→ CH3COOCH2CH3.
Câu 11 [334335]: Đốt cháy hoàn toàn hợp chất hữu cơ nào sau đây thì sản phẩm thu được khác với chất còn lại?
A, Chất béo.
B, Cao su thiên nhiên.
C, Tinh bột.
D, Protein.
HD: Phân tích các đáp án:
❌ A. Chất béo (RCOO)3C3H5 + O2 ––to→ CO2 + H2O.
❌ B. cao su thiên nhiên: –[–CH2–C(CH3)=CH–CH2–]n– + O2 ––to→ CO2 + H2O.
❌ C. Tinh bột: (C6H10O5)n + O2 ––to→ CO2 + H2O.
✔️ D. Protein: (C; H; O; N) + O2 ––to→ CO2 + H2O + N2.
❌ A. Chất béo (RCOO)3C3H5 + O2 ––to→ CO2 + H2O.
❌ B. cao su thiên nhiên: –[–CH2–C(CH3)=CH–CH2–]n– + O2 ––to→ CO2 + H2O.
❌ C. Tinh bột: (C6H10O5)n + O2 ––to→ CO2 + H2O.
✔️ D. Protein: (C; H; O; N) + O2 ––to→ CO2 + H2O + N2.
Câu 12 [60725]: Dung dịch nào sau đây tác dụng với lượng dư dung dịch CrCl3 thu được kết tủa?
A, HCl.
B, NaOH.
C, NaCl.
D, NH4Cl.
Giải: CrCl3 + 3NaOH → Cr(OH)3↓ + 3NaCl ⇒ chọn B.
Câu 13 [679720]: Cặp chất nào sau đây không cùng tồn tại trong dung dịch?
A, NaOH và Na2CO3.
B, CuSO4 và NaOH.
C, FeCl3 và NaNO3.
D, Cu(NO3)2 và H2SO4.
HD: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Có phản ứng xảy ra giữa CuSO4 và NaOH nên chúng không cùng tồn tại trong một dung dịch ⇝ Chọn đáp án B. ♦
Có phản ứng xảy ra giữa CuSO4 và NaOH nên chúng không cùng tồn tại trong một dung dịch ⇝ Chọn đáp án B. ♦
Câu 14 [679367]: Thủy phân este X trong dung dịch axit, thu được CH3COOH và CH3OH. Công thức cấu tạo của X là
A, HCOOC2H5.
B, CH3COOC2H5.
C, C2H5COOCH3.
D, CH3COOCH3.
HD: Phản ứng: X + H2O ⇄ CH3COOH + CH3OH.
⇝ Suy ngược lại công thức cấu tạo của X là CH3COOCH3 (metyl axetat).
⇝ Suy ngược lại công thức cấu tạo của X là CH3COOCH3 (metyl axetat).
Câu 15 [343531]: Axit benzoic được sử dụng như một chất bảo quản thực phẩm (kí hiệu là E-210) cho xúc xích, nước sốt cà chua, mù tạt, bơ thực vật …. Nó ức chế sự phát triển của nấm mốc, nấm men và một số vi khuẩn. Công thức của axit benzoic là
A, CH3COOH
B, C6H5COOH
C, HCOOH
D, HOOC-COOH
Giải: CH3COOH: Axit axetic.
+ C6H5COOH: Axit benzoic.
+ HCOOH: Axit fomic.
+ (COOH)2: Axit oxalic.
⇒ Chọn B
+ C6H5COOH: Axit benzoic.
+ HCOOH: Axit fomic.
+ (COOH)2: Axit oxalic.
⇒ Chọn B
Câu 16 [679555]: Cho 2 ml chất lỏng X vào ống nghiệm khô có sẵn vài viên đá bọt, sau đó thêm từng giọt dung dịch H2SO4 đặc, lắc đều. Đun nóng hỗn hợp, sinh ra hydrocarbon làm nhạt màu dung dịch KMnO4. Chất X là
A, methyl alcohol.
B, acetic acid.
C, ethyl alcohol.
D, acetaldehyde.
HD: Mô tả thí nghiệm điều chế ethylene (C2H4) từ ethyl alcohol:

☆ Phản ứng: C2H5OH ––H2SO4 đặc, to→ CH2=CH2 + H2O.

☆ Phản ứng: C2H5OH ––H2SO4 đặc, to→ CH2=CH2 + H2O.
Câu 17 [679260]: Cho 19,1 gam hỗn hợp CH3COOC2H5 và H2NCH2COOC2H5 tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, thu được dung dịch chứa m gam muối. Giá trị của m là
A, 16,6.
B, 17,9.
C, 19,4.
D, 9,2.
Chọn đáp án B.
Phản ứng:
★ Nhận xét: số mol C2H5OH bằng số mol NaOH là 0,2 mol nên bảo toàn khối lượng, ta có:
19,1 + 0,2 × 40 = m + 0,2 × 46 → m = 17,9 gam.
Phản ứng:

★ Nhận xét: số mol C2H5OH bằng số mol NaOH là 0,2 mol nên bảo toàn khối lượng, ta có:
19,1 + 0,2 × 40 = m + 0,2 × 46 → m = 17,9 gam.
Câu 18 [12102]: Lên men hoàn toàn 135 gam glucozơ thành ancol etylic thu được V lít khí CO2 (đktc). Giá trị của V là
A, 8,4.
B, 33,6.
C, 16,8.
D, 50,4.
HD: Phản ứng lên men rượu:
![567153[LG3].png](https://m.moon.vn/Images/Teachers/rongden_167/ProS2018/TAP%20II/567153[LG3].png)
Giả thiết: mglucozơ = 135 gam ⇒ nglucozơ = 0,75 mol
⇒ Theo tỉ lệ phản ứng: nCO2 = 0,75 × 2 = 1,5 mol ⇒ V = 33,6 lít. ❒
Giả thiết: mglucozơ = 135 gam ⇒ nglucozơ = 0,75 mol
⇒ Theo tỉ lệ phản ứng: nCO2 = 0,75 × 2 = 1,5 mol ⇒ V = 33,6 lít. ❒
Câu 19 [60596]: Thí nghiệm nào sau đây chỉ thu được muối sắt (III)?
A, Cho Fe3O4 vào dung dịch H2SO4 loãng.
B, Cho Fe2O3 dung dịch H2SO4 loãng.
C, Cho FeO vào dung dịch HCl.
D, Cho Fe đến dư vào dung dịch HNO3 loãng.
HD: Các phản ứng hóa xảy ra khi tiến hành các thí nghiệm là:
☒ A. Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O.
☑ B. Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
☒ C. FeO + 2HCl → FeCl2 + H2O.
☒ D. 3Fe (dư) + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4H2O.
|⇝ chỉ có thí nghiệm B thu được dung dịch chỉ chứa muối sắt(III). ❒
☒ A. Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O.
☑ B. Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
☒ C. FeO + 2HCl → FeCl2 + H2O.
☒ D. 3Fe (dư) + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4H2O.
|⇝ chỉ có thí nghiệm B thu được dung dịch chỉ chứa muối sắt(III). ❒
Câu 20 [311911]: Cho dung dịch Ba(OH)2 vào dung dịch NaHCO3, hiện tượng quan sát được là
A, có kết tủa trắng và không tan.
B, chỉ có bọt khí bay ra.
C, có kết tủa trắng và bọt khí.
D, có kết tủa trắng rồi tan dần.
HD: ☆ Phản ứng xảy ra: Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO2 + H2O.
⇝ Hiện tượng quan sát được là có kết tủa trắc (BaCO3) và không tan. ❒
⇝ Hiện tượng quan sát được là có kết tủa trắc (BaCO3) và không tan. ❒
Câu 21 [982240]: Hòa tan hết m gam Al trong dung dịch HCl dư, thu được 0,12 mol khí H2. Giá trị của m là
A, 3,24.
B, 2,16.
C, 4,86.
D, 1,62.
HD: Phản ứng: 2Al + 6HCl → 2AlCl3 + 3H2↑.
Giả thiết nH2 = 0,12 mol ⇒ nAl = 0,08 mol
⇒ m = 0,08 × 27 = 2,16 gam ⇝ Chọn đáp án B. ♦
Giả thiết nH2 = 0,12 mol ⇒ nAl = 0,08 mol
⇒ m = 0,08 × 27 = 2,16 gam ⇝ Chọn đáp án B. ♦
Câu 22 [14893]: Nhựa novolac là chất rắn, dễ nóng chảy, dễ tan trong một số dung môi hữu cơ, được dùng để sản xuất bột ép, sơn. Nhựa novolac được tổng hợp bằng phương pháp trùng ngưng từ các monome là
A, buta-1,3-đien và stiren.
B, etylen glicol và axit terephtalic.
C, phenol và fomanđehit.
D, hexametylenđiamin và axit ađipic.

Câu 23 [14356]: Rót H2SO4 đặc vào cốc đựng chất X màu trắng thấy X dần dần chuyển sang màu vàng, sau đó chuyển sang màu nâu và cuối cùng thành một khối đen xốp, bị bọt khí đẩy lên miệng cốc. Chất X là
A, NaCl.
B, CO2 rắn.
C, saccarozơ.
D, CuSO4 khan.
HD: Đường saccarozơ có màu trắng là hợp chất cacbohiđrat C12(H2O)11.
H2SO4 đặc có tính háo nước nên cho vào sẽ hút nước của hợp chất cacbohiđrat
⇝ Tách: C12H22O11 → 12C + 11H2O.
C màu nâu đen + trắng → lúc đầu sẽ thấy màu vàng, sau đó sẽ nhanh chuyển sang màu nâu
(Lưu ý: màu này là do màu trắng của saccarozơ chưa phản ứng kéo lại).
Cuối cùng, khi bị hút hết nước, ta thu được cacbon màu đen, trong đó:
một phần cacbon: C + 2H2SO4 → CO2↑ + 2SO2↑ + 2H2O.
Phản ứng oxi hóa khử này tạo khí sẽ đẩy cacbon trong cốc lên thành khối. ❒
Rõ hơn, quan sát video của thí nghiệm này:
H2SO4 đặc có tính háo nước nên cho vào sẽ hút nước của hợp chất cacbohiđrat
⇝ Tách: C12H22O11 → 12C + 11H2O.
C màu nâu đen + trắng → lúc đầu sẽ thấy màu vàng, sau đó sẽ nhanh chuyển sang màu nâu
(Lưu ý: màu này là do màu trắng của saccarozơ chưa phản ứng kéo lại).
Cuối cùng, khi bị hút hết nước, ta thu được cacbon màu đen, trong đó:
một phần cacbon: C + 2H2SO4 → CO2↑ + 2SO2↑ + 2H2O.
Phản ứng oxi hóa khử này tạo khí sẽ đẩy cacbon trong cốc lên thành khối. ❒
Rõ hơn, quan sát video của thí nghiệm này:
Câu 24 [311852]: Phát biểu nào sau đây là sai?
A, Axit glutamic làm quỳ tím ẩm chuyển màu đỏ.
B, Amino axit là hợp chất hữu cơ tạp chức.
C, Dung dịch glyxin làm đổi màu phenolphtalein.
D, Anilin tác dụng với nước brom tạo kết tủa trắng.
HD: Xem xét - phân tích các phát biểu:
☑ A. đúng vì phân tử axit glutamic có 1 nhóm NH2; 2 nhóm COOH.
☑ B. đúng vì chứa nhóm NH2 và nhóm COOH nên amino axit là hợp chất tạp chức.
☒ C. sai vì phân tử glyxin có 1 nhóm NH2 và 1 nhóm COOH.
☑ D. đúng.
☑ A. đúng vì phân tử axit glutamic có 1 nhóm NH2; 2 nhóm COOH.
☑ B. đúng vì chứa nhóm NH2 và nhóm COOH nên amino axit là hợp chất tạp chức.
☒ C. sai vì phân tử glyxin có 1 nhóm NH2 và 1 nhóm COOH.
☑ D. đúng.

Câu 25 [311411]: Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A, 3,84
B, 2,32
C, 1,68
D, 0,64
HD: ☆ Phản ứng kim loại đẩy muối: Fe + CuSO4 → FeSO4 + Cu.
Giả thiết: nFe = 0,04 mol; nCuSO4 = 0,01 mol ⇝ Fe còn dư sau phản ứng.
Tăng giảm khối lượng có m = mY = 2,24 + 0,01 × (64 – 56) = 2,32 gam. ❒
Giả thiết: nFe = 0,04 mol; nCuSO4 = 0,01 mol ⇝ Fe còn dư sau phản ứng.
Tăng giảm khối lượng có m = mY = 2,24 + 0,01 × (64 – 56) = 2,32 gam. ❒
Câu 26 [679767]: Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,75a mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch Ca(OH)2 dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,75 gam kết tủa. Giá trị của a là
A, 0,045.
B, 0,030.
C, 0,010.
D, 0,015.
HD: Tổng ôn hoá tập 1:

⇒ nC = 1,75a – a = 0,75a mol ⇒ ∑nCO; H2 = 0,75a × 2 = 1,5a mol.
⇒ nCO2 trong Y = 1,75a – 1,5a = 0,25a mol = 0,0075 mol (từ số mol kết tủa).
⇒ a = 0,03 ⇝ Chọn đáp án B. ♦

⇒ nC = 1,75a – a = 0,75a mol ⇒ ∑nCO; H2 = 0,75a × 2 = 1,5a mol.
⇒ nCO2 trong Y = 1,75a – 1,5a = 0,25a mol = 0,0075 mol (từ số mol kết tủa).
⇒ a = 0,03 ⇝ Chọn đáp án B. ♦
Câu 27 [65014]: Cho sơ đồ các phản ứng xảy ra ở nhiệt độ thường:

Hai chất X, T lần lượt là
Hai chất X, T lần lượt là
A, NaOH, Fe(OH)3.
B, Cl2, FeCl2.
C, NaOH, FeCl3.
D, Cl2, FeCl3.
Giải: – 2NaCl + 2H2O  2NaOH (X) + H2↑ + Cl2↑.
2NaOH (X) + H2↑ + Cl2↑.
– 2NaOH (X) + FeCl2 → Fe(OH)2 (Y) + 2NaCl.
– 4Fe(OH)2 (Y) + O2 + 2H2O → 4Fe(OH)3 (Z).
– Fe(OH)3 (Z) + 3HCl → FeCl3 (T) + 3H2O.
– 2FeCl3 (T) + Cu → 2FeCl2 + CuCl2.
||⇒ X là NaOH và T là FeCl3 ⇒ chọn C.
 2NaOH (X) + H2↑ + Cl2↑.
2NaOH (X) + H2↑ + Cl2↑.– 2NaOH (X) + FeCl2 → Fe(OH)2 (Y) + 2NaCl.
– 4Fe(OH)2 (Y) + O2 + 2H2O → 4Fe(OH)3 (Z).
– Fe(OH)3 (Z) + 3HCl → FeCl3 (T) + 3H2O.
– 2FeCl3 (T) + Cu → 2FeCl2 + CuCl2.
||⇒ X là NaOH và T là FeCl3 ⇒ chọn C.
Câu 28 [908882]: Đun nóng một lượng butan trong bình kín (với xúc tác thích hợp), thu được 0,47 mol hỗn hợp X gồm H2 và các hiđrocacbon mạch hở (CH4; C2H4; C2H6; C4H8; C4H10). Cho toàn bộ X vào bình chứa dung dịch Br2 dư thì có tối đa a mol Br2 phản ứng, khối lượng bình tăng 9,52 gam và thoát ra hỗn hợp khí Y. Đốt cháy hoàn toàn Y cần vừa đủ 0,28 mol O2, thu được CO2 và H2O. Giá trị của a là
A, 0,24.
B, 0,27.
C, 0,21.
D, 0,20.
HD: ► Phản ứng với Br2 và làm bình tăng là các anken.
Tinh tế quy 9,52 gam anken tương ứng với 0,68 mol cụm CH2.
☆ Giải đốt 0,68 mol CH2 cần 0,68 × 1,5 = 1,02 mol O2.
Lại có đốt Y cần 0,28 mol O2 và butan ––to→ (0,68 mol CH2) + Y
⇒ đốt C4H10 ban đầu cần 1,3 mol O2 ⇒ nC4H10 ban đầu = 1,3 ÷ (4 + 10 ÷ 4) = 0,2 mol.
Ta có ∑nH2 + ankan trong X = nC4H10 ban đầu = 0,2 mol
⇒ ∑nanken còn lại trong X = 0,47 – 0,2 = 0,27 mol ⇒ a = 0,27 ⇝ Chọn đáp án B. ♦
Tinh tế quy 9,52 gam anken tương ứng với 0,68 mol cụm CH2.
☆ Giải đốt 0,68 mol CH2 cần 0,68 × 1,5 = 1,02 mol O2.
Lại có đốt Y cần 0,28 mol O2 và butan ––to→ (0,68 mol CH2) + Y
⇒ đốt C4H10 ban đầu cần 1,3 mol O2 ⇒ nC4H10 ban đầu = 1,3 ÷ (4 + 10 ÷ 4) = 0,2 mol.
Ta có ∑nH2 + ankan trong X = nC4H10 ban đầu = 0,2 mol
⇒ ∑nanken còn lại trong X = 0,47 – 0,2 = 0,27 mol ⇒ a = 0,27 ⇝ Chọn đáp án B. ♦
Câu 29 [273499]: Phân tích các mẫu đá Mặt Trăng cho biết thành phần hóa học của bề mặt Mặt Trăng như sau:
Biết rằng các nguyên tố đều ở dạng oxit, và Ti chỉ ở dạng TiO2. Kết luận nào sau đây là phù hợp nhất?
| Nguyên tố |  |  |  |  |  |  |  |  | Khác |
| Hàm lượng % | 43,21% | 21,19% | 10,97% | 8,43% | 7,89% | 5,52% | 2,34% | 0,45% | < 0,1% |
Biết rằng các nguyên tố đều ở dạng oxit, và Ti chỉ ở dạng TiO2. Kết luận nào sau đây là phù hợp nhất?
A, Nguyên tố sắt trên bề mặt Mặt Trăng chủ yếu ở dạng FeO.
B, Nguyên tố sắt trên bề mặt Mặt Trăng chủ yếu ở dạng Fe2O3.
C, Nguyên tố sắt trên bề mặt Mặt Trăng chủ yếu ở dạng Fe3O4.
D, Không đủ thông tin để kết luận về trạng thái tồn tại của nguyên tố sắt trên bề mặt Mặt Trăng.
Đáp án: A
Câu 30 [982778]: Cho các phát biểu sau:
(a) Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc.
(b) Thành phần chính của giấy viết là xenlulozơ.
(c) Dầu nhớt bôi trơn động cơ xe gắn máy có thành phần chính là chất béo.
(d) PVC được dùng làm vật liệu cách điện, ống dẫn nước.
(e) Cao su buna có tính đàn hồi và độ bền lớn hơn cao su thiên nhiên.
Số phát biểu đúng là
(a) Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc.
(b) Thành phần chính của giấy viết là xenlulozơ.
(c) Dầu nhớt bôi trơn động cơ xe gắn máy có thành phần chính là chất béo.
(d) PVC được dùng làm vật liệu cách điện, ống dẫn nước.
(e) Cao su buna có tính đàn hồi và độ bền lớn hơn cao su thiên nhiên.
Số phát biểu đúng là
A, 3.
B, 5.
C, 2.
D, 4.
HD: Phân tích các phát biểu:
✔️ (a) đúng theo ứng dụng của saccarozơ.
✔️ (b) đúng theo ứng dụng của xenlulozơ.
❌ (c) sai vì dầu nhớt là một phân khúc trong chưng cất dầu mỏ; thành phần chính là hiđrocacbon ≠ chất béo.
✔️ (d) đúng theo ứng dụng của PVC (chất dẻo).
❌ (e) sai ⇝ cao su buna kém bền, nên cần lưu hoá, hay đồng trùng hợp,...
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
✔️ (a) đúng theo ứng dụng của saccarozơ.
✔️ (b) đúng theo ứng dụng của xenlulozơ.
❌ (c) sai vì dầu nhớt là một phân khúc trong chưng cất dầu mỏ; thành phần chính là hiđrocacbon ≠ chất béo.
✔️ (d) đúng theo ứng dụng của PVC (chất dẻo).
❌ (e) sai ⇝ cao su buna kém bền, nên cần lưu hoá, hay đồng trùng hợp,...
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án A. ♥
Câu 31 [508326]: Lấy 34,46 gam hỗn hợp X gồm các triglixerit X, cho tác dụng hoàn toàn với 0,1 mol H2 thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được CO2 và 2,09 mol H2O. Mặt khác, Y tác dụng được tối đa với 0,05 mol Br2 trong dung dịch. Nếu cho Y tác dụng vừa đủ với KOH thì thu được glyxerol và m gam muối. Giá trị của m là
A, 37,50.
B, 37,70.
C, 35,78.
D, 35,58.
HD: 34,46 gam X + 0,1 mol H2 ––Ni, to→ Y ||⇒ mY = 34,66 gam.
☆ Giải đốt 34,66 gam Y (a mol) + O2 ––to→ b mol CO2 + 2,09 mol H2O.
Tương quan đốt: ∑nCO2 – ∑nH2O = 2nY + nBr2 phản ứng
⇒ b = ∑nCO2 = (2,09 + 2a + 0,05) mol.
Lại có mY = mC + mH + mO = 12b + 2,09 × 2 + 16 × 6a = 34,66 gam.
⇒ Giải hệ được: a = 0,04 và b = 2,22.
☆ Giải thuỷ phân Y + 0,12 mol KOH → m gam muối + 0,04 mol C3H5(OH)3.
⇒ BTKL có ngay: 34,66 + 0,12 × 56 = m + 0,04 × 92 ⇒ m = 37,70 gam.
☆ Giải đốt 34,66 gam Y (a mol) + O2 ––to→ b mol CO2 + 2,09 mol H2O.
Tương quan đốt: ∑nCO2 – ∑nH2O = 2nY + nBr2 phản ứng
⇒ b = ∑nCO2 = (2,09 + 2a + 0,05) mol.
Lại có mY = mC + mH + mO = 12b + 2,09 × 2 + 16 × 6a = 34,66 gam.
⇒ Giải hệ được: a = 0,04 và b = 2,22.
☆ Giải thuỷ phân Y + 0,12 mol KOH → m gam muối + 0,04 mol C3H5(OH)3.
⇒ BTKL có ngay: 34,66 + 0,12 × 56 = m + 0,04 × 92 ⇒ m = 37,70 gam.
Câu 32 [679394]: Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl với điện cực trơ, thu được khí H2 ở catot.
(b) Dùng khí CO (dư) khử CuO nung nóng, thu được kim loại Cu.
(c) Để hợp kim Fe-Ni ngoài không khí ẩm thì kim loại Ni bị ăn mòn điện hóa học.
(d) Dùng dung dịch Fe2(SO4)3 dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu.
(e) Cho Fe dư vào dung dịch AgNO3, sau phản ứng thu được dung dịch chứa hai muối.
Số phát biểu đúng là
(a) Điện phân dung dịch NaCl với điện cực trơ, thu được khí H2 ở catot.
(b) Dùng khí CO (dư) khử CuO nung nóng, thu được kim loại Cu.
(c) Để hợp kim Fe-Ni ngoài không khí ẩm thì kim loại Ni bị ăn mòn điện hóa học.
(d) Dùng dung dịch Fe2(SO4)3 dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu.
(e) Cho Fe dư vào dung dịch AgNO3, sau phản ứng thu được dung dịch chứa hai muối.
Số phát biểu đúng là
A, 4.
B, 2.
C, 5.
D, 3.
HD: Phân tích các phát biểu:
✔️ (a) đúng. Điện phân dung dịch: 2NaCl + 2H2O → 2NaOH + Cl2 (anot)↑ + H2 (catot)↑.
✔️ (b) đúng. Phản ứng CO + CuO ––to→ Cu + CO2.
❌ (c) 2 kim loại Fe-Ni, tiếp xúc nhau và H2O dẫn điện → thỏa mãn xảy ra ăn mòn điện hóa, trong đó Fe > Ni trong dãy điện hóa nên Fe bị ăn mòn chứ không phải Ni.
✔️ (d) đúng vì Fe(SO4)3 + Cu → CuSO4 + 2FeSO4; Ag không phản ứng nên tách ra.
❌ (e) sai vì Fe dư nên cuối cùng chỉ thu được một muối: Fe + 2AgNO3 → 2Fe(NO3)2 + 2Ag↓.
⇝ có tất cả 3/5 phát biểu đúng ⇝ Chọn đáp án D. ♠
✔️ (a) đúng. Điện phân dung dịch: 2NaCl + 2H2O → 2NaOH + Cl2 (anot)↑ + H2 (catot)↑.
✔️ (b) đúng. Phản ứng CO + CuO ––to→ Cu + CO2.
❌ (c) 2 kim loại Fe-Ni, tiếp xúc nhau và H2O dẫn điện → thỏa mãn xảy ra ăn mòn điện hóa, trong đó Fe > Ni trong dãy điện hóa nên Fe bị ăn mòn chứ không phải Ni.
✔️ (d) đúng vì Fe(SO4)3 + Cu → CuSO4 + 2FeSO4; Ag không phản ứng nên tách ra.
❌ (e) sai vì Fe dư nên cuối cùng chỉ thu được một muối: Fe + 2AgNO3 → 2Fe(NO3)2 + 2Ag↓.
⇝ có tất cả 3/5 phát biểu đúng ⇝ Chọn đáp án D. ♠
Câu 33 [311859]: Từ hợp chất hữu cơ X (mạch hở, thành phần chứa C, H, O) thực hiện sơ đồ phản ứng sau với hệ số phương trình biểu thị đúng tỉ lệ mol:

Phân tử khối của X là

Phân tử khối của X là
A, 190.
B, 174.
C, 172.
D, 208.
HD: Phân tích từ sơ đồ các phản ứng:
Từ (b) ⇒ Y là muối, T là axit, kết hợp (c) ⇒ T là axit ađipic: C4H8(COOH).
Biết Y ⇒ từ (a) và (d) ⇒ Z là ancol etylen glicol, theo đó, phản ứng (a):
X + 2NaOH → C4H8(COONa)2 + C2H4(OH)2 + H2O.
⇝ cấu tạo của X là HOOC–[CH2]4–COOCH2CH2OH (MX = 190). ❒
Từ (b) ⇒ Y là muối, T là axit, kết hợp (c) ⇒ T là axit ađipic: C4H8(COOH).
Biết Y ⇒ từ (a) và (d) ⇒ Z là ancol etylen glicol, theo đó, phản ứng (a):
X + 2NaOH → C4H8(COONa)2 + C2H4(OH)2 + H2O.
⇝ cấu tạo của X là HOOC–[CH2]4–COOCH2CH2OH (MX = 190). ❒
Câu 34 [507949]: Tiến hành thí nghiệm sau theo các bước sau:
Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 5ml nước cất, lắc đều, sau đó để yên.
Bước 2: Nhỏ tiếp dung dịch HCl đặc vào ống nghiệm.
Bước 3: Cho tiếp dung dịch NaOH loãng (dùng dư), đun nóng.
Cho các nhận định sau:
(a) Kết thúc bước 1, nhúng quỳ tím vào dung dịch thấy quỳ tím không đổi màu.
(b) Ở bước 2 thi anilin tan dần.
(c) Kết thúc bước 3, thu được dung dịch trong suốt.
(d) Ở bước 1, anilin hầu như không tan, nó tạo vẩn đục và lắng xuống đáy.
(e) Ở thí nghiệm trên, nếu thay anilin và metylamin thì thu được kết quả tương tự.
Số nhận định đúng là
Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 5ml nước cất, lắc đều, sau đó để yên.
Bước 2: Nhỏ tiếp dung dịch HCl đặc vào ống nghiệm.
Bước 3: Cho tiếp dung dịch NaOH loãng (dùng dư), đun nóng.
Cho các nhận định sau:
(a) Kết thúc bước 1, nhúng quỳ tím vào dung dịch thấy quỳ tím không đổi màu.
(b) Ở bước 2 thi anilin tan dần.
(c) Kết thúc bước 3, thu được dung dịch trong suốt.
(d) Ở bước 1, anilin hầu như không tan, nó tạo vẩn đục và lắng xuống đáy.
(e) Ở thí nghiệm trên, nếu thay anilin và metylamin thì thu được kết quả tương tự.
Số nhận định đúng là
A, 5.
B, 4.
C, 3
D, 2.
HD: Phân tích thí nghiệm:
• Bước 1: theo tính chất vật lý của anilin, ít tan trong nước nên sẽ xuất hiện vẩn đục.
• Bước 2: xảy ra phản ứng: C6H5NH2 + HCl → C6H5NH3Cl.
⇝ muối phenylamoni clorua tan nên dung dịch trở nên trong suốt.
• Bước 3: xảy ra phản ứng: C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O.
⇝ thu được anilin làm dung dịch quay lại vẩn đục như sau bước 1.
☆ Phân tích các phát biểu:
✔️ (a) đúng, dung dịch anilin có tính bazơ rất yếu, không đủ làm quỳ tím đổi màu.
✔️ (b) đúng theo phân tích bước 2 trên.
❌ (c) sai theo phân tích ở bước 3 trên.
✔️ (d) đúng theo phân tích ở bước 1 trên.
❌ (e) sai vì metylamin: CH3NH2 là chất khí ở điều kiện thường và tan tốt trong nước, mặc dù có các phản ứng tương tự trên nhưng hiện tượng quan sát được không giống nữa.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
• Bước 1: theo tính chất vật lý của anilin, ít tan trong nước nên sẽ xuất hiện vẩn đục.
• Bước 2: xảy ra phản ứng: C6H5NH2 + HCl → C6H5NH3Cl.
⇝ muối phenylamoni clorua tan nên dung dịch trở nên trong suốt.
• Bước 3: xảy ra phản ứng: C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O.
⇝ thu được anilin làm dung dịch quay lại vẩn đục như sau bước 1.
☆ Phân tích các phát biểu:
✔️ (a) đúng, dung dịch anilin có tính bazơ rất yếu, không đủ làm quỳ tím đổi màu.
✔️ (b) đúng theo phân tích bước 2 trên.
❌ (c) sai theo phân tích ở bước 3 trên.
✔️ (d) đúng theo phân tích ở bước 1 trên.
❌ (e) sai vì metylamin: CH3NH2 là chất khí ở điều kiện thường và tan tốt trong nước, mặc dù có các phản ứng tương tự trên nhưng hiện tượng quan sát được không giống nữa.
⇝ có 3/5 phát biểu đúng ⇝ Chọn đáp án C. ♣
Câu 35 [904631]: Điện phân dung dịch X gồm CuSO4 x mol/lít và NaCl 0,14M với điện cực trơ, có màng ngăn, cường dòng điện không đổi, sau thời gian t giây thu được V lít một khí duy nhất. Nếu thời gian điện phân là 2,5t giây thì thu được hai khí có tổng thể tích 3,5V lít. Còn nếu tiến hành điện phân trong 4,5t giây thì thu được các khí có tổng thể tích là 7V lít. Biết hiệu suất của quá trình điện phân là 100%. Giá trị của x là
A, 0,10.
B, 0,03.
C, 0,02.
D, 0,20.
HD: Chọn I = 2 × 96500. Chọn V lít ~ 1 mol khí. Gọi các điểm A(t; 1); B(2,5t; 3,5); C(4,5t; 7).
Phân tích giả thiết ta có A thuộc OM (thu một khí duy nhất); B thuộc MN (thu được hai khí).

► A ∈ OM, tỉ lệ OH = HM nên luôn có t = 1.
Tương quan đồ thị: nếu rơi vào đồ thị TH1 thì rõ 2,5t sẽ thu được số mol khí nhỏ hơn 2,5 ⇒ Đồ thị của hệ phải là TH2:

Thứ tự dung dịch ra: a mol CuCl2; b mol HCl; c mol H2O.
⇒ Tọa độ: M(a; a); N(a + b; a + 0,5b).
Ta có NF = 2BF ⇒ a + b – 3,5 = 2 × (a + 0,5b – 2,5) ⇒ a = 1,5.
Lại có CE = 1,5NE ⇒ 7 – (a + b) = 1,5 × (4,5 – a – 0,5b) ⇒ b = 4.
Vậy ban đầu có 1,5 mol CuSO4 và 7 mol NaCl ⇒ x : 0,14 = 1,5 : 7 ⇒ x = 0,03.
Phân tích giả thiết ta có A thuộc OM (thu một khí duy nhất); B thuộc MN (thu được hai khí).

► A ∈ OM, tỉ lệ OH = HM nên luôn có t = 1.
Tương quan đồ thị: nếu rơi vào đồ thị TH1 thì rõ 2,5t sẽ thu được số mol khí nhỏ hơn 2,5 ⇒ Đồ thị của hệ phải là TH2:

Thứ tự dung dịch ra: a mol CuCl2; b mol HCl; c mol H2O.
⇒ Tọa độ: M(a; a); N(a + b; a + 0,5b).
Ta có NF = 2BF ⇒ a + b – 3,5 = 2 × (a + 0,5b – 2,5) ⇒ a = 1,5.
Lại có CE = 1,5NE ⇒ 7 – (a + b) = 1,5 × (4,5 – a – 0,5b) ⇒ b = 4.
Vậy ban đầu có 1,5 mol CuSO4 và 7 mol NaCl ⇒ x : 0,14 = 1,5 : 7 ⇒ x = 0,03.
Câu 36 [35439]: Hòa tan hoàn toàn m gam hỗn hợp gồm Na, Na2O, Ba, BaO vào nước, thu được 0,15 mol khí H2 và dung dịch X. Sục 0,32 mol khí CO2 vào dung dịch X, thu được dung dịch Y chỉ chứa các muối và kết tủa Z. Chia dung dịch Y làm hai phần bằng nhau:
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,6M, thu được 0,075 mol khí CO2.
+ Cho từ từ 200 ml dung dịch HCl 0,6M vào phần 2, thu được 0,06 mol khí CO2.
Giá trị của m là
+ Cho từ từ phần 1 vào 200 ml dung dịch HCl 0,6M, thu được 0,075 mol khí CO2.
+ Cho từ từ 200 ml dung dịch HCl 0,6M vào phần 2, thu được 0,06 mol khí CO2.
Giá trị của m là
A, 30,68.
B, 20,92.
C, 25,88.
D, 28,28.
HD: Cùng một lượng axit HCl nhưng cách tiến hành thí nghiệm với dung dịch X cho lượng khí CO2↑ khác nhau ⇝ chứng tỏ dung dịch X gồm x mol Na2CO3 và y mol NaHCO3 (toàn bộ Ba tạo tủa BaCO3).
• Phần 1: xảy ra đồng thời các phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
Và NaHCO3 + HCl → NaCl + CO2↑ + H2O.
⇒ giả sử có kx mol Na2CO3 và ky mol NaHCO3 phản ứng.
⇒ ta có kx + ky = ∑nCO2 = 0,075 mol và 2kx + ky = nHCl = 0,12 mol
⇒ giải hệ tìm kx, ky rồi suy ra x ÷ y = 3 ÷ 2.
• Phần 2: xảy ra lần lượt: Na2CO3 + HCl → NaCl + NaHCO3
sau đó mới tiếp NaHCO3 + HCl → NaCl + CO2↑ + H2O.
⇒ số lượng Na2CO3 là x = (0,12 – 0,06) = 0,06 mol ⇒ y = 0,04 mol.
Phản ứng: X + 0,32 mol CO2 → 0,12 mol Na2CO3 + 0,08 mol NaHCO3 + ? mol BaCO3↓ (nhân đôi số)
⇒ theo bảo toàn nguyên tố cacbon có 0,12 mol BaCO3.
☆ Sử dụng tương quan 2H với 1O → từ 0,15 mol H2 ta thêm tương ứng 0,15 mol O vào m gam hỗn hợp đầu
⇒ quy đổi về (m + 2,4) gam hỗn hợp chỉ chứa các oxit Na2O và BaO;
số mol theo bảo toàn tính được lần lượt là 0,16 mol và 0,12 mol
⇒ m = 0,16 × 62 + 0,12 × 153 – 2,4 = 25,88 gam.
• Phần 1: xảy ra đồng thời các phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
Và NaHCO3 + HCl → NaCl + CO2↑ + H2O.
⇒ giả sử có kx mol Na2CO3 và ky mol NaHCO3 phản ứng.
⇒ ta có kx + ky = ∑nCO2 = 0,075 mol và 2kx + ky = nHCl = 0,12 mol
⇒ giải hệ tìm kx, ky rồi suy ra x ÷ y = 3 ÷ 2.
• Phần 2: xảy ra lần lượt: Na2CO3 + HCl → NaCl + NaHCO3
sau đó mới tiếp NaHCO3 + HCl → NaCl + CO2↑ + H2O.
⇒ số lượng Na2CO3 là x = (0,12 – 0,06) = 0,06 mol ⇒ y = 0,04 mol.
Phản ứng: X + 0,32 mol CO2 → 0,12 mol Na2CO3 + 0,08 mol NaHCO3 + ? mol BaCO3↓ (nhân đôi số)
⇒ theo bảo toàn nguyên tố cacbon có 0,12 mol BaCO3.
☆ Sử dụng tương quan 2H với 1O → từ 0,15 mol H2 ta thêm tương ứng 0,15 mol O vào m gam hỗn hợp đầu
⇒ quy đổi về (m + 2,4) gam hỗn hợp chỉ chứa các oxit Na2O và BaO;
số mol theo bảo toàn tính được lần lượt là 0,16 mol và 0,12 mol
⇒ m = 0,16 × 62 + 0,12 × 153 – 2,4 = 25,88 gam.
Câu 37 [904978]: Đốt cháy hoàn toàn 0,25 mol X (gồm metyl axetat, etyl benzoat và hai hiđrocacbon mạch hở) tạo ra a mol CO2 và 0,81 mol H2O. Mặt khác, cho 0,25 mol X tác dụng vừa đủ với 150 ml dung dịch NaOH 1M thu được 5,5 gam ancol Y. Nếu cho 0,25 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là 0,08 mol. Giá trị của a là
A, 0,16.
B, 0,99.
C, 0,97.
D, 0,28.
HD: Sơ đồ phản ứng X với NaOH:

Gọi số mol hai ancol CH3OH; C2H5OH lần lượt là a, b mol thì:
• tổng số mol ancol = số mol NaOH phản ứng ⇒ a + b = 0,15 mol.
• khối lượng ancol là 32a + 46b = 5,5 gam.
⇒ Giải hệ được a = 0,1 và b = 0,05. ∑ncác hiđrocacbon còn lại = 0,1 mol.
► nBr2 phản ứng = 0,08 mol ⇒ ∑nπC=C/hđc = 0,08 mol.
☆ Giải đốt 0,25 mol X + O2 ––to→ a mol CO2 + 0,81 mol H2O.
► Tương quan đốt: ∑nCO2 – ∑nH2O = 4netyl benzoat + 0.nmetyl axetat + (nπC=C/hđc – nhđc)
Thay số: a – 0,81 = 4 × 0,05 + 0 + (0,08 – 0,1) ⇒ a = 0,99 mol ⇝ Chọn đáp án B. ♦

Gọi số mol hai ancol CH3OH; C2H5OH lần lượt là a, b mol thì:
• tổng số mol ancol = số mol NaOH phản ứng ⇒ a + b = 0,15 mol.
• khối lượng ancol là 32a + 46b = 5,5 gam.
⇒ Giải hệ được a = 0,1 và b = 0,05. ∑ncác hiđrocacbon còn lại = 0,1 mol.
► nBr2 phản ứng = 0,08 mol ⇒ ∑nπC=C/hđc = 0,08 mol.
☆ Giải đốt 0,25 mol X + O2 ––to→ a mol CO2 + 0,81 mol H2O.
► Tương quan đốt: ∑nCO2 – ∑nH2O = 4netyl benzoat + 0.nmetyl axetat + (nπC=C/hđc – nhđc)
Thay số: a – 0,81 = 4 × 0,05 + 0 + (0,08 – 0,1) ⇒ a = 0,99 mol ⇝ Chọn đáp án B. ♦
Câu 38 [679569]: Hòa tan hết 23,18 gam hỗn hợp X gồm Fe, Mg và Fe(NO3)3 vào dung dịch chứa 0,92 mol HCl và 0,01 mol NaNO3, thu được dung dịch Y (chất tan chỉ có 46,95 gam hỗn hợp muối) và 2,92 gam hỗn hợp Z gồm ba khí không màu (trong đó hai khí có số mol bằng nhau). Dung dịch Y phản ứng được tối đa với 0,91 mol KOH, thu được 29,18 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích của khí có phân tử khối lớn nhất trong Z là
A, 75,34%.
B, 51,37%.
C, 58,82%.
D, 45,45%.
HD: Xét bài toán nhỏ Y + 0,91 mol KOH. Vừa đẹp 0,91 mol KCl và 0,01 mol NaCl
⇒ Y chỉ chứa các muối clorua ⇒ sản phẩm X có thể chứa H2.
Rõ hơn:

Thấy ngay theo bảo toàn khối lượng: mNH4OH = 0,35 gam ⇒ nNH4OH = 0,01 mol.
☆ Sơ đồ chính

Bảo toàn khối lượng cả sơ đồ có: mH2O = 7,74 gam ⇒ nH2O = 0,43 mol.
► “ban – bật” thuần bảo toàn nguyên tố: bảo toàn H có 0,01 mol H2.
Bảo toàn O hoặc ghép cụm NO3 hoặc bên vế phải tổng số mol O gấp 3 lần tổng số mol N
Ta có: 0,43 + nO trong Z = 3(nN trong Z + 0,01); lại thêm mO trong Z + mN trong Z = 2,92 – 0,01 × 2.
Giải ra số mol O trong Z là 0,05 mol và số mol N trong Z là 0,15 mol.
Z gồm 0,01 mol H2 và hai trong ba khí NO; N2O và N2 (trong Z có hai khí cùng số mol).
⇒ Z gồm 0,01 mol H2 và 0,05 mol N?O + 0,05 mol N2 ⇒ ? = 1.
Khí có phân tử khối lớn nhất là NO; %VNO trong Z = 0,05 ÷ 0,11 × 100% = 45,45%.
⇒ Y chỉ chứa các muối clorua ⇒ sản phẩm X có thể chứa H2.
Rõ hơn:

Thấy ngay theo bảo toàn khối lượng: mNH4OH = 0,35 gam ⇒ nNH4OH = 0,01 mol.
☆ Sơ đồ chính

Bảo toàn khối lượng cả sơ đồ có: mH2O = 7,74 gam ⇒ nH2O = 0,43 mol.
► “ban – bật” thuần bảo toàn nguyên tố: bảo toàn H có 0,01 mol H2.
Bảo toàn O hoặc ghép cụm NO3 hoặc bên vế phải tổng số mol O gấp 3 lần tổng số mol N
Ta có: 0,43 + nO trong Z = 3(nN trong Z + 0,01); lại thêm mO trong Z + mN trong Z = 2,92 – 0,01 × 2.
Giải ra số mol O trong Z là 0,05 mol và số mol N trong Z là 0,15 mol.
Z gồm 0,01 mol H2 và hai trong ba khí NO; N2O và N2 (trong Z có hai khí cùng số mol).
⇒ Z gồm 0,01 mol H2 và 0,05 mol N?O + 0,05 mol N2 ⇒ ? = 1.
Khí có phân tử khối lớn nhất là NO; %VNO trong Z = 0,05 ÷ 0,11 × 100% = 45,45%.
Câu 39 [136658]: Hòa tan 5,33 gam hỗn hợp 2 muối RCln và BaCl2 vào nước được 200 gam dung dịch X. Chia X thành hai phần bằng nhau:
Phần 1: Cho tác dụng với 100 gam dung dịch AgNO3 8,5% thu được 5,74 gam kết tủa X1 và dung dịch X2.
Phần 2: Cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,165 gam kết tủa X3.
Nồng độ phần trăm của R(NO3)n trong dung dịch X2 gần nhất với giá trị nào sau đây?
Phần 1: Cho tác dụng với 100 gam dung dịch AgNO3 8,5% thu được 5,74 gam kết tủa X1 và dung dịch X2.
Phần 2: Cho tác dụng với dung dịch H2SO4 loãng, dư thu được 1,165 gam kết tủa X3.
Nồng độ phần trăm của R(NO3)n trong dung dịch X2 gần nhất với giá trị nào sau đây?
A, 0,72%.
B, 1,36%.
C, 1,24%.
D, 1,42%.
Giải: ► Xét phần 2: ↓ chỉ có BaSO4 ⇒ nBaCl2 = nBaSO4 = 0,005 mol.
► Xét phần 1: nAgCl = 0,04 mol. Bảo toàn nguyên tố Clo: nRCln = 0,03/n mol.
⇒ mX 1 phần = 2,665(g) = 0,03/n × (R + 35,5n) + 0,005 × 208.
⇒ R = 56n/3 ⇒ n = 3 và R = 56 ⇒ RCln là FeCl3.
► Bảo toàn khối lượng: mX2 = 100 + 100 – 5,74 = 194,26(g).
C%Fe(NO3)3 = 0,01 × 242 ÷ 194,26 × 100% = 1,24% ⇒ chọn C.
► Xét phần 1: nAgCl = 0,04 mol. Bảo toàn nguyên tố Clo: nRCln = 0,03/n mol.
⇒ mX 1 phần = 2,665(g) = 0,03/n × (R + 35,5n) + 0,005 × 208.
⇒ R = 56n/3 ⇒ n = 3 và R = 56 ⇒ RCln là FeCl3.
► Bảo toàn khối lượng: mX2 = 100 + 100 – 5,74 = 194,26(g).
C%Fe(NO3)3 = 0,01 × 242 ÷ 194,26 × 100% = 1,24% ⇒ chọn C.
Câu 40 [679570]: Hỗn hợp X gồm ba este mạch hở đều tạo bởi axit cacboxylic với ancol, trong đó hai este có cùng số nguyên tử cacbon trong phân tử. Xà phòng hóa hoàn toàn 7,76 gam X bằng dung dịch NaOH vừa đủ, thu được hỗn hợp Y gồm hai ancol đơn chức, kế tiếp trong dãy đồng đẳng và hỗn hợp Z gồm hai muối. Cho toàn bộ Y vào bình đựng kim loại Na dư, sau phản ứng có khí H2 thoát ra và khối lượng bình tăng 4 gam. Đốt cháy hoàn toàn Z cần vừa đủ 0,09 mol O2, thu được Na2CO3 và 4,96 gam hỗn hợp CO2 và H2O. Phần trăm khối lượng của este có phân tử khối nhỏ nhất trong X là
A, 15,46%.
B, 61,86%.
C, 19,07%.
D, 77,32%.
HD: Phản ứng thuỷ phân chức este: –COO– + NaOH → –COONa + –OH.
Sau đó: –OH + Na → –ONa + ½H2↑. Gọi a = nOH = n–COO– = nNaOH = n–COONa.
Ta có mbình natri tăng = mancol – mH2↑ = 4 ⇒ mancol = (4 + a) gam.
BTKL phản ứng thuỷ phân este: 7,76 + 40a = mmuối + mancol ⇒ mmuối = (3,76 + 39a) gam.
☆ Giải đốt (3,76 + 39a) gam Z + 0,09 mol O2 –––to–→ a/2 mol Na2CO3 + 4,96 gam (CO2 + H2O).
⇒ BTKL có ngay: (3,76 + 39a) + 0,09 × 32 = 53a + 4,96 ⇒ a = 0,12 mol.
♦ Giải 4,12 gam hai ancol với số mol 0,12 ⇒ Mtrung bình = 34,33
⇒ cho biết có 0,1 mol CH3OH và 0,02 mol C2H5OH.
♦ Đốt 8,44 gam Z + 0,09 mol O2 –––to–→ 0,06 mol Na2CO3 + 4,96 gam (CO2 + H2O).
Z chứa 0,12 mol chức COONa ⇒ nO trong Z = 0,24 mol
⇒ bảo toàn O có 2nCO2 + nH2O = 0,24 mol.
Lại có mCO2 + mH2O = 4,96 gam nên giải ra nCO2 = nH2O = 0,08 mol.
► Chú ý: tương quan đốt muối nCO2 = nH2O ⇒ hai muối đều là muối của axit cacboxylic no, đơn chức, mạch hở.
Mtrung bình = 8,44 ÷ 0,12 = 70,333 cho biết có một muối là HCOONa (68).
Lại để ý có hai este cùng số cacbon nên hai muối hơn kém nhau 1C
⇒ muối còn lại là CH3COONa ⇒ giải hệ số mol có nHCOONa = 0,1 mol; nCH3COONa = 0,02 mol.
Ghép X: có 0,02 mol HCOOCH3; 0,08 mol HCOOC2H5 và 0,02 mol CH3COOCH3.
⇒ yêu cầu C%mHCOOCH3/X = 0,02 × 60 ÷ 7,76 × 100% ≈ 15,46%.
Sau đó: –OH + Na → –ONa + ½H2↑. Gọi a = nOH = n–COO– = nNaOH = n–COONa.
Ta có mbình natri tăng = mancol – mH2↑ = 4 ⇒ mancol = (4 + a) gam.
BTKL phản ứng thuỷ phân este: 7,76 + 40a = mmuối + mancol ⇒ mmuối = (3,76 + 39a) gam.
☆ Giải đốt (3,76 + 39a) gam Z + 0,09 mol O2 –––to–→ a/2 mol Na2CO3 + 4,96 gam (CO2 + H2O).
⇒ BTKL có ngay: (3,76 + 39a) + 0,09 × 32 = 53a + 4,96 ⇒ a = 0,12 mol.
♦ Giải 4,12 gam hai ancol với số mol 0,12 ⇒ Mtrung bình = 34,33
⇒ cho biết có 0,1 mol CH3OH và 0,02 mol C2H5OH.
♦ Đốt 8,44 gam Z + 0,09 mol O2 –––to–→ 0,06 mol Na2CO3 + 4,96 gam (CO2 + H2O).
Z chứa 0,12 mol chức COONa ⇒ nO trong Z = 0,24 mol
⇒ bảo toàn O có 2nCO2 + nH2O = 0,24 mol.
Lại có mCO2 + mH2O = 4,96 gam nên giải ra nCO2 = nH2O = 0,08 mol.
► Chú ý: tương quan đốt muối nCO2 = nH2O ⇒ hai muối đều là muối của axit cacboxylic no, đơn chức, mạch hở.
Mtrung bình = 8,44 ÷ 0,12 = 70,333 cho biết có một muối là HCOONa (68).
Lại để ý có hai este cùng số cacbon nên hai muối hơn kém nhau 1C
⇒ muối còn lại là CH3COONa ⇒ giải hệ số mol có nHCOONa = 0,1 mol; nCH3COONa = 0,02 mol.
Ghép X: có 0,02 mol HCOOCH3; 0,08 mol HCOOC2H5 và 0,02 mol CH3COOCH3.
⇒ yêu cầu C%mHCOOCH3/X = 0,02 × 60 ÷ 7,76 × 100% ≈ 15,46%.