Đáp án [BTTL] Bài học 01: Lý thuyết trọng tâm các chủ đề lớp 10
Câu 1 [575219]: Hạt nào sau đây không phải là hạt cơ bản trong nguyên tử?
A, Neutron.
B, Electron.
C, Proton.
D, Hạt nhân nguyên tử.
Nguyên tử gồm 3 hạt cơ bản là proton, neutron và electron. Các nhà khoa học đã phát hiện chúng thông qua các thí nghiệm:
- Năm 1897, Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm ⇒ Chùm các hạt electron.
- Năm 1918, E. Rutherford và các cộng sự dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton.
- Năm 1932, J. Chadwick và cộng sự của Rutherford đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α.
⟶ Hạt nhân nguyên tử chứa neutron và proton là một thành phần của nguyên tử, không phải hạt cơ bản trong nguyên tử.
⇒ Chọn đáp án D Đáp án: D
- Năm 1897, Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm ⇒ Chùm các hạt electron.
- Năm 1918, E. Rutherford và các cộng sự dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton.
- Năm 1932, J. Chadwick và cộng sự của Rutherford đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α.
⟶ Hạt nhân nguyên tử chứa neutron và proton là một thành phần của nguyên tử, không phải hạt cơ bản trong nguyên tử.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [241772]: Hạt nhân của nguyên tử nào có số hạt neutron là 30?
A, 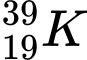 .
.
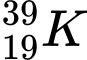 .
.B, 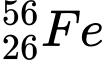 .
.
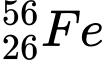 .
.C, 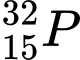 .
.
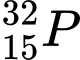 .
.D, 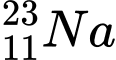 .
.
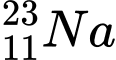 .
.
Số hạt neutron (N) = Số khối (A) – Số hạt proton (P).
Xét hạt nhân của các nguyên tử:
❌ A.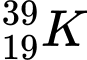 : N = 39 – 19 = 20
: N = 39 – 19 = 20
✔️ B.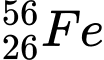 : N = 56 – 26 = 30
: N = 56 – 26 = 30
❌ C.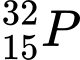 : N = 32 – 15 = 17
: N = 32 – 15 = 17
❌ D.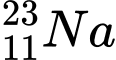 : N = 23 – 11 = 12
: N = 23 – 11 = 12
⇒ Chọn đáp án B Đáp án: B
Xét hạt nhân của các nguyên tử:
❌ A.
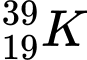 : N = 39 – 19 = 20
: N = 39 – 19 = 20✔️ B.
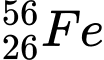 : N = 56 – 26 = 30
: N = 56 – 26 = 30❌ C.
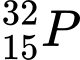 : N = 32 – 15 = 17
: N = 32 – 15 = 17❌ D.
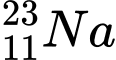 : N = 23 – 11 = 12
: N = 23 – 11 = 12⇒ Chọn đáp án B Đáp án: B
Câu 3 [247270]: Cấu hình electron nào sau đây không đúng?
A, 1s22s22p5.
B, 1s22s22p63s2.
C, 1s22s22p63s23p5.
D, 1s22s22p63s23p34s2.
1s22s22p63s23p34s2 Phân lớp 3p chưa bão hòa.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 4 [247263]: Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là 1s22s22p63s2?
A, Ca (Z = 20).
B, K (Z = 19).
C, Mg (Z = 12).
D, Na (Z = 11).
Phân tích các đáp án:
Cấu hình electron của các nguyên tố:
❌A. Ca(Z=20): 1s22s22p63s23p64s2
❌B. K(Z=19): 1s22s22p63s23p64s1
✔️C. Mg(Z=12): 1s22s22p63s2
❌D. Na(Z=11): 1s22s22p63s1
⟹Chọn đáp án C Đáp án: C
Cấu hình electron của các nguyên tố:
❌A. Ca(Z=20): 1s22s22p63s23p64s2
❌B. K(Z=19): 1s22s22p63s23p64s1
✔️C. Mg(Z=12): 1s22s22p63s2
❌D. Na(Z=11): 1s22s22p63s1
⟹Chọn đáp án C Đáp án: C
Câu 5 [575571]: Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là 1s22s22p5?
A, Mg (Z = 12).
B, F (Z = 9).
C, Cl (Z = 17).
D, P (Z = 15).
Phân tích các đáp án:
Cấu hình electron của các nguyên tố:
❌A.Mg (Z = 12): 1s22s22p53s2
✔️B.F (Z = 9): 1s22s22p5
❌C.Cl (Z = 17): 1s22s22p53s23p5
❌D.P (Z = 15): 1s22s22p53s23p3
⟹ Chọn đáp án B Đáp án: B
Cấu hình electron của các nguyên tố:
❌A.Mg (Z = 12): 1s22s22p53s2
✔️B.F (Z = 9): 1s22s22p5
❌C.Cl (Z = 17): 1s22s22p53s23p5
❌D.P (Z = 15): 1s22s22p53s23p3
⟹ Chọn đáp án B Đáp án: B
Câu 6 [575572]: Nguyên tử phosphorus có cấu hình electron ngoài cùng là 3s23p3. Số hiệu nguyên tử của phosphorus là
A, 14.
B, 25.
C, 17.
D, 15.
Cấu hình electron của phosphorus là: 1s2 2s2 2p6 3s2 3p3
Nguyên tử của nguyên tố có 15 electron ⟹ Số hiệu nguyên tử của phosphorus là 15
⟹ Chọn đáp án D Đáp án: D
Nguyên tử của nguyên tố có 15 electron ⟹ Số hiệu nguyên tử của phosphorus là 15
⟹ Chọn đáp án D Đáp án: D
Câu 7 [575573]: Nguyên tử copper có cấu hình electron là [Ar]3d104s1. Số hiệu nguyên tử của copper là
A, 26.
B, 29.
C, 22.
D, 27.
Cấu hình electron của copper là: 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Nguyên tử của nguyên tố có 29 electron ⇒ Số hiệu nguyên tử của copper là 29.
⇒ Chọn đáp án B Đáp án: B
Nguyên tử của nguyên tố có 29 electron ⇒ Số hiệu nguyên tử của copper là 29.
⇒ Chọn đáp án B Đáp án: B
Câu 8 [574686]: Nguyên tố X thuộc vào chu kì 2, nhóm VA trong bảng tuần hoàn. X là nguyên tố nào sau đây?
A, B (Z = 5).
B, N (Z = 7).
C, Na (Z = 11).
D, P (Z = 15).
Nguyên tố X thuộc vào chu kì 2, nhóm VA trong bảng tuần hoàn → X có 2 lớp electron và 5 electron ở lớp ngoài cùng.
→ Cấu hình electron của X là: 1s2 2s2 2p3
→ ZX = 7 (N)
⟹ Chọn đáp án B Đáp án: B
→ Cấu hình electron của X là: 1s2 2s2 2p3
→ ZX = 7 (N)
⟹ Chọn đáp án B Đáp án: B
Câu 9 [246706]: Nguyên tử của nguyên tố B thuộc chu kì 3, nhóm VIIA. Cấu hình electron thu gọn nào sau đây phù hợp với nguyên tố B?
A, [Ne]3s23p4.
B, [Ar]3s23p5.
C, [Ne]3s23p5.
D, [Ar]4s24p5.
Nguyên tố B thuộc chu kì 3 ⇒ có 3 lớp electron.
Thuộc nhóm VIIA ⇒ Có 7 electron lớp ngoài cùng.
⟶ Cấu hình electron của B là: [Ne]3s23p5.
⇒ Chọn đáp án C Đáp án: C
Thuộc nhóm VIIA ⇒ Có 7 electron lớp ngoài cùng.
⟶ Cấu hình electron của B là: [Ne]3s23p5.
⇒ Chọn đáp án C Đáp án: C
Câu 10 [246689]: Một nguyên tử có cấu hình electron: 1s22s22p4. Nguyên tố này thuộc nhóm
A, IVA.
B, VIA.
C, IIA.
D, VIIIA.
Cấu hình electron: 1s22s22p4
Nguyên tử có 6e lớp ngoài cùng nên thuộc nhóm VIA
⟹ Chọn đáp án B
Đáp án: B
Nguyên tử có 6e lớp ngoài cùng nên thuộc nhóm VIA
⟹ Chọn đáp án B
Đáp án: B
Câu 11 [246697]: Nguyên tử nguyên tố X có chứa 9 proton và 10 hạt neutron. X thuộc nhóm nào trong bảng tuần hoàn?
A, VIIA.
B, VIIIA.
C, IIIA.
D, IA.
Cấu hình electron của X 1s22s22p5.
X có 7e lớp ngoài cùng ⟹ X thuộc nhóm VIIA trong bảng tuần hoàn.
⟹ Chọn đáp án A Đáp án: A
X có 7e lớp ngoài cùng ⟹ X thuộc nhóm VIIA trong bảng tuần hoàn.
⟹ Chọn đáp án A Đáp án: A
Câu 12 [246579]: Nguyên tử sulfur (Z = 16) có bao nhiêu electron hóa trị?
A, 4.
B, 6.
C, 16.
D, 8.
Cấu hình electron của Sulfur: 1s22s22p63s23p4
⟹ Sulfur có 6 electron hóa trị.
⟹ Chọn đáp án B Đáp án: B
⟹ Sulfur có 6 electron hóa trị.
⟹ Chọn đáp án B Đáp án: B
Câu 13 [575646]: Nguyên tử sodium (Z = 11) có bao nhiêu electron hóa trị?
A, 4.
B, 3.
C, 1.
D, 2.
Cấu hình electron của Sodium là: 1s2 2s2 2p6 3s1
→ Sodium Có 1 electron hóa trị.
⟹ Chọn đáp án C Đáp án: C
→ Sodium Có 1 electron hóa trị.
⟹ Chọn đáp án C Đáp án: C
Câu 14 [575616]: Để hình thành ion O2– thì mỗi nguyên tử oxygen đã
A, nhường 2 electron.
B, nhận 2 electron.
C, nhường 1 electron.
D, nhận 3 electron.
Nguyên tử O (Z = 8) có cấu hình electron là 1s22s22p4
⟶ Oxygen có 6 electron lớp ngoài cùng cần nhận 2 electron đạt octet tạo thành ion O2–:
O + 2e ⟶ O2–
⇒ Chọn đáp án B Đáp án: B
⟶ Oxygen có 6 electron lớp ngoài cùng cần nhận 2 electron đạt octet tạo thành ion O2–:
O + 2e ⟶ O2–
⇒ Chọn đáp án B Đáp án: B
Câu 15 [680857]: Nguyên tố natri (sodium, Na ) có số hiệu nguyên tử là 11 . Ở trạng thái cơ bản, cấu hình electron của ion Na+ là
A, 1s22s22p63s1.
B, 1s22s22p6.
C, 1s22s22p5.
D, 1s22s22p63s2.
Cấu hình electron của Sodium là: 1s22s22p63s1
⟶ Sodium có 1 electron lớp ngoài cùng cần nhường 1 eletron để tạo thành ion Na+
Na ⟶ Na+ + 1e
Cấu hình electron của ion Na+ là: 1s22s22p6
⟹ Chọn đáp án B Đáp án: B
⟶ Sodium có 1 electron lớp ngoài cùng cần nhường 1 eletron để tạo thành ion Na+
Na ⟶ Na+ + 1e
Cấu hình electron của ion Na+ là: 1s22s22p6
⟹ Chọn đáp án B Đáp án: B
Câu 16 [247271]: Khi nguyên tử chlorine (Z=17) nhận thêm 1e thì cấu hình electron của ion tương ứng là
A, 1s2 2s2 2p6 3s1.
B, 1s2 2s2 2p6.
C, 1s2 2s2 2p6 3s3.
D, 1s2 2s2 2p6 3s2 3p6.
Cấu hình e của Cl: 1s22s22p63s23p5
⟶ Nhận thêm 1e ⟶ Cấu hình e của Y: 1s22s22p63s23p6
⟹ Chọn đáp án D Đáp án: D
⟶ Nhận thêm 1e ⟶ Cấu hình e của Y: 1s22s22p63s23p6
⟹ Chọn đáp án D Đáp án: D
Câu 17 [247272]: Ion X2+ có cấu hình electron là 1s2 2s2 2p6. Nguyên tố X là
A, Ne (Z= 10).
B, Mg (Z = 12).
C, Na (Z = 11).
D, O (Z = 8).
X2+ có cấu hình electron là 1s2 2s2 2p6 đã nhường đi 2e.
⟶ Cấu hình electron của X: 1s2 2s2 2p63s2
⟶ X là Mg
⟹ Chọn đáp án B Đáp án: B
⟶ Cấu hình electron của X: 1s2 2s2 2p63s2
⟶ X là Mg
⟹ Chọn đáp án B Đáp án: B
Câu 18 [575625]: Ion X3+ có cấu hình electron là 1s22s22p6. Nguyên tố X là
A, Ar (Z= 18).
B, K (Z = 19).
C, Al (Z = 13).
D, F (Z = 9).
X3+ có cấu hình electron là 1s22s22p6.
→ Nguyên tố X3+ đã nhận 3 electron để tạo thành X
X có cấu hình electron là: 1s22s22p63s23p1
→ Nguyên tố X có 13 electron → X là Al (Z=13)
⟹Chọn đáp án C Đáp án: C
→ Nguyên tố X3+ đã nhận 3 electron để tạo thành X
X có cấu hình electron là: 1s22s22p63s23p1
→ Nguyên tố X có 13 electron → X là Al (Z=13)
⟹Chọn đáp án C Đáp án: C
Câu 19 [575628]: Ion nào sau đây không có cấu hình electron giống khí hiếm?
A, Na+.
B, Al3+.
C, Cl–.
D, Fe2+.
Cấu hình electron nguyên tử Na (Z = 11): 1s2 2s2 2p6 3s1 → ion Na+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Al (Z = 13): 1s2 2s2 2p6 3s2 3p1 → ion Al3+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5 → ion Cl-: 1s2 2s2 2p6 3s2 3p6
Cấu hình electron nguyên tử Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2 → ion Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
→ ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
⇒ Chọn đáp án D Đáp án: D
Cấu hình electron nguyên tử Al (Z = 13): 1s2 2s2 2p6 3s2 3p1 → ion Al3+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5 → ion Cl-: 1s2 2s2 2p6 3s2 3p6
Cấu hình electron nguyên tử Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2 → ion Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
→ ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
⇒ Chọn đáp án D Đáp án: D
Câu 20 [823553]: Cặp nguyên tử nào sau đây có cùng số neutron?
A, 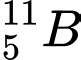 và
và 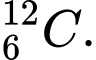
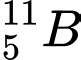 và
và 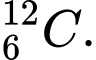
B, 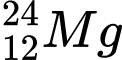 và
và 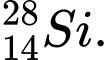
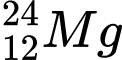 và
và 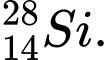
C, 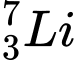 và
và 
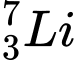 và
và 
D, 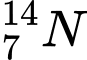 và
và 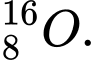
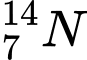 và
và 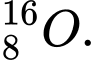
Công thức tính Số neutron (N) = Số khối (A) - Số proton (Z)
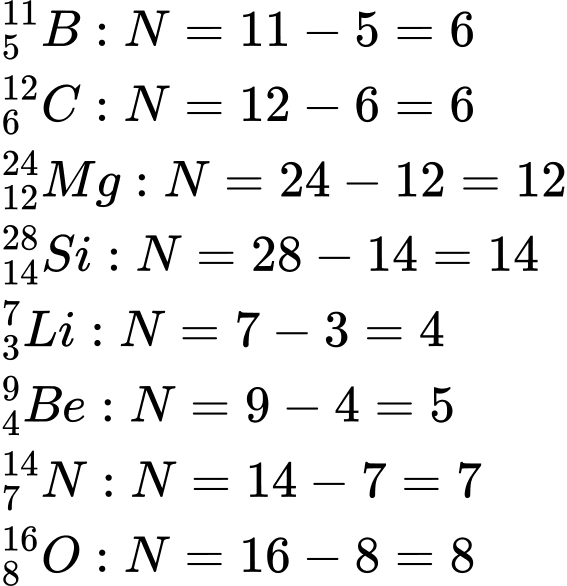
Phân tích các đáp án:
✔️Đúng. A. và
và 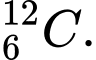 . Có cùng số neutron
. Có cùng số neutron
❌Sai. B.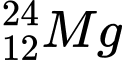 và
và 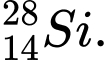 . Có số neutron khác nhau.
. Có số neutron khác nhau.
❌Sai. C.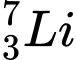 và
và  . Có số neutron khác nhau.
. Có số neutron khác nhau.
❌Sai. D.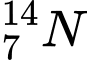 và
và 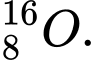 . Có số neutron khác nhau
. Có số neutron khác nhau
⟹ Chọn đáp án A Đáp án: A
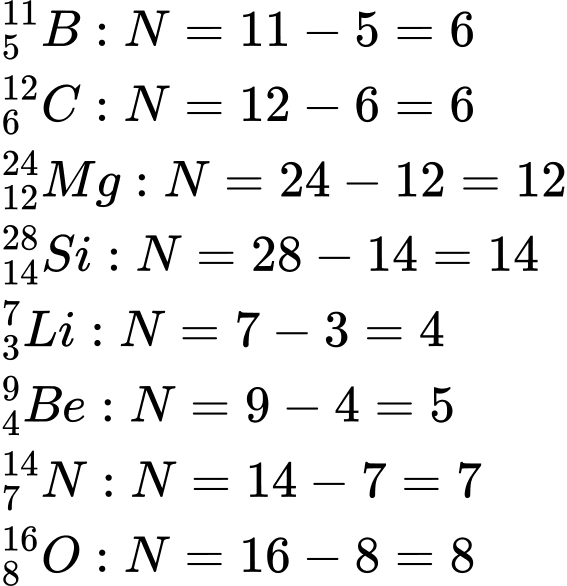
Phân tích các đáp án:
✔️Đúng. A.
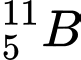 và
và 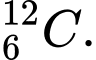 . Có cùng số neutron
. Có cùng số neutron❌Sai. B.
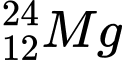 và
và 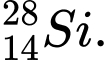 . Có số neutron khác nhau.
. Có số neutron khác nhau.❌Sai. C.
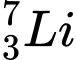 và
và  . Có số neutron khác nhau.
. Có số neutron khác nhau.❌Sai. D.
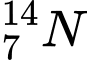 và
và 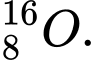 . Có số neutron khác nhau
. Có số neutron khác nhau⟹ Chọn đáp án A Đáp án: A
Câu 21 [823555]: Cặp nào sau đây có số electron khác nhau?
A, 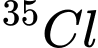 và
và 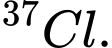
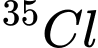 và
và 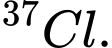
B,  và
và 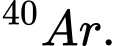
 và
và 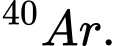
C, 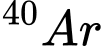 và
và 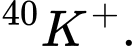
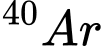 và
và 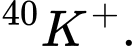
D, 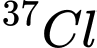 và
và 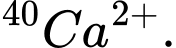
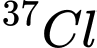 và
và 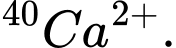
⭐Ta có: Số hiệu nguyên tử (Z) = Số elctron (e) = Số proton (p)
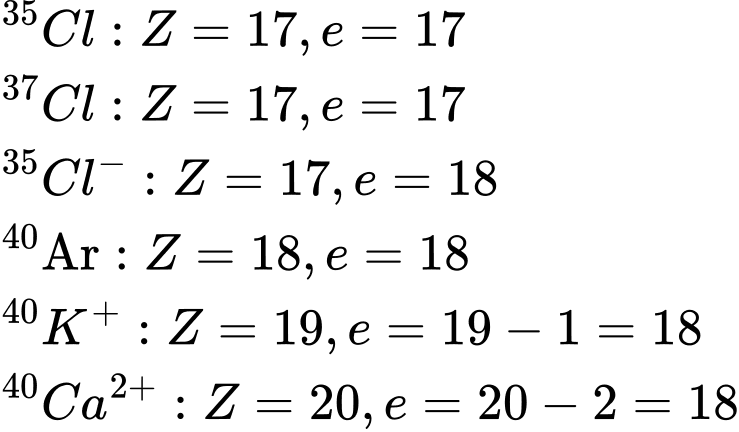
Phân tích các đáp án:
❌Sai. A. Cặp nguyên tử có số electron bằng nhau e= 17
❌Sai. B. Cặp nguyên tử có số electron bằng nhau e= 18
❌Sai. C. Cặp nguyên tử có số electron bằng nhau e= 18
✔️Đúng. D. Cặp nguyên tử có số electron khác nhau e = 17 và e = 18
⟹ Chọn đáp án D Đáp án: D
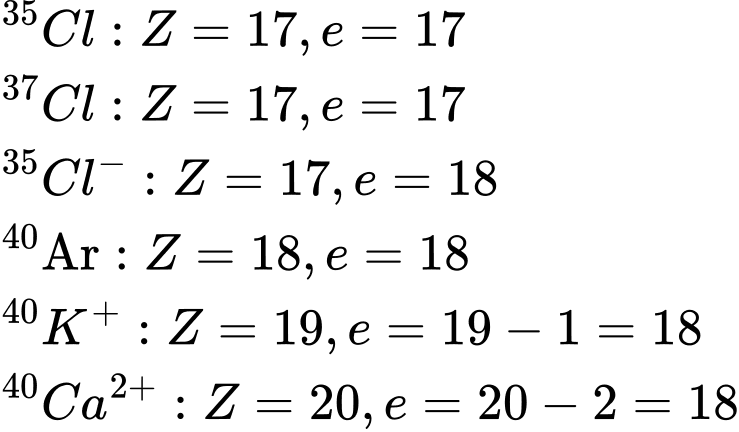
Phân tích các đáp án:
❌Sai. A. Cặp nguyên tử có số electron bằng nhau e= 17
❌Sai. B. Cặp nguyên tử có số electron bằng nhau e= 18
❌Sai. C. Cặp nguyên tử có số electron bằng nhau e= 18
✔️Đúng. D. Cặp nguyên tử có số electron khác nhau e = 17 và e = 18
⟹ Chọn đáp án D Đáp án: D
Câu 22 [823556]: Hạt X có 18 electron và 20 neutron. Kí hiệu của hạt X không thể là
A, 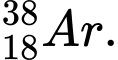
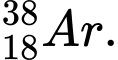
B, 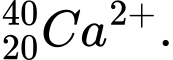
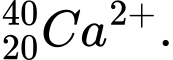
C, 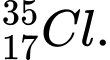
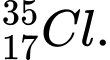
D, 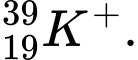
Các em ơi, chú ý💥
Nhập liệu câu này trong sách của chúng ta đang bị lỗi, vì vậy các em sửa giống trên web để chọn đáp án nhé́!
Sách mới không tránh khỏi những lỗi sai nên rất mong sự góp ý yêu thương của các em để nhóm tác giả hoàn thiện sách cho lần tái bản sau nha. Cảm ơn các em nhiều.
Phân tích các đáp án
✔️Đúng. A.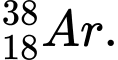 có 18 electron và 20 neutron.
có 18 electron và 20 neutron.
✔️Đúng. B.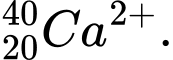 có 18 electron và 20 neutron.
có 18 electron và 20 neutron.
❌Sai. C.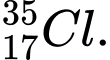 có 17 electron và 18 neutron.
có 17 electron và 18 neutron.
✔️Đúng D.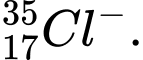 có 18 electron và 20 neutron.
có 18 electron và 20 neutron.
⟹ Chọn đáp án C Đáp án: C
Nhập liệu câu này trong sách của chúng ta đang bị lỗi, vì vậy các em sửa giống trên web để chọn đáp án nhé́!
Sách mới không tránh khỏi những lỗi sai nên rất mong sự góp ý yêu thương của các em để nhóm tác giả hoàn thiện sách cho lần tái bản sau nha. Cảm ơn các em nhiều.
Phân tích các đáp án
✔️Đúng. A.
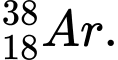 có 18 electron và 20 neutron.
có 18 electron và 20 neutron.✔️Đúng. B.
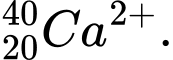 có 18 electron và 20 neutron.
có 18 electron và 20 neutron. ❌Sai. C.
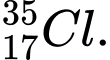 có 17 electron và 18 neutron.
có 17 electron và 18 neutron. ✔️Đúng D.
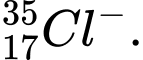 có 18 electron và 20 neutron.
có 18 electron và 20 neutron. ⟹ Chọn đáp án C Đáp án: C
Câu 23 [823557]: Hạt nào sau đây có số electron nhỏ nhất?
A, B3+.
B, H+.
C, He+.
D, Be2+.
Phân tích các đáp án:
❌Sai. A. B3+ Z = 5, e = 5 - 3 =2
✔️Đúng. B. H+ Z= 1, e = 1 - 1 = 0
❌Sai. C. He+ Z= 2, e = 2 - 1 = 1
❌Sai. D. Be2+ Z= 4, e = 4 - 2 = 2
⟹ Chọn đáp án B Đáp án: B
❌Sai. A. B3+ Z = 5, e = 5 - 3 =2
✔️Đúng. B. H+ Z= 1, e = 1 - 1 = 0
❌Sai. C. He+ Z= 2, e = 2 - 1 = 1
❌Sai. D. Be2+ Z= 4, e = 4 - 2 = 2
⟹ Chọn đáp án B Đáp án: B
Câu 24 [823561]: Hạt nào sau đây có số proton, neutron và electron đôi một khác nhau?
A, 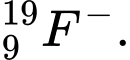
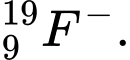
B, 

C, 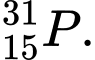
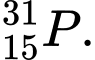
D, 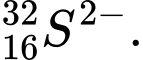
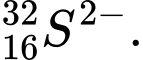
⭐Ta có: Số hiệu nguyên tử (Z) = Số proton (P) = Số electron (E)
Số neutron (N) = Số khối (A) - Số proton (P)
Phân tích các đáp án:
❌Sai. A.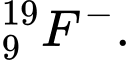 Z = 9 , N = 19 - 9 =10, e = 9 + 1 = 10 . Số electron và neutron bằng nhau
Z = 9 , N = 19 - 9 =10, e = 9 + 1 = 10 . Số electron và neutron bằng nhau
✔️Đúng B. Z = 11, N = 23 - 11 = 12, e = 11 - 1 = 10. Số proton, electron, neutron đôi một khác nhau.
Z = 11, N = 23 - 11 = 12, e = 11 - 1 = 10. Số proton, electron, neutron đôi một khác nhau.
❌Sai. C.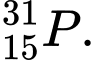 Z = 15, p = e = 15, N = 31 - 15 = 16 . Số proton và electron bằng nhau .
Z = 15, p = e = 15, N = 31 - 15 = 16 . Số proton và electron bằng nhau .
❌Sai. D.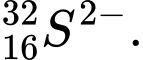 Z = 16, N = 32 - 16 = 16 , e = 16 + 2 = 18 . Số proton bằng neutron.
Z = 16, N = 32 - 16 = 16 , e = 16 + 2 = 18 . Số proton bằng neutron.
⟹ Chọn đáp án B Đáp án: B
Số neutron (N) = Số khối (A) - Số proton (P)
Phân tích các đáp án:
❌Sai. A.
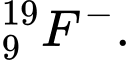 Z = 9 , N = 19 - 9 =10, e = 9 + 1 = 10 . Số electron và neutron bằng nhau
Z = 9 , N = 19 - 9 =10, e = 9 + 1 = 10 . Số electron và neutron bằng nhau✔️Đúng B.
 Z = 11, N = 23 - 11 = 12, e = 11 - 1 = 10. Số proton, electron, neutron đôi một khác nhau.
Z = 11, N = 23 - 11 = 12, e = 11 - 1 = 10. Số proton, electron, neutron đôi một khác nhau. ❌Sai. C.
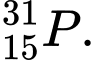 Z = 15, p = e = 15, N = 31 - 15 = 16 . Số proton và electron bằng nhau .
Z = 15, p = e = 15, N = 31 - 15 = 16 . Số proton và electron bằng nhau . ❌Sai. D.
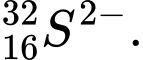 Z = 16, N = 32 - 16 = 16 , e = 16 + 2 = 18 . Số proton bằng neutron.
Z = 16, N = 32 - 16 = 16 , e = 16 + 2 = 18 . Số proton bằng neutron.⟹ Chọn đáp án B Đáp án: B
Câu 25 [823563]: Nguyên tử nào sau đây có cùng số electron với ion ammonium 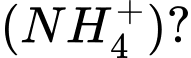
A, Mg.
B, Ne.
C, Cl.
D, O.
Số electron của ion ammonium (NH4+) là 10.
Phân tích các đáp án:
❌Sai. A. Mg có Z = 12 , e = 12
✔️Đúng. B. Ne có Z = 10, e = 10
❌Sai. C. Cl có Z = 17 , e =17
❌Sai. D. O có Z = 8, e = 8
⟹ Chọn đáp án B Đáp án: B
Phân tích các đáp án:
❌Sai. A. Mg có Z = 12 , e = 12
✔️Đúng. B. Ne có Z = 10, e = 10
❌Sai. C. Cl có Z = 17 , e =17
❌Sai. D. O có Z = 8, e = 8
⟹ Chọn đáp án B Đáp án: B
Câu 26 [823564]: Điều kiện để xảy ra phản ứng tỏa nhiệt (t = 25oC)?
A, 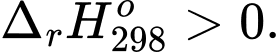
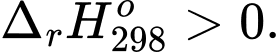
B, 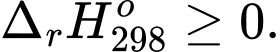
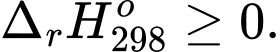
C, 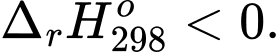
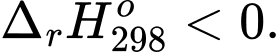
D, 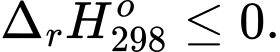
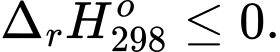
Phản ứng toả nhiệt là phản ứng hoá học thường kèm theo sự giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt.
⟹ Điều kiện để xảy ra phản ứng toả nhiệt là biến thiên enthalpy âm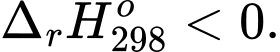
⟹ Chọn đáp án C Đáp án: C
⟹ Điều kiện để xảy ra phản ứng toả nhiệt là biến thiên enthalpy âm
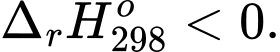
⟹ Chọn đáp án C Đáp án: C
Câu 27 [823565]: Đơn vị của tốc độ phản ứng thường được biểu diễn bằng?
A, mol/L.
B, mol/s.
C, mol/L.s.
D, g/mol.
Đơn vị của tốc độ phản ứng thường được biểu diễn bằng mol/L.s.
Các đáp án còn lại
A. mol/L : đơn vị tính nồng độ mol
B. mol/s: đơn vị tốc độ phản ứng
D. g/mol: đơn vị khối lượng mol
⟹ Chọn đáp án C Đáp án: C
Các đáp án còn lại
A. mol/L : đơn vị tính nồng độ mol
B. mol/s: đơn vị tốc độ phản ứng
D. g/mol: đơn vị khối lượng mol
⟹ Chọn đáp án C Đáp án: C
Câu 28 [823566]: “Tốc độ phản ứng thể hiện mức độ phản ứng ……… của một phản ứng”. Nội dung phù hợp trong ô trống là
A, tỏa nhiệt.
B, thu nhiệt.
C, nhanh/chậm.
D, oxi hóa – khử.
Tốc độ phản ứng thể hiện mức độ phản ứng nhanh/chậm của một phản ứng.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 29 [823567]: Cách nào sau đây sẽ làm miếng thịt lợn chín nhanh nhất?
A, Luộc trong nước sôi.
B, Hấp cách thủy trong nồi cơm.
C, Nướng ở 180 oC.
D, Hấp trên nồi hơi.
Tốc độ chín của thịt: Tốc độ chín của thịt phụ thuộc vào nhiệt độ và cách truyền nhiệt.
Phân tích các đáp án:
❌Sai. A. Luộc trong nước sôi , nước có nhiệt độ sôi là 100oC nước được truyền vào thịt .
❌Sai. B. Hấp cách thủy trong nồi cơm không đủ nhiệt lượng làm cho thịt lâu chín.
✔️Đúng. C. Nướng ở 180oC Nhiệt độ cao hơn nhiều so với luộc và hấp, nhiệt được truyền trực tiếp từ lò nướng vào thịt. Làm cho thịt chín nhanh nhất.
❌Sai. D. Hấp trên nồi hơi nhiệt độ của hơi nước cao hơn nước sôi, nhiệt được truyền qua hơi nước vào thịt.
⟹ Chọn đáp án C Đáp án: C
Phân tích các đáp án:
❌Sai. A. Luộc trong nước sôi , nước có nhiệt độ sôi là 100oC nước được truyền vào thịt .
❌Sai. B. Hấp cách thủy trong nồi cơm không đủ nhiệt lượng làm cho thịt lâu chín.
✔️Đúng. C. Nướng ở 180oC Nhiệt độ cao hơn nhiều so với luộc và hấp, nhiệt được truyền trực tiếp từ lò nướng vào thịt. Làm cho thịt chín nhanh nhất.
❌Sai. D. Hấp trên nồi hơi nhiệt độ của hơi nước cao hơn nước sôi, nhiệt được truyền qua hơi nước vào thịt.
⟹ Chọn đáp án C Đáp án: C
Câu 30 [823568]: Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng?
A, Nồng độ chất phản ứng.
B, Áp suất của sản phẩm.
C, Nhiệt độ.
D, Chất xúc tác.
Các yếu tố ảnh hưởng tới tốc độ phản ứng là: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác.
Áp suất của sản phẩm chỉ ảnh hưởng tới cân bằng của phản ứng không ảnh hưởng tới tốc độ của phản ứng.
⟹ Chọn đáp án B Đáp án: B
Áp suất của sản phẩm chỉ ảnh hưởng tới cân bằng của phản ứng không ảnh hưởng tới tốc độ của phản ứng.
⟹ Chọn đáp án B Đáp án: B
Câu 31 [823570]: Nguyên tố nào sau đây dễ tạo thành hợp chất cộng hóa trị nhất?
A, Boron.
B, Magnesium.
C, Neon.
D, Potassium.
Hợp chất cộng hóa trị: Là hợp chất được hình thành do sự dùng chung electron giữa các nguyên tử.
Phân tích câc đáp án:
✔️Đúng. A. Boron có xu hướng tạo thành hợp chất cộng hóa trị
❌Sai. B. Magnesium là một kim loại, có xu hướng tạo thành hợp chất ion.
❌Sai. C. Neon là một khí hiếm, có lớp vỏ electron ngoài cùng bền vững (8 electron), rất khó tham gia phản ứng hóa học và không tạo thành hợp chất cộng hóa trị.
❌Sai. D. Potassium là một kim loại, có xu hướng tạo thành hợp chất ion.
⟹ Chọn đáp án A Đáp án: A
Phân tích câc đáp án:
✔️Đúng. A. Boron có xu hướng tạo thành hợp chất cộng hóa trị
❌Sai. B. Magnesium là một kim loại, có xu hướng tạo thành hợp chất ion.
❌Sai. C. Neon là một khí hiếm, có lớp vỏ electron ngoài cùng bền vững (8 electron), rất khó tham gia phản ứng hóa học và không tạo thành hợp chất cộng hóa trị.
❌Sai. D. Potassium là một kim loại, có xu hướng tạo thành hợp chất ion.
⟹ Chọn đáp án A Đáp án: A
Câu 32 [823572]: Phân tử nào sau đây chứa 6 electron liên kết?
A, NCl3.
B, H2S.
C, C2H4.
D, SF6.
Phân tích các đáp án:
✔️Đúng. A. NCl3 có 6 electron liên kết.
❌Sai. B. H2S có 4 electron liên kết.
❌Sai. C. C2H4 có 12 electron liên kết
❌Sai. D. SF6 có 12 electron liên kết.
⟹ Chọn đáp án A Đáp án: A
✔️Đúng. A. NCl3 có 6 electron liên kết.
❌Sai. B. H2S có 4 electron liên kết.
❌Sai. C. C2H4 có 12 electron liên kết
❌Sai. D. SF6 có 12 electron liên kết.
⟹ Chọn đáp án A Đáp án: A
Câu 33 [823573]: Loại liên kết nào không bao giờ xuất hiện trong các đơn chất?
A, Cộng hóa trị.
B, Ion.
C, Kim loại.
D, Lực van de Waals.
Đơn chất là chất được tạo từ 1 hay nhiều nguyên tử của cùng 1 nguyên tố hóa học.
Phân tích các đáp án:
❌Sai. A. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Có thể xuất hiện trong các đơn chất.
✔️Đúng. B. Liên kết ion hay liên kết điện tích, là một loại liên kết hóa học bao gồm lực hút tĩnh điện giữa các ion tích điện trái dấu hoặc giữa hai nguyên tử có độ âm điện khác nhau rõ rệt. Liên kết ion thường xuất hiện trong các hợp chất, không xuất hiện trong các đơn chất.
❌Sai. C. Liên kết kim loại là liên kết sinh ra bởi lực hút tĩnh điện giữa các electron tự do và các ion dương, kết dính các ion dương kim loại với nhau. Liên kết kim loại thường xuất hiện trong đơn chất kim loại.
❌Sai. D. Liên kết van der Waals là tương tác tĩnh điện lưỡng cực - lưỡng cỰC giữa các nguyên tử hoặc phân tử.
⟹ Chọn đáp án B Đáp án: B
Phân tích các đáp án:
❌Sai. A. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Có thể xuất hiện trong các đơn chất.
✔️Đúng. B. Liên kết ion hay liên kết điện tích, là một loại liên kết hóa học bao gồm lực hút tĩnh điện giữa các ion tích điện trái dấu hoặc giữa hai nguyên tử có độ âm điện khác nhau rõ rệt. Liên kết ion thường xuất hiện trong các hợp chất, không xuất hiện trong các đơn chất.
❌Sai. C. Liên kết kim loại là liên kết sinh ra bởi lực hút tĩnh điện giữa các electron tự do và các ion dương, kết dính các ion dương kim loại với nhau. Liên kết kim loại thường xuất hiện trong đơn chất kim loại.
❌Sai. D. Liên kết van der Waals là tương tác tĩnh điện lưỡng cực - lưỡng cỰC giữa các nguyên tử hoặc phân tử.
⟹ Chọn đáp án B Đáp án: B
Câu 34 [705570]: Số oxi hóa trung bình của nguyên tố được đánh dấu (in đậm) trong ion nào sau đây có giá trị lớn nhất?
A, 

B, 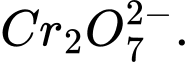
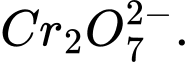
C, 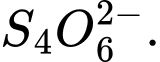
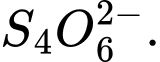
D, 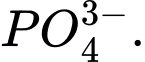
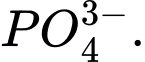
Gọi số oxi hoá của các nguyên tố được in đậm ở từng ion là a, b, c, d. Tổng số oxi hoá của các ion phải bằng điện tích của ion đó nên ta có:
✔️Đúng.A.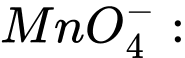 a + 4 × (−2) = −1 ⇔ a − 8 = −1 ⇔ a = +7 ⟶ Số oxi hóa trung bình của Mn là +7.
a + 4 × (−2) = −1 ⇔ a − 8 = −1 ⇔ a = +7 ⟶ Số oxi hóa trung bình của Mn là +7.
❌Sai.B.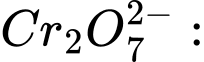 2b + 7 × (−2) = −2 ⇔ 2b − 14 = −2 ⇔ 2b = 12 ⇔ b = +6 ⟶ Số oxi hóa trung bình của Cr là +6.
2b + 7 × (−2) = −2 ⇔ 2b − 14 = −2 ⇔ 2b = 12 ⇔ b = +6 ⟶ Số oxi hóa trung bình của Cr là +6.
❌Sai.C.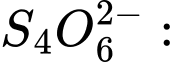 c = [(2×5) + (2×0)] ÷ 4 = 10 ÷ 4 = +2,5 ⟶ Số oxi hóa trung bình của S là +2,5.
c = [(2×5) + (2×0)] ÷ 4 = 10 ÷ 4 = +2,5 ⟶ Số oxi hóa trung bình của S là +2,5.
❌Sai.D.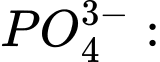 d + 4 × (−2) = −3 ⇔ d − 8 = −3 ⇔ d = +5 ⟶ Số oxi hóa trung bình của P là +5.
d + 4 × (−2) = −3 ⇔ d − 8 = −3 ⇔ d = +5 ⟶ Số oxi hóa trung bình của P là +5.
Vậy số oxi hóa trung bình của nguyên tố được đánh dấu (in đậm) trong ion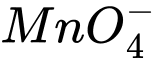 có giá trị lớn nhất.
có giá trị lớn nhất.
⇒ Chọn đáp án A Đáp án: A
✔️Đúng.A.
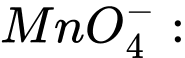 a + 4 × (−2) = −1 ⇔ a − 8 = −1 ⇔ a = +7 ⟶ Số oxi hóa trung bình của Mn là +7.
a + 4 × (−2) = −1 ⇔ a − 8 = −1 ⇔ a = +7 ⟶ Số oxi hóa trung bình của Mn là +7.❌Sai.B.
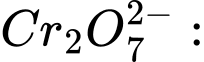 2b + 7 × (−2) = −2 ⇔ 2b − 14 = −2 ⇔ 2b = 12 ⇔ b = +6 ⟶ Số oxi hóa trung bình của Cr là +6.
2b + 7 × (−2) = −2 ⇔ 2b − 14 = −2 ⇔ 2b = 12 ⇔ b = +6 ⟶ Số oxi hóa trung bình của Cr là +6.❌Sai.C.
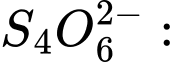 c = [(2×5) + (2×0)] ÷ 4 = 10 ÷ 4 = +2,5 ⟶ Số oxi hóa trung bình của S là +2,5.
c = [(2×5) + (2×0)] ÷ 4 = 10 ÷ 4 = +2,5 ⟶ Số oxi hóa trung bình của S là +2,5.❌Sai.D.
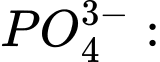 d + 4 × (−2) = −3 ⇔ d − 8 = −3 ⇔ d = +5 ⟶ Số oxi hóa trung bình của P là +5.
d + 4 × (−2) = −3 ⇔ d − 8 = −3 ⇔ d = +5 ⟶ Số oxi hóa trung bình của P là +5.Vậy số oxi hóa trung bình của nguyên tố được đánh dấu (in đậm) trong ion
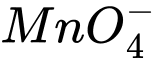 có giá trị lớn nhất.
có giá trị lớn nhất.⇒ Chọn đáp án A Đáp án: A
Câu 35 [705852]: Trong tinh thể kim loại M, ... chuyển động tự do. Nội dung phù hợp điền vào ô trống là
A, cation Mn+.
B, anion Mn–.
C, nguyên tử M.
D, electron hóa trị.
Phân tích các đáp án :
❌A. Sai. Trong tinh thể kim loại, các nguyên tử kim loại mất electron hóa trị để tạo thành ion dương (cation).
Tuy nhiên, các cation này không chuyển động tự do mà nằm cố định trong mạng tinh thể kim loại.
❌B. Sai. Kim loại không tạo anion (ion âm) trong mạng tinh thể của nó.
❌C. Sai. Nguyên tử kim loại không tồn tại tự do mà liên kết trong mạng tinh thể.
✔️D. Đúng. Trong kim loại, các electron hóa trị tách khỏi nguyên tử và tạo thành " electron tự do", di chuyển linh hoạt trong mạng tinh thể kim loại.
⟹ Chọn đáp án D
Đáp án: D ⟹ Chọn đáp án D
Câu 36 [706006]: Tinh thể kim loại M
A, mang điện tích dương.
B, mang điện tích âm.
C, trung hòa về điện.
D, không xác định.
Phân tích các đáp án :
❌A. Mang điện tích dương: Trong kim loại, các nguyên tử kim loại liên kết với nhau bằng liên kết kim loại. Các ion dương (cation) nằm trong "biển electron" tự do, nhưng tổng thể tinh thể kim loại không mang điện tích dương vì số lượng electron vẫn đủ để cân bằng với ion dương.
❌B. Mang điện tích âm: Dù có các electron tự do di chuyển, tinh thể kim loại không bị thừa electron đến mức mang điện tích âm.
✔️C. Trung hòa về điện: Trong trạng thái tự nhiên, tinh thể kim loại có tổng điện tích bằng 0 do số proton trong hạt nhân cân bằng với số electron trong hệ thống.
❌D. Không xác định: Điện tích của tinh thể kim loại đã được xác định rõ ràng là trung hòa về điện, nên đáp án này không chính xác.
⟹ Chọn đáp án C Đáp án: C
❌A. Mang điện tích dương: Trong kim loại, các nguyên tử kim loại liên kết với nhau bằng liên kết kim loại. Các ion dương (cation) nằm trong "biển electron" tự do, nhưng tổng thể tinh thể kim loại không mang điện tích dương vì số lượng electron vẫn đủ để cân bằng với ion dương.
❌B. Mang điện tích âm: Dù có các electron tự do di chuyển, tinh thể kim loại không bị thừa electron đến mức mang điện tích âm.
✔️C. Trung hòa về điện: Trong trạng thái tự nhiên, tinh thể kim loại có tổng điện tích bằng 0 do số proton trong hạt nhân cân bằng với số electron trong hệ thống.
❌D. Không xác định: Điện tích của tinh thể kim loại đã được xác định rõ ràng là trung hòa về điện, nên đáp án này không chính xác.
⟹ Chọn đáp án C Đáp án: C
Câu 37 [823576]: Cho phương trình hóa học:
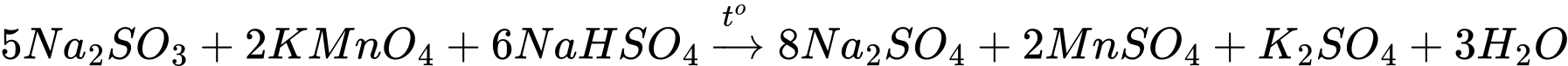
Với cùng một số mol các chất tham gia phản ứng, chất nào sau đây hết chậm nhất?
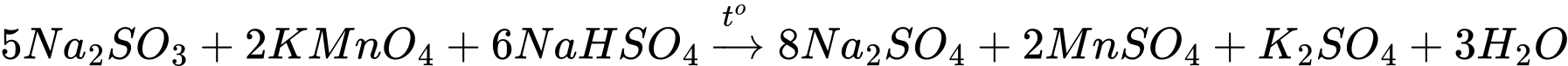
Với cùng một số mol các chất tham gia phản ứng, chất nào sau đây hết chậm nhất?
A, Na2SO3.
B, KMnO4.
C, NaHSO4.
D, Cả 3 chất hết cùng lúc.
Theo phương trình tỉ lệ mol giữa các chất là: Na2SO3 : KMnO4 : NaHSO4 = 5 : 2 : 6
Giả sử với cùng số mol chất tham gia phản ứng là n thì nhìn vào tỉ lệ có thể thấy được cứ tốn 5 mol Na2SO3, 6 mol NaHSO4 thì mới hết 2 mol KMnO4.
⟹ Nếu cùng 1 số mol thì KMnO4 sẽ hết chậm nhất.
⟹ Chọn đáp án B Đáp án: B
Giả sử với cùng số mol chất tham gia phản ứng là n thì nhìn vào tỉ lệ có thể thấy được cứ tốn 5 mol Na2SO3, 6 mol NaHSO4 thì mới hết 2 mol KMnO4.
⟹ Nếu cùng 1 số mol thì KMnO4 sẽ hết chậm nhất.
⟹ Chọn đáp án B Đáp án: B
Câu 38 [706040]: Phát biểu nào sau đây là không đúng?
A, Ở điều kiện thường, tất cả các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể.
B, Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
C, Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử.
D, Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
Phân tích các đáp án :
❌A – Sai. Ở điều kiện thường, hầu như các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể ngoại trừ Hg ở trạng thái lỏng ở dk thường.
✔️B – Đúng. Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
✔️(c) – Đúng. Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử, vì ở lớp ngoài cùng cách xa hạt nhân nhất nên ít chịu ảnh hưởng bởi hạt nhân.
✔️(d) – Đúng. Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
⟹ Chọn đáp án A Đáp án: A
❌A – Sai. Ở điều kiện thường, hầu như các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể ngoại trừ Hg ở trạng thái lỏng ở dk thường.
✔️B – Đúng. Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
✔️(c) – Đúng. Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử, vì ở lớp ngoài cùng cách xa hạt nhân nhất nên ít chịu ảnh hưởng bởi hạt nhân.
✔️(d) – Đúng. Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
⟹ Chọn đáp án A Đáp án: A
Câu 39 [823579]: Tốc độ của phản ứng nào sau đây sẽ tăng khi tăng nhiệt độ?
A, Phản ứng tỏa nhiệt.
B, Phản ứng thu nhiệt.
C, Không có phản ứng nào.
D, Cả hai phản ứng.
⭐Phản ứng tỏa nhiệt:
Phản ứng tỏa nhiệt giải phóng nhiệt ra môi trường.
Tăng nhiệt độ vẫn làm tăng tốc độ phản ứng tỏa nhiệt.
⭐Phản ứng thu nhiệt:
Phản ứng thu nhiệt hấp thụ nhiệt từ môi trường.
Tăng nhiệt độ cung cấp thêm năng lượng cho phản ứng thu nhiệt, làm tăng tốc độ phản ứng.
⟹ Chọn đáp án D Đáp án: D
Phản ứng tỏa nhiệt giải phóng nhiệt ra môi trường.
Tăng nhiệt độ vẫn làm tăng tốc độ phản ứng tỏa nhiệt.
⭐Phản ứng thu nhiệt:
Phản ứng thu nhiệt hấp thụ nhiệt từ môi trường.
Tăng nhiệt độ cung cấp thêm năng lượng cho phản ứng thu nhiệt, làm tăng tốc độ phản ứng.
⟹ Chọn đáp án D Đáp án: D
Câu 40 [823580]: Cho phản ứng: A + B ⟶ C + D.
Hãy cho biết đồ thị hình bên có thể biểu diễn sự thay đổi nồng độ của những chất nào?
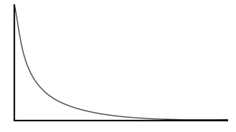
Hãy cho biết đồ thị hình bên có thể biểu diễn sự thay đổi nồng độ của những chất nào?

A, A và C.
B, A và B.
C, C và D.
D, B và D.
Nhìn vào đồ thị ta thấy nồng độ các chất giảm dần theo thời gian nên suy ra các chất tham gia sẽ giảm dần
⟶ Nồng độ A và B phù hợp với kết quả của đồ thị.
⟹ Chọn đồ thị B Đáp án: B
⟶ Nồng độ A và B phù hợp với kết quả của đồ thị.
⟹ Chọn đồ thị B Đáp án: B