Đáp án [BTTL] Bài học 16: Tổng ôn cấp tốc hóa vô cơ: pin điện – điện phân
Câu 1 [247443]: Chất khử còn gọi là
A, chất bị khử.
B, chất bị oxi hoá.
C, chất có tính khử.
D, chất đi oxi hoá.
Chất khử còn gọi là chất bị oxi hoá.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 2 [247444]: Quá trình oxi hoá là
A, quá trình nhường electron.
B, quá trình nhận electron.
C, quá trình tăng electron.
D, quá trình giảm số oxi hoá.
Quá trình oxi hoá là quá trình nhường electron.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 3 [247445]: Chất khử là chất
A, nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B, nhường e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C, nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D, nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Ta có: “Khử tăng o giảm”, khử cho, o nhận: Chất khử là chất nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 4 [247447]: Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A, Số mol.
B, Số oxi hóa.
C, Số khối.
D, Số proton.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của ít nhất một nguyên tố.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 5 [560408]: Cho quá trình oxi hóa – khử của Mg2+ với Mg như sau:
Mg2+ + 2e ⇌ Mg
Biểu diễn cặp oxi hóa – khử của quá trình trên là A, Mg2+.
B, Mg.
C, Mg2+/Mg.
D, Mg/Mg2+.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Mg2+/Mg.
⟹ Chọn đáp án C Đáp án: C
→ Cặp oxi hoá - khử của quá trình là Mg2+/Mg.
⟹ Chọn đáp án C Đáp án: C
Câu 6 [560409]: Cho quá trình oxi hóa – khử của Fe2+ với Fe3+ như sau:
Fe3+ + e ⇌ Fe2+
Biểu diễn cặp oxi hóa – khử của quá trình trên là A, Fe3+/Fe.
B, Fe2+/Fe.
C, Fe2+/Fe3+.
D, Fe3+/Fe2+.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe2+.
⇒ Chọn đáp án D Đáp án: D
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe2+.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [560410]: Khi nhúng thanh kim loại Cu vào trong dung dịch muối CuSO4 sẽ tạo thành điện cực của cặp oxi hóa – khử nào sau đây?
A, Cu3+/Cu.
B, Cu2+/Cu.
C, Cu2+/Cu3+.
D, Cu2+/SO42–.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Cu2+/Cu.
⇒ Chọn đáp án B Đáp án: B
→ Cặp oxi hoá - khử của quá trình là Cu2+/Cu.
⇒ Chọn đáp án B Đáp án: B
Câu 8 [560411]: Khi nhúng thanh kim loại Fe vào trong dung dịch muối Fe2(SO4)3 sẽ tạo thành điện cực của cặp oxi hóa – khử nào sau đây?
A, Fe3+/Fe.
B, Fe2+/Fe.
C, Fe2+/Fe3+.
D, Fe3+/ SO42–.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe.
⟹ Chọn đáp án A Đáp án: A
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe.
⟹ Chọn đáp án A Đáp án: A
Câu 9 [560412]: Thế điện cực chuẩn là thế điện cực được đo trong điều kiện nồng độ ion kim loại trong dung dịch là 1 M và nhiệt độ
A, 0oC.
B, 20oC.
C, 25oC.
D, 100oC.
Điều kiện chuẩn là điều kiện trong đó nồng độ của ion kim loại trong dung dịch là 1 M và nhiệt độ là 25 oC (nhiệt độ phòng)
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 10 [560414]: Yếu tố nào sau đây không ảnh hưởng đến thế điện cực của điện cực?
A, Bản chất của điện cực (kim loại).
B, Nhiệt độ.
C, Nồng độ mol của dung dịch.
D, Kích thước của điện cực.
Kích thước của điện cực không ảnh hưởng đến thế điện cực, vì thế điện cực phụ thuộc vào bản chất của điện cực (kim loại) và nồng độ ion, chứ không phải vào kích thước của điện cực đó.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 11 [824892]: Giá trị thế điện cực chuẩn của cặp oxi hóa – khử nào được quy ước bằng 0 V?
A, Na+/Na.
B, 2H+/H2.
C, Cl2/2Cl–.
D, Hg2+/Hg.
Phân tích các đáp án:
❌A. Giá trị thế điện cực chuẩn của Na+/Na Eo = -2,71V.
✔️B. Giá trị thế điện cực chuẩn của 2H+/H2 Eo = 0V.
❌C. Giá trị thế điện cực chuẩn của Cl2/2Cl- Eo = 1,36V.
❌D. Giá trị thế điện cực chuẩn của Hg2+/Hg Eo = 0,85V.
⟹ Chọn đáp án B Đáp án: B
❌A. Giá trị thế điện cực chuẩn của Na+/Na Eo = -2,71V.
✔️B. Giá trị thế điện cực chuẩn của 2H+/H2 Eo = 0V.
❌C. Giá trị thế điện cực chuẩn của Cl2/2Cl- Eo = 1,36V.
❌D. Giá trị thế điện cực chuẩn của Hg2+/Hg Eo = 0,85V.
⟹ Chọn đáp án B Đáp án: B
Câu 12 [824894]: Cặp oxi hóa - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ hơn 0?
A, Ag+/Ag.
B, Na+/Na.
C, Cu2+/Cu.
D, Au3+/Au.
Phân tích các đáp án:
❌A. Giá trị thế điện cực của Ag+/Ag Eo = 0,80V.
✔️B. Giá trị thế điện cực của Na+/Na Eo = -2,71V.
❌C. Giá trị thế điện cực của Cu2+/Cu Eo = 0,34V.
❌D. Giá trị thế điện cực của Au3+/Au Eo = 1,50V.
⟹ Cặp oxi hóa - khử Na+/Na có giá trị thế điện cực Eo < 0.
⟹ Chọn đáp án B Đáp án: B
❌A. Giá trị thế điện cực của Ag+/Ag Eo = 0,80V.
✔️B. Giá trị thế điện cực của Na+/Na Eo = -2,71V.
❌C. Giá trị thế điện cực của Cu2+/Cu Eo = 0,34V.
❌D. Giá trị thế điện cực của Au3+/Au Eo = 1,50V.
⟹ Cặp oxi hóa - khử Na+/Na có giá trị thế điện cực Eo < 0.
⟹ Chọn đáp án B Đáp án: B
Câu 13 [824895]: Cặp oxi hóa - khử nào sau đây có giá trị thế điện cực chuẩn lớn hơn 0?
A, Ni2+/Ni.
B, Pb2+/Pb.
C, Al3+/Al.
D, Hg2+/Hg.
Phân tích các đáp án:
❌A. Giá trị thế điện cực chuẩn của Ni2+/Ni Eo = -0,25V.
❌B. Giá trị thế điện cực chuẩn của Pb2+/Pb Eo = -0,13V.
❌C. Giá trị thế điện cực chuẩn của Al3+/Al Eo = -1,66V.
✔️D. Giá trị thế điện cực chuẩn của Hg2+/Hg Eo = 0,85V.
⟹ Cặp oxi hóa - khử Hg2+/Hg có giá trị thế điện cực chuẩn lớn hơn 0.
⟹ Chọn đáp án D Đáp án: D
❌A. Giá trị thế điện cực chuẩn của Ni2+/Ni Eo = -0,25V.
❌B. Giá trị thế điện cực chuẩn của Pb2+/Pb Eo = -0,13V.
❌C. Giá trị thế điện cực chuẩn của Al3+/Al Eo = -1,66V.
✔️D. Giá trị thế điện cực chuẩn của Hg2+/Hg Eo = 0,85V.
⟹ Cặp oxi hóa - khử Hg2+/Hg có giá trị thế điện cực chuẩn lớn hơn 0.
⟹ Chọn đáp án D Đáp án: D
Câu 14 [824896]: Trong dãy điện hóa của kim loại, khi đi từ trái sang phải, tính oxi hóa của các ion kim loại biến đổi như thế nào?
A, Không đổi.
B, Tăng dần.
C, Tuần hoàn.
D, Giảm dần.
Trong dãy điện hóa của kim loại, khi đi từ trái sang phải, tính oxi hóa của các ion kim loại tăng dần.
Giải thích:
- Dãy điện hóa của kim loại được sắp xếp theo chiều tăng dần của thế điện cực chuẩn (Eo) của các cặp oxi hóa-khử Mn+/M.
⟹ Chọn đáp án B Đáp án: B
Giải thích:
- Dãy điện hóa của kim loại được sắp xếp theo chiều tăng dần của thế điện cực chuẩn (Eo) của các cặp oxi hóa-khử Mn+/M.
⟹ Chọn đáp án B Đáp án: B
Câu 15 [560415]: Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
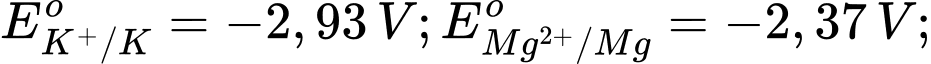
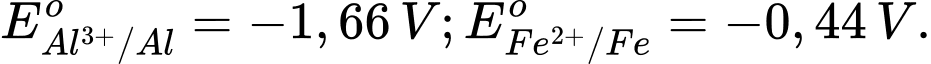
Trong các kim loại sau đây, kim loại nào sau đây có tính khử mạnh nhất?
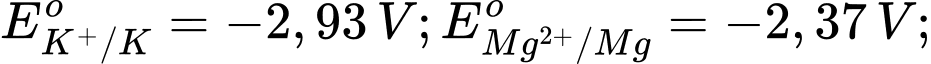
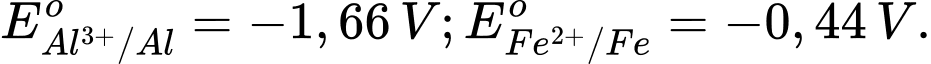
Trong các kim loại sau đây, kim loại nào sau đây có tính khử mạnh nhất?
A, Fe.
B, K.
C, Al.
D, Mg.
Kim loại có tính khử mạnh nhất trong số các kim loại được liệt kê là Potassium (K), vì nó có thế điện cực chuẩn âm nhất.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 16 [560416]: Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
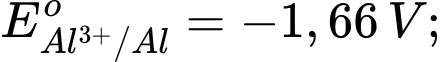
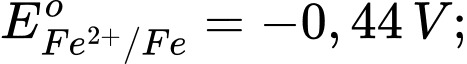
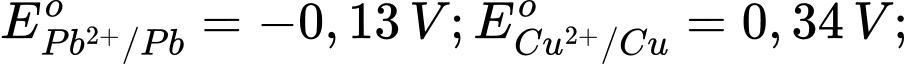
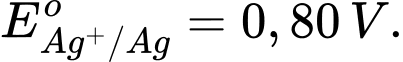
Kim loại nào sau đây có tính khử mạnh hơn Fe?
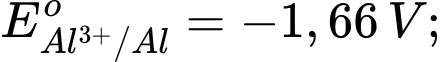
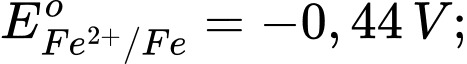
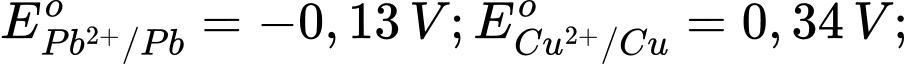
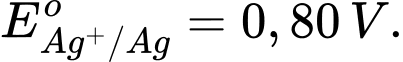
Kim loại nào sau đây có tính khử mạnh hơn Fe?
A, Ag.
B, Cu.
C, Pb.
D, Al.
Kim loại có tính khử mạnh hơn Fe là Al vì có thế điện cực chuẩn của cặp oxi hoá khử nhỏ hơn của Fe.
Kim loại có tính khử càng mạnh thì thế điện cực chuẩn càng nhỏ.
⟹ Chọn đáp án D Đáp án: D
Kim loại có tính khử càng mạnh thì thế điện cực chuẩn càng nhỏ.
⟹ Chọn đáp án D Đáp án: D
Câu 17 [560417]: Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
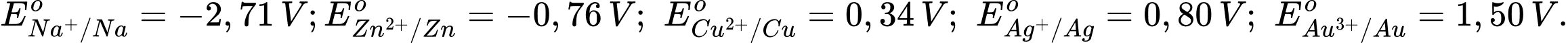
Kim loại nào sau đây có tính khử mạnh hơn kim loại Zn?
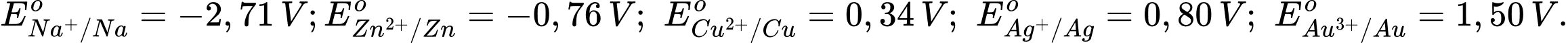
Kim loại nào sau đây có tính khử mạnh hơn kim loại Zn?
A, Ag.
B, Na.
C, Cu.
D, Au.
Kim loại có tính khử mạnh hơn Zn là Na vì có thế điện cực chuẩn của cặp oxi hoá khử nhỏ hơn của Zn.
Kim loại có tính khử càng mạnh thì thế điện cực chuẩn càng nhỏ.
⟹ Chọn đáp án B Đáp án: B
Kim loại có tính khử càng mạnh thì thế điện cực chuẩn càng nhỏ.
⟹ Chọn đáp án B Đáp án: B
Câu 18 [560418]: Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
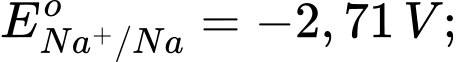
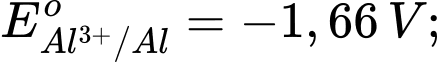
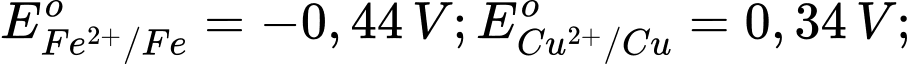
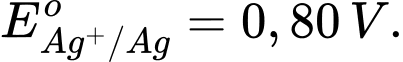
Kim loại nào sau đây có tính khử yếu nhất?
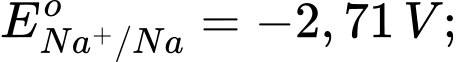
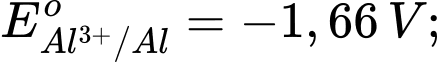
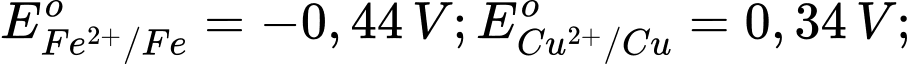
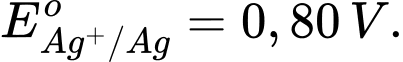
Kim loại nào sau đây có tính khử yếu nhất?
A, Ag.
B, Na.
C, Al.
D, Fe.
Tính khử của một kim loại được thể hiện qua khả năng nhường electron của nó. Kim loại có thế điện cực chuẩn Eo của cặp oxi hóa-khử Mn+/M càng lớn thì tính khử càng yếu, vì kim loại đó khó bị oxi hóa thành ion Mn+.
Phân tích các giá trị thế điện cực chuẩn:
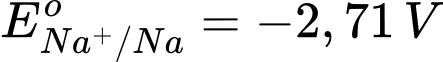 : Kim loại NaNa có tính khử mạnh nhất.
: Kim loại NaNa có tính khử mạnh nhất.
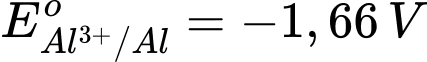 : Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
: Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
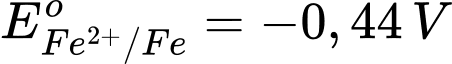 : Kim loại Fe có tính khử yếu hơn Al.
: Kim loại Fe có tính khử yếu hơn Al.
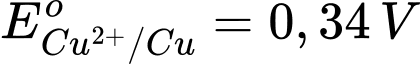 : Kim loại Cu có tính khử yếu hơn Fe.
: Kim loại Cu có tính khử yếu hơn Fe.
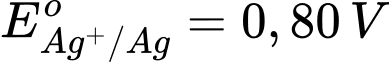 : Kim loại Ag có tính khử yếu nhất trong các kim loại này.
: Kim loại Ag có tính khử yếu nhất trong các kim loại này.
⇒ Chọn đáp án A Đáp án: A
Phân tích các giá trị thế điện cực chuẩn:
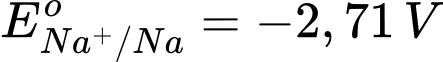 : Kim loại NaNa có tính khử mạnh nhất.
: Kim loại NaNa có tính khử mạnh nhất.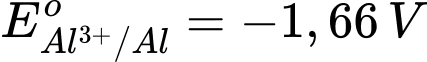 : Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.
: Kim loại Al có tính khử mạnh, nhưng yếu hơn Na.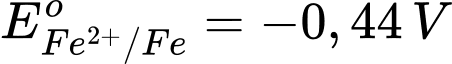 : Kim loại Fe có tính khử yếu hơn Al.
: Kim loại Fe có tính khử yếu hơn Al. 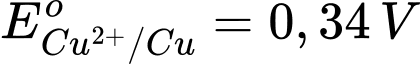 : Kim loại Cu có tính khử yếu hơn Fe.
: Kim loại Cu có tính khử yếu hơn Fe.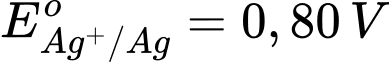 : Kim loại Ag có tính khử yếu nhất trong các kim loại này.
: Kim loại Ag có tính khử yếu nhất trong các kim loại này.⇒ Chọn đáp án A Đáp án: A
Câu 19 [560419]: Ion kim loại nào sau đây có tính oxi hóa mạnh nhất?
A, Cu2+.
B, Mg2+.
C, Pb2+.
D, Ag+.
Tính oxi hóa tăng dần như sau: Mg2+ < Pb2+ < Cu2+ < Ag+.
Vậy ion kim loại có tính oxi hóa mạnh nhất là Ag+.
⟹ Chọn đáp án D Đáp án: D
Vậy ion kim loại có tính oxi hóa mạnh nhất là Ag+.
⟹ Chọn đáp án D Đáp án: D
Câu 20 [560420]: Cho dãy các ion: Fe2+, Ni2+, Cu2+, Sn2+. Trong cùng điều kiện, ion có tính oxi hóa mạnh nhất trong dãy là
A, Sn2+.
B, Ni2+.
C, Cu2+.
D, Fe2+.
Trong cùng điều kiện, tính oxi hóa mạnh nhất trong dãy có xu hướng tăng dần như sau: Fe2+ < Ni2+ < Sn2+ < Cu2+
→ Ion có tính oxi hóa mạnh nhất trong dãy là Cu2+
⟹ Chọn đáp án C Đáp án: C
→ Ion có tính oxi hóa mạnh nhất trong dãy là Cu2+
⟹ Chọn đáp án C Đáp án: C
Câu 21 [824897]: Ion kim loại nào sau đây không bị khử bởi Zn?
A, Cu2+.
B, Ag+.
C, Al3+.
D, Hg2+.
Để một ion kim loại bị khử bởi Zn, kim loại đó phải đứng sau Zn trong dãy điện hóa. Dãy điện hóa được sắp xếp theo chiều tăng dần tính khử (từ trái sang phải) của kim loại và giảm dần tính oxi hóa (từ trái sang phải) của ion kim loại.
Phân tích các đáp án:
❌A. Cu2+ đứng sau Zn nên bị Zn khử.
❌B. Ag+ đứng sau Zn nên bị Zn khử.
✔️C. Al3+ đứng trước Zn nên không bị khử.
❌D. Hg2+ đứng sau Zn nên bị Zn khử.
⟹ Chọn đáp án C Đáp án: C
Phân tích các đáp án:
❌A. Cu2+ đứng sau Zn nên bị Zn khử.
❌B. Ag+ đứng sau Zn nên bị Zn khử.
✔️C. Al3+ đứng trước Zn nên không bị khử.
❌D. Hg2+ đứng sau Zn nên bị Zn khử.
⟹ Chọn đáp án C Đáp án: C
Câu 22 [824901]: Thế điện cực chuẩn 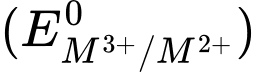 của các kim loại Cr, Mn, Fe và Co lần lượt là –0,408 V; 1,57 V; 0,771 V và 1,97 V. Kim loại nào thay đổi trạng thái oxi hóa từ +2 lên +3 dễ nhất?
của các kim loại Cr, Mn, Fe và Co lần lượt là –0,408 V; 1,57 V; 0,771 V và 1,97 V. Kim loại nào thay đổi trạng thái oxi hóa từ +2 lên +3 dễ nhất?
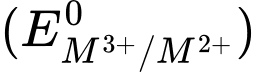 của các kim loại Cr, Mn, Fe và Co lần lượt là –0,408 V; 1,57 V; 0,771 V và 1,97 V. Kim loại nào thay đổi trạng thái oxi hóa từ +2 lên +3 dễ nhất?
của các kim loại Cr, Mn, Fe và Co lần lượt là –0,408 V; 1,57 V; 0,771 V và 1,97 V. Kim loại nào thay đổi trạng thái oxi hóa từ +2 lên +3 dễ nhất? A, Cr.
B, Mn.
C, Fe.
D, Co.
So sánh các giá trị thế điện cực chuẩn, ta thấy Cr có thế điện cực chuẩn thấp nhất (-0,408 V).
Điều này có nghĩa là Cr2+ dễ dàng nhường electron nhất để trở thành Cr3+.
Vậy, kim loại dễ thay đổi trạng thái oxi hóa từ +2 lên +3 nhất là Cr.
⟹ Chọn đáp án A Đáp án: A
Điều này có nghĩa là Cr2+ dễ dàng nhường electron nhất để trở thành Cr3+.
Vậy, kim loại dễ thay đổi trạng thái oxi hóa từ +2 lên +3 nhất là Cr.
⟹ Chọn đáp án A Đáp án: A
Câu 23 [824902]: Phản ứng X + Y2+ → X2+ + Y sẽ tự xảy ra nếu X và Y lần lượt là các chất nào sau đây?
A, Sn và Fe.
B, Mg và Zn.
C, Fe và Mg.
D, Sn và Zn.
Để phản ứng X + Y2+ → X2+ + Y xảy ra tự phát, X phải là chất khử mạnh hơn Y2+. Điều này có nghĩa là thế điện cực chuẩn của cặp X2+/X phải nhỏ hơn thế điện cực chuẩn của cặp Y2+/Y.
Thế điện cực chuẩn của các cặp oxi hóa - khử
Eo Sn2+/Sn = -0,14V
Eo Mg2+/Mg = -2,37V
Eo Fe2+/Fe = -0,44V
Eo Zn2+/Zn = -0,76V
Phân tích các đáp án:
❌A. Sn và Fe. Ta có Eo Sn2+/Sn > Eo Fe2+/Fe (-0,14 > -0,44) . Phản ứng không tự xảy ra theo chiều tự phát.
✔️B. Mg và Zn. Ta có Eo Mg2+/Mg > Eo Zn2+/Zn (-2,37 < -0,76). Phản ứng tự xảy ra theo chiều tự phát.
❌C. Fe và Mg. Ta có Eo Fe2+/Fe > Eo Mg2+/Mg ( -0,44 > -2,37). Phản ứng không tự xảy ra theo chiều tự phát.
❌D. Sn và Zn. Ta có Eo Sn2+/Sn > Eo Zn2+/Zn (-0,14 > -0,76). Phản ứng không tự xảy ra theo chiều tự phát.
⟹ Chọn đáp án B Đáp án: B
Thế điện cực chuẩn của các cặp oxi hóa - khử
Eo Sn2+/Sn = -0,14V
Eo Mg2+/Mg = -2,37V
Eo Fe2+/Fe = -0,44V
Eo Zn2+/Zn = -0,76V
Phân tích các đáp án:
❌A. Sn và Fe. Ta có Eo Sn2+/Sn > Eo Fe2+/Fe (-0,14 > -0,44) . Phản ứng không tự xảy ra theo chiều tự phát.
✔️B. Mg và Zn. Ta có Eo Mg2+/Mg > Eo Zn2+/Zn (-2,37 < -0,76). Phản ứng tự xảy ra theo chiều tự phát.
❌C. Fe và Mg. Ta có Eo Fe2+/Fe > Eo Mg2+/Mg ( -0,44 > -2,37). Phản ứng không tự xảy ra theo chiều tự phát.
❌D. Sn và Zn. Ta có Eo Sn2+/Sn > Eo Zn2+/Zn (-0,14 > -0,76). Phản ứng không tự xảy ra theo chiều tự phát.
⟹ Chọn đáp án B Đáp án: B
Câu 24 [560468]: Cho pin điện Zn-Cu được tạo thành từ hai điện cực Cu2+/Cu và Zn2+/Zn với thế điện cực tương ứng 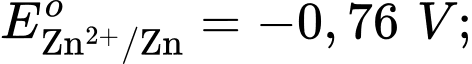
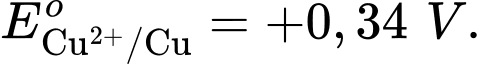 Anode của pin là điện cực của cặp oxi hóa – khử nào?
Anode của pin là điện cực của cặp oxi hóa – khử nào?
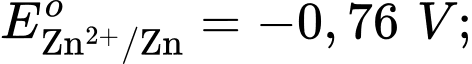
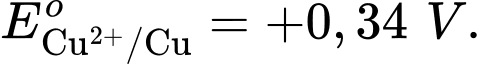 Anode của pin là điện cực của cặp oxi hóa – khử nào?
Anode của pin là điện cực của cặp oxi hóa – khử nào? A, Cu2+/Cu.
B, Zn2+/Zn.
C, Cu2+/Zn.
D, Zn2+/Cu.
Cặp oxi hoá – khử có thế điện cực lớn hơn sẽ là cathode ⇝ Điện cực 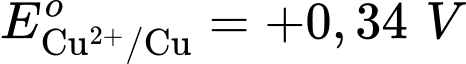 là cathode.
là cathode.
Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực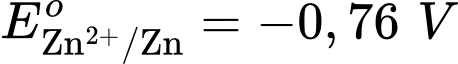 là anode.
là anode.
⟹ Chọn đáp án B Đáp án: B
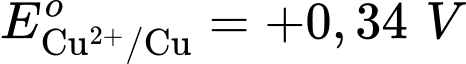 là cathode.
là cathode.Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực
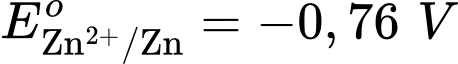 là anode.
là anode.⟹ Chọn đáp án B Đáp án: B
Câu 25 [560469]: Cho pin điện Fe-Cu được tạo thành từ hai điện cực Cu2+/Cu và Fe2+/Fe với thế điện cực tương ứng 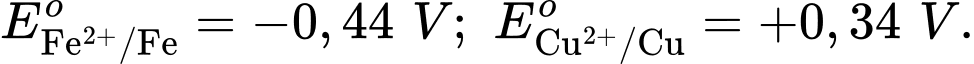 Cathode của pin là điện cực của cặp oxi hóa – khử nào?
Cathode của pin là điện cực của cặp oxi hóa – khử nào?
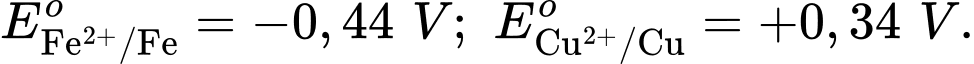 Cathode của pin là điện cực của cặp oxi hóa – khử nào?
Cathode của pin là điện cực của cặp oxi hóa – khử nào? A, Cu2+/Cu.
B, Fe2+/Fe.
C, Cu2+/Fe.
D, Fe2+/Cu.
Cặp oxi hoá – khử có thế điện cực lớn hơn sẽ là cathode ⇝ Điện cực 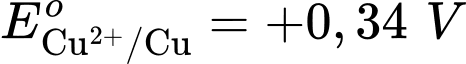 là cathode.
là cathode.
Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực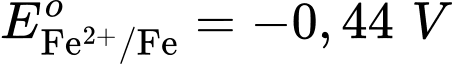 là anode.
là anode.
⟹ Chọn đáp án A Đáp án: A
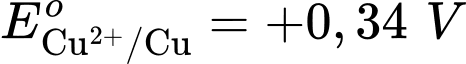 là cathode.
là cathode.Cặp oxi hoá – khử có thế điện cực nhỏ hơn sẽ là anode ⇝ Điện cực
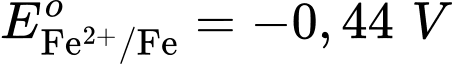 là anode.
là anode.⟹ Chọn đáp án A Đáp án: A
Câu 26 [560470]: Phát biểu nào sau đây là đúng khi nói về pin Galvani?
A, Anode là điện cực dương.
B, Cathode là điện cực âm.
C, Ở cực âm xảy ra quá trình oxi hoá.
D, Dòng electron di chuyển từ cathode sang anode.
- Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, tạo từ hai cặp oxi hoá – khử Xm+/X và Yn⁺/Y (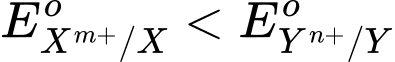 ) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
Anode (-): X → Xm+ + me
Cathode (+) Yn+ + ne → Y
- Sức điện động chuẩn của pin (Eopin) tạo từ hai cặp oxi hoá – khử Xm+/X và Yn⁺/Y (trong đó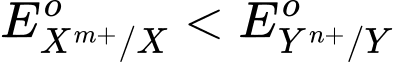 ) được tính theo công thức sau:
) được tính theo công thức sau:
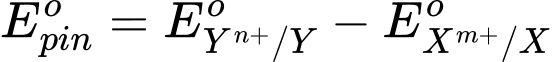
⇒ Chọn đáp án C Đáp án: C
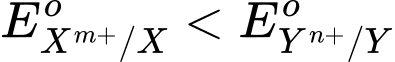 ) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
) trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.Anode (-): X → Xm+ + me
Cathode (+) Yn+ + ne → Y
- Sức điện động chuẩn của pin (Eopin) tạo từ hai cặp oxi hoá – khử Xm+/X và Yn⁺/Y (trong đó
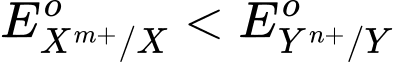 ) được tính theo công thức sau:
) được tính theo công thức sau: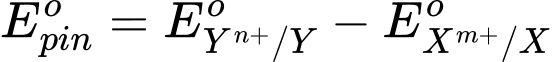
⇒ Chọn đáp án C Đáp án: C
Câu 27 [705910]: Trong pin Galvani, nếu rút cầu muối ra thì hiệu điện thế giữa hai điện cựccủa pin sẽ
A, bằng 0.
B, không thay đổi.
C, tăng từ từ.
D, giảm từ từ.
Dựa vào lí thuyết về pin điện hoá. Trong pin Galvani, nếu rút cầu muối ra thì hiệu điện thế giữa hai điện cực của pin sẽ bằng 0 vì mạch điện không khép kín, nên sẽ không có dòng điện chạy qua hai điện cực.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 28 [824903]: Trong pin Galvani, thành phần nào dưới đây không phải là một phần cấu tạo nhất định phải có trong pin?
A, Điện cực dương.
B, Cầu muối.
C, Dây dẫn.
D, Điện cực âm.
Trong pin Galvani, thành phần không phải là một phần cấu tạo nhất định phải có trong pin: dây dẫn điện.
Giải thích:
- Một pin Galvani được tạo nên từ hai cặp oxi hoá - khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu). Trong đó, kim loại mạnh hơn đóng vai trò anode (điện cực âm của pin), kim loại yếu hơn đóng vai trò cathode (điện cực dương của pin).
- Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối. Cầu muối có vai trò trung hoà điện tích mỗi dung dịch trong pin, duy trì dòng điện trong quá trình hoạt động của pin điện hoá.
Chú ý: Trong pin điện hoá, anode là điện cực âm, nơi xảy ra quá trình oxi hoá (quá trình nhường electron); cathode là điện cực dương, nơi xảy ra quá trình khử (quá trình nhận electron).
⟹ Chọn đáp án C Đáp án: C
Giải thích:
- Một pin Galvani được tạo nên từ hai cặp oxi hoá - khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu). Trong đó, kim loại mạnh hơn đóng vai trò anode (điện cực âm của pin), kim loại yếu hơn đóng vai trò cathode (điện cực dương của pin).
- Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối. Cầu muối có vai trò trung hoà điện tích mỗi dung dịch trong pin, duy trì dòng điện trong quá trình hoạt động của pin điện hoá.
Chú ý: Trong pin điện hoá, anode là điện cực âm, nơi xảy ra quá trình oxi hoá (quá trình nhường electron); cathode là điện cực dương, nơi xảy ra quá trình khử (quá trình nhận electron).
⟹ Chọn đáp án C Đáp án: C
Câu 29 [560472]: Cho một pin điện hoá được tạo bởi các cặp oxi hoá khử Fe2+/Fe, Ag+/Ag ở điều kiện chuẩn. Quá trình xảy ra ở cực âm khi pin hoạt động là
A, Fe(s)  Fe2+(aq) +2e.
Fe2+(aq) +2e.
 Fe2+(aq) +2e.
Fe2+(aq) +2e.B, Fe2+(aq) + 2e  Fe(s).
Fe(s).
 Fe(s).
Fe(s).C, Ag+(aq) + 1e  Ag(s).
Ag(s).
 Ag(s).
Ag(s).D, Ag(s)  Ag+(aq) + 1e.
Ag+(aq) + 1e.
 Ag+(aq) + 1e.
Ag+(aq) + 1e.
Phản ứng oxi hoá – khử diễn ra trong pin: Fe + 2Ag+ → Fe2+ + 2Ag
Trong pin điện hoá, cực âm là anode, xảy ra quá trình nhường electron.
Vậy quá trình xảy ra ở cực âm khi pin hoạt động là:Fe(s) → Fe2+(aq) + 2e.
⟹ Chọn đáp án A
Đáp án: A
Trong pin điện hoá, cực âm là anode, xảy ra quá trình nhường electron.
Vậy quá trình xảy ra ở cực âm khi pin hoạt động là:Fe(s) → Fe2+(aq) + 2e.
⟹ Chọn đáp án A
Câu 30 [560473]: Cathode trong pin điện hoá là điện cực nơi xảy ra
A, Quá trình nhường electron.
B, Quá trình oxi hóa.
C, Quá trình khử.
D, Quá trình các chất tăng số oxi hóa.
Cathode (cực dương) là điện cực tại đó xảy ra quá trình khử: Nm+(aq) + me ⟶ M(s).
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 31 [560474]: Quá trình tổng quát xảy ra ở cathode trong pin điện có thể biểu diễn bằng bán phương trình nào sau đây?
A, M+(aq) + 1e  M(s).
M(s).
 M(s).
M(s).B, Mn+(aq) + ne  M(s).
M(s).
 M(s).
M(s).C, M(s)  Mn+(aq) + ne.
Mn+(aq) + ne.
 Mn+(aq) + ne.
Mn+(aq) + ne.D, M(s)  M+(aq) + 1e.
M+(aq) + 1e.
 M+(aq) + 1e.
M+(aq) + 1e.
Cathode (cực dương) là điện cực tại đó xảy ra quá trình khử:
Mn+(aq) + ne ⟶ M(s).
⟹ Chọn đáp án B Đáp án: B
Mn+(aq) + ne ⟶ M(s).
⟹ Chọn đáp án B Đáp án: B
Câu 32 [560475]: Dây dẫn có tác dụng dẫn các hạt X gián tiếp từ cực âm về cực dương để xảy ra quá trình oxi hóa khử tại các điện cực. Hạt X là
A, Proton.
B, Electron.
C, Neutron.
D, Electron và neutron.
Dây dẫn có tác dụng dẫn các hạt X gián tiếp từ cực âm về cực dương để xảy ra quá trình oxi hóa khử tại các điện cực. Vì trong pin xảy ra quá trình oxi hóa và khử nên có sự trao đổi electron.
⟹ Chọn đáp án B
Đáp án: B
⟹ Chọn đáp án B
Đáp án: B
Câu 33 [560476]: Trong pin điện Zn-Cu, tại anode, Zn chuyển thành ion Zn2+(aq), chúng đồng thời cho đi các electron. Các electron này chảy qua X đến cathode, nơi chúng bị ion Cu2+(aq) nhận lấy và chuyển thành kim loại Cu. X là
A, Cầu muối.
B, Dây dẫn.
C, Dung dịch.
D, Ion.
Trong pin điện Zn-Cu, tại cực dương, Zn chuyển thành ion Zn2+(aq) đồng thời cho các electron đi. Các electron này sẽ chuyển đến cực âm, nơi chúng nhận được ion Cu2+(aq) và chuyển thành kim loại Cu. Vì vậy X trong trường hợp này chính là dây dẫn .
Dây dẫn có vai trò quan trọng trong công việc kết nối cực dương và cực âm, tạo thành mạch kín cho phép dòng electron chuyển từ cực âm sang cực dương.
⟹Chọn đáp án B Đáp án: B
Dây dẫn có vai trò quan trọng trong công việc kết nối cực dương và cực âm, tạo thành mạch kín cho phép dòng electron chuyển từ cực âm sang cực dương.
⟹Chọn đáp án B Đáp án: B
Câu 34 [560477]: Vai trò của cầu muối trong pin điện hóa là
A, Giữ cho nồng độ của tất cả các ion không đổi.
B, Cân bằng điện tích trong các dung dịch.
C, Làm chất xúc tác cho phản ứng oxi hóa – khử xảy ra khi pin hoạt động.
D, Con đường di chuyển của các electron từ cực âm sang cực dương.
Vai trò của cầu muối trong pin điện hóa là
- Duy trì tính trung hòa điện
- Đóng mạch điện
- Ngăn chặn sự trộn lẫn các dịch chuyển.
⟹Chọn đáp án B Đáp án: B
- Duy trì tính trung hòa điện
- Đóng mạch điện
- Ngăn chặn sự trộn lẫn các dịch chuyển.
⟹Chọn đáp án B Đáp án: B
Câu 35 [560527]: Cathode trong bình điện phân là điện cực nơi xảy ra
A, quá trình nhường electron.
B, quá trình oxi hóa.
C, quá trình khử.
D, quá trình các chất tăng số oxi hóa.
Cathode là điện cực xảy ra quá trình khử.
Anode là điện cực xảy ra quá trình oxi hóa.
⟹ Chọn đáp án C Đáp án: C
Anode là điện cực xảy ra quá trình oxi hóa.
⟹ Chọn đáp án C Đáp án: C
Câu 36 [560529]: Quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) thu được đồng thời NaOH và hai đơn chất là
A, O2 và Cl2.
B, H2 và Cl2.
C, H2 và O2.
D, Na và Cl2.
Quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) thu được đồng thời NaOH và hai đơn chất H2 và Cl2.
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án B
Đáp án: B
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án B
Câu 37 [560530]: Ở cathode (cực âm) của bình điện phân sẽ thu được kim loại khi điện phân dung dịch nào sau đây?
A, HCl.
B, NaCl.
C, CuCl2.
D, KNO3.
Tại cathode (-) của 4 bình điện phân: HCl, NaCl, CuCl2, KNO3
★ Cation không bị điện phân: Na+; K+ (nước sẽ bị điện phân)
★ Cation bị điện phân: Cu2+; H+
Cu2+ + 2e ➝ Cu
H+ + 2e ➝ H2
⟹ Dung dịch CuCl2 sẽ thu được kim loại ở cathode.
⟹ Chọn đáp án C Đáp án: C
★ Cation không bị điện phân: Na+; K+ (nước sẽ bị điện phân)
★ Cation bị điện phân: Cu2+; H+
Cu2+ + 2e ➝ Cu
H+ + 2e ➝ H2
⟹ Dung dịch CuCl2 sẽ thu được kim loại ở cathode.
⟹ Chọn đáp án C Đáp án: C
Câu 38 [560532]: Trong công nghiệp, để điều chế NaOH người ta điện phân dung dịch chất X (có màng ngăn). Chất X là
A, Na2SO4.
B, NaNO3.
C, Na2CO3.
D, NaCl.
Trong công nghiệp, để điều chế NaOH người ta điện phân dung dịch NaCl (có màng ngăn)
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án D Đáp án: D
Phương trình điện phân: 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2.
⟹ Chọn đáp án D Đáp án: D
Câu 39 [560533]: Điện phân dung dịch chất T (với điện cực trơ, màng ngăn xốp), thu được dung dịch có chứa chất tan là base. Chất nào sau đây thỏa mãn tính chất của T?
A, CuSO4.
B, AgNO3.
C, FeCl3.
D, NaCl.
Phương trình điện phân:
➝ Dựa vào sản phẩm thì dung dịch NaCl có chứa chất tan là base.
⟹ Chọn đáp án D Đáp án: D
⋆ 2CuSO4 + H2O ➝ 2Cu + 2O2 + H2SO4
⋆ 4AgNO3 + 2H2O ➝ 4Ag + O2 + 4HNO3
⋆ 2FeCl3 + 6H2O ➝ 2Fe(OH)3 + 3Cl2 + 3H2
⋆ 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2
⟹ Chọn đáp án D Đáp án: D
Câu 40 [560534]: Điện phân dung dịch chất E (với điện cực trơ), thu được dung dịch có chứa chất tan là acid. Chất nào sau đây thỏa mãn tính chất của E?
A, K2SO4.
B, CuSO4.
C, NaCl.
D, KNO3.
Phương trình điện phân
⋆ 2CuSO4 + H2O ➝ 2Cu + 2O2 + H2SO4
⋆ 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2
⋆ Điện phân K2SO4, KNO3 thực chất là điện phân H2O : H2O ➝ H2 + O2
⟹ Chọn đáp án B
Đáp án: B
⋆ 2CuSO4 + H2O ➝ 2Cu + 2O2 + H2SO4
⋆ 2NaCl + 2H2O ➝ 2NaOH + H2 + Cl2
⋆ Điện phân K2SO4, KNO3 thực chất là điện phân H2O : H2O ➝ H2 + O2
⟹ Chọn đáp án B
Câu 41 [560535]: Điện phân dung dịch nào sau đây thì có khí thoát ra ở cả 2 điện cực (ngay từ lúc mới đầu bắt đầu điện phân)?
A, Cu(NO3)2.
B, FeCl2.
C, K2SO4.
D, FeSO4.
Vì cation K+ và anion SO42- không bị điện phân trong dung dịch nên thực tế điện phân K2SO4 là điện phân H2O:
⋆ H2O ➝ H2 + O2 ➝ Ở cả 2 điện cực có khí thoát ra ngay lúc mới bắt đầu điện phân.
⟹ Chọn đáp án C
Đáp án: C
⋆ H2O ➝ H2 + O2 ➝ Ở cả 2 điện cực có khí thoát ra ngay lúc mới bắt đầu điện phân.
⟹ Chọn đáp án C
Câu 42 [824904]: Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ?
A, NaBr.
B, NaCl.
C, CuSO4.
D, CuCl2.
Để thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ thì dung dịch đó phải có tính acid.
Phân tích các đáp án:
❌A. Điện phân dung dịch NaBr dung dịch thu được chứa NaOH là một base làm quỳ tim chuyển thành màu xanh.
❌B. Điện phân dung dịch NaCl dung dịch thu được chứa NaOH là một base làm quỳ tím chuyển thành màu xanh.
✔️C. Điện phân dung dịch CuSO4 dung dịch thu được chứa H2SO4 là một acid mạnh làm quỳ tím chuyển thành màu đỏ.
❌D. Điện phân dung dịch CuCl2 dung dịch thu được có tính base làm quỳ tím chuyển thành màu xanh.
⟹ Chọn đáp án C Đáp án: C
Phân tích các đáp án:
❌A. Điện phân dung dịch NaBr dung dịch thu được chứa NaOH là một base làm quỳ tim chuyển thành màu xanh.
❌B. Điện phân dung dịch NaCl dung dịch thu được chứa NaOH là một base làm quỳ tím chuyển thành màu xanh.
✔️C. Điện phân dung dịch CuSO4 dung dịch thu được chứa H2SO4 là một acid mạnh làm quỳ tím chuyển thành màu đỏ.
❌D. Điện phân dung dịch CuCl2 dung dịch thu được có tính base làm quỳ tím chuyển thành màu xanh.
⟹ Chọn đáp án C Đáp án: C
Câu 43 [824910]: Điện phân dung dịch chất nào sau đây (với điện cực trơ, không có màng ngăn điện cực), thu được dung dịch có khả năng tầy màu?
A, CuSO4.
B, NaCl.
C, K2SO4.
D, AgNO3.
Chất có khả năng tẩy màu thường là những chất có tính oxi hóa mạnh, ví dụ như Cl2, O3, hoặc HClO,...
Khi điện phân dung dịch NaCl (nước muối) với điện cực trơ và không có màng ngăn, các phản ứng xảy ra:
Tại anode (oxi hóa):
2Cl- ⟶ Cl2 + H2.
Tại cathode:
2H2O + 2e ⟶ H2 + OH- .
Trong dung dịch:
Khí Cl2 tan trong nước tạo thành HCl và HClO :
Cl2 + H2O ⟶ HCl + HClO.
⟶ HClO có tính oxi hóa ⟶ Có khả năng tẩy màu.
⟹ Chọn đáp án B
Đáp án: B
Khi điện phân dung dịch NaCl (nước muối) với điện cực trơ và không có màng ngăn, các phản ứng xảy ra:
Tại anode (oxi hóa):
2Cl- ⟶ Cl2 + H2.
Tại cathode:
2H2O + 2e ⟶ H2 + OH- .
Trong dung dịch:
Khí Cl2 tan trong nước tạo thành HCl và HClO :
Cl2 + H2O ⟶ HCl + HClO.
⟶ HClO có tính oxi hóa ⟶ Có khả năng tẩy màu.
⟹ Chọn đáp án B
Đáp án: B
Câu 44 [824911]: Trong quá trình điện phân nóng chảy, 1 mol Al3+ được điện phân cần bao nhiêu mol electron?
A, 3.
B, 1.
C, 2.
D, 6.
Trong quá trình điện phân nóng chảy, ion Al3+ sẽ bị khử ở cathode (cực âm) để tạo thành kim loại Al.
Quá trình khử diễn ra như sau: Al3+ +3e →Al.
Mỗi ion Al3+cần 3 electron để khử thành Al kim loại.
Vậy 1 mol Al3+ sẽ cần 3 mol electron.
⟹ Chọn đáp án A Đáp án: A
Quá trình khử diễn ra như sau: Al3+ +3e →Al.
Mỗi ion Al3+cần 3 electron để khử thành Al kim loại.
Vậy 1 mol Al3+ sẽ cần 3 mol electron.
⟹ Chọn đáp án A Đáp án: A
Câu 45 [560536]: Khi điện phân dung dịch NaCl (cực âm bằng sắt, cực dương bằng than chì, có màng ngăn xốp) thì
A, ở cực âm xảy ra quá trình khử H2O và ở cực dương xảy ra quá trình oxi hóa ion Cl–.
B, ở cực âm xảy ra quá trình oxi hóa H2O và ở cực dương xảy ra quá trình khử ion Cl–.
C, ở cực âm xẩy ra quá trình khử ion Na+ và ở cực dương xảy ra quá trình oxi hóa ion Cl–.
D, ở cực dương xảy ra quá trình oxi hóa ion Na+ và ở cực âm xảy ra quá trình khử ion Cl–.
Trong điện phân:
+ Cathode (cực âm) là nơi xảy ra quá trình khử
+ Anode (cực dương) là nơi xảy ra quá trình oxi hóa
Phản ứng điện cực:
Cathode (-): Na+ không bị điện phân => H2O bị khử 2H2O + 2e ➝ H2 + 2OH-
Anode (+): Cl- bị oxi hóa => 2Cl- ➝ Cl2 + 2e.
⟹ Chọn đáp án A Đáp án: A
+ Cathode (cực âm) là nơi xảy ra quá trình khử
+ Anode (cực dương) là nơi xảy ra quá trình oxi hóa
Phản ứng điện cực:
Cathode (-): Na+ không bị điện phân => H2O bị khử 2H2O + 2e ➝ H2 + 2OH-
Anode (+): Cl- bị oxi hóa => 2Cl- ➝ Cl2 + 2e.
⟹ Chọn đáp án A Đáp án: A
Câu 46 [560537]: Trong quá trình điện phân nóng chảy NaCl, ở anode (cực dương) thu được chất nào?
A, Cl2.
B, Na.
C, NaOH.
D, H2.
Dưới tác dụng của điện trường, ion Cl- chạy về cực dương. Tại đây xảy ra quá trình oxi hóa Cl-
2Cl- ➝ Cl2 + 2e
⟹ Chọn đáp án A Đáp án: A
2Cl- ➝ Cl2 + 2e
⟹ Chọn đáp án A Đáp án: A
Câu 47 [560538]: Khi điện phân NaCl nóng chảy (với điện cực trơ), tại cathode xảy ra
A, sự oxi hóa ion Cl–.
B, sự oxi hóa ion Na+.
C, sự khử ion Cl–.
D, sự khử ion Na+.
Cathode là cực âm nên hút các ion dương (Na+), và tại đây xảy ra quá trình khử Na+:
Na+ + 1e ➝ Na
⟹ Chọn đáp án D Đáp án: D
Na+ + 1e ➝ Na
⟹ Chọn đáp án D Đáp án: D
Câu 48 [560539]: Trong quá trình điện phân nóng chảy Al2O3 với anode than chì, hỗn hợp khí thoát ra ở anode gồm O2 và hai khí nào sau đây?
A, Cl2 và F2.
B, H2 và Cl2.
C, CO và CO2.
D, H2 và H2S.
Do điện cực anode làm bằng than chì, khí O2 sinh ra ở nhiệt độ cao đốt cháy C thành CO và CO2:
2C + O2 ➝ 2CO
C + O2 ➝ CO2
⟹Ngoài O2 thì hỗn hợp khí thoát ra ở anode có thêm CO và CO2.
⟹ Chọn đáp án C Đáp án: C
2C + O2 ➝ 2CO
C + O2 ➝ CO2
⟹Ngoài O2 thì hỗn hợp khí thoát ra ở anode có thêm CO và CO2.
⟹ Chọn đáp án C Đáp án: C
Câu 49 [824913]: Ion kim loại nào sau đây bị điện phân trong dung dịch (với điện cực graphite)?
A, Na+.
B, Ag+.
C, Ca2+.
D, Li+.
Trong dung dịch, ion kim loại chỉ bị khử tại cathode (để tạo kim loại) nếu chúng có thế khử chuẩn (Eo) cao hơn nước.
Eo Na+/Na = -2,71V
Eo Ag+/Ag = 0,80V
Eo Ca2+/Ca = -2,87V
Eo Li+/Li = -3,05V.
Eo H2O/H2 = -0,413V.
Các ion như Na+, Li+, Ca2+ có thế khử rất thấp → nước sẽ ưu tiên bị khử hơn → tạo khí H2.
Ion Ag+ có thế khử cao (Eo = +0.80 V) → Ag+ sẽ bị khử thành Ag tại cathode thay vì nước.
⟹ Chọn đáp án B
Câu 50 [824915]: Ion halide nào sau đây hầu như không bị điện phân trong dung dịch?
A, Br–.
B, Cl–.
C, I–.
D, F–.
Trong quá trình điện phân dung dịch, khả năng bị oxi hóa tại anode (cực dương)của các ion halide phụ thuộc vào thế oxi hóa-khử chuẩn (Eo). Các ion có Eo thấp hơn sẽ dễ bị oxi hóa hơn.
Thứ tự khả năng bị oxi hóa của các ion halide: I⁻ > Br⁻ > Cl⁻ > F⁻
Ion F⁻ có thế điệc cực oxi hóa rất lớn nên khó bị oxi hóa tại anode trong điều kiện bình thường - nước sẽ bị oxi hóa ưu tiên hơn.
⟹ Chọn đáp án D Đáp án: D
Thứ tự khả năng bị oxi hóa của các ion halide: I⁻ > Br⁻ > Cl⁻ > F⁻
Ion F⁻ có thế điệc cực oxi hóa rất lớn nên khó bị oxi hóa tại anode trong điều kiện bình thường - nước sẽ bị oxi hóa ưu tiên hơn.
⟹ Chọn đáp án D Đáp án: D