Câu 1 [252345]: Liên kết trong các phân tử đơn chất halogen là
A, cộng hóa trị không cực.
B, cộng hóa trị có cực.
C, liên kết ion.
D, liên kết cho nhận.
Liên kết trong các phân tử đơn chất halogen là liên kết cộng hóa trị không cực.
Các đáp án khác:
B. Liên kết cộng hóa trị có cực là liên kết trong đó cặp electron dùng chung lệch về phía 1 nguyên tử có độ âm điện lớn hơn.
C. Liên kết ion là liên kết là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Điều này thường xảy ra giữa kim loại và phi kim.
D. Liên kết cho nhận là một dạng đặc biệt của liên kết cộng hóa trị trong đó một nguyên tử cung cấp cả hai electron cho cặp electron dùng chung. Điều này không xảy ra trong các phân tử đơn chất halogen.
⟹ Chọn đáp án B Đáp án: A
Các đáp án khác:
B. Liên kết cộng hóa trị có cực là liên kết trong đó cặp electron dùng chung lệch về phía 1 nguyên tử có độ âm điện lớn hơn.
C. Liên kết ion là liên kết là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Điều này thường xảy ra giữa kim loại và phi kim.
D. Liên kết cho nhận là một dạng đặc biệt của liên kết cộng hóa trị trong đó một nguyên tử cung cấp cả hai electron cho cặp electron dùng chung. Điều này không xảy ra trong các phân tử đơn chất halogen.
⟹ Chọn đáp án B Đáp án: A
Câu 2 [252359]: Halogen nào là nguyên tố phi kim mạnh nhất trong bảng tuần hoàn?
A, Chlorine.
B, Bromine.
C, Iodine.
D, Fluorine.
Dựa vào sự biến đổi tính phi kim của các nguyên tố trong một nhóm A, dựa vào bảng độ âm điện của các nguyên tố trong nhóm Halogen trong nhóm halogen tính oxi hóa, tính phi kim: F2>Cl2>Br2>I2.
⟹ Chọn đáp án D Đáp án: D
⟹ Chọn đáp án D Đáp án: D
Câu 3 [252418]: Nguyên tố chlorine không có khả năng thể hiện số oxi hoá nào dưới đây?
A, +3.
B, 0.
C, +1.
D, +2.
- Fluorine là nguyên tố có độ âm điện lớn nhất nên sẽ luôn nhận cặp electron trong liên kết ion. Do đó trong hợp chất fluorine luôn thể hiện số oxi hoá là –1.
- Các nguyên tử chlorine, bromine và iodine ở trạng thái cơ bản và kích thích có thể tạo ra 1, 3, 5 và 7 electron độc thân
⟹ Có thể thể hiện số oxi hoá –1, +1, +3, +5 và +7 trong hợp chất.
⟹ Chọn đáp án D Đáp án: D
- Các nguyên tử chlorine, bromine và iodine ở trạng thái cơ bản và kích thích có thể tạo ra 1, 3, 5 và 7 electron độc thân
⟹ Có thể thể hiện số oxi hoá –1, +1, +3, +5 và +7 trong hợp chất.
⟹ Chọn đáp án D Đáp án: D
Câu 4 [252424]: Các halogen có tính chất hóa học gần giống nhau vì có cùng
A, cấu hình e lớp ngoài cùng.
B, tính oxi hóa mạnh.
C, số electron độc thân.
D, số lớp electron.
Halogen là các nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn. Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA là ns2np5 có nghĩa là có 7 electron lớp ngoài cùng.
Số electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố. Vì các halogen có cùng số electron lớp ngoài cùng, chúng có tính chất hóa học gần giống nhau, đặc biệt là xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm.
⟹ Chọn đáp án A Đáp án: A
Số electron lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố. Vì các halogen có cùng số electron lớp ngoài cùng, chúng có tính chất hóa học gần giống nhau, đặc biệt là xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm.
⟹ Chọn đáp án A Đáp án: A
Câu 5 [252629]: Để khắc chữ lên thủy tinh người ta dùng chất nào?

Hình 7.69. Ly thủy tinh được khắc chữ
A, HF đặc.
B, HCl đặc.
C, HI đặc.
D, HBr đặc.
Thủy tinh có thành phần chính SiO2. Dung dịch HF có khả năng phản ứng với SiO2, còn HCl, HI, HBr không phản ứng.
4HF + SiO2 → SiF4 + 2H2O
⟹ Để khắc chữ lên thủy tinh người ta dùng HF đặc.
⟹ Chọn đáp án A
Đáp án: A ⟹ Để khắc chữ lên thủy tinh người ta dùng HF đặc.
⟹ Chọn đáp án A
Câu 6 [823639]: Khí chlorine được sử dụng rộng rãi để xử lí nước bị ô nhiễm. Khi dẫn khí chlorine vào nước, phản ứng sẽ tạo thành hợp chất/ion nào có vai trò tiêu diệt vi khuẩn?
A, 

B, 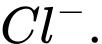
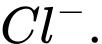
C, HCl.
D, 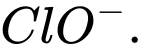
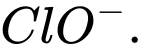
Khí chlorine được sử dụng rộng rãi để xử lí nước bị ô nhiễm. Khi dẫn khí chlorine vào nước, phản ứng sẽ tạo thành ion ClO- có vai trò tiêu diệt vi khuẩn.
Khí chlorine phản ứng với nước theo phương trình:
Cl2 + H2O ⟶ HCl + HClO
Acid hypochlorơ (HClO) có tính oxi hóa mạnh và có tính diệt khuẩn, nó phân li một phần trong nước tạo thành ion ClO-.
⟹ Chọn đáp án D
Khí chlorine phản ứng với nước theo phương trình:
Cl2 + H2O ⟶ HCl + HClO
Acid hypochlorơ (HClO) có tính oxi hóa mạnh và có tính diệt khuẩn, nó phân li một phần trong nước tạo thành ion ClO-.
⟹ Chọn đáp án D
Câu 7 [823640]: Dưới đây là một số ứng dụng của chlorine và bromide. Ứng dụng nào là của bromine?
A, Sản xuất chất tảy trắng vải và giấy.
B, Tạo khí CFC dùng trong máy lạnh.
C, Làm chất chống cháy và bình chữa cháy.
D, Làm polymer PVC.
Phân tích các đáp án:
❌Sai. A. Sản xuất chất tẩy trắng vải và giấy đây là ứng dụng của chlorine.
❌Sai. B. Tạo khí CFC dùng trong máy lạnh.CFC là các hợp chất chứa chlorine, fluorine và carbon. Chúng đã từng được sử dụng làm chất làm lạnh , nhưng hiện nay bị cấm do gây hại cho tầng ozone.
✔️Đúng. C. Làm chất chống cháy và bình chữa cháy là ứng dụng của bromine.
❌Sai. D. Làm polymer PVC là một loại nhựa được tạo ra từ vinyl chlorine là một hợp chất của chlorine.
⟹Chọn đáp án C
❌Sai. A. Sản xuất chất tẩy trắng vải và giấy đây là ứng dụng của chlorine.
❌Sai. B. Tạo khí CFC dùng trong máy lạnh.CFC là các hợp chất chứa chlorine, fluorine và carbon. Chúng đã từng được sử dụng làm chất làm lạnh , nhưng hiện nay bị cấm do gây hại cho tầng ozone.
✔️Đúng. C. Làm chất chống cháy và bình chữa cháy là ứng dụng của bromine.
❌Sai. D. Làm polymer PVC là một loại nhựa được tạo ra từ vinyl chlorine là một hợp chất của chlorine.
⟹Chọn đáp án C
Câu 8 [823646]: Chất nào sau đây có nhiệt độ sôi thấp nhất
A, HF.
B, HBr.
C, HCl.
D, HI.
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Riêng HF có nhiệt độ sôi cao nhất, cao bất thường do tạo được liên kết hydrogen liên phân tử.
- Giải thích: Khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.
⟹ Chất có nhiệt độ sôi thấp nhất là: HCl
⟹ Chọn đáp án C Đáp án: C
- Giải thích: Khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.
⟹ Chất có nhiệt độ sôi thấp nhất là: HCl
⟹ Chọn đáp án C Đáp án: C
Câu 9 [706034]: Trong phòng thí nghiệm, một lượng nhỏ hydrogen chloride có thể được điều chế bằng phản ứng trực tiếp giữa dung dịch sodium chloride và dung dịch sulfuric acid đặc như hình dưới đây:
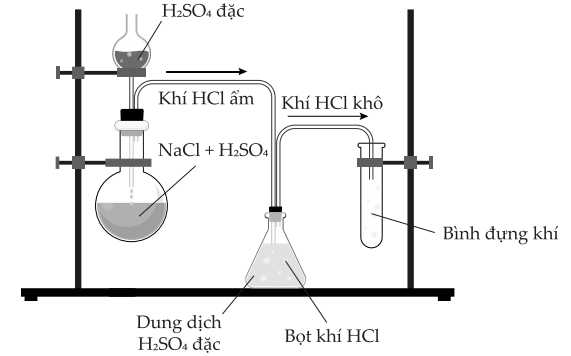
Tuy nhiên, phương pháp này không thể dùng để điều chế hydrogen bromide, do không thu được HBr từ phản ứng giữa NaBr và H2SO4 đặc:
2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g).
Cho các ohát biểu sau:
(a) Anion Cl– không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
(b) Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này.
(c) Trong thực tế, người ta điều chế HF cũng bằng thí nghiệm theo thiết kế ở hình trên.
(d) Tính khử của anion Br– yếu hơn anion Cl–.
Trong các phát biểu trên, những phát biểu đúng là

Tuy nhiên, phương pháp này không thể dùng để điều chế hydrogen bromide, do không thu được HBr từ phản ứng giữa NaBr và H2SO4 đặc:
2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g).
Cho các ohát biểu sau:
(a) Anion Cl– không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
(b) Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này.
(c) Trong thực tế, người ta điều chế HF cũng bằng thí nghiệm theo thiết kế ở hình trên.
(d) Tính khử của anion Br– yếu hơn anion Cl–.
Trong các phát biểu trên, những phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (c).
D, (c), (d).
Phân tích các đáp án :
✔️(a) – Đúng. Anion Cl- không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
✔️(b) – Đúng. Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này, ion I- có tính khử mạnh hơn Br- nên sử dụng H2SO4 đặc sẽ không thu được HI tương ứng.
8NaI + 5H2SO4 → H2S + 4I2 + 4Na2SO4 + 4H2O
❌(c) – Sai. Để điều chế HF, người ta dùng phương pháp sulfate. Đó là cho H2SO4 đặc tác dụng với muối floride, chloride vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF. Hay nói cách khác là HF có tính khử yếu, chúng không khử được H2SO4 đặc. Nhưng để điều chế HF, cần sử dụng phương pháp úp bình do HF nhẹ hơn không khí.
❌(d) - Sai . Br- có tính khử mạnh hơn Cl- vì brom có kích thước nguyên tử lớn hơn clo, lực hút giữa hạt nhân và electron ngoài cùng yếu hơn, nên Br- dễ nhường electron hơn Cl-
⟹Chọn đáp án A Đáp án: A
✔️(a) – Đúng. Anion Cl- không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
✔️(b) – Đúng. Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này, ion I- có tính khử mạnh hơn Br- nên sử dụng H2SO4 đặc sẽ không thu được HI tương ứng.
8NaI + 5H2SO4 → H2S + 4I2 + 4Na2SO4 + 4H2O
❌(c) – Sai. Để điều chế HF, người ta dùng phương pháp sulfate. Đó là cho H2SO4 đặc tác dụng với muối floride, chloride vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF. Hay nói cách khác là HF có tính khử yếu, chúng không khử được H2SO4 đặc. Nhưng để điều chế HF, cần sử dụng phương pháp úp bình do HF nhẹ hơn không khí.
❌(d) - Sai . Br- có tính khử mạnh hơn Cl- vì brom có kích thước nguyên tử lớn hơn clo, lực hút giữa hạt nhân và electron ngoài cùng yếu hơn, nên Br- dễ nhường electron hơn Cl-
⟹Chọn đáp án A Đáp án: A
Câu 10 [823647]: Trong khí quyển Trái Đất, nguyên tố nào phổ biến nhất?
A, Nitrogen.
B, Oxygen.
C, Neon.
D, Hydrogen.
Khí quyển Trái Đất là lớp các chất khí bao quanh và được giữ lại bởi lực hấp dẫn của Trái Đất. Thành phần khí quyển gồm có nitrogen chiếm 78%, oxygen chiếm 21% , argon, carbon dioxide, hơi nước và một số chất khí khác(helium, neon, methane, hydrogen, …) chiếm 1%.
⟹ Nitrogen là nguyên tố phổ biến nhất trong Trái Đất.
⟹ Chọn đáp án A
⟹ Nitrogen là nguyên tố phổ biến nhất trong Trái Đất.
⟹ Chọn đáp án A
Câu 11 [823651]: Phân tử nitrogen có cấu tạo là?
A, N = N.
B, N ≡N.
C, N ‒ N.
D, N → N.
Phân tử nitrogen có cấu tạo là N ≡N.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 12 [823653]: Nitrogen được sản xuất chủ yếu ở dạng?
A, Khí.
B, Lỏng.
C, Bột mịn.
D, Tinh thể.
Nitrogen được sản xuất công nghiệp chủ yếu ở dạng khí bằng phương pháp chưng cất phân đoạn không khí lỏng.
Nitrogen lỏng cũng được sản xuất nhưng không phải là dạng chính.
Nitrogen không tồn tại ở dạng bột mịn hoặc tinh thể trong điều kiện bình thường.
⟹ Chọn đáp án A Đáp án: A
Nitrogen lỏng cũng được sản xuất nhưng không phải là dạng chính.
Nitrogen không tồn tại ở dạng bột mịn hoặc tinh thể trong điều kiện bình thường.
⟹ Chọn đáp án A Đáp án: A
Câu 13 [186512]: Khí nào dưới đây không độc đối với cơ thể người?
A, Cl2.
B, N2.
C, NO2.
D, SO2.
Phân tích các phát biểu:
❌Sai. a. Cl2 (Chlorine): Chlorine là một khí độc, có tính oxi hóa mạnh, gây kích ứng đường hô hấp và có thể gây tử vong nếu hít phải nồng độ cao.
✔️Đúng. b. N2(Nitrogen): Nitrogen là một khí trơ, chiếm khoảng 78% thể tích không khí. Ở điều kiện bình thường, nitrogen không độc đối với cơ thể người.
❌Sai. c. NO2 (Nitơ đioxide): Nitơ đioxide là một khí độc, gây kích ứng đường hô hấp và có thể gây tổn thương phổi.
❌Sai. d. SO2(Lưu huỳnh đioxide): Lưu huỳnh đioxide là một khí độc, gây kích ứng đường hô hấp và có thể gây ra các vấn đề về hô hấp.
Khí N2 không độc đối với cơ thể người.
Chọn đáp án B Đáp án: B
❌Sai. a. Cl2 (Chlorine): Chlorine là một khí độc, có tính oxi hóa mạnh, gây kích ứng đường hô hấp và có thể gây tử vong nếu hít phải nồng độ cao.
✔️Đúng. b. N2(Nitrogen): Nitrogen là một khí trơ, chiếm khoảng 78% thể tích không khí. Ở điều kiện bình thường, nitrogen không độc đối với cơ thể người.
❌Sai. c. NO2 (Nitơ đioxide): Nitơ đioxide là một khí độc, gây kích ứng đường hô hấp và có thể gây tổn thương phổi.
❌Sai. d. SO2(Lưu huỳnh đioxide): Lưu huỳnh đioxide là một khí độc, gây kích ứng đường hô hấp và có thể gây ra các vấn đề về hô hấp.
Khí N2 không độc đối với cơ thể người.
Chọn đáp án B Đáp án: B
Câu 14 [823654]: Trong khí quyển nitrogen tồn tại chủ yếu ở dạng?
A, Đơn chất.
B, Hợp chất vô cơ.
C, Hợp chất hữu cơ.
D, Ion.
Trong khí quyển nitrogen tồn tại chủ yếu ở dạng đơn chất.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
Câu 15 [823655]: Ở trạng thái lỏng nguyên chất, phân tử hợp chất nào sau đây tạo được liên kết hydrogen với nhau?
A, Nitrogen.
B, Ammonia.
C, Oxygen.
D, Nitrogen oxide.
Phân tích các đáp án:
❌Sai. A. Nitrogen là một phân tử không phân cực nên không tạo được liên kết hydrogen.
✔️Đúng. B. Ammonia có liên kết N-H phân cực do đó có thể tạo liên kết hydrogen.
❌Sai. C. Oxygen là một phân tử không phân cực nên không tạo được liên kết hydrogen.
❌Sai. D. Nitrogen oxide là một phân tử phân cực nên nhưng nó không có liên kết N-H hoặc O-H nên không thể tạo đượ liên kết hydrogen.
⟹ Chọn đáp án B Đáp án: B
❌Sai. A. Nitrogen là một phân tử không phân cực nên không tạo được liên kết hydrogen.
✔️Đúng. B. Ammonia có liên kết N-H phân cực do đó có thể tạo liên kết hydrogen.
❌Sai. C. Oxygen là một phân tử không phân cực nên không tạo được liên kết hydrogen.
❌Sai. D. Nitrogen oxide là một phân tử phân cực nên nhưng nó không có liên kết N-H hoặc O-H nên không thể tạo đượ liên kết hydrogen.
⟹ Chọn đáp án B Đáp án: B
Câu 16 [823656]: Khi tác dụng với dung dịch hydrochloric acid, ammonia đóng vai trò là
A, acid.
B, base.
C, chất khử.
D, chất oxi hóa.
Khi tác dụng với dung dịch hydrochloric acid, ammonia đóng vai trò là base do phân tử ammonia nhận proton.
NH3 + HCl ⇄ NH4+ + Cl-.
⟹ Chọn đáp án B Đáp án: B
NH3 + HCl ⇄ NH4+ + Cl-.
⟹ Chọn đáp án B Đáp án: B
Câu 17 [823658]: Khí nào sau đây trực tiếp tạo thành từ nitrogen và oxygen trong những cơn mưa dông kèm sấm sét?
A, N2O.
B, NO.
C, NH3.
D, N2O5.
Khí NO được tạo thành từ nitrogen và oxygen trong những cơn mưa dông kèm sấm sét.
Các đáp án khác:
A. N2O. Là một khí gây mê không được điều chế trực tiếp từ nitrogen và oxygen trong cơn mưa dông sấm sét.
C. NH3 là khí ammonia được tạo ra từ nitrogen và hydrogen.
D. N2O5 là một chất oxi hóa mạnh không được tạo ra trực tiếp từ cơn mưa dông kèm sấm chớp.
⟹ Chọn đáp án B Đáp án: B
Các đáp án khác:
A. N2O. Là một khí gây mê không được điều chế trực tiếp từ nitrogen và oxygen trong cơn mưa dông sấm sét.
C. NH3 là khí ammonia được tạo ra từ nitrogen và hydrogen.
D. N2O5 là một chất oxi hóa mạnh không được tạo ra trực tiếp từ cơn mưa dông kèm sấm chớp.
⟹ Chọn đáp án B Đáp án: B
Câu 18 [679355]: Cho vài giọt quỳ tím vào dung dịch NH3 thì dung dịch chuyển thành
A, màu đỏ.
B, màu vàng.
C, màu xanh.
D, màu hồng.
Dung dịch ammonia (NH3) có tính base khi cho vài giọt quỳ tím vào thì dung dịch chuyển thành màu xanh.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 19 [705495]: Nitrogen trong không khí có vai trò nào sau đây?
A, Hình thành sấm sét.
B, Tham gia quá trình quang hợp của cây.
C, Tham gia hình thành mây.
D, Cung cấp đạm tự nhiên cho cây trồng.
❌ A. Sấm sét là hiện tượng do sự phóng điện trong khí quyển, không phải do nitrogen gây ra. Tuy nhiên, sấm sét giúp chuyển hóa nitrogen thành hợp chất có ích cho cây, chứ nitrogen không phải là nguyên nhân hình thành sấm sét.
❌ B. Quang hợp chủ yếu sử dụng CO2, nước và ánh sáng để tổng hợp chất hữu cơ, không liên quan trực tiếp đến nitrogen trong không khí.
❌ C. Mây được hình thành do sự ngưng tụ của hơi nước trong không khí, không liên quan đến nitrogen.
✔️ D. Trong không khí nitrogen chiếm khoảng 78% thể tích, nhờ các quá trình tự nhiên như sấm sét mà nitrogen chuyển hóa thành các hợp chất mà cây có thể hấp thu được , đó là đạm tự nhiên cho cây.
⇒ Chọn đáp án D Đáp án: D
❌ B. Quang hợp chủ yếu sử dụng CO2, nước và ánh sáng để tổng hợp chất hữu cơ, không liên quan trực tiếp đến nitrogen trong không khí.
❌ C. Mây được hình thành do sự ngưng tụ của hơi nước trong không khí, không liên quan đến nitrogen.
✔️ D. Trong không khí nitrogen chiếm khoảng 78% thể tích, nhờ các quá trình tự nhiên như sấm sét mà nitrogen chuyển hóa thành các hợp chất mà cây có thể hấp thu được , đó là đạm tự nhiên cho cây.
⇒ Chọn đáp án D Đáp án: D
Câu 20 [186489]: Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí ammonia là
A, giấy quỳ chuyển sang màu đỏ.
B, giấy quỳ chuyển sang màu xanh.
C, giấy quỳ mất màu.
D, giấy quỳ không chuyển màu.
Dung dịch ammonia mới làm đổi màu quỳ tím thành màu xanh, khí ammonia không làm đổi màu quỳ.
⟹ Chọn đáp án D
Đáp án: D
⟹ Chọn đáp án D
Đáp án: D
Câu 21 [186582]: Trong phân tử HNO3, nguyên tử N có
A, số oxi hoá +2.
B, số oxi hoá +5.
C, số oxi hoá +4.
D, số oxi hoá +3.
Trong phân tử HNO3, nguyên tử N có số oxi hoá +5
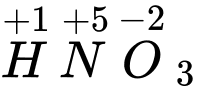
⟹ Chọn đáp án B. Đáp án: B
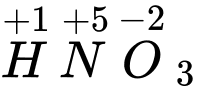
⟹ Chọn đáp án B. Đáp án: B
Câu 22 [823659]: Nitric acid dễ bị phân hủy bởi ánh sáng hoặc nhiệt độ, tạo thành các sản phẩm là
A, NO2, H2O.
B, NO2, O2, H2O.
C, N2, O2, H2O.
D, N2, H2O.
Nitric acid là một acid mạnh dễ bị phân hủy bởi ánh sáng hoặc nhiệt độ, tạo thành sản phẩm là: NO2, O2, H2O.
Phương trình phân hủy là:
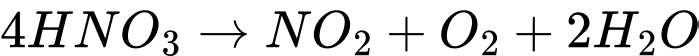
⟹ Chọn đáp án B Đáp án: B
Phương trình phân hủy là:
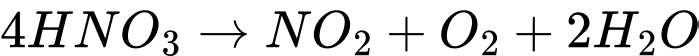
⟹ Chọn đáp án B Đáp án: B
Câu 23 [823660]: Ứng dụng nào sau đây không phải của nitrogen?
A, Bảo quản mẫu vật phẩm trong y học.
B, Làm căng vỏ bao bì thực phẩm như snack.
C, Tổng hợp ammonia.
D, Làm chất tẩy trắng và diệt khuẩn trong bể bơi.
🌟Ứng dụng của nitrogen là:
Nitrogen được ứng dụng để làm lạnh (nitrogen lỏng), là nguyên liệu điều chế ammonia, tạo khí quyển trơ và bảo vệ thực phẩm
🌟 Ứng dụng của nitrogen lỏng trong y tế và công nghiệp thực phẩm.
+ Nitrogen lỏng làm đóng băng mô tế bào ngay khi tiếp xúc nên được ứng dụng để điều trị mụn cóc và một số bệnh ngoài da.
+ Nitrogen lỏng còn được phun vào vỏ bao bì để làm căng vỏ bao bì giúp tránh va chạm trong quá trình vận chuyển và bảo quản thực phẩm.
⟹ Làm chất tẩy trắng và diệt khuẩn trong bể bơi không phải ứng dụng của nitrogen.
⟹ Chọn đáp án D
Đáp án: D
Nitrogen được ứng dụng để làm lạnh (nitrogen lỏng), là nguyên liệu điều chế ammonia, tạo khí quyển trơ và bảo vệ thực phẩm
🌟 Ứng dụng của nitrogen lỏng trong y tế và công nghiệp thực phẩm.
+ Nitrogen lỏng làm đóng băng mô tế bào ngay khi tiếp xúc nên được ứng dụng để điều trị mụn cóc và một số bệnh ngoài da.
+ Nitrogen lỏng còn được phun vào vỏ bao bì để làm căng vỏ bao bì giúp tránh va chạm trong quá trình vận chuyển và bảo quản thực phẩm.
⟹ Làm chất tẩy trắng và diệt khuẩn trong bể bơi không phải ứng dụng của nitrogen.
⟹ Chọn đáp án D
Đáp án: D
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 24 – 25:
Hãy xem xét hỗn hợp ban đầu của khí N2 và H2 có thể được biểu diễn như sau:
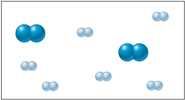
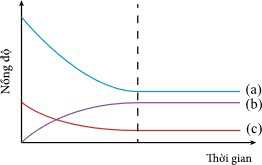
Các khí phản ứng tạo thành khí ammonia (NH3) và nồng độ của các chất biến đổi theo thời gian được biểu diễn bằng sơ đồ sau:

Các khí phản ứng tạo thành khí ammonia (NH3) và nồng độ của các chất biến đổi theo thời gian được biểu diễn bằng sơ đồ sau:

Câu 24 [706332]: Đồ thị hình bên biểu diễn nồng độ các chất trong phản ứng theo thời gian. Đường biểu diễn nồng độ của NH3 là
A, đường (a).
B, đường (b).
C, đường (c).
D, cả đường (a) và (b).
Từ đồ thị, NH3 là sản phẩm sau thời gian phản ứng nồng độ NH3 tăng dần đến khi phản ứng đặt trạng thái cân bằng.
→ Đường (b) phù hợp với NH3
⟹ Chọn đáp án B Đáp án: B
→ Đường (b) phù hợp với NH3
⟹ Chọn đáp án B Đáp án: B
Câu 25 [706333]: Nếu coi nồng độ của N2 trong hỗn hợp ban đầu là 2 M và tại nhiệt độ t oC, hằng số cân bằng KC là 3,125. Nồng độ sản phẩm NH3 tại thời điểm cân bằng là
A, 0,56.
B, 1,44.
C, 2,88.
D, 2,42.
Từ hình minh họa thấy rằng tỉ lệ số nguyên tử của N2 và H2 là 1:3
Trong hỗn hợp ban đầu N2 có nồng độ là 2 M → Nồng độ của H2 là 6M
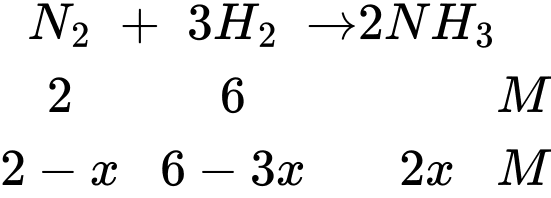
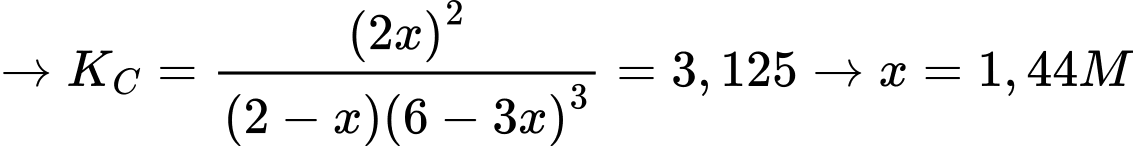
Nồng độ sản phẩm là 2x = 2,88 M
⟹ Chọn đáp án C Đáp án: C
Trong hỗn hợp ban đầu N2 có nồng độ là 2 M → Nồng độ của H2 là 6M
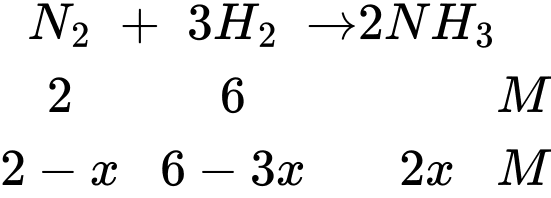
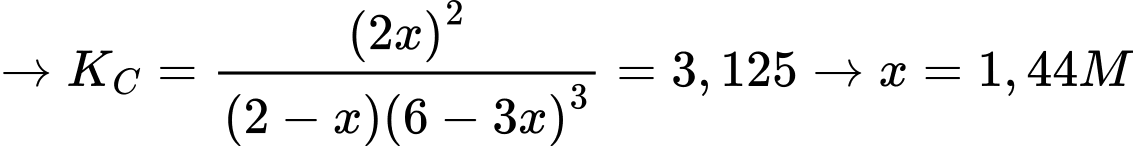
Nồng độ sản phẩm là 2x = 2,88 M
⟹ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 26 – 27:
Quy trình Haber được sử dụng trong công nghiệp để sản xuất ra ammonia, phần lớn dùng để sản xuất phân bón, phương trình được biểu diễn như sau:
Phản ứng của nitrogen N2 và hydrogen H2 để điều chế ra ammonia NH3 là một phản ứng thuận nghịch.
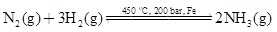
Phản ứng của nitrogen N2 và hydrogen H2 để điều chế ra ammonia NH3 là một phản ứng thuận nghịch.
Câu 26 [706175]: Xét các tác động sau đến cân bằng của phản ứng tổng hợp NH3:
(a) tăng áp suất;
(b) tăng nồng độ N2 và H2;
(c) tăng nhiệt độ;
(d) giảm nồng độ NH3;
(e) thêm chất xúc tác Fe.
Trong những tác động trên, có bao nhiêu tác động làm tăng hiệu suất của phản ứng tổng hợp?
(a) tăng áp suất;
(b) tăng nồng độ N2 và H2;
(c) tăng nhiệt độ;
(d) giảm nồng độ NH3;
(e) thêm chất xúc tác Fe.
Trong những tác động trên, có bao nhiêu tác động làm tăng hiệu suất của phản ứng tổng hợp?
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các đáp án:
✔️(a) – Đúng. Tăng áp suất làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
✔️(b) – Đúng. Tăng nồng độ N2 và H2 cân bằng chuyển dịch theo chiều làm giảm N2, H2 nghĩa là chiều thuận.
❌(c) – Sai. Khi tăng nhiệt độ cân bằng chuyển dịch theo nghịch, giảm hiệu suất phản ứng.
✔️(d) – Đúng. Khi giảm nồng độ NH3 làm cân bằng chuyển dịch theo chiều tăng nồng độ NH3 làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
❌(e) – Sai. Chất xúc tác không làm ảnh hưởng đến chuyển dịch cân bằng.
Có 3 tác động làm tăng hiệu suất.
⟹Chọn đáp án C Đáp án: C
✔️(a) – Đúng. Tăng áp suất làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
✔️(b) – Đúng. Tăng nồng độ N2 và H2 cân bằng chuyển dịch theo chiều làm giảm N2, H2 nghĩa là chiều thuận.
❌(c) – Sai. Khi tăng nhiệt độ cân bằng chuyển dịch theo nghịch, giảm hiệu suất phản ứng.
✔️(d) – Đúng. Khi giảm nồng độ NH3 làm cân bằng chuyển dịch theo chiều tăng nồng độ NH3 làm cân bằng chuyển dịch theo chiều thuận, tăng hiệu suất phản ứng.
❌(e) – Sai. Chất xúc tác không làm ảnh hưởng đến chuyển dịch cân bằng.
Có 3 tác động làm tăng hiệu suất.
⟹Chọn đáp án C Đáp án: C
Câu 27 [382567]: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol tương ứng 4 : 1), trong bình kín có xúc tác, thu được hỗn hợp khí, đồng thời thấy áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng tổng hợp là
A, 20%.
B, 22,5%.
C, 25%.
D, 27%.
Tỉ lệ mol của H2 và N2 là 4:1
Giả sử có 4 mol H2 và 1 mol N2
Gọi áp xuất ban đầu là p
Áp suất tỉ lệ thuận với số mol khí → 4 + 1 = p (1)
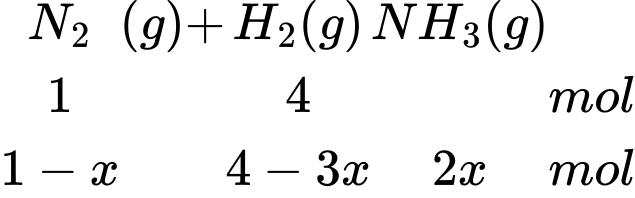
Tổng số mol khí sau phản ứng là: nH2 + nN2 + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x (mol)
Sau phản ứng số áp suất khí của hệ giảm đi 9% so với ban đầu → 5 – 2x = 0,91p (2)
Ta có: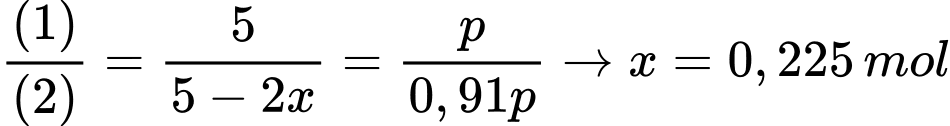
Hiệu suất của phản ứng là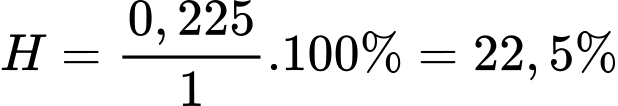
⇒ Chọn đáp án B Đáp án: B
Giả sử có 4 mol H2 và 1 mol N2
Gọi áp xuất ban đầu là p
Áp suất tỉ lệ thuận với số mol khí → 4 + 1 = p (1)
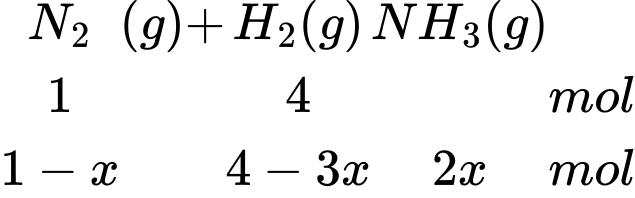
Tổng số mol khí sau phản ứng là: nH2 + nN2 + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x (mol)
Sau phản ứng số áp suất khí của hệ giảm đi 9% so với ban đầu → 5 – 2x = 0,91p (2)
Ta có:
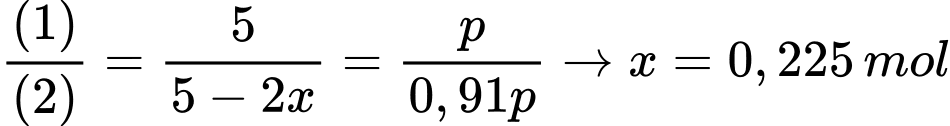
Hiệu suất của phản ứng là
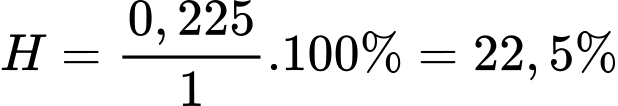
⇒ Chọn đáp án B Đáp án: B
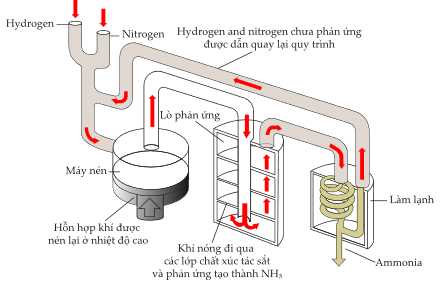
Câu 28 [704004]: Quy trình Haber được phát triển vào năm 1915 và bao gồm việc bổ sung nitrogen và hydrogen để tạo thành ammonia. Ammonia được tạo ra sau đó được sử dụng làm nguyên liệu để sản xuất phân bón:
(*) N2(g) + 3H2(g)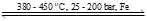 2NH3(g);
2NH3(g); 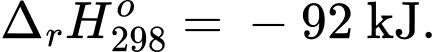
Cho các phát biểu sau:
(a) Chiều thuận của phản ứng (*) là quá trình tỏa nhiệt.
(b) Khi tăng áp suất, cân bằng của phản ứng (*) chuyển dịch theo chiều nghịch.
(c) Chất xúc tác (Fe) giúp phản ứng nhanh đạt trạng thái cân bằng.
(d) NH3 có nhiệt độ sôi cao hơn N2 và H2.
(e) N2 và H2 dư có thể được đưa trở lại hỗn hợp ban đầu để tái sử dụng.
Số phát biểu đúng là

(*) N2(g) + 3H2(g)
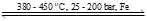 2NH3(g);
2NH3(g); 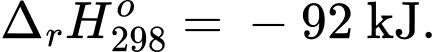
Cho các phát biểu sau:
(a) Chiều thuận của phản ứng (*) là quá trình tỏa nhiệt.
(b) Khi tăng áp suất, cân bằng của phản ứng (*) chuyển dịch theo chiều nghịch.
(c) Chất xúc tác (Fe) giúp phản ứng nhanh đạt trạng thái cân bằng.
(d) NH3 có nhiệt độ sôi cao hơn N2 và H2.
(e) N2 và H2 dư có thể được đưa trở lại hỗn hợp ban đầu để tái sử dụng.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) Đúng. Giá trị biến thiên enthalpy của phản ứng là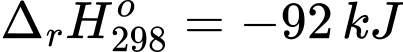 nên chiều thuận của phản ứng là tỏa nhiệt.
nên chiều thuận của phản ứng là tỏa nhiệt.
❌ (b) Sai. Theo nguyên lí chuyển dịch cân bằng, khi tăng áp suất cân bằng của phản ứng chuyển dịch theo chiều giảm áp suất là chiều thuận.
✔️ (c) Đúng. Fe là chất xúc tác có vai trò đẩy nhanh tốc độ phản ứng, giúp phản ứng nhanh đạt trạng thái cân bằng.
✔️ (d) Đúng. Nhiệt độ sôi của NH3, H2 và N2 lần lượt là -33,34 oC, -252,9 oC và -195,8 oC.
✔️ (e) Đúng. Trong chu trình tại nơi làm lạnh để ngưng tụ NH3 thì phần khí N2 và H2 chưa phản ứng sẽ dẫn quay lại đầu chu trình để điều chế NH3.
Có 4 phát biểu đúng là (a) (c) (d) (e)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Giá trị biến thiên enthalpy của phản ứng là
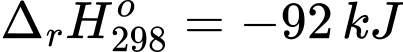 nên chiều thuận của phản ứng là tỏa nhiệt.
nên chiều thuận của phản ứng là tỏa nhiệt.❌ (b) Sai. Theo nguyên lí chuyển dịch cân bằng, khi tăng áp suất cân bằng của phản ứng chuyển dịch theo chiều giảm áp suất là chiều thuận.
✔️ (c) Đúng. Fe là chất xúc tác có vai trò đẩy nhanh tốc độ phản ứng, giúp phản ứng nhanh đạt trạng thái cân bằng.
✔️ (d) Đúng. Nhiệt độ sôi của NH3, H2 và N2 lần lượt là -33,34 oC, -252,9 oC và -195,8 oC.
✔️ (e) Đúng. Trong chu trình tại nơi làm lạnh để ngưng tụ NH3 thì phần khí N2 và H2 chưa phản ứng sẽ dẫn quay lại đầu chu trình để điều chế NH3.
Có 4 phát biểu đúng là (a) (c) (d) (e)
⇒ Chọn đáp án D Đáp án: D
Câu 29 [823661]: Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
A, diêm sinh.
B, đá vôi.
C, phèn chua.
D, giấm ăn.
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là diêm sinh.
Các đáp án khác
B. đá vôi có tên gọi là calcium carbonate.
C. phèn chua có tên gọi là Aluminium potassium sulfate.
D. giấm ăn có tên gọi là acetic acid.
⟹ Chọn đáp án A Đáp án: A
Các đáp án khác
B. đá vôi có tên gọi là calcium carbonate.
C. phèn chua có tên gọi là Aluminium potassium sulfate.
D. giấm ăn có tên gọi là acetic acid.
⟹ Chọn đáp án A Đáp án: A
Câu 30 [823663]: Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
A, Fe.
B, O2.
C, H2.
D, Hg.
Sulfur đóng vai trò là chất khử khi tác dụng với O2.
Phương trình phản ứng:
S + O2 ⟶ SO2.
⟹ Chọn đáp án B
Phương trình phản ứng:
S + O2 ⟶ SO2.
⟹ Chọn đáp án B
Câu 31 [823667]: Oxide X là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, X được dùng làm chất tẩy trắng bột gỗ, sản xuất sulfuric acid. Công thức của X là
A, CO2.
B, H2S.
C, SO2.
D, NO2.
Oxide SO2 là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, SO2 được dùng làm chất tẩy trắng bột gỗ, sản xuất sulfuric acid.
⟹ Chọn đáp án C
Đáp án: C
⟹ Chọn đáp án C
Đáp án: C
Câu 32 [823668]: Tác nhân chính gây mưa acid là khí NOx và khí nào sau đây?
A, CO2.
B, NH3.
C, SO2.
D, CO.
Tác nhân chính gây mưa là khí NOx và khí SO2.
Phân tích các đáp án:
❌Sai. A. CO2 là khí carbon dioxide là một khí nhà kính góp phần làm cho Trái Đất nóng lên không phải tác nhân gây mưa acid.
❌Sai. A. NH3 là khí ammonia không phải tác nhân gây mưa aicd.
✔️Đúng. C. SO2 được tạo ra từ quá trình đốt cháy nhiên liệu hóa thạch chứa lưu huỳnh, chẳng hạn như than đá và dầu mỏ. Khi NOx và SO2 hòa tan vào nước mưa, chúng tạo thành các axit nitric (HNO3) và sulfuric acid (H2SO4), làm giảm độ pH của nước mưa là tác nhân gây mưa acid.
❌Sai. A. CO là một khí độc không phải tác nhân gây mưa acid.
⟹ Chọn đáp án C
Đáp án: C
Phân tích các đáp án:
❌Sai. A. CO2 là khí carbon dioxide là một khí nhà kính góp phần làm cho Trái Đất nóng lên không phải tác nhân gây mưa acid.
❌Sai. A. NH3 là khí ammonia không phải tác nhân gây mưa aicd.
✔️Đúng. C. SO2 được tạo ra từ quá trình đốt cháy nhiên liệu hóa thạch chứa lưu huỳnh, chẳng hạn như than đá và dầu mỏ. Khi NOx và SO2 hòa tan vào nước mưa, chúng tạo thành các axit nitric (HNO3) và sulfuric acid (H2SO4), làm giảm độ pH của nước mưa là tác nhân gây mưa acid.
❌Sai. A. CO là một khí độc không phải tác nhân gây mưa acid.
⟹ Chọn đáp án C
Đáp án: C
Câu 33 [186734]: Không dùng sulfuric acid đặc để làm khô khí
A, O3.
B, Cl2.
C, H2S.
D, O2.
Không dùng sulfuric acid đặc để làm khô khí vì có xảy ra phản ứng:
H2S + 3H2SO4(đặc) 4SO2 + 4H2O
4SO2 + 4H2O
⟹ Chọn đáp án C Đáp án: C
H2S + 3H2SO4(đặc)
 4SO2 + 4H2O
4SO2 + 4H2O⟹ Chọn đáp án C Đáp án: C
Câu 34 [823669]: Khi nhiệt kế thủy ngân vỡ, rắc chất bột nào sau đây lên thủy ngân rơi vãi sẽ chuyển hóa chúng thành hợp chất bền và ít độc hại?
A, Thạch cao.
B, Muối ăn.
C, Đường.
D, Sulfur.
Khi nhiệt kế thủy ngân vỡ, rắc chất bột sulfur lên thủy ngân rơi vãi sẽ chuyển hóa chúng thành hợp chất bền và ít độc hại.
Các đáp án khác:
A. Thạch cao là một khoáng chất được sử dụng trong xây dựng, không phản ứng với thủy ngân.
B. Muối ăn là (NaCl), không phản ứng với thủy ngân.
C. Đường là một carbohydrate, không phản ứng với thủy ngân.
⟹ Chọn đáp án D
Đáp án: D
Các đáp án khác:
A. Thạch cao là một khoáng chất được sử dụng trong xây dựng, không phản ứng với thủy ngân.
B. Muối ăn là (NaCl), không phản ứng với thủy ngân.
C. Đường là một carbohydrate, không phản ứng với thủy ngân.
⟹ Chọn đáp án D
Đáp án: D
Câu 35 [823670]: Quá trình pha loãng dung dịch đậm đặc của acid nào sau đây tỏa rất nhiều nhiệt nên không được tự ý pha loãng?
A, HCl.
B, HNO3.
C, CH3COOH.
D, H2SO4.
Quá trình pha loãng dung dịch đậm đặc của acid H2SO4 tỏa rất nhiều nhiệt nên không được tự ý pha loãng.
Pha loãng HCl, HNO3, CH3COOH, HNO3 pha loãng cũng tỏa nhiệt nhưng không nhiều bằng H2SO4.
⟹ Chọn đáp án D Đáp án: D
Pha loãng HCl, HNO3, CH3COOH, HNO3 pha loãng cũng tỏa nhiệt nhưng không nhiều bằng H2SO4.
⟹ Chọn đáp án D Đáp án: D
Câu 36 [823673]: Muối E không tan trong nước và các dung môi hữu cơ. Trong y học, muối E thường được dùng làm chất cản quang trong xét nghiệm X-quang đường tiêu hóa. Công thức của muối E là
A, MgSO4.
B, K2SO4.
C, BaSO4.
D, Na2SO4.
Muối BaSO4 không tan trong nước và các dung môi hữu cơ. Trong y học, muối BaSO4 thường được dùng làm chất cản quang trong xét nghiệm X-quang đường tiêu hóa.
⟹ Chọn đáp án C Đáp án: C
⟹ Chọn đáp án C Đáp án: C
Câu 37 [823674]: Trong công nghiệp sản xuất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành những hợp chất có công thức chung nào sau đây?
A, H2SO4.
B, H2S2O7.
C, H2SO4.nSO3.
D, (SO3)n.
Phân tích các đáp án:
❌Sai. A. H2SO4 là công thức của sulfuric acid.
❌Sai. B. H2S2O7 là công thức của oleum nhưng chỉ khi n=1.
✔️Đúng.C. H2SO4.nSO3 là công thức của oleum.
❌Sai. D. (SO3) là công thức của sulfur trioxide.
⟹ Chọn đáp án C
❌Sai. A. H2SO4 là công thức của sulfuric acid.
❌Sai. B. H2S2O7 là công thức của oleum nhưng chỉ khi n=1.
✔️Đúng.C. H2SO4.nSO3 là công thức của oleum.
❌Sai. D. (SO3) là công thức của sulfur trioxide.
⟹ Chọn đáp án C
Câu 38 [823676]: Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A, lưu hóa cao su tự nhiên.
B, sản xuất sulfuric acid.
C, điều chế thuốc bảo vệ thực vật.
D, bào chế thuốc đông y.
Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để sản xuất sulfuric acid.
Các đáp án khác:
A. Lưu hóa cao su tự nhiên: Sulfur được sử dụng trong quá trình lưu hóa cao su, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
C. Điều chế thuốc bảo vệ thực vật: Sulfur được sử dụng trong một số loại thuốc bảo vệ thực vật, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
D. Bào chế thuốc đông y: Sulfur được sử dụng trong một số bài thuốc đông y, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
⟹ Chọn đáp án B Đáp án: B
Các đáp án khác:
A. Lưu hóa cao su tự nhiên: Sulfur được sử dụng trong quá trình lưu hóa cao su, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
C. Điều chế thuốc bảo vệ thực vật: Sulfur được sử dụng trong một số loại thuốc bảo vệ thực vật, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
D. Bào chế thuốc đông y: Sulfur được sử dụng trong một số bài thuốc đông y, nhưng đây không phải là ứng dụng chính của sulfur đơn chất khai thác từ mỏ.
⟹ Chọn đáp án B Đáp án: B
Câu 39 [704390]: Quá trình sản xuất sulfuric acid được thực hiện theo các bước sau: Ở bước 1, không khí được sử dụng làm nguồn oxygen. Nguồn này rẻ và dễ kiếm. Một lượng không khí dư được sử dụng, cung cấp oxygen cần thiết cho bước 2. Điều này làm cho quá trình hiệu quả hơn vì hai chất phản ứng cho bước 2 đã được trộn lẫn với nhau. Tuy nhiên, lượng không khí được kiểm soát sao cho tỷ lệ sulfur dioxide so với oxygen ở bước 2 là 1:1.
▪ Bước 1: S(r) + O2(g) → SO2(g)
▪ Bước 2: 2SO2(g) + O2(g)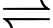 2SO3(g)
2SO3(g)
▪ Bước 3: 3SO3(g) + H2SO4(l) → H2S2O7(l)
▪ Bước 4: H2S2O7(l) + H2O(l) → 2H2SO4(l)
Cho các phát biểu sau:
(a) Ở bước 1, hỗn hợp khí thu được sau phản ứng gồm SO2 và O2 dư.
(b) Ở bước 2, SO2 trong quá trình trên đã được dùng dư để cân bằng chuyển dịch theo chiều thuận.
(c) Ở bước 3 và bước 4, S không có sự thay đổi số oxi hóa.
(d) Nếu tổng số mol SO2 và O2 khi bắt đầu trộn ở bước 2 là 2 mol thì số mol O2 đã được đưa vào ở bước 1 là 2 mol.
Các phát biểu đúng là
▪ Bước 1: S(r) + O2(g) → SO2(g)
▪ Bước 2: 2SO2(g) + O2(g)
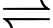 2SO3(g)
2SO3(g)▪ Bước 3: 3SO3(g) + H2SO4(l) → H2S2O7(l)
▪ Bước 4: H2S2O7(l) + H2O(l) → 2H2SO4(l)
Cho các phát biểu sau:
(a) Ở bước 1, hỗn hợp khí thu được sau phản ứng gồm SO2 và O2 dư.
(b) Ở bước 2, SO2 trong quá trình trên đã được dùng dư để cân bằng chuyển dịch theo chiều thuận.
(c) Ở bước 3 và bước 4, S không có sự thay đổi số oxi hóa.
(d) Nếu tổng số mol SO2 và O2 khi bắt đầu trộn ở bước 2 là 2 mol thì số mol O2 đã được đưa vào ở bước 1 là 2 mol.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (c), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Phương trình bước 1: S(s) + O2(g) → SO2(g).
Theo đề bài, không khí (nguồn O2) được sử dụng dư để đảm bảo quá trình hiệu quả. Vì vậy, sau phản ứng, hỗn hợp khí gồm SO2 và O2 dư.
❌ (b) Sai. Phương trình bước 2: 2SO2(g) + O2(g) ⇌ 2SO3(g).
Để phản ứng xảy ra theo chiều thuận (tạo SO3) người ta đã cung cấp không khí dư để cung cấp oxygen dư, không phải SO2 dư.
✔️ (c) Đúng. Số oxi hóa của nguyên tố S trong hợp chất SO3 và H2SO4 ở bước 3 và 6 đều có số oxi hóa là +6.
✔️ (d) Đúng. Tỉ lệ mol của SO2:O2 = 1:1, tổng mol của O2 và SO2 ở bước 2 là 2 (mol) nên nO2 = nSO2 = 1 (mol)
Theo PTHH (1): nO2 (1) = nSO2 = 1 (mol)
→ Tổng mol của O2 ở bước 1 và 2 là 2 mol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Phương trình bước 1: S(s) + O2(g) → SO2(g).
Theo đề bài, không khí (nguồn O2) được sử dụng dư để đảm bảo quá trình hiệu quả. Vì vậy, sau phản ứng, hỗn hợp khí gồm SO2 và O2 dư.
❌ (b) Sai. Phương trình bước 2: 2SO2(g) + O2(g) ⇌ 2SO3(g).
Để phản ứng xảy ra theo chiều thuận (tạo SO3) người ta đã cung cấp không khí dư để cung cấp oxygen dư, không phải SO2 dư.
✔️ (c) Đúng. Số oxi hóa của nguyên tố S trong hợp chất SO3 và H2SO4 ở bước 3 và 6 đều có số oxi hóa là +6.
✔️ (d) Đúng. Tỉ lệ mol của SO2:O2 = 1:1, tổng mol của O2 và SO2 ở bước 2 là 2 (mol) nên nO2 = nSO2 = 1 (mol)
Theo PTHH (1): nO2 (1) = nSO2 = 1 (mol)
→ Tổng mol của O2 ở bước 1 và 2 là 2 mol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án C Đáp án: C
Câu 40 [703986]: Một trong những hóa chất quan trọng nhất được sản xuất và sử dụng trên toàn thế giới là sulfuric acid. Sulfuric acid được sử dụng trong sản xuất kim loại, sản xuất sơn, phân bón, ắc quy ô tô, chất tẩy rửa, thuốc nhuộm và sợi và trong nông nghiệp. Quá trình dưới đây cho phép sản xuất sulfuric acid nồng độ cao với số lượng lớn.
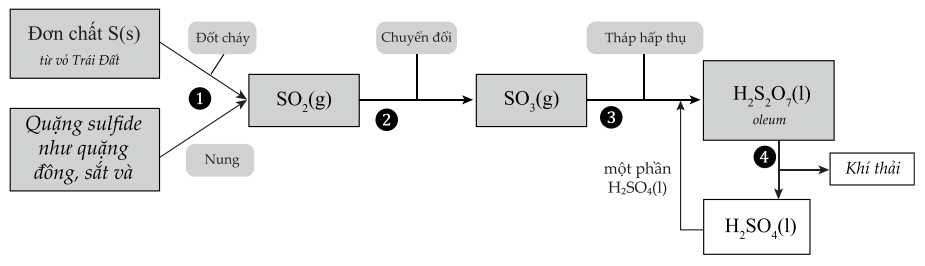
Trong các phát biểu sau:
(a) S trong các nguồn quặng có số oxi hóa 0.
(b) Số oxi hóa của sulfur có xu hướng tăng trong quá trình sản xuất.
(c) Để tăng hiệu suất chuyển hóa trong giai đoạn (2) có thể sử dụng xúc tác V2O5.
(d) Nồng độ của sulfuric acid có thể được tăng lên trong giai đoạn (3).
Các phát biểu đúng là

Trong các phát biểu sau:
(a) S trong các nguồn quặng có số oxi hóa 0.
(b) Số oxi hóa của sulfur có xu hướng tăng trong quá trình sản xuất.
(c) Để tăng hiệu suất chuyển hóa trong giai đoạn (2) có thể sử dụng xúc tác V2O5.
(d) Nồng độ của sulfuric acid có thể được tăng lên trong giai đoạn (3).
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu:
❌ (a) Sai. Đơn chất S có số oxi hóa là 0, nhưng các quặng sulfide như FeS2, MoS2,… S đều có các trặng thái oxi hóa khác.
✔️ (b) Đúng. Số oxi hóa của Sulfur là 0 và các quặng sulfide có số oxi -1 tăng dần lên +6 trong H2SO4.
✔️ (c) Đúng. V2O5 là chất xúc tác cho quá trình từ SO2 thành SO3.
✔️ (d) Đúng. Giai đoạn (3) tháp hấp thụ nSO3 bằng dung dịch H2SO4 tạo thành oleum (H2SO4.nSO3), pha loãng oleum thành H2SO4 với một lượng nước phù hợp thu được các dung dịch H2SO4 với các nồng độ mong muốn.
Các phát biểu đúng là (b), (c), (d)
⇒ Chọn đáp án D Đáp án: D
❌ (a) Sai. Đơn chất S có số oxi hóa là 0, nhưng các quặng sulfide như FeS2, MoS2,… S đều có các trặng thái oxi hóa khác.
✔️ (b) Đúng. Số oxi hóa của Sulfur là 0 và các quặng sulfide có số oxi -1 tăng dần lên +6 trong H2SO4.
✔️ (c) Đúng. V2O5 là chất xúc tác cho quá trình từ SO2 thành SO3.
✔️ (d) Đúng. Giai đoạn (3) tháp hấp thụ nSO3 bằng dung dịch H2SO4 tạo thành oleum (H2SO4.nSO3), pha loãng oleum thành H2SO4 với một lượng nước phù hợp thu được các dung dịch H2SO4 với các nồng độ mong muốn.
Các phát biểu đúng là (b), (c), (d)
⇒ Chọn đáp án D Đáp án: D