Câu 1 [829961]: Nhúng thanh Mg vào V mL dung dịch CuSO4 2 M đến khi dung dịch không còn màu xanh, lấy thanh Mg ra làm khô cẩn thận rồi cân lại thấy thanh Mg tăng 12,8 gam. Giá trị V là bao nhiêu?
Đặt số mol của Mg phản ứng là x mol
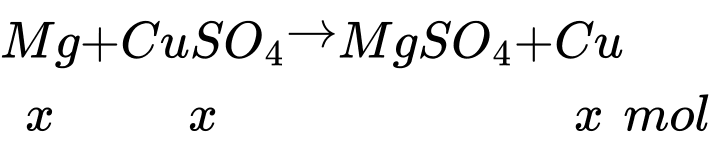
Nhúng thanh Mg vào V mL dung dịch CuSO4 2 M đến khi dung dịch không còn màu xanh
→ Mg có thể còn dư, dung dịch CuSO4 hết
Lấy thanh Mg ra làm khô cẩn thận rồi cân lại thấy thanh Mg tăng 12,8 gam
mCu - mMg = 64x – 24x = 12,8 gam → x = 0,32 mol
Thể tích dung dịch CuSO4 2 M là
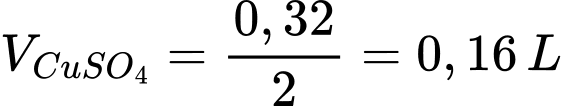
= 160mL
⇒ Điền đáp án: 160
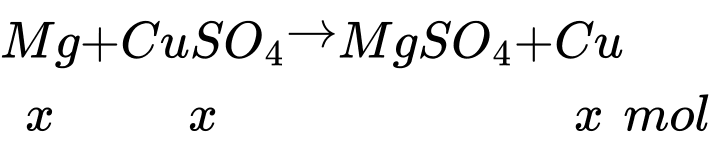
Nhúng thanh Mg vào V mL dung dịch CuSO4 2 M đến khi dung dịch không còn màu xanh
→ Mg có thể còn dư, dung dịch CuSO4 hết
Lấy thanh Mg ra làm khô cẩn thận rồi cân lại thấy thanh Mg tăng 12,8 gam
mCu - mMg = 64x – 24x = 12,8 gam → x = 0,32 mol
Thể tích dung dịch CuSO4 2 M là
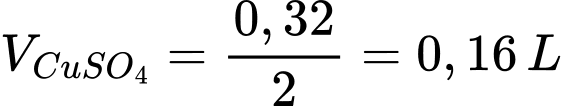
= 160mL
⇒ Điền đáp án: 160
Câu 2 [829963]: Cho m gam bột Cu vào 200 mL dung dịch AgNO3 0,2 M, sau một thời gian thu được 4,64 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất. Giá trị của m là bao nhiêu?
Cu + 2AgNO3 ⟶ Cu(NO3)2 + Ag
Sau một thời gian thu được 4,64 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất
→ AgNO3 phản ứng hết
Số mol của AgNO3 là nAgNO3 = 0,2.0,2 = 0,04 mol
Từ PTHH số mol của Ag là 0,04 mol
mAg = 0,04.108 = 4,32 gam < 4,64 gam → sau phản ứng Cu dư
Từ PTHH số mol của Cu là 0,02 mol
Khối lượng của Cu ban đầu là mCu = 0,02.64 + 4,64 – 4,32 = 1,6 gam
⇒ Điền đáp án: 1,6
Sau một thời gian thu được 4,64 gam chất rắn Z và dung dịch chỉ chứa 1 muối duy nhất
→ AgNO3 phản ứng hết
Số mol của AgNO3 là nAgNO3 = 0,2.0,2 = 0,04 mol
Từ PTHH số mol của Ag là 0,04 mol
mAg = 0,04.108 = 4,32 gam < 4,64 gam → sau phản ứng Cu dư
Từ PTHH số mol của Cu là 0,02 mol
Khối lượng của Cu ban đầu là mCu = 0,02.64 + 4,64 – 4,32 = 1,6 gam
⇒ Điền đáp án: 1,6
Câu 3 [829959]: Cho 1,12 gam bột sắt vào 200 mL dung dịch gồm AgNO3 0,3 M và Cu(NO3)2 0,5 M. Sau khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là bao nhiêu?
Đổi 200 mL = 0,2 L
Số mol của Fe, AgNO3 và Cu(NO3)2 lần lượt là
nFe = m:M = 1,12:56 = 0,02 mol;
nAgNO3 = CM.V = 0,2.0,3 = 0,06 mol;
nCu(NO3)2 = CM.V = 0,2.0,5 = 0,1 mol
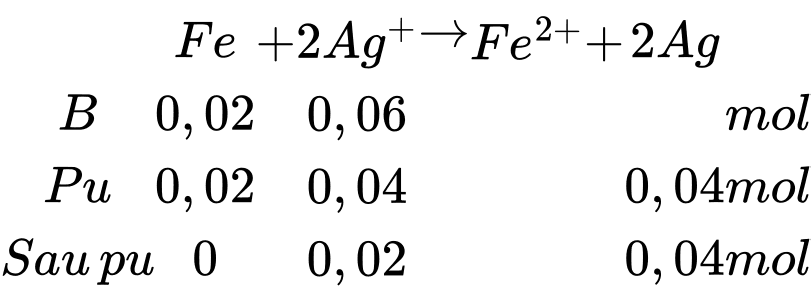
→ Sau phản ứng Fe hết, Ag+ dư
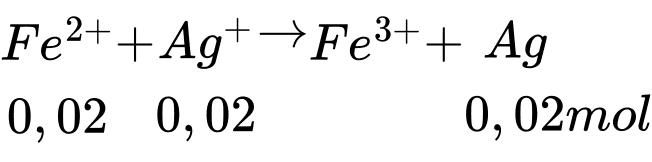
Sau phản ứng số mol của Ag là 0,04 + 0,02 = 0,06 mol
Khối lượng của Ag là mAg = n.M = 0,06.108 = 6,48 gam
⇒ Điền đáp án: 6,48
Số mol của Fe, AgNO3 và Cu(NO3)2 lần lượt là
nFe = m:M = 1,12:56 = 0,02 mol;
nAgNO3 = CM.V = 0,2.0,3 = 0,06 mol;
nCu(NO3)2 = CM.V = 0,2.0,5 = 0,1 mol
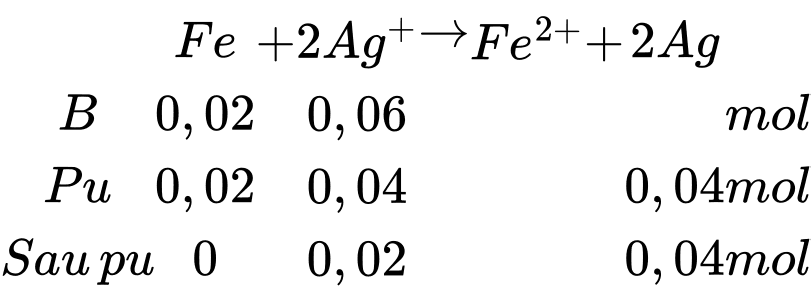
→ Sau phản ứng Fe hết, Ag+ dư
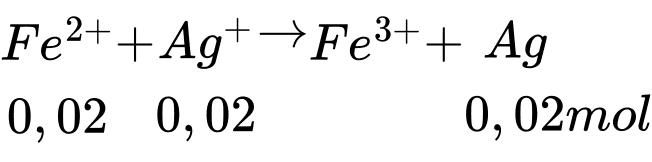
Sau phản ứng số mol của Ag là 0,04 + 0,02 = 0,06 mol
Khối lượng của Ag là mAg = n.M = 0,06.108 = 6,48 gam
⇒ Điền đáp án: 6,48
Câu 4 [829969]: Điện phân NaCl nóng chảy với dường độ I = 1,93 A trong thời gian 6 phút 40 giây thì thu được 0,1472 gam Na. Hiệu suất quá trình điện phân là bao nhiêu (làm tròn đến hàng đơn vị)?
Đổi 6 phút 40 giây = 400 giây
Khối lượng Na thu được theo lí thuyết là
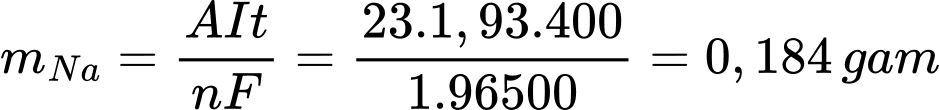
Hiệu suất của quá trình điều chế Na là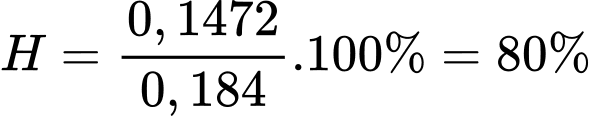
⇒ Điền đáp án: 80
Khối lượng Na thu được theo lí thuyết là
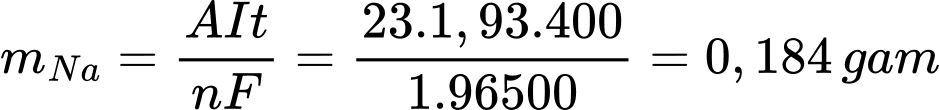
Hiệu suất của quá trình điều chế Na là
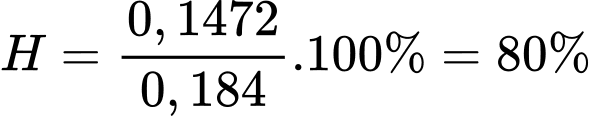
⇒ Điền đáp án: 80
Câu 5 [680874]: Trong công nghiệp, kim loại nhôm (aluminium, Al) được sản xuất bằng phương pháp điện phân nóng chảy aluminium oxide. Biết hiệu suất của quá trình chuyển hóa Al2O3 thành Al là 95,4 %. Để sản xuất 5,4 tấn Al cần sử dụng bao nhiêu tấn nguyên liệu Al2O3 (làm tròn đến hàng phần mười)?
Sơ đồ phản ứng:
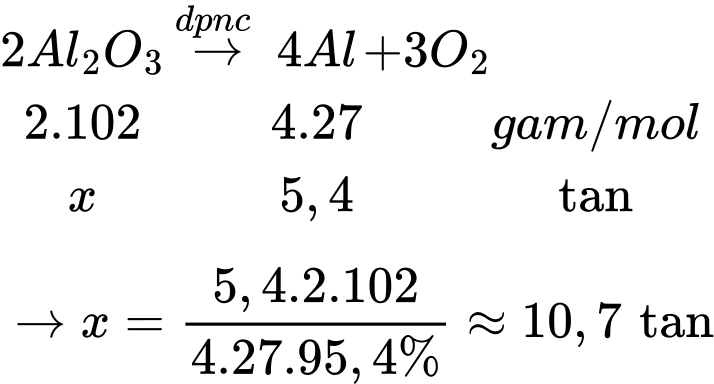
⇒ Điền đáp án: 10,7
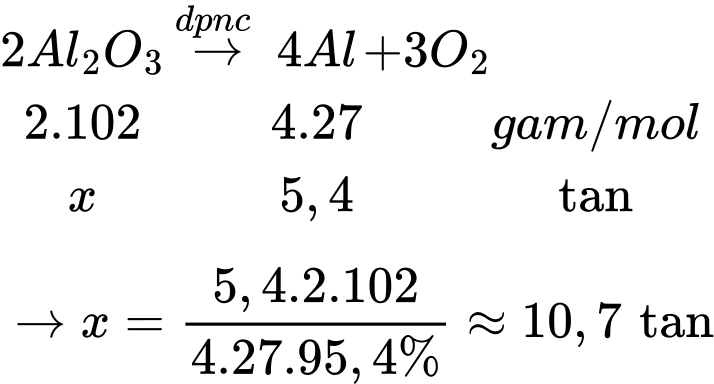
⇒ Điền đáp án: 10,7
Câu 6 [829968]: Xét quá trình sản xuất nhôm được thực hiện theo phương pháp điện phân Al2O3 nóng chảy với điện cực than chì. Trung bình để sản xuất được 1 tấn Al thì khối lượng điện cực than chì bị tiêu hao do phản ứng oxi hóa là bao nhiêu tấn (làm tròn đến hàng phần trăm)? Giả thiết thành phần khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích, không có khí O2 thoát ra.
Khí bay ra ở cực dương gồm 50% CO và 50% CO2 về thể tích, không có khí O2 thoát ra
→ Khí O2 sinh ra phản ứng hoàn toàn với C
Đặt nCO2 = nCO = x mol
Sơ đồ phản ứng:
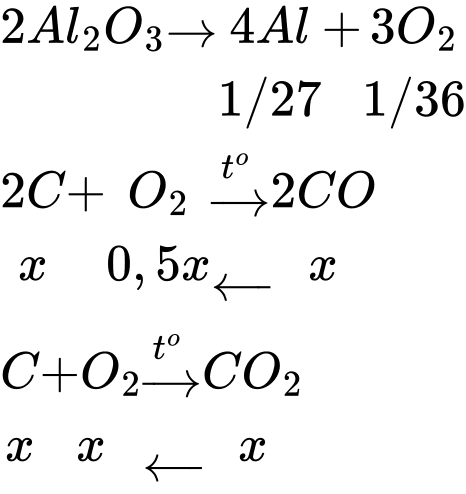
Bảo toàn nguyên tố O: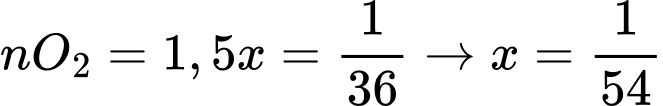
Khối lượng điện cực than chì tiêu hao là mC = 2x.12 = 2.1/54.12 = 0,44.
⟹ Điền đáp án 0,44
→ Khí O2 sinh ra phản ứng hoàn toàn với C
Đặt nCO2 = nCO = x mol
Sơ đồ phản ứng:
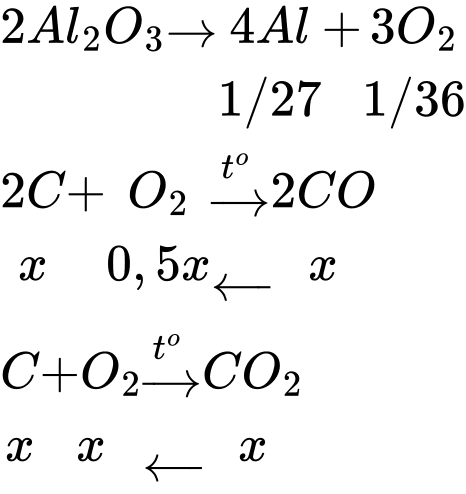
Bảo toàn nguyên tố O:
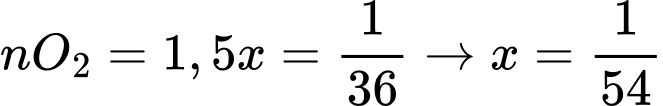
Khối lượng điện cực than chì tiêu hao là mC = 2x.12 = 2.1/54.12 = 0,44.
⟹ Điền đáp án 0,44
Câu 7 [829977]: Điện phân dung dịch chứa 23,4 gam muối ăn (với điện cực trơ, màng ngăn xốp) thu được 2,5 L dung dịch có pH = 13. Phần trăm muối ăn bị điện phân là bao nhiêu (làm tròn đến hàng phần mười)?
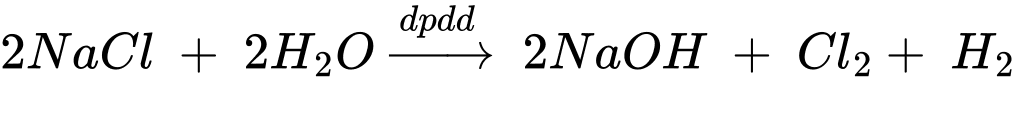
Ta có: pH = 13 → [H+] = 10-13 m → [OH-] = 0,1 M
Số mol của NaOH là nNaOH = 0,1.2,5 = 0,25 mol
Từ PTHH số mol của NaCl là 0,25 mol
Phần trăm muối ăn bị điện phân là
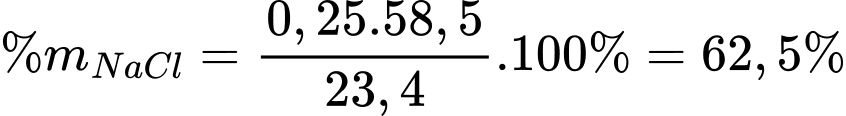
⇒ Điền đáp án: 62,5
Câu 8 [829964]: Tiến hành điện phân 400 mL dung dịch CuSO4 0,5 M với cường độ dòng điện 1,34 A trong vòng 24 phút. Hiệu suất phản ứng điện phân là 100%. Khối lượng kim loại bám vào cathode là bao nhiêu?(làm tròn đến hàng phần trăm).
Cathode: Cu2+ + 2e → Cu
Áp dụng định luật Faraday
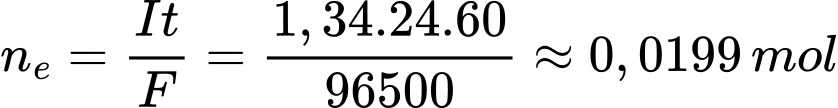
Từ quá trình số mol của Cu là 0,00999 mol
Khối lượng Cu thu được trên cathode là mCu = 0,00999.64 ≈ 0,64 gam
⇒ Điền đáp án: 0,64
Áp dụng định luật Faraday
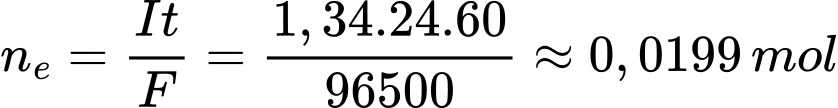
Từ quá trình số mol của Cu là 0,00999 mol
Khối lượng Cu thu được trên cathode là mCu = 0,00999.64 ≈ 0,64 gam
⇒ Điền đáp án: 0,64
Câu 9 [829973]: Điện phân với điện cực trơ màng ngăn xốp dung dịch chứa 0,1 mol CuSO4 và 0,12 mol NaCl đến khi cathode bắt đầu thoả khí thì dừng lại, thể tích khí ở điểu kiện chuẩn thu được ở anode là bao nhiêu (làm tròn đến hàng phần trăm)?
Điện phân đến khi cathode bắt đầu thoát khí thì dừng lại → Cu2+ đã bị điện phân hết
Tại anode (+) Cl-, SO42-, H2O
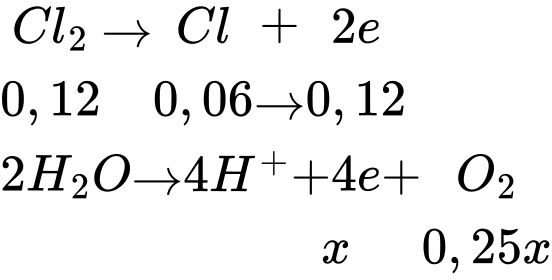
Tại cathode (-): Na+, Cu2+, H2O
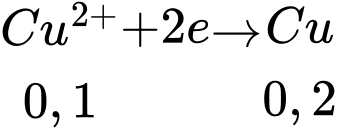
=> 0,12 + x = 0,2 => x = 0,08.
Thể tích khí thu được tại anode là:
Vanode = VCl2 + VO2 = (0,06 + 0,25x) . 24,79
= (0,06 + 0,25. 0,08) .24,79 =1,98.
⟹ Điền đáp án 1,98
Tại anode (+) Cl-, SO42-, H2O
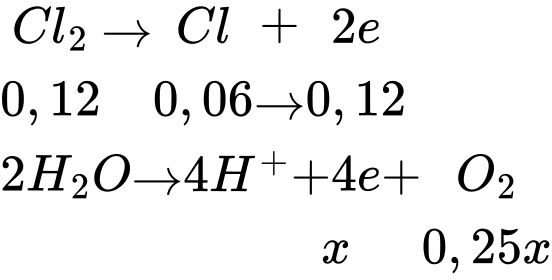
Tại cathode (-): Na+, Cu2+, H2O
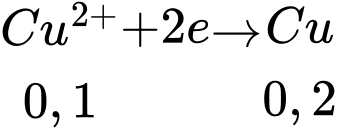
=> 0,12 + x = 0,2 => x = 0,08.
Thể tích khí thu được tại anode là:
Vanode = VCl2 + VO2 = (0,06 + 0,25x) . 24,79
= (0,06 + 0,25. 0,08) .24,79 =1,98.
⟹ Điền đáp án 1,98
Câu 10 [706076]: Để tráng bạc một chiếc huy chương có bề dầy là 3 mm, bán kính 4 cm, người ta tiến hành điện phân dung dịch AgNO3 với cathode là tấm huy chương và anode bằng Ag. Biết cường độ dòng điện không đổi là 2,0 A, hiệu suất điện phân là 90%, khối lượng riêng của Ag là 10,8 g/cm³, hằng số Faraday F = 96485 C/mol. Cho biết thời gian điện phân để lớp mạ có độ dày đồng nhất 0,01 mm là bao nhiêu phút (chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị)?


Đổi 3 mm = 0,3 cm; 0,01 mm = 0,001 cm
Thể tích tấm huy chương trước khi mạ có V = π.42.0,3 = 15,072 cm3
Thể tích tấm huy chương sau khi mạ có:
V, = π.(4 + 0,001)².(0,3 + 0,001.2) = 15,18 cm3
Khối lượng bạc trên tấm huy chương là mAg = 10,8(15,18 – 15,072) = 1,1664 gam
Ta có:
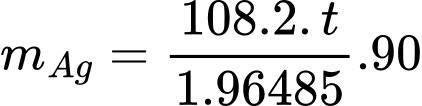
⟹ Điền đáp án : 10
Thể tích tấm huy chương trước khi mạ có V = π.42.0,3 = 15,072 cm3
Thể tích tấm huy chương sau khi mạ có:
V, = π.(4 + 0,001)².(0,3 + 0,001.2) = 15,18 cm3
Khối lượng bạc trên tấm huy chương là mAg = 10,8(15,18 – 15,072) = 1,1664 gam
Ta có:
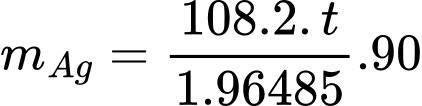
⟹ Điền đáp án : 10
Câu 11 [829979]: Trong công nghiệp, kim loại nhôm được sản xuất từ quặng bauxite Al2O3.2H2O bằng phương pháp điện phân nóng chảy với điện cực than chì và có mặt cryolite. Giả sử ở cathode thu được kim loại nhôm, ở anode chỉ thu được hỗn hợp khí CO và CO2 theo tỉ lệ thể tích 1 : 1. Nếu thu được 99,16 m3 (ở đkc) hỗn hợp khí ở anode thì khối lượng (kg) quặng bauxite đã sử dụng là bao nhiêu? Biết hiệu suất cả quá trình điện phân là 80%.
ở anode chỉ thu được hỗn hợp khí CO và CO2 theo tỉ lệ thể tích 1 : 1
→ Khí O2 sinh ra phản ứng hoàn toàn với C
Đổi 99,16 m3 = 99160 L
Số mol của hỗn hợp khí là
VKhí = 99610:24,79 = 4000 mol → nCO2 = nCO = 2000 mol
Bảo toàn nguyên tố O: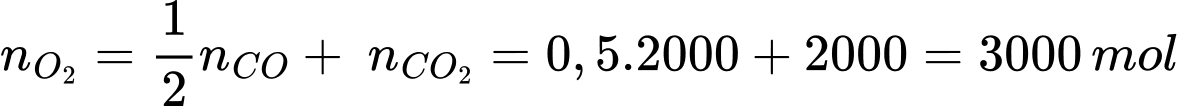
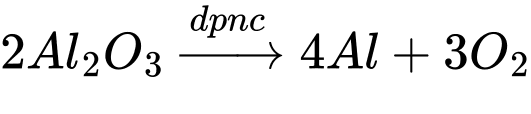
Từ PTHH số mol của Al2O3 là 2000 mol
Khối lượng (kg) quặng bauxite đã sử dụng là
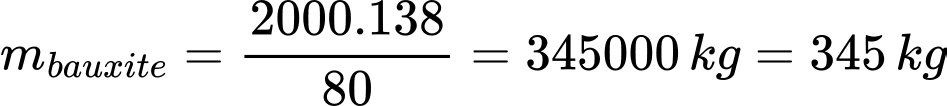
⇒ Điền đáp án: 345
→ Khí O2 sinh ra phản ứng hoàn toàn với C
Đổi 99,16 m3 = 99160 L
Số mol của hỗn hợp khí là
VKhí = 99610:24,79 = 4000 mol → nCO2 = nCO = 2000 mol
Bảo toàn nguyên tố O:
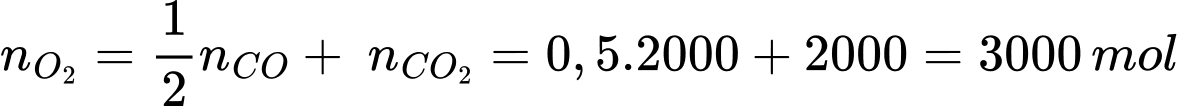
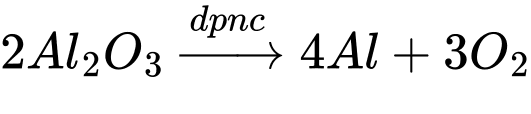
Từ PTHH số mol của Al2O3 là 2000 mol
Khối lượng (kg) quặng bauxite đã sử dụng là
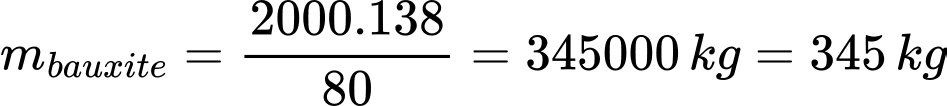
⇒ Điền đáp án: 345
Câu 12 [829980]: Một nhà máy luyện kim sản xuất nhôm bằng cách điện phân nóng chảy 20 tấn quặng bauxite (chứa 47% Al2O3 về khối lượng, còn lại là tạp chất không chứa nhôm, hiệu suất quá trình đạt 85%). Toàn bộ lượng nhôm tạo ra được đúc thành x thanh nhôm hình hộp chữ nhật có chiều dài 110 cm, chiều rộng 20 cm, chiều cao 10 cm. Biết khối lượng riêng của nhôm là 2,7 g/cm3. Giá trị của x bằng bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
Khối lượng Al2O3 có trong quặng bauxite là mAl2O3 = 20.47% = 9,4 tấn
Sơ đồ phản ứng:
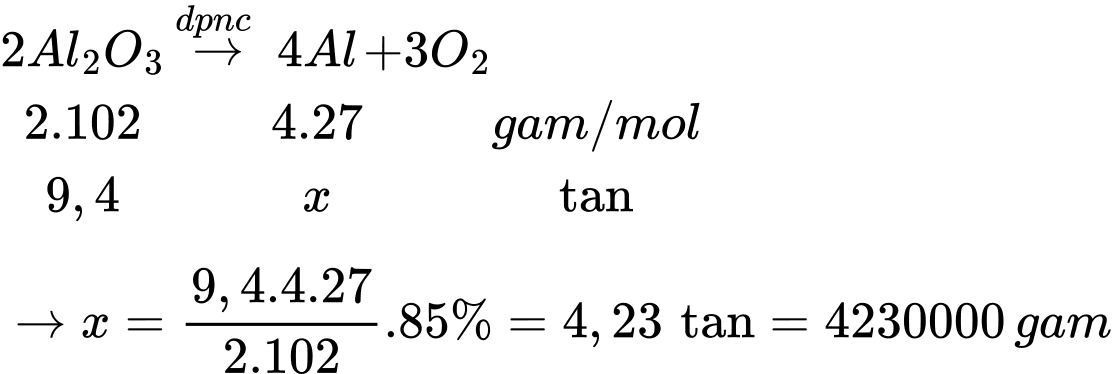
Thể tích 1 thanh nhôm là VAl = 110.20.10 = 22000 cm3
Số thanh nhôm tối đa được tạo thành là
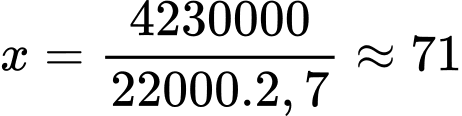 thanh nhôm
thanh nhôm
⇒ Điền đáp án: 71
Sơ đồ phản ứng:
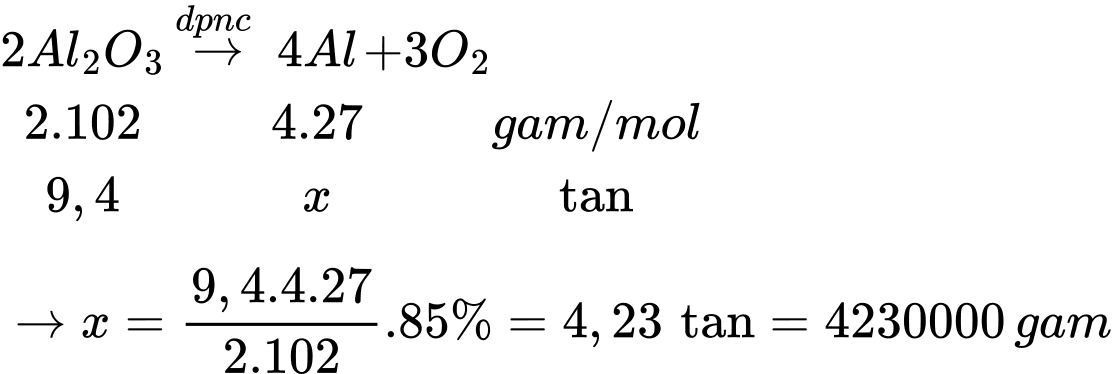
Thể tích 1 thanh nhôm là VAl = 110.20.10 = 22000 cm3
Số thanh nhôm tối đa được tạo thành là
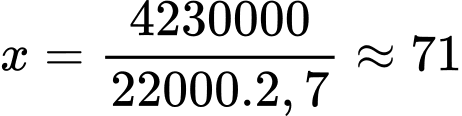 thanh nhôm
thanh nhôm⇒ Điền đáp án: 71
Câu 13 [705793]: Trong công nghiệp, kim loại sắt (Iron, Fe) được sản xuất bằng phương pháp nhiệt luyện quặng hemantite. Với hiệu suất chuyển hóa từ Fe2O3 thành Fe là 75%. Để sản xuất được 5,6 tấn Fe cần dùng bao nhiêu tấn nguyên liệu quặng hematite biết quặng có chưa 70% Fe2O3. (Làm tròn đến hàng phần mười)
Trong Fe2O3 có 2 nguyên tử Fe
Số mol Fe = m ÷ M = 5,6.106 ÷ 56 = 0,1.106 mol
⇒ Số mol Fe2O3 = nFe ÷ 2 ÷ Hiệu suất = 0,1 ÷ 2 ÷ 75%
Do trong quặng chứa 70% Fe2O3
⇒ mquặng = mFe2O3 ÷ 70% = 0,1.106 ÷ 2 ÷ 75% × 160 ÷ 70%
= 15238095 gam ≈ 15,2 tấn
⇒ Điền đáp án : 15,2
Số mol Fe = m ÷ M = 5,6.106 ÷ 56 = 0,1.106 mol
⇒ Số mol Fe2O3 = nFe ÷ 2 ÷ Hiệu suất = 0,1 ÷ 2 ÷ 75%
Do trong quặng chứa 70% Fe2O3
⇒ mquặng = mFe2O3 ÷ 70% = 0,1.106 ÷ 2 ÷ 75% × 160 ÷ 70%
= 15238095 gam ≈ 15,2 tấn
⇒ Điền đáp án : 15,2
Câu 14 [829981]: Một nhà máy chuyên sản xuất thép (chứa 1% C theo khối lượng) với công nghệ lò luyện thép Martin. Sơ đồ phản ứng luyện thép trong lò là FexOy + C → Fe + CO2. Nguyên liệu nhà máy trên sử dụng để luyện thép gồm sắt phế liệu (chứa 50% Fe3O4; 49% Fe; 1% C theo khối lượng) và gang (chứa 4% khối lượng C còn lại là Fe). Một mẻ luyện thép cần 5 tấn gang và m tấn sắt phế liệu (hiệu suất của quá trình là 100%). Tính giá trị m (làm tròn kết quả đến hàng đơn vị).
Sử dụng để luyện thép gồm sắt phế liệu (chứa 50% Fe3O4; 49% Fe; 1% C theo khối lượng) và gang (chứa 4% khối lượng C còn lại là Fe) sản xuất thép (chứa 1% C theo khối lượng)
→ 5 tấn gang (4,8 tấn Fe + 0,2 tấn C) + m tấn phế liệu (0,5m tấn Fe3O4; 0,49m tấn Fe; 0,01m tấn C)
→ a tấn thép (0,99a tấn Fe + 0,01a tấn C)
Bảo toàn nguyên tố Fe
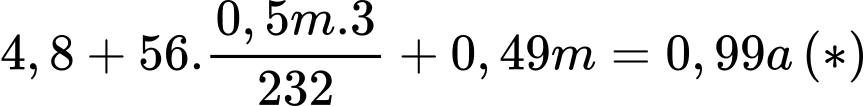
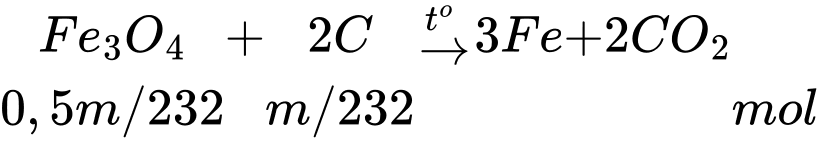
Bảo toàn nguyên tố C
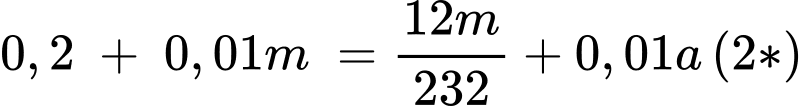
Từ (*) và (2*) → m = 3,01038 tấn; a = 7,4394 tấn
⇒ Điền đáp án: 3
→ 5 tấn gang (4,8 tấn Fe + 0,2 tấn C) + m tấn phế liệu (0,5m tấn Fe3O4; 0,49m tấn Fe; 0,01m tấn C)
→ a tấn thép (0,99a tấn Fe + 0,01a tấn C)
Bảo toàn nguyên tố Fe
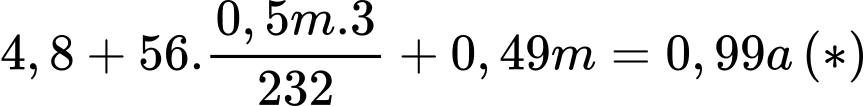
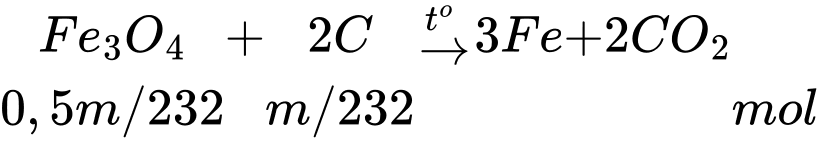
Bảo toàn nguyên tố C
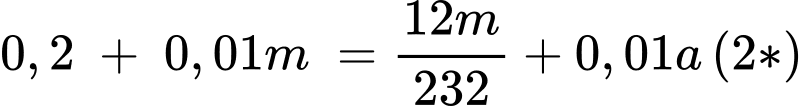
Từ (*) và (2*) → m = 3,01038 tấn; a = 7,4394 tấn
⇒ Điền đáp án: 3
Câu 15 [829982]: Người ta mạ nickel lên mặt vật kim loại bằng phương pháp mạ điện, dung dịch điện phân chứa NiSO4, cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%) (làm tròn kết quả đến hàng phần mười).
Cathode (-) : Ni2+ + 2e → Ni
Áp dụng định luật Faraday
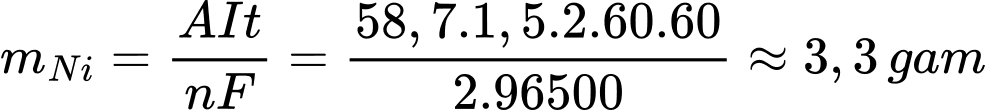
⇒ Điền đáp án: 3,3
Áp dụng định luật Faraday
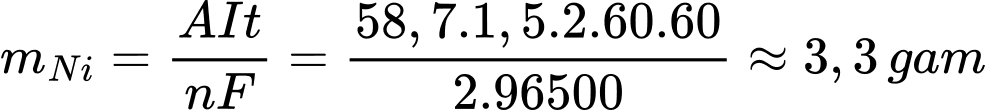
⇒ Điền đáp án: 3,3
Câu 16 [829985]: Hiện nay mạ điện được sử dụng rộng rãi trong thực tế, mạ điện là quá trình phủ một lớp kim loại lên bề mặt kim loại khác bằng phương pháp điện phân. Giả sử người ta cần mạ Ag lên một mặt của một chiếc đĩa kim loại hình tròn có bán kính 20 cm, độ dày lớp mạ là 0,01 mm. Nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2A thì thời gian cần dùng là t giờ. Biết rằng khối lượng riêng của Ag là 10,5 g/cm3; π = 3,14; hằng số Faraday (F = 96500 C/mol) ; hiệu suất điện phân là 100%. Giá trị của t là bao nhiêu (chỉ làm tròn ở phép tính cuối cùng và làm tròn kết quả đến hàng phần trăm)?
Đổi 0,01 mm = 0,001 cm
Thể tích lớp Ag là VAg = 0,001. r2 .π= 0,001.202.3,14 =1,256 cm3
Khối lượng Ag cần mạ là
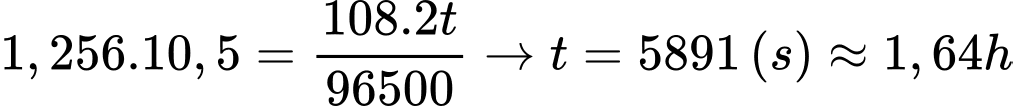
⇒ Điền đáp án: 1,64
Thể tích lớp Ag là VAg = 0,001. r2 .π= 0,001.202.3,14 =1,256 cm3
Khối lượng Ag cần mạ là
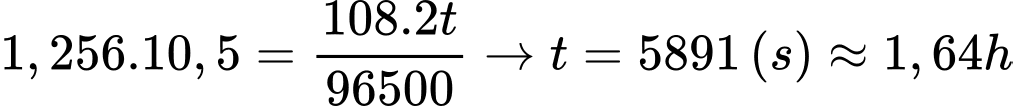
⇒ Điền đáp án: 1,64
Câu 17 [829992]: Hàm lượng Au trong quặng hoặc trong đất thường rất thấp vì vậy rất khó tách Au bằng phương pháp cơ học. Trong công nghiệp, người ta tách vàng từ quặng theo phương trình:
Vàng bị hoà tan tạo thành phức chất:
4Au(s) + 8KCN(aq) + O2(g) + 2H2O(l)→ 4K[Au(CN)2](aq) + 4KOH(aq) (1)
và sau đó kết tủa vàng bằng kẽm (Zn):
Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s) (2)
Nếu dùng 26 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
Vàng bị hoà tan tạo thành phức chất:
4Au(s) + 8KCN(aq) + O2(g) + 2H2O(l)→ 4K[Au(CN)2](aq) + 4KOH(aq) (1)
và sau đó kết tủa vàng bằng kẽm (Zn):
Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s) (2)
Nếu dùng 26 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
(1) 4Au(s) + 8KCN(aq) + O2(g) + 2H2O(l) → 4K[Au(CN)2](aq) + 4KOH(aq)
(2) Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s)
Đổi 26 kg = 26000 gam
Số mol của KCN là nKCN = 26000:65 = 400 mol
Từ PTHH (1) và (2) số mol của Au thu được là 200 mol
Khối lượng Au thu được là mAu = 197.200 = 39400 gam = 39,4 kg
⇒ Điền đáp án: 39,4
(2) Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s)
Đổi 26 kg = 26000 gam
Số mol của KCN là nKCN = 26000:65 = 400 mol
Từ PTHH (1) và (2) số mol của Au thu được là 200 mol
Khối lượng Au thu được là mAu = 197.200 = 39400 gam = 39,4 kg
⇒ Điền đáp án: 39,4
Câu 18 [702821]: Quy trình sản xuất đồng (Cu) từ quặng chứa Cu2S được thực hiện như sau:
Giai đoạn 1: Đốt Cu2S bằng khí oxygen theo phản ứng:
2Cu2S + 3O2 2Cu2O + 2SO2.
2Cu2O + 2SO2.
Giai đoạn 2: Copper(I) oxide sẽ phản ứng với phần còn lại của Cu2S theo phản ứng:
2Cu2O + Cu2S 6Cu + SO2.
6Cu + SO2.
Quặng đồng ban đầu chứa khoảng 40% Cu2S theo khối lượng. Tính khối lượng quặng đồng (theo tấn) cần lấy để điều chế được 1 tấn Cu. Biết hiệu suất của quá trình đạt 90% (làm tròn kết quả đến hàng phần trăm).
Giai đoạn 1: Đốt Cu2S bằng khí oxygen theo phản ứng:
2Cu2S + 3O2
 2Cu2O + 2SO2.
2Cu2O + 2SO2.Giai đoạn 2: Copper(I) oxide sẽ phản ứng với phần còn lại của Cu2S theo phản ứng:
2Cu2O + Cu2S
 6Cu + SO2.
6Cu + SO2.Quặng đồng ban đầu chứa khoảng 40% Cu2S theo khối lượng. Tính khối lượng quặng đồng (theo tấn) cần lấy để điều chế được 1 tấn Cu. Biết hiệu suất của quá trình đạt 90% (làm tròn kết quả đến hàng phần trăm).
Đổi 1 tấn = 1000000 gam
Số mol của Cu là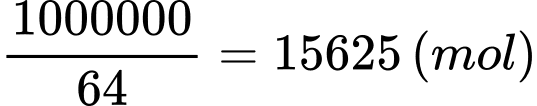
Bảo toàn nguyên tố Cu: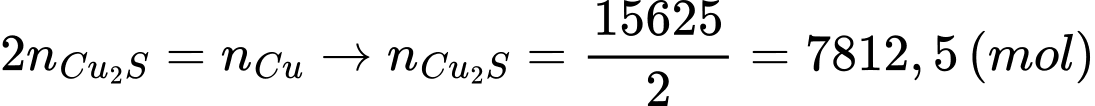
Khối lượng của quặng ban đầu: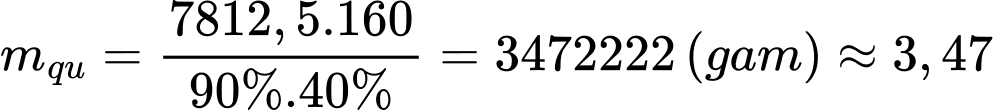 (tấn)
(tấn)
⇒ Điền đáp án: 3,47
Số mol của Cu là
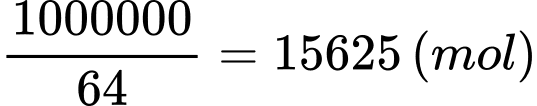
Bảo toàn nguyên tố Cu:
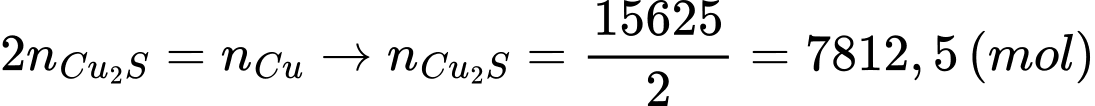
Khối lượng của quặng ban đầu:
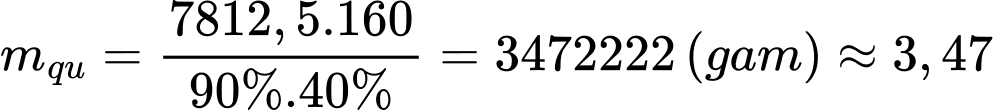 (tấn)
(tấn)⇒ Điền đáp án: 3,47
Câu 19 [829993]: Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng zinc blende thu được sản phẩm phụ là SO2 theo sơ đồ phản ứng: ZnS + O2 → ZnO + SO2. Đốt cháy 1 tấn quặng zinc blende (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Tính giá trị của V (làm tròn kết quả đến hàng đơn vị).
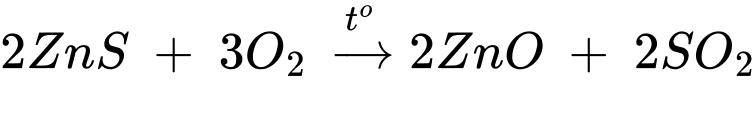
Đổi 1 tấn = 1000000 gam
Khối lượng ZnS là mZnS = 1000000.77,6% = 776000 gam
Số mol của ZnS là nZnS = 776000:97 = 8000 mol
Từ PTHH số mol của SO2 là 8000 mol
Thể tích khí SO2 là VSO2 = 8000.24,79 = 198320 L ≈ 198 m3
⇒ Điền đáp án: 198
Câu 20 [829996]: Một ao nuôi thủy sản có diện tích bề mặt là 2000 m2, độ sâu trung bình của ao là 0,7 m đang có hiện tượng phú dưỡng. Để xử lý tảo xanh có trong ao, người ta cho copper (II) sulfate pentahydrate vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 gam cho 1,0 m3 nước trong ao. Hãy tính tổng khối lượng (kg) copper (II) sulfate pentahydrate cần sử dụng (làm tròn kết quả đến hàng phần trăm).
Thể tích của ao là Vao = 2000.0,7 = 1400 m3
Tổng khối lượng (kg) copper (II) sulfate pentahydrate cần sử dụng là
mCuSO4.5H2O = 0,25.1400.3 = 1050 gam = 1,05 kg
⇒ Điền đáp án: 1,05
Tổng khối lượng (kg) copper (II) sulfate pentahydrate cần sử dụng là
mCuSO4.5H2O = 0,25.1400.3 = 1050 gam = 1,05 kg
⇒ Điền đáp án: 1,05