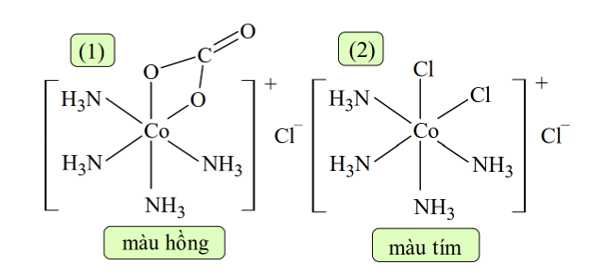
Câu 1 [705812]: Cho hai phức chất A và B có công thức lần lượt sau:
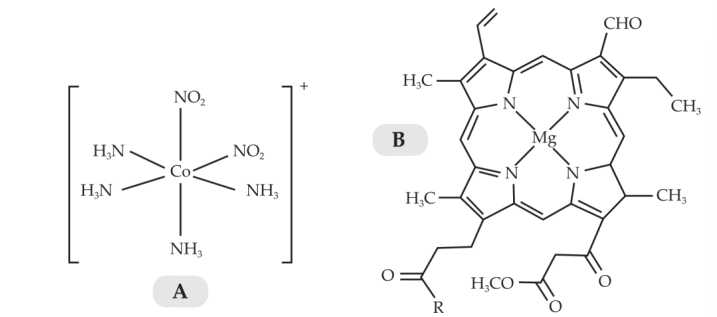
Phát biểu nào sau đây đúng?

Phát biểu nào sau đây đúng?
A, Trong phức chất B có 4 phối tử.
B, Hai phức chất A và B có dạng hình học khác nhau.
C, Trong A và trong B đều có hai loại phối tử.
D, Nguyên tử trung tâm của hai phức chất đều là nguyên tố kim loại chuyển tiếp.
Phân tích các phát biểu:
❌A. Trong phức chất B có 1 phối tử.
✔️B. A có dạng bát diện, B là phức có phối tử đa càng ⟹ Hai phức chất A và B có dạng hình học khác nhau.
❌C. Trong A có 2 loại phối tử là NO2 và NH3, trong B đều có 1 phối tử đa càng.
❌D. Co là kim loại chuyển tiếp, Mg không phải kim loại chuyển tiếp.
⟹ Chọn đáp án B
Đáp án: B
❌A. Trong phức chất B có 1 phối tử.
✔️B. A có dạng bát diện, B là phức có phối tử đa càng ⟹ Hai phức chất A và B có dạng hình học khác nhau.
❌C. Trong A có 2 loại phối tử là NO2 và NH3, trong B đều có 1 phối tử đa càng.
❌D. Co là kim loại chuyển tiếp, Mg không phải kim loại chuyển tiếp.
⟹ Chọn đáp án B
Đáp án: B
Câu 2 [704352]: Khi vừa hoà tan phèn nhôm – kali có công thức K2SO4.Al2(SO4)3.24H2O vào nước thu được dung dịch chứa K+, [Al(OH2)6]3+ và SO42–. Sau đó, một phần phức chất aqua chuyển thành phức chất không tan theo phương trình hoá học sau:
[Al(OH2)6]3+(aq) + 3H2O(1) [Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
[Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
Có các phát biểu sau đây:
(1) Trong dung dịch có diễn ra quá trình phân li và quá trình hình thành phức chất.
(2) Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
(3) Giá trị n ở phức chất trong cân bằng (*) là 1.
(4) Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
(5) Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng (*) giúp giải thích ứng dụng làm trong nước của phèn nhôm – kali.
Các phát biểu đúng là
[Al(OH2)6]3+(aq) + 3H2O(1)
 [Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
[Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)Có các phát biểu sau đây:
(1) Trong dung dịch có diễn ra quá trình phân li và quá trình hình thành phức chất.
(2) Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
(3) Giá trị n ở phức chất trong cân bằng (*) là 1.
(4) Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
(5) Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng (*) giúp giải thích ứng dụng làm trong nước của phèn nhôm – kali.
Các phát biểu đúng là
A, (1), (4), (5).
B, (1), (2), (3).
C, (3), (5).
D, (2), (4), (5).
(1) 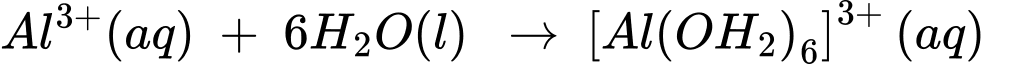
(2)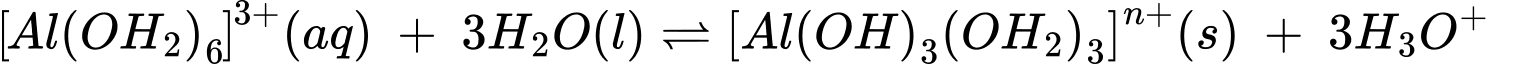
Phân tích các phát biểu:
✔️ (1) Đúng. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+, quá trình (2) là quá trình phân lí của phức chất tạo ion H3O+.
(2) Sai. Trong dung dịch, cation kim loại chuyển tiếp tồn tại ở dạng phức chất aqua. Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. Do đó dựa vào các dấu hiệu như màu sắc bị thay đổi, sự xuất hiện kết tủa, kết tủa bị hoà tan,… người ta có thể dự đoán phức chất trong dung dịch được tạo thành.
(3) Sai. Giá trị n = 0, trong [Al(OH)3(OH2)3]3+ có Al3+ và 3OH-
✔️ (4) Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
✔️ (5) Đúng. Kết tủa [Al(OH)3(OH2)3]3+ được tạo ra khi khuấy phèn vào nước đã kết dính các hạt đất nhỏ lơ lửng trong nước đục thành các hát đất to hơn, nặng và chìm xuống làm trong nước. Phèn chua rất cần cho việc xử lí nước đục ở các vùng lũ để có nước dùng cho sinh hoạt của con người.
Các phát biểu đúng là (1) (4) (5)
⇒ Chọn đáp án A Đáp án: A
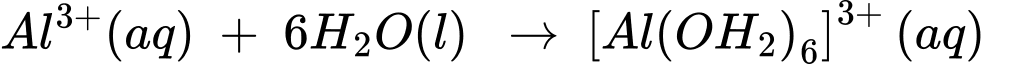
(2)
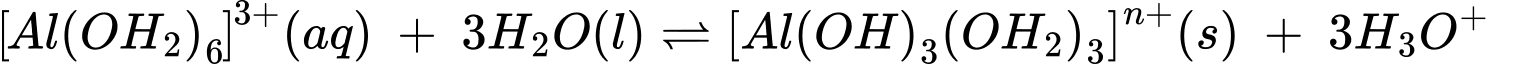
Phân tích các phát biểu:
✔️ (1) Đúng. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+, quá trình (2) là quá trình phân lí của phức chất tạo ion H3O+.
(2) Sai. Trong dung dịch, cation kim loại chuyển tiếp tồn tại ở dạng phức chất aqua. Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. Do đó dựa vào các dấu hiệu như màu sắc bị thay đổi, sự xuất hiện kết tủa, kết tủa bị hoà tan,… người ta có thể dự đoán phức chất trong dung dịch được tạo thành.
(3) Sai. Giá trị n = 0, trong [Al(OH)3(OH2)3]3+ có Al3+ và 3OH-
✔️ (4) Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
✔️ (5) Đúng. Kết tủa [Al(OH)3(OH2)3]3+ được tạo ra khi khuấy phèn vào nước đã kết dính các hạt đất nhỏ lơ lửng trong nước đục thành các hát đất to hơn, nặng và chìm xuống làm trong nước. Phèn chua rất cần cho việc xử lí nước đục ở các vùng lũ để có nước dùng cho sinh hoạt của con người.
Các phát biểu đúng là (1) (4) (5)
⇒ Chọn đáp án A Đáp án: A
Câu 3 [705768]: Trong thành phần của một loại phèn sắt có muối Fe2(SO4)3 và một loại phèn nhôm có muối Al2(SO4)3. Kí hiệu chung của hai muối sulfate trên là M2(SO4)3. Khi hoà tan hoàn toàn phèn sắt hoặc phèn nhôm vào nước có một số quá trình quan trọng sau:
M2(SO4)3(aq) 2M3+(aq) + 3SO42–(aq) (1)
2M3+(aq) + 3SO42–(aq) (1)
M3+(aq) + 6H2O(l) [M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) + mH2O(l) [M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
[M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
Cho các phát biểu sau:
(a) Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3).
(b) Trong nước, [M(OH2)6]3+ là một acid theo Brønsted – Lowry.
(c) Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 2.
(d) Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu.
Các phát biểu đúng là
M2(SO4)3(aq)
 2M3+(aq) + 3SO42–(aq) (1)
2M3+(aq) + 3SO42–(aq) (1)M3+(aq) + 6H2O(l)
 [M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) (2)[M(OH2)6]3+(aq) + mH2O(l)
 [M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
[M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)Cho các phát biểu sau:
(a) Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3).
(b) Trong nước, [M(OH2)6]3+ là một acid theo Brønsted – Lowry.
(c) Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 2.
(d) Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu.
Các phát biểu đúng là
A, (a), (b).
B, (a), (c).
C, (a), (b), (c).
D, (a), (b), (d).
Phân tích các phát biểu:
(a) Đúng. Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3). Giải thích ion M3+ là một acid theo Brønsted – Lowry.
(b) Đúng. Trong nước, [M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted - Lowry.
(c) Sai. Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 3 thì phức chất trung hòa về điện tạo dạng kết tủa không tan [M(OH)3(OH2)3] có khả năng làm trong nước
(d) Đúng. Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu do[M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted – Lowry.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án D Đáp án: D
(a) Đúng. Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3). Giải thích ion M3+ là một acid theo Brønsted – Lowry.
(b) Đúng. Trong nước, [M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted - Lowry.
(c) Sai. Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 3 thì phức chất trung hòa về điện tạo dạng kết tủa không tan [M(OH)3(OH2)3] có khả năng làm trong nước
(d) Đúng. Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu do[M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted – Lowry.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án D Đáp án: D
Câu 4 [705367]: Tiến hành cho từ từ dung dịch sodium choride bão hoà đến dư vào dung dịch copper(II) sulfate loãng, chỉ thấy dấu hiệu nhạt màu, không thấy dấu hiệu dung dịch chuyển sang màu khác. Nếu tiến hành thí nghiệm thay bằng dung dịch hydrochloric acid đặc và dung dịch copper(II) sulfate thì dung dịch chuyển sang màu vàng.
Cho các phát biểu sau:
(a) Trong dung dịch CuSO4, ion Cu2+ tồn tại ở dạng phức chất aqua [Cu(OH2)6]2+.
(b) Dung dịch chuyển sang màu vàng là dấu hiệu của sự hình thành phức chất.
(c) Khả năng thay thế phối tử trong phức chất không phụ thuộc vào nồng độ của anion Cl trong dung dịch.
(d) Nồng độ Cl– trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl– trong dung dịch hydrochloric acid đặc.
Các phát biểu đúng là
Cho các phát biểu sau:
(a) Trong dung dịch CuSO4, ion Cu2+ tồn tại ở dạng phức chất aqua [Cu(OH2)6]2+.
(b) Dung dịch chuyển sang màu vàng là dấu hiệu của sự hình thành phức chất.
(c) Khả năng thay thế phối tử trong phức chất không phụ thuộc vào nồng độ của anion Cl trong dung dịch.
(d) Nồng độ Cl– trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl– trong dung dịch hydrochloric acid đặc.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Cu2+(aq) + 6H2O(l) →[Cu(OH2)6]2+(aq)
✔️ (b) Đúng. Nhỏ vài giọt dung dịch HCI đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
[Cu(OH2)6]2 +(aq) + Cl-(aq) → [CuCl4]2+ (aq) + 6H2O(l)
❌ (c) Sai. Khả năng thay thế phối tử trong phức chất không phụ thuộc vào khả năng tương tác giữa phối tử và ion nguyên tử trung tâm, phối tử anion Cl- tương tác mạnh hơn phối tử trung hòa aqua trong dung dịch.
✔️ (d) Đúng. Nồng độ Cl- trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl- trong dung dịch hydrochloric acid đặc nguyên do độ tan trong nước của HCl (725g/L) ở 20 độ C) cao hơn nhiều so với NaCl (35,9 g/100 mL)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Cu2+(aq) + 6H2O(l) →[Cu(OH2)6]2+(aq)
✔️ (b) Đúng. Nhỏ vài giọt dung dịch HCI đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
[Cu(OH2)6]2 +(aq) + Cl-(aq) → [CuCl4]2+ (aq) + 6H2O(l)
❌ (c) Sai. Khả năng thay thế phối tử trong phức chất không phụ thuộc vào khả năng tương tác giữa phối tử và ion nguyên tử trung tâm, phối tử anion Cl- tương tác mạnh hơn phối tử trung hòa aqua trong dung dịch.
✔️ (d) Đúng. Nồng độ Cl- trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl- trong dung dịch hydrochloric acid đặc nguyên do độ tan trong nước của HCl (725g/L) ở 20 độ C) cao hơn nhiều so với NaCl (35,9 g/100 mL)
⇒ Chọn đáp án C Đáp án: C
Câu 5 [705786]: Muối CoCl2 khan có màu xanh. Hòa tan một lượng muối này vào nước, thu được dung dịch màu hồng (có chứa phức chất X). Nhúng mảnh giấy lọc vào dung dịch này, sấy khô, thu được mảnh giấy có màu xanh (giấy Y). Giấy Y được sử dụng làm giấy chỉ thị để phát hiện nước. Cho các phát biểu sau:
(a) CoCl2 là hợp chất của kim loại chuyển tiếp.
(b) Phức chất X không chứa phối tử aqua (phối tử H2O).
(c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
(d) Khi nhỏ giọt nước lên giấy Y, giấy Y chuyển màu.
Trong các phát biểu trên, những phát biểu đúng là
(a) CoCl2 là hợp chất của kim loại chuyển tiếp.
(b) Phức chất X không chứa phối tử aqua (phối tử H2O).
(c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
(d) Khi nhỏ giọt nước lên giấy Y, giấy Y chuyển màu.
Trong các phát biểu trên, những phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (d).
D, (c), (d).
Phân tích các đáp án:
✔️ (a) Đúng. Cobalt (Co) là kim loại chuyển tiếp thuộc nhóm VIIIB (nhóm 9) trong bảng tuần hoàn.CoCl2 là muối của kim loại chuyển tiếp.
❌ (b) Sai. Khi hòa tan CoCl2 khan (màu xanh) vào nước, thu được dung dịch màu hồng do tạo thành phức chất [Co(H2O)6]2+.
CoCl2 + 6H2O → [Co(H2O)6]2+ + 2Cl−
Phức chất có chứa phối tử aqua (H2O).
❌ (c) Sai. Trong phức chất [Co(H2O)6]2+, nguyên tử trung tâm Co2+ liên kết với phối tử H2O bằng liên kết cho nhận, không phải liên kết ion. Liên kết ion chỉ xuất hiện giữa ion phức với các ion đối (ví dụ Cl−).
✔️ (d) Đúng. Giấy Y (đã tẩm CoCl2 khan, màu xanh) hấp thụ nước tạo thành [Co(H2O)6]2+, có màu hồng. Ứng dụng: Giấy này được dùng làm chỉ thị phát hiện hơi nước.
⟹ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Cobalt (Co) là kim loại chuyển tiếp thuộc nhóm VIIIB (nhóm 9) trong bảng tuần hoàn.CoCl2 là muối của kim loại chuyển tiếp.
❌ (b) Sai. Khi hòa tan CoCl2 khan (màu xanh) vào nước, thu được dung dịch màu hồng do tạo thành phức chất [Co(H2O)6]2+.
CoCl2 + 6H2O → [Co(H2O)6]2+ + 2Cl−
Phức chất có chứa phối tử aqua (H2O).
❌ (c) Sai. Trong phức chất [Co(H2O)6]2+, nguyên tử trung tâm Co2+ liên kết với phối tử H2O bằng liên kết cho nhận, không phải liên kết ion. Liên kết ion chỉ xuất hiện giữa ion phức với các ion đối (ví dụ Cl−).
✔️ (d) Đúng. Giấy Y (đã tẩm CoCl2 khan, màu xanh) hấp thụ nước tạo thành [Co(H2O)6]2+, có màu hồng. Ứng dụng: Giấy này được dùng làm chỉ thị phát hiện hơi nước.
⟹ Chọn đáp án C Đáp án: C
Câu 6 [705839]: Dichloro(ethylenediamine)platinum(II) có công thức PtCl2(en) là một loại bột màu vàng, được sử dụng làm chất xúc tác tiền chất trong công nghiệp và cũng là chất phản ứng bắt đầu cho quá trình mạ điện, một số hợp chất platinum có khả năng chống ung thư.
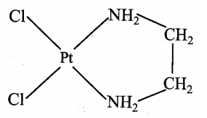
Cho các phát biểu sau:
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho – nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Số phát biểu đúng là

Cho các phát biểu sau:
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho – nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Số phát biểu đúng là
A, 2.
B, 3.
C, 4.
D, 5.
Phân tích các đáp án:
✔️(a) – Đúng. Điện tích của phức chất bằng 0. Nguyên tử trung tâm Pt có điện tích là 2+ và có 2 phối tử Cl- và phối tử trung hòa H2NCH2CH2NH2.
❌(b) – Sai. Mỗi phối tử có số dung lượng phối trí khác nhau Cl- có dung lượng phối trí là 1 nên có 1 liên kết với ion nguyên tử trung tâm và H2NCH2CH2NH2 có dung lượng phối trí là 2 nên có 2 liên kết với ion nguyên tử trung tâm
❌(c) – Sai. Số oxi hoá của nguyên tử trung tâm trong phức chất là +2.
✔️(d) – Đúng. Liên kết trong phức chất là liên kết cho – nhận (trường hợp của liên kết cộng hóa trị) nên phân tử hoặc anion cần có cặp electron hóa trị riêng.
✔️(e) – Đúng. Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Có 3 nhận định đúng.
⟹ Chọn đáp án B Đáp án: B
✔️(a) – Đúng. Điện tích của phức chất bằng 0. Nguyên tử trung tâm Pt có điện tích là 2+ và có 2 phối tử Cl- và phối tử trung hòa H2NCH2CH2NH2.
❌(b) – Sai. Mỗi phối tử có số dung lượng phối trí khác nhau Cl- có dung lượng phối trí là 1 nên có 1 liên kết với ion nguyên tử trung tâm và H2NCH2CH2NH2 có dung lượng phối trí là 2 nên có 2 liên kết với ion nguyên tử trung tâm
❌(c) – Sai. Số oxi hoá của nguyên tử trung tâm trong phức chất là +2.
✔️(d) – Đúng. Liên kết trong phức chất là liên kết cho – nhận (trường hợp của liên kết cộng hóa trị) nên phân tử hoặc anion cần có cặp electron hóa trị riêng.
✔️(e) – Đúng. Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Có 3 nhận định đúng.
⟹ Chọn đáp án B Đáp án: B
Câu 7 [705889]: Khi hoà tan hợp chất AgNO3 vào nước, ion Ag+ sẽ tạo phức với các phối tử aqua, đây là phức chất hiếm hoi tồn tại ở dạng hình học tứ diện [Ag(OH2)m]+(aq).
Có các phát biểu dưới đây về phức chất:
(a) có điện tích là +1.
(b) tan tốt trong nước.
(c) có giá trị của m là 4.
(d) kém bền hơn cation Ag+(aq).
(e) tạo thành do cation Ag+(aq) nhận cặp electron hoá trị riêng của các phân tử nước.
Số phát biểu đúng là
Có các phát biểu dưới đây về phức chất:
(a) có điện tích là +1.
(b) tan tốt trong nước.
(c) có giá trị của m là 4.
(d) kém bền hơn cation Ag+(aq).
(e) tạo thành do cation Ag+(aq) nhận cặp electron hoá trị riêng của các phân tử nước.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các đáp án:
✔️ (a) – Đúng. Phức chất [Ag(OH2)m]+(aq) có điện tích là +1.
✔️ (b) – Đúng. Phức chất [Ag(OH2)m]+(aq) tan tốt trong nước.
✔️ (c) – Đúng. Phức chất [Ag(OH2)m]+(aq) có dạng tứ diện nên m = 4.
❌ (d) – Sai. Hòa tan AgNO3 vào nước thì thu được dung dịch chứa phức chất [Ag(OH2)m]+ (một chất sẽ chuyển thành dạng bền hơn của chính nó).
✔️(e) – Đúng. Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
Có 4 phát biểu đúng.
⟹ Chọn đáp án D Đáp án: D
✔️ (a) – Đúng. Phức chất [Ag(OH2)m]+(aq) có điện tích là +1.
✔️ (b) – Đúng. Phức chất [Ag(OH2)m]+(aq) tan tốt trong nước.
✔️ (c) – Đúng. Phức chất [Ag(OH2)m]+(aq) có dạng tứ diện nên m = 4.
❌ (d) – Sai. Hòa tan AgNO3 vào nước thì thu được dung dịch chứa phức chất [Ag(OH2)m]+ (một chất sẽ chuyển thành dạng bền hơn của chính nó).
✔️(e) – Đúng. Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học của phức chất.
Có 4 phát biểu đúng.
⟹ Chọn đáp án D Đáp án: D
Câu 8 [705913]: Dạng hình học của phức chất được xác nhận bằng thực nghiệm. Phức chất mà xung quanh nguyên tử trung tâm có 4 liên kết σ thường có dạng hình học là tứ diện hoặc vuông phẳng và được gọi là phức chất tứ diện hoặc phức chất vuông phẳng. Phức chất mà xung quanh nguyên tử trung tâm có 6 liên kết σ có dạng hình học là bát diện và được gọi là phức chất bát diện. Cấu trúc của phức chất [PtCl4]2– được cho dưới đây:
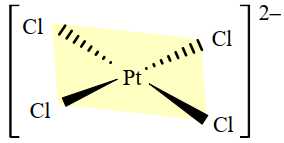
Cho các phát biểu sau:
(a) Phức chất có 4 liên kết xung quanh nguyên tử trung tâm.
(b) Phức chất có dạng hình học là tứ diện.
(c) Hai liên kết Pt–Cl kế cận nhau trong phức chất tạo thành một góc 90o.
(d) Phức chất có thể kết hợp với hai cation K+ để tạo thành hợp chất trung hòa điện.
Số phát biểu đúng là

Cho các phát biểu sau:
(a) Phức chất có 4 liên kết xung quanh nguyên tử trung tâm.
(b) Phức chất có dạng hình học là tứ diện.
(c) Hai liên kết Pt–Cl kế cận nhau trong phức chất tạo thành một góc 90o.
(d) Phức chất có thể kết hợp với hai cation K+ để tạo thành hợp chất trung hòa điện.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) – Đúng. Phức chất [PtCl4]2- có ion nguyên tử trung tâm là Pt2+ và 4 phối tử Cl- liên kết với nguyên tử trung tâm.
❌ (b) – Sai. Từ cấu tạo, phức chất [PtCl4]2- có dạng vuông phẳng.
✔️(c) – Đúng. [PtCl4]2- là phức chất vuông phẳng. Hai liên kết Pt-Cl kế cận nhau trong anion [PtCl4]2- tạo thành một góc liên kết. Thực nghiệm xác nhận trong anion [PtCl4]- có bốn góc liên kết đều có giá trị xấp xỉ 90°.
✔️ (d) – Đúng. Phức chất [PtCl4]2- là phức chất anion có điện tích 2- nên cần 2 cation K+ để trung hòa về điện.
Có 3 phát biểu đúng.
⟹ Chọn đáp án C Đáp án: C
✔️ (a) – Đúng. Phức chất [PtCl4]2- có ion nguyên tử trung tâm là Pt2+ và 4 phối tử Cl- liên kết với nguyên tử trung tâm.
❌ (b) – Sai. Từ cấu tạo, phức chất [PtCl4]2- có dạng vuông phẳng.
✔️(c) – Đúng. [PtCl4]2- là phức chất vuông phẳng. Hai liên kết Pt-Cl kế cận nhau trong anion [PtCl4]2- tạo thành một góc liên kết. Thực nghiệm xác nhận trong anion [PtCl4]- có bốn góc liên kết đều có giá trị xấp xỉ 90°.
✔️ (d) – Đúng. Phức chất [PtCl4]2- là phức chất anion có điện tích 2- nên cần 2 cation K+ để trung hòa về điện.
Có 3 phát biểu đúng.
⟹ Chọn đáp án C Đáp án: C
Câu 9 [705968]: Cho các quá trình tạo phức chất bát diện sau:
Fe3+(aq) + 6H2O(l) ⟶ [Fe(OH2)6]3+(aq) (I)
[Fe(OH2)6]3+(aq) + SCN–(aq) ⇌ [Fe(OH2)5(SCN)]2+(aq) + H2O(1) K = 1,4.102 (II)
[Fe(OH2)6]3+(aq) + F– (l) ⇌ [Fe(OH2)5F]2+(aq) + H2O(l) K = 2,0.105 (III)
Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN–, F– đều không có màu.
Cho các phát biểu sau:
(a) Quá trình (I) xảy ra khi hoà tan FeCl3 trong nước và dung dịch thu được có chứa lượng lớn cation Fe3+ và phức chất aqua [Fe(OH2)6]3+.
(b) So với anion F–, anion SCN– dễ thay thế phối tử H2O trong [Fe(OH)6]3+ hơn.
(c) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu.
(d) Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN– hay anion F– đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
Số phát biểu đúng là
Fe3+(aq) + 6H2O(l) ⟶ [Fe(OH2)6]3+(aq) (I)
[Fe(OH2)6]3+(aq) + SCN–(aq) ⇌ [Fe(OH2)5(SCN)]2+(aq) + H2O(1) K = 1,4.102 (II)
[Fe(OH2)6]3+(aq) + F– (l) ⇌ [Fe(OH2)5F]2+(aq) + H2O(l) K = 2,0.105 (III)
Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN–, F– đều không có màu.
Cho các phát biểu sau:
(a) Quá trình (I) xảy ra khi hoà tan FeCl3 trong nước và dung dịch thu được có chứa lượng lớn cation Fe3+ và phức chất aqua [Fe(OH2)6]3+.
(b) So với anion F–, anion SCN– dễ thay thế phối tử H2O trong [Fe(OH)6]3+ hơn.
(c) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu.
(d) Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN– hay anion F– đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu :
❌(a) – Sai. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau
Mn+(aq) + m H2O(l) → [M(OH2)m]n+(aq)
Quá trình (I) xảy ra khi hoà tan FeCl3 trong nước và dung dịch thu được có chứa lượng lớn phức chất aqua [Fe(OH2)6] 3+
❌(b) – Sai. So với anion F-, anion SCN khó thay thế phối tử H2O trong [Fe(OH)6]3+ hơn nguyên do hằng số cân bằng của phản ứng thế anion SCN- là 1,4.102 nhỏ hơn rất nhiều so với phản ứng thế F- là 2.105
✔️(c) – Đúng. Phản ứng (III) thuận nghịch nên vẫn còn phức [Fe(OH2)6]3+(aq), sẽ xảy ra phản ứng (II) tạo phức chất màu đỏ.
✔️(d) – Đúng. Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+ Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm.
Có 2 phát biểu đúng.
⟹Chọn đáp án C Đáp án: B
❌(a) – Sai. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau
Mn+(aq) + m H2O(l) → [M(OH2)m]n+(aq)
Quá trình (I) xảy ra khi hoà tan FeCl3 trong nước và dung dịch thu được có chứa lượng lớn phức chất aqua [Fe(OH2)6] 3+
❌(b) – Sai. So với anion F-, anion SCN khó thay thế phối tử H2O trong [Fe(OH)6]3+ hơn nguyên do hằng số cân bằng của phản ứng thế anion SCN- là 1,4.102 nhỏ hơn rất nhiều so với phản ứng thế F- là 2.105
✔️(c) – Đúng. Phản ứng (III) thuận nghịch nên vẫn còn phức [Fe(OH2)6]3+(aq), sẽ xảy ra phản ứng (II) tạo phức chất màu đỏ.
✔️(d) – Đúng. Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+ Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm.
Có 2 phát biểu đúng.
⟹Chọn đáp án C Đáp án: B
Câu 10 [705992]: Cho hai quá trình sau:
[Cu(OH2)6]2+(aq) + 2NH3(aq) [Cu(NH3)2(OH2)4]2+(aq) + 2H2O(l)
[Cu(OH2)6]2+(aq) + en(aq) [Cu(en)(OH2)4]2+(aq) + 2H2O(l)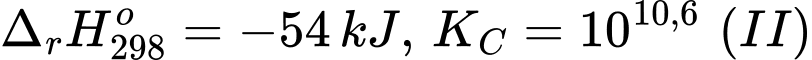
Trong đó, en là ethylenediamine. Phân tử này đã dùng tất cả các cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation Cu2+. Cho các phát biểu sau:
(a) Quá trình (II) thuận lợi hơn quá trình (I) về năng lượng.
(b) Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất bền hơn so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en.
(c) Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en)(OH2)4]2+ đều có 6 liên kết σ.
(d) Phản ứng diễn ra ở quá trình (I) và (II) đều có sự tạo thành phức chất không tan và có sự biến đổi màu sắc.Các phát biểu đúng là
[Cu(OH2)6]2+(aq) + 2NH3(aq) [Cu(NH3)2(OH2)4]2+(aq) + 2H2O(l)

[Cu(OH2)6]2+(aq) + en(aq) [Cu(en)(OH2)4]2+(aq) + 2H2O(l)
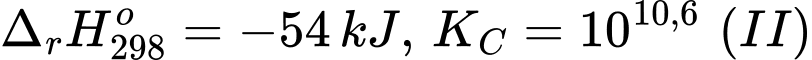
Trong đó, en là ethylenediamine. Phân tử này đã dùng tất cả các cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation Cu2+. Cho các phát biểu sau:
(a) Quá trình (II) thuận lợi hơn quá trình (I) về năng lượng.
(b) Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất bền hơn so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en.
(c) Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en)(OH2)4]2+ đều có 6 liên kết σ.
(d) Phản ứng diễn ra ở quá trình (I) và (II) đều có sự tạo thành phức chất không tan và có sự biến đổi màu sắc.Các phát biểu đúng là
A, (a), (c).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu :
✔️(a) – Đúng. Quá trình (II) thuận lợi hơn quá trình (I) về mặt năng lượng do có lượng năng lượng tỏa ra lớn hơn và hằng số cân bằng lớn hơn.
❌(b) – Sai. Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất không bền so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en do có hằng số cân bằng 107,7 nhỏ hơn 1010,6 của quá trình (II)
✔️(c) – Đúng. Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en) (OH2)4]2+ đều có 6 liên kết σ, xung quanh nguyên tử trung tâm đều có 6 liên kết cho nhận, NH3 và H2O có dung lượng phối trí là 1 và en có dung lượng phối trí là 2.
❌(d) – Sai. Cả hai quá trình đều tạo ra phức chất tan trong dung dịch. Tuy nhiên, chúng có sự biến đổi màu sắc, do sự thay đổi phối tử xung quanh ion Cu2+
⟹ Có 2 phát biểu đúng là (a),(c)
⟹ Chọn đáp án A Đáp án: A
✔️(a) – Đúng. Quá trình (II) thuận lợi hơn quá trình (I) về mặt năng lượng do có lượng năng lượng tỏa ra lớn hơn và hằng số cân bằng lớn hơn.
❌(b) – Sai. Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất không bền so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en do có hằng số cân bằng 107,7 nhỏ hơn 1010,6 của quá trình (II)
✔️(c) – Đúng. Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en) (OH2)4]2+ đều có 6 liên kết σ, xung quanh nguyên tử trung tâm đều có 6 liên kết cho nhận, NH3 và H2O có dung lượng phối trí là 1 và en có dung lượng phối trí là 2.
❌(d) – Sai. Cả hai quá trình đều tạo ra phức chất tan trong dung dịch. Tuy nhiên, chúng có sự biến đổi màu sắc, do sự thay đổi phối tử xung quanh ion Cu2+
⟹ Có 2 phát biểu đúng là (a),(c)
⟹ Chọn đáp án A Đáp án: A
Câu 11 [705936]: Một mẫu nước có chứa các ion Ca2+, [Cu(OH2)6]2+, [Fe(OH2)6]2+, Na+, Cl–, SO42–. Sau một thời gian tiếp xúc với không khí, mẫu nước này chuyển sang màu vàng và nổi váng màu nâu do quá trình:
[M(OH2)6]n+(aq) + mH2O(l) ⇌ [M(OH)m(OH2)6–m](n–m)+(aq hoặc s) + mH3O+(aq) (3)
Cho các phát biểu sau:
(a) Mẫu nước trên có pH lớn hơn 7.
(b) Ion bị oxi hoá và gây nên hiện tượng trên là [Fe(OH2)6]2+.
(c) Trong nước, ion H+ nhận cặp electron từ H2O để tạo thành ion H3O+.
(d) Chất màu nâu sinh trong mô tả trên là phức chất có công thức là [Fe(OH)2(OH2)4].
Các phát biểu đúng là
[M(OH2)6]n+(aq) + mH2O(l) ⇌ [M(OH)m(OH2)6–m](n–m)+(aq hoặc s) + mH3O+(aq) (3)
Cho các phát biểu sau:
(a) Mẫu nước trên có pH lớn hơn 7.
(b) Ion bị oxi hoá và gây nên hiện tượng trên là [Fe(OH2)6]2+.
(c) Trong nước, ion H+ nhận cặp electron từ H2O để tạo thành ion H3O+.
(d) Chất màu nâu sinh trong mô tả trên là phức chất có công thức là [Fe(OH)2(OH2)4].
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu:
❌(a) – Sai. Mẫu nước trên có pH nhỏ hơn 7. Trong quá trình phức chất phân li trong nước sinh ra H3O+ có tính acid nên tạo môi trường acid có pH nhỏ hơn 7.
✔️(b) – Đúng. Sau một thời gian tiếp xúc với không khí, mẫu nước này chuyển sang màu vàng và nổi váng màu nâu do quá trình lon bị oxi hoá và gây nên hiện tượng trên chất phù hợp là [Fe(OH2)6]2+.
✔️(c) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H+ + H2O → H3O+
❌(d) – Sai. Chất trong mô tả trên là phức chất có công thức là [Fe(OH)2(OH2)4] có màu trắng xanh, sau khi tiếp xúc với không khí chuyển sang màu vàng và nổi váng màu nâu.
Các phát biểu đúng là (b), (c)
⟹ Chọn đáp án B Đáp án: B
❌(a) – Sai. Mẫu nước trên có pH nhỏ hơn 7. Trong quá trình phức chất phân li trong nước sinh ra H3O+ có tính acid nên tạo môi trường acid có pH nhỏ hơn 7.
✔️(b) – Đúng. Sau một thời gian tiếp xúc với không khí, mẫu nước này chuyển sang màu vàng và nổi váng màu nâu do quá trình lon bị oxi hoá và gây nên hiện tượng trên chất phù hợp là [Fe(OH2)6]2+.
✔️(c) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H+ + H2O → H3O+
❌(d) – Sai. Chất trong mô tả trên là phức chất có công thức là [Fe(OH)2(OH2)4] có màu trắng xanh, sau khi tiếp xúc với không khí chuyển sang màu vàng và nổi váng màu nâu.
Các phát biểu đúng là (b), (c)
⟹ Chọn đáp án B Đáp án: B
Câu 12 [706081]: Khi hoà tan zinc(II) chloride trong nước diễn ra một số quá trình cơ bản sau:
Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I)
[Zn(OH2)6]2+(aq) ⇌ [Zn(OH)(OH2)5]+(aq) + H+(aq); KC = 10–9 (II)
H+(aq) + H2O(l) → H3O+(aq) (III)
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Brønsted–Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Brønsted–Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Brønsted–Lowry.
Số phát biểu đúng là:
Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I)
[Zn(OH2)6]2+(aq) ⇌ [Zn(OH)(OH2)5]+(aq) + H+(aq); KC = 10–9 (II)
H+(aq) + H2O(l) → H3O+(aq) (III)
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Brønsted–Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Brønsted–Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Brønsted–Lowry.
Số phát biểu đúng là:
A, 2.
B, 3.
C, 4.
D, 5.
Phân tích các phát biểu :
❌(1) – Sai. vì quá trình (II) xảy ra không hoàn toàn (thuận nghịch)
✔️(2) – Đúng. Trong dung dịch [Zn(OH2)6]2+ phân li ra H+ nên coi là acid theo Arrhenius.
✔️(3) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H2O nhận H+ nên là base.
✔️(4) – Đúng. Từ quá trình (I), (II) và (III) suy ra "trong nước, cation Zn2+ là acid theo Bronsted-Lowry", Zn2+ là chất nhường proton (H+)
❌(5) – Sai. Hằng số cân bằng của quá trình phân li nhỏ 10-9 nên phân lí ra lượng H+ nhỏ tính acid yếu.
✔️(6) – Đúng. Trong dung dịch zinc (II) chloride, nước vừa là dung môi (môi trường điện li), vừa đóng vai trò base (chất nhận proton) theo Bronsted-Lowry.
Có 4 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
❌(1) – Sai. vì quá trình (II) xảy ra không hoàn toàn (thuận nghịch)
✔️(2) – Đúng. Trong dung dịch [Zn(OH2)6]2+ phân li ra H+ nên coi là acid theo Arrhenius.
✔️(3) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H2O nhận H+ nên là base.
✔️(4) – Đúng. Từ quá trình (I), (II) và (III) suy ra "trong nước, cation Zn2+ là acid theo Bronsted-Lowry", Zn2+ là chất nhường proton (H+)
❌(5) – Sai. Hằng số cân bằng của quá trình phân li nhỏ 10-9 nên phân lí ra lượng H+ nhỏ tính acid yếu.
✔️(6) – Đúng. Trong dung dịch zinc (II) chloride, nước vừa là dung môi (môi trường điện li), vừa đóng vai trò base (chất nhận proton) theo Bronsted-Lowry.
Có 4 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
Sử dụng thông tin dưới đây để trả lời các câu 13 – 14:
Khi hydrochloric acid đặc được thêm vào dung dịch copper(II) sulfate, ion Cl– sẽ phá hủy phức chất aqua để tạo thành phức chất mới [CuCl4]2–.
[Cu(H2O)6]2+(aq) + Cl–(aq) ↔ [CuCl4]2−(aq) + 6H2O(l)
xanh lam vàng
Dung dịch nước thu được được tạo thành chứa các ion phức hợp [CuCl4]2− và [Cu(H2O)6]2+.
[Cu(H2O)6]2+(aq) + Cl–(aq) ↔ [CuCl4]2−(aq) + 6H2O(l)
xanh lam vàng
Dung dịch nước thu được được tạo thành chứa các ion phức hợp [CuCl4]2− và [Cu(H2O)6]2+.
Câu 13 [705865]: Dung dịch nước sau phản ứng chứa hỗn hợp hai phức chất có màu
A, xanh lam.
B, xanh lục.
C, vàng.
D, đỏ.
Sau phản ứng có hình thành phức chất [CuCl2]2-(aq), phức chất ban đầu là [Cu(H2O)6]2+ màu xanh sau phản ứng dung dịch chuyển sang màu xanh lục do phản ứng là phản ứng thuận nghịch, chưa cả [CuCl2]2- màu vàng và [Cu(H2O)6]2+ màu xanh lam.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 14 [705866]: Sự trao đổi các phối tử diễn ra từng bước khi các phối tử lần lượt được thay thế. Ví dụ, bước thứ hai trong quá trình trao đổi phối tử H2O với phối tử Cl– được thể hiện bằng phương trình này:
[Cu(H2O)5Cl]+(aq) + Cl–(aq) ⇄ Cu(H2O)4Cl2(aq) + H2O(l)
Người ta thấy rằng đối với phản ứng này, với nồng độ đầu của phức chất [(Cu(H2O)5Cl]+ là 0,15 M và HCl là 0,15 M thì tại thời điểm cân bằng, nồng độ của phức Cu(H2O)4Cl2(aq) là 0,10 M. Hằng số cân bằng KC của phản ứng trên là
[Cu(H2O)5Cl]+(aq) + Cl–(aq) ⇄ Cu(H2O)4Cl2(aq) + H2O(l)
Người ta thấy rằng đối với phản ứng này, với nồng độ đầu của phức chất [(Cu(H2O)5Cl]+ là 0,15 M và HCl là 0,15 M thì tại thời điểm cân bằng, nồng độ của phức Cu(H2O)4Cl2(aq) là 0,10 M. Hằng số cân bằng KC của phản ứng trên là
A, 4,4.
B, 8,8.
C, 40,0.
D, 84,4.
Phương trình phản ứng:
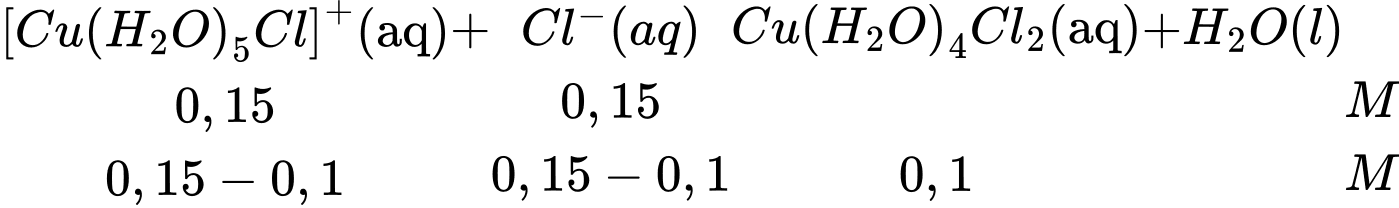
Hằng số cân bằng KC của phản ứng trên là:
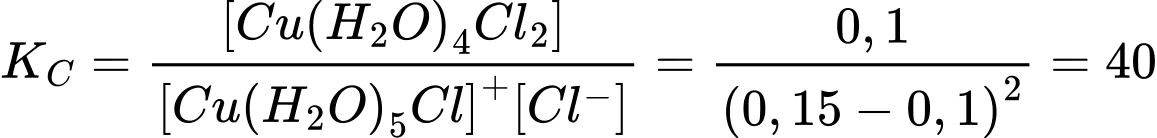
⟹Chọn đáp án C Đáp án: C
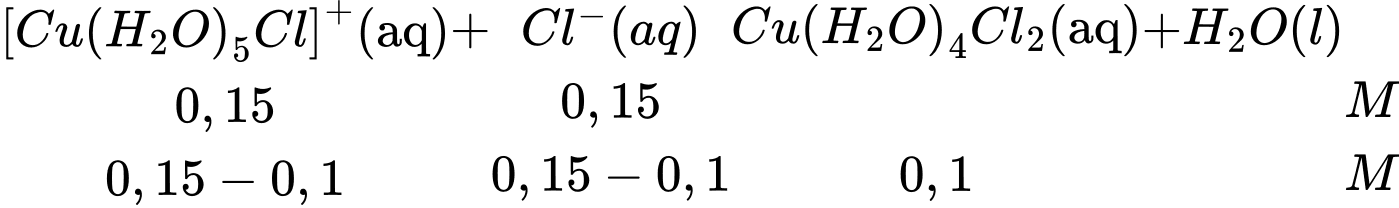
Hằng số cân bằng KC của phản ứng trên là:
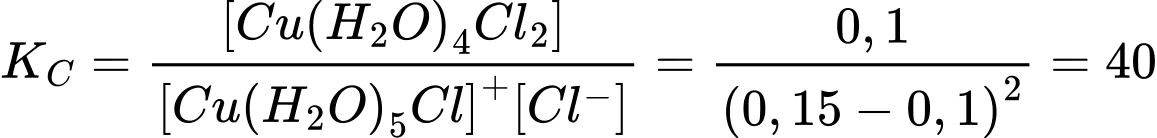
⟹Chọn đáp án C Đáp án: C
Sử dụng đoạn thông tin dưới đây để trả lời câu 15 và câu 16:
Hemoglobin là thành phần cấu tạo nên hồng cầu trong các mạch máu. Mỗi phân tử hemoglobin chứa 4 heme B. Heme B kết hợp thêm một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mô. Heme B cũng kết hợp được với phân tử carbon monoxide (CO). Khi con người hít thở không khí có nồng độ CO cao (như không khí ở các đám cháy, không khí trong nhà kín có đốt than để sưởi ấm có thể bị hôn mê, thậm chí tử vong.
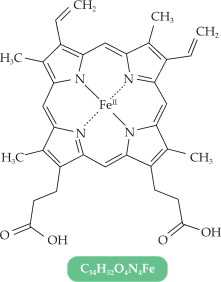

Câu 15 [705481]: Trong heme B có bao nhiêu phối tử liên kết với nguyên tử trung tâm.
A, 1.
B, 2.
C, 3.
D, 4.
Phối tử đa càng là loại phối tử có nhiều vị trí liên kết với ion trung tâm, nhưng vẫn được xem là một phối tử duy nhất.
Trong heme B, vòng porphyrin đóng vai trò như một phối tử, liên kết với nguyên tử trung tâm Fe(II) bằng 4 nguyên tử nitrogen.
Mặc dù có 4 liên kết, nhưng vì chúng đều thuộc một vòng porphyrin, nên chỉ được tính là một phối tử.
⇒ Chọn đáp án A Đáp án: A
Trong heme B, vòng porphyrin đóng vai trò như một phối tử, liên kết với nguyên tử trung tâm Fe(II) bằng 4 nguyên tử nitrogen.
Mặc dù có 4 liên kết, nhưng vì chúng đều thuộc một vòng porphyrin, nên chỉ được tính là một phối tử.
⇒ Chọn đáp án A Đáp án: A
Câu 16 [705482]: Phát biểu nào dưới đây không đúng?
A, Nguyên tử trung tâm trong heme B là Fe.
B, Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 4 phân tử O2.
C, Liên kết giữa heme B với CO bền hơn liên kết giữa heme B với O2.
D, Dạng hình học của heme B là bát diện.
Phân tích các phát biểu:
✔️ A. Đúng. Trong heme B, nguyên tử trung tâm là sắt (Fe(II)), liên kết với vòng porphyrin.
✔️B. Đúng. Mỗi phân tử hemoglobin (Hb) có 4 tiểu đơn vị, mỗi tiểu đơn vị chứa 1 nhóm heme B.Mỗi heme B có thể liên kết với 1 phân tử O2, nên tối đa 1 hemoglobin có thể gắn 4 O2.
✔️ C. Đúng. Liên kết giữa Fe và CO trong heme B bền hơn liên kết giữa Fe và O2 gấp ~200-250 lần.Điều này giải thích tại sao CO rất độc, vì nó chiếm chỗ của O2 trong hemoglobin, khiến máu không vận chuyển được oxygen.
❌ D. Sai. Chỉ có 4 liên kết N-Fe nên không tạo hình bát diện.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. Trong heme B, nguyên tử trung tâm là sắt (Fe(II)), liên kết với vòng porphyrin.
✔️B. Đúng. Mỗi phân tử hemoglobin (Hb) có 4 tiểu đơn vị, mỗi tiểu đơn vị chứa 1 nhóm heme B.Mỗi heme B có thể liên kết với 1 phân tử O2, nên tối đa 1 hemoglobin có thể gắn 4 O2.
✔️ C. Đúng. Liên kết giữa Fe và CO trong heme B bền hơn liên kết giữa Fe và O2 gấp ~200-250 lần.Điều này giải thích tại sao CO rất độc, vì nó chiếm chỗ của O2 trong hemoglobin, khiến máu không vận chuyển được oxygen.
❌ D. Sai. Chỉ có 4 liên kết N-Fe nên không tạo hình bát diện.
⇒ Chọn đáp án D Đáp án: D
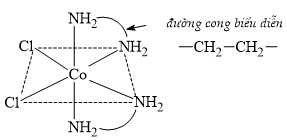
Câu 17 [702819]: Đối với các trường hợp đơn giản, trong phức chất, số phối trí là số liên kết được tạo thành giữa một nguyên tử kim loại trung tâm với các phối tử. Xét trường hợp của cobalt tạo thành một phức chất có cấu trúc đơn giản như hình bên.

Phân tích các phát biểu:
✔️ a) Đúng. Trong phức chất, số oxi hóa của cobalt là +2.
❌ b) Sai. Số phối tử của phức chất là 4 gồm gồm 2 phối tử Cl- và 2 phối tử đa càng H2N–CH2CH2–NH2 (mỗi phối tử tạo 2 liên kết).
✔️ c) Đúng. Phức chất có 6 đỉnh tạo thành dạng hình học bát diện.
❌ d) Sai. Có thể thay 2 phối tử Cl– bằng 1 phối tử NH2–CH2CH2–NH2 mà vẫn giữ nguyên số phối trí do 1 phối tử NH2–CH2CH2–NH2 tạo 2 liên kết.
✔️ a) Đúng. Trong phức chất, số oxi hóa của cobalt là +2.
❌ b) Sai. Số phối tử của phức chất là 4 gồm gồm 2 phối tử Cl- và 2 phối tử đa càng H2N–CH2CH2–NH2 (mỗi phối tử tạo 2 liên kết).
✔️ c) Đúng. Phức chất có 6 đỉnh tạo thành dạng hình học bát diện.
❌ d) Sai. Có thể thay 2 phối tử Cl– bằng 1 phối tử NH2–CH2CH2–NH2 mà vẫn giữ nguyên số phối trí do 1 phối tử NH2–CH2CH2–NH2 tạo 2 liên kết.
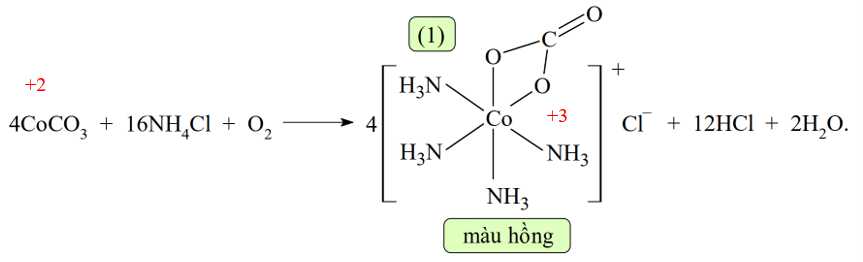
Câu 18 [829825]: Một bạn học sinh tiến hành thí nghiệm theo các bước sau:
▪ Bước 1: Oxi hóa muối CoCO3 và NH4Cl bằng không khí tạo ra phức chất (1) màu hồng:
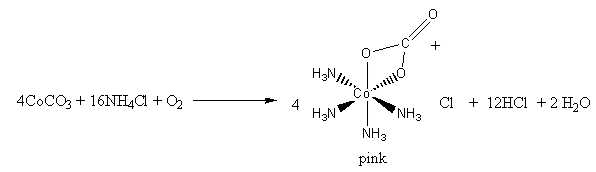
▪ Bước 2: Việc thêm HCl gây ra phản ứng acid/base với phối tử carbonate, giải phóng carbon dioxide và tạo thành phức chất (2) màu tím:
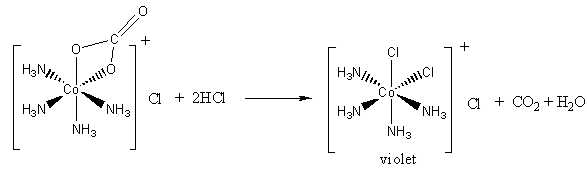
▪ Bước 1: Oxi hóa muối CoCO3 và NH4Cl bằng không khí tạo ra phức chất (1) màu hồng:

▪ Bước 2: Việc thêm HCl gây ra phản ứng acid/base với phối tử carbonate, giải phóng carbon dioxide và tạo thành phức chất (2) màu tím:

🌟 Phần phức đôi khi là một ion, đôi khi là một phân tử trung hòa. Do đó, để ám chỉ phần phức trong một chất hóa học, chúng ta gọi đó là "cầu nội" (inner-sphere).
🌟 Phần còn lại không có cấu tạo như một phức được gọi là "cầu ngoại" (outer-sphere).
🌟 Chẳng hạn, trong hợp chất [Ag(NH3)2]Cl, chỉ có phần [Ag(NH3)2]+ là phức, còn anion Cl- không phải là phức. Khi đó phần [Ag(NH3)2]+ được gọi là cầu nội, còn phần anion Cl- được gọi là cầu ngoại.
Phân tích các phát biểu:
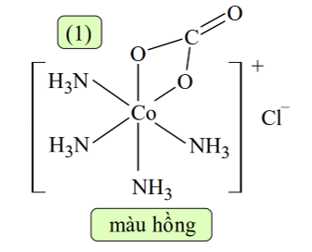
❌a. Sai. Phức chất (1) có chứa ion Cl- cầu ngoại và [Co(NH3)4CO3]+ là cầu nội.
❌b. Sai. Bước 1 có sự thay đổi số oxi hóa của nguyên tố Co từ +2 lên +3.
✔️c. Đúng. Muối CoCO3 khan (nếu điều chế và giữ khan được, dù rất hiếm vì CoCO3 dễ hút ẩm và thường tồn tại ở dạng ngậm nước) có màu hồng nhạt hoặc hồng xám.Kết tủa CoCO3 tan dần, dung dịch chuyển dần sang màu hồng đậm → chứng tỏ có sự hình thành phức chất.
✔️d. Đúng. Quá trình ở bước 2 không làm thay đổi dạng hình học bát diện của phức chất.
🌟 Phần còn lại không có cấu tạo như một phức được gọi là "cầu ngoại" (outer-sphere).
🌟 Chẳng hạn, trong hợp chất [Ag(NH3)2]Cl, chỉ có phần [Ag(NH3)2]+ là phức, còn anion Cl- không phải là phức. Khi đó phần [Ag(NH3)2]+ được gọi là cầu nội, còn phần anion Cl- được gọi là cầu ngoại.
Phân tích các phát biểu:
❌a. Sai. Phức chất (1) có chứa ion Cl- cầu ngoại và [Co(NH3)4CO3]+ là cầu nội.

❌b. Sai. Bước 1 có sự thay đổi số oxi hóa của nguyên tố Co từ +2 lên +3.

✔️c. Đúng. Muối CoCO3 khan (nếu điều chế và giữ khan được, dù rất hiếm vì CoCO3 dễ hút ẩm và thường tồn tại ở dạng ngậm nước) có màu hồng nhạt hoặc hồng xám.Kết tủa CoCO3 tan dần, dung dịch chuyển dần sang màu hồng đậm → chứng tỏ có sự hình thành phức chất.
✔️d. Đúng. Quá trình ở bước 2 không làm thay đổi dạng hình học bát diện của phức chất.

Câu 19 [829827]: Các phức chất dưới đây đều chứa nguyên tử trung tâm là Co:

Các phức chất đều có dạng hình học như sau, với X là các phối tử liên kết với nguyên tử trung tâm Co.
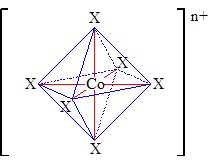

Các phức chất đều có dạng hình học như sau, với X là các phối tử liên kết với nguyên tử trung tâm Co.

Phân tích các phát biểu:
❌(a). Sai. Cả 4 phức chất đều có cùng dạng hình học bát diện.
✔️(b). Đúng. Coban đóng vai trò là nguyên tử trung tâm. Mỗi phối tử (ligand) liên kết với Co thông qua một cặp electron cho, tạo thành liên kết phối trí (còn gọi là liên kết sigma trong trường hợp đơn giản nhất). Tổng số liên kết sigma là 6, nghĩa là số phối tử hoặc tổng số vị trí liên kết là 6. → Đây là đặc điểm của các phức chất có số phối trí là 6, thường có hình học bát diện (octahedral).
✔️(c). Đúng. Khi số lượng phối tử Cl⁻ trong cầu nội tăng, thì điện tích của phân tử phức chất sẽ giảm (âm dần). Lý do là vì Cl⁻ mang điện tích âm, khi liên kết trực tiếp với ion kim loại trung tâm (thay thế các phối tử trung hòa như NH3, H2O...), tổng điện tích của phần phức sẽ trở nên âm hơn.
❌(d). Sai.
∎Phức chất (1) [Co(NH3)3Cl3] là phức trung hòa
∎Phức chất (2) [Co(NH3)4Cl2]Cl khi tan trong nước phân li ra [Co(NH3)4Cl2]+ và Cl-
∎Phức chất (3) [Co(NH3)6]Cl3 khi tan trong nước phân li ra [Co(NH3)6]3+ và 3Cl-
∎Phức chất (4) [Co(NH3)5Cl]Cl2 khi tan trong nước phân li ra [Co(NH3)5Cl]2+ và 2Cl-
→ Khả năng dẫn điện của các phức chất trong dung dịch giảm dần theo chiều: (3) > (4) > (2) > (1).
❌(a). Sai. Cả 4 phức chất đều có cùng dạng hình học bát diện.
✔️(b). Đúng. Coban đóng vai trò là nguyên tử trung tâm. Mỗi phối tử (ligand) liên kết với Co thông qua một cặp electron cho, tạo thành liên kết phối trí (còn gọi là liên kết sigma trong trường hợp đơn giản nhất). Tổng số liên kết sigma là 6, nghĩa là số phối tử hoặc tổng số vị trí liên kết là 6. → Đây là đặc điểm của các phức chất có số phối trí là 6, thường có hình học bát diện (octahedral).
✔️(c). Đúng. Khi số lượng phối tử Cl⁻ trong cầu nội tăng, thì điện tích của phân tử phức chất sẽ giảm (âm dần). Lý do là vì Cl⁻ mang điện tích âm, khi liên kết trực tiếp với ion kim loại trung tâm (thay thế các phối tử trung hòa như NH3, H2O...), tổng điện tích của phần phức sẽ trở nên âm hơn.
❌(d). Sai.
∎Phức chất (1) [Co(NH3)3Cl3] là phức trung hòa
∎Phức chất (2) [Co(NH3)4Cl2]Cl khi tan trong nước phân li ra [Co(NH3)4Cl2]+ và Cl-
∎Phức chất (3) [Co(NH3)6]Cl3 khi tan trong nước phân li ra [Co(NH3)6]3+ và 3Cl-
∎Phức chất (4) [Co(NH3)5Cl]Cl2 khi tan trong nước phân li ra [Co(NH3)5Cl]2+ và 2Cl-
→ Khả năng dẫn điện của các phức chất trong dung dịch giảm dần theo chiều: (3) > (4) > (2) > (1).
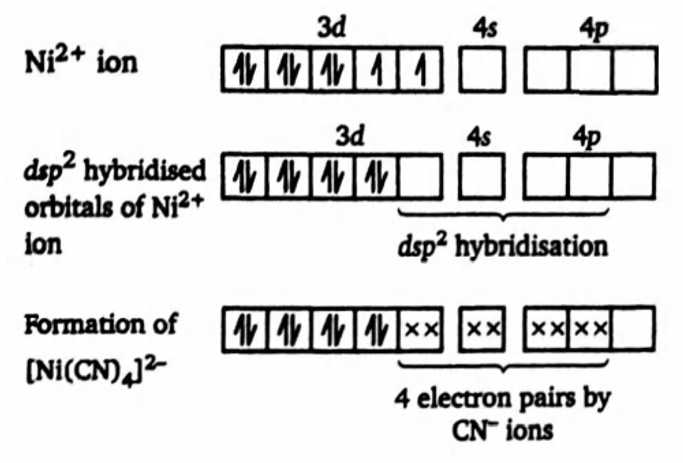
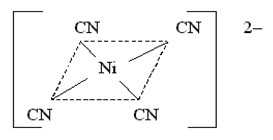
Câu 20 [829829]: Khi hình thành phức chất [Ni(CN)4]2–, các phối tử CN– tạo liên kết với nguyên tử trung tâm Ni, đồng thời nó sẽ tương tác làm thay đổi cấu hình electron của nguyên tử trung tâm, các electron sẽ được dồn lại để tạo ra các AO chứa cặp electron là tối đa.
Biết rằng cấu hình electron của ion Ni2+ tự do biểu diễn theo các AO như sau:
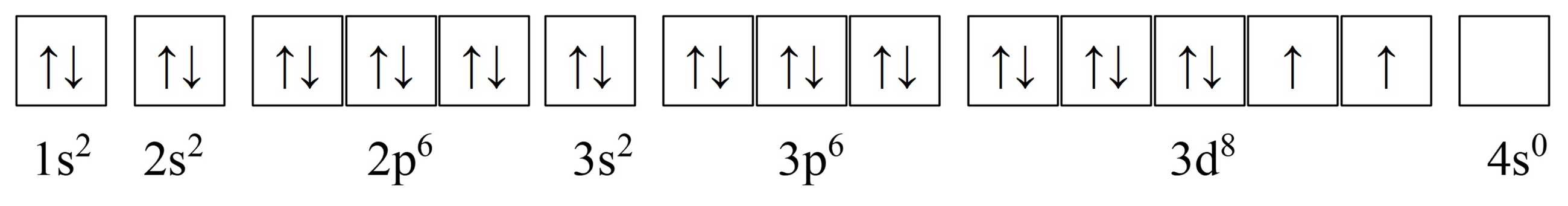

Biết rằng cấu hình electron của ion Ni2+ tự do biểu diễn theo các AO như sau:

Phân tích các phát biểu:
✔️(a). Đúng. Đúng rồi! Mỗi AO (viết tắt của Atomic Orbital – orbital nguyên tử) chỉ chứa tối đa 2 electron, theo nguyên lý Pauli (Pauli Exclusion Principle). Hai electron này phải có spin đối nhau (một quay lên – ↑, một quay xuống – ↓).
✔️(b). Đúng. Phức chất chứa 4 phối tử CN–.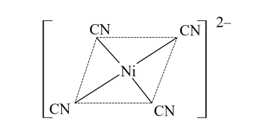
✔️(c). Đúng. Trong phức chất [Ni(CN)4]2– nguyên tử Ni (nickel) có số oxi hóa là +2.
Cùng phân tích chi tiết nhé:• CN⁻ (ion cyanuide là một ligand đơn chức, mang điện tích -1.
• Có 4 ligand CN⁻, nên tổng điện tích do các ligand gây ra là -4
• Điện tích tổng của cả phức chất là -2.
✔️(d) . Đúng. Trong phức chất [Ni(CN)4]2–, nguyên tử trung tâm Ni không chứa AO với electron độc thân. Cơ chế hình thành phức chất được biểu diễn như sau: