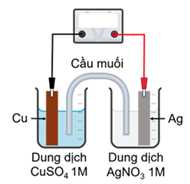
Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V và +0,799 V.
Ta có:
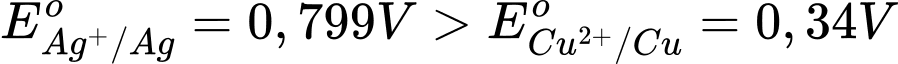
Anode (-): Cu → Cu2+ + 2e
Cathode (+): Ag+ + e → Ag
→ Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+ → Cu2+ + 2Ag.
→ Epin = E(+) – E(-) = 0,799 – 0,34 = 0,459 V
✔️(a) – Đúng. Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+ → Cu2+ + 2Ag.
✔️(b) – Đúng. Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
✔️(c) – Đúng. Điện cực Cu giảm khối lượng, điện cực Ag tăng khối lượng
Điện cực Cu: là cực âm, xảy ra oxi hóa → Cu → Cu2+ + 2e → giảm khối lượng.
Điện cực Ag: là cực dương, xảy ra khử → Ag+ + e → Ag → tăng khối lượng.
Điện cực Cu giảm khối lượng, điện cực Ag tăng khối lượng
✔️(d) – Đúng.
Cân bằng điện tích giữa hai nửa tế bào điện hóa, giúp dòng electron tiếp tục di chuyển:
Khi Cu bị oxi hóa, tạo ra ion Cu2+ → dung dịch ở ngăn này tích điện dương.
Khi Ag+ bị khử, mất ion Ag+ → dung dịch ở ngăn này thiếu ion dương → tích điện âm.
Cầu muối cho phép các ion âm (anion) và ion dương (cation) di chuyển qua lại → trung hòa điện tích ở cả hai bên.
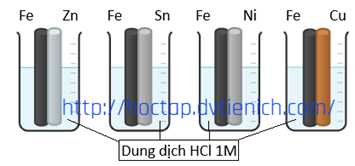
✔️(a) – Đúng. Trong ăn mòn điện hóa, kim loại bị ăn mòn trước là kim loại mạnh hơn đóng vai trò là cực âm (anode) – nơi xảy ra phản ứng oxi hóa.
Các thí nghiệm Fe bị ăn mòn trước là Fe-Sn; Fe-Ni và Fe-Cu.
✔️(b) – Đúng. Điều kiện xảy ra ăn mòn điện hóa:
Có hai điện cực khác nhau (hai kim loại có thế điện cực khác nhau).
Tiếp xúc trực tiếp hoặc nối với nhau bằng dây dẫn.
Cùng nằm trong dung dịch chất điện li (có ion dẫn điện)
❌(c) – Sai. Có 1 thí nghiệm trong đó Fe đóng vai trò là cathode.
Thí nghiệm Fe-Zn trong dung dịch HCl, Zn mạnh hơn Fe nên vai trò của Fe là cathode và Zn là anode.
✔️(d) – Đúng. Fe có thế điện cực thấp hơn cả Sn, Ni và Cu, nên trong cả ba trường hợp Fe đều bị ăn mòn.
• Độ chênh lệch thế điện cực Fe – Cu lớn nhất
• Chênh lệch càng lớn → dòng điện càng mạnh → tốc độ ăn mòn càng nhanh.
Bước 1: Cho dung dịch NaCl 5% vào ống thuỷ tinh hình chữ U như hình dưới:
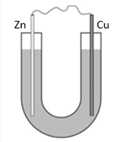
Bước 2: Nhúng một thanh đồng và một thanh kẽm đã làm sạch vào hai đầu của ống chữ U.
Bước 3: Nối hai thanh kim loại bằng dây dẫn.
✔️(a) – Đúng. Sau bước 2, không kim loại nào bị ăn mòn vì 2 kim loại chưa tiếp xúc với nhau hay được nối qua dây dẫn để đủ điền kiện ăn mòn điện hóa.
✔️(b) – Đúng.
Ta có: Zn > Cu → Zn đóng vai trò là Anode và Cu đóng vai trò là cathode.
Anode (-) Zn → Cu2+ + 2e
Cathode (+) 2H2O + 2e → 2OH- + H2
❌(c) – Sai. Trong dung dịch không có ion Cu2+ nên Cu2+ bị khử thành Cu bám vào thanh đồng, làm khối lượng thanh đồng tăng dần
✔️(d) – Đúng. Khoảng vài phút sau bước 3, nhỏ vài giọt phenolphthalein vào dung dịch gần thanh đồng và quan sát thấy dung dịch dần chuyển sang màu hồng. Tai cathode có phân li ra OH- mang tính kiềm: Cathode (+) 2H2O + 2e → 2OH- + H2
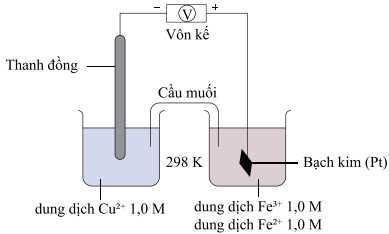
Sau khi thiết lập, trên vôn kế hiển thị giá trị là 0,43 V. Biết thế khử chuẩn của Cu2+/Cu là 0,34 V.
Trong pin điện hóa trên Cu2+/Cu đóng vai trò là anode; thanh Pt trong dung dịch Fe3+/Fe2+ đóng vai trò là cathode
Quá trình xảy ra trong pin:
Cathode (+): Fe3+ + 1e ⟶ Fe2+
Anode (-): Cu ⟶ Cu2+ + 2e
→ Nồng độ của Cu2+ tăng dần, nồng độ của Fe3+ giảm dần.
Phân tích các phát biểu:
✔️ a) Đúng. Anode là nơi xảy ra quá trình oxi hóa, giải phóng electron. Cathode là nơi xảy ra quá trình khử, nhận electron. Electron luôn di chuyển từ anode (Cu) sang cathode (Pt/Fe3+, Fe2+).
✔️ b) Đúng. Kim loại Pt là kim loại trơ, không tham gia phản ứng nhưng đóng vai trò làm điện cực dẫn electron cho phản ứng Fe3+ + 1e ⟶ Fe2+.
✔️ c) Đúng. Giả thuyết ban đầu sai vì ở cực dương (cathode), không có kim loại Fe mà chỉ có điện cực Pt trơ nhúng trong dung dịch Fe3+/Fe2+. Nếu giả thuyết đúng, điện cực dương phải là thanh sắt (Fe), nhưng thực tế lại dùng bạch kim (Pt).
✔️ d) Đúng. Ở anode: Cu bị oxi hóa nên nồng độ Cu2+ tăng.
Ở cathode: Fe3+ bị khử nên nồng độ Fe3+ giảm, Fe2+ tăng.
Phản ứng dừng lại khi thế điện cực bằng nhau (Eanode = Ecathode), lúc này không còn dòng electron nữa.
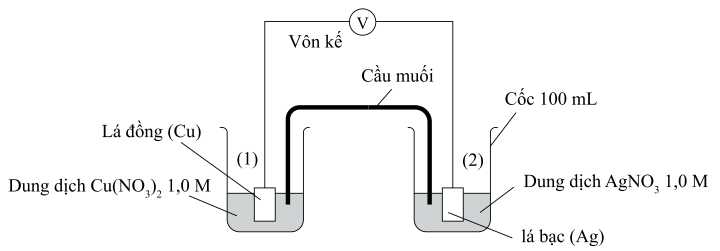
Khi pha loãng dung dịch AgNO3 tới nồng độ 0,5 M ở điện cực 2 và giữ nguyên nồng độ CuSO4 ở điện cực 1 thì thấy giá trị trên vôn kế giảm. Biết thế khử chuẩn của các điện cực:
Ag+(aq) + 1e
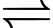 Ag(s);
Ag(s); 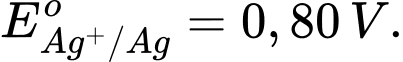
Cu2+(aq) + 2e
 Cu(s);
Cu(s); 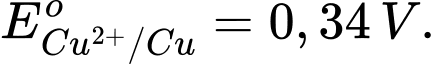
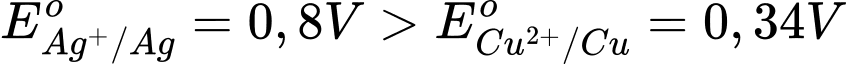
Trong pin galvani trên Ag đóng vai trò là cực dương (cathode)
Cu đóng vai trò là cực âm (anode)
Các quá trình xảy ra trong pin:
Cathode (+): Ag+ + 1e ⟶ Ag
Anode (-): Zn ⟶ Zn2+ + 2e
Phản ứng xảy ra: Zn + 2Ag+ ⟶ 2Ag + Zn2+
Phân tích các phát biểu:
✔️ (a) Đúng. Thế điện cực chuẩn của cặp Ag+/Ag (0,80) lớn hơn cặp Cu2+/Cu (0,34) nên Ag+ bị khử tại cathode.
❌ (b) Sai. Electron luôn di chuyển từ anode (Cu) sang cathode (Ag).
✔️ (c) Đúng. Cả CuSO4 1 M và Cu(NO3)2 1 M đều cung cấp ion Cu2+ với nồng độ như nhau nên không ảnh hưởng đến thế điện cực.
❌ (d) Sai. Khi pha loãng nồng độ AgNO3 thì giá trị trên vôn kế giảm nhưng nếu pha loãng nồng độ CuSO4 thì giá trị trên vôn kế lại tăng nên giả thuyết ban đầu “Nồng độ của ion kim loại trong dung dịch của bất kì điện cực nào giảm đều làm cho thế khử của điện cực đó giảm, dẫn đến sức điện động của pin giảm” là sai.
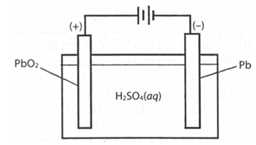
Cực dương là thanh than chì (C) được phủ PbO2 và cực âm là tấm chì (Pb), cùng nhúng vào dung dịch H2SO4 nồng độ 28%. Phản ứng xảy ra khi acquy xả điện là:
Pb(s) + PbO2(s) + 2H2SO4(aq)
 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)Biết rằng PbSO4 sinh ra từ điện cực nào đều bám hết vào điện cực đó.
Quá trình trong pin điện hóa
Anode (-): Pb → Pb2+ + 2e
Cathode (+): PbO2 + 4H+ + 4e → Pb2+ + 2H2O
Phân tích các đáp án
❌(a) – Sai. Tại anode, Pb bị oxi hoá và tạo thành PbSO4.
❌(b) – Sai. Tại cathode, PbO2 bị khử và tạo thành PbSO4.
❌(c) – Sai. Khi ắc quy xả điện, các điện cực bị biến đổi hóa học thành PbSO4.
Khối lượng vật liệu hoạt động giảm, nhưng tổng khối lượng có thể không thay đổi đáng kể do PbSO4 vẫn bám trên bản cực.
✔️(d) – Đúng. Ắc quy chì có dung dịch điện ly là sulfuric acid loãng (H2SO4).Khi xả điện: Cả hai điện cực (Pb và PbO2) phản ứng với ion SO42- từ H2SO4 để tạo thành PbSO4: Do đó, ion SO42- trong dung dịch bị tiêu hao → nồng độ H2SO4 giảm.
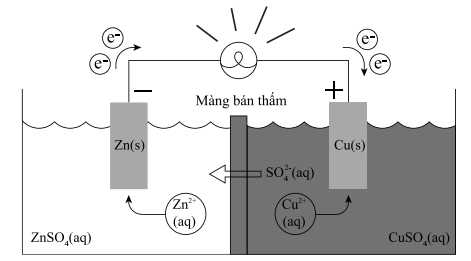
Trong đó, màng bán thẩm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan trong dung dịch là 1,00 M. Cho biết:
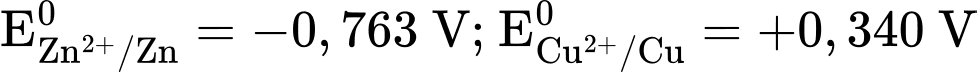 .
. ☆ Cathode (+)
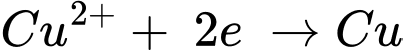
☆ Anode (-)
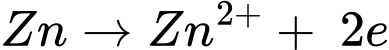
→
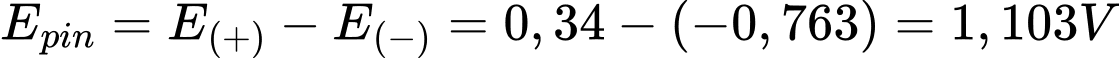
Phản ứng chung trong pin:
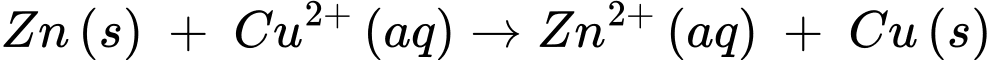
Phân tích các phát biểu:
❌ (a) Sai. Nguyên tử khối của Zn và Cu lần lượt là 65 gam/mol và 64 gam/mol, từ PTHH cứ 1 mol Zn mất đi sẽ có 1 mol Cu sinh ra nên khối lượng điện cực Zn mất đi sẽ lớn hơn Cu sinh ra.
✔️ (b) Đúng. Từ phản ứng trong pin, ta thấy ở cathode, nồng độ Cu2+ giảm nên để cân bằng điện tích thì nồng độ SO42- phải tăng. Ngược lại ở anode, nồng độ Zn2+ tăng nên nồng độ SO42- phải giảm để cân bằng điện tích.
✔️ (c) Đúng. Sức điện động chuẩn của pin là 1,103 V.
✔️ (d) Đúng. Phản ứng chung xảy ra trong pin điện là Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
❌(a) – Sai. Fe – Zn (kẽm): Zn có thế điện cực thấp hơn Fe, nên Zn bị ăn mòn, Fe được bảo vệ → Fe gỉ chậm hơn khi tiếp xúc với kẽm. Fe – Cu (đồng): Cu có thế điện cực cao hơn Fe, nên Fe bị ăn mòn, Cu không bị gì → Fe gỉ nhanh hơn khi tiếp xúc với đồng.
❌(b) – Sai . Kim loại hi sinh là kim loại có thế điện cực chuẩn thấp hơn kim loại cần bảo vệ, và nó dễ bị oxi hóa hơn kim loại kia. Kim loại cần bảo vệ có thế điện cực chuẩn cao hơn, nên ít bị oxi hóa hơn. Khi kim loại hi sinh (ví dụ kẽm) tiếp xúc với kim loại cần bảo vệ (ví dụ sắt), kim loại hi sinh sẽ bị oxi hóa trước, bảo vệ kim loại cần bảo vệ khỏi bị ăn mòn
✔️(c) – Đúng. Kim loại hi sinh (ví dụ kẽm) có thế điện cực thấp hơn, bị oxi hóa và bị mất electron. Các electron di chuyển từ kim loại hi sinh sang kim loại cần bảo vệ (ví dụ sắt), giúp kim loại cần bảo vệ không bị oxi hóa.
✔️(d) – Đúng. Nếu thanh kẽm không tiếp xúc hoặc không nối với thanh sắt, kẽm vẫn bị ăn mòn trong nước biển, nhưng không bảo vệ được sắt khỏi sự ăn mòn. Để bảo vệ sắt, kẽm phải tiếp xúc hoặc nối với sắt để các electron từ kẽm di chuyển sang sắt, giúp sắt không bị oxi hóa.
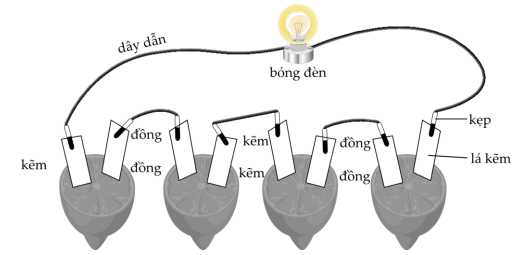
Bước 1: Chuẩn bị bốn quả chanh. Rửa sạch lá đồng và lá kẽm bằng chất tẩy rửa nhẹ để đảm bảo bề mặt của chúng sạch sẽ.
Bước 2: Có thể lăn quả chanh trên bàn bằng một lực nhẹ.
Bước 3: Cắm lá đồng và lá kẽm vào quả chanh như hình dưới đây thì thấy bóng đèn phát sáng.
C6H8O7 ⇌ C6H7O7- + H+
Trong pin điện hóa trên, xảy ra các phản ứng trên các điện cực
Anode (-) Zn ⟶ Zn2+ + 2e
Cathode (+) 2H+ + 2e ⟶ H2
Khi nối hai cực của pin với mạch ngoài (máy đo) do chênh lệch điện thế giữa cực âm Zn và cực dương Cu sẽ có một dòng các electron tự do dịch chuyển từ cực âm Zn (thừa e) qua cực dương Cu (thiếu e) tạo ra dòng điện giữa hai cực của viên pin chanh.
Phân tích các phát biểu:
✔️ a) Đúng. Trong nước chanh có chứa các chất điện li nên có thể dẫn điện.
✔️ b) Đúng. Bước 2 lăn quả chanh mục đích tiết thêm nước chanh để thêm dung dịch chất điện li cho quá trình hoạt động của pin điện hóa.
✔️ c) Đúng. Bóng đèn sáng, dòng điện là dòng electron di chuyển từ cực âm Zn sang cực dương Cu.
✔️ d) Đúng. Suất điện động của một viên pin điện hóa tùy thuộc vào chất hóa học ở bên trong viên pin điện hóa thông thường là 1,5V; 6V; 9V … có thể ghép nối tiếp nhiều viên pin để thu được nguồn điện có suất điện động phù hợp.
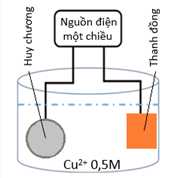
Người ta có thể tiến hành điện phân dung dịch X (CuSO4) nồng độ 0,5 M, dư với cường độ dòng điện không đổi 2 A, khi kết thúc điện phân (quá trình mạ hoàn thành) thì hết thời gian là t (s). Biết khối lượng riêng của copper là 8,95 g/cm3 và hiệu suất điện phân là 100%, giả thiết lớp mạ huy chương dày như nhau, toàn bộ lượng copper tạo ra đều bám hết vào tấm huy chương. Cho hằng số Faraday F = 96500, π = 3,14.
✔️(a) – Đúng. Thanh copper là cực dương, huy chương được mạ sẽ đóng vai trò cực âm.
Trong quá trình điện phân tại anode (+) sẽ có quá trình Cu bị ăn mòn, Cu → Cu2+ + 2e. Tại cathode (-) có quá trình Cu2+ + 2e → Cu bám trên huy chương.
✔️(b) – Đúng.
Trước mạ: r = 2,5cm ; h = 0 ,3 cm → Vtrước = π r2h = 5,8905 cm3
Sau khi mạ: r = 2,5 + 0 1 = 2, 6cm; h = 0, 3 + 0, 1.2 = 0, 5cm →VSau = π r2h = 10, 6186 cm3
→ mCu = 8,95 (Vsau - Vtrước) = 42,316495 gam
Thời gian điện phân là
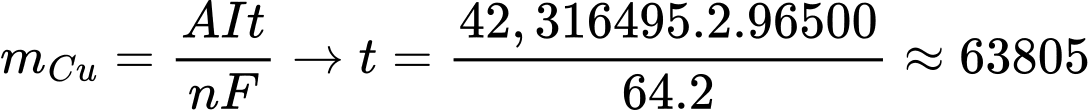
❌(c) – Sai. anode (+) sẽ có quá trình Cu bị ăn mòn, Cu → Cu2+ + 2e không có khí thoát ra
❌(d) – Sai. chiều dòng electron di chuyển từ thanh Cu, qua nguồn điện đến tấm huy chương. Nguồn điện đóng vai trò giống như “máy bơm" electron.
▪ Nối mẫu đồng không tinh khiết với một điện cực và miếng đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch copper(II) sulfate.
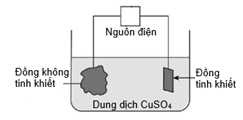
▪ Tiến hành điện phân với cường độ dòng điện 24 A. Sau t giờ, các điện cực được lấy ra, làm khô và đem cân.
▪ Khối lượng các điện cực trước và sau điện phân được ghi lại trong bảng dưới đây:

Giả sử hiệu suất quá trình điện phân là 100%. Biết q = ne×F = I×t, trong đó: q là điện lượng (C), ne là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96500 C/mol).
❌(a) – Sai. mẫu đồng không tinh khiết được nối với cực dương, miếng đồng tinh khiết được nối với cực âm của nguồn điện. Trong quá trình điện phân tại anode (+) sẽ có quá trình Cu bị ăn mòn, Cu → Cu2+ + 2e. Tại cathode (-) có quá trình Cu2+ + 2e → Cu
✔️(b) – Đúng. Tại cathode (-) có quá trình khử: Cu2+ + 2e → Cu
❌(c) – Sai. Khối lượng Cu mới tạo ra ở cực âm là
mCu = 980 - 155 = 825 gam
Thời gian điện phân là
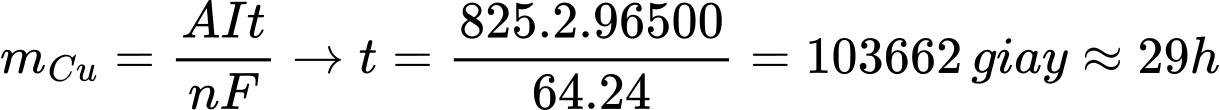
❌(d) – Sai.
Khối lượng cực dương giảm là
mgiảm = 1030 - 85,6 = 944,4 gam
→ Độ tinh khiết = 825.100%/944,4 = 87,36%
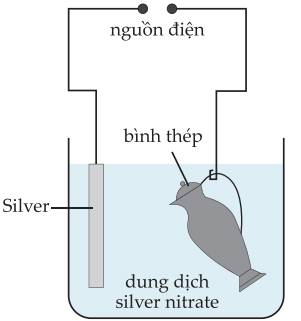
Mạ điện là một công nghệ điện phân. Quá trình tổng quát là:
– Trên anode xảy ra quá trình hòa tan kim loại:
M – ne ⟶ Mn+
– Trên cathode xảy ra quá trình cation phóng điện trở thành kim loại mạ:
Mn+ + ne → M
Phân tích các phát biểu:
✔️a) Đúng. Trong quá trình mạ điện, vật cần mạ (bình thép) được gắn với cực âm cathode, kim loại mạ (silver) gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
❌b) Sai. Trên anode xảy ra quá trình hòa tan kim loại: Ag(s) – e ⟶ Ag+(aq)
✔️c) Đúng. Trên anode xảy ra quá trình hòa tan kim loại
❌d) Sai. Ion Ag+ di chuyển về cathode (cực âm), bị khử thành kim loại Ag và phủ lên bề mặt của bình thép.
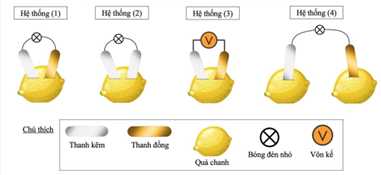
Ở các hệ thống (1), (2), (3), khi lắp ráp không để hai thanh kim loại chạm nhau.
❌(a) – Sai. bóng đèn (1) sáng do điện cực khác chất và tạo thành mạch kín nên có dòng điện chạy qua. Bóng đèn (2) không sáng do cặp điện cực cùng chất nên không có điện áp giữa hai cực.
❌(b) – Sai. thay hai thanh kẽm bằng hai thanh đồng thì cặp điện cực vẫn cùng chất nên không xảy ra ăn mòn điện hóa nên đèn không sáng
❌(c) – Sai. dung dịch điện li (nước chanh) không phải dung dịch chuẩn nên sức điện động mà điện kế đọc được không phải sức điện động chuẩn.
❌(d) – Sai. hệ thống (4) đèn không sáng do không tạo thành mạch điện kín.

✔️(a) – Đúng. • Cathode (vật dụng cần mạ):
Là vật liệu cần được phủ lớp kim loại (ví dụ như thìa, dao, nhẫn...) trong quá trình mạ.
Tại cực âm (cathode), các ion kim loại từ dung dịch sẽ nhận electron và kết tủa lên bề mặt vật cần mạ: Cu2+ + 2e → Cu
• Anode (cực dương): Là kim loại dùng làm cực dương. Anode thường là kim loại đồng thô, nơi xảy ra quá trình oxi hóa và giải phóng ion kim loại vào dung dịch, từ đó ion kim loại sẽ di chuyển và bám vào vật cần mạ: Cu → Cu2+ + 2e
❌(b) – Sai. Nồng độ mol của ion Cu2+ trong dung dịch không đổi trong quá trình điện phân
Tại cực âm (cathode), các ion kim loại từ dung dịch sẽ nhận electron và kết tủa lên bề mặt vật cần mạ: Cu2+ + 2e → Cu
Anode thường là kim loại đồng thô, nơi xảy ra quá trình oxi hóa và giải phóng ion kim loại vào dung dịch, từ đó ion kim loại sẽ di chuyển và bám vào vật cần mạ: Cu → Cu2+ + 2e
Cu2+ vừa mất đi và sinh ra nên theo lí thuyết sẽ không đổi trong thờ gian điện phân.
✔️(c) – Đúng.
Đổi 0,1 mm = 0,01 cm
Khối lượng Cu được mạ là mCu¬ = VCu.dCu = 10.0,01.8,94 = 0,894 gam
Thời gian điện phân là
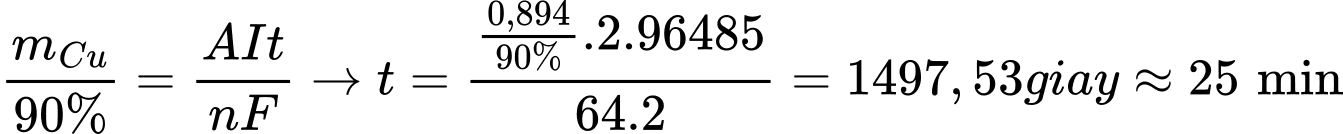
❌(d) – Sai. anode (+) sẽ có quá trình Cu bị ăn mòn, Cu → Cu2+ + 2e không có khí thoát ra.
Ở bề mặt cực dương, xảy ra quá trình:
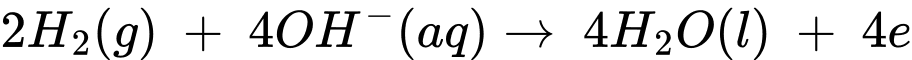
Ở cực âm, các electron sẽ kết hợp với khí oxygen có sẵn trong không khí (nồng độ 21%).
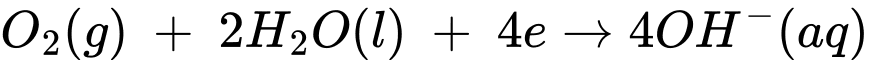
ANH
✔️(a) – Đúng. Ở bề mặt cực dương, xảy ra quá trình: 2H2(g) + 4OH-(aq) → 4H2O(l) + 4e
✔️(b) – Đúng. Quá trình nhận electron xảy ra ở cathode, tại cathode xảy ra quá trình khử nên nhận electron.
✔️(c) – Đúng.
Ở bề mặt cực dương, xảy ra quá trình:
2H2(g) + 4OH-(aq) → 4H2O(l) + 4e
Ở cực âm, các electron sẽ kết hợp với khí oxygen có sẵn trong không khí :
O2(g) + 2H2O(l) + 4e → 4OH-(aq)
Phản ứng tổng xảy ra trong pin: 2H2(g) + O2(g) → 2H2O(l)
✔️(d) – Đúng. Bạch kim (Pt) là kim loại trơ, không bị oxi hóa hay khử trong điều kiện điện phân thông thường. Do đó, Pt không tham gia phản ứng, chỉ truyền electron, nên có thể dùng làm: Anode (cực dương) – truyền electron ra ngoài; Cathode (cực âm) – nhận electron từ nguồn điện.
▪ Lấy 1 chỉ vàng tây 18K đúng chuẩn có khối lượng 3,75 gam (đã được cân lại) làm điện cực dương.
▪ Điện cực còn lại là than chì tinh khiết có khối lượng 2,00 gam.
▪ Nối chỉ vàng với điện cực dương và than chì tinh khiết với điện cực âm của nguồn điện một chiều, rồi nhúng hoàn toàn vào bình điện phân chứa 100 mL dung dịch Au(NO3)3 0,2 M. Kẹp nối 2 điện cực đều làm bằng than chì.
▪ Tiến hành điện phân ở hiệu điện thế phù hợp.
▪ Sau khi thấy chỉ vàng tan hết thì ngừng điện phân, làm khô, rồi cân thấy khối lượng của thanh than chì tinh khiết là 4,85 gam.
Biết trong quá trình điện phân nước không bay hơi và thể tích dung dịch không đổi, Au sinh ra do điện phân đều bám trên điện cực âm, không có cặn rần dưới đáy bình.
Phân tích các đáp án
❌(a) – Sai.
Vàng là kim loại có độ hoạt động yếu nên sẽ đong vai trò là cực dương – cathode. Tại cathode xảy ra phản ứng: Au3+ + 3e → Au .
❌(b) – Sai. Ni và Ag cũng tan vào dung dịch và NO3- không đổi nên nồng độ dung dịch Au(NO3)3 sau điện phân nhỏ hơn 0,2M.
✔️(c) – Đúng. Tại cực dương chỉ vàng phải ngập hoàn toàn trong dung dịch nên không thể kẹp hay nối bằng dây đồng. Tại cực âm có thể dùng dây đồng để nối nhưng không cho phần dây đồng chạm vào dung dịch.
✔️(d) – Đúng.
Nếu 3,75 gam vàng tây đem phân tích đạt chuẩn thì thành phần gồm
Au (75% hay 2,1825 gam; Ni (x mol) và Ag (y mol)
→ 59x + 108y + 2,1825 = 3,75
Quá trình oxi hóa
Ni → Ni2+ + 2e
Ag → Ag+ + e
Quá trình khử
Au3+ + 3e → Au
Bảo toàn electron: 2x + y + 3.2,1825/197 = 3(4,85-2)/197
Nghiệm âm, vậy mẫu vàng trên không đạt tiêu chuẩn (Ni, Ag có giá trị nhỏ hơn so với Au nên nếu vàng tây không đạt tiêu chuẩn thì Au phải nhỏ hơn Au tiêu chuẩn là 75%)
Bước 1: Lấy 500 mL nước cất vào cốc thuỷ tinh. Sau đó cho khoảng 150 g muối ăn và khuấy đều. Nếu tan hết, tiếp tục cho thêm muối ăn từng chút một đến nào thấy không thể hòa tan thêm được nữa thì thu được dung dịch NaCl bão hòa.
Bước 2: Cắm hai điện cực vào cốc thuỷ tinh. Nối dây dẫn vào nguồn điện một chiều (hình bên) và duy trì quá trình điện phân trong khoảng 5 phút.
Bước 3: Cho một mẩu cánh hoa màu hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân.
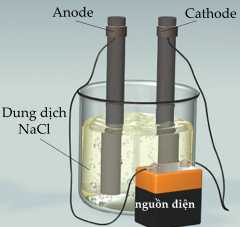
❌ a) Sai. Ion Na+ không bị điện phân trong dung dịch do Na sinh ra là kim loại mạnh sẽ lập tức phản ứng với nước.
✔️ b) Đúng. Có 2 khí thoát ra ở cả 2 điện cực là H2 và Cl2
Cathode (-): H2O(l) + 2e → OH-(aq) + H2(g)
Anode (+) Cl-(aq) → Cl2(g) + 2e
✔️c) Đúng. Hỗn hợp sau phản ứng chứa NaCl, NaClO:
2NaCl + 2H2O -(đpdd)→ 2NaOH + Cl2 ↑ + H2 ↑
2NaOH + Cl2 → NaClO + NaCl + H2O
✔️ d) Đúng. Ion ClO- có tính oxi hóa mạnh, gốc acid này có khả năng phá vỡ cấu trúc sắc tố màu sắc nên khi cho cánh hoa hồng vào sau một thời gian sẽ mất màu.
- Cân để xác định khối lượng ban đầu của chiếc vòng là 5,00 gam và thanh đồng là 12,50 gam.
- Nối chiếc vòng với một điện cực và thanh đồng với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch CuSO4 1,00 M.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của chiếc vòng và thanh đồng, thấy khối lượng chiếc vòng là 5,64 gam và khối lượng thanh đồng là 11,86 gam.
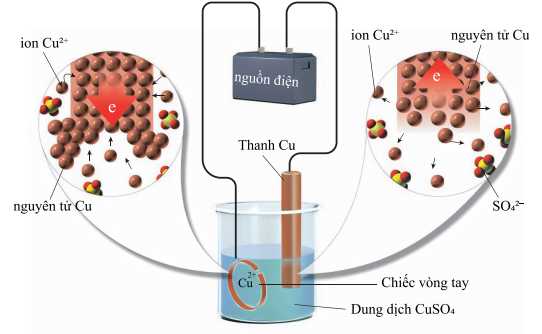
✔️ (a) Đúng. Trong quá trình mạ điện, vật cần mạ được gắn với cực âm cathode, kim loại mạ gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
✔️ (b) Đúng. Cực dương của nguồn điện sẽ hút các electron trong quá trình oxi hóa và giải phóng các ion kim loại dương, dưới tác dụng lực tĩnh điện các ion dương này sẽ di chuyển về cực âm, tại đây chúng nhận lại electron trong quá trình oxi hóa khử hình thành lớp kim loại bám trên bề mặt của vật được mạ.
✔️ (c) Đúng. Khối lượng chiếc vòng tăng lên 5,64 – 5 = 0,64 gam; khối lượng thanh đồng giảm 12,5 – 11,86 = 0,64 gam.
✔️ (d) Đúng. CuSO4 đóng vai trò xúc tác, tạo ion Cu2+ nên sau phản ứng sinh ra ion Cu2+ trả lại, khối lượng của chiếc vòng sau quá trình mạ vẫn không đổi.
 4Al(l) + 3O2(g)
4Al(l) + 3O2(g)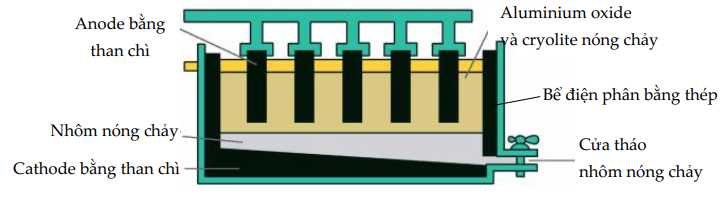
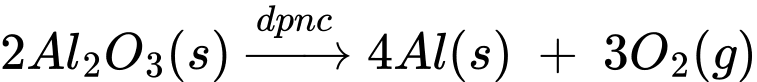
Các quá trình xảy ra tại điện cực:
Tại cathode (–) (cực âm): Al3+ + 3e → Al (Quá trình khử)
Tại anode (+) (cực dương): 2O2- → O2 + 4e (Quá trình oxi hóa)
Graphite (C) bị oxi hóa tạo CO2: C + O2 → CO2 ↑
Vì thế, anode bị ăn mòn theo thời gian.
Phân tích các phát biểu:
✔️ a) Đúng. Vì Al3+ nhận electron tại cathode nên aluminium kim loại được tách ra tại cathode.
✔️ b) Đúng. Cryolite giảm nhiệt độ nóng chảy từ >2000 oC xuống ~950 oC, giúp tiết kiệm nhiên liệu và giảm chi phí sản xuất.
❌ c) Sai. O2 thoát ra ở anode nhưng phản ứng với graphite tạo CO2 nên không thu được O2 tinh khiết.
❌ d) Sai. Cathode (–) cần để tách Al3+ thành Al, còn anode (+) tạo O2. Nếu đổi cực, nhôm sẽ bị oxi hóa thay vì được tạo ra.
▪ Nhóm 1: Nối điện cực than chì với cực dương và điện cực đồng với cực âm của nguồn điện.
▪ Nhóm 2: Nối điện cực than chì với cực âm và điện cực đồng với cực dương của nguồn điện.
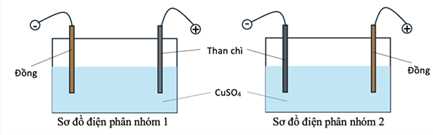
Hai nhóm đều đưa ra giả thuyết sau: “Trong quá trình điện phân, nồng độ ion Cu2+ giảm dần ứng với màu xanh của dung dịch nhạt dần”.
✔️(a) – Đúng. Nhóm 2 có anode bằng Cu thì: Cu2+ + 2e → Cu
✔️(b) – Đúng. Tại cathode cả 2 nhóm: Cu2+ + 2e → Cu
✔️(c) – Đúng. Anode nhóm 1: 2H2O → O2 + 4H+ + 4e
Nồng độ H+ tăng nên pH giảm
✔️(d) – Đúng. Giả thuyết đúng với nhóm thứ nhất và sai với nhóm thứ hai nhóm 1 có quá trình Cu2+ + 2e → Cu nên giảm Cu, nhóm 2 xảy ra 2 quá trình cathode (-) Cu2+ + 2e → Cu và anode (-) nên màu xanh của dung dịch không giảm.