Câu 1 [829505]: Thực hiện thí nghiệm sau:
▪ Bước 1: Rót vào cốc thuỷ tinh thứ nhất, cốc thuỷ tinh thứ hai và thứ ba khoảng 20 mL nước (khoảng 1/2 cốc), thêm vài giọt dung dịch phenolphthalein vào mỗi cốc và đặt lên giá đỡ.
▪ Bước 2: Bỏ vào cốc thuỷ tinh thứ nhất một mẫu sodium (Na) nhỏ bằng hạt gạo; cốc thuỷ tinh thứ hai một mẫu kim loại magnesium (Mg) và cốc thuỷ tỉnh thứ ba một mẫu kim loại aluminium (Al) vừa cạo sạch lớp vỏ oxide.
▪ Bước 3: Đun nóng nhẹ cốc thuỷ tinh thứ hai và thứ ba.
▪ Bước 1: Rót vào cốc thuỷ tinh thứ nhất, cốc thuỷ tinh thứ hai và thứ ba khoảng 20 mL nước (khoảng 1/2 cốc), thêm vài giọt dung dịch phenolphthalein vào mỗi cốc và đặt lên giá đỡ.
▪ Bước 2: Bỏ vào cốc thuỷ tinh thứ nhất một mẫu sodium (Na) nhỏ bằng hạt gạo; cốc thuỷ tinh thứ hai một mẫu kim loại magnesium (Mg) và cốc thuỷ tỉnh thứ ba một mẫu kim loại aluminium (Al) vừa cạo sạch lớp vỏ oxide.
▪ Bước 3: Đun nóng nhẹ cốc thuỷ tinh thứ hai và thứ ba.
Phân tích các phát biểu:
✔️(a). Đúng. Phương trình phản ứng:
Na + H2O → NaOH + 2H2
Phản ứng mãnh liệt làm Na nóng chảy thành giọt tròn, bọt khí H2 thoát ra mạnh làm Na nổi và chạy trên mặt nước. Sản phẩm NaOH làm dung dịch có màu hồng.
❌(b). Sai.cốc thứ 2 có màu hồng nhưng nhạt hơn cốc 1, cốc 3 không có màu hồng:
Phương trình phản ứng:
Mg + 2H2O → Mg(OH)2 + H2
Phản ứng xảy ra chậm và Mg(OH)2 là chất điện li yếu nên dung dịch có màu hồng nhạt. Al cũng phản ứng với H2O nhưng kết tủa Al(OH)3 dạng keo ngăn Al tiếp xúc với H2O nên phản ứng dừng lại. Lượng rất nhỏ Al(OH)3 tạo ra (dạng màng mỏng) là không đủ để phenolphthalein chuyển màu.
✔️(c). Đúng. Do phản ứng chậm (Mg) và phản ứng không đáng kể (Al) nên lượng H2 thoát ra không đủ để nâng đỡ các kim loại này nổi trên mặt nước như Na và chúng chìm xuống.
✔️(d). Đúng. Các thí nghiệm trên chứng tỏ khả năng phản ứng của sodium > magnesium > aluminium
✔️(a). Đúng. Phương trình phản ứng:
Na + H2O → NaOH + 2H2
Phản ứng mãnh liệt làm Na nóng chảy thành giọt tròn, bọt khí H2 thoát ra mạnh làm Na nổi và chạy trên mặt nước. Sản phẩm NaOH làm dung dịch có màu hồng.
❌(b). Sai.cốc thứ 2 có màu hồng nhưng nhạt hơn cốc 1, cốc 3 không có màu hồng:
Phương trình phản ứng:
Mg + 2H2O → Mg(OH)2 + H2
Phản ứng xảy ra chậm và Mg(OH)2 là chất điện li yếu nên dung dịch có màu hồng nhạt. Al cũng phản ứng với H2O nhưng kết tủa Al(OH)3 dạng keo ngăn Al tiếp xúc với H2O nên phản ứng dừng lại. Lượng rất nhỏ Al(OH)3 tạo ra (dạng màng mỏng) là không đủ để phenolphthalein chuyển màu.
✔️(c). Đúng. Do phản ứng chậm (Mg) và phản ứng không đáng kể (Al) nên lượng H2 thoát ra không đủ để nâng đỡ các kim loại này nổi trên mặt nước như Na và chúng chìm xuống.
✔️(d). Đúng. Các thí nghiệm trên chứng tỏ khả năng phản ứng của sodium > magnesium > aluminium
Câu 2 [829507]: Thực hiện thí nghiệm theo các bước sau:
▪ Bước 1: Cho khoảng 1 gam phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 gam phân bón ammonium chloride vào ống nghiệm (2). Thêm vào mỗi ống nghiệm khoảng 3 ml nước cất, lắc đều cho tan hết.
▪ Bước 2: Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
▪ Bước 3: Đưa hai mẩu giấy quỳ tím đã tẩm ướt vào miệng mỗi ống nghiệm.
▪ Bước 1: Cho khoảng 1 gam phân bón potassium nitrate vào ống nghiệm (1) và khoảng 1 gam phân bón ammonium chloride vào ống nghiệm (2). Thêm vào mỗi ống nghiệm khoảng 3 ml nước cất, lắc đều cho tan hết.
▪ Bước 2: Nhỏ 1 mL dung dịch NaOH 20% vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
▪ Bước 3: Đưa hai mẩu giấy quỳ tím đã tẩm ướt vào miệng mỗi ống nghiệm.
Phân tích các phát biểu:
✔️(a). Đúng. Ống (1) không có phản ứng, chỉ có hơi nước thoát ra khi đun nên quỳ tím không đổi màu.
✔️(b). Đúng. Trong bước 2, có khí không màu, mùi khai và xốc thoát ra ở ống nghiệm (2)
Phương trình phản ứng:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
❌(c). Sai. Sau bước 2, dung dịch sau phản ứng ở ống nghiệm (1) không màu.
✔️(d). Đúng. NH3 tan trong nước tạo môi trường kiềm nên quỳ tím ẩm chuyển màu xanh.
✔️(a). Đúng. Ống (1) không có phản ứng, chỉ có hơi nước thoát ra khi đun nên quỳ tím không đổi màu.
✔️(b). Đúng. Trong bước 2, có khí không màu, mùi khai và xốc thoát ra ở ống nghiệm (2)
Phương trình phản ứng:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
❌(c). Sai. Sau bước 2, dung dịch sau phản ứng ở ống nghiệm (1) không màu.
✔️(d). Đúng. NH3 tan trong nước tạo môi trường kiềm nên quỳ tím ẩm chuyển màu xanh.
Câu 3 [706050]: Iodine phản ứng với potassium hydroxide khi đun nóng tương tự chlorine. Tiến hành thí nghiệm sau:
• Bước 1: Lấy 20 gam dung dịch KOH 42% (đặc) cho vào bình nón, đặt bình trên lưới amiang rồi đun nóng, vừa đun vừa thêm thật từ từ tinh thể iodine vào khuấy thật kỹ đến khi xuất hiện màu vàng rơm nhạt thì ngừng thêm iodine.
• Bước 2: Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
Biết các phản ứng xảy ra hoàn toàn, 99% potassium iodate và 2% potassium iodide (về khối lượng) bị kết tinh và được giữ lại trên phễu lọc.
• Bước 1: Lấy 20 gam dung dịch KOH 42% (đặc) cho vào bình nón, đặt bình trên lưới amiang rồi đun nóng, vừa đun vừa thêm thật từ từ tinh thể iodine vào khuấy thật kỹ đến khi xuất hiện màu vàng rơm nhạt thì ngừng thêm iodine.
• Bước 2: Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
Biết các phản ứng xảy ra hoàn toàn, 99% potassium iodate và 2% potassium iodide (về khối lượng) bị kết tinh và được giữ lại trên phễu lọc.
Phân tích các đáp án :
❌(a) – Sai. Phản ứng ở bước 1 thuộc phản ứng tự oxi hoá, tự khử . Trong phản ứng I2 có số oxi hoá vừa tăng lên +5 vừa giảm xuống -1 .
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Số oxi hóa của I tăng lên +5 và giảm xuống -1
✔️(b) – Đúng. Màu vàng rơm nhạt xuất hiện ở bước 1 cho biết I2 bắt đầu dư. Dung dịch I2 có màu vàng nhạt.
✔️(c) – Đúng. Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
→ potassium iodide có độ tan kém hơn nên bị tách ra trước
❌(d) – Sai.
Số mol của KOH là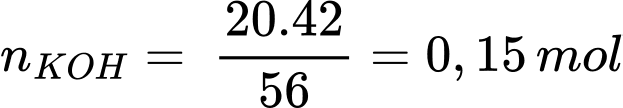
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Theo phương trình số mol của KI và KIO3 là nKI = 0,125 mol và
nKIO3 = 0,025 mol 99% KIO3 và 2% KI bị kết tinh và được giữ lại trên phễu.
Khi lọc thu được phần nước lọc còn lại 1% KIO3 và 98% KI
Cô cạn nước lọc được:
mKIO3 = 1% × 0,025 × 214 = 0,0535 gam
mKI = 98% × 0,125 × 166 = 20,335
Độ tinh khiết = 20,335 ÷ (20,335 + 0,0535) = 99,74% ≈ 99%
❌(a) – Sai. Phản ứng ở bước 1 thuộc phản ứng tự oxi hoá, tự khử . Trong phản ứng I2 có số oxi hoá vừa tăng lên +5 vừa giảm xuống -1 .
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Số oxi hóa của I tăng lên +5 và giảm xuống -1
✔️(b) – Đúng. Màu vàng rơm nhạt xuất hiện ở bước 1 cho biết I2 bắt đầu dư. Dung dịch I2 có màu vàng nhạt.
✔️(c) – Đúng. Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
→ potassium iodide có độ tan kém hơn nên bị tách ra trước
❌(d) – Sai.
Số mol của KOH là
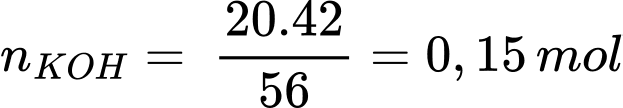
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Theo phương trình số mol của KI và KIO3 là nKI = 0,125 mol và
nKIO3 = 0,025 mol 99% KIO3 và 2% KI bị kết tinh và được giữ lại trên phễu.
Khi lọc thu được phần nước lọc còn lại 1% KIO3 và 98% KI
Cô cạn nước lọc được:
mKIO3 = 1% × 0,025 × 214 = 0,0535 gam
mKI = 98% × 0,125 × 166 = 20,335
Độ tinh khiết = 20,335 ÷ (20,335 + 0,0535) = 99,74% ≈ 99%
Câu 4 [829510]: Trong công nghiệp, một lượng lớn NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay bằng cách cho khí CO2 (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hoà và ammonia (NH3) bão hoà.
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) → NH4Cl(aq) + NaHCO3(s) (1)
NaHCO3 tách ra đem nhiệt phân thu được soda:
2NaHCO3 → Na2CO3 + CO2 + H2O (2)
và NH4Cl được sử dụng để tái tạo NH3 bằng cách tác dụng với Ca(OH)2 tạo ra từ CaO.
2NH4Cl(aq) + CaO(s) → 2NH3(g) + CaCl2(aq) + H2O (3)
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) → NH4Cl(aq) + NaHCO3(s) (1)
NaHCO3 tách ra đem nhiệt phân thu được soda:
2NaHCO3 → Na2CO3 + CO2 + H2O (2)
và NH4Cl được sử dụng để tái tạo NH3 bằng cách tác dụng với Ca(OH)2 tạo ra từ CaO.
2NH4Cl(aq) + CaO(s) → 2NH3(g) + CaCl2(aq) + H2O (3)
Phân tích các phát biểu:
✔️(a) Đúng. Khi làm lạnh, NaHCO3 (sodium hydrogencarbonate) có độ tan giảm nên kết tinh ra khỏi dung dịch. Sau đó, NaHCO3 rắn được lọc ra khỏi hệ phản ứng.
✔️(b) Đúng. Đun nóng sẽ làm tăng độ tan của NaHCO3 nên (1) không xảy ra.
✔️(c) Đúng. Nguyên liệu chính là NaCl và CaCO3, còn NH3 sẽ tuần hoàn để quay lại.
✔️(d) Đúng.
• Làm bột nở (baking soda): Khi nung nóng, NaHCO3 phân hủy tạo khí CO2, giúp thực phẩm nở xốp.
Phương trình phản ứng: 2NaHCO3 → Na2CO3 + CO2 + H2O.
• Giảm đau dạ dày do thừa acid: NaHCO3 là chất base yếu, có thể trung hòa acid trong dạ dày:
Phương trình phản ứng: NaHCO3 + HCl → NaCl + CO2 + H2O.
✔️(a) Đúng. Khi làm lạnh, NaHCO3 (sodium hydrogencarbonate) có độ tan giảm nên kết tinh ra khỏi dung dịch. Sau đó, NaHCO3 rắn được lọc ra khỏi hệ phản ứng.
✔️(b) Đúng. Đun nóng sẽ làm tăng độ tan của NaHCO3 nên (1) không xảy ra.
✔️(c) Đúng. Nguyên liệu chính là NaCl và CaCO3, còn NH3 sẽ tuần hoàn để quay lại.
✔️(d) Đúng.
• Làm bột nở (baking soda): Khi nung nóng, NaHCO3 phân hủy tạo khí CO2, giúp thực phẩm nở xốp.
Phương trình phản ứng: 2NaHCO3 → Na2CO3 + CO2 + H2O.
• Giảm đau dạ dày do thừa acid: NaHCO3 là chất base yếu, có thể trung hòa acid trong dạ dày:
Phương trình phản ứng: NaHCO3 + HCl → NaCl + CO2 + H2O.
Câu 5 [705448]: Một bạn học sinh tiến hành các thí nghiệm như sau:
■ Bước 1: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
■ Bước 2: Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
■ Bước 1: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
■ Bước 2: Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
Hiện tượng: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride, sodium chloride và potassium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí là cháy với ngọn lửa màu lần lượt là đỏ tía, màu vàng và màu tím.
Phân tích các phát biểu:
✔️ a) Đúng. Que nhúng vào dung dịch lithium chloride sẽ cháy với ngọn lửa màu đỏ tía.
✔️ b) Đúng. Platinum (Pt) ở dạng tinh khiết, không bị oxi hóa ở bất cứ nhiệt độ nào. Kim loại này khó bị ăn mòn, chịu được nhiệt độ cao nên được dùng để làm que đốt.
❌ c) Sai. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên nếu thay NaCl bằng NaNO3 thì que nhúng vào dung dịch vẫn sẽ cháy với ngọn lửa màu vàng chứ không phải màu tím.
✔️ d) Đúng. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên có thể nhận biết riêng từng cation kim loại
Phân tích các phát biểu:
✔️ a) Đúng. Que nhúng vào dung dịch lithium chloride sẽ cháy với ngọn lửa màu đỏ tía.
✔️ b) Đúng. Platinum (Pt) ở dạng tinh khiết, không bị oxi hóa ở bất cứ nhiệt độ nào. Kim loại này khó bị ăn mòn, chịu được nhiệt độ cao nên được dùng để làm que đốt.
❌ c) Sai. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên nếu thay NaCl bằng NaNO3 thì que nhúng vào dung dịch vẫn sẽ cháy với ngọn lửa màu vàng chứ không phải màu tím.
✔️ d) Đúng. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên có thể nhận biết riêng từng cation kim loại
Câu 6 [829511]: Soda (Na2CO3) khi để lâu ngoài không khí ẩm bị chuyển hóa một phần thành NaHCO3 và hút ẩm tạo thành hỗn hợp X. Lấy một lượng X hòa tan hoàn toàn vào nước thu được 200 mL dung dịch Y. Tiến hành các thí nghiệm sau:
▪ Thí nghiệm 1: Cho 25,0 mL dung dịch HCl 1 M vào 10,0 ml dung dịch Y, sau đó đun nhẹ. Chuẩn độ dung dịch thu được với chỉ thị phenolphtalein tới khi dung dịch trong bình chuyển từ không màu sang màu hồng và bền ít nhất trong 20 giây thì thấy hết 25,0 mL dung dịch NaOH 0,2 M.
▪ Thí nghiệm 2: Cho 25,0 mL dung dịch NaOH 1 M vào 10,0 ml dung dịch Y, sau đó thêm tiếp dung dịch BaCl2 dư thì thu được 0,011 mol kết tủa.
▪ Thí nghiệm 1: Cho 25,0 mL dung dịch HCl 1 M vào 10,0 ml dung dịch Y, sau đó đun nhẹ. Chuẩn độ dung dịch thu được với chỉ thị phenolphtalein tới khi dung dịch trong bình chuyển từ không màu sang màu hồng và bền ít nhất trong 20 giây thì thấy hết 25,0 mL dung dịch NaOH 0,2 M.
▪ Thí nghiệm 2: Cho 25,0 mL dung dịch NaOH 1 M vào 10,0 ml dung dịch Y, sau đó thêm tiếp dung dịch BaCl2 dư thì thu được 0,011 mol kết tủa.
Phân tích các phát biểu:
❌(a). Sai. Phản ứng tạo NaHCO3 thường xảy ra khi cho Na2CO3 tác dụng với CO2 và H2O.
Phương trình phản ứng: Na2CO3 + CO2 + H2O → 2NaHCO3
Trong phản ứng này: Không có sự thay đổi số oxi hóa của các nguyên tố.
❌(b). Sai. Chỉ thị phenolphtalein (PP) không chuyển sang màu hồng trong môi trường acid, mà trong môi trường base.
❌(c). Sai. Khi trộn BaCl2 với NaHCO3 không có kết tủa xuất hiện vì muối Ba(HCO3)2 là muối tan.
✔️(d). Đúng.
Đổi 10 mL = 0,01 L
Trong 10 mL Y chứa Na2CO3 (a mol) và NaHCO3 (b mol)
Thí nghiệm 1:
Na2CO3 + 2HCI → 2NaCl + CO2 + H2O
NaHCO3 + HCI → NaCl + CO2 + H2O
NaOH + HCl → NaCl + H2O (phản ứng chuẩn độ)
Số mol của HCl phản ứng là nHCl = 2a + b +0,2 × 0,025 = 0,025 × 1 mol (1)
Thí nghiệm 2:
NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
Số mol NaOH tham gian phản ứng là
nNaOH = b + 0,04 × 0,2 = 0,01 × 1 mol (2)
Từ (1),(2)→ a = 0,009 mol; b = 0,002 mol
Số mol của Na2CO3 ban đầu là n Na2CO3 = a + b/2 = 0,01 mol
Số mol của Na2CO3 bị chuyển hóa là n Na2CO3 = b/2 = 0,001 mol
→ %Na2CO3 bị chuyển hóa = 0,001 × 100%/0,01 = 10%
❌(a). Sai. Phản ứng tạo NaHCO3 thường xảy ra khi cho Na2CO3 tác dụng với CO2 và H2O.
Phương trình phản ứng: Na2CO3 + CO2 + H2O → 2NaHCO3
Trong phản ứng này: Không có sự thay đổi số oxi hóa của các nguyên tố.
❌(b). Sai. Chỉ thị phenolphtalein (PP) không chuyển sang màu hồng trong môi trường acid, mà trong môi trường base.
❌(c). Sai. Khi trộn BaCl2 với NaHCO3 không có kết tủa xuất hiện vì muối Ba(HCO3)2 là muối tan.
✔️(d). Đúng.
Đổi 10 mL = 0,01 L
Trong 10 mL Y chứa Na2CO3 (a mol) và NaHCO3 (b mol)
Thí nghiệm 1:
Na2CO3 + 2HCI → 2NaCl + CO2 + H2O
NaHCO3 + HCI → NaCl + CO2 + H2O
NaOH + HCl → NaCl + H2O (phản ứng chuẩn độ)
Số mol của HCl phản ứng là nHCl = 2a + b +0,2 × 0,025 = 0,025 × 1 mol (1)
Thí nghiệm 2:
NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
Số mol NaOH tham gian phản ứng là
nNaOH = b + 0,04 × 0,2 = 0,01 × 1 mol (2)
Từ (1),(2)→ a = 0,009 mol; b = 0,002 mol
Số mol của Na2CO3 ban đầu là n Na2CO3 = a + b/2 = 0,01 mol
Số mol của Na2CO3 bị chuyển hóa là n Na2CO3 = b/2 = 0,001 mol
→ %Na2CO3 bị chuyển hóa = 0,001 × 100%/0,01 = 10%
Câu 7 [829515]: Trong một phòng thí nghiệm, có 5 lọ chứa hoá chất bị mất nhãn được đánh số từ 1 đến 5, mỗi lọ chứa một trong các dung dịch sau: (NH4)2SO4, K2SO4, Ba(OH)2, Na2CO3, HCl. Tiến hành thí nghiệm với các dung dịch trên cho kết quả như sau:
▪ Thí nghiệm 1: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
▪ Thí nghiệm 2: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
▪ Thí nghiệm 3: Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
▪ Thí nghiệm 1: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
▪ Thí nghiệm 2: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
▪ Thí nghiệm 3: Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Phân tích các phát biểu:
🌟Thí nghiệm 1: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
→ Lọ (2) và (3) chứa (NH4)2SO4 và Ba(OH)2
Phương trình phản ứng:
(NH4)2SO4 + Ba(OH)2 → 2NH3 + 2H2O + BaSO4
🌟Thí nghiệm 2: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
Từ thí nghiệm (1) và (2)
→ (2) là Ba(OH)2 và lọ (1) và (4) vó thể là K2SO4 và Na2CO3.
🌟Phương trình phản ứng:
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
Thí nghiệm 3: Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Từ thí nghiệm 3 và 2
→ Lọ (4) chứa Na2CO3 và lọ (5) là HCl
→ Lọ (1) là K2SO4
Phương trình phản ứng:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
🌟Thí nghiệm 1: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
→ Lọ (2) và (3) chứa (NH4)2SO4 và Ba(OH)2
Phương trình phản ứng:
(NH4)2SO4 + Ba(OH)2 → 2NH3 + 2H2O + BaSO4
🌟Thí nghiệm 2: Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
Từ thí nghiệm (1) và (2)
→ (2) là Ba(OH)2 và lọ (1) và (4) vó thể là K2SO4 và Na2CO3.
🌟Phương trình phản ứng:
K2SO4 + Ba(OH)2 → BaSO4 + 2KOH
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
Thí nghiệm 3: Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Từ thí nghiệm 3 và 2
→ Lọ (4) chứa Na2CO3 và lọ (5) là HCl
→ Lọ (1) là K2SO4
Phương trình phản ứng:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Phân tích các phát biểu:
❌(a). Sai. Thí nghiệm 1: Dung dịch ở lọ (2) chứa (NH4)2SO4 tác dụng với dung dịch ở lọ (3) chứa Ba(OH)2 có kết tủa BaSO4 và khí thoát ra là NH3.
Phương trình phản ứng:
(NH4)2SO4 + Ba(OH)2 → 2NH3 + 2H2O + BaSO4
❌(b). Sai. Lọ (2) chứa dung dịch Ba(OH)2
❌(c). Sai. Dung dịch trong lọ (1) và (4) vó thể là K2SO4 và Na2CO3.
✔️(d). Đúng. Trộn dung dịch ở lọ (5) và (2) thì có xảy ra phản ứng trung hòa.
Phương trình phản ứng:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Câu 8 [705502]: Để nhận biết sự có mặt của một số ion kim loại có thể tiến hành các thí nghiệm theo quy trình dưới đây:
▪ Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (1) chứa khoảng 1 mL dung dịch CuSO4.
▪ Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (2) chứa khoảng 1 mL dung dịch FeCl3.
▪ Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (1) chứa khoảng 1 mL dung dịch CuSO4.
▪ Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (2) chứa khoảng 1 mL dung dịch FeCl3.
Hiện tượng và PTHH xảy ra ở 2 ống nghiệm như sau:
Ống nghiệm (1): Xuất hiện kết tủa xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ (xanh) + Na2SO4
Ống nghiệm (2): Xuất hiện kết tủa đỏ nâu:
FeCl3 + 3NaOH → Fe(OH)3↓ (đỏ nâu) + 3NaCl
Phân tích các phát biểu:
✔️ (a) Đúng. Ống nghiệm (1) xuất hiện kết tủa xanh trong ống nghiệm là Cu(OH)2.
❌ (b) Sai. Ống nghiệm (2) xuất hiện kết tủa nâu đỏ Fe(OH)3 không bị oxi hóa không khí ẩm nên không chuyển sang màu vàng nâu.
✔️ (c) Đúng. Nếu NaOH bằng dung dịch NH3 thì hiện tượng trong cả hai ống nghiệm vẫn xảy ra tương tự do NH3 và NaOH mang tính base như nhau, đều chứa ion OH-, phản ứng xảy ra:
Ống nghiệm (1): Xuất hiện kết tủa xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ (xanh) + Na2SO4
Ống nghiệm (2): Xuất hiện kết tủa đỏ nâu:
FeCl3 + 3NaOH → Fe(OH)3↓ (đỏ nâu) + 3NaCl
Phân tích các phát biểu:
✔️ (a) Đúng. Ống nghiệm (1) xuất hiện kết tủa xanh trong ống nghiệm là Cu(OH)2.
❌ (b) Sai. Ống nghiệm (2) xuất hiện kết tủa nâu đỏ Fe(OH)3 không bị oxi hóa không khí ẩm nên không chuyển sang màu vàng nâu.
✔️ (c) Đúng. Nếu NaOH bằng dung dịch NH3 thì hiện tượng trong cả hai ống nghiệm vẫn xảy ra tương tự do NH3 và NaOH mang tính base như nhau, đều chứa ion OH-, phản ứng xảy ra:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ (xanh) + (NH4)2SO4
FeCl3 + 3NH3 + 3H2O → Fe(OH)3↓ (đỏ nâu) + 3NH4Cl
✔️ (d) Đúng. Dựa vào màu sắc của kết tủa có thể phân biệt được sự có mặt của ion Cu2+ và Fe3+ trong dung dịch. Kết tủa của Fe3+ có màu nâu đỏ là Fe(OH)3 và kết tủa của Cu2+ có màu xanh là Cu(OH)2.
Câu 9 [706176]: Trong không khí ẩm, trên bề mặt của gang, thép luôn có một lớp nước rất mỏng đã hoà tan khí oxygen và carbon dioxide trong khí quyển, tạo thành dung dịch chất điện li. Gang, thép có thành phần chính là sắt và carbon cùng tiếp xúc với dung dịch chất điện li tạo nên vô số pin rất nhỏ mà trong đó sắt đóng vai trò là anode và carbon đóng vai trò là cathode.
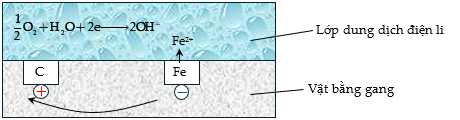

Phân tích các phát biểu:
❌a. Sai. Carbon đóng vai trò là cực dương (cathode)
✔️ b. Đúng. Oxygen bị khử, nhận electron, đóng vai trò là chất oxi hóa.
✔️ c. Đúng. Các electron di chuyển từ anode đến cathode.
❌ d .Sai. Xuất hiện hiện tượng ăn mòn điện hoá: Sắt phản ứng trực tiếp với oxygen trong không khí ẩm. Sắt và carbon tạo thành pin nhỏ, gây ăn mòn điện hóa.
❌a. Sai. Carbon đóng vai trò là cực dương (cathode)
✔️ b. Đúng. Oxygen bị khử, nhận electron, đóng vai trò là chất oxi hóa.
✔️ c. Đúng. Các electron di chuyển từ anode đến cathode.
❌ d .Sai. Xuất hiện hiện tượng ăn mòn điện hoá: Sắt phản ứng trực tiếp với oxygen trong không khí ẩm. Sắt và carbon tạo thành pin nhỏ, gây ăn mòn điện hóa.
Câu 10 [829506]: Copper(II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordeaux (trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp), ... Để diệt nấm trên cây cà chua, thuốc Bordeaux được pha với nước theo tỉ lệ 25g/8L nước. Trung bình mỗi ha cây cà chua cần phun khoảng 500 L dung dịch thuốc Bordeaux. Trong công nghiệp, copper(II) sulfate thường được sản xuất bằng 2 cách:
▪ Cách 1: Ngâm đồng phế liệu trong dung dịch sulfuric acid loãng và sục không khí:
2Cu + O2 + 2H2SO4 (loãng) → 2CuSO4 + 2H2O (1)
▪ Cách 2: Cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑+2H2O (2)
▪ Cách 1: Ngâm đồng phế liệu trong dung dịch sulfuric acid loãng và sục không khí:
2Cu + O2 + 2H2SO4 (loãng) → 2CuSO4 + 2H2O (1)
▪ Cách 2: Cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑+2H2O (2)
Phân tích các phát biểu:
✔️(a). Đúng. Để có 1 mol CuSO4 thì cách 1 dùng 1 mol H2SO4, cách 2 dùng 2 mol H2SO4.
Phương trình phản ứng:
(1) 2Cu + O2 + 2H2SO4 (loãng) → 2CuSO4 + 2H2O
(2) Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑+2H2O
✔️(b). Đúng. Cách 1 chỉ tạo chất đích (CuSO4), cách 2 tạo cả SO2 gây ô nhiễm môi trường
❌(c). Sai.
Thể tích thuốc cần phun là V = 500 × 5 = 2500 L
→ Khối lượng thuốc là
mBordeaux = 2500 × 25/8 = 7812,5 gam = 7,8125 kg
❌(d). Sai. trong phản ứng (1) thì Cu là chất khử, O2 là chất oxi hóa, H2SO4 là môi trường.
Quá trình oxi hóa: Cu → Cu2+ + 2e
Quá trình khử: O2 + 4e → 2O2-
✔️(a). Đúng. Để có 1 mol CuSO4 thì cách 1 dùng 1 mol H2SO4, cách 2 dùng 2 mol H2SO4.
Phương trình phản ứng:
(1) 2Cu + O2 + 2H2SO4 (loãng) → 2CuSO4 + 2H2O
(2) Cu + 2H2SO4 (đặc) → CuSO4 + SO2↑+2H2O
✔️(b). Đúng. Cách 1 chỉ tạo chất đích (CuSO4), cách 2 tạo cả SO2 gây ô nhiễm môi trường
❌(c). Sai.
Thể tích thuốc cần phun là V = 500 × 5 = 2500 L
→ Khối lượng thuốc là
mBordeaux = 2500 × 25/8 = 7812,5 gam = 7,8125 kg
❌(d). Sai. trong phản ứng (1) thì Cu là chất khử, O2 là chất oxi hóa, H2SO4 là môi trường.
Quá trình oxi hóa: Cu → Cu2+ + 2e
Quá trình khử: O2 + 4e → 2O2-
Câu 11 [829523]: Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất tròng, tẩy uế, sát trùng, xử lí nước thải,... Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quả trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn. Xét một lò nung với công nghiệp sử dụng than đã làm nhiên liệu. Giả thiết:
▪ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 KJ.
▪ Đốt cháy 1 kg than đá giải phóng ra một nhiệt lượng là 27000 KJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
▪ Than đã chứa 1% sulfur (ở dạng vô cơ và hữu cơ như FeS2, CaSO4, CxHySH,...) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% lượng SO2 sinh ra phát thải vào khí quyển.
▪ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Giả thiết toàn bộ lượng SO2 phát ra từ lò nung vôi trên trong 30 ngày chuyển hết thành sufuric acid trong nước mưa.
▪ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 KJ.
▪ Đốt cháy 1 kg than đá giải phóng ra một nhiệt lượng là 27000 KJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
▪ Than đã chứa 1% sulfur (ở dạng vô cơ và hữu cơ như FeS2, CaSO4, CxHySH,...) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% lượng SO2 sinh ra phát thải vào khí quyển.
▪ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Giả thiết toàn bộ lượng SO2 phát ra từ lò nung vôi trên trong 30 ngày chuyển hết thành sufuric acid trong nước mưa.
Phân tích các phát biểu:
❌(a). Sai. Phản ứng nhiệt phân đá vôi là phản ứng thu nhiệt. Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 kJ.
✔️(b). Đúng.
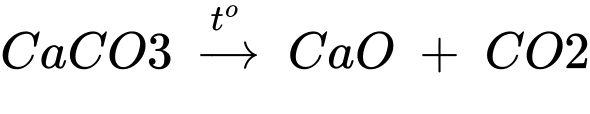
Khối lượng đá vôi sử dụng trong 1 ngày: mCaO = 420 tấn → mCaCO3 = 420 × 100/56 = 750 tấn
→ m than = 100 tấn
✔️(c). Đúng.
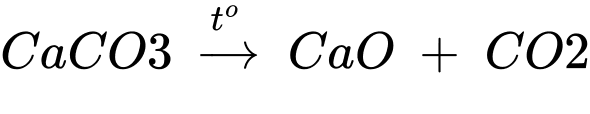
Khối lượng đá vôi sử dụng trong 1 ngày: mCaO = 420 tấn → mCaCO3 = 420 × 100/56 = 750 tấn
Bảo toàn năng lượng khi nung:
(mthan) × 27000 × 50% = 750 × 1800
→ m than = 100 tấn
❌(d). Sai.
Sơ đồ phản ứng
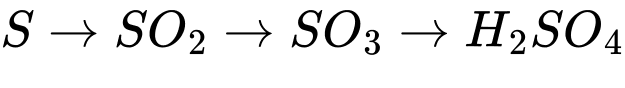
Trong 30 ngày đã phát thải:
Bảo toàn nguyên tố nSO2 = nS cháy tạo SO2 = 30 × 100 × 1% × 80% × 1,6%/32 = 0,012 × 106 mol
Bảo toàn nguyên tố S, số mol của H2SO4 là
n H2SO4 = 0,012 × 106 mol
Nồng độ H2SO4 trong nước mưa là:
❌(a). Sai. Phản ứng nhiệt phân đá vôi là phản ứng thu nhiệt. Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 kJ.
✔️(b). Đúng.
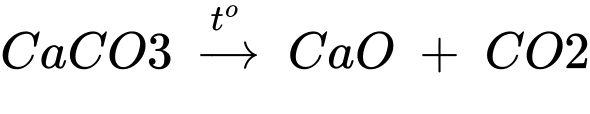
Khối lượng đá vôi sử dụng trong 1 ngày: mCaO = 420 tấn → mCaCO3 = 420 × 100/56 = 750 tấn
→ m than = 100 tấn
✔️(c). Đúng.
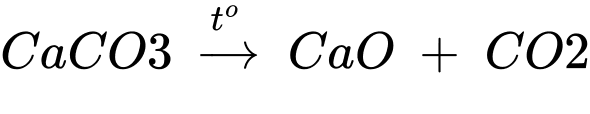
Khối lượng đá vôi sử dụng trong 1 ngày: mCaO = 420 tấn → mCaCO3 = 420 × 100/56 = 750 tấn
Bảo toàn năng lượng khi nung:
(mthan) × 27000 × 50% = 750 × 1800
→ m than = 100 tấn
❌(d). Sai.
Sơ đồ phản ứng
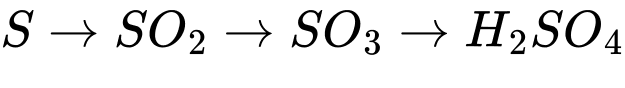
Trong 30 ngày đã phát thải:
Bảo toàn nguyên tố nSO2 = nS cháy tạo SO2 = 30 × 100 × 1% × 80% × 1,6%/32 = 0,012 × 106 mol
Bảo toàn nguyên tố S, số mol của H2SO4 là
n H2SO4 = 0,012 × 106 mol
Nồng độ H2SO4 trong nước mưa là:
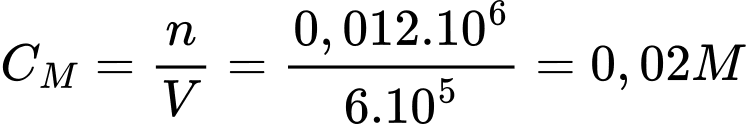
Câu 12 [705789]: Trong nước thải của một nhà máy, hàm lượng ion amonium là 192 mg/L. Để xử lí ion amonium về nồng độ cho phép là không quá 5 mg/L (theo quy chuẩn Việt Nam), người ta tiến hành xử lí nước thải theo phương pháp Anammox (Anaerobic Ammonium Oxidation). Phương pháp này gồm 2 giai đoạn:
▪ Giai đoạn 1: Oxi hóa một phần ion amonium thành ion nitrite theo phản ứng sau:
2NH4+(aq) + 3O2(g) +4HCO3–(aq) 2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
Trong đó, sử dụng muối NaHCO3 để cung cấp ion HCO3–, sục không khí liên tục để cung cấp O2.
▪ Giai đoạn 2: Diễn ra trong điều kiện yếm khí, lượng amonium còn lại sẽ được oxi hoá trực tiếp bằng ion nitrite từ giai đoạn 1, sản phẩm tạo thành là khí nitrogen theo phản ứng:
NH4+(aq) + NO2–(aq) N2(g) + 2H2O
N2(g) + 2H2O
Biết các phản ứng xảy ra hoàn toàn.
▪ Giai đoạn 1: Oxi hóa một phần ion amonium thành ion nitrite theo phản ứng sau:
2NH4+(aq) + 3O2(g) +4HCO3–(aq)
 2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
2NO2–(aq) + 4CO2(aq) + 6H2O(aq)Trong đó, sử dụng muối NaHCO3 để cung cấp ion HCO3–, sục không khí liên tục để cung cấp O2.
▪ Giai đoạn 2: Diễn ra trong điều kiện yếm khí, lượng amonium còn lại sẽ được oxi hoá trực tiếp bằng ion nitrite từ giai đoạn 1, sản phẩm tạo thành là khí nitrogen theo phản ứng:
NH4+(aq) + NO2–(aq)
 N2(g) + 2H2O
N2(g) + 2H2OBiết các phản ứng xảy ra hoàn toàn.
Phân tích các phát biểu:
✔️A. Đúng. CM (NH4+) = n : V = 192.10-3 : 18 : 1 = 1,07.10-2 M.
❌B. Sai. Số oxi hóa theo PT:
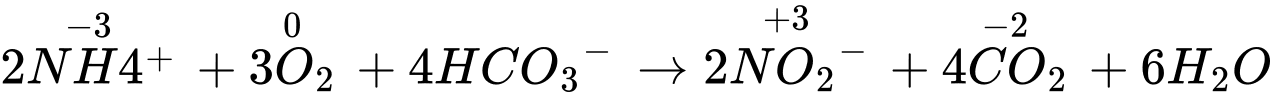
⟹ Chất khử là NH4+, chất oxi hóa là O2.
❌C. Sai. Nếu số oxi hóa thay đổi trong cùng 1 phân tử ⟹ oxi hóa nội phân tử. Nhưng ở giai đoạn 2 có 2 phân tử thay đổi số oxi hóa là NH4+ và NO2-.
✔️D. Đúng. 1mol NH4+ ⟹ 1mol HCO3-
✔️A. Đúng. CM (NH4+) = n : V = 192.10-3 : 18 : 1 = 1,07.10-2 M.
❌B. Sai. Số oxi hóa theo PT:
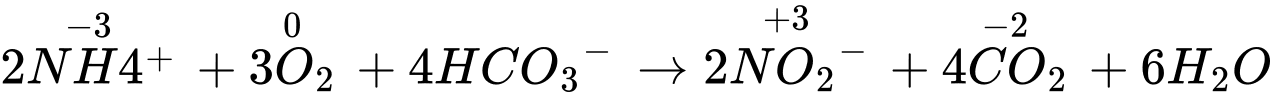
⟹ Chất khử là NH4+, chất oxi hóa là O2.
❌C. Sai. Nếu số oxi hóa thay đổi trong cùng 1 phân tử ⟹ oxi hóa nội phân tử. Nhưng ở giai đoạn 2 có 2 phân tử thay đổi số oxi hóa là NH4+ và NO2-.
✔️D. Đúng. 1mol NH4+ ⟹ 1mol HCO3-
Câu 13 [684393]: Tiến hành thí nghiệm theo các bước
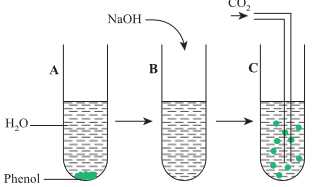
Bước 1: Cho phenol vào ống nghiệm, thêm nước và lắc đều ống nghiệm (ống nghiệm A).
Bước 2: Cho dung dịch NaOH tới dư vào ống nghiệm A thấy dung dịch chuyển sang trong suốt (ống nghiệm B).
Bước 3: Sục khí CO2 tới dư vào ống nghiệm B thấy dung dịch chuyển màu trắng đục như ban đầu (ống nghiệm C).

Bước 1: Cho phenol vào ống nghiệm, thêm nước và lắc đều ống nghiệm (ống nghiệm A).
Bước 2: Cho dung dịch NaOH tới dư vào ống nghiệm A thấy dung dịch chuyển sang trong suốt (ống nghiệm B).
Bước 3: Sục khí CO2 tới dư vào ống nghiệm B thấy dung dịch chuyển màu trắng đục như ban đầu (ống nghiệm C).
Phân tích các phát biểu:
❌a. Sai. Khi cho phenol vào ống nghiệm A, thêm nước và lắc ống nghiệm ta thấy ống nghiệm A chuyển sang màu trắng đục. Phenol ít tan trong nước ở nhiệt độ thường nên một phần phenol không tan chuyển sang màu trắng đục ( phenol bão hòa)
✔️b. Đúng. CO2 và SO2 đều là oxide acid nên có thể tác dụng với dung dịch base tạo ra muối và nước. Trong trường hợp này cả 2 khí đều tác dụng với natri phenolate (C6H5ONa) tạo ra muối mới và phenol.
C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3
2C6H5ONa + SO2 + H2O ⟶ 2C6H5OH + Na2SO3
Phản ứng này được gọi là phản ứng trung hòa acid base nên khi thay CO2 bằng SO2 thì hiện tượng quan sát được dung dịch chuyển màu trắng đục như ban đầu.
❌c. Sai. Cho dung dịch NaOH vào ống nghiệm A thấy dung dịch chuyển màu trong suốt do phản ứng của phenol với NaOH tạo muối tan .
C6H5OH + NaOH ⟶ C6H5ONa + H2O.
Khi cho phenolphtalein vào ống nghiệm B, NaOH dư làm dung dịch trở thành môi trường, làm phenolphtalein chuyển sang màu hồng.
✔️d. Đúng. Phenol có tính chất ở nhiệt độ thường, tan ít trong nước lạnh nhưng khi đun nóng lên phenol tan tốt trong nước làm dung dịch trở nên trong suốt hơn. Hiện tượng này cho thấy độ tan của phenol phụ thuộc vào nhiệt độ.
❌a. Sai. Khi cho phenol vào ống nghiệm A, thêm nước và lắc ống nghiệm ta thấy ống nghiệm A chuyển sang màu trắng đục. Phenol ít tan trong nước ở nhiệt độ thường nên một phần phenol không tan chuyển sang màu trắng đục ( phenol bão hòa)
✔️b. Đúng. CO2 và SO2 đều là oxide acid nên có thể tác dụng với dung dịch base tạo ra muối và nước. Trong trường hợp này cả 2 khí đều tác dụng với natri phenolate (C6H5ONa) tạo ra muối mới và phenol.
C6H5ONa + CO2 + H2O ⟶ C6H5OH + NaHCO3
2C6H5ONa + SO2 + H2O ⟶ 2C6H5OH + Na2SO3
Phản ứng này được gọi là phản ứng trung hòa acid base nên khi thay CO2 bằng SO2 thì hiện tượng quan sát được dung dịch chuyển màu trắng đục như ban đầu.
❌c. Sai. Cho dung dịch NaOH vào ống nghiệm A thấy dung dịch chuyển màu trong suốt do phản ứng của phenol với NaOH tạo muối tan .
C6H5OH + NaOH ⟶ C6H5ONa + H2O.
Khi cho phenolphtalein vào ống nghiệm B, NaOH dư làm dung dịch trở thành môi trường, làm phenolphtalein chuyển sang màu hồng.
✔️d. Đúng. Phenol có tính chất ở nhiệt độ thường, tan ít trong nước lạnh nhưng khi đun nóng lên phenol tan tốt trong nước làm dung dịch trở nên trong suốt hơn. Hiện tượng này cho thấy độ tan của phenol phụ thuộc vào nhiệt độ.
Câu 14 [829519]: Nung 25 gam một mẫu quặng malachite có thành phần chính là Cu(OH)2.CuCO3 (còn lại là tạp chất trơ) trong không khí đến khối lượng không đổi thu được chất rắn M. Cho toàn bộ lượng chất rắn M vào cốc thủy tinh, sau đó cho từ từ dung dịch H2SO4 19,6% vào cốc cho đến khi chất rắn không tan thêm được nữa thì dừng lại, lọc bỏ tạp chất trơ thu được dung dịch X. Làm lạnh toàn bộ dung dịch X xuống 10 oC thu được dung dịch Y có nồng độ 14,16% và tách ra 25 gam tinh thể CuSO4.5H2O.
Phân tích các phát biểu:
✔️(a). Đúng. Chất rắn M gồm CuO và tạp chất trơ.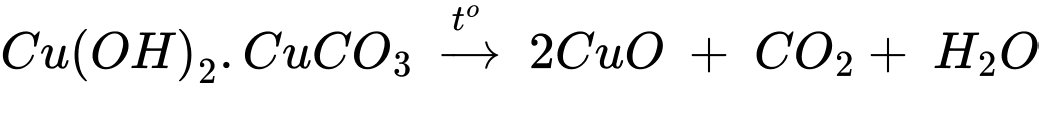
✔️(b). Đúng. Dung dịch X chỉ chứa chất tan là
CuSO4. CuO + H2SO4 → CuSO4 + H2O
❌(c). Sai. Số mol ion Cu2+ trong dung dịch X lớn hoinw dung dịch Y nguyên do Làm lạnh toàn bộ dung dịch X xuống 10oC thu được dung dịch Y.
✔️(d). Đúng.
Phương trình phản ứng:
CuO + H2SO4 → CuSO4 + H2O
Đặt nCuO = n H2SO4 = nCuSO4 = x
Khối lượng dung dịch X là
mddX = mCuO + mdd H2SO4 = 80x + 98x/19,6% = 580x gam
Số mol của CuSO4. 5H2O là nCuSO4.5H2O = 25/250 = 0,1 mol
Bảo toàn khối lượng CuSO4: mCuSO4 = 160x = 160 × 0,1 + 14,16% × (580x-25) → x = 0,16 mol
Phần trăm Cu có trong quạng là %mCu = 0,16 × 64 × 100%/25 = 40,96%. ≈ 41%.
✔️(a). Đúng. Chất rắn M gồm CuO và tạp chất trơ.
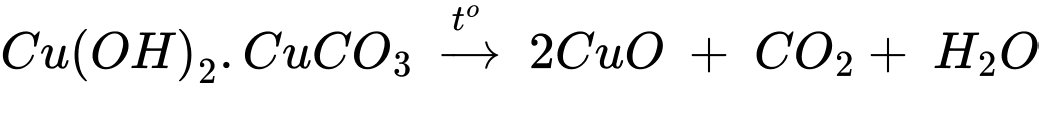
✔️(b). Đúng. Dung dịch X chỉ chứa chất tan là
CuSO4. CuO + H2SO4 → CuSO4 + H2O
❌(c). Sai. Số mol ion Cu2+ trong dung dịch X lớn hoinw dung dịch Y nguyên do Làm lạnh toàn bộ dung dịch X xuống 10oC thu được dung dịch Y.
✔️(d). Đúng.
Phương trình phản ứng:
CuO + H2SO4 → CuSO4 + H2O
Đặt nCuO = n H2SO4 = nCuSO4 = x
Khối lượng dung dịch X là
mddX = mCuO + mdd H2SO4 = 80x + 98x/19,6% = 580x gam
Số mol của CuSO4. 5H2O là nCuSO4.5H2O = 25/250 = 0,1 mol
Bảo toàn khối lượng CuSO4: mCuSO4 = 160x = 160 × 0,1 + 14,16% × (580x-25) → x = 0,16 mol
Phần trăm Cu có trong quạng là %mCu = 0,16 × 64 × 100%/25 = 40,96%. ≈ 41%.
Câu 15 [680854]: Một nhóm học sinh tìm hiểu quá trình thu hồi kim loại đồng (copper) bằng phương pháp điện phân từ một đồng xu làm bằng hợp kim Cu – Zn chứa khoảng 95 % đồng về khối lượng. Giả thuyết của nhóm học sinh là "khi điện phân, chỉ có tạp chất trong đồng xu tan hết vào trong dung dịch, còn lại sẽ là đồng tinh khiết". Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau:
- Cân để xác định khối lượng ban đầu của đồng xu (2,23 gam) và thanh đồng tinh khiết (2,55 gam).
- Nối đồng xu với một điện cực và thanh đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch copper(II) sulfate.
- Điện phân ở hiệu điện thế phù hợp.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của đồng xu và thanh đồng tinh khiết, thấy khối lượng đồng xu là 1,94 gam và khối lượng thanh đồng là m1 gam.
- Cân để xác định khối lượng ban đầu của đồng xu (2,23 gam) và thanh đồng tinh khiết (2,55 gam).
- Nối đồng xu với một điện cực và thanh đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch copper(II) sulfate.
- Điện phân ở hiệu điện thế phù hợp.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của đồng xu và thanh đồng tinh khiết, thấy khối lượng đồng xu là 1,94 gam và khối lượng thanh đồng là m1 gam.
Phân tích các phát biểu:
✔️a. Đúng. Do đồng xu có khối lượng giảm nên đây là quá trình điện phân xảy ra hiện tượng dương cực tan với đồng xu được nối với cực dương, thanh đồng tinh khiết được nối với cực âm của nguồn điện.
✔️b. Đúng.
Tại anode (đồng xu) : Cu ⟶ Cu2+ + 2e.
Tại cathode (thanh đồng tinh khiết): Cu2+ + 2e ⟶ Cu.
Do có thêm Cu bám vào nên thanh đồng tinh khiết nặng hơn thanh đồng ban đầu (m > 2,55).
❌c. Sai. Tại cực dương (anode) xảy ra quá trình oxi hoá: Cu ⟶ Cu2+ + 2e.
❌d. Sai. Khối lượng của đồng xu giảm là do Cu tan ra chứ không phải tạp chất tan ra, nên giả thuyết ban đầu của nhóm học sinh là sai.
✔️a. Đúng. Do đồng xu có khối lượng giảm nên đây là quá trình điện phân xảy ra hiện tượng dương cực tan với đồng xu được nối với cực dương, thanh đồng tinh khiết được nối với cực âm của nguồn điện.
✔️b. Đúng.
Tại anode (đồng xu) : Cu ⟶ Cu2+ + 2e.
Tại cathode (thanh đồng tinh khiết): Cu2+ + 2e ⟶ Cu.
Do có thêm Cu bám vào nên thanh đồng tinh khiết nặng hơn thanh đồng ban đầu (m > 2,55).
❌c. Sai. Tại cực dương (anode) xảy ra quá trình oxi hoá: Cu ⟶ Cu2+ + 2e.
❌d. Sai. Khối lượng của đồng xu giảm là do Cu tan ra chứ không phải tạp chất tan ra, nên giả thuyết ban đầu của nhóm học sinh là sai.
Câu 16 [706337]: Một ví dụ điển hình về việc sử dụng phản ứng kết tủa để tìm tỉ lệ hợp thức của phương trình là phản ứng giữa dung dịch lead nitrate và potassium iodide. Cả hai dung dịch đều không màu, khi chúng được trộn lẫn, kết tủa màu màu vàng lead iodide được hình thành.
Phương trình phản ứng bằng chữ được thể hiện như sau:
lead nitrate + potassium iodide → lead iodide + potassium nitrate
Sau đây là các bước tiến hành thí nghiệm.
∎ Bước 1: Đổ cùng một thể tích dung dịch potassium iodide vào một loạt ống nghiệm.
∎ Bước 2: Thêm các thể tích khác nhau của dung dịch lead nitrate vào ống nghiệm.
∎ Bước 3: Đặt từng ống nghiệm vào máy ly tâm và quay các ống trong cùng khoảng thời gian. Máy li tâm giúp kết tủa lắng động ở phía dưới đáy ở ống nghiệm.
∎ Bước 4: Đo chiều cao của kết tủa trong mỗi ống.Kết quả của các thí nghiệm được thể hiện trong bảng.
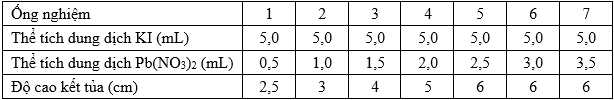
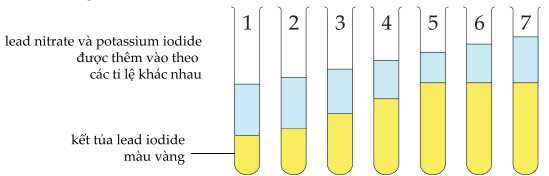
Nồng độ của cả hai dung dịch là 1,0 M.
Phương trình phản ứng bằng chữ được thể hiện như sau:
lead nitrate + potassium iodide → lead iodide + potassium nitrate
Sau đây là các bước tiến hành thí nghiệm.
∎ Bước 1: Đổ cùng một thể tích dung dịch potassium iodide vào một loạt ống nghiệm.
∎ Bước 2: Thêm các thể tích khác nhau của dung dịch lead nitrate vào ống nghiệm.
∎ Bước 3: Đặt từng ống nghiệm vào máy ly tâm và quay các ống trong cùng khoảng thời gian. Máy li tâm giúp kết tủa lắng động ở phía dưới đáy ở ống nghiệm.
∎ Bước 4: Đo chiều cao của kết tủa trong mỗi ống.Kết quả của các thí nghiệm được thể hiện trong bảng.

Nồng độ của cả hai dung dịch là 1,0 M.

Phân tích các phát biểu:
✔️(a) – Đúng. Từ hình minh họa, chiều cao của kết tủa tỉ lệ thuận với khối lượng kết tủa được hình thành.
✔️(b) – Đúng. Dựa vào phương trình ion rút gọn, ion K+ và NO3- chỉ đóng vai trò là ion quan sát.
PTHH: 2KI + Pb(NO3)2→ PbI2 + 2KNO3
Phương trình ion rút gọn: Pb2+ + 2I- → PbI2
❌(c) – Sai. Trong các thí nghiệm, khối lượng kết tủa phụ thuộc vào lượng KI và Pb(NO3)2, lượng càng nhiều thì kết tủa càng lớn.
❌(d) – Sai.
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,0005 mol
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,002 mol
Chỉ cung cáp thông tin về thay đổi độ cao kết tủa chưa thể xác định được tỉ lệ giữa KI và Pb(NO3)2
✔️(a) – Đúng. Từ hình minh họa, chiều cao của kết tủa tỉ lệ thuận với khối lượng kết tủa được hình thành.
✔️(b) – Đúng. Dựa vào phương trình ion rút gọn, ion K+ và NO3- chỉ đóng vai trò là ion quan sát.
PTHH: 2KI + Pb(NO3)2→ PbI2 + 2KNO3
Phương trình ion rút gọn: Pb2+ + 2I- → PbI2
❌(c) – Sai. Trong các thí nghiệm, khối lượng kết tủa phụ thuộc vào lượng KI và Pb(NO3)2, lượng càng nhiều thì kết tủa càng lớn.
❌(d) – Sai.
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,0005 mol
Thí nghiệm (1) số mol của KI và Pb(NO3)2 lần lượt là 0,005 mol và 0,002 mol
Chỉ cung cáp thông tin về thay đổi độ cao kết tủa chưa thể xác định được tỉ lệ giữa KI và Pb(NO3)2
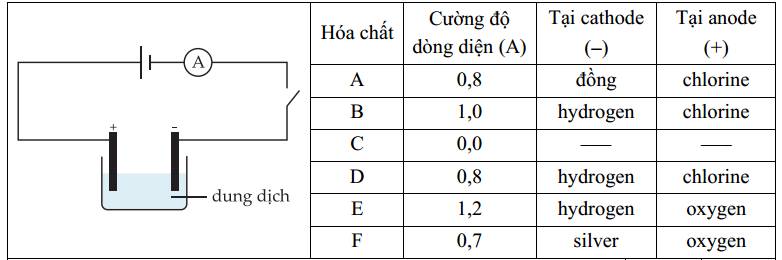
Câu 17 [560570]: Có 6 hóa chất từ A đến F được hòa tan trong nước và lần lượt nối vào mạch điện bên dưới. A đại diện cho một ampe kế, được sử dụng để đo dòng điện. Bảng hiển thị kết quả.

Phân tích các phát biểu sau:
✔️a. Đúng. Tại cathode thu được kim loại Cu, anode thu được khí chlorine => hóa chất A có thể là CuCl2.
Cathode ( - ) : Cu2+ + 2e ⟶ Cu
Anode ( + ) : 2Cl- ⟶ Cl2 + 2e
✔️ b. Đúng. Vì cường độ dòng điện bằng 0 nên chất C không dẫn diện, không có khả năng phân li thành ion trong dung dịch => Saccharose là đúng.
❌ c. Sai. Tại anode (+) thu được khí oxygen (nước bị điện phân) nên anion trong dung dịch không bị điện phân. Tuy nhiên có nhiều loại anion không bị điện phân như SO42-, NO3-, ClO4-,... => Dung dịch E và F có thể chứa khác loại anion.
Anode (+) 2H2O ⟶ 4H+ + O2 + 4e
❌d. Sai. Điện phân dung dịch B, D, E tại cathode có thể là điện phân nước và H+ để tạo H2
✔️a. Đúng. Tại cathode thu được kim loại Cu, anode thu được khí chlorine => hóa chất A có thể là CuCl2.
Cathode ( - ) : Cu2+ + 2e ⟶ Cu
Anode ( + ) : 2Cl- ⟶ Cl2 + 2e
✔️ b. Đúng. Vì cường độ dòng điện bằng 0 nên chất C không dẫn diện, không có khả năng phân li thành ion trong dung dịch => Saccharose là đúng.
❌ c. Sai. Tại anode (+) thu được khí oxygen (nước bị điện phân) nên anion trong dung dịch không bị điện phân. Tuy nhiên có nhiều loại anion không bị điện phân như SO42-, NO3-, ClO4-,... => Dung dịch E và F có thể chứa khác loại anion.
Anode (+) 2H2O ⟶ 4H+ + O2 + 4e
❌d. Sai. Điện phân dung dịch B, D, E tại cathode có thể là điện phân nước và H+ để tạo H2
Câu 18 [829512]: Một học sinh đã thực hiện một thí nghiệm để xác định tốc độ phản ứng giữa hydrochloric acid (HCl) và đá cẩm thạch (thành phần chính là calcium carbonate, còn lại tạp chất không tan, không tác dụng với acid). Phản ứng giữa hai chất này được biểu diễn bằng phương trình hoá học:
2HCl(aq) + CaCO3(s) → CaCl2(aq) + H2O(l) + CO2(g);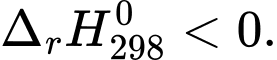
▪ Thí nghiệm 1: Cho các viên đá cẩm thạch (kích thước hạt khoảng 1 mm) tác dụng với dung dịch HCl. Thời gian bắt đầu tính khi các viên đá cẩm thạch được thả vào acid và miếng bông gòn được chèn vào. Bông gòn ngăn không cho dung dịch phun ra. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây. Kết quả thí nghiệm được biểu diễn như hình (b).
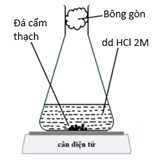
Hình (a). Cách thiết lập thí nghiệm.
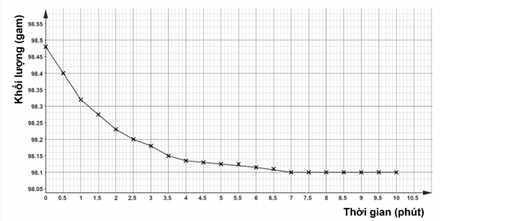
Hình (b). Đồ thị khối lượng của bình và thành phần trong bình theo thời gian.
▪ Thí nghiệm 2: Tiến hành giống hoàn toàn ở thí nghiệm 1, sự khác biệt duy nhất là những viên đá cẩm thạnh ở thí nghiệm 2 được nghiền nhỏ thành dạng bột mịn so với thí nghiệm 1. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây.
Học sinh đã đề xuất những giả thuyết sau đây để giải thích hình dạng của đồ thị hình (b).
(I) Ở mốc 7 phút, một hoặc cả hai chất tham gia phản ứng đã hết.
(II) Khối lượng tiếp tục giảm khi chất rắn đang hoà tan; dung dịch có khối lượng nhỏ hơn chất rắn.
(III) Tốc độ phản ứng ban đầu là nhanh nhất vì nồng độ của acid tại thời điểm này lớn nhất.
(IV) Trong quá trình phản ứng thì tốc độ phản ứng giảm vì dung dịch lạnh dần.
2HCl(aq) + CaCO3(s) → CaCl2(aq) + H2O(l) + CO2(g);
▪ Thí nghiệm 1: Cho các viên đá cẩm thạch (kích thước hạt khoảng 1 mm) tác dụng với dung dịch HCl. Thời gian bắt đầu tính khi các viên đá cẩm thạch được thả vào acid và miếng bông gòn được chèn vào. Bông gòn ngăn không cho dung dịch phun ra. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây. Kết quả thí nghiệm được biểu diễn như hình (b).

Hình (a). Cách thiết lập thí nghiệm.

Hình (b). Đồ thị khối lượng của bình và thành phần trong bình theo thời gian.
▪ Thí nghiệm 2: Tiến hành giống hoàn toàn ở thí nghiệm 1, sự khác biệt duy nhất là những viên đá cẩm thạnh ở thí nghiệm 2 được nghiền nhỏ thành dạng bột mịn so với thí nghiệm 1. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây.
Học sinh đã đề xuất những giả thuyết sau đây để giải thích hình dạng của đồ thị hình (b).
(I) Ở mốc 7 phút, một hoặc cả hai chất tham gia phản ứng đã hết.
(II) Khối lượng tiếp tục giảm khi chất rắn đang hoà tan; dung dịch có khối lượng nhỏ hơn chất rắn.
(III) Tốc độ phản ứng ban đầu là nhanh nhất vì nồng độ của acid tại thời điểm này lớn nhất.
(IV) Trong quá trình phản ứng thì tốc độ phản ứng giảm vì dung dịch lạnh dần.
Phân tích các phát biểu:
✔️(a).Đúng.
(I) Đúng, từ lúc 7 phút, thời gian trôi nhưng khối lượng bình không giảm (đồ thị đi ngang) chứng tỏ không còn CO2 thoát ra ⟶ Một hoặc cả hai chất tham gia phản ứng đã hết.
(II) Sai, không có tương quan giữa khối lượng dung dịch và khối lượng chất rắn.
(III) Đúng. Tốc độ phản ứng ban đầu là nhanh nhất vì nồng độ acid lúc đó lớn nhất, làm tăng xác suất va chạm giữa các phân tử.
(IV) Sai, trong quá trình phản ứng thì tốc độ phản ứng giảm vì nồng độ acid giảm.
❌(b).Sai. 98,10 là khối lượng bình còn lại sau khi CO2 ngừng thoát ra.
❌(c). Sai. chỉ nghiền nhỏ đá và các yếu tố khác giữ nguyên thì tốc độ phản ứng tăng lên, đồ thị có độ dốc lớn hơn nhưng điểm kết thúc (đi ngang) vẫn không thay đổi (vẫn là 98,10).
❌(d). Sai. nếu thay HCI bằng CH3COOH cùng nồng độ thì thời gian thí nghiệm sẽ kéo dài, đồ thị có độ dốc thấp do CH3COOH có tính acid yếu nên phản ứng diễn ra chậm.
✔️(a).Đúng.
(I) Đúng, từ lúc 7 phút, thời gian trôi nhưng khối lượng bình không giảm (đồ thị đi ngang) chứng tỏ không còn CO2 thoát ra ⟶ Một hoặc cả hai chất tham gia phản ứng đã hết.
(II) Sai, không có tương quan giữa khối lượng dung dịch và khối lượng chất rắn.
(III) Đúng. Tốc độ phản ứng ban đầu là nhanh nhất vì nồng độ acid lúc đó lớn nhất, làm tăng xác suất va chạm giữa các phân tử.
(IV) Sai, trong quá trình phản ứng thì tốc độ phản ứng giảm vì nồng độ acid giảm.
❌(b).Sai. 98,10 là khối lượng bình còn lại sau khi CO2 ngừng thoát ra.
❌(c). Sai. chỉ nghiền nhỏ đá và các yếu tố khác giữ nguyên thì tốc độ phản ứng tăng lên, đồ thị có độ dốc lớn hơn nhưng điểm kết thúc (đi ngang) vẫn không thay đổi (vẫn là 98,10).
❌(d). Sai. nếu thay HCI bằng CH3COOH cùng nồng độ thì thời gian thí nghiệm sẽ kéo dài, đồ thị có độ dốc thấp do CH3COOH có tính acid yếu nên phản ứng diễn ra chậm.
Câu 19 [829524]: Phosphoric acid là một acid ba nấc. Một nhóm học sinh thực hiện điều chế phosphoric acid trong phòng thí nghiệm theo các bước sau:
▪ Bước 1: Cân 0,5258 gam phosphorus đỏ (đã sấy khô) cho vào chén sứ và thấm ướt bằng vài giọt nước cất.
▪ Bước 2: Thêm từ từ từng lượng nhỏ dung dịch HNO3 đặc vào chén sứ, đun nhẹ và khuấy cho đến khi phosphorus đỏ tan hết. Tiếp tục đun nhẹ đến khi không còn khí màu nâu thoát ra.
▪ Bước 3: Thêm nước cất vào chén sứ đã để nguội, chuyển toàn bộ dung dịch thu được vào bình định mức 100 mL. Thêm nước cất đến vạch định mức và lắc đều.
▪ Bước 4: Chuẩn độ 5,00 mL dung dịch ở bước 3 bằng dung dịch NaOH 0,108 M sử dụng chỉ thị phenolphthalein để phản ứng (2) xảy ra hoàn toàn mà chưa xảy ra phản ứng (3). Sau 3 lần chuẩn độ, giá trị V trung bình là 14,76 mL.
Biết phản ứng của H3PO4 với NaOH xảy ra theo ba nấc như sau:
H3PO4 + NaOH → NaH2PO4 + H2O (1)
NaH2PO4 + NaOH → Na2HPO4 + H2O (2)
Na2HPO4 + NaOH → Na3PO4 + H2O (3)
▪ Bước 1: Cân 0,5258 gam phosphorus đỏ (đã sấy khô) cho vào chén sứ và thấm ướt bằng vài giọt nước cất.
▪ Bước 2: Thêm từ từ từng lượng nhỏ dung dịch HNO3 đặc vào chén sứ, đun nhẹ và khuấy cho đến khi phosphorus đỏ tan hết. Tiếp tục đun nhẹ đến khi không còn khí màu nâu thoát ra.
▪ Bước 3: Thêm nước cất vào chén sứ đã để nguội, chuyển toàn bộ dung dịch thu được vào bình định mức 100 mL. Thêm nước cất đến vạch định mức và lắc đều.
▪ Bước 4: Chuẩn độ 5,00 mL dung dịch ở bước 3 bằng dung dịch NaOH 0,108 M sử dụng chỉ thị phenolphthalein để phản ứng (2) xảy ra hoàn toàn mà chưa xảy ra phản ứng (3). Sau 3 lần chuẩn độ, giá trị V trung bình là 14,76 mL.
Biết phản ứng của H3PO4 với NaOH xảy ra theo ba nấc như sau:
H3PO4 + NaOH → NaH2PO4 + H2O (1)
NaH2PO4 + NaOH → Na2HPO4 + H2O (2)
Na2HPO4 + NaOH → Na3PO4 + H2O (3)
Phân tích các phát biểu:
❌(a). Sai. Tại bước 1 chưa sử dung dịch acid HNO3.
✔️(b).Đúng. Phương trình phản ứng:
H3PO4 + 3NaOH → Na3PO4 + 2H2O
Đổi 14,76 mL = 0,01476 L
Số mol của NaOH là nNaoH = 0,01476 × 0,108 = 0,00159408 mol
Từ phương trình hóa học số mol của H3PO4 là 0,00053136 mol
Số mol Của H3PO4 ban đầu là nH3PO4 =0,00053136 × 100/5 = 0,0106272 mol
Bảo toàn nguyên tố P: nP = nH3PO4 = 0,0106272 mol Hiệu suất (làm tròn đến hàng đơn vị) của quá trình điều chế H3PO4 trong thí nghiệm trên là
H = 0,0106272 × 31 × 100%/ 0,5258 ≈ 94%
✔️(c). Đúng. Phospho đỏ bị ẩm làm tăng khối lượng ban đầu do có lẫn nước. Nước không tham gia phản ứng, nên làm sai lệch kết quả tính toán. Do đó, hiệu suất tính được nhỏ hơn hiệu suất thực tế.
❌(d). Sai. Ở bước 2, nếu thay HNO3 đặc bằng H2SO4 đặc thì sẽ thu được H3PO4 sẽ lẫn nhiều tạp chất hơn.
❌(a). Sai. Tại bước 1 chưa sử dung dịch acid HNO3.
✔️(b).Đúng. Phương trình phản ứng:
H3PO4 + 3NaOH → Na3PO4 + 2H2O
Đổi 14,76 mL = 0,01476 L
Số mol của NaOH là nNaoH = 0,01476 × 0,108 = 0,00159408 mol
Từ phương trình hóa học số mol của H3PO4 là 0,00053136 mol
Số mol Của H3PO4 ban đầu là nH3PO4 =0,00053136 × 100/5 = 0,0106272 mol
Bảo toàn nguyên tố P: nP = nH3PO4 = 0,0106272 mol Hiệu suất (làm tròn đến hàng đơn vị) của quá trình điều chế H3PO4 trong thí nghiệm trên là
H = 0,0106272 × 31 × 100%/ 0,5258 ≈ 94%
✔️(c). Đúng. Phospho đỏ bị ẩm làm tăng khối lượng ban đầu do có lẫn nước. Nước không tham gia phản ứng, nên làm sai lệch kết quả tính toán. Do đó, hiệu suất tính được nhỏ hơn hiệu suất thực tế.
❌(d). Sai. Ở bước 2, nếu thay HNO3 đặc bằng H2SO4 đặc thì sẽ thu được H3PO4 sẽ lẫn nhiều tạp chất hơn.
Câu 20 [834377]: Tính oxi hoá giữa các halogen Cl2, Br2, I2 có thể được so sánh thông qua phản ứng thế halogen trong dung dịch muối:
X2 + 2NaY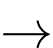 2NaX + Y2.
2NaX + Y2.
Một mô hình thí nghiệm lượng nhỏ được thiết kế như sau nhằm đưa ra kết luận về tính oxi hoá giữa các halogen:
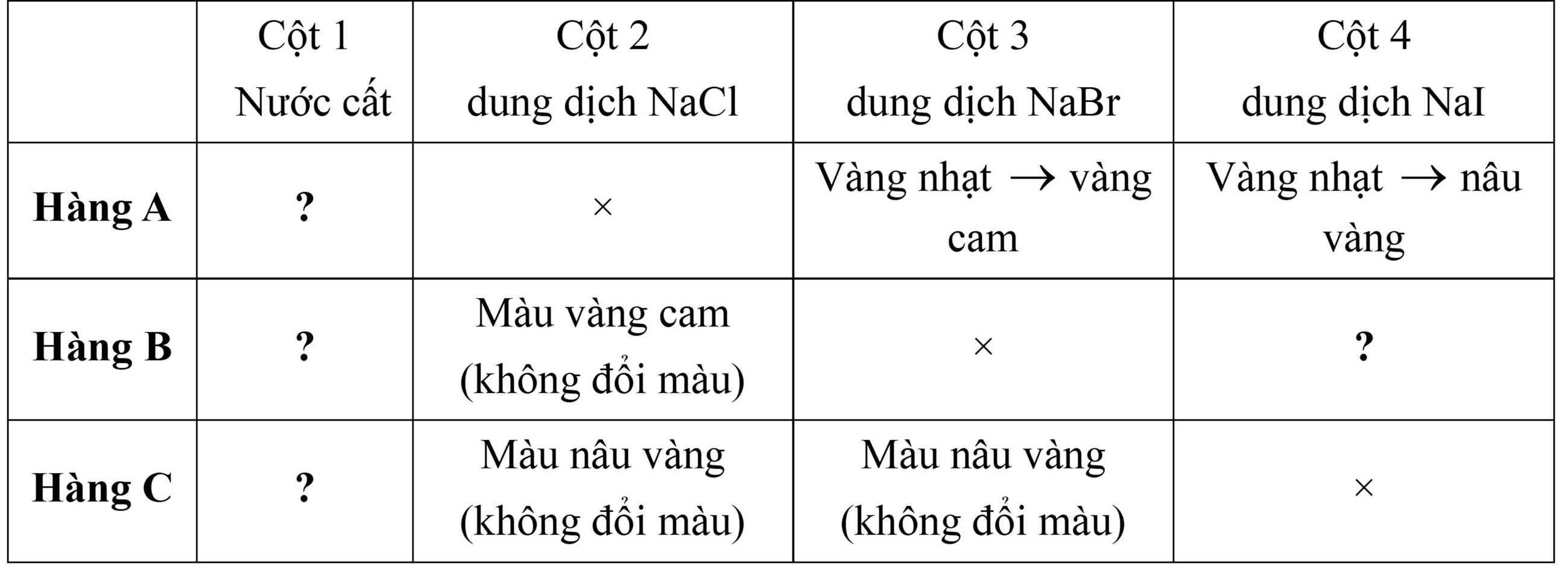
Dụng cụ, hoá chất: Một khay với 12 giếng đựng; các dung dịch muối NaCl 0,10 M, NaBr 0,10 M, NaI 0,10 M; nước chlorine, nước bromine 0,10 M, dung dịch iodine 0,10 M; nước cất.
Cách tiến hành:
▪ Bước 1: Cho 2 giọt nước chlorine, nước bromine và dung dịch iodine vào lần lượt vào các giếng ở hàng A, B, C.
▪ Bước 2: Cho 2 giọt nước cất, dung dịch NaCl, dung dịch NaBr, dung dịch NaI lần lượt vào các giếng ở các cột 1, 2, 3, 4.
Kết quả thí nghiệm:
X2 + 2NaY
 2NaX + Y2.
2NaX + Y2.Một mô hình thí nghiệm lượng nhỏ được thiết kế như sau nhằm đưa ra kết luận về tính oxi hoá giữa các halogen:
Dụng cụ, hoá chất: Một khay với 12 giếng đựng; các dung dịch muối NaCl 0,10 M, NaBr 0,10 M, NaI 0,10 M; nước chlorine, nước bromine 0,10 M, dung dịch iodine 0,10 M; nước cất.

Cách tiến hành:
▪ Bước 1: Cho 2 giọt nước chlorine, nước bromine và dung dịch iodine vào lần lượt vào các giếng ở hàng A, B, C.
▪ Bước 2: Cho 2 giọt nước cất, dung dịch NaCl, dung dịch NaBr, dung dịch NaI lần lượt vào các giếng ở các cột 1, 2, 3, 4.
Kết quả thí nghiệm:

Phân tích các phát biểu:
❌(a). Sai. Cl2 tan trong nước tạo dung dịch có màu vàng lục nhạt do một phần Cl2 phản ứng với nước tạo HCl và HClO.
✔️(b). Đúng. Cột 4 đã xảy ra phản ứng: Br2 + 2NaI → 2NaBr + I2 và có phản ứng Cl2 + 2NaI → 2NaCl + I2
✔️(c). Đúng. Có 5 vị trí trong giếng đựng đã xảy ra phản ứng oxi hóa khử, phản ứng của Cl2 và Br2 với nước; phản ứng của Cl2 với NaI và NaBr; phản ứng của Br2 với NaI.
✔️(d). Đúng. Việc sử dụng nước cất ở cột 1 làm đối chứng là rất quan trọng trong thí nghiệm, nhằm so sánh sự thay đổi màu sắc với các cột có chứa hóa chất khác.
❌(a). Sai. Cl2 tan trong nước tạo dung dịch có màu vàng lục nhạt do một phần Cl2 phản ứng với nước tạo HCl và HClO.
✔️(b). Đúng. Cột 4 đã xảy ra phản ứng: Br2 + 2NaI → 2NaBr + I2 và có phản ứng Cl2 + 2NaI → 2NaCl + I2
✔️(c). Đúng. Có 5 vị trí trong giếng đựng đã xảy ra phản ứng oxi hóa khử, phản ứng của Cl2 và Br2 với nước; phản ứng của Cl2 với NaI và NaBr; phản ứng của Br2 với NaI.
✔️(d). Đúng. Việc sử dụng nước cất ở cột 1 làm đối chứng là rất quan trọng trong thí nghiệm, nhằm so sánh sự thay đổi màu sắc với các cột có chứa hóa chất khác.