Câu 1 [829890]: Đun nóng hỗn hợp gồm ethyl alcohol, acetic acid và sulfuric acid đặc ở điều kiện thích hợp để tổng hợp ra ester E. Sau một thời gian phản ứng thì thu được hỗn hợp X. Tiến hành tách được chất E từ X. Cho các thông số tính chất vật lý sau:


CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
Phân tích các đáp án:
❌A. Sai, vì phản ứng ester hóa là phản ứng thuận nghịch, không phải một chiều.
✔️B. Đúng. Nhiệt độ sôi của ester ethyl acetate (CH3COOC2H5) là 77°C, thấp hơn so với các chất còn lại (nước: 100°C, ethanol: 78°C, acid acetic: 118°C), nên có thể tách ester ra bằng chưng cất phân đoạn.Chiết không phù hợp vì ester tan ít trong nước (2g/100g nước), nhưng không tạo hai lớp rõ ràng như trong chiết.
✔️C. Đúng. Ester có nhóm chức:
Nhóm C=O (carbonyl) ~ 1735 cm-1
Nhóm C–O ~ 1000–1300 cm-1
✔️D. Đúng, trong phản ứng tạo ester:
Nhóm OH từ acid (CH3COOH)
H từ nhóm OH của alcohol (C2H5OH) → tạo ra nước (H2O)
Phân tích các đáp án:
❌A. Sai, vì phản ứng ester hóa là phản ứng thuận nghịch, không phải một chiều.
✔️B. Đúng. Nhiệt độ sôi của ester ethyl acetate (CH3COOC2H5) là 77°C, thấp hơn so với các chất còn lại (nước: 100°C, ethanol: 78°C, acid acetic: 118°C), nên có thể tách ester ra bằng chưng cất phân đoạn.Chiết không phù hợp vì ester tan ít trong nước (2g/100g nước), nhưng không tạo hai lớp rõ ràng như trong chiết.
✔️C. Đúng. Ester có nhóm chức:
Nhóm C=O (carbonyl) ~ 1735 cm-1
Nhóm C–O ~ 1000–1300 cm-1
✔️D. Đúng, trong phản ứng tạo ester:
Nhóm OH từ acid (CH3COOH)
H từ nhóm OH của alcohol (C2H5OH) → tạo ra nước (H2O)
Câu 2 [829891]: Phản ứng thủy phân ester trong môi trường kiềm được biểu diễn như sau:
R–COO–R’ + NaOH RCOONa + R’OH
RCOONa + R’OH
Một nhóm học sinh dự đoán “nồng độ NaOH càng lớn thì tốc độ phản ứng thủy phân càng lớn”. Từ đó, học sinh tiến hành thí nghiệm ở nhiệt độ không đổi (60 oC) nhưng thay đổi nồng độ NaOH để kiểm tra dự đoán trên như sau:
▪ Bước 1: Thêm 4 mL ethyl acetate (d = 0,9 g/mL) vào một ống nghiệm chứa 20 mL dung dịch NaOH nồng độ C (M). Các giá trị nồng độ này không giống nhau giữa các thí nghiệm.
▪ Bước 2: Ngâm ống nghiệm trong nồi nước nóng (nhiệt độ nước khoảng 60°C) và đo thời gian cho đến khi phần chất lỏng trong ống nghiệm trở lên đồng nhất.
Kết quả thí nghiệm được cho ở bảng sau:

R–COO–R’ + NaOH
 RCOONa + R’OH
RCOONa + R’OHMột nhóm học sinh dự đoán “nồng độ NaOH càng lớn thì tốc độ phản ứng thủy phân càng lớn”. Từ đó, học sinh tiến hành thí nghiệm ở nhiệt độ không đổi (60 oC) nhưng thay đổi nồng độ NaOH để kiểm tra dự đoán trên như sau:
▪ Bước 1: Thêm 4 mL ethyl acetate (d = 0,9 g/mL) vào một ống nghiệm chứa 20 mL dung dịch NaOH nồng độ C (M). Các giá trị nồng độ này không giống nhau giữa các thí nghiệm.
▪ Bước 2: Ngâm ống nghiệm trong nồi nước nóng (nhiệt độ nước khoảng 60°C) và đo thời gian cho đến khi phần chất lỏng trong ống nghiệm trở lên đồng nhất.
Kết quả thí nghiệm được cho ở bảng sau:

CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Khi nồng độ NaOH cao, thời gian để thu được dung dịch đồng nhất ngắn hơn → phản ứng nhanh hơn.
Dung dịch trở nên đồng nhất tức là phản ứng hoàn tất (ester tan ít trong nước, nhưng sản phẩm thu được lại tan tốt, nên dung dịch trở thành một pha đồng nhất).
Phân tích các đáp án:
✔️A. Đúng, vì ethyl acetate ít tan trong nước (chỉ 2g/100g nước), nên khi thêm vào dung dịch NaOH (nước) sẽ tạo hai lớp chất lỏng.
✔️B. Đúng, vì phản ứng cần nhiệt độ để xảy ra nhanh hơn. Bước 2 là bước ngâm ống nghiệm vào nước nóng (60°C) để phản ứng thuỷ phân xảy ra.
✔️C. Đúng, vì khi phản ứng hoàn tất, ethyl acetate bị phân huỷ hoàn toàn thành muối và rượu, hai chất này đều tan tốt trong nước → dung dịch trở nên đồng nhất (1 lớp).
❌D. Sai. Nồng độ NaOH tăng → thời gian phản ứng (trở nên đồng nhất) giảm.
Khi nồng độ NaOH cao, thời gian để thu được dung dịch đồng nhất ngắn hơn → phản ứng nhanh hơn.
Dung dịch trở nên đồng nhất tức là phản ứng hoàn tất (ester tan ít trong nước, nhưng sản phẩm thu được lại tan tốt, nên dung dịch trở thành một pha đồng nhất).
Phân tích các đáp án:
✔️A. Đúng, vì ethyl acetate ít tan trong nước (chỉ 2g/100g nước), nên khi thêm vào dung dịch NaOH (nước) sẽ tạo hai lớp chất lỏng.
✔️B. Đúng, vì phản ứng cần nhiệt độ để xảy ra nhanh hơn. Bước 2 là bước ngâm ống nghiệm vào nước nóng (60°C) để phản ứng thuỷ phân xảy ra.
✔️C. Đúng, vì khi phản ứng hoàn tất, ethyl acetate bị phân huỷ hoàn toàn thành muối và rượu, hai chất này đều tan tốt trong nước → dung dịch trở nên đồng nhất (1 lớp).
❌D. Sai. Nồng độ NaOH tăng → thời gian phản ứng (trở nên đồng nhất) giảm.
Câu 3 [829902]: Tiến hành thí nghiệm của glucose với thuốc thử Tollens theo các bước sau:
▪ Bước 1: Cho 2 mL dung dịch AgNO3 1% vào ống nghiệm sạch.
▪ Bước 2: Thêm từ từ từng giọt dung dịch ammonia 5%, lắc đều cho đến khi kết tủa tan hết.
▪ Bước 3: Thêm tiếp khoảng 2 mL dung dịch glucose 2% vào ống nghiệm, lắc đều. Sau đó, ngâm ống nghiệm vào cốc thủy tinh chứa nước nóng trong vài phút.
Để sản xuất một số lượng gương soi người ta đun nóng dung dịch chứa 39,6 gam glucose với một lượng dư dung dịch AgNO3 trong ammonia. Biết khối lượng riêng của silver là 10,49 g/cm3; hiệu suất phản ứng tráng gương là 75% và mỗi chiếc gương có diện tích bề mặt 0,35 m2 với độ dày 0,1 µm.
▪ Bước 1: Cho 2 mL dung dịch AgNO3 1% vào ống nghiệm sạch.
▪ Bước 2: Thêm từ từ từng giọt dung dịch ammonia 5%, lắc đều cho đến khi kết tủa tan hết.
▪ Bước 3: Thêm tiếp khoảng 2 mL dung dịch glucose 2% vào ống nghiệm, lắc đều. Sau đó, ngâm ống nghiệm vào cốc thủy tinh chứa nước nóng trong vài phút.
Để sản xuất một số lượng gương soi người ta đun nóng dung dịch chứa 39,6 gam glucose với một lượng dư dung dịch AgNO3 trong ammonia. Biết khối lượng riêng của silver là 10,49 g/cm3; hiệu suất phản ứng tráng gương là 75% và mỗi chiếc gương có diện tích bề mặt 0,35 m2 với độ dày 0,1 µm.
Glucose là một aldose (có nhóm -CHO), nên có thể phản ứng với thuốc thử Tollens:
R-CHO- +2[Ag(NH3)2]++3OH- + ⟶ R-COO-+ 2Ag++ 4NH3 + 2H2O
→ Glucose khử ion bạc Ag thành bạc kim loại Ag (tráng lên thành ống nghiệm).
Phân tích các đáp án:
❌A. Sai, vì phản ứng Tollens chứng minh glucose có nhóm aldehyde (CHO), không liên quan gì đến tính polyalcohol (nhiều nhóm OH). Tính polyalcohol được kiểm chứng qua phản ứng tạo este hay tạo phức, không phải phản ứng Tollens.
✔️B. Đúng, vì khi glucose phản ứng với AgNO3 trong môi trường kiềm và amoniac, nhóm -CHO bị oxi hoá thành -COO⁻, tạo muối gluconate với ion NH4+ → ammonium gluconate.
❌C. Sai, vì sau bước 2 chỉ mới tạo thành phức Tollens, chưa có glucose nên chưa có phản ứng khử → chưa có bạc bám.
❌D. Sai.Ta có:
n glucose = 39,6 : 180 = 0,22 mol
nAg = 2n glucose= 0,22 . 2 = 0,44 mol
m Ag = n glucose . M. 75% = 35,64 g
m gương = V.D = 3500.10-5 . 10,49 = 0,367 g
Số gương = 35,64 : 0,367 = 97 > 95
R-CHO- +2[Ag(NH3)2]++3OH- + ⟶ R-COO-+ 2Ag++ 4NH3 + 2H2O
→ Glucose khử ion bạc Ag thành bạc kim loại Ag (tráng lên thành ống nghiệm).
Phân tích các đáp án:
❌A. Sai, vì phản ứng Tollens chứng minh glucose có nhóm aldehyde (CHO), không liên quan gì đến tính polyalcohol (nhiều nhóm OH). Tính polyalcohol được kiểm chứng qua phản ứng tạo este hay tạo phức, không phải phản ứng Tollens.
✔️B. Đúng, vì khi glucose phản ứng với AgNO3 trong môi trường kiềm và amoniac, nhóm -CHO bị oxi hoá thành -COO⁻, tạo muối gluconate với ion NH4+ → ammonium gluconate.
❌C. Sai, vì sau bước 2 chỉ mới tạo thành phức Tollens, chưa có glucose nên chưa có phản ứng khử → chưa có bạc bám.
❌D. Sai.Ta có:
n glucose = 39,6 : 180 = 0,22 mol
nAg = 2n glucose= 0,22 . 2 = 0,44 mol
m Ag = n glucose . M. 75% = 35,64 g
m gương = V.D = 3500.10-5 . 10,49 = 0,367 g
Số gương = 35,64 : 0,367 = 97 > 95
Câu 4 [704034]: Saccharose có phản ứng với copper(II) hydroxide tương tự như glucose, thí nghiệm được tiến hành như sau:
▪ Bước 1: Cho vào ống nghiệm khoảng 0,5 mL dung dịch NaOH 10 % và khoảng 0,5 mL dung dịch CuSO4 5 %, lắc đều.
▪ Bước 2: Thêm tiếp vào ống nghiệm khoảng 4 mL dung dịch saccharose 3 %, lắc đều ống nghiệm đến khi thu được dung dịch đồng nhất (nếu còn chất rắn thì thêm tiếp dung dịch saccharose).
▪ Bước 3: Đun nóng dung dịch trong ống nghiệm.
▪ Bước 1: Cho vào ống nghiệm khoảng 0,5 mL dung dịch NaOH 10 % và khoảng 0,5 mL dung dịch CuSO4 5 %, lắc đều.
▪ Bước 2: Thêm tiếp vào ống nghiệm khoảng 4 mL dung dịch saccharose 3 %, lắc đều ống nghiệm đến khi thu được dung dịch đồng nhất (nếu còn chất rắn thì thêm tiếp dung dịch saccharose).
▪ Bước 3: Đun nóng dung dịch trong ống nghiệm.
Phân tích các phát biểu:
✔️ a. Đúng. Mục đích của bước 1 là hình thành kết tủa nên có thể bỏ qua bước 1 và thêm trực tiếp dung dịch saccharose vào kết tủa Cu(OH)2.
✔️ b. Đúng. Tại bước 2 đã có phản ứng của dung dịch saccharose với Cu(OH)2:
2C12H22O11 + Cu(OH)2 ⟶ [Cu(C12H21O11)2] + 2H2O
✔️ c. Đúng. Saccharose có phản ứng với Cu(OH)2 chứng tỏ phân tử saccharose có ít nhất 2 nhóm OH liền kề.
❌ d. Sai. Phân tử saccharose không có khả năng mở vòng → không có nhóm chức aldehyde nên không phản ứng Cu(OH)2/OH- để tạo được Cu2O.
✔️ a. Đúng. Mục đích của bước 1 là hình thành kết tủa nên có thể bỏ qua bước 1 và thêm trực tiếp dung dịch saccharose vào kết tủa Cu(OH)2.
✔️ b. Đúng. Tại bước 2 đã có phản ứng của dung dịch saccharose với Cu(OH)2:
2C12H22O11 + Cu(OH)2 ⟶ [Cu(C12H21O11)2] + 2H2O
✔️ c. Đúng. Saccharose có phản ứng với Cu(OH)2 chứng tỏ phân tử saccharose có ít nhất 2 nhóm OH liền kề.
❌ d. Sai. Phân tử saccharose không có khả năng mở vòng → không có nhóm chức aldehyde nên không phản ứng Cu(OH)2/OH- để tạo được Cu2O.
Câu 5 [829895]: Tiến hành thí nghiệm theo các bước sau:
▪ Bước 1: Cho 2 mL dung dịch NaOH 10% vào ống nghiệm. Sau đó, thêm 0,5 mL dung dịch CuSO4 5% vào, lắc nhẹ.
▪ Bước 2: Cho 3 mL dung dịch saccharose 5% vào ống nghiệm, lắc đều.
▪ Bước 1: Cho 2 mL dung dịch NaOH 10% vào ống nghiệm. Sau đó, thêm 0,5 mL dung dịch CuSO4 5% vào, lắc nhẹ.
▪ Bước 2: Cho 3 mL dung dịch saccharose 5% vào ống nghiệm, lắc đều.
Phân tích các đáp án:
✔️A. CuSO4 và NaOH tạo Cu(OH)2 (kết tủa xanh lam), sau đó thêm saccharose → phức đồng-saccharose tan → dung dịch xanh lam.
✔️B. Maltose là đường khử (có nhóm hemiacetal) → phản ứng với Cu(OH)2 tương tự, tạo dung dịch xanh lam và khi đun sẽ có kết tủa Cu2O .
❌C. Saccharose là disaccharide không khử, do cả hai nhóm hemiacetal của glucose và fructose đều bị liên kết → không phản ứng với thuốc thử Fehling, không chứng minh tính aldehyde.
❌D. Vì saccharose không phải là đường khử, nên khi đun không xảy ra phản ứng khử Cu(OH)2 thành Cu2O → không có kết tủa đỏ gạch.
✔️A. CuSO4 và NaOH tạo Cu(OH)2 (kết tủa xanh lam), sau đó thêm saccharose → phức đồng-saccharose tan → dung dịch xanh lam.
✔️B. Maltose là đường khử (có nhóm hemiacetal) → phản ứng với Cu(OH)2 tương tự, tạo dung dịch xanh lam và khi đun sẽ có kết tủa Cu2O .
❌C. Saccharose là disaccharide không khử, do cả hai nhóm hemiacetal của glucose và fructose đều bị liên kết → không phản ứng với thuốc thử Fehling, không chứng minh tính aldehyde.
❌D. Vì saccharose không phải là đường khử, nên khi đun không xảy ra phản ứng khử Cu(OH)2 thành Cu2O → không có kết tủa đỏ gạch.
Câu 6 [829898]: Saccharose octaacetate có công thức C28H38O19 hay (C2H3O2)8C12H14O3, là ester của acetic acid với saccharose. Saccharose octaacetate được dùng làm chất nhũ hoá, chất kháng nấm trong các chế phẩm thuộc lĩnh vực dược phẩm, mĩ phẩm. Cơ quan Quản lí Thực phẩm và Dược phẩm Mỹ (FDA) cho phép sử dụng saccharose octaacetate làm chất phụ gia thực phẩm, chất chống cắn móng tay và mút ngón tay ở trẻ do tính chất rất đắng của nó. Để tổng hợp saccharose octaacetate theo phương pháp “Hoá học xanh” (green chemistry), người ta tiến hành ester hoá saccharose, cho 10 gam saccharose phản ứng với 30 mL acetic anhydride (D = 1,08 g/mL) thì thu được khối lượng saccharose octaacetate là 14,9 gam.
Phân tích các đáp án:
❌A. Saccharose Octaacetate: C28H38O19
→ M = 12.28 + 38 + 16.19 = 678
❌B. n sac = 10 : 432 mol
m = D×V = 1,08×30 = 32,4 g
mmax = 0,02924×678 ≈ 19,82 g
H = 14,9 : 19,82 = 75,2 %
❌C. "Octaacetate" nghĩa là có 8 nhóm acetate → tương đương 8 nhóm chức ester
✔️D. “FDA cho phép sử dụng saccharose octaacetate làm chất phụ gia thực phẩm, dược phẩm, mỹ phẩm…” do an toàn, không độc
❌A. Saccharose Octaacetate: C28H38O19
→ M = 12.28 + 38 + 16.19 = 678
❌B. n sac = 10 : 432 mol
m = D×V = 1,08×30 = 32,4 g
mmax = 0,02924×678 ≈ 19,82 g
H = 14,9 : 19,82 = 75,2 %
❌C. "Octaacetate" nghĩa là có 8 nhóm acetate → tương đương 8 nhóm chức ester
✔️D. “FDA cho phép sử dụng saccharose octaacetate làm chất phụ gia thực phẩm, dược phẩm, mỹ phẩm…” do an toàn, không độc
Câu 7 [705449]: Tiến hành thí nghiệm hòa tan cellulose trong nước Schweizer theo bước sau:
∎ Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
∎ Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20 % vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
∎ Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
∎ Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
∎ Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20 % vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
∎ Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
CuSO4 + 2NaOH ⟶ Cu(OH)2 + Na2SO4
Cu2+ + 2OH– ⟶ Cu(OH)2
Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20% vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
Cu(OH)2 + 4NH3 ⟶ [Cu(NH3)4](OH)2
Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể thay muối CuSO4.5H2O bằng muối Cu(NO3)2.6H2O vì chỉ cần tạo ra Cu(OH)2 nên khi đổi muối thì phương trình ion vẫn không đổi.
Cu2+ + 2OH– ⟶ Cu(OH)2
✔️ b) Đúng. Bước 2 kết tủa tan hình thành phức chất [Cu(NH3)4](OH)2.
❌ c) Sai. Cellulose không bị thủy phân, chỉ bị thủy phân trong môi trường acid hoặc enzyme.
✔️ d) Đúng. Bước 3 chứng minh celllulose có khả năng tan trong nước Schweizer.
CuSO4 + 2NaOH ⟶ Cu(OH)2 + Na2SO4
Cu2+ + 2OH– ⟶ Cu(OH)2
Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20% vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
Cu(OH)2 + 4NH3 ⟶ [Cu(NH3)4](OH)2
Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể thay muối CuSO4.5H2O bằng muối Cu(NO3)2.6H2O vì chỉ cần tạo ra Cu(OH)2 nên khi đổi muối thì phương trình ion vẫn không đổi.
Cu2+ + 2OH– ⟶ Cu(OH)2
✔️ b) Đúng. Bước 2 kết tủa tan hình thành phức chất [Cu(NH3)4](OH)2.
❌ c) Sai. Cellulose không bị thủy phân, chỉ bị thủy phân trong môi trường acid hoặc enzyme.
✔️ d) Đúng. Bước 3 chứng minh celllulose có khả năng tan trong nước Schweizer.
Câu 8 [705715]: Quá trình nấu rượu gạo thủ công được thực hiện như sau:
➊ Gạo được nấu chín, để nguội, rắc men, ủ kín 3-5 ngày, thu được một hỗn hợp gồm nước, ethanol và bã rượu.
➋ Đun nóng hỗn hợp trên đến nhiệt độ sôi, hơi bay ra đi vào đường ống dẫn. Hỗn hợp hơi trong đường ống được làm lạnh sẽ hoá lỏng và chảy vào bình hứng.
Quá trình này gọi là chưng cất rượu. Biết nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC.
➊ Gạo được nấu chín, để nguội, rắc men, ủ kín 3-5 ngày, thu được một hỗn hợp gồm nước, ethanol và bã rượu.
➋ Đun nóng hỗn hợp trên đến nhiệt độ sôi, hơi bay ra đi vào đường ống dẫn. Hỗn hợp hơi trong đường ống được làm lạnh sẽ hoá lỏng và chảy vào bình hứng.
Quá trình này gọi là chưng cất rượu. Biết nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC.
Phân tích các phát biểu:
✔️ (a) Đúng. Ở giai đoạn đầu xảy ra sự chuyển hoá tinh bột thành ethanol.
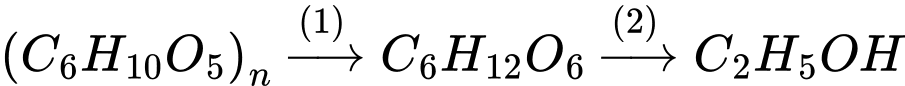
(b) Sai. Nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC nên để chưng cất rượu cần nhiệt độ trong khoảng từ 78 oC đến 100 oC, nếu nhiệt độ lớn hơn 100 oC thì quá trình chưng cất sẽ kèm theo hơi nước không thu được rượu nguyên chất.
✔️ (c) Đúng. Trong quá trình chưng cất, hơi ethanol và hơi nước bay ra theo đường ống. Khi đi qua thùng nước lạnh (bình ngưng tụ), hơi bị làm lạnh và ngưng tụ thành chất lỏng chảy vào bình hứng. Vì vậy, thùng nước lạnh có vai trò chuyển pha từ hơi sang pha lỏng. .
✔️ (d) Đúng. Ban đầu, hỗn hợp chứa nhiều ethanol hơn nước do ethanol bay hơi ở nhiệt độ thấp hơn. Khi chưng cất, ethanol dần thoát ra trước, làm tỉ lệ ethanol/nước trong phần còn lại giảm dần. Sau một thời gian, khi phần ethanol đã gần hết, phần còn lại chủ yếu là nước, và tỉ lệ này không đổi nữa.
✔️ (a) Đúng. Ở giai đoạn đầu xảy ra sự chuyển hoá tinh bột thành ethanol.
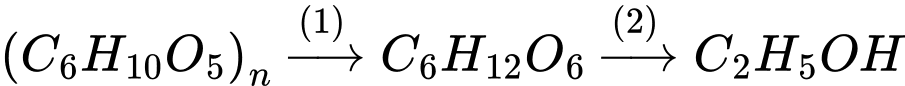
(b) Sai. Nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC nên để chưng cất rượu cần nhiệt độ trong khoảng từ 78 oC đến 100 oC, nếu nhiệt độ lớn hơn 100 oC thì quá trình chưng cất sẽ kèm theo hơi nước không thu được rượu nguyên chất.
✔️ (c) Đúng. Trong quá trình chưng cất, hơi ethanol và hơi nước bay ra theo đường ống. Khi đi qua thùng nước lạnh (bình ngưng tụ), hơi bị làm lạnh và ngưng tụ thành chất lỏng chảy vào bình hứng. Vì vậy, thùng nước lạnh có vai trò chuyển pha từ hơi sang pha lỏng. .
✔️ (d) Đúng. Ban đầu, hỗn hợp chứa nhiều ethanol hơn nước do ethanol bay hơi ở nhiệt độ thấp hơn. Khi chưng cất, ethanol dần thoát ra trước, làm tỉ lệ ethanol/nước trong phần còn lại giảm dần. Sau một thời gian, khi phần ethanol đã gần hết, phần còn lại chủ yếu là nước, và tỉ lệ này không đổi nữa.
Câu 9 [829901]: Một học sinh thực hiện phản ứng giữa cellulose và nitric acid theo các bước sau:
▪ Cho khoảng 5 mL dung dịch HNO3 đặc vào cốc thủy tinh (loại 100 mL) ngâm trong chậu nước đá. Thêm từ từ khoảng 10 mL dung dịch H2SO4 vào cốc và khuấy đều. Sau đó, lấy cốc thủy tinh ra khỏi chậu nước đá, thêm một nhúm bông vào cốc và dùng đũa thủy tinh ấn bông ngập trong dung dịch.
▪ Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
▪ Ép sản phẩm giữa hai miếng giấy lọc để hút nước và làm khô tự nhiên. Sau đó, để sản phẩm lên đĩa sứ rồi đốt cháy sản phẩm.
▪ Cho khoảng 5 mL dung dịch HNO3 đặc vào cốc thủy tinh (loại 100 mL) ngâm trong chậu nước đá. Thêm từ từ khoảng 10 mL dung dịch H2SO4 vào cốc và khuấy đều. Sau đó, lấy cốc thủy tinh ra khỏi chậu nước đá, thêm một nhúm bông vào cốc và dùng đũa thủy tinh ấn bông ngập trong dung dịch.
▪ Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
▪ Ép sản phẩm giữa hai miếng giấy lọc để hút nước và làm khô tự nhiên. Sau đó, để sản phẩm lên đĩa sứ rồi đốt cháy sản phẩm.
Phản ứng giữa cellulose và hỗn hợp HNO3 + H2SO4 tạo ra cellulose trinitrate (thuộc loại ester nitrat).
Sau phản ứng, sản phẩm được rửa bằng nước lạnh và NaHCO3 loãng để trung hòa acid.
Sản phẩm dễ cháy, được kiểm tra bằng cách đốt.
Phân tích các đáp án:
✔️A. Rửa với nước lạnh để loại bỏ acid dư.
Dùng NaHCO3 để trung hòa acid còn sót lại. → Giúp loại bỏ hoàn toàn các tạp chất acid như H2SO4, HNO3 còn dư trong sản phẩm.
✔️B. Cellulose có cấu trúc gồm các đơn vị glucose lặp lại với nhiều nhóm –OH.
Trong phản ứng với HNO3 (có mặt H2SO4), các nhóm –OH bị ester hóa thành –ONO2.
Nếu ba nhóm –OH trên mỗi đơn vị glucose bị ester hóa → ta thu được cellulose trinitrate
❌C. Tinh bột và cellulose đều là polysaccharide, nhưng có cấu trúc khác nhau:
Cellulose: liên kết β(1→4) → tạo cấu trúc mạch thẳng, bền hơn, dễ tạo sản phẩm nổ như cellulose trinitrate.
Tinh bột: liên kết α(1→4), cấu trúc cuộn xoắn, phản ứng không giống cellulose. → Sản phẩm và tính chất không giống nhau, không thể thay thế hoàn toàn.
✔️D. Đây là phản ứng ester hóa đặc biệt tạo ra ester nitrate (khác với ester carboxylic thông thường).
Sau phản ứng, sản phẩm được rửa bằng nước lạnh và NaHCO3 loãng để trung hòa acid.
Sản phẩm dễ cháy, được kiểm tra bằng cách đốt.
Phân tích các đáp án:
✔️A. Rửa với nước lạnh để loại bỏ acid dư.
Dùng NaHCO3 để trung hòa acid còn sót lại. → Giúp loại bỏ hoàn toàn các tạp chất acid như H2SO4, HNO3 còn dư trong sản phẩm.
✔️B. Cellulose có cấu trúc gồm các đơn vị glucose lặp lại với nhiều nhóm –OH.
Trong phản ứng với HNO3 (có mặt H2SO4), các nhóm –OH bị ester hóa thành –ONO2.
Nếu ba nhóm –OH trên mỗi đơn vị glucose bị ester hóa → ta thu được cellulose trinitrate
❌C. Tinh bột và cellulose đều là polysaccharide, nhưng có cấu trúc khác nhau:
Cellulose: liên kết β(1→4) → tạo cấu trúc mạch thẳng, bền hơn, dễ tạo sản phẩm nổ như cellulose trinitrate.
Tinh bột: liên kết α(1→4), cấu trúc cuộn xoắn, phản ứng không giống cellulose. → Sản phẩm và tính chất không giống nhau, không thể thay thế hoàn toàn.
✔️D. Đây là phản ứng ester hóa đặc biệt tạo ra ester nitrate (khác với ester carboxylic thông thường).
Câu 10 [829913]: Cho sơ đồ phản ứng sau, các chất phản ứng theo đúng tỉ lệ mol:
(1) X + H2O Y
Y
(2) 2Y + Cu(OH)2 T + 2H2O
T + 2H2O
(3) X + 3nHNO3 (xt H2SO4 đặc) Z + 3nH2O
Z + 3nH2O
(4) Y 2Q
2Q
Biết rằng các chất X, Y, T, Q đều chứa nhóm –OH, chất Z có tính nổ mạnh, nhạy với va đập, ma sát và nhiệt.
(1) X + H2O
 Y
Y (2) 2Y + Cu(OH)2
 T + 2H2O
T + 2H2O (3) X + 3nHNO3 (xt H2SO4 đặc)
 Z + 3nH2O
Z + 3nH2O (4) Y
 2Q
2Q Biết rằng các chất X, Y, T, Q đều chứa nhóm –OH, chất Z có tính nổ mạnh, nhạy với va đập, ma sát và nhiệt.
(1) X + H2O→(enzyme) Y
→ Đây là quá trình thủy phân bằng enzyme. → Vì X là chất bị thủy phân, có thể là polymer tự nhiên chứa nhóm –OH, ví dụ cellulose, tinh bột - Y là monosaccharide như glucose.
(2) 2Y + Cu(OH)2→T + 2H2O
- Đây là phản ứng tráng gương hoặc phản ứng của hợp chất chứa nhiều nhóm –OH với Cu(OH)2. → Nếu tạo phức xanh lam → chứng tỏ Y là polyancol như glucose (chứa nhiều nhóm -OH kề nhau).
(3) X + 3HNO3 (H2SO4 đ) → Z + 3H2O
→ X phản ứng với HNO3 đặc có H2SO4 đặc - tạo ra Z và nước. - Đây là phản ứng nitrate hóa → Z là một chất dễ nổ như cellulose trinitrate.
(4) Y (enzyme) 2Q
→ Y tiếp tục bị thủy phân thành Q → Y là disaccharide hoặc polysaccharide nhỏ. → Q có thể là monomer chứa –OH, khả năng tham gia trùng ngưng.
X: polymer tự nhiên (cellulose hoặc tinh bột).
Y: glucose (có thể là sản phẩm thủy phân của cellulose/tinh bột).
T: phức màu xanh lam.
Z: cellulose trinitrate (tính nổ).
Q: có thể là đơn vị glucose.
Phân tích các đáp án:
✔️A. Dựa vào phản ứng (1) và (3), X chính là cellulose hoặc tinh bột – đều là polymer tự nhiên.
✔️B. Q là sản phẩm thủy phân từ Y (có nhiều nhóm –OH) → có thể tham gia phản ứng trùng ngưng (với acid hoặc isocyanate...).
✔️C. Thủy phân cellulose hoặc tinh bột không chỉ bằng enzyme mà còn bằng acid mạnh (H2SO4 loãng, nóng) → cũng tạo glucose.
✔️D. Glucose có nhiều nhóm –OH kề nhau → tác dụng với Cu(OH)2 tạo phức màu xanh lam → là tính chất của polyalcohol.
→ Đây là quá trình thủy phân bằng enzyme. → Vì X là chất bị thủy phân, có thể là polymer tự nhiên chứa nhóm –OH, ví dụ cellulose, tinh bột - Y là monosaccharide như glucose.
(2) 2Y + Cu(OH)2→T + 2H2O
- Đây là phản ứng tráng gương hoặc phản ứng của hợp chất chứa nhiều nhóm –OH với Cu(OH)2. → Nếu tạo phức xanh lam → chứng tỏ Y là polyancol như glucose (chứa nhiều nhóm -OH kề nhau).
(3) X + 3HNO3 (H2SO4 đ) → Z + 3H2O
→ X phản ứng với HNO3 đặc có H2SO4 đặc - tạo ra Z và nước. - Đây là phản ứng nitrate hóa → Z là một chất dễ nổ như cellulose trinitrate.
(4) Y (enzyme) 2Q
→ Y tiếp tục bị thủy phân thành Q → Y là disaccharide hoặc polysaccharide nhỏ. → Q có thể là monomer chứa –OH, khả năng tham gia trùng ngưng.
X: polymer tự nhiên (cellulose hoặc tinh bột).
Y: glucose (có thể là sản phẩm thủy phân của cellulose/tinh bột).
T: phức màu xanh lam.
Z: cellulose trinitrate (tính nổ).
Q: có thể là đơn vị glucose.
Phân tích các đáp án:
✔️A. Dựa vào phản ứng (1) và (3), X chính là cellulose hoặc tinh bột – đều là polymer tự nhiên.
✔️B. Q là sản phẩm thủy phân từ Y (có nhiều nhóm –OH) → có thể tham gia phản ứng trùng ngưng (với acid hoặc isocyanate...).
✔️C. Thủy phân cellulose hoặc tinh bột không chỉ bằng enzyme mà còn bằng acid mạnh (H2SO4 loãng, nóng) → cũng tạo glucose.
✔️D. Glucose có nhiều nhóm –OH kề nhau → tác dụng với Cu(OH)2 tạo phức màu xanh lam → là tính chất của polyalcohol.
Câu 11 [308649]: Dưới đây là sơ đồ để tách hỗn hợp amine béo chính (RNH2), carboxylic acid (RCOOH) và phenol (ArOH). Giả sử các chất trên không tan trong nước nhưng tan trong diethyl ether. Hỗn hợp này được tách thành các phần A, B và C.
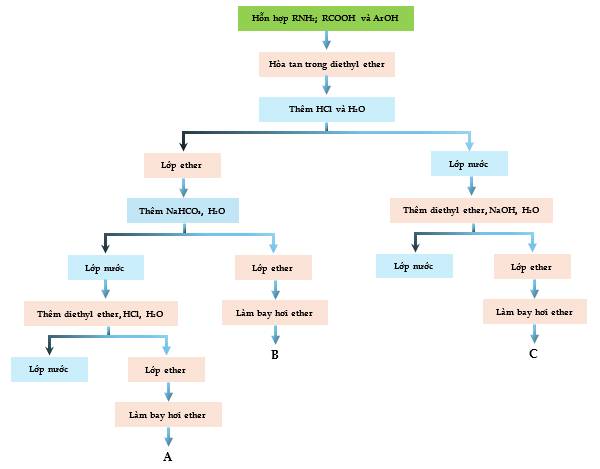

Phân tích sơ đồ tách chế hỗn hợp:
Hỗn hợp RNH2; RCOOH và ArOH khi hòa tan trong diethyl ether rồi thêm HCl và H2O thì dung dịch được tách làm 2 lớp:
① Lớp ether gồm RCOOH và ArOH ở phía trên → Thêm NaHCO3 thu được 2 lớp:
+ Lớp ether là ArOH (B)
+ Lớp nước là RCOO-Na+ → Thêm diethyl ether, HCl, H2O thì dd tách 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RCOOH (A)
② Lớp nước là RNH3+Cl- ở dưới. Thêm diethyl ether, NaOH và H2O vào thì dd tách làm 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RNH2 (C)
Phân tích các phát biểu:
❌ Sai. A là carboxylic acid RCOOH theo phân tích sơ đồ
✔️ Đúng. C là amine RNH2
✔️ Đúng. Carboxylic acid RCOOH có khả năng tác dụng với NaHCO3
✔️ Đúng. C là amine, có tính base yếu nên có phản ứng với dung dịch HCl tạo muối RNH3+ tan trong nước.
Hỗn hợp RNH2; RCOOH và ArOH khi hòa tan trong diethyl ether rồi thêm HCl và H2O thì dung dịch được tách làm 2 lớp:
① Lớp ether gồm RCOOH và ArOH ở phía trên → Thêm NaHCO3 thu được 2 lớp:
+ Lớp ether là ArOH (B)
+ Lớp nước là RCOO-Na+ → Thêm diethyl ether, HCl, H2O thì dd tách 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RCOOH (A)
② Lớp nước là RNH3+Cl- ở dưới. Thêm diethyl ether, NaOH và H2O vào thì dd tách làm 2 lớp: lớp nước và lớp ether. Làm bay hơi ether thu được RNH2 (C)
Phân tích các phát biểu:
❌ Sai. A là carboxylic acid RCOOH theo phân tích sơ đồ
✔️ Đúng. C là amine RNH2
✔️ Đúng. Carboxylic acid RCOOH có khả năng tác dụng với NaHCO3
✔️ Đúng. C là amine, có tính base yếu nên có phản ứng với dung dịch HCl tạo muối RNH3+ tan trong nước.
Câu 12 [705430]: Một bạn học sinh tiến hành các thí nghiệm và ghi lại như sau:
∎ Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được dung dịch màu xanh tím.
∎ Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
∎ Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên.
∎ Thí nghiệm 4: Nhỏ vài giọt dung dịch aniline vào mẩu giấy quỳ tím, thấy màu quỳ tím chuyển sang màu xanh.
∎ Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được dung dịch màu xanh tím.
∎ Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
∎ Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên.
∎ Thí nghiệm 4: Nhỏ vài giọt dung dịch aniline vào mẩu giấy quỳ tím, thấy màu quỳ tím chuyển sang màu xanh.
Phân tích hiện tượng và phản ứng xảy ra ở các thí nghiệm:
Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được phức tan.
2CH3NH2 + 2H2O + CuSO4 → Cu(OH)2 + (CH3NH3)2SO4
Cu(OH)2 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2
Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
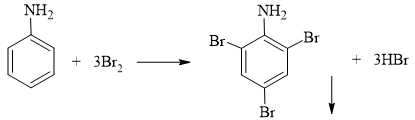
Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên là nitrogen (N2).
HCl + NaNO2 ⇌ HNO2 + NaCl
C2H5NH2 + HNO2 ⟶ C2H5OH + N2 + H2O
Thí nghiệm 4: Aniline có vòng benzene đính vào nguyên tử N, do hiệu ứng của vòngthơm làm cho mật độ electron trên nguyên tử N giảm, từ đó tính base sẽ yếu hơn ammonia nên aniline không làm đổi màu phenolphthalein và quỳ tím.
Phân tích các phát biểu:
❌ a) Sai. Bạn học sinh ghi đúng hiện tượng của thí nghiệm 2 là thấy có kết tủa màu trắng xuất hiện.
✔️ b) Đúng. Aniline không có khả năng làm đổi màu quỳ tím nên dù quỳ tím khô hay quỳ tím ẩm thì quỳ tím vẫn không đổi màu.
❌ c) Sai. Thí nghiệm 1 là phản ứng tạo phức tan màu xanh của amine [Cu(CH3NH2)4](OH)2.
❌ d) Sai.Ở thí nghiệm 3 nếu thay ethylamine bằng một alkylamine bậc 2 thì thu được N-Nitrosamine (một chất dạng dầu không hoà tan) màu vàng nổi trên mặt nước. Nếu thay bằng amine bậc 3 mới thu được dung dịch trong suốt.
Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được phức tan.
2CH3NH2 + 2H2O + CuSO4 → Cu(OH)2 + (CH3NH3)2SO4
Cu(OH)2 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2
Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.

Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên là nitrogen (N2).
HCl + NaNO2 ⇌ HNO2 + NaCl
C2H5NH2 + HNO2 ⟶ C2H5OH + N2 + H2O
Thí nghiệm 4: Aniline có vòng benzene đính vào nguyên tử N, do hiệu ứng của vòngthơm làm cho mật độ electron trên nguyên tử N giảm, từ đó tính base sẽ yếu hơn ammonia nên aniline không làm đổi màu phenolphthalein và quỳ tím.
Phân tích các phát biểu:
❌ a) Sai. Bạn học sinh ghi đúng hiện tượng của thí nghiệm 2 là thấy có kết tủa màu trắng xuất hiện.
✔️ b) Đúng. Aniline không có khả năng làm đổi màu quỳ tím nên dù quỳ tím khô hay quỳ tím ẩm thì quỳ tím vẫn không đổi màu.
❌ c) Sai. Thí nghiệm 1 là phản ứng tạo phức tan màu xanh của amine [Cu(CH3NH2)4](OH)2.
❌ d) Sai.Ở thí nghiệm 3 nếu thay ethylamine bằng một alkylamine bậc 2 thì thu được N-Nitrosamine (một chất dạng dầu không hoà tan) màu vàng nổi trên mặt nước. Nếu thay bằng amine bậc 3 mới thu được dung dịch trong suốt.
Câu 13 [829912]: Bột ngọt là một loại gia vị, được sản xuất từ dung dịch NaOH 40% và tinh thể glutamic acid (chứa 80% acid) bằng cách dùng dung dịch NaOH trung hòa dung dịch glutamic acid đến pH = 6,8. Sau đó đem lọc, cô đặc và kết tinh dung dịch sản phẩm bằng phương pháp sấy chân không ở nhiệt độ thấp. Bột ngọt thu được có độ tinh khiết 99,5%. Giả thiết hiệu suất của cả quá trình tính theo glutamic acid là 90%.
Phân tích các đáp án:
✔️A. Glutamic acid là một acid amin, cụ thể là một acid amin có nhóm –COOH nhiều hơn nhóm –NH2, nên dung dịch của nó có pH < 7 (có tính acid).
✔️B. pKa của các nhóm –COOH trong glutamic acid khoảng 2,1 và 4,1.
Tại pH = 6,8 (> 4,1), ít nhất một nhóm –COOH đã bị khử proton thành –COO⁻, và phản ứng với NaOH tạo thành –COONa.
Glutamic acid có 2 nhóm –COOH → ở pH 6,8, 1 nhóm tồn tại dạng COONa, nhóm còn lại có thể vẫn là –COOH hoặc cũng là –COO⁻ tùy vào môi trường.
❌C. NaOH là base mạnh, khi cho vào dung dịch acid thì pH sẽ tăng, không giảm.
✔️D. Ta có : R - (COOH)2 ⟶ R - COONa
Số mol bột ngọt là: n bột ngọt = 1/(147 + 22) × 99,5%
Khối lượng tinh thể là: 1/(147 + 22) × 99,5% : 90% : 80% × 147 = 1,2 tấn
✔️A. Glutamic acid là một acid amin, cụ thể là một acid amin có nhóm –COOH nhiều hơn nhóm –NH2, nên dung dịch của nó có pH < 7 (có tính acid).
✔️B. pKa của các nhóm –COOH trong glutamic acid khoảng 2,1 và 4,1.
Tại pH = 6,8 (> 4,1), ít nhất một nhóm –COOH đã bị khử proton thành –COO⁻, và phản ứng với NaOH tạo thành –COONa.
Glutamic acid có 2 nhóm –COOH → ở pH 6,8, 1 nhóm tồn tại dạng COONa, nhóm còn lại có thể vẫn là –COOH hoặc cũng là –COO⁻ tùy vào môi trường.
❌C. NaOH là base mạnh, khi cho vào dung dịch acid thì pH sẽ tăng, không giảm.
✔️D. Ta có : R - (COOH)2 ⟶ R - COONa
Số mol bột ngọt là: n bột ngọt = 1/(147 + 22) × 99,5%
Khối lượng tinh thể là: 1/(147 + 22) × 99,5% : 90% : 80% × 147 = 1,2 tấn
Câu 14 [829903]: Cao su thiên nhiên không dẫn điện, không thấm nước và khí, có tính đàn hồi tốt. Tuy nhiên, cao su thiên nhiên dễ bị lão hóa dưới tác động của không khí, ánh sáng, nhiệt. Ngoài ra, tính đàn hồi của cao su chỉ tồn tại trong một khoảng nhiệt độ hẹp. Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với sulfur) có khoảng 2,0% sulfur về khối lượng.
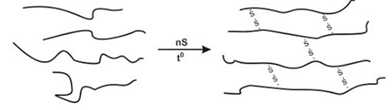

Phân tích các đáp án:
✔️A. Khi lưu hóa với 2% lưu huỳnh, khoảng 20–50 mắt xích có một cầu nối disulfide.
C5H8 ( k mắt xích ) ⟶ C5kH8k-2S2
32 : 2 /(12.5k + 8k - 2 + 32.2) × 100 = 2%
⟶ k = 46
✔️B. Lưu hóa tạo các cầu nối –S–S– giữa các chuỗi polyisoprene → tạo ra cấu trúc polyme mạng lưới không gian ba chiều → mạng lưới không gian.
✔️C. Có thể tổng hợp cao su tương tự (nhân tạo) bằng trùng hợp isoprene
✔️D. Cao su lưu hóa:Đàn hồi tốt hơnBền nhiệt, bền ánh sáng, bền cơ học hơnÍt bị lão hóa hơn cao su tự nhiên
✔️A. Khi lưu hóa với 2% lưu huỳnh, khoảng 20–50 mắt xích có một cầu nối disulfide.
C5H8 ( k mắt xích ) ⟶ C5kH8k-2S2
32 : 2 /(12.5k + 8k - 2 + 32.2) × 100 = 2%
⟶ k = 46
✔️B. Lưu hóa tạo các cầu nối –S–S– giữa các chuỗi polyisoprene → tạo ra cấu trúc polyme mạng lưới không gian ba chiều → mạng lưới không gian.
✔️C. Có thể tổng hợp cao su tương tự (nhân tạo) bằng trùng hợp isoprene
✔️D. Cao su lưu hóa:Đàn hồi tốt hơnBền nhiệt, bền ánh sáng, bền cơ học hơnÍt bị lão hóa hơn cao su tự nhiên
Câu 15 [829910]: PMMA (poly(methyl methacrylate)) là một nhựa nhiệt dẻo trong suốt thường được sử dụng ở dạng tấm, miếng như một vật liệu nhẹ, khó bể vỡ và có thể được dùng để thay thế cho kính và thủy tinh. PMMA được điều chế theo 2 giai đoạn:
▪ Giai đoạn 1: Methyl alcohol tác dụng với methacrylic acid tạo thành methyl methacrylate.
▪ Giai đoạn 2: Trùng hợp methyl methacrylate tạo thành PMMA.
Từ 348,3 kg methacrylic acid tiến hành sản xuất kính, mỗi tấm kính có chiều dài 20 cm, chiều rộng 15 cm và độ dày 1 cm (khối lượng riêng của tấm kính là D = 1,2 g/cm3). Biết trong mỗi tấm kính khối lượng PMMA chiếm 90% và hiệu suất phản ứng của toàn bộ quá trình tính theo methacrylic acid là 80%.
▪ Giai đoạn 1: Methyl alcohol tác dụng với methacrylic acid tạo thành methyl methacrylate.
▪ Giai đoạn 2: Trùng hợp methyl methacrylate tạo thành PMMA.
Từ 348,3 kg methacrylic acid tiến hành sản xuất kính, mỗi tấm kính có chiều dài 20 cm, chiều rộng 15 cm và độ dày 1 cm (khối lượng riêng của tấm kính là D = 1,2 g/cm3). Biết trong mỗi tấm kính khối lượng PMMA chiếm 90% và hiệu suất phản ứng của toàn bộ quá trình tính theo methacrylic acid là 80%.
Phân tích các đáp án
✔️A. Methyl methacrylate là ester của methacrylic acid (CH2=C(CH3)COOH) và methanol (CH3OH).
→ Công thức đúng là CH2=C(CH3)COOH.
❌B. Giai đoạn 1 là phản ứng ester hóa, cần xúc tác H2SO4 đặc để tạo methyl methacrylate.
❌C. Thủy phân ester (CH2=C(CH3)COOCH3) trong môi trường kiềm sẽ tạo: Muối của acid
Methanol (CH3OH) → là một alcohol, không phải aldehyde.
→ Mệnh đề sai vì sản phẩm không có aldehyde.
✔️D. Ta có:
CH3OH + H2C=C(CH3)-COOH → H2C=C(CH3)-COOCH3 + H2O
Số mol acid là: n acid = 348,3.103/86
→ số mol ester = 348,3.103/86 × 80% = 3240 mol
→ m = 324000(g)
Khối lượng PMMA(1 tấn) = 20.15.1.1,2.90% = 324(g)
→ Số tấm kính = 324000 : 324 = 1000 tấm
✔️A. Methyl methacrylate là ester của methacrylic acid (CH2=C(CH3)COOH) và methanol (CH3OH).
→ Công thức đúng là CH2=C(CH3)COOH.
❌B. Giai đoạn 1 là phản ứng ester hóa, cần xúc tác H2SO4 đặc để tạo methyl methacrylate.
❌C. Thủy phân ester (CH2=C(CH3)COOCH3) trong môi trường kiềm sẽ tạo: Muối của acid
Methanol (CH3OH) → là một alcohol, không phải aldehyde.
→ Mệnh đề sai vì sản phẩm không có aldehyde.
✔️D. Ta có:
CH3OH + H2C=C(CH3)-COOH → H2C=C(CH3)-COOCH3 + H2O
Số mol acid là: n acid = 348,3.103/86
→ số mol ester = 348,3.103/86 × 80% = 3240 mol
→ m = 324000(g)
Khối lượng PMMA(1 tấn) = 20.15.1.1,2.90% = 324(g)
→ Số tấm kính = 324000 : 324 = 1000 tấm
Câu 16 [705867]: Khi thực hành thí nghiệm phản ứng của hexane với bromine. Cần tiến hành các bước:
• Bước 1: Cho vào ống nghiệm khô khoảng 1 mL hexane và nhỏ thêm vào ống nghiệm khoảng 1 mL nước bromine. Quan sát màu sắc sau đó lắc nhẹ hỗn hợp rồi để yên 10 phút.
• Bước 2: Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH rồi nhúng phần đáy ống nghiệm vào cốc nước nóng 50 oC (đã chuẩn bị trước) hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời.
Chú ý an toàn: Hexane, bromine và hydrogen bromine dễ bay hơi, có mùi xốc, độc.
• Bước 1: Cho vào ống nghiệm khô khoảng 1 mL hexane và nhỏ thêm vào ống nghiệm khoảng 1 mL nước bromine. Quan sát màu sắc sau đó lắc nhẹ hỗn hợp rồi để yên 10 phút.
• Bước 2: Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH rồi nhúng phần đáy ống nghiệm vào cốc nước nóng 50 oC (đã chuẩn bị trước) hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời.
Chú ý an toàn: Hexane, bromine và hydrogen bromine dễ bay hơi, có mùi xốc, độc.
Phân tích các đáp án :
✔️(a) – Đúng. Br2 tan trong hexane tốt hơn tan trong H2O nên Br2 sẽ di chuyển từ dung dịch nước sang dung môi mới là hexane.
✔️(b) – Đúng. Phần nổi là dung dịch Br2/Hexane có màu vàng nâu có khối lượng riêng nhỏ hơn, phần dưới là H2O nên phần trên có màu đậm hơn phần dưới.
✔️(c) – Đúng. Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH là để hạn chế các khí độc bay ra ngoài. Bước 2 xảy ra phản ứng giữa hexane với Br2 tạo khí HBr gây độc
C6H14 + Br2 → C6H13Br + HBr
❌(d) – Sai. Cl2 phản ứng với hexane để tạo ra các dẫn xuất chloro, các dẫn xuất này đều tan trong hexane → tạo thành dung dịch đồng nhất.
✔️(a) – Đúng. Br2 tan trong hexane tốt hơn tan trong H2O nên Br2 sẽ di chuyển từ dung dịch nước sang dung môi mới là hexane.
✔️(b) – Đúng. Phần nổi là dung dịch Br2/Hexane có màu vàng nâu có khối lượng riêng nhỏ hơn, phần dưới là H2O nên phần trên có màu đậm hơn phần dưới.
✔️(c) – Đúng. Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH là để hạn chế các khí độc bay ra ngoài. Bước 2 xảy ra phản ứng giữa hexane với Br2 tạo khí HBr gây độc
C6H14 + Br2 → C6H13Br + HBr
❌(d) – Sai. Cl2 phản ứng với hexane để tạo ra các dẫn xuất chloro, các dẫn xuất này đều tan trong hexane → tạo thành dung dịch đồng nhất.
Câu 17 [829911]: Thuốc chữa ghẻ lở, tróc vảy hoặc côn trùng cắn DEP (chứa thành phần diethyl phthalate) được sản xuất từ nguồn nguyên liệu đầu là naphthalene và ethyl acohol theo sơ đồ các quá trình chuyển hoá, kèm hiệu suất như sau:
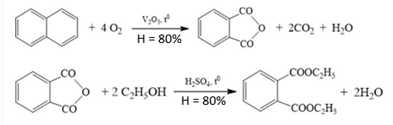
Tiến hành sản xuất 10 triệu hộp DEP (quy cách 10 gam/hộp, trong đó hoạt chất diethyl phthalate chiếm 88,8% về khối lượng).

Tiến hành sản xuất 10 triệu hộp DEP (quy cách 10 gam/hộp, trong đó hoạt chất diethyl phthalate chiếm 88,8% về khối lượng).
Phân tích các đáp án
✔️(a) Đúng, diethyl phthalate có 2 chức ester, không có nhóm chức khác nên thuộc loại diester.
❌(b) Sai, diethyl phthalate có 5 liên kết , nằm trong 3C=C và 2C=O.
❌(c) Sai, cho 1 mol diethyl phthalate tác dụng hết 2 mol NaOH thu được 2 mol alcohol C2H5OH và 1 mol muối C6H4(COONa)2.
✔️(d) Đúng. Ta có: mDEP = 10.10.88,8% = 88,8 tấn
Khối lượng Naphtalene là: = 88,8.128 / (222.80%.80%) = 80 tấn
✔️(a) Đúng, diethyl phthalate có 2 chức ester, không có nhóm chức khác nên thuộc loại diester.
❌(b) Sai, diethyl phthalate có 5 liên kết , nằm trong 3C=C và 2C=O.
❌(c) Sai, cho 1 mol diethyl phthalate tác dụng hết 2 mol NaOH thu được 2 mol alcohol C2H5OH và 1 mol muối C6H4(COONa)2.
✔️(d) Đúng. Ta có: mDEP = 10.10.88,8% = 88,8 tấn
Khối lượng Naphtalene là: = 88,8.128 / (222.80%.80%) = 80 tấn
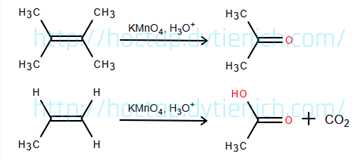
Câu 18 [829904]: Biết liên kết đôi C=C có thể bị oxi hóa bởi KMnO4 trong môi trường acid như sau:
Phản ứng iodoform cùng với các phản ứng khác có thể được sử dụng để xác định cấu trúc của các hợp chất chưa biết. Dùng thông tin trong bảng dưới đây để suy ra cấu trúc của các hợp chất trong sơ đồ sau:
C6H12 (A) C3H6O2 (B) + (C)
C3H6O2 (B) + (C)
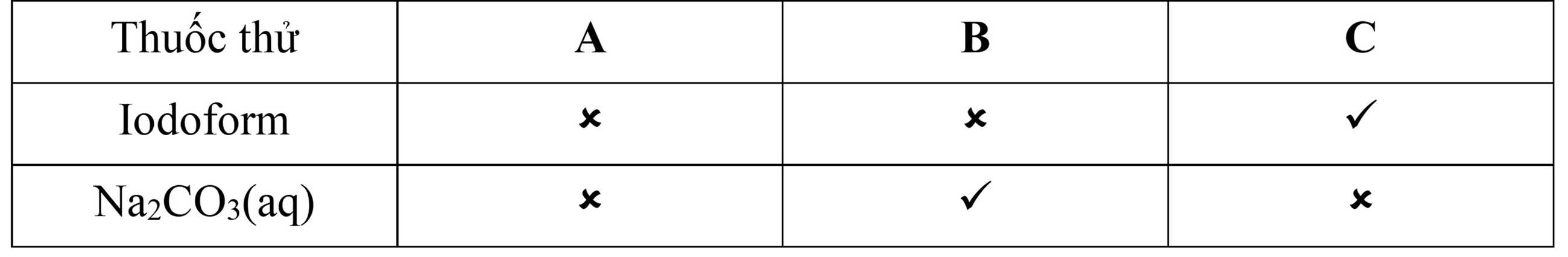
Kết quả các phép thử (v: dương tính, ×: âm tính)

Phản ứng iodoform cùng với các phản ứng khác có thể được sử dụng để xác định cấu trúc của các hợp chất chưa biết. Dùng thông tin trong bảng dưới đây để suy ra cấu trúc của các hợp chất trong sơ đồ sau:
C6H12 (A)
 C3H6O2 (B) + (C)
C3H6O2 (B) + (C)Kết quả các phép thử (v: dương tính, ×: âm tính)

Phản ứng iodoform là phản ứng đặc trưng của các hợp chất chứa nhóm methyl ketone hoặc rượu bậc hai.
+ B không phản ứng với iodoform, nhưng có phản ứng với Na2CO3, nghĩa là B là acid (có nhóm –COOH) → B là CH3–CH2–COOH
+ C có phản ứng iodoform → C có nhóm CH3–CO– hoặc CH3–CH(OH)–
+ C không phản ứng với Na2CO3, nên C không phải acid, là ketone hoặc rượu bậc hai
→ C là CH3–CO–CH3
→ A là CH3–CH=C(CH3)–CH2–CH3
Các phản ứng:
Phản ứng oxi hóa
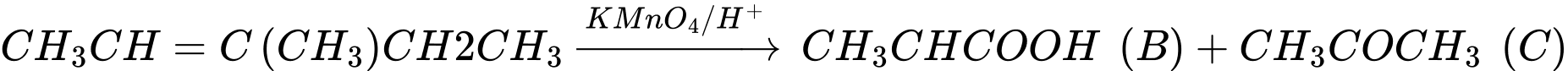
Phản ứng iodoform của C
CH3–CO–CH3 + 3I2 + 4NaOH ⟶ CHI3 + CH3COONa + 3NaI + 3H2O
Phản ứng với Na2CO3 của B
CH3CH2COOH + Na2CO3 ⟶ CH3COONa + H2O + CO2
Phân tích các đáp án:
✔️a: Chất A chứa 1 liên kết π vì A là alkene (có liên kết đôi C=C).
✔️b: Chỉ có một cấu tạo phù hợp với B là CH3–CH2–COOH, vì B là sản phẩm của phản ứng oxi hóa KMnO4 và là carboxylic acid.
❌c: B là acid có 2O; C là ketone có 1O nên không có cùng số lượng nguyên tử oxygen.
✔️d: A, B, C có cùng độ bất bão hòa bằng 1.
Độ bất bão hòa = 2C + 2 - H / 2
Độ bất bão hòa của A = 2×6 + 2 - 12 / 2 = 1
Độ bất bão hòa của B = C = 2×3 + 2 - 6 / 2 = 1
+ B không phản ứng với iodoform, nhưng có phản ứng với Na2CO3, nghĩa là B là acid (có nhóm –COOH) → B là CH3–CH2–COOH
+ C có phản ứng iodoform → C có nhóm CH3–CO– hoặc CH3–CH(OH)–
+ C không phản ứng với Na2CO3, nên C không phải acid, là ketone hoặc rượu bậc hai
→ C là CH3–CO–CH3
→ A là CH3–CH=C(CH3)–CH2–CH3
Các phản ứng:
Phản ứng oxi hóa
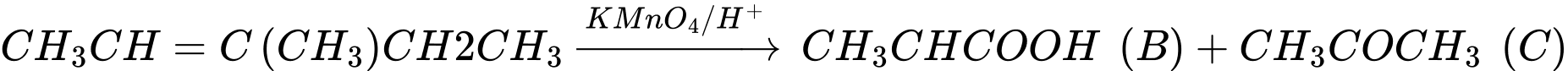
Phản ứng iodoform của C
CH3–CO–CH3 + 3I2 + 4NaOH ⟶ CHI3 + CH3COONa + 3NaI + 3H2O
Phản ứng với Na2CO3 của B
CH3CH2COOH + Na2CO3 ⟶ CH3COONa + H2O + CO2
Phân tích các đáp án:
✔️a: Chất A chứa 1 liên kết π vì A là alkene (có liên kết đôi C=C).
✔️b: Chỉ có một cấu tạo phù hợp với B là CH3–CH2–COOH, vì B là sản phẩm của phản ứng oxi hóa KMnO4 và là carboxylic acid.
❌c: B là acid có 2O; C là ketone có 1O nên không có cùng số lượng nguyên tử oxygen.
✔️d: A, B, C có cùng độ bất bão hòa bằng 1.
Độ bất bão hòa = 2C + 2 - H / 2
Độ bất bão hòa của A = 2×6 + 2 - 12 / 2 = 1
Độ bất bão hòa của B = C = 2×3 + 2 - 6 / 2 = 1
Câu 19 [704376]: Bốn hợp chất diethyl ether, ethanol, acetic acid, acetone được đựng trong các lọ khác nhau và được dán nhãn để phân biệt:

Tiến hành đo phổ hồng ngoại của lọ có nhãn (1) của một trong bốn chất. Kết quả phổ hồng ngoại được cho như dưới đây:
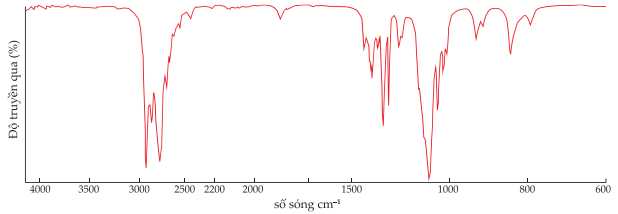

Tiến hành đo phổ hồng ngoại của lọ có nhãn (1) của một trong bốn chất. Kết quả phổ hồng ngoại được cho như dưới đây:

+) C2H5OH có tín hiệu đặc trung cho nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1.
+) CH3COOH có tín hiệu đặc trung cho nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1 và nhóm C=O (carboxylic acid) có số sóng trong khoảng 1750 – 1680 cm-1.
+) CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
Trên phổ hồng ngoại không có tín hiệu tín hiệu đặc trưng cho các chất C2H5OH, CH3COOH, CH3COCH3.
→ Chất dán nhãn (1) là C2H5OC2H5.
Phân tích các phát biểu:
✔️ (a) Đúng. CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
✔️ (b) Đúng. Nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1 và nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1.
❌ (c) Sai. Kết quả phổ hồng ngoại của hợp chất trong lọ gắn nhãn (1) thuộc về hợp chất diethyl ether như đã phân tích.
✔️ (d) Đúng. Có thể sử dụng phổ hồng ngoại để phân biệt được bốn chất tương ứng trong các lọ gắn nhãn do ba chất đều có tín hiệu đặc trưng riêng còn ether không có.
+) CH3COOH có tín hiệu đặc trung cho nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1 và nhóm C=O (carboxylic acid) có số sóng trong khoảng 1750 – 1680 cm-1.
+) CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
Trên phổ hồng ngoại không có tín hiệu tín hiệu đặc trưng cho các chất C2H5OH, CH3COOH, CH3COCH3.
→ Chất dán nhãn (1) là C2H5OC2H5.
Phân tích các phát biểu:
✔️ (a) Đúng. CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
✔️ (b) Đúng. Nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1 và nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1.
❌ (c) Sai. Kết quả phổ hồng ngoại của hợp chất trong lọ gắn nhãn (1) thuộc về hợp chất diethyl ether như đã phân tích.
✔️ (d) Đúng. Có thể sử dụng phổ hồng ngoại để phân biệt được bốn chất tương ứng trong các lọ gắn nhãn do ba chất đều có tín hiệu đặc trưng riêng còn ether không có.
Câu 20 [705450]: Một hợp chất X chứa nhóm chức carbonyl được tiến hành hành nghiên cứu tính chất hóa học như sau:
∎ X không có phản ứng với thuốc thử Tollens.
∎ X không có phản ứng iodoform.
Kết quả phổ hồng ngoại (phổ IR) và phổ khối lượng (phổ MS) của hợp chất X được cho dưới đây:
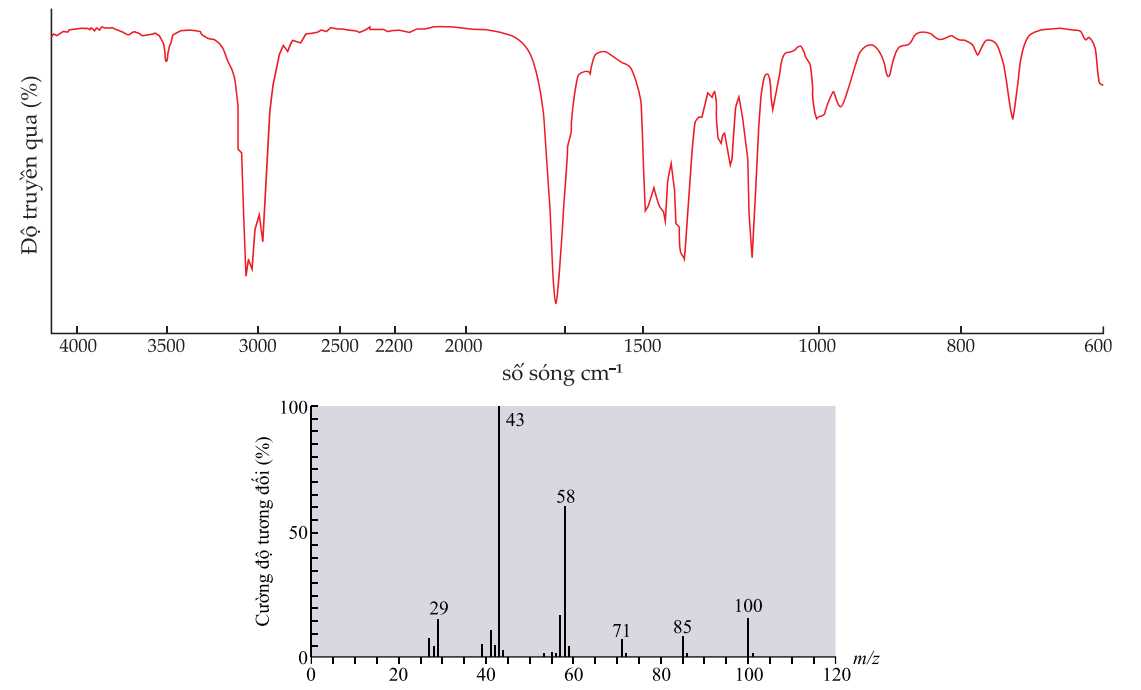
∎ X không có phản ứng với thuốc thử Tollens.
∎ X không có phản ứng iodoform.
Kết quả phổ hồng ngoại (phổ IR) và phổ khối lượng (phổ MS) của hợp chất X được cho dưới đây:

Một hợp chất X chứa nhóm chức carbonyl được tiến hành hành nghiên cứu tính chất hóa học như sau:
X không có phản ứng với thuốc thử Tollens → X không có nhóm chức -CHO
X không có phản ứng iodoform → X không có dạng CH3-CO-R
Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
Từ phổ MS thấy phân tử khối của X là 100 gam/mol
Gọi công thức của X có dạng CxHyOz
MX = 12x + y + 16z = 100 (gam/mol)
Với z = 1 → x = 6; y = 12
Công thức phân tử của X là C6H12O
Với z = 2 → x = 5; y = 8
Công thức phân tử của X là C5H8O2 (loại vì không có CTCT phù hợp)
Với z = 4 → giá trị x = 2; y = 4 là phù hợp
Công thức phân tử của X là C4H4O3 (loại vì không có CTCT phù hợp)
Khi giá trị z càng lớn thì không có công thức cấu tạo của X thỏa mãn yêu cầu bài ra.
→ X có công thức phân tử là C6H12O
Các công thức cấu tạo thỏa mãn của X là:
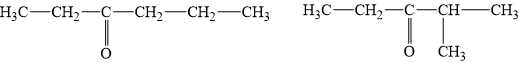
Phân tích các phát biểu:
✔️ a) Đúng. Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
✔️ b) Đúng. X không có phản ứng iodoform → X không có dạng CH3-CO-R
❌ c) Sai. Công thức phân tử của hợp chất X là C6H12O.
❌ d) Sai. X có 2 công thức cấu tạo tỏa mãn điều kiện đề bài.
X không có phản ứng với thuốc thử Tollens → X không có nhóm chức -CHO
X không có phản ứng iodoform → X không có dạng CH3-CO-R
Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
Từ phổ MS thấy phân tử khối của X là 100 gam/mol
Gọi công thức của X có dạng CxHyOz
MX = 12x + y + 16z = 100 (gam/mol)
Với z = 1 → x = 6; y = 12
Công thức phân tử của X là C6H12O
Với z = 2 → x = 5; y = 8
Công thức phân tử của X là C5H8O2 (loại vì không có CTCT phù hợp)
Với z = 4 → giá trị x = 2; y = 4 là phù hợp
Công thức phân tử của X là C4H4O3 (loại vì không có CTCT phù hợp)
Khi giá trị z càng lớn thì không có công thức cấu tạo của X thỏa mãn yêu cầu bài ra.
→ X có công thức phân tử là C6H12O
Các công thức cấu tạo thỏa mãn của X là:
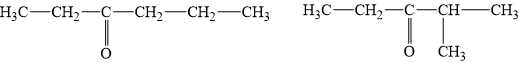
Phân tích các phát biểu:
✔️ a) Đúng. Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
✔️ b) Đúng. X không có phản ứng iodoform → X không có dạng CH3-CO-R
❌ c) Sai. Công thức phân tử của hợp chất X là C6H12O.
❌ d) Sai. X có 2 công thức cấu tạo tỏa mãn điều kiện đề bài.