Câu 1 [680876]: Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
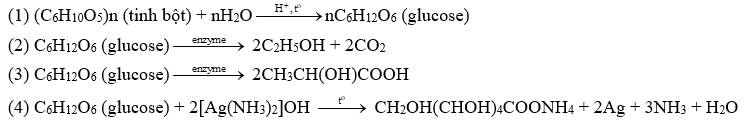
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: lên men rượu, thủy phân, lên men lactic, tráng gương và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321,…).
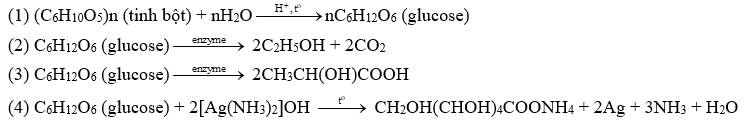
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: lên men rượu, thủy phân, lên men lactic, tráng gương và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321,…).
Phản ứng (1) phản ứng thủy phân tinh bột
(C6H10O5)n (tinh bột) + nH2O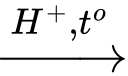 nC6H12O6 (glucose).
nC6H12O6 (glucose).
Phản ứng (2) phản ứng lên men rượu
(C6H12O6) (glucose) 2C2H5OH + 2CO2.
2C2H5OH + 2CO2.
Phản ứng (3) phản ứng lên men lactic.
C6H12O6 (glucose) 2CH3CH(OH)COOH.
2CH3CH(OH)COOH.
Phản ứng (4) phản ứng tráng gương.
C6H12O6 (glucose) + 2[Ag(NH3)2]OH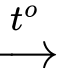 CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
Thứ tự đúng là: 2134
⟹ Điền đáp án 2134
(C6H10O5)n (tinh bột) + nH2O
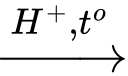 nC6H12O6 (glucose).
nC6H12O6 (glucose). Phản ứng (2) phản ứng lên men rượu
(C6H12O6) (glucose)
 2C2H5OH + 2CO2.
2C2H5OH + 2CO2.
Phản ứng (3) phản ứng lên men lactic.
C6H12O6 (glucose)
 2CH3CH(OH)COOH.
2CH3CH(OH)COOH. Phản ứng (4) phản ứng tráng gương.
C6H12O6 (glucose) + 2[Ag(NH3)2]OH
 CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.Thứ tự đúng là: 2134
⟹ Điền đáp án 2134
Câu 2 [706024]: Cho phương trình hóa học của các phản ứng đánh số thứ tự từ 1 đến 4 dưới đây:
(1) CH3COOH + CH3CH(CH3)CH2CH2OH ⇄ CH3COOCH2CH2CH(CH3)CH3 +H2O
(2) CH3CH2CH2CH2COOH + C2H5OH ⇄ CH3CH2CH2CH2COOC2H5 + H2O
(3) CH3COOH + CH3C(CH3)=CH[CH2]2CH=C(CH3)CH2OH ⇄ CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 + H2O
(4) CH3COOH + C6H5CH2OH ⇄ CH3COOCH2C6H5 + H2O
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các ester sau: mùi chuối chín; mùi dứa; mùi hoa nhài; mùi hoa hồng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
(1) CH3COOH + CH3CH(CH3)CH2CH2OH ⇄ CH3COOCH2CH2CH(CH3)CH3 +H2O
(2) CH3CH2CH2CH2COOH + C2H5OH ⇄ CH3CH2CH2CH2COOC2H5 + H2O
(3) CH3COOH + CH3C(CH3)=CH[CH2]2CH=C(CH3)CH2OH ⇄ CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 + H2O
(4) CH3COOH + C6H5CH2OH ⇄ CH3COOCH2C6H5 + H2O
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các ester sau: mùi chuối chín; mùi dứa; mùi hoa nhài; mùi hoa hồng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Phản ứng (1) điều chế CH3COOCH2CH2CH(CH3)CH3 – isoamyl acetate mùi chuối chín
Phản ứng (2) điều chế CH3CH2CH2COOC2H5 – ethyl butirate mùi dứa
Phản ứng (3) điều chế CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 – geranyl acetate mùi hoa hồng
Phản ứng (4) điều chế CH3COOCH2C6H5 – benzyl acetate mùi hoa nhài
Thứ tự đúng 1243
⟹Điền đáp án : 1243
Phản ứng (2) điều chế CH3CH2CH2COOC2H5 – ethyl butirate mùi dứa
Phản ứng (3) điều chế CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 – geranyl acetate mùi hoa hồng
Phản ứng (4) điều chế CH3COOCH2C6H5 – benzyl acetate mùi hoa nhài
Thứ tự đúng 1243
⟹Điền đáp án : 1243
Câu 3 [706077]: Cho phương trình hóa học của các phản ứng đánh số thứ tự từ 1 đến 4 dưới đây:
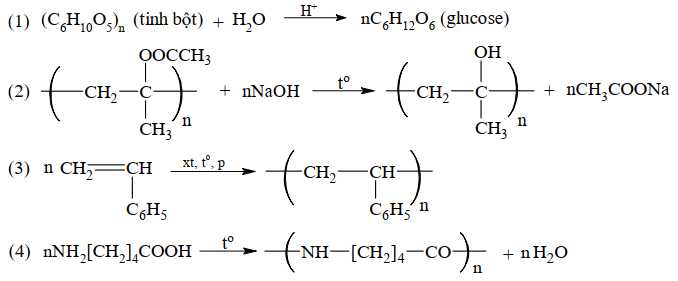
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi: phản ứng giữ nguyên mạch polymer, phản ứng cắt mạch polymer, phản ứng trùng hợp, phản ứng trùng ngưng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi: phản ứng giữ nguyên mạch polymer, phản ứng cắt mạch polymer, phản ứng trùng hợp, phản ứng trùng ngưng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Phản ứng giữa nguyên mạch polymer – Phản ứng số (2)
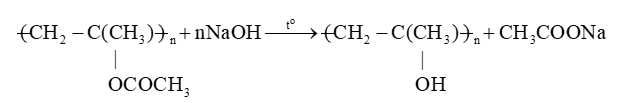
Phản ứng cắt mạch – Phản ứng số (1)
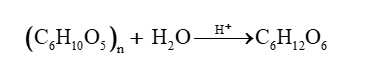
Phản ứng trùng hợp – Phản ứng số (3)
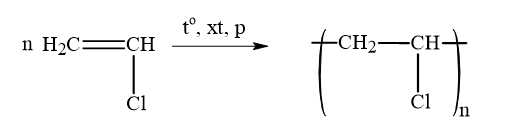
Phản ứng trùng ngưng – Phản ứng số (4)
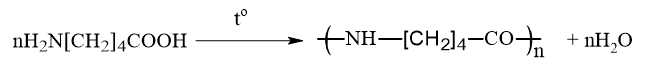
Thứ tự sắp xếp : 2134
⟹ Điền đáp án : 2134
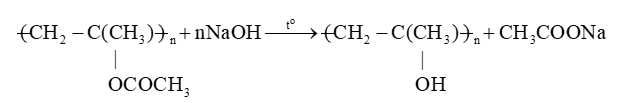
Phản ứng cắt mạch – Phản ứng số (1)
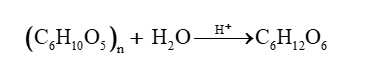
Phản ứng trùng hợp – Phản ứng số (3)
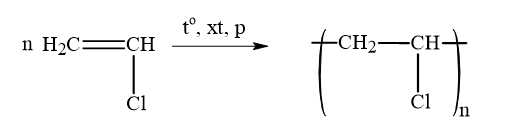
Phản ứng trùng ngưng – Phản ứng số (4)
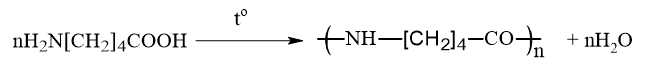
Thứ tự sắp xếp : 2134
⟹ Điền đáp án : 2134
Câu 4 [706055]: Cho phương trình hóa học của các phản ứng đánh số thứ tự từ 1 đến 4 dưới đây:
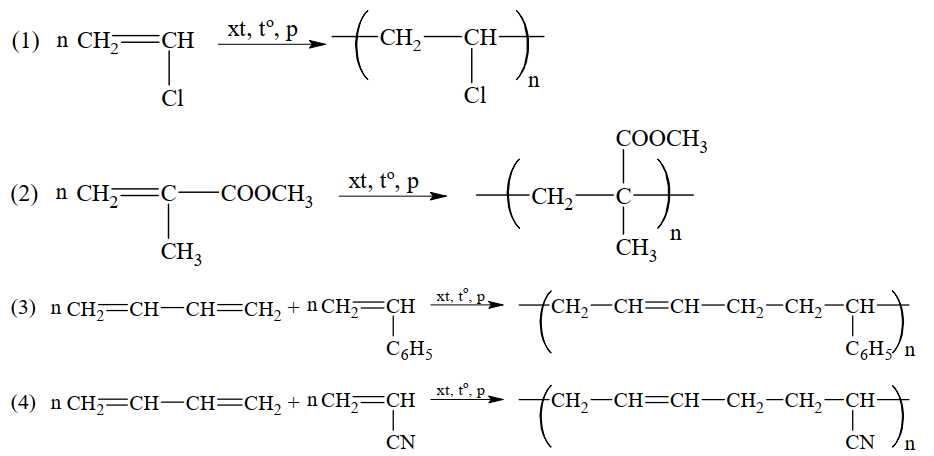
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các chất sau: cao su buna–S; cao su buna–N; nhựa PVC; thủy tinh hữu cơ plexiglas và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các chất sau: cao su buna–S; cao su buna–N; nhựa PVC; thủy tinh hữu cơ plexiglas và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
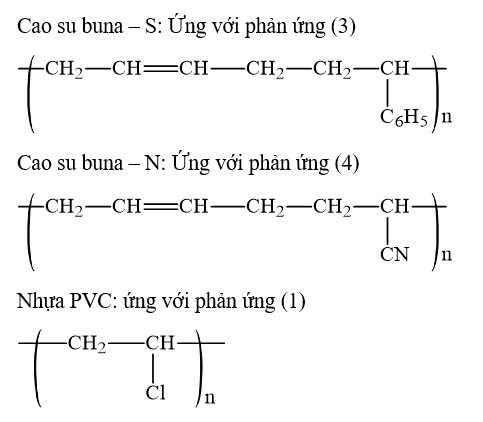
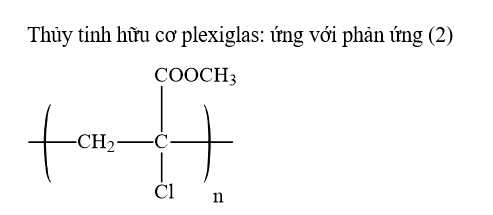
Trình tự dãy số là 3412
⟹ Điền đáp án : 3412
Câu 5 [830066]: Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
(1) CH3–CH=O + 2[Ag(NH3)2]OH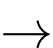 CH3COONH4 + 2Ag + 3NH3 + H2O
CH3COONH4 + 2Ag + 3NH3 + H2O
(2) CH3–CH=O + 3I2 + 4NaOH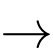 CHI3 + HCOONa + 3NaI + H2O
CHI3 + HCOONa + 3NaI + H2O
(3) C6H12O6 2C2H5OH + 2CO2
2C2H5OH + 2CO2
(4) (C6H10O5)n + nH2O (enzyme) nC6H12O6
nC6H12O6
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: Phản ứng với thuốc thử Tollens, phản ứng lên men rượu, phản ứng tạo iodoform, phản ứng thủy phân và sắp xếp theo trình tự thành dãy bốn số. (ví dụ: 1234, 4321,..).
(1) CH3–CH=O + 2[Ag(NH3)2]OH
 CH3COONH4 + 2Ag + 3NH3 + H2O
CH3COONH4 + 2Ag + 3NH3 + H2O (2) CH3–CH=O + 3I2 + 4NaOH
 CHI3 + HCOONa + 3NaI + H2O
CHI3 + HCOONa + 3NaI + H2O (3) C6H12O6
 2C2H5OH + 2CO2
2C2H5OH + 2CO2 (4) (C6H10O5)n + nH2O (enzyme)
 nC6H12O6
nC6H12O6 Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: Phản ứng với thuốc thử Tollens, phản ứng lên men rượu, phản ứng tạo iodoform, phản ứng thủy phân và sắp xếp theo trình tự thành dãy bốn số. (ví dụ: 1234, 4321,..).
Phương trình (1) phản ứng với thuốc thử Tollens
(1) CH3–CH=O + 2[Ag(NH3)2]OH CH3COONH4 + 2Ag + 3NH3 + H2O.
CH3COONH4 + 2Ag + 3NH3 + H2O.
Phương trình (2) phản ứng tạo iodoform.
(2) CH3–CH=O + 3I2 + 4NaOH CHI3 + HCOONa + 3NaI + H2O.
CHI3 + HCOONa + 3NaI + H2O.
Phương trình (3) phản ứng lên men rượu.
(3) C6H12O6 2C2H5OH + 2CO2.
2C2H5OH + 2CO2.
Phương trình (4) phản ứng thủy phân.
(4) (C6H10O5)n + nH2O (enzyme) nC6H12O6.
nC6H12O6.
Thứ tự đúng: 1324
⟹ Điền đáp án 1324
(1) CH3–CH=O + 2[Ag(NH3)2]OH
 CH3COONH4 + 2Ag + 3NH3 + H2O.
CH3COONH4 + 2Ag + 3NH3 + H2O. Phương trình (2) phản ứng tạo iodoform.
(2) CH3–CH=O + 3I2 + 4NaOH
 CHI3 + HCOONa + 3NaI + H2O.
CHI3 + HCOONa + 3NaI + H2O.Phương trình (3) phản ứng lên men rượu.
(3) C6H12O6
 2C2H5OH + 2CO2.
2C2H5OH + 2CO2. Phương trình (4) phản ứng thủy phân.
(4) (C6H10O5)n + nH2O (enzyme)
 nC6H12O6.
nC6H12O6. Thứ tự đúng: 1324
⟹ Điền đáp án 1324
Câu 6 [702626]: Để chứng minh cấu tạo saccharose chứa nhiều nhóm OH liền kề, có thể cho dung dịch saccharose phản ứng với kết tủa Cu(OH)2. Các bước tiến hành thí nghiệm như sau:
(1) Thêm vào ống nghiệm chứa kết tủa dung dịch saccharose 3%, lắc đều đến khi thu được dung dịch đồng nhất.
(2) Lọc lấy kết tủa Cu(OH)2 màu xanh rồi cho vào ống nghiệm.
(3) Đun nóng dung dịch chứa phức chất xanh thẫm trong ống nghiệm.
(4) Cho vào ống nghiệm khoảng dung dịch NaOH 10% và dung dịch CuSO4 5%, lắc đều.
Hãy sắp xếp các bước trên với trình tự dãy bốn số theo đúng thứ tự các bước cần tiến hành (ví dụ: 1234, 4213, ...).
(1) Thêm vào ống nghiệm chứa kết tủa dung dịch saccharose 3%, lắc đều đến khi thu được dung dịch đồng nhất.
(2) Lọc lấy kết tủa Cu(OH)2 màu xanh rồi cho vào ống nghiệm.
(3) Đun nóng dung dịch chứa phức chất xanh thẫm trong ống nghiệm.
(4) Cho vào ống nghiệm khoảng dung dịch NaOH 10% và dung dịch CuSO4 5%, lắc đều.
Hãy sắp xếp các bước trên với trình tự dãy bốn số theo đúng thứ tự các bước cần tiến hành (ví dụ: 1234, 4213, ...).
Thí nghiệm: Chứng minh cấu tạo của sacchorose chứa nhiều nhóm OH liền kề bằng cách cho dung dịch saccharose phản ứng với kết tủa Cu(OH)2. Các bước thực hiện như sau:
Bước 1: Cho vào ống nghiệm khoảng 2 ml dung dịch NaOH 10% và 0,5 ml dung dịch CuSO4 5%, lắc đều → ứng với (4).
Bước 2: Lọc lấy kết tủa Cu(OH)2 màu xanh rồi cho vào ống nghiệm → ứng với (2).
Bước 3: Thêm vào ống nghiệm chứa kết tủa dung dịch saccharose 3%, lắc đều đến khi thu được dung dịch đồng nhất → ứng với (1).
Bước 4: Đun nóng dung dịch chứa phức chất xanh thẫm trong ống nghiệm → ứng với (1)
⇒ Điền đáp án: 4213
Bước 1: Cho vào ống nghiệm khoảng 2 ml dung dịch NaOH 10% và 0,5 ml dung dịch CuSO4 5%, lắc đều → ứng với (4).
Bước 2: Lọc lấy kết tủa Cu(OH)2 màu xanh rồi cho vào ống nghiệm → ứng với (2).
Bước 3: Thêm vào ống nghiệm chứa kết tủa dung dịch saccharose 3%, lắc đều đến khi thu được dung dịch đồng nhất → ứng với (1).
Bước 4: Đun nóng dung dịch chứa phức chất xanh thẫm trong ống nghiệm → ứng với (1)
⇒ Điền đáp án: 4213
Câu 7 [705452]: Một nhóm học sinh tiến hành thí nghiệm thủy phân hoàn toàn tinh bột để điều chế glucose, sau đó thử tính chất của glucose bằng thuốc thử Fehling. Do quá trình không xảy ra các hiện tượng có thể quan sát nên để biết tiến trình của phản ứng thủy phân có thể sử dụng thêm iodine làm chất nhận biết. Các bước trong thí nghiệm này như sau:
(1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
(2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
(3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
(4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
Hãy sắp xếp số thứ tự các bước theo trình tự thành dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4213, ...).
(1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
(2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
(3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
(4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
Hãy sắp xếp số thứ tự các bước theo trình tự thành dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4213, ...).
Các bước trong thí nghiệm này như sau:
⭐Bước 1: Chuẩn bị dung dịch hồ tinh bột và H2SO4, sau đó đun nóng để thủy phân tinh bột thành glucose. Đây là bước khởi đầu.
⟶ (2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
⭐Bước 2: Kiểm tra tiến trình thủy phân bằng cách lấy một ít dung dịch và nhỏ vào ống nghiệm chứa iodine. Nếu còn tinh bột, dung dịch sẽ có màu xanh tím; nếu đã thủy phân hoàn toàn, màu sẽ nhạt dần và mất hẳn.
⟶ (1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
⭐Bước 3: Khi dung dịch đã thủy phân hoàn toàn, lấy một phần dung dịch và trung hòa bằng NaOH để tạo môi trường kiềm, cần thiết trước khi thực hiện phản ứng với Fehling.
⟶ (4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
⭐Bước 4: Thử tính chất của glucose bằng thuốc thử Fehling (trộn với CuSO4 và đun nóng để quan sát kết tủa đỏ gạch của Cu2O nếu có glucose).
⟶ (3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
Vậy thứ tự tiến hành các bước là: 2143
⇒ Điền đáp án: 2143
⭐Bước 1: Chuẩn bị dung dịch hồ tinh bột và H2SO4, sau đó đun nóng để thủy phân tinh bột thành glucose. Đây là bước khởi đầu.
⟶ (2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
⭐Bước 2: Kiểm tra tiến trình thủy phân bằng cách lấy một ít dung dịch và nhỏ vào ống nghiệm chứa iodine. Nếu còn tinh bột, dung dịch sẽ có màu xanh tím; nếu đã thủy phân hoàn toàn, màu sẽ nhạt dần và mất hẳn.
⟶ (1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
⭐Bước 3: Khi dung dịch đã thủy phân hoàn toàn, lấy một phần dung dịch và trung hòa bằng NaOH để tạo môi trường kiềm, cần thiết trước khi thực hiện phản ứng với Fehling.
⟶ (4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
⭐Bước 4: Thử tính chất của glucose bằng thuốc thử Fehling (trộn với CuSO4 và đun nóng để quan sát kết tủa đỏ gạch của Cu2O nếu có glucose).
⟶ (3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
Vậy thứ tự tiến hành các bước là: 2143
⇒ Điền đáp án: 2143
Câu 8 [704311]: Các kim loại kiềm có khả năng tác dụng mãnh liệt với oxygen có mặt trong không khí và càng mạnh hơn đối với oxygen tinh khiết. Một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng với ba kim loại kiềm: lithium (Li), sodium (Na) và potassium (K) như sau:
(1) Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại sẽ tác dụng với oxygen trong không khí.
(2) Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
(3) Đưa nhanh muỗng chứa kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
(4) Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su).
Hãy sắp xếp số thứ tự các bước để thực hiện thí nghiệm theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
(1) Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại sẽ tác dụng với oxygen trong không khí.
(2) Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
(3) Đưa nhanh muỗng chứa kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
(4) Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su).
Hãy sắp xếp số thứ tự các bước để thực hiện thí nghiệm theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
Các bước kiểm chứng khả năng tác dụng của kim loại kiềm với oxygen trong không khí và oxygen tinh khiết:
Bước 1: Dùng dao cắt các mẫu kim loại to bằng hạt đậu → ứng với (2)
Bước 2: Dùng kẹp lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua 1 nút cao su) → ứng với (4)
Bước 3: Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại tác dụng được với oxygen trong không khí. → ứng với (1)
Bước 4: Đưa nhanh muỗng chứa các kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. → ứng với (3)
⇒ Điền đáp án: 2413
Bước 1: Dùng dao cắt các mẫu kim loại to bằng hạt đậu → ứng với (2)
Bước 2: Dùng kẹp lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua 1 nút cao su) → ứng với (4)
Bước 3: Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại tác dụng được với oxygen trong không khí. → ứng với (1)
Bước 4: Đưa nhanh muỗng chứa các kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. → ứng với (3)
⇒ Điền đáp án: 2413
Câu 9 [702824]: Saccharose được sản xuất từ cây mía, củ cải đường hoặc hoa thốt nốt. Ở Việt Nam, cây mía được thu hoạch được đem đi để ép lấy nước mía (chứa khoảng 12 – 15 % đường).
Sau đó, cần tiến hành các bước tiếp theo như sau:
(1) Sục khí CO2 vào dung dịch muối, kết tủa CaCO3 tách ra, loại bỏ kết tủa và thu được dung dịch chứa đường saccharose độ tinh khiết cao.
(2) Dung dịch đường saccharose độ tinh khiết cao có màu nên được sục khí SO2 để tẩy màu.
(3) Thêm vôi sữa (thành phần chính Ca(OH)2) vào nước mía để chuyển saccharose thành dung dịch muối C12H22O11.CaO.H2O và loại bỏ phần tạp chất không tan.
(4) Dung dịch đường saccharose độ tinh khiết cao, không màu được cô đặc để kết tinh thu được đường kính.
Hãy sắp xếp các bước trên theo đúng quy trình sản xuất saccharose từ cây mía với trình tự dãy bốn số (ví dụ: 2345, 5324, ...).
Sau đó, cần tiến hành các bước tiếp theo như sau:
(1) Sục khí CO2 vào dung dịch muối, kết tủa CaCO3 tách ra, loại bỏ kết tủa và thu được dung dịch chứa đường saccharose độ tinh khiết cao.
(2) Dung dịch đường saccharose độ tinh khiết cao có màu nên được sục khí SO2 để tẩy màu.
(3) Thêm vôi sữa (thành phần chính Ca(OH)2) vào nước mía để chuyển saccharose thành dung dịch muối C12H22O11.CaO.H2O và loại bỏ phần tạp chất không tan.
(4) Dung dịch đường saccharose độ tinh khiết cao, không màu được cô đặc để kết tinh thu được đường kính.
Hãy sắp xếp các bước trên theo đúng quy trình sản xuất saccharose từ cây mía với trình tự dãy bốn số (ví dụ: 2345, 5324, ...).
Quy trình để sản xuất saccharose từ cây mía sau khi ép lấy nước mía (chứa khoảng 12-15% đường) như sau:
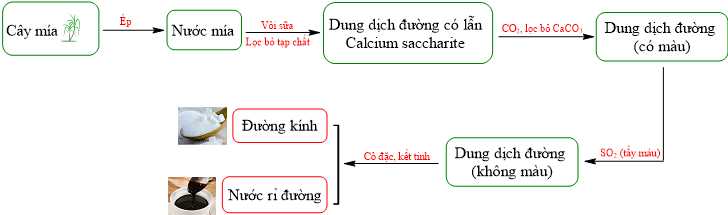
Bước 1: Thêm vôi sữa (thành phần chính Ca(OH)2) vào nước mía để chuyển saccharose thành dung dịch muối C12H22O11.CaO.H2O và loại bỏ phần tạp chất không tan.
Bước 2: Sục khí CO2 vào dung dịch muối, kết tủa CaCO3 tách ra, loại bỏ kết tủa và thu được dung dịch chứa đường saccharose độ tinh khiết cao.
Bước 3: Dung dịch đường saccharose độ tinh khiết cao có màu nên được sục khí SO2 để tẩy màu.
Bước 4: Dung dịch đường saccharose độ tinh khiết cao, không màu được cô đặc để kết tinh thu được đường kính.
⇒ Điền đáp án: 3124

Bước 1: Thêm vôi sữa (thành phần chính Ca(OH)2) vào nước mía để chuyển saccharose thành dung dịch muối C12H22O11.CaO.H2O và loại bỏ phần tạp chất không tan.
Bước 2: Sục khí CO2 vào dung dịch muối, kết tủa CaCO3 tách ra, loại bỏ kết tủa và thu được dung dịch chứa đường saccharose độ tinh khiết cao.
Bước 3: Dung dịch đường saccharose độ tinh khiết cao có màu nên được sục khí SO2 để tẩy màu.
Bước 4: Dung dịch đường saccharose độ tinh khiết cao, không màu được cô đặc để kết tinh thu được đường kính.
⇒ Điền đáp án: 3124
Câu 10 [861085]: Cho kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 sau:
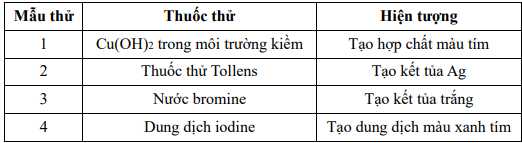
Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Điền đáp án: [..........]

Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Điền đáp án: [..........]
Mẫu thử 1: Tác dụng với Cu(OH)2 tạo hợp chất màu tím . Phản ứng màu biuret.
⟶ Mẫu thử 1 là: Gly–Gly–Ala.
Mẫu thử 2: Glucose phản ứng với thuốc thử Tollens thu được kết tủa Ag.
Phương trình phản ứng: C6H12O6 + 2[Ag(NH3)2]OH CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
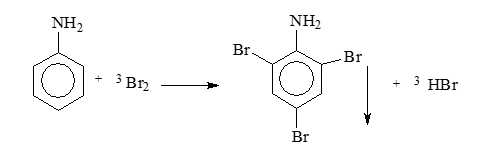
Mẫu thử 3: Aniline tác dụng với nước Bromine tạo kết tủa trắng.
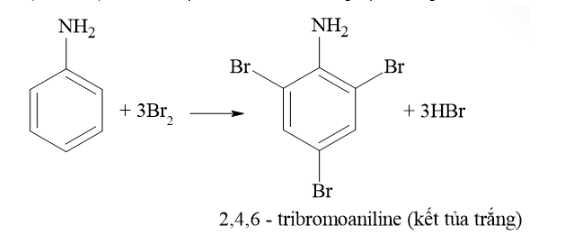
Mẫu thử 4: Hồ tinh bột tác dụng với dung dịch iodine tạo dung dịch màu xanh tím đặc trưng.
Số thứ tự các mẫu thử trên ứng với các chất là: (1)Gly–Gly–Ala; (3) Glucose, (4) aniline, (2) hồ tinh bột.
⟹ Điền đáp án 1342
⟶ Mẫu thử 1 là: Gly–Gly–Ala.
Mẫu thử 2: Glucose phản ứng với thuốc thử Tollens thu được kết tủa Ag.
Phương trình phản ứng: C6H12O6 + 2[Ag(NH3)2]OH
 CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O. Mẫu thử 3: Aniline tác dụng với nước Bromine tạo kết tủa trắng.

Mẫu thử 4: Hồ tinh bột tác dụng với dung dịch iodine tạo dung dịch màu xanh tím đặc trưng.
Số thứ tự các mẫu thử trên ứng với các chất là: (1)Gly–Gly–Ala; (3) Glucose, (4) aniline, (2) hồ tinh bột.
⟹ Điền đáp án 1342
Câu 11 [704015]: Kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 với thuốc thử được ghi lại ở bảng sau:
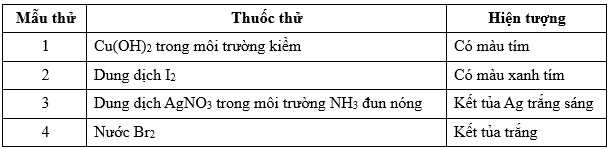
Gán số thứ tự các mẫu thử trên ứng với các chất: hồ tinh bột, lòng trắng trứng, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự các mẫu thử trên ứng với các chất: hồ tinh bột, lòng trắng trứng, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
⭐ Mẫu thử 1 là lòng trắng trứng chứa nhiều protein nên có phản ứng màu biuret của protein với Cu(OH)2/OH-.
⭐ Mẫu thử 2 là hồ tinh bột có phản ứng với dung dịch I2 thu được dung dịch có màu xanh tím đặc trưng.
⭐ Mẫu thử 3 là glucose phản ứng với AgNO3/NH3 thu được được kết tủa Ag: C6H12O6 + 2AgNO3 + 3NH3 + H2O → CH2OH(CHOH)4COONH4 + 2Ag + 2NH4NO3
⭐ Mẫu thử 4 là aniline phản ứng với dung dịch Br2 thu được kết tủa trắng.
Số thứ tự các mẫu thử trên ứng với các chất là: hồ tinh bột (2), lòng trắng trứng (1), glucose (3), aniline (4).
⇒ Điền đáp án: 2134
⭐ Mẫu thử 2 là hồ tinh bột có phản ứng với dung dịch I2 thu được dung dịch có màu xanh tím đặc trưng.
⭐ Mẫu thử 3 là glucose phản ứng với AgNO3/NH3 thu được được kết tủa Ag: C6H12O6 + 2AgNO3 + 3NH3 + H2O → CH2OH(CHOH)4COONH4 + 2Ag + 2NH4NO3
⭐ Mẫu thử 4 là aniline phản ứng với dung dịch Br2 thu được kết tủa trắng.
Số thứ tự các mẫu thử trên ứng với các chất là: hồ tinh bột (2), lòng trắng trứng (1), glucose (3), aniline (4).
⇒ Điền đáp án: 2134
Câu 12 [706355]: Cho các mẫu chất và dán nhãn tương ứng như sau: Methylammonium nitrate (1), saccharose (2), phenylammonium chloride (3), tinh bột (4). Tiến hành thí nghiệm với dung dịch X, Y, Z và T. Kết quả được ghi ở bảng:
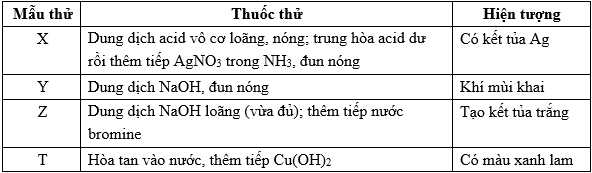
Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
Mẫu thử X: Dung dịch acid vô cơ loãng, nóng; trung hòa acid du rồi thêm tiếp AgNO3 trong NH3, đun nóng thu được kết tủ Ag
→ Mẫu thử X là tinh bột (4)
Phản ứng thủy phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x (x < n) và maltose. Sản phẩm cuối cùng là glucose.
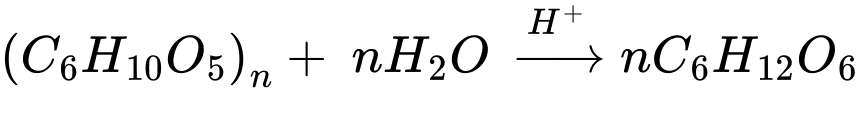
Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
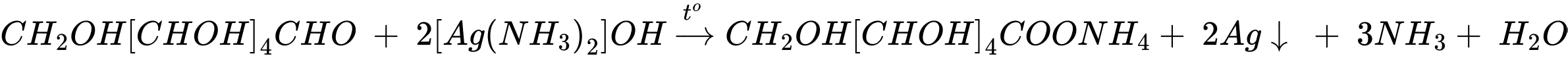
Mẫu thử Y: Dung dịch NaOH, đun nóng sinh ra khí có mùi khai
→ Mẫu thử Y là methylammonium nitrate (1)
CH3NH3NO3 + NaOH → CH3NH2 + NaNO3 + H2O
Mẫu thử Z: Dung dịch NaOH loãng (vừa đủ); thêm tiếp nước bromine tạo kết tủa trắng
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
→ Mẫu thử Z là phenylammonium chloride (3)
Mẫu thử T: Hòa tan vào nước, thêm tiếp Cu(OH)2 thu được dung dịch màu xanh lam
→ mẫu thử T là saccharose (2)
Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
⟹ Điền đáp án : 4132
→ Mẫu thử X là tinh bột (4)
Phản ứng thủy phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x (x < n) và maltose. Sản phẩm cuối cùng là glucose.
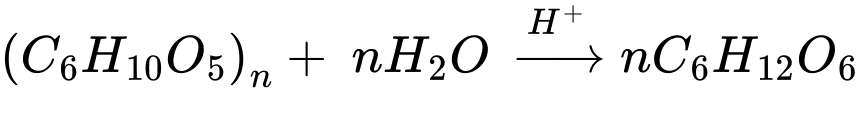
Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
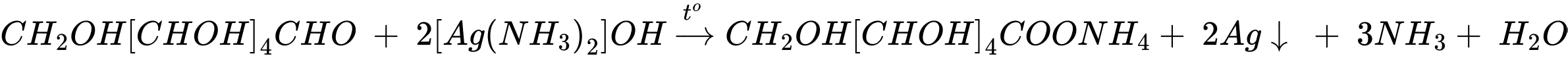
Mẫu thử Y: Dung dịch NaOH, đun nóng sinh ra khí có mùi khai
→ Mẫu thử Y là methylammonium nitrate (1)
CH3NH3NO3 + NaOH → CH3NH2 + NaNO3 + H2O
Mẫu thử Z: Dung dịch NaOH loãng (vừa đủ); thêm tiếp nước bromine tạo kết tủa trắng
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O

→ Mẫu thử Z là phenylammonium chloride (3)
Mẫu thử T: Hòa tan vào nước, thêm tiếp Cu(OH)2 thu được dung dịch màu xanh lam
→ mẫu thử T là saccharose (2)
Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
⟹ Điền đáp án : 4132
Câu 13 [706339]: Cho các mẫu chất và dán nhãn tương ứng như sau: Ammonium formate (1), lysine (2), fructose (3), aniline (4). Tiến hành thí nghiệm với dung dịch X, Y, Z và T. Kết quả được ghi ở bảng:

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)

Gán nhãn dán các chất tương ứng với hiện tượng của dung dịch X, Y, Z, T theo trình tự dãy bốn số (ví dụ: 1234, 4213, ...)
Mẫu thử Z: tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam
Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ Z là fructose (3)
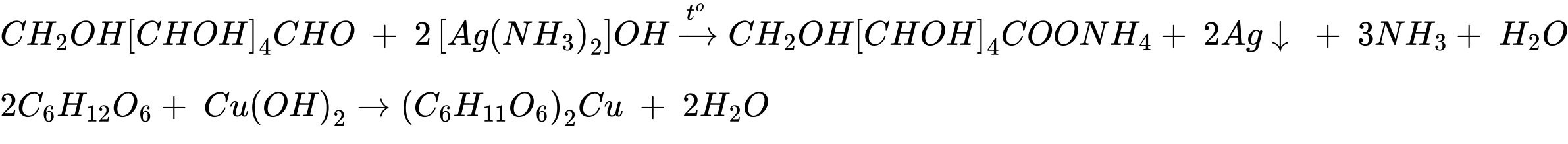
Mẫu thử X: Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ X là ammonium formate (1)
6HCOONH4 + 10AgNO3 + 11NH3 → 10Ag + 12NH4NO3 + 3CHCOONH4
Mẫu thử Y làm quì tím chuyển xanh
→ Y là lysine (2)
Mẫu thử T: Aniline + nước bromine
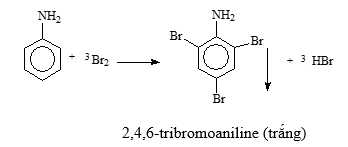
=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine → ứng với aniline (4)
⟹ Điền đáp án : 1234
Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ Z là fructose (3)
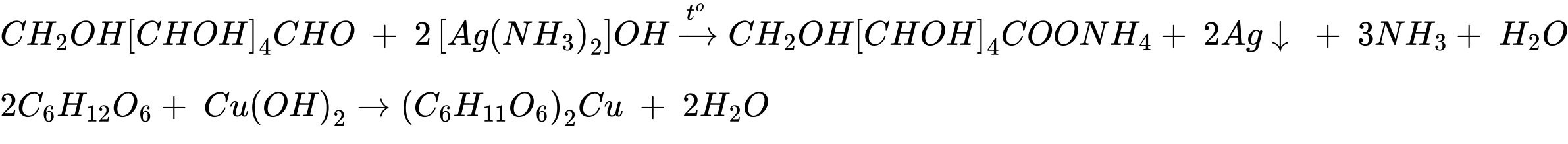
Mẫu thử X: Tác dụng với dung dịch AgNO3/NH3 xuất hiện kết tủa Ag
→ X là ammonium formate (1)
6HCOONH4 + 10AgNO3 + 11NH3 → 10Ag + 12NH4NO3 + 3CHCOONH4
Mẫu thử Y làm quì tím chuyển xanh
→ Y là lysine (2)
Mẫu thử T: Aniline + nước bromine

=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine → ứng với aniline (4)
⟹ Điền đáp án : 1234
Câu 14 [703021]: Dung dịch glucose ở dạng mạch hở có chứa nhóm aldehyde CHO nên có thể phản ứng oxi hóa khử với Cu(OH)2, các bước tiến hành thí nghiệm như sau:
▪ Bước 1: Chuẩn bị hai ống nghiệm có đánh số (1) và (2); thêm vào mỗi ống nghiệm khoảng 0,5 – 1,0 mL dung dịch CuSO4 5% và 1 mL dung dịch NaOH 10%, lắc nhẹ.
▪ Bước 2: Cho 3 mL dung dịch glucose 2% vào mỗi ống nghiệm, lắc nhẹ.
▪ Bước 3: Đun nhẹ ống (2) đến khi hoá chất trong ống nghiệm đổi màu hoàn toàn.
Cho các phương trình hóa học như sau:
(1) CuSO4 + 2NaOH Cu(OH)2↓ + Na2SO4.
Cu(OH)2↓ + Na2SO4.
(2) Cu(OH)2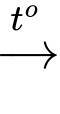 Cu2O.
Cu2O.
(3) 2C6H12O6 + Cu(OH)2 Cu(C6H11O6)2 + 2H2O.
Cu(C6H11O6)2 + 2H2O.
(4) C6H12O6 + 2Cu(OH)2 + NaOH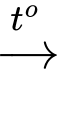 C5H11COONa + Cu2O↓ + 3H2O.
C5H11COONa + Cu2O↓ + 3H2O.
(5) 2C6H12O6 + O2 2C6H12O7.
2C6H12O7.
Hãy sắp xếp các phương trình hóa học dùng để giải thích cho các bước theo đúng thứ tự trong thí nghiệm trên (ví dụ: 123, 135, ...).
▪ Bước 1: Chuẩn bị hai ống nghiệm có đánh số (1) và (2); thêm vào mỗi ống nghiệm khoảng 0,5 – 1,0 mL dung dịch CuSO4 5% và 1 mL dung dịch NaOH 10%, lắc nhẹ.
▪ Bước 2: Cho 3 mL dung dịch glucose 2% vào mỗi ống nghiệm, lắc nhẹ.
▪ Bước 3: Đun nhẹ ống (2) đến khi hoá chất trong ống nghiệm đổi màu hoàn toàn.
Cho các phương trình hóa học như sau:
(1) CuSO4 + 2NaOH
 Cu(OH)2↓ + Na2SO4.
Cu(OH)2↓ + Na2SO4.(2) Cu(OH)2
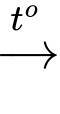 Cu2O.
Cu2O.(3) 2C6H12O6 + Cu(OH)2
 Cu(C6H11O6)2 + 2H2O.
Cu(C6H11O6)2 + 2H2O.(4) C6H12O6 + 2Cu(OH)2 + NaOH
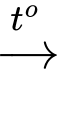 C5H11COONa + Cu2O↓ + 3H2O.
C5H11COONa + Cu2O↓ + 3H2O.(5) 2C6H12O6 + O2
 2C6H12O7.
2C6H12O7.Hãy sắp xếp các phương trình hóa học dùng để giải thích cho các bước theo đúng thứ tự trong thí nghiệm trên (ví dụ: 123, 135, ...).
Các bước tiến hành thí nghiệm phản ứng oxi hóa khử của dung dịch glucose ở dạng mạch hở với Cu(OH)2 như sau:
Bước 1: Phản ứng tạo kết tủa Cu(OH)2
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
Bước 2: Tính chất của polyalcohol qua phản ứng của glucose với Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam.
Cu(OH)2 + 2C6H12O6 → [C6H11O6]2Cu + 2H2O
Bước 3: Đun nhẹ ống (2) thì xuất hiện kết tủa màu đỏ gạch, tính oxi hóa của glucose.
C6H12O6 + 2Cu(OH)2 + NaOH → C5H11O5COONa + Cu2O + 3H2O
→ Các phương trình hóa học xảy ra theo đúng thức tự các bước thí nghiệm là: 1→3→4.
⇒ Điền đáp án: 134
Bước 1: Phản ứng tạo kết tủa Cu(OH)2
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
Bước 2: Tính chất của polyalcohol qua phản ứng của glucose với Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam.
Cu(OH)2 + 2C6H12O6 → [C6H11O6]2Cu + 2H2O
Bước 3: Đun nhẹ ống (2) thì xuất hiện kết tủa màu đỏ gạch, tính oxi hóa của glucose.
C6H12O6 + 2Cu(OH)2 + NaOH → C5H11O5COONa + Cu2O + 3H2O
→ Các phương trình hóa học xảy ra theo đúng thức tự các bước thí nghiệm là: 1→3→4.
⇒ Điền đáp án: 134
Câu 15 [830067]: Cho các phản ứng được đánh số thứ từ 1 tới 5 dưới đây:
(1) Glucose phản ứng thuốc thử Tollens.
(2) Glucose phản ứng với nước bromine.
(3) Glucose phản ứng với methanol khi có mặt HCl khan xúc tác.
(4) Cellulose phản ứng với HNO3 đặc có mặt H2SO4 đặc, đun nóng.
(5) Saccharose thủy phân trong môi trường acid.
Hãy liệt kê các phản ứng oxi hóa - khử theo số thứ tự tăng dần?
(1) Glucose phản ứng thuốc thử Tollens.
(2) Glucose phản ứng với nước bromine.
(3) Glucose phản ứng với methanol khi có mặt HCl khan xúc tác.
(4) Cellulose phản ứng với HNO3 đặc có mặt H2SO4 đặc, đun nóng.
(5) Saccharose thủy phân trong môi trường acid.
Hãy liệt kê các phản ứng oxi hóa - khử theo số thứ tự tăng dần?
Phương trình phản ứng:
(1) Glucose phản ứng thuốc thử Tollens.
CH2OH[CHOH]4CHO + 2[Ag(NH3)2]OH 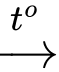 CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O.
CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O.
(2) Glucose phản ứng với nước bromine.
OHCH2(CHOH)4CHO + Br2 + H2O → OHCH2(CHOH)4COOH + 2HBr
(3) Glucose phản ứng với methanol khi có mặt HCl khan xúc tác.
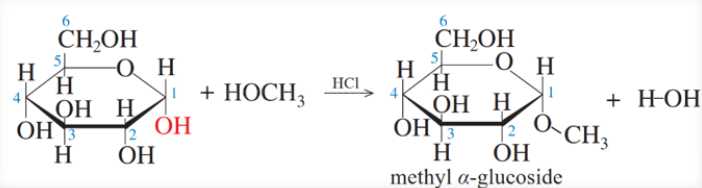
(4) Cellulose phản ứng với HNO3 đặc có mặt H2SO4 đặc, đun nóng.
[C6H7O2(OH)3]n + 2nHNO3 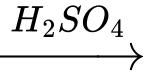 [C6H7O2(OH)(ONO2)2]n + 2nH2O.
[C6H7O2(OH)(ONO2)2]n + 2nH2O.
(5) Saccharose thủy phân trong môi trường acid.
C12H22O11+ H2O  C6H12O6+ C6H12O6.
C6H12O6+ C6H12O6.
Các phản ứng oxi hóa - khử theo thứ 4 tăng dần là: (1) < (2) < (4) .
⟹Điền đáp án : 124
Câu 16 [830070]: Để tìm hiểu về sự ăn mòn kim loại. Một nhóm học sinh đã thực hiện 5 thí nghiệm sau
▪ Thí nghiệm 1: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 2: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M nhỏ thêm vài giọt dung dịch CuSO4.
▪ Thí nghiệm 3: Cho một dây bạc sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 4: Cho một dây Cu được quấn bởi dây Zinc (Zn) vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 5: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch CuSO4 0,2 M.
Liệt kê các thí nghiệm xuất hiện ăn mòn điện hóa theo thứ tự tăng dần (Ví dụ 123,1234,...).
▪ Thí nghiệm 1: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 2: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M nhỏ thêm vài giọt dung dịch CuSO4.
▪ Thí nghiệm 3: Cho một dây bạc sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 4: Cho một dây Cu được quấn bởi dây Zinc (Zn) vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
▪ Thí nghiệm 5: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch CuSO4 0,2 M.
Liệt kê các thí nghiệm xuất hiện ăn mòn điện hóa theo thứ tự tăng dần (Ví dụ 123,1234,...).
Thí nghiệm 1: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
Zn tác dụng với HCl tạo ra khí H2 và ZnCl2. Đây là ăn mòn hóa học, vì Zn trực tiếp phản ứng với acid.
Zn + 2HCl ⟶ ZnCl2 + H2.
Thí nghiệm 2: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M nhỏ thêm vài giọt dung dịch CuSO4.
Khi thêm CuSO4, xảy ra phản ứng thế giữa Zn và CuSO4 tạo ra Cu bám trên bề mặt Zn ⟶ xảy ra ăn mòn điện hóa
Zn + CuSO4 ⟶ ZnSO4 + Cu.
Thí nghiệm 3: Cho một dây bạc sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M. Ag kém hoạt đông hóa học hơn H nên không tác dụng với dung dịch HCl.
Thí nghiệm 4: Cho một dây Cu được quấn bởi dây Zinc (Zn) vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
Dây Cu quấn dây Zn tạo thành pin điện hóa. Trong môi trường HCl, Zn là anode (bị ăn mòn) và Cu là cathode ⟶ xảy ra ăn mòn điện hóa.
Thí nghiệm 5: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch CuSO4 0,2 M.
Zn hoạt động hóa học mạnh hơn Cu, nên xảy ra phản ứng
Zn + CuSO4 ⟶ ZnSO4 + Cu.
⟶ Xảy ra ăn mòn điện hóa.
Thứ tự các thí nghiệm xuất hiện ăn mòn điện hóa là: 245
⟹ Điền đáp án 245
Zn tác dụng với HCl tạo ra khí H2 và ZnCl2. Đây là ăn mòn hóa học, vì Zn trực tiếp phản ứng với acid.
Zn + 2HCl ⟶ ZnCl2 + H2.
Thí nghiệm 2: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M nhỏ thêm vài giọt dung dịch CuSO4.
Khi thêm CuSO4, xảy ra phản ứng thế giữa Zn và CuSO4 tạo ra Cu bám trên bề mặt Zn ⟶ xảy ra ăn mòn điện hóa
Zn + CuSO4 ⟶ ZnSO4 + Cu.
Thí nghiệm 3: Cho một dây bạc sạch vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M. Ag kém hoạt đông hóa học hơn H nên không tác dụng với dung dịch HCl.
Thí nghiệm 4: Cho một dây Cu được quấn bởi dây Zinc (Zn) vào ống nghiệm chứa 2 mL dung dịch HCl 0,2 M.
Dây Cu quấn dây Zn tạo thành pin điện hóa. Trong môi trường HCl, Zn là anode (bị ăn mòn) và Cu là cathode ⟶ xảy ra ăn mòn điện hóa.
Thí nghiệm 5: Cho một dây Zinc (Zn) sạch vào ống nghiệm chứa 2 mL dung dịch CuSO4 0,2 M.
Zn hoạt động hóa học mạnh hơn Cu, nên xảy ra phản ứng
Zn + CuSO4 ⟶ ZnSO4 + Cu.
⟶ Xảy ra ăn mòn điện hóa.
Thứ tự các thí nghiệm xuất hiện ăn mòn điện hóa là: 245
⟹ Điền đáp án 245
Câu 17 [830072]: Cho ba mẫu kim loại X, Y và Z:
(a) Cho X vào dung dịch muối của Y thấy bề mặt X đổi màu, có kim loại mới bám vào.
(b) Cho Y vào dung dịch HCl thấy có bọt khí tạo thành trên bề mặt Y.
(c) Cho X vào dung dịch muối của Z không thấy hiện tượng xảy ra.
(d) Cho Z vào nước thu được sản phẩm gồm chất khí và dung dịch chứa chất tan.
Cho các phát biểu sau:
(1) Các kim loại X, Y, Z đều đứng trước hydrogen trong dãy điện hoá.
(2) Kim loại Z khử được ion của kim loại Y trong dung dịch.
(3) Dãy sắp xếp theo chiều giảm dần tính khử là Z, Y, X.
(4) Kim loại Z khử được ion H+ tạo thành H2.
Hãy liệt kê các phát biểu đúng theo thứ tự tăng dần (ví dụ: 12 hoặc 234,...)
(a) Cho X vào dung dịch muối của Y thấy bề mặt X đổi màu, có kim loại mới bám vào.
(b) Cho Y vào dung dịch HCl thấy có bọt khí tạo thành trên bề mặt Y.
(c) Cho X vào dung dịch muối của Z không thấy hiện tượng xảy ra.
(d) Cho Z vào nước thu được sản phẩm gồm chất khí và dung dịch chứa chất tan.
Cho các phát biểu sau:
(1) Các kim loại X, Y, Z đều đứng trước hydrogen trong dãy điện hoá.
(2) Kim loại Z khử được ion của kim loại Y trong dung dịch.
(3) Dãy sắp xếp theo chiều giảm dần tính khử là Z, Y, X.
(4) Kim loại Z khử được ion H+ tạo thành H2.
Hãy liệt kê các phát biểu đúng theo thứ tự tăng dần (ví dụ: 12 hoặc 234,...)
Phân tích các thí nghiệm:
(a) Cho X vào dung dịch muối của Y thấy bề mặt X đổi màu, có kim loại mới bám vào. Chứng tỏ X đẩy Y ra khỏi dung dịch muối của nó. Suy ra tính khử của X mạnh hơn Y: X > Y
(b) Cho Y vào dung dịch HCl thấy có bọt khí tạo thành trên bề mặt Y.Chứng tỏ Y phản ứng với HCl giải phóng khí H2. Vậy, Y đứng trước H trong dãy điện hóa: Y > H. Phương trình phản ứng: Y + HCl ⟶ Y(Cl)n + H2
(c) Cho X vào dung dịch muối của Z không thấy hiện tượng xảy ra. Chứng tỏ X không đẩy được Z ra khỏi dung dịch muối của nó. Suy ra tính khử của Z mạnh hơn hoặc bằng X: Z ≥ X.
(d) Cho Z vào nước thu sản phẩm gồm chất khí và dung dịch chứa chất tan. Điều này cho thấy Z phản ứng với nước. Các kim loại kiềm và kiềm thổ (trừ Be và Mg) có phản ứng với nước ở điều kiện thường. Chứng tỏ Z có tính khử mạnh và đứng trước H trong dãy điện hóa: Z>H.
Từ các thí nghiệm, ta có thể suy ra thứ tự tính khử ban đầu: Z ≥ X > Y > H. Kết hợp với Z>H, ta có dãy tính khử: Z ≥ X > Y.
Phân tích các phát biểu:
✔️ (1). Đúng. Các kim loại X, Y, Z đều đứng trước hydrogen trong dãy điện hóa.
✔️ (2). Đúng. Kim loại Z khử được ion của kim loại Y trong dung dịch. Vì Z ≥ X > Y, Z có tính khử mạnh hơn Y, nên Z sẽ đẩy được Y ra khỏi dung dịch muối của Y.
❌ (3). Sai. Dãy sắp xếp theo chiều giảm dần tính khử là Z, Y, X. Dãy tính khử của các kim loại là Z ≥ X >Y. X có tính khử mạnh hơn Y.
✔️ (4). Đúng. Kim loại Z khử được ion H+ tạo thành H2. Từ thí nghiệm (d), Z phản ứng với nước tạo khí, chứng tỏ Z có khả năng phản ứng với acid để giải phóng H2.
Các phát biểu đúng theo thứ tự tăng dần là: 124.
⟹ Điền đáp án 124
(a) Cho X vào dung dịch muối của Y thấy bề mặt X đổi màu, có kim loại mới bám vào. Chứng tỏ X đẩy Y ra khỏi dung dịch muối của nó. Suy ra tính khử của X mạnh hơn Y: X > Y
(b) Cho Y vào dung dịch HCl thấy có bọt khí tạo thành trên bề mặt Y.Chứng tỏ Y phản ứng với HCl giải phóng khí H2. Vậy, Y đứng trước H trong dãy điện hóa: Y > H. Phương trình phản ứng: Y + HCl ⟶ Y(Cl)n + H2
(c) Cho X vào dung dịch muối của Z không thấy hiện tượng xảy ra. Chứng tỏ X không đẩy được Z ra khỏi dung dịch muối của nó. Suy ra tính khử của Z mạnh hơn hoặc bằng X: Z ≥ X.
(d) Cho Z vào nước thu sản phẩm gồm chất khí và dung dịch chứa chất tan. Điều này cho thấy Z phản ứng với nước. Các kim loại kiềm và kiềm thổ (trừ Be và Mg) có phản ứng với nước ở điều kiện thường. Chứng tỏ Z có tính khử mạnh và đứng trước H trong dãy điện hóa: Z>H.
Từ các thí nghiệm, ta có thể suy ra thứ tự tính khử ban đầu: Z ≥ X > Y > H. Kết hợp với Z>H, ta có dãy tính khử: Z ≥ X > Y.
Phân tích các phát biểu:
✔️ (1). Đúng. Các kim loại X, Y, Z đều đứng trước hydrogen trong dãy điện hóa.
✔️ (2). Đúng. Kim loại Z khử được ion của kim loại Y trong dung dịch. Vì Z ≥ X > Y, Z có tính khử mạnh hơn Y, nên Z sẽ đẩy được Y ra khỏi dung dịch muối của Y.
❌ (3). Sai. Dãy sắp xếp theo chiều giảm dần tính khử là Z, Y, X. Dãy tính khử của các kim loại là Z ≥ X >Y. X có tính khử mạnh hơn Y.
✔️ (4). Đúng. Kim loại Z khử được ion H+ tạo thành H2. Từ thí nghiệm (d), Z phản ứng với nước tạo khí, chứng tỏ Z có khả năng phản ứng với acid để giải phóng H2.
Các phát biểu đúng theo thứ tự tăng dần là: 124.
⟹ Điền đáp án 124
Câu 18 [830075]: Cho các cặp oxi hoá – khử và giá trị thế điện cực chuẩn tương ứng:

Cho các phát biểu sau: Ở điều kiện chuẩn:
(1) Ion Cu2+ có tính oxi hoá mạnh hơn ion Fe3+.
(2) Dãy sắp xếp theo chiều tăng dần tính khử: Ag, Cu, Fe2+.
(3) Ion Fe2+ khử được ion Ag+ thành Ag kim loại.
(4) Ion Fe3+ và ion Ag+ đều oxi hoá được Cu thành ion Cu2+.
Viết số thứ tự của các phát biểu đúng theo thứ tự tăng dần từ trái sang phải (ví dụ: 12 hoặc 123 hoặc 23,...)

Cho các phát biểu sau: Ở điều kiện chuẩn:
(1) Ion Cu2+ có tính oxi hoá mạnh hơn ion Fe3+.
(2) Dãy sắp xếp theo chiều tăng dần tính khử: Ag, Cu, Fe2+.
(3) Ion Fe2+ khử được ion Ag+ thành Ag kim loại.
(4) Ion Fe3+ và ion Ag+ đều oxi hoá được Cu thành ion Cu2+.
Viết số thứ tự của các phát biểu đúng theo thứ tự tăng dần từ trái sang phải (ví dụ: 12 hoặc 123 hoặc 23,...)
Phân tích các phát biểu:
❌a. Sai. Thế điện cực chuẩn của cặp Fe3+/Fe (+0,771) cao hơn thế điện cực chuẩn của Cu2+/Cu (+0,34). Điều này có nghĩa Fe3+ có xu hướng nhận electron mạnh hơn Cu2+ do đó Fe3+ là chất oxi hóa mạnh hơn Cu2+.
❌b. Sai. Dựa vào giá trị thế điện cực chuẩn ta có tính oxi hóa giảm dần theo thứ tự Ag+ < Fe3+ < Cu2+. Vậy tính khử của các kim loại tăng dần Fe2+ > Cu > Ag.
✔️c. Đúng. Để phản ứng xảy ra thì thế điện cực chuẩn của Ag+/Ag phải lớn hơn thế điện cực chuẩn của Fe3+/Fe2+. So sánh giá trị thế điện cực thì thế điện cực chuẩn của cặp Ag+/Ag (+0,799) lớn hơn thế điện cực chuẩn của Fe3+/Fe2+. Vậy Ion Fe2+ khử được ion Ag+ thành Ag kim loại.
✔️d. Đúng. Ion Fe3+ và ion Ag+ đều oxi hoá được Cu thành ion Cu2+ .
Các phát biểu đúng theo thứ tự tăng dần là 34.
⟹ Điền đáp án 34
❌a. Sai. Thế điện cực chuẩn của cặp Fe3+/Fe (+0,771) cao hơn thế điện cực chuẩn của Cu2+/Cu (+0,34). Điều này có nghĩa Fe3+ có xu hướng nhận electron mạnh hơn Cu2+ do đó Fe3+ là chất oxi hóa mạnh hơn Cu2+.
❌b. Sai. Dựa vào giá trị thế điện cực chuẩn ta có tính oxi hóa giảm dần theo thứ tự Ag+ < Fe3+ < Cu2+. Vậy tính khử của các kim loại tăng dần Fe2+ > Cu > Ag.
✔️c. Đúng. Để phản ứng xảy ra thì thế điện cực chuẩn của Ag+/Ag phải lớn hơn thế điện cực chuẩn của Fe3+/Fe2+. So sánh giá trị thế điện cực thì thế điện cực chuẩn của cặp Ag+/Ag (+0,799) lớn hơn thế điện cực chuẩn của Fe3+/Fe2+. Vậy Ion Fe2+ khử được ion Ag+ thành Ag kim loại.
✔️d. Đúng. Ion Fe3+ và ion Ag+ đều oxi hoá được Cu thành ion Cu2+ .
Các phát biểu đúng theo thứ tự tăng dần là 34.
⟹ Điền đáp án 34
Câu 19 [706067]: Sử dụng hình bên dưới, xác định các vùng của phổ IR mà bạn mong đợi sẽ thấy sự hấp thụ nhóm chức đặc trưng cho thứ tự lần lượt từng hợp chất sau: CH3(CH2)3NH2; CH3CHO; CH3CH2CH2OH.


1. CH3(CH2)3NH2 (Butylamine): nhóm chức amino (-NH2).
Vùng hấp thụ đặc trưng : (2) N-H: Dao động kéo giãn của N-H, xuất hiện ở vùng 3300-3500 cm-1
2. CH3CHO (Acetaldehyde): Nhóm chức aldehyde (-CHO)
Vùng hấp thụ đặc trưng: (6) C=O: Dao động kéo giãn của C=O, xuất hiện ở vùng 1700-1750 cm-1.
3. CH3CH2CH2OH (Propanol): Nhóm chức hydroxyl (-OH)
Vùng hấp thụ đặc trưng: (3) O-H: Dao động kéo giãn của O-H, xuất hiện ở vùng 3200-3600 cm-1.
Thứ tự là : (2); (6); (3).
⟹ Điền đáp án 263
Vùng hấp thụ đặc trưng : (2) N-H: Dao động kéo giãn của N-H, xuất hiện ở vùng 3300-3500 cm-1
2. CH3CHO (Acetaldehyde): Nhóm chức aldehyde (-CHO)
Vùng hấp thụ đặc trưng: (6) C=O: Dao động kéo giãn của C=O, xuất hiện ở vùng 1700-1750 cm-1.
3. CH3CH2CH2OH (Propanol): Nhóm chức hydroxyl (-OH)
Vùng hấp thụ đặc trưng: (3) O-H: Dao động kéo giãn của O-H, xuất hiện ở vùng 3200-3600 cm-1.
Thứ tự là : (2); (6); (3).
⟹ Điền đáp án 263
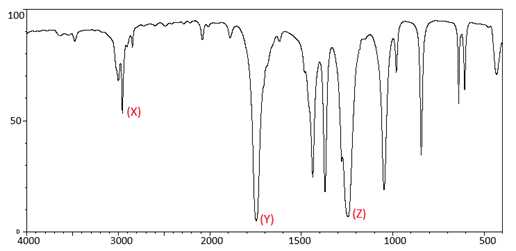
Câu 20 [830073]: Tiến hành ghi phổ hồng ngoại (IR) một hợp chất có công thức phân tử C3H6O2 thu được kết quả như sau:
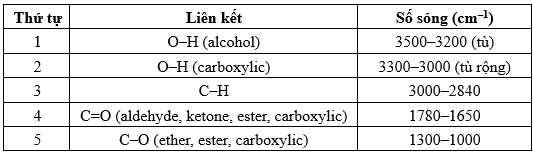
Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số liên kết như sau:

Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số liên kết như sau:

Từ phổ hồng ngoại (IR) ta có các tín hiệu này thuộc các liên kết:
- Tín hiệu tại X đặc trưng của liên kết C-H tại số sóng 3000-2840cm-1.
- Tín hiệu tại Y đặc trưng của liên kết C=O tại số sóng 1780-1650 cm-1.
- Tín hiệu Z đặc trưng của liên kết C-O tại số sóng 1300-1000 cm-1.
Các em để ý nhé: - Nếu thấy một dải rất rộng kéo từ ~3300 đến 2500 cm-1→ gần như chắc chắn là O–H acid.
- Nếu chỉ có các đỉnh sắc nét quanh ~2850–2950 cm-1 → là C–H
⟹ Điền đáp án 345
- Tín hiệu tại X đặc trưng của liên kết C-H tại số sóng 3000-2840cm-1.
- Tín hiệu tại Y đặc trưng của liên kết C=O tại số sóng 1780-1650 cm-1.
- Tín hiệu Z đặc trưng của liên kết C-O tại số sóng 1300-1000 cm-1.
Các em để ý nhé: - Nếu thấy một dải rất rộng kéo từ ~3300 đến 2500 cm-1→ gần như chắc chắn là O–H acid.
- Nếu chỉ có các đỉnh sắc nét quanh ~2850–2950 cm-1 → là C–H
⟹ Điền đáp án 345