Câu 1 [829504]: Lactic acid hay acid sữa là hợp chất hoá học đóng vai trò quan trọng trong nhiều quá trình sinh hoá. Lactic acid có công thức cấu tạo CH3–CH(OH)–COOH. Khi vận động mạnh cơ thể không đủ cung cấp năng lượng, thì cơ thể sẽ chuyển hoá glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể theo phương trình sau:
CH2OH[CHOH]5CHO(aq) → 2CH3–CH(OH)–COOH(aq);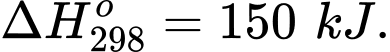
Biết rằng cơ thể chỉ cung cấp 98% năng lượng từ thực phẩm và đồ uống, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Một người chạy bộ trong một thời gian tiêu tốn 1255,2 kJ, số gam lactic acid tạo ra từ quá trình chuyển hoá của người này là bao nhiêu gam (làm tròn kết quả đến hàng phần mười)?
CH2OH[CHOH]5CHO(aq) → 2CH3–CH(OH)–COOH(aq);
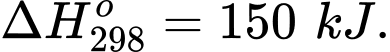
Biết rằng cơ thể chỉ cung cấp 98% năng lượng từ thực phẩm và đồ uống, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Một người chạy bộ trong một thời gian tiêu tốn 1255,2 kJ, số gam lactic acid tạo ra từ quá trình chuyển hoá của người này là bao nhiêu gam (làm tròn kết quả đến hàng phần mười)?
Phương trình phản ứng:
CH2OH[CHOH]4CHO(aq) →2CH3CH(OH)COOH(aq)
Số mol lactic acid tạo thành là nlactic acid = 1255,2.2.2% : 150 = 0,33472 mol
Khối lượng của lactic acid là mlactic acid = 0,33472.90 = 30,1 gam
⟹ Điền đáp án 30,1
CH2OH[CHOH]4CHO(aq) →2CH3CH(OH)COOH(aq)
Số mol lactic acid tạo thành là nlactic acid = 1255,2.2.2% : 150 = 0,33472 mol
Khối lượng của lactic acid là mlactic acid = 0,33472.90 = 30,1 gam
⟹ Điền đáp án 30,1
Câu 2 [830077]: Formaldehyde là một hoá chất quan trọng, có thể điều chế bằng phương pháp dehydrogen hoá methanol:
CH3OH(g)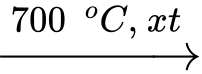 HCH=O(g) + H2(g);
HCH=O(g) + H2(g); 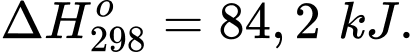 (1)
(1)
Không khí được dẫn vào hệ và sau phản ứng (1) xảy ra phản ứng sau:
H2(g) + 2O2(g) H2O(g);
H2O(g); 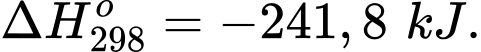 (2)
(2)
Tính tỉ lệ mol (methanol : không khí) đưa vào để nhiệt độ hệ phản ứng được duy trì ở 700 oC. Giả sử oxygen chiếm 20% thể tích không khí (làm tròn kết quả đến hàng phần trăm)?
CH3OH(g)
 HCH=O(g) + H2(g);
HCH=O(g) + H2(g); 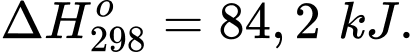 (1)
(1)Không khí được dẫn vào hệ và sau phản ứng (1) xảy ra phản ứng sau:
H2(g) + 2O2(g)
 H2O(g);
H2O(g); 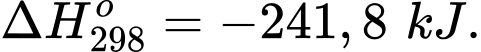 (2)
(2)Tính tỉ lệ mol (methanol : không khí) đưa vào để nhiệt độ hệ phản ứng được duy trì ở 700 oC. Giả sử oxygen chiếm 20% thể tích không khí (làm tròn kết quả đến hàng phần trăm)?
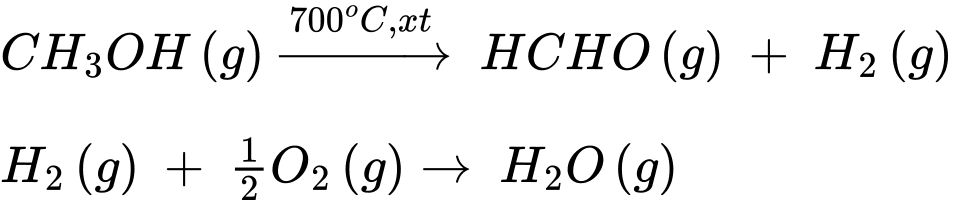
Để nhiệt độ không đổi thì (1) và (2) trao đổi nhiệt vừa đủ cho nhau nên ta có:
84,2.n CH3OH = 241,8.0,5.nO2
→ 84,2.n CH3OH = 241,8.0,5.20% n không khí
→n CH3OH: n không khí = 241,8.0,5.20%: 84,2 = 0,2872 ≈ 0,29
⇒ Điền đáp án: 0,29
Câu 3 [830089]: Các dữ kiện nhiệt động học của các chất ở 298K và 1 atm được cho trong bảng sau:

Giả sử quá trình cháy đều tạo thành sản phẩm là CO2. Mỗi mol than chì cháy trong ozone tỏa nhiệt nhiều hơn bao nhiêu J so với khi cháy trong oxygen (làm tròn kết quả đến hàng đơn vị)?

Giả sử quá trình cháy đều tạo thành sản phẩm là CO2. Mỗi mol than chì cháy trong ozone tỏa nhiệt nhiều hơn bao nhiêu J so với khi cháy trong oxygen (làm tròn kết quả đến hàng đơn vị)?
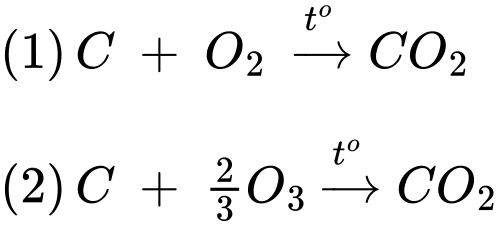
Biến thiên enthalpy của phản ứng (1) và (2) là
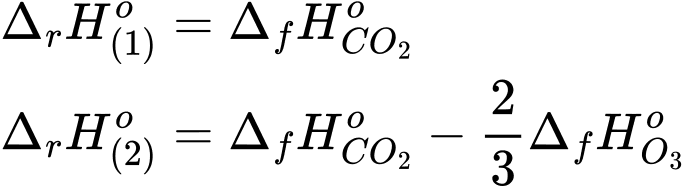
Mỗi mol than chì cháy trong ozone tỏa nhiệt nhiều hơn so với khi cháy trong oxygen là
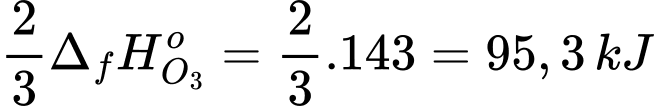
⇒ Điền đáp án: 95,3
Câu 4 [704192]: Trong phản ứng hóa học, đại lượng enthalpy  đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước:
đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước: 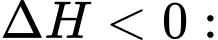 phản ứng tỏa nhiệt,
phản ứng tỏa nhiệt, 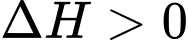 phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
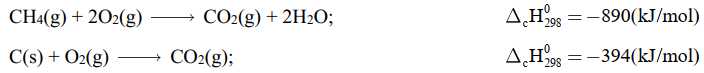
Khí carbonic sinh ra từ các quá trình cháy là một trong những nguyên nhân chính gây hiệu ứng nhà kính. Hiện nay, nồng độ CO2 trong khí quyển là 0,035% so với cách đây 300 năm là 0,028%. Nếu nồng độ CO2 tăng 25% thì góp phần tăng nhiệt độ toàn cầu 0,5 oC. Do đó, các biện pháp làm giảm thiểu sự phát thải CO2 là vấn đề lớn của toàn thế giới.Tính tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane.
 đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước:
đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước: 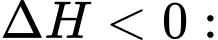 phản ứng tỏa nhiệt,
phản ứng tỏa nhiệt, 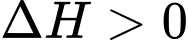 phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau: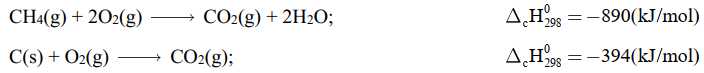
Khí carbonic sinh ra từ các quá trình cháy là một trong những nguyên nhân chính gây hiệu ứng nhà kính. Hiện nay, nồng độ CO2 trong khí quyển là 0,035% so với cách đây 300 năm là 0,028%. Nếu nồng độ CO2 tăng 25% thì góp phần tăng nhiệt độ toàn cầu 0,5 oC. Do đó, các biện pháp làm giảm thiểu sự phát thải CO2 là vấn đề lớn của toàn thế giới.Tính tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane.
* Đốt cháy CH4:
Cứ 1 mol CH4 bị đốt cháy, tức 1 mol CO2 sinh ra sẽ tạo ra 890 kJ
→ 1kJ được sinh ra bởi 1/890 mol CH4 và phát thải ra 1/890 mol CO2.
* Đốt cháy C:
Cứ 1 mol CO2 tạo thành sẽ phát thải ra môi trường 394 kJ
→ Phát thải ra 1 kJ thì cần 1/394 mol CO2.
Tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane là:
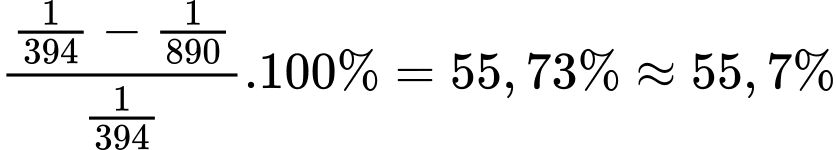
⇒ Điền đáp án: 55,7
Cứ 1 mol CH4 bị đốt cháy, tức 1 mol CO2 sinh ra sẽ tạo ra 890 kJ
→ 1kJ được sinh ra bởi 1/890 mol CH4 và phát thải ra 1/890 mol CO2.
* Đốt cháy C:
Cứ 1 mol CO2 tạo thành sẽ phát thải ra môi trường 394 kJ
→ Phát thải ra 1 kJ thì cần 1/394 mol CO2.
Tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane là:
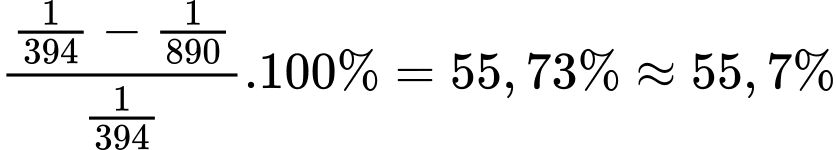
⇒ Điền đáp án: 55,7
Câu 5 [834382]: Ngoài CO2, một số khí khác cũng gây nên hiệu ứng nhà kính, trong đó có methane (CH4). Chỉ số GWP (Global Warming Potential) của một khí thường được sử dụng để đánh giá mức độ gây hiệu ứng nhà kính của 1 tấn khí đó so với ảnh hưởng của 1 tấn CO2 trong cùng một khoảng thời gian (thường là 100 năm). Giá trị GWP càng lớn, mức độ gây hiệu ứng nhà kính của khí càng cao. GWP (trong 100 năm) của CO2 và CH4 tương ứng là 1,0 và 25,0. Hãy tính tỉ lệ giữa mức độ gây hiệu ứng nhà kính của việc thải trực tiếp CH4 (từ sự phân giải kị khí của các chất hữu cơ) vào môi trường so với việc đốt cháy hoàn toàn chính lượng CH4 đó. Bỏ qua ảnh hưởng của hơi nước (làm tròn đến kết quả đến hàng đơn vị).
Trường hợp 1: Thải trực tiếp CH4. Khi thải 1 tấn CH4 ra môi trường, nó có chỉ số GWP = 25
→ Nghĩa là gây hiệu ứng nhà kính tương đương 25 tấn CO2.
Trường hợp 2: Đốt cháy hoàn toàn CH4
1 mol CH4 tạo ra 1 mol CO2. Khối lượng mol CH4 = 16 g/mol
→ 1 tấn CH4 = 1.000.000 g → số mol = 1.000.000 / 16 = 62500 mol
→ sinh ra 62500 mol CO2
Khối lượng CO2 = 62500 mol × 44 g/mol = 2750000 g = 2,75 tấn CO2 → GWP của CO2 là 1
→ tổng ảnh hưởng hiệu ứng nhà kính: 2,75
tỉ lệ giữa mức độ gây hiệu ứng nhà kính của việc thải trực tiếp CH4 (từ sự phân giải kị
khí của các chất hữu cơ) vào môi trường so với việc đốt cháy hoàn toàn chính lượng CH4 tỉ lệ = GWP khi thải CH4 trực tiếp/GWP khi đốt CH4 = 25/2.75 ≈ 9,09
⇒ Điền đáp án: 9,09
Câu 6 [830085]: Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau:
(1) CaCO3(s) CaO(s) + CO2(s)
CaO(s) + CO2(s)
Phản ứng (2) được thực hiện để cung cấp nhiệt lượng cho phản ứng (1):
(2) CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
CO2(g) + 2H2O(g)
Biết nhiệt tạo thành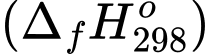 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau:
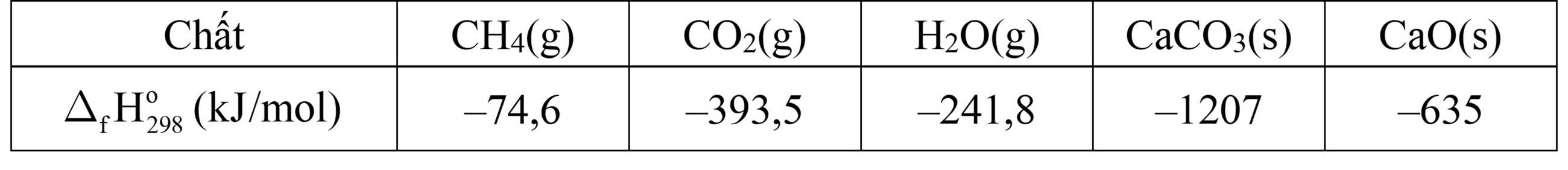
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH4(g) (làm tròn kết quả đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
(1) CaCO3(s)
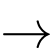 CaO(s) + CO2(s)
CaO(s) + CO2(s)Phản ứng (2) được thực hiện để cung cấp nhiệt lượng cho phản ứng (1):
(2) CH4(g) + 2O2(g)
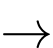 CO2(g) + 2H2O(g)
CO2(g) + 2H2O(g) Biết nhiệt tạo thành
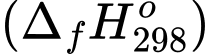 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau:
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH4(g) (làm tròn kết quả đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Biến thiên enthalpy của phản ứng (1) va (2) là
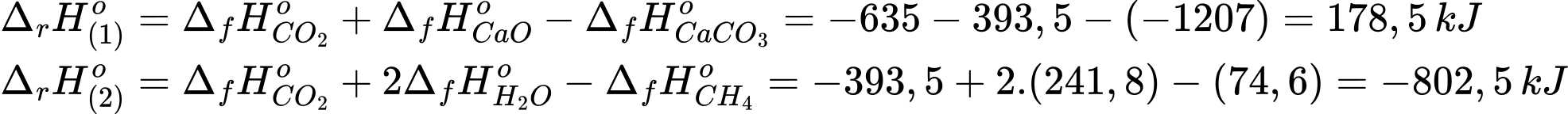
Để thu được 1 mol CaO(s) cần phải cung cấp 178,5 kJ nhiệt lượng.
Khi đốt cháy hoàn toàn 1 mol CH4 sẽ giải phóng một nhiệt lượng là 802,5 kJ
→ 1 mol CH4 sẽ cung cấp lượng nhiệt phân hủy 802,5/178,5 ≈ 4,5 mol CaCO3 tạo ra CaO cần phải đốt cháy hoàn toàn số gam methane CH4(g) (làm tròn kết quả đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO
mCH4 = 16.1,5/4,5 = 5,33 gam
⇒ Điền đáp án: 5,33
Câu 7 [830086]: Ở một lò nung vôi công nghiệp, cứ sản xuất được 1000 kg vôi sống cần dùng m kg than đá làm nhiên liệu. Biết rằng:
- Than đá chứa 84% carbon về khối lượng, còn lại là các tạp chất trơ.
- Có 50% lượng nhiệt tỏa ra từ nhiên liệu được hấp thụ để phân huỷ đá vôi.
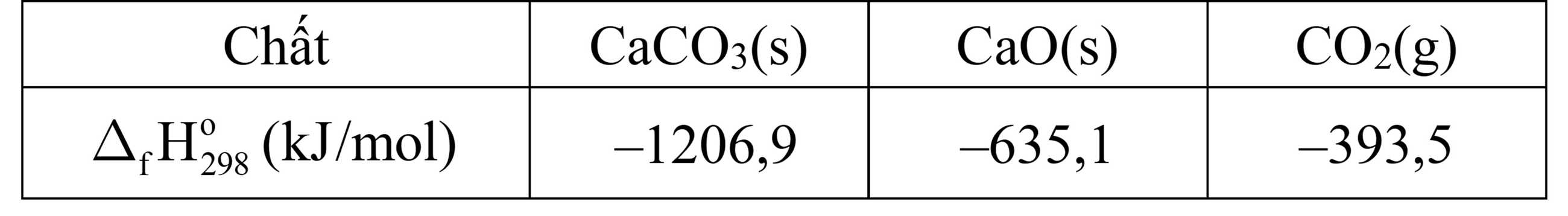
- Nhiệt tạo thành của các chất được cho trong bảng sau:
Giá trị của m bằng bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
- Than đá chứa 84% carbon về khối lượng, còn lại là các tạp chất trơ.
- Có 50% lượng nhiệt tỏa ra từ nhiên liệu được hấp thụ để phân huỷ đá vôi.
- Nhiệt tạo thành của các chất được cho trong bảng sau:

Giá trị của m bằng bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
CaCO3 ⟶ CaO + CO2 (1)
C+O2 ⟶ CO2
ΔrΗ o298 (1) = ΔrΗ o298 (CaO) + ΔrΗ o298 (CO2) - ΔrΗ o298 (CaCO3)
= -635,1+(-393,5)-(-1206, 9) = 178, 3kJ
ΔrΗ o298 (2) = ΔrΗ o298 (CO2) = -393,5kJ
n CaO = 1000: 56 (k.mol)
Bảo toàn năng lượng: 1000/56 . 178,3 = m/12 . 50% . 84% . 393,5
⟶ m = 231 tấn
⇒ Điền đáp án: 231
C+O2 ⟶ CO2
ΔrΗ o298 (1) = ΔrΗ o298 (CaO) + ΔrΗ o298 (CO2) - ΔrΗ o298 (CaCO3)
= -635,1+(-393,5)-(-1206, 9) = 178, 3kJ
ΔrΗ o298 (2) = ΔrΗ o298 (CO2) = -393,5kJ
n CaO = 1000: 56 (k.mol)
Bảo toàn năng lượng: 1000/56 . 178,3 = m/12 . 50% . 84% . 393,5
⟶ m = 231 tấn
⇒ Điền đáp án: 231
Câu 8 [830087]: Acetylene thường được dùng làm nhiên liệu, ví dụ đèn xì oxygen - acetylene dùng để hàn cắt kim loại. Khí methane là thành phần chính của khí thiên nhiên cũng được sử dụng làm nhiên liệu. Methane và acetylene cháy theo phương trình hóa học sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) (1)
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(g) (2)
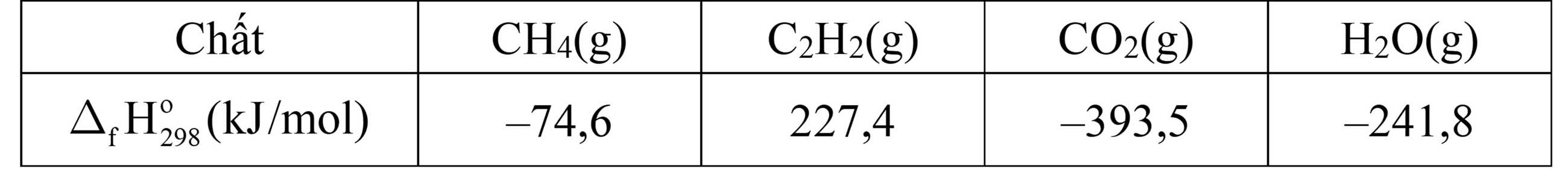
Cho biết nhiệt tạo thành chuẩn của một số chất như sau:
Nếu xét cùng số mol thì lượng nhiệt tỏa ra từ C2H2 gấp CH4 bao nhiêu lần (làm tròn kết quả đến hàng phần trăm)?
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) (1)
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(g) (2)
Cho biết nhiệt tạo thành chuẩn của một số chất như sau:

Nếu xét cùng số mol thì lượng nhiệt tỏa ra từ C2H2 gấp CH4 bao nhiêu lần (làm tròn kết quả đến hàng phần trăm)?
ΔΗ1 = ΔrΗo298 (CO2) +2ΔrΗo298(H2O) – ΔrΗo298(CH4) – 2ΔrΗo298(O2)
= - 393,5 + 2(- 241,8) - (- 74,6) - 0 = - 802,5 kJ/mol
Nhiệt lượng tỏa ra khi đốt 1g Methane là: - 802,5 : 16 = - 50,15625 kJ/g
ΔΗ2 = 2ΔrΗo298(CO2) + ΔrΗo298(H2O) – ΔrΗo298 (C2H2) - 2ΔrΗo298(O2)
= 2(- 393,5) + (- 241,8) - 227,4 - 0 = -1255,8 kJ/mol
Nhiệt lượng tỏa ra khi đốt 1g C2H2 là: -1255,8 : 26 = - 48,3 kJ/g
Tỉ lệ : - 50,15625 / - 48,3 = 1,038 lần
⇒ Điền đáp án: 1,04
= - 393,5 + 2(- 241,8) - (- 74,6) - 0 = - 802,5 kJ/mol
Nhiệt lượng tỏa ra khi đốt 1g Methane là: - 802,5 : 16 = - 50,15625 kJ/g
ΔΗ2 = 2ΔrΗo298(CO2) + ΔrΗo298(H2O) – ΔrΗo298 (C2H2) - 2ΔrΗo298(O2)
= 2(- 393,5) + (- 241,8) - 227,4 - 0 = -1255,8 kJ/mol
Nhiệt lượng tỏa ra khi đốt 1g C2H2 là: -1255,8 : 26 = - 48,3 kJ/g
Tỉ lệ : - 50,15625 / - 48,3 = 1,038 lần
⇒ Điền đáp án: 1,04
Câu 9 [830082]: Cho phản ứng: C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(g).
Dựa vào bảng số liệu sau:

Một bình gas chứa 12 kg khí trong đó butane (C4H10) chiếm 96,67% về khối lượng còn lại là tạp chất không cháy. Một hộ gia đình cần đốt gas để cung cấp 10 000 kJ nhiệt trong mỗi ngày. Biết hiệu suất hấp thụ nhiệt là 80%. Sau bao nhiêu ngày thì hộ gia đình trên dùng hết bình gas 12 kg (làm tròn kết quả đến hàng phần mười)?
Dựa vào bảng số liệu sau:

Một bình gas chứa 12 kg khí trong đó butane (C4H10) chiếm 96,67% về khối lượng còn lại là tạp chất không cháy. Một hộ gia đình cần đốt gas để cung cấp 10 000 kJ nhiệt trong mỗi ngày. Biết hiệu suất hấp thụ nhiệt là 80%. Sau bao nhiêu ngày thì hộ gia đình trên dùng hết bình gas 12 kg (làm tròn kết quả đến hàng phần mười)?
Biến thiên enthalpy của phản ứng trên là
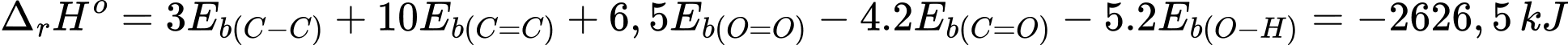
Đổi 12 kg = 12000 gam
Số ngày thì hộ gia đình trên dùng hết bình gas 12 kg là
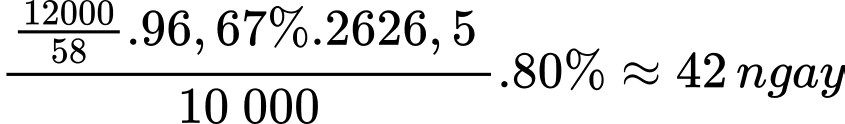
⇒ Điền đáp án: 42
Câu 10 [706143]: Quá trình chuyển hóa ammonium chloride từ dạng khan sang dạng dung dịch (bằng cách hòa tan vào nước) là một quá trình thu nhiệt.
NH4Cl(s)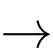 NH4Cl(aq);
NH4Cl(aq); 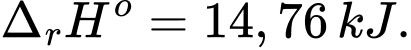
Sự giảm nhiệt độ khi phản ứng hòa tan ammonium chloride vào nước giúp nó được ứng dụng trong các túi chườm giúp giảm đau, giảm viêm một cách tạm thời. Nếu mỗi túi chườm lạnh chứa 20 gam muối và 100 mL nước cất (có D = 1 g/mL) thì khi hoạt động, nhiệt độ của túi chườm hạ xuống là t2 (oC). Biết nhiệt lượng cần để nâng nhiệt độ của 1,0 gam sản phẩm lên 1 oC là 4,184 J. Xác định giá trị của t2 (làm tròn đến hàng phần mười).
NH4Cl(s)
 NH4Cl(aq);
NH4Cl(aq); 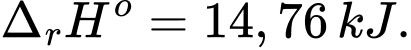
Sự giảm nhiệt độ khi phản ứng hòa tan ammonium chloride vào nước giúp nó được ứng dụng trong các túi chườm giúp giảm đau, giảm viêm một cách tạm thời. Nếu mỗi túi chườm lạnh chứa 20 gam muối và 100 mL nước cất (có D = 1 g/mL) thì khi hoạt động, nhiệt độ của túi chườm hạ xuống là t2 (oC). Biết nhiệt lượng cần để nâng nhiệt độ của 1,0 gam sản phẩm lên 1 oC là 4,184 J. Xác định giá trị của t2 (làm tròn đến hàng phần mười).
Số mol của NH4Cl là n NH4Cl = 20 ÷ 53,5 mol
⟶ Lượng nhiệt tạo ra : 20 ÷ 53,5 × 14,76 × 1000 (J)
Nhiệt lượng NH4Cl hấp thụ khi hòa tan vào nước là:
20 ÷ 53,5 × 14,76 × 1000 = 100 × 4,184 × (t2 - 25 )
→ t2 = 11,8oC.
⟹ Điền đáp án: 11,8
⟶ Lượng nhiệt tạo ra : 20 ÷ 53,5 × 14,76 × 1000 (J)
Nhiệt lượng NH4Cl hấp thụ khi hòa tan vào nước là:
20 ÷ 53,5 × 14,76 × 1000 = 100 × 4,184 × (t2 - 25 )
→ t2 = 11,8oC.
⟹ Điền đáp án: 11,8
Câu 11 [560515]: Thử nghiệm với hai chiếc xe ô tô tương đương, một xe chạy bằng xăng (dung tích bình chứa 4 kg xăng) và một xe chạy bằng pin nhiên liệu (thể tích bình nhiên liệu có thể quy về ứng với 400 gam hydrogen ở áp suất cao). Để di chuyển được 1 km, cần cung cấp năng lượng đủ cho mỗi xe là 106 J. Biết khi đốt cháy 1 kg xăng tỏa ra nhiệt lượng là 5 × 107 J nhưng chỉ có 40% lượng nhiệt được chuyển thành công có ích. Trong khi đó, khi sử dụng 2 gam hydrogen trong pin thì giải phóng năng lượng là 286.000 J và có 60% năng lượng này được chuyển thành công có ích. Bỏ qua các hao phí khác, quãng đường tối đa mà xe ô tô chạy bằng xăng nhiều hay ít hơn xe ô tô chạy bằng pin là bao nhiêu km?
Năng lượng có ích khi đốt cháy 4kg xăng: 4 . 5.107 . 40% = 8.107
⇒ Quãng đường tối đa xe chạy xăng đi được: 8.107 / 106 = 80 km
Năng lượng có ích khi sử dụng 400 gam hydrogen: 400/2 . 286 000 . 60% = 34 320 000 J
⇒ Quãng đường tối đa xe chạy pin đi được: 34 320 000/ 106 = 34,3 km
Vậy quãng đường xe xăng chạy nhiều hơn xe chạy bằng pin 80 - 34,3 = 45,7 km
⇒ Điền đáp án: 45,7
⇒ Quãng đường tối đa xe chạy xăng đi được: 8.107 / 106 = 80 km
Năng lượng có ích khi sử dụng 400 gam hydrogen: 400/2 . 286 000 . 60% = 34 320 000 J
⇒ Quãng đường tối đa xe chạy pin đi được: 34 320 000/ 106 = 34,3 km
Vậy quãng đường xe xăng chạy nhiều hơn xe chạy bằng pin 80 - 34,3 = 45,7 km
⇒ Điền đáp án: 45,7
Câu 12 [705583]: Khí Biogas còn gọi là khí sinh học. Thành phần chính của khí sinh học Biogas có khí methane chiếm 60% thể tích còn lại là carbon dioxide và các khí khác. Một bình gas (khí hóa lỏng) chứa hỗn hợp propane và butane với tỉ lệ mol 1 : 2. Trung bình 60 ngày một hộ gia đình cần dùng hết một bình “ga” loại 12 kg (giả thiết hiệu suất hấp thụ nhiệt các chất bằng nhau). Thể tích khí Biogas tối thiểu cần dùng để tạo ra lượng nhiệt tương đương khi đốt cháy 1 bình “ga” loại 12 kg là bao nhiêu m3 (đkc)? (Làm tròn đến hàng phần mười)
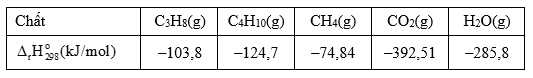

Trong 12kg có : C3H8: x mol ; C4H10 : 2x mol
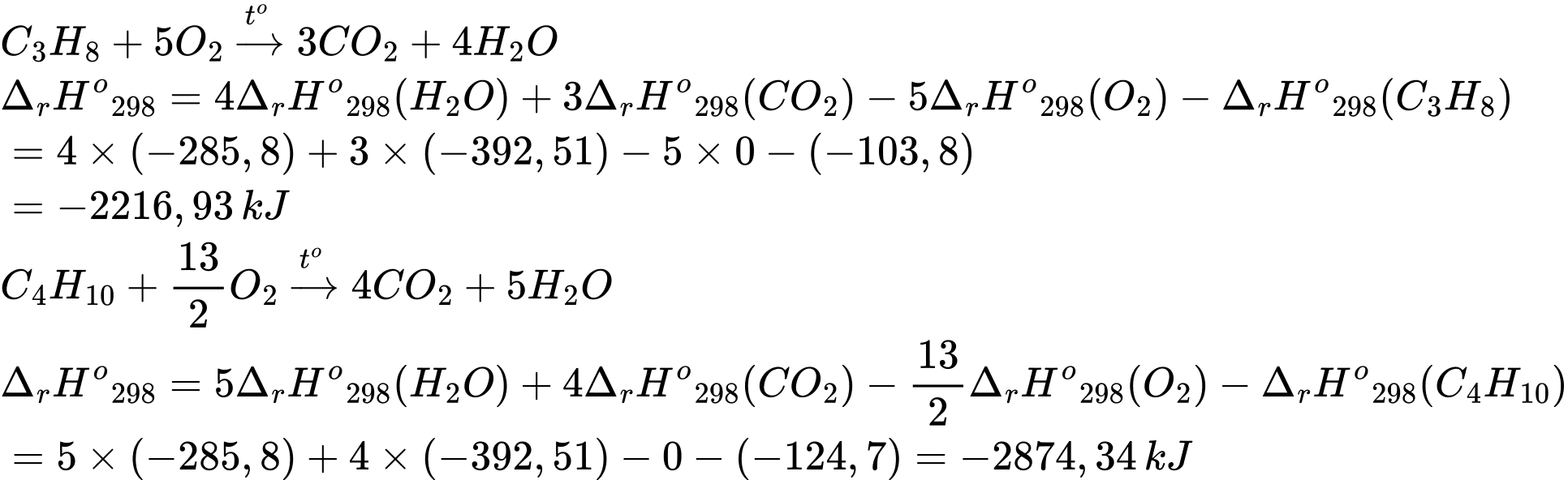
Nhiệt tỏa ra khi đốt bình ga : Q tỏa = x.(2216,93) + 2x.(2874,34) = 597420,75 kJ
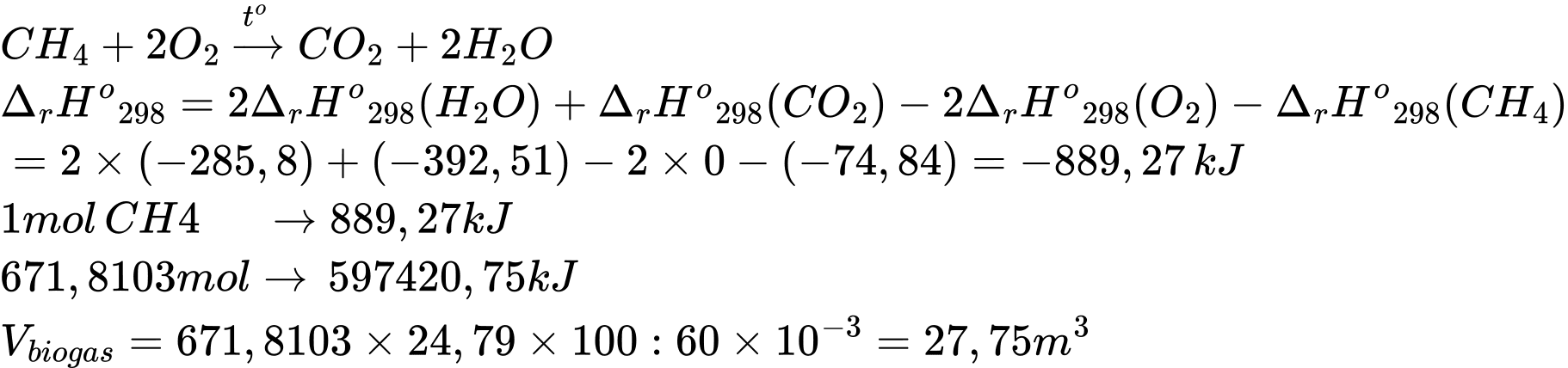
⇒ Điền đáp án: 27,8
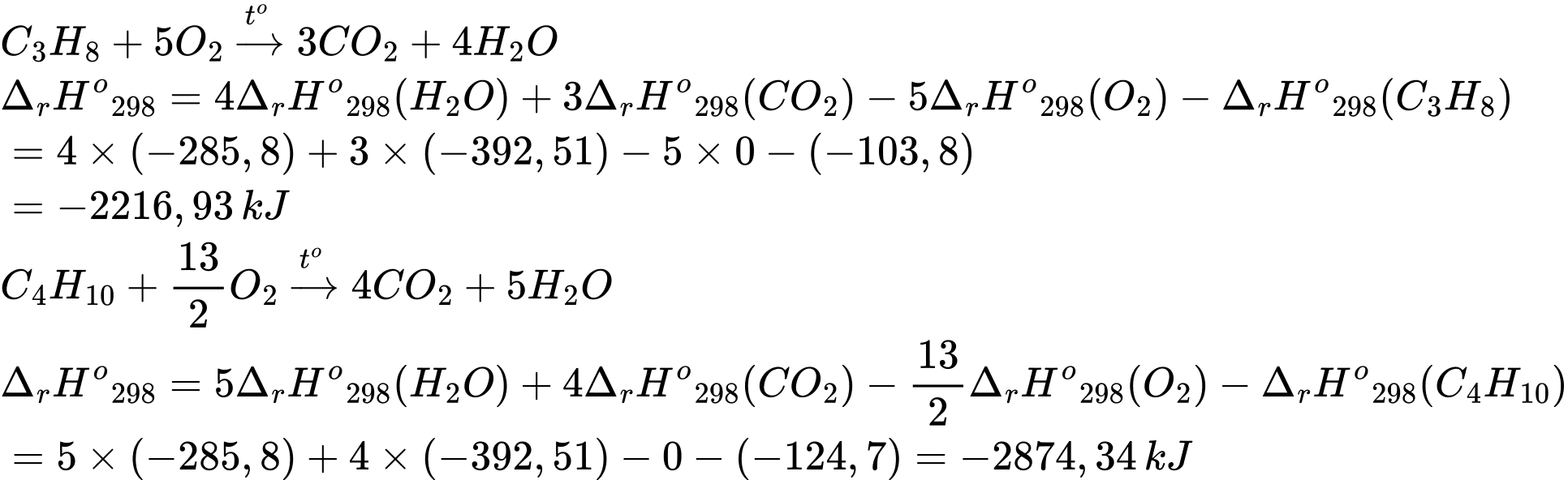
Nhiệt tỏa ra khi đốt bình ga : Q tỏa = x.(2216,93) + 2x.(2874,34) = 597420,75 kJ
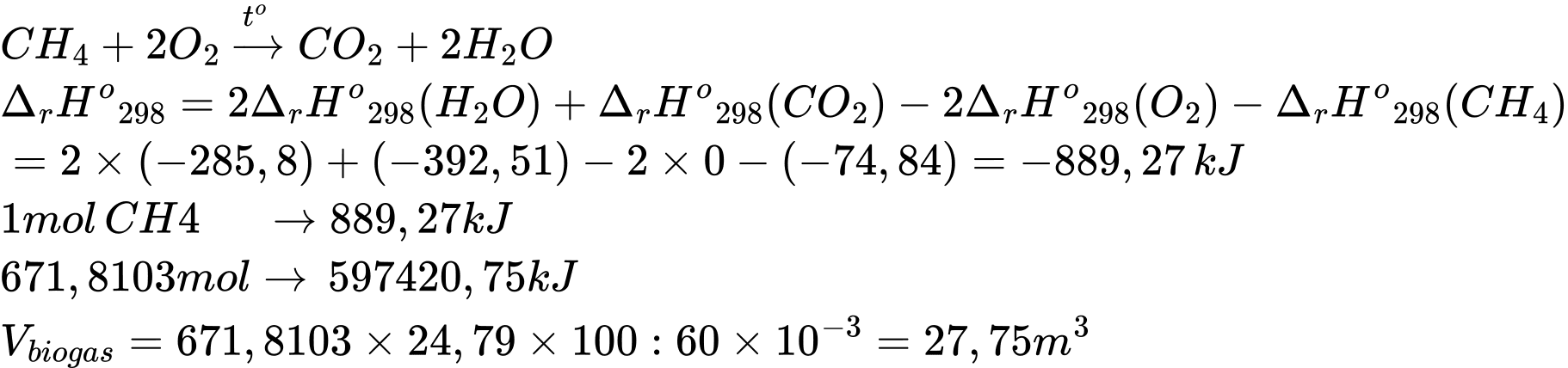
⇒ Điền đáp án: 27,8
Câu 13 [705437]: Các nhà khoa học muốn tìm ra loại nhiên liệu mới thay thế cho xăng, ethanol là “một ứng cử viên” cho vị trí này. Giả sử octane (C8H18) làm chất đại diện cho thành phần phức tạp của các hydrocarbon trong xăng. Các dữ liệu được cung cấp như sau:
C8H18(l) + 12,5O2(g) ⟶ 8CO2(g) + 9H2O(l);
C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l);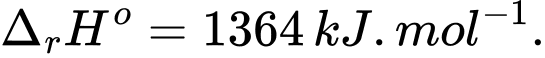
Biết rằng khối lượng riêng của octane và ethanol lần lượt là 0,699 g/mL và 0,785 g/mL. Đốt cháy 1 lít octane tạo ra lượng nhiệt bằng với đốt cháy bao nhiêu L ethanol (Làm tròn đến hàng phần trăm)?
C8H18(l) + 12,5O2(g) ⟶ 8CO2(g) + 9H2O(l);

C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l);
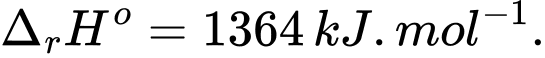
Biết rằng khối lượng riêng của octane và ethanol lần lượt là 0,699 g/mL và 0,785 g/mL. Đốt cháy 1 lít octane tạo ra lượng nhiệt bằng với đốt cháy bao nhiêu L ethanol (Làm tròn đến hàng phần trăm)?
Khối lượng octane là: mC8H18 = V × d = 1 × 0,699 = 0,699 (kg)
Số mol octane là: nC8H18 = m ÷ M = (1 × 0,699) ÷ 114 = 0,0048... (lưu ý ở đây không làm tròn, tránh sai số)
Nhiệt lượng tỏa ra khi đốt cháy 1L C8H18 là:
QC8H18 = [(1 × 0,699) ÷ 114] × 5470 = 26,5522... (không làm tròn)
Nhiệt lượng tỏa ra khi đốt cháy lượng C2H5OH là:
QC2H5OH = [(V × 0,785) ÷ 46] × 1364
Mà nhiệt lượng tạo ra khi đốt cháy 1 L octane bằng với nhiệt lượng tạo ra khi đốt cháy V (L) ethanol nên ta có:
[(V × 0,785) ÷ 46] × 1364 = 26,5522... ⟶ V = 1,4408... ≈ 1,44 (L)
⇒ Điền đáp án: 1,44
Số mol octane là: nC8H18 = m ÷ M = (1 × 0,699) ÷ 114 = 0,0048... (lưu ý ở đây không làm tròn, tránh sai số)
Nhiệt lượng tỏa ra khi đốt cháy 1L C8H18 là:
QC8H18 = [(1 × 0,699) ÷ 114] × 5470 = 26,5522... (không làm tròn)
Nhiệt lượng tỏa ra khi đốt cháy lượng C2H5OH là:
QC2H5OH = [(V × 0,785) ÷ 46] × 1364
Mà nhiệt lượng tạo ra khi đốt cháy 1 L octane bằng với nhiệt lượng tạo ra khi đốt cháy V (L) ethanol nên ta có:
[(V × 0,785) ÷ 46] × 1364 = 26,5522... ⟶ V = 1,4408... ≈ 1,44 (L)
⇒ Điền đáp án: 1,44
Câu 14 [705566]: Xăng sinh học E5 chứa 5% ethanol về thể tích (Khối lượng riêng của ethanol là 0,8 g/mL), còn lại là xăng truyền thống, giả thiết xăng truyền thống chỉ chứa hai alkane là C8H18 và C9H20 có tỉ lệ mol tương ứng là 4 : 3 (Khối lượng riêng của xăng truyền thống là 0,7 g/mL). Khi được đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5072 kJ và 1 mol C9H20 tỏa ra nhiệt lượng là 6119 kJ. Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 212 kJ. Nếu xe máy tay ga đó đã sử dụng hết 6,5 lít xăng E5 ở trên thì quãng đường xe di chuyển được là bao nhiêu km? (biết hiệu suất sử dụng nhiên liệu của động cơ là 40%) (làm tròn đến hàng đơn vị).
Đổi 6,5 L = 6500 mL
Thể tích của ethanol trong xăng E5 là: Vethanol = 6500 × 5% = 325 mL
Thể tích của xăng truyền thống trong xăng E5 là: Vxăng = 6500 – 325 = 6175 mL
Khối lượng của xăng truyền thống là: mxăng = 6175 × 0,7 = 4322,5 gam
Khối lượng của ethanol là: methanol = 325 × 0,8 = 260 gam
Số mol của ethanol là: nethanol = 260 ÷ 46 = 130/23 mol
Đặt số mol của C8H18 là 4a mol; số mol của C9H20 là 2a mol;
Khối lượng của xăng truyền thống là: mxăng = 4a × 114a + 3a × 128 = 4322,5 gam
→ a = 247/48 mol
Nhiệt lượng xe máy sử dụng khi dùng hết 6,5 L xăng E5 là:
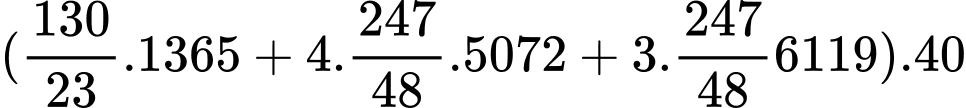
Quãng đường xe máy đi được là: 82630,397 ÷ 212 = 389,766 ≈ 390 km
⇒ Điền đáp án: 390
Thể tích của ethanol trong xăng E5 là: Vethanol = 6500 × 5% = 325 mL
Thể tích của xăng truyền thống trong xăng E5 là: Vxăng = 6500 – 325 = 6175 mL
Khối lượng của xăng truyền thống là: mxăng = 6175 × 0,7 = 4322,5 gam
Khối lượng của ethanol là: methanol = 325 × 0,8 = 260 gam
Số mol của ethanol là: nethanol = 260 ÷ 46 = 130/23 mol
Đặt số mol của C8H18 là 4a mol; số mol của C9H20 là 2a mol;
Khối lượng của xăng truyền thống là: mxăng = 4a × 114a + 3a × 128 = 4322,5 gam
→ a = 247/48 mol
Nhiệt lượng xe máy sử dụng khi dùng hết 6,5 L xăng E5 là:
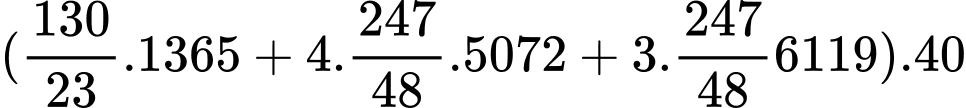
Quãng đường xe máy đi được là: 82630,397 ÷ 212 = 389,766 ≈ 390 km
⇒ Điền đáp án: 390
Câu 15 [702850]: Xăng sinh học (Biogasonline) là hỗn hợp của xăng truyền thống và cồn sinh học C2H5OH được sử dụng cho các động cơ đốt trong như ô tô, xe máy. Một loại xăng sinh học có thành phần và khối lượng riêng các chất như bảng dưới đây:
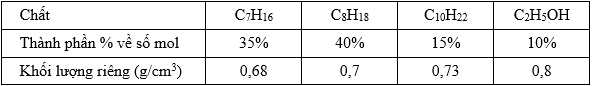
Cho các phương trình nhiệt hóa sau:
(1) C7H16(g) +11O2(g) 7CO2(g) + 8H2O(l)
7CO2(g) + 8H2O(l) 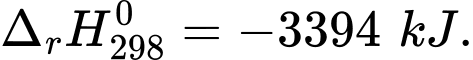
(2) C8H18(l) + 12,5O2(g) 8CO2(g) + 9H2O(l)
8CO2(g) + 9H2O(l) 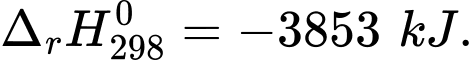
(3) C10H22(l) + 15,5O2(g) 10CO2(g) + 11H2O(l)
10CO2(g) + 11H2O(l) 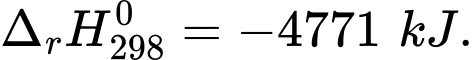
(4) C2H5OH(l) + 3,5O2(g) 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) 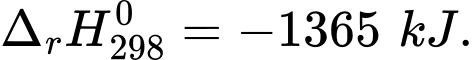
Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 250 kJ. Nếu dùng xăng sinh học trên làm nhiên liệu, hãy tính quãng đường xe đi được theo đơn vị km với 1 lít xăng, biết hiệu suất sử dụng nhiệt của xe là 60% (làm tròn đến hàng phần mười).

Cho các phương trình nhiệt hóa sau:
(1) C7H16(g) +11O2(g)
 7CO2(g) + 8H2O(l)
7CO2(g) + 8H2O(l) 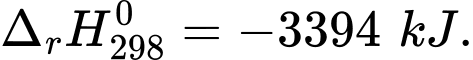
(2) C8H18(l) + 12,5O2(g)
 8CO2(g) + 9H2O(l)
8CO2(g) + 9H2O(l) 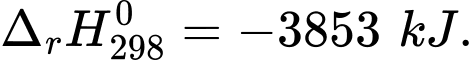
(3) C10H22(l) + 15,5O2(g)
 10CO2(g) + 11H2O(l)
10CO2(g) + 11H2O(l) 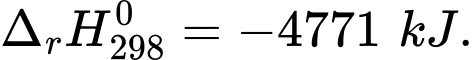
(4) C2H5OH(l) + 3,5O2(g)
 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) 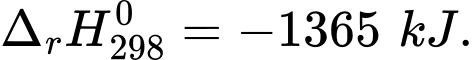
Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 250 kJ. Nếu dùng xăng sinh học trên làm nhiên liệu, hãy tính quãng đường xe đi được theo đơn vị km với 1 lít xăng, biết hiệu suất sử dụng nhiệt của xe là 60% (làm tròn đến hàng phần mười).
Đổi 1 L = 1000 mL
Gọi số mol của xăng là a mol
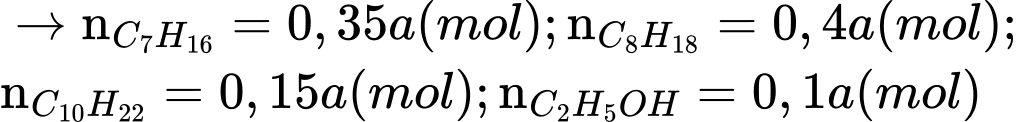
Ta có:
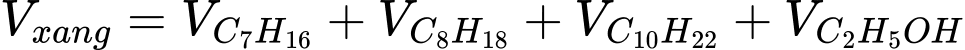
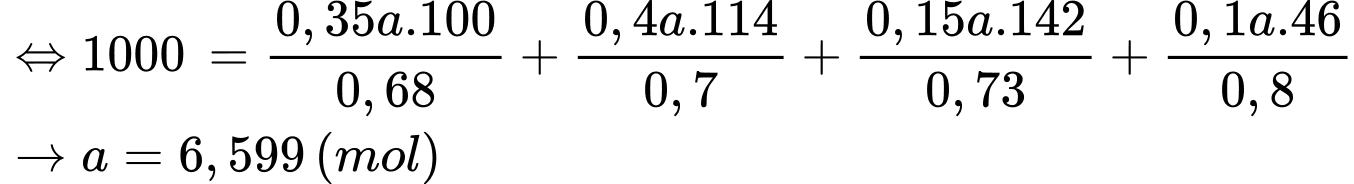
Nhiệt lượng mà 1 L xăng toả ra là:
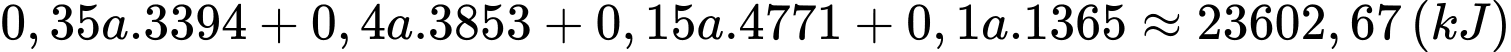
Quãng đường xe đi được khi tiêu thụ hết 1 L xăng là:
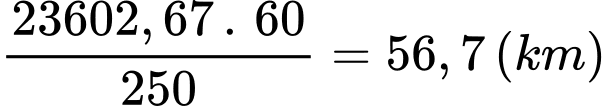
⇒ Điền đáp án: 56,7
Gọi số mol của xăng là a mol
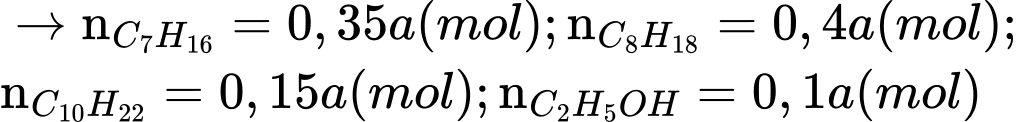
Ta có:
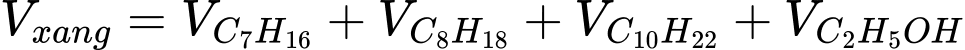
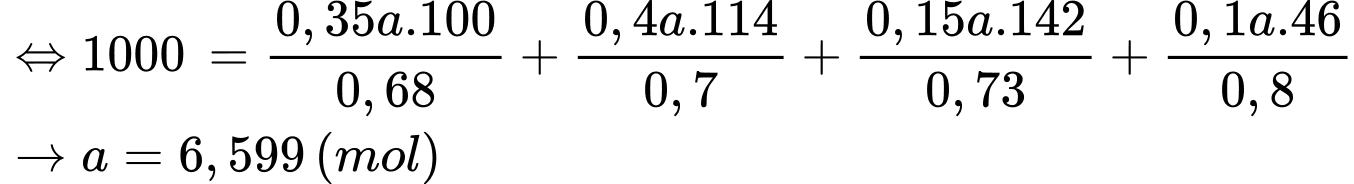
Nhiệt lượng mà 1 L xăng toả ra là:
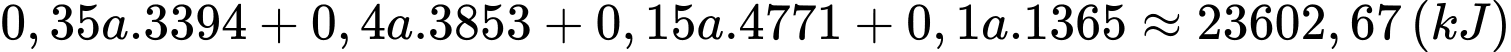
Quãng đường xe đi được khi tiêu thụ hết 1 L xăng là:
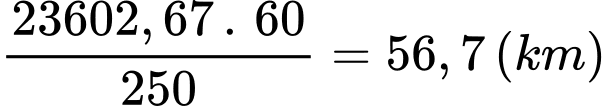
⇒ Điền đáp án: 56,7
Câu 16 [706057]: Quy trình Mond được sử dụng vào cuối thế kỷ 19 và đầu thế kỷ 20 để tinh chế kim loại nickel khỏi các tạp chất như iron và cobalt. Quá trình này dựa trên phản ứng của nickel với carbon monoxide để tạo thành nickel tetracarbonyl dễ bay hơi, có thể được tách ra khỏi các tạp chất rắn: Ni(s) + 4CO(g)  Ni(CO)4(g).
Ni(CO)4(g).
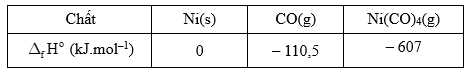
Tính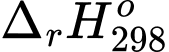 của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
 Ni(CO)4(g).
Ni(CO)4(g).
Tính
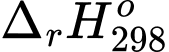 của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
Ni(s) + 4CO(g) → Ni(CO)4(g)
Biến thiên enthalpy của phản ứng trên là
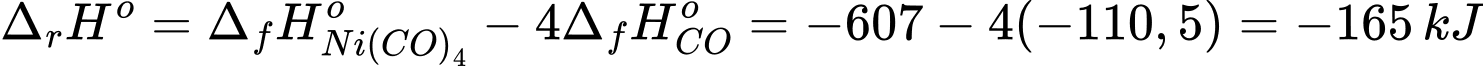
⟹ Điền đáp án : 165
Biến thiên enthalpy của phản ứng trên là
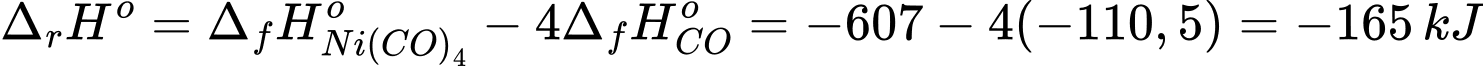
⟹ Điền đáp án : 165
Câu 17 [704313]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Trong pin propane - oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
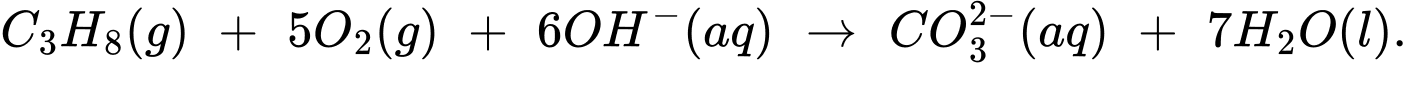
Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane - oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 110 gam propane làm nhiên liệu ở điều kiện chuẩn? Biết enthalpy tiêu chuẩn của các chất được cho trong bảng sau:
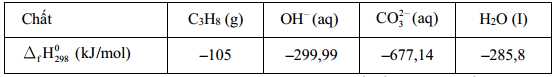
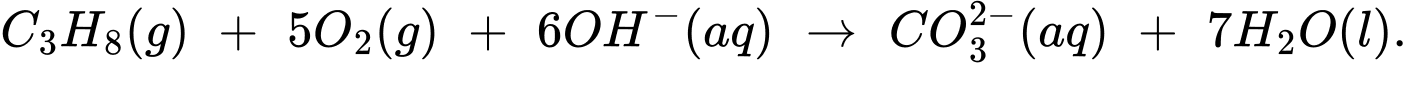
Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane - oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 110 gam propane làm nhiên liệu ở điều kiện chuẩn? Biết enthalpy tiêu chuẩn của các chất được cho trong bảng sau:

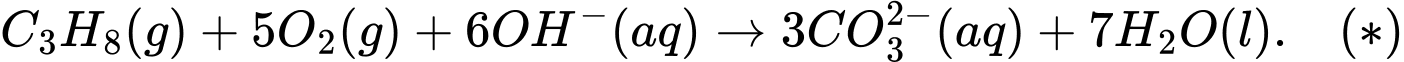
Số mol của propane là:
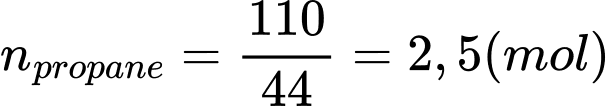
Biến thiên enthalpy của phản ứng (*) là:
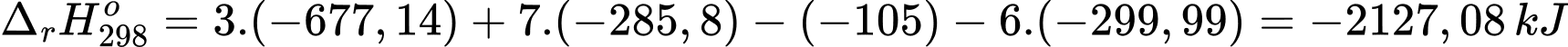
Thời gian thắp sáng bóng đèn liên tục là:
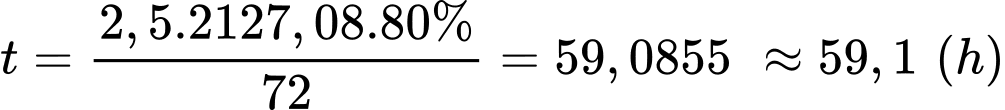
⇒ Điền đáp án: 59,1
Câu 18 [704018]: Thực phẩm đóng hộp tự sôi (self-heating food packaging) là sản phẩm đóng gói tiện dụng, nhanh chóng với khả năng làm nóng bên trong thực phẩm mà không cần nguồn nhiệt bên ngoài hoặc nguồn điện. Nguồn nhiệt thương mại để đóng gói thực phẩm: vôi sống và nước, có đặc điểm là giá thành rẻ cũng như nguồn cung sẵn có, thường được FDA công nhận là an toàn. Kim loại magnesium dạng bột mịn với một lượng nhỏ sắt và muối ăn, hoạt động bằng cách thêm nước.
Một gói làm nóng thức ăn có trong lẩu tự sôi, chứa khoảng 10 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước, xảy ra phản ứng, phản ứng này toả nhiều nhiệt và làm nóng phần nước lẩu bên trên.
Mg(s) + H2O(l) → Mg(OH)2(s) + H2(g)
Biết rằng enthalpy tạo thành chuẩn của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
Một gói làm nóng thức ăn có trong lẩu tự sôi, chứa khoảng 10 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước, xảy ra phản ứng, phản ứng này toả nhiều nhiệt và làm nóng phần nước lẩu bên trên.
Mg(s) + H2O(l) → Mg(OH)2(s) + H2(g)
Biết rằng enthalpy tạo thành chuẩn
 của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
Mg(s) + 2H2O(l) ⟶ Mg(OH)2(s) + H2(g)
Biến thiên ethalpy chuẩn của phản ứng trên là:
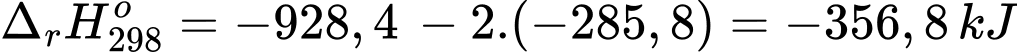
Số mol của Mg trong gói tự sôi trên là:
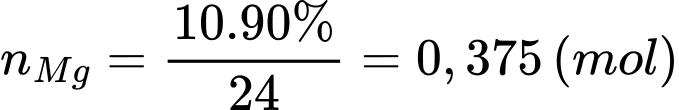
Lượng nhiệt tỏa ra khi sử dụng 1 mol Mg là 356,8 kJ
Lượng nhiệt tỏa ra khi sử dụng 0,375 mol Mg làm nóng nước là:
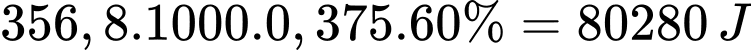
Khối lượng nước tối đa làm nóng từ 0,375 mol Mg là:
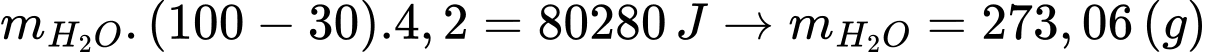
Thể tích nước là:
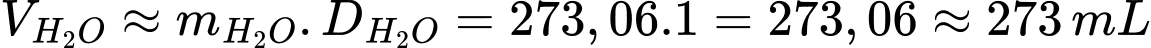
⇒ Điền đáp án: 273
Biến thiên ethalpy chuẩn của phản ứng trên là:
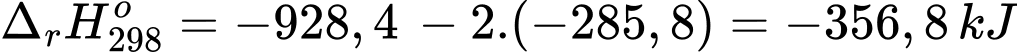
Số mol của Mg trong gói tự sôi trên là:
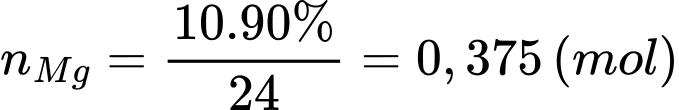
Lượng nhiệt tỏa ra khi sử dụng 1 mol Mg là 356,8 kJ
Lượng nhiệt tỏa ra khi sử dụng 0,375 mol Mg làm nóng nước là:
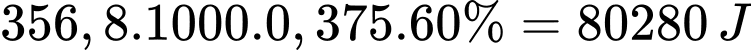
Khối lượng nước tối đa làm nóng từ 0,375 mol Mg là:
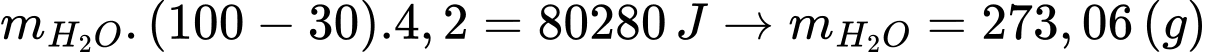
Thể tích nước là:
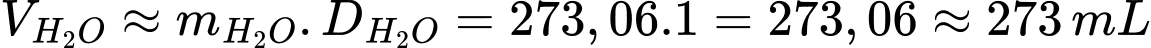
⇒ Điền đáp án: 273
Câu 19 [705454]: Khi sử dụng đồ uống có cồn (ethanol), dưới tác dụng của hai loại enzyme dehydrogenase (ADH) và aldehyde dehydrogenase (ALDH) trong gan, có chuyển hóa như sau:
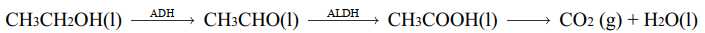
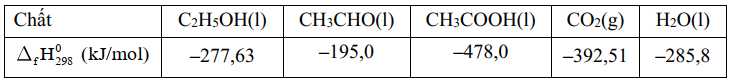
Thông thường, khi một người uống rượu (C2H5OH), có khoảng 10% rượu được thải ra ngoài qua mồ hôi, hơi thở và nước tiểu; 90% được hấp thụ và chuyển hóa hết thành acetaldehyde (CH3CHO) tại gan nhờ hệ thống enzyme. Nếu một người uống hai lon bia, mỗi lon dung tích 330 mL và độ cồn của bia là 5% thì lượng năng lượng mà cơ thể nhận được khi chuyển hóa hết lượng cồn ở trên là bao nhiêu, biết khối lượng riêng của C2H5OH là 0,789 g/mL và enthalpy tiêu chuẩn của các chất được cho trong bảng sau:
(chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị).
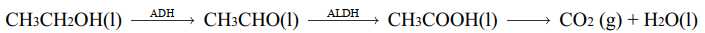
Thông thường, khi một người uống rượu (C2H5OH), có khoảng 10% rượu được thải ra ngoài qua mồ hôi, hơi thở và nước tiểu; 90% được hấp thụ và chuyển hóa hết thành acetaldehyde (CH3CHO) tại gan nhờ hệ thống enzyme. Nếu một người uống hai lon bia, mỗi lon dung tích 330 mL và độ cồn của bia là 5% thì lượng năng lượng mà cơ thể nhận được khi chuyển hóa hết lượng cồn ở trên là bao nhiêu, biết khối lượng riêng của C2H5OH là 0,789 g/mL và enthalpy tiêu chuẩn của các chất được cho trong bảng sau:

(chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị).
Thể tích ethanol trong 2 lon bia là: 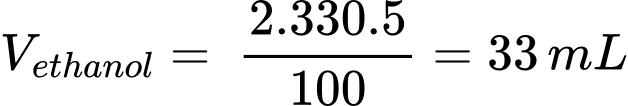
Khối lượng ethanol là: methanol = 33 × 0,789 = 26,037 (g)
Số mol của ethanol là: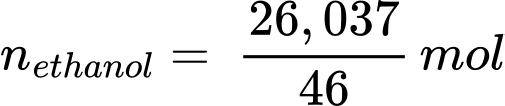
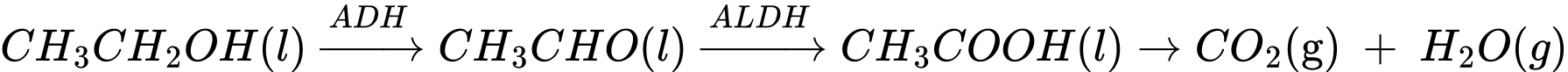
Phản ứng tổng quát:
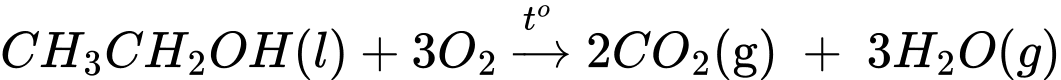
Biến thiên enthalpy của phản ứng trên là
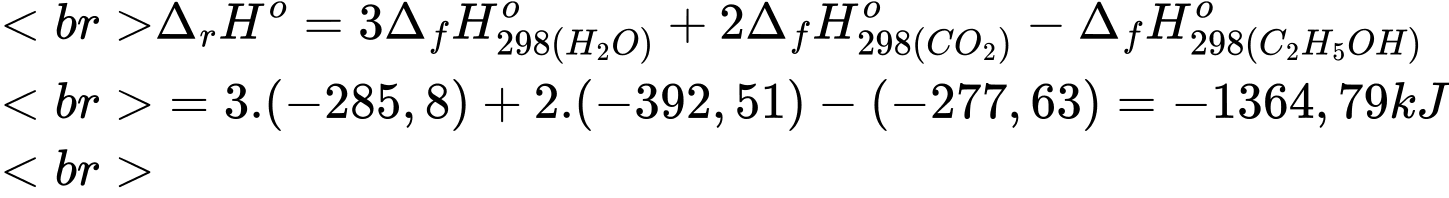
Lượng năng lượng mà cơ thể nhận được khi phân hủy hết lượng cồn ở trên là:

⇒ Điền đáp án: 695
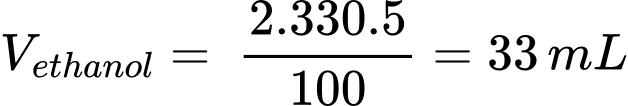
Khối lượng ethanol là: methanol = 33 × 0,789 = 26,037 (g)
Số mol của ethanol là:
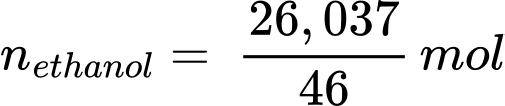
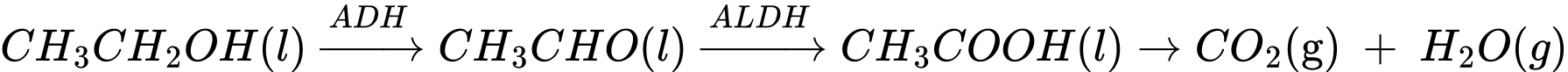
Phản ứng tổng quát:
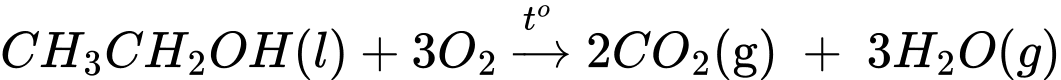
Biến thiên enthalpy của phản ứng trên là
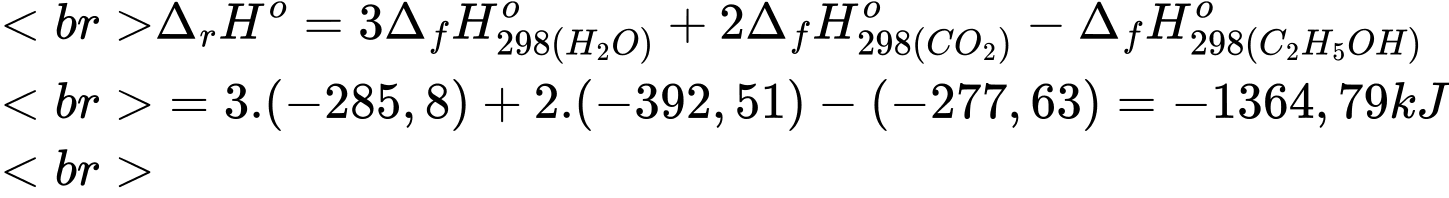
Lượng năng lượng mà cơ thể nhận được khi phân hủy hết lượng cồn ở trên là:

⇒ Điền đáp án: 695
Câu 20 [705472]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Pin carbonate nóng chảy (MCFC) kết hợp nhiệt và điện cho các trạm điện phân cấp và cho các phương tiện giao thông chuyển hoá năng lượng thành điện năng:
Anode (+): H2(g)+ CO32–(aq) ⟶ H2O(l) + CO2(g) + 2e
Cathode (–): 1/2O2(g) + CO2(g) + 2e ⟶ CO32–(aq)
Một động cơ “DEUZT MODEL TCD 2012” sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi giờ động cơ tiêu hao 88 kWh. Tính khối lượng theo đơn vị kg của khí hydrogen đã tiêu thụ (Làm tròn đến hàng phần trăm) trong 1 giờ? Cho biết: (H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
(H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
Anode (+): H2(g)+ CO32–(aq) ⟶ H2O(l) + CO2(g) + 2e
Cathode (–): 1/2O2(g) + CO2(g) + 2e ⟶ CO32–(aq)
Một động cơ “DEUZT MODEL TCD 2012” sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi giờ động cơ tiêu hao 88 kWh. Tính khối lượng theo đơn vị kg của khí hydrogen đã tiêu thụ (Làm tròn đến hàng phần trăm) trong 1 giờ? Cho biết:
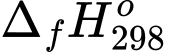 (H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
(H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s. 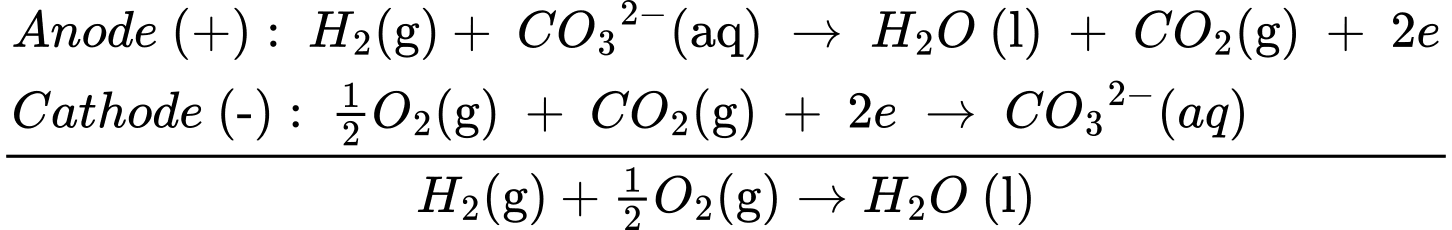
Năng lượng động cơ thật sự tiêu hao trong 1 giờ là: 88 × 3,6 × 106 ÷ 0,6 = 582000 kJ
1 mol H2 chuyển hóa thành lượng năng lượng là 285,84 (kJ)
x mol H2 chuyển hóa thành lượng năng lượng là 582000 (kJ)
→ x = 528000 ÷ 285,84 = 1874,187 (mol)
Khối lượng H2 cần dung là: mH2 = 1874,187 × 2 = 3694,374 (g) ≈ 3,69 (kg)
⇒ Điền đáp án: 3,69