Câu 1 [680879]: Khi bảo quản trong phòng thí nghiệm, muối Mohr (FeSO4.(NH4)2SO4.6H2O) bị hút ẩm và bị oxi hóa một phần bởi O2 trong không khí thành hỗn hợp X. Để xác định phần trăm khối lượng muối Mohr trong X, tiến hành hòa tan hoàn toàn 2,656 gam X trong nước rồi pha thành 100,0 mL dung dịch Y. Chuẩn độ 10,00 mL dung dịch Y (trong môi trường sulfuric acid loãng, dư) bằng dung dịch KMnO4 nồng độ 0,012 M đến khi xuất hiện màu hồng nhạt thì dừng. Lặp lại thí nghiệm chuẩn độ thêm 2 lần nữa. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,72 mL. Phần trăm khối lượng của muối Mohr trong X là a %. Tính giá trị của a (làm tròn đến hàng phần muời).
Phương trình phản ứng:
5Fe2+ + MnO4- + 8H+ → Mn2+ + 5Fe3+ + 4H2O
Đổi 9,72 mL = 0,00972 L
Số mol của KMnO4 là nKMnO4 = 0,00972 × 0,012 = 0,00011664 mol
Từ phương trình hóa học số mol của Fe2+ là 0,0005832 mol
Phần trăm khối lượng của muối Mohr trong X là
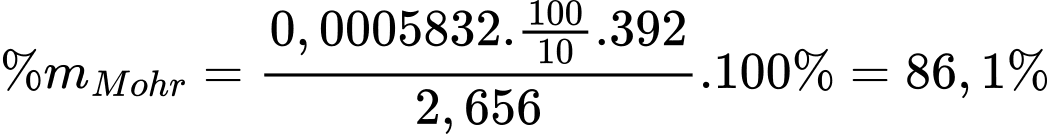
⟹ Điền đáp án 86,1
5Fe2+ + MnO4- + 8H+ → Mn2+ + 5Fe3+ + 4H2O
Đổi 9,72 mL = 0,00972 L
Số mol của KMnO4 là nKMnO4 = 0,00972 × 0,012 = 0,00011664 mol
Từ phương trình hóa học số mol của Fe2+ là 0,0005832 mol
Phần trăm khối lượng của muối Mohr trong X là
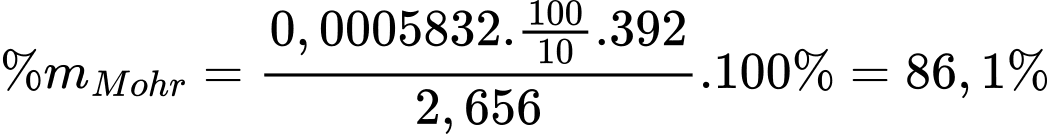
⟹ Điền đáp án 86,1
Câu 2 [830090]: Tiến hành thí nghiệm chuẩn độ dung dịch FeSO4 nồng độ a M theo các bước sau:
Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch FeSO4 nồng độ a M cho vào bình định mức loại 50 mL. Thêm tiếp nước cất vào bình định mức đến vạch, lắc đều, thu được 50 mL dung dịch Y.
Bước 2: Lấy 10,00 mL dung dịch Y cho vào bình tam giác, thêm H2SO4 loãng. Tiến hành chuẩn độ và ghi kết quả thể tích dung dịch KMnO4 0,02M ở bảng sau:
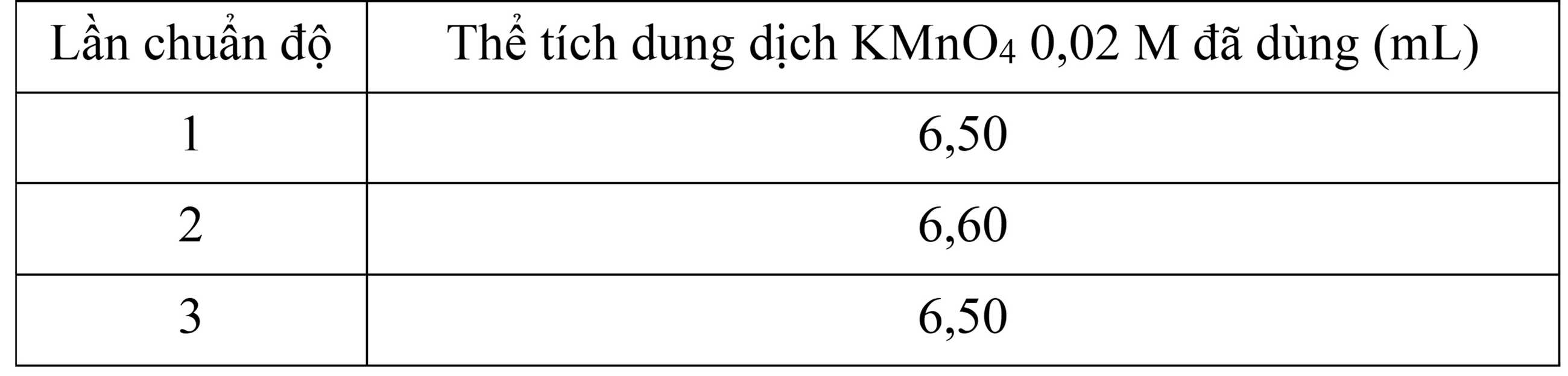
Xác định giá trị của a.
Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch FeSO4 nồng độ a M cho vào bình định mức loại 50 mL. Thêm tiếp nước cất vào bình định mức đến vạch, lắc đều, thu được 50 mL dung dịch Y.
Bước 2: Lấy 10,00 mL dung dịch Y cho vào bình tam giác, thêm H2SO4 loãng. Tiến hành chuẩn độ và ghi kết quả thể tích dung dịch KMnO4 0,02M ở bảng sau:

Xác định giá trị của a.
Đổi 5 mL = 0,005 L
Thể tích trung bình của KMnO4 là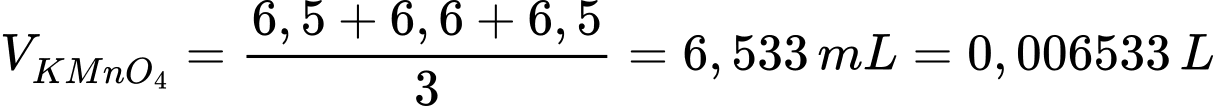
Phương trình phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là nKMnO4 = 0,006533 × 0,02 = 0,00013066 mol
Theo phương trình số mol của FeSO4 là 0,0006533 mol
Nồng độ của dung dịch FeSO4 ban đầu là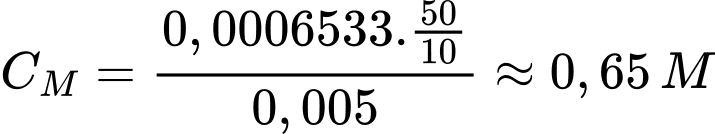
⟹ Điền đáp án 0,65
Thể tích trung bình của KMnO4 là
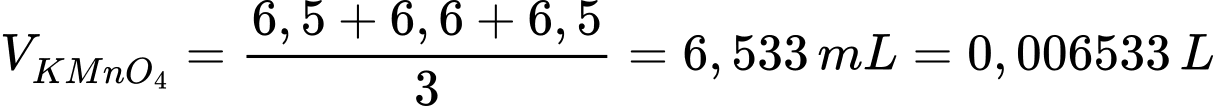
Phương trình phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là nKMnO4 = 0,006533 × 0,02 = 0,00013066 mol
Theo phương trình số mol của FeSO4 là 0,0006533 mol
Nồng độ của dung dịch FeSO4 ban đầu là
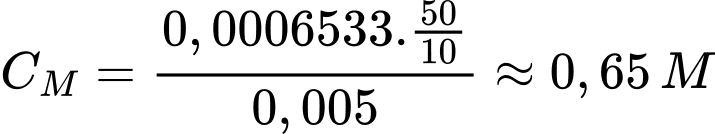
⟹ Điền đáp án 0,65
Câu 3 [830093]: Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O bị oxy hóa bởi oxy không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho BaCl2 vào 25 mL dung dịch Y, thu được 0,0425 mol kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 loãng vào 25 mL dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,04 M vào Z đến khi phản ứng vừa đủ thì hết 120 mL.
Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng đơn vị).
Thí nghiệm 1: Cho BaCl2 vào 25 mL dung dịch Y, thu được 0,0425 mol kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 loãng vào 25 mL dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,04 M vào Z đến khi phản ứng vừa đủ thì hết 120 mL.
Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng đơn vị).
Thí nghiệm 1:
SO42- + Ba2+ → BaSO4
Bảo toàn gốc SO42- ta có: nFeSO4.7H2O + 0,05 × 25/100 = 0,0425 mol
→ nFeSO4.7H2O = 0,03 mol
Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 120 mL = 0,12 L
Số mol của KMnO4 là nKMnO4 = 0,12 × 0,04 = 0,0048 mol
Theo phương trình số mol của FeSO4 là 0,024 mol
Phần trăm số mol Fe(II) đã bị oxi hóa trong không khí là
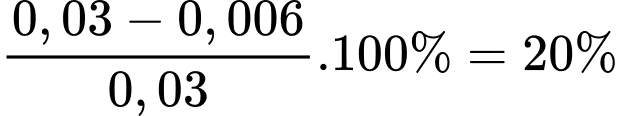 .
.
⟹ Điền đáp án 20
SO42- + Ba2+ → BaSO4
Bảo toàn gốc SO42- ta có: nFeSO4.7H2O + 0,05 × 25/100 = 0,0425 mol
→ nFeSO4.7H2O = 0,03 mol
Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 120 mL = 0,12 L
Số mol của KMnO4 là nKMnO4 = 0,12 × 0,04 = 0,0048 mol
Theo phương trình số mol của FeSO4 là 0,024 mol
Phần trăm số mol Fe(II) đã bị oxi hóa trong không khí là
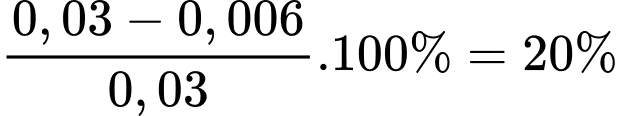 .
. ⟹ Điền đáp án 20
Câu 4 [830091]: Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10,0 mL dung dịch X, thêm 10,0 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023 M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
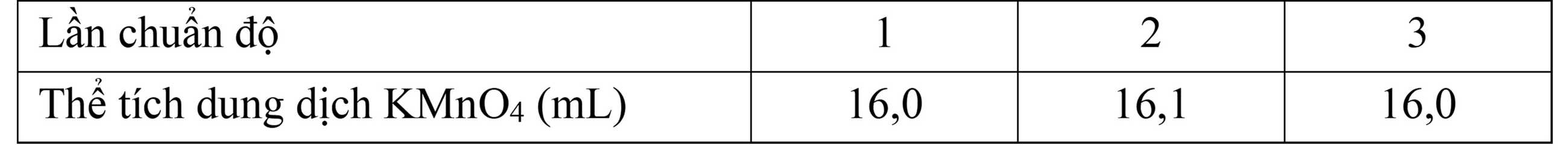
Độ tinh khiết (phần trăm khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr là bao nhiêu (làm tròn đến hàng phần mười)?

Độ tinh khiết (phần trăm khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr là bao nhiêu (làm tròn đến hàng phần mười)?
Đổi 5 mL = 0,005 L
Thể tích trung bình của KMnO4 là
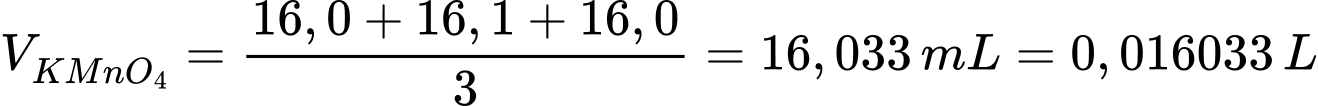
Phương trình phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là nKMnO4 = 0,016033 × 0,023 = 0,0003688 mol
Từ phương trình hóa học số mol của FeSO4 là 0,001844 mol
Độ tinh khiết (phần trăm khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr là
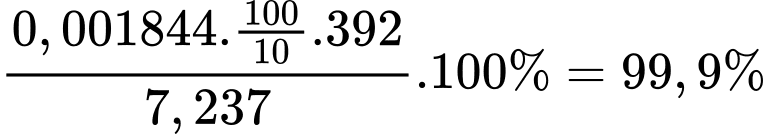
⟹ Điền đáp án 99,9
Thể tích trung bình của KMnO4 là
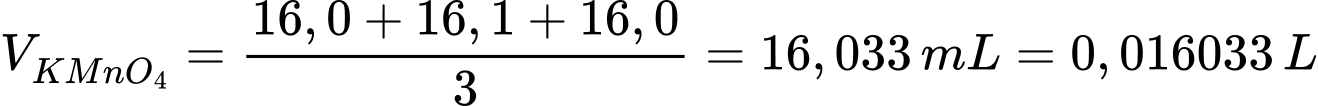
Phương trình phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là nKMnO4 = 0,016033 × 0,023 = 0,0003688 mol
Từ phương trình hóa học số mol của FeSO4 là 0,001844 mol
Độ tinh khiết (phần trăm khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr là
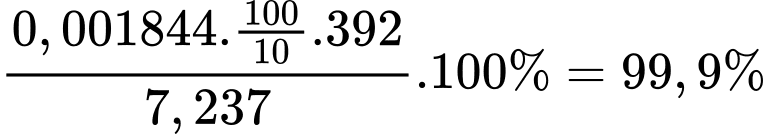
⟹ Điền đáp án 99,9
Câu 5 [830094]: Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O bị oxi hóa bởi oxygen trong không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan hoàn toàn X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với dung dịch Y:
▪ Thí nghiệm 1: Cho lượng dư dung dịch Ba(NO3)2 vào 25,0 mL dung dịch Y, thu được 6,99 gam kết tủa.
▪ Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25,0 mL dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1 M vào Z đến khi phản ứng vừa đủ thì hết 30,0 mL. Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng phần mười).
▪ Thí nghiệm 1: Cho lượng dư dung dịch Ba(NO3)2 vào 25,0 mL dung dịch Y, thu được 6,99 gam kết tủa.
▪ Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25,0 mL dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1 M vào Z đến khi phản ứng vừa đủ thì hết 30,0 mL. Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng phần mười).
Thí nghiệm 1:
SO42- + Ba2+ → BaSO4
Đặt số mol của FeSO4 và Fe2(SO4)3 trong 25 mL dung dịch lần lượt là a và b mol
Số mol của BaSO4 là nBaSO4 = 6,99 ÷ 233 = 0,03 mol
Bảo toàn gốc SO42- ta có: nFeSO4.7H2O + 0,05 × 25/100 = 0,03 mol
→ nFeSO4.7H2O = 0,0175 mol.
Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 30 mL = 0,03 L
Số mol của KMnO4 là nKMnO4 = 0,03 × 0,1 = 0,003 mol
Theo phương trình số mol của FeSO4 là 0,015 mol
Phần trăm số mol Fe(II) đã bị oxi hóa trong không khí là
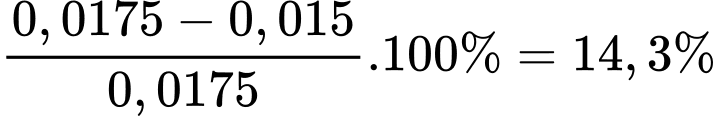 .
.
⟹ Điền đáp án 14,3
Câu 6 [703981]: Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện tượng phú dưỡng. Để xác định hàm lượng nitrate trong nước, người ta tiến hành các thí nghiệm như sau:
Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr (NH4)2SO4.FeSO4.6H2O, thêm dung dịch H2SO4 1 M vào và chuẩn độ bằng dung dịch KMnO4.
Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
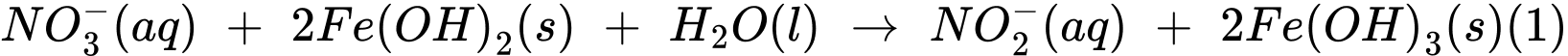
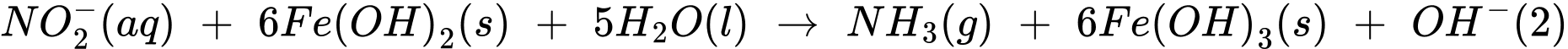
Sau khi các phản ứng (1) và (2) xảy ra hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg có trong mẫu nước (làm tròn đến hàng phần mười).
có trong mẫu nước (làm tròn đến hàng phần mười).
Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr (NH4)2SO4.FeSO4.6H2O, thêm dung dịch H2SO4 1 M vào và chuẩn độ bằng dung dịch KMnO4.
Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
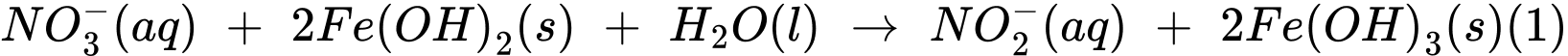
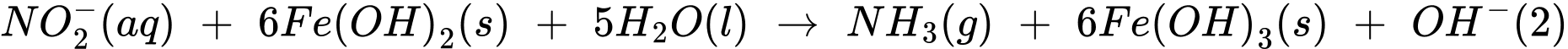
Sau khi các phản ứng (1) và (2) xảy ra hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg
 có trong mẫu nước (làm tròn đến hàng phần mười).
có trong mẫu nước (làm tròn đến hàng phần mười).
Gọi tổng số mol MnO4- cần dùng trong thí nghiệm 1 là a (mol), ta có:
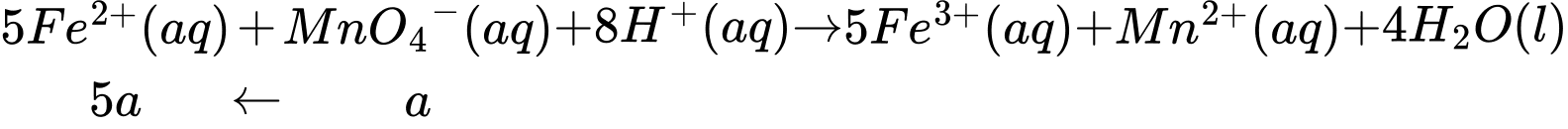
Gọi số mol NO3- đã dùng ở thí nghiệm 2 là b (mol), ta có:
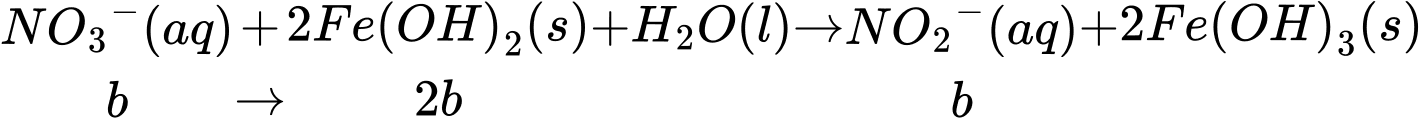
Lượng NO2- sinh ra là b (mol) tiếp tục phản ứng với Fe(OH)2
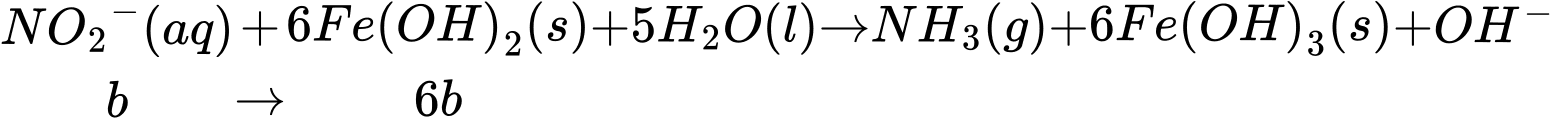
Thấy ban đầu ta có tổng số mol Fe2+ = 5a (mol), đã dùng hết (2b + 6b) mol ở thí nghiệm 2 nên lượng Fe2+ dư còn lại là:
nFe2+ dư = 5a - 8b (mol). Khi này, quá trình lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 xảy ra như sau:
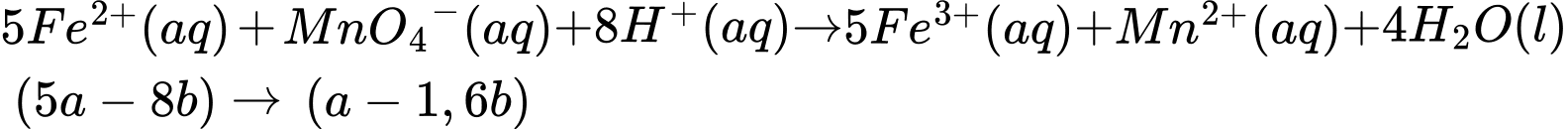
⇒ Số mol MnO4- chênh lệch là: nMnO4- (TN1) - nMnO4- (TN2) = a - (a - 1,6b) = 1,6b (mol)
Coi 1,6b (mol) = 1 (mmol) = 1x10-3 (mol) ⟶ b = 6,25x10-4 (mol)
Khối lượng NO3- có trong mẫu nước tương ứng với số mol MnO4- chênh lệch là:
mNO3- = 62.b = 62 . 6,25x10-4 = 0,03875 (g) = 38,75 (mg) ≈ 38,8 (mg)
⇒ Điền đáp án: 38,8
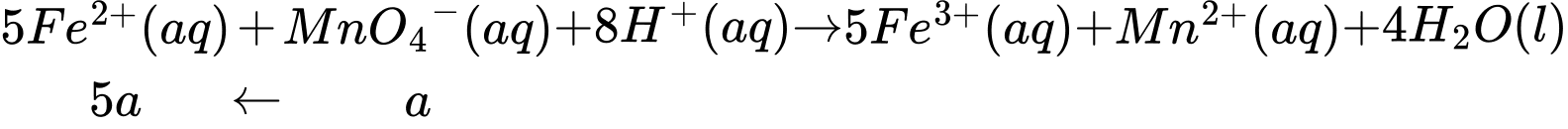
Gọi số mol NO3- đã dùng ở thí nghiệm 2 là b (mol), ta có:
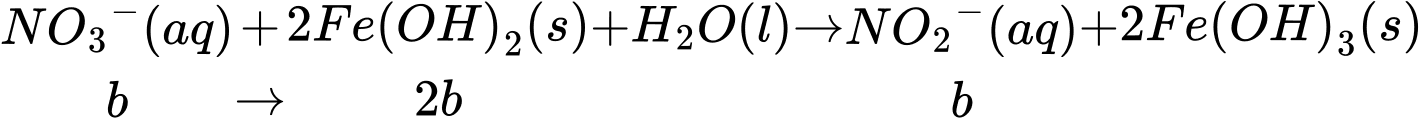
Lượng NO2- sinh ra là b (mol) tiếp tục phản ứng với Fe(OH)2
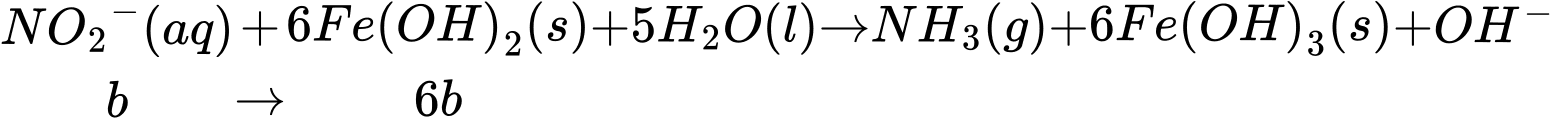
Thấy ban đầu ta có tổng số mol Fe2+ = 5a (mol), đã dùng hết (2b + 6b) mol ở thí nghiệm 2 nên lượng Fe2+ dư còn lại là:
nFe2+ dư = 5a - 8b (mol). Khi này, quá trình lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 xảy ra như sau:
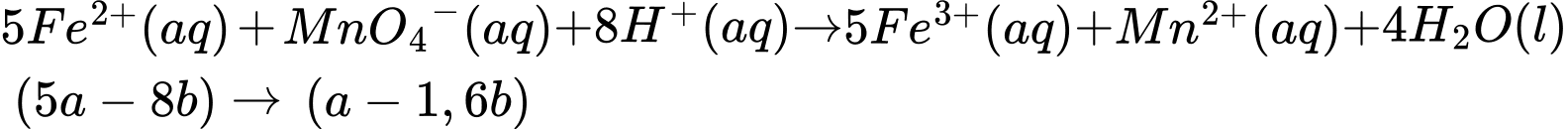
⇒ Số mol MnO4- chênh lệch là: nMnO4- (TN1) - nMnO4- (TN2) = a - (a - 1,6b) = 1,6b (mol)
Coi 1,6b (mol) = 1 (mmol) = 1x10-3 (mol) ⟶ b = 6,25x10-4 (mol)
Khối lượng NO3- có trong mẫu nước tương ứng với số mol MnO4- chênh lệch là:
mNO3- = 62.b = 62 . 6,25x10-4 = 0,03875 (g) = 38,75 (mg) ≈ 38,8 (mg)
⇒ Điền đáp án: 38,8
Câu 7 [830098]: Siderite là một khoáng vật quan trọng trong ngành công nghiệp và khai thác quặng sắt, có thành chính là FeCO3. Hàm lượng sắt trong quặng này có thể được xác định bằng phương pháp chuẩn độ. Người ta tiến hành thí nghiệm như sau:
▪ Bước 1: Cân chính xác 1,095 gam mẫu quặng siderite đã nghiền mịn và chuyển toàn bộ sang cốc thủy tinh 100 mL.
▪ Bước 2: Thêm 50 mL dung dịch H2SO4 loãng vào cốc, đun nhẹ để hòa tan quặng và đuổi khí CO2. Sau khi hòa tan hoàn toàn, lọc lấy dung dịch và loại bỏ phần không tan. Sau đó định mức thành 100 mL dung dịch.
FeCO3 + H2SO4 FeSO4 + CO2 + H2O
FeSO4 + CO2 + H2O
▪ Bước 3: Hút chính xác 10,00 mL dung dịch sau khi định mức cho vào bình tam giác, thêm 2 mL dung dịch H2SO4 loãng và thêm tiếp 10 giọt dung dịch H3PO4 (để che màu vàng của ion Fe3+). Đun nóng bình tam giác đến 60 oC, chuẩn độ bằng dung dịch KMnO4 nồng độ 0,015 M đến khi xuất hiện màu hồng nhạt bên trong 10 giây thì dừng lại.
10FeSO4 + 2KMnO4 + 8H2SO4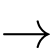 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Lặp lại bước 3 thêm hai lần nữa. Thể tích trung bình của dung dịch KMnO4 sau ba lần chuẩn độ là 10,06 mL. Phần trăm khối lượng sắt trong quặng siderite là bao nhiêu phần trăm (làm tròn kết quả đến hàng phần mười)?
▪ Bước 1: Cân chính xác 1,095 gam mẫu quặng siderite đã nghiền mịn và chuyển toàn bộ sang cốc thủy tinh 100 mL.
▪ Bước 2: Thêm 50 mL dung dịch H2SO4 loãng vào cốc, đun nhẹ để hòa tan quặng và đuổi khí CO2. Sau khi hòa tan hoàn toàn, lọc lấy dung dịch và loại bỏ phần không tan. Sau đó định mức thành 100 mL dung dịch.
FeCO3 + H2SO4
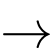 FeSO4 + CO2 + H2O
FeSO4 + CO2 + H2O▪ Bước 3: Hút chính xác 10,00 mL dung dịch sau khi định mức cho vào bình tam giác, thêm 2 mL dung dịch H2SO4 loãng và thêm tiếp 10 giọt dung dịch H3PO4 (để che màu vàng của ion Fe3+). Đun nóng bình tam giác đến 60 oC, chuẩn độ bằng dung dịch KMnO4 nồng độ 0,015 M đến khi xuất hiện màu hồng nhạt bên trong 10 giây thì dừng lại.
10FeSO4 + 2KMnO4 + 8H2SO4
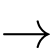 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2OLặp lại bước 3 thêm hai lần nữa. Thể tích trung bình của dung dịch KMnO4 sau ba lần chuẩn độ là 10,06 mL. Phần trăm khối lượng sắt trong quặng siderite là bao nhiêu phần trăm (làm tròn kết quả đến hàng phần mười)?
Phương trình phản ứng:
FeCO3 + H2SO4 →FeSO4 + CO2 + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 10,06 mL = 0,01006 L
Số mol của KMnO4 là n KMnO4 = 0,01006 × 0,015 = 0,0001509 mol
Từ phương trình hóa học số mol của FeCO3 là 0,0007545 mol
Phần trăm khối lượng sắt trong quặng siderite là
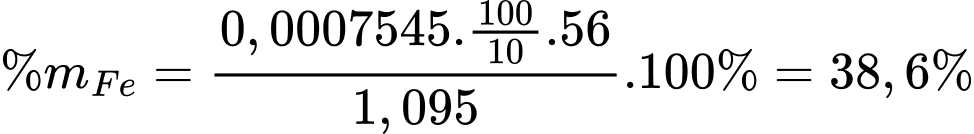
⟹ Điền đáp án 38,6
FeCO3 + H2SO4 →FeSO4 + CO2 + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Đổi 10,06 mL = 0,01006 L
Số mol của KMnO4 là n KMnO4 = 0,01006 × 0,015 = 0,0001509 mol
Từ phương trình hóa học số mol của FeCO3 là 0,0007545 mol
Phần trăm khối lượng sắt trong quặng siderite là
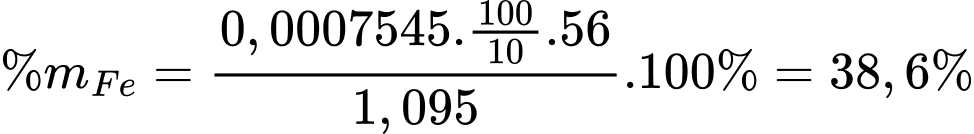
⟹ Điền đáp án 38,6
Câu 8 [830100]: Chuẩn độ dung dịch H2C2O4 bằng dung dịch KMnO4:
▪ Bước 1: Rót dung dịch KMnO4 0,002M vào burette (tối màu), điều chỉnh đến vạch ‘0’.
▪ Bước 2: Dùng pipete lấy 10 mL dung dịch mẫu chứa H2C2O4 (nồng độ Co) cho vào bình định mức, sau đó cho tiếp nước cất đến vạch định mức 100 mL (lắc đều). Lấy 10 mL dung dịch từ bình định mức cho vào bình tam giác, cho thêm 5 mL dung dịch HClO4 (dùng dư so với lượng phản ứng), rồi cho thêm nước cất đến khoảng 25 mL.
▪ Bước 3: Cho từ từ dung dịch KMnO4 0,002 M từ burette vào bình tam giác đã chứa hỗn hợp H2C2O4 và HClO4 ở bước 2 và lắc đều cho đến khi dung dịch chuyển sang màu hồng (bền trong 30 s) thì dừng chuẩn độ.
Lặp lại thí nghiệm trên thêm 2 lần nữa, kết quả ghi nhận được thể tích dung dịch KMnO4 0,002 M như sau:
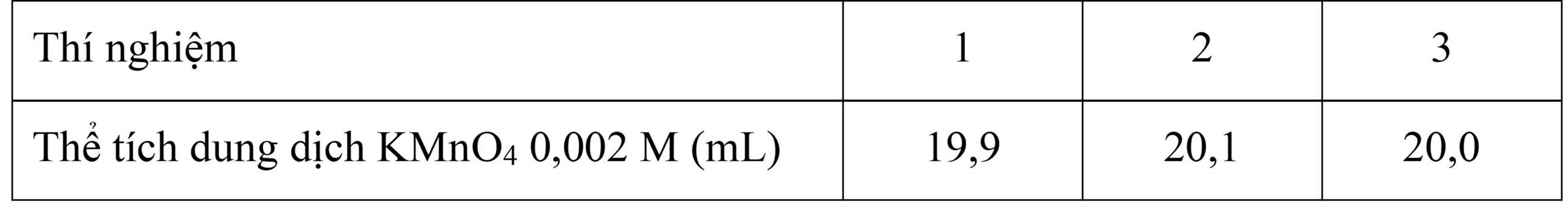
Tính nồng độ Co (mol/L) của dung dịch H2C2O4 ban đầu.
▪ Bước 1: Rót dung dịch KMnO4 0,002M vào burette (tối màu), điều chỉnh đến vạch ‘0’.
▪ Bước 2: Dùng pipete lấy 10 mL dung dịch mẫu chứa H2C2O4 (nồng độ Co) cho vào bình định mức, sau đó cho tiếp nước cất đến vạch định mức 100 mL (lắc đều). Lấy 10 mL dung dịch từ bình định mức cho vào bình tam giác, cho thêm 5 mL dung dịch HClO4 (dùng dư so với lượng phản ứng), rồi cho thêm nước cất đến khoảng 25 mL.
▪ Bước 3: Cho từ từ dung dịch KMnO4 0,002 M từ burette vào bình tam giác đã chứa hỗn hợp H2C2O4 và HClO4 ở bước 2 và lắc đều cho đến khi dung dịch chuyển sang màu hồng (bền trong 30 s) thì dừng chuẩn độ.
Lặp lại thí nghiệm trên thêm 2 lần nữa, kết quả ghi nhận được thể tích dung dịch KMnO4 0,002 M như sau:

Tính nồng độ Co (mol/L) của dung dịch H2C2O4 ban đầu.
Đổi 5 mL = 0,005 L
Thể tích trung bình của KMnO4 là
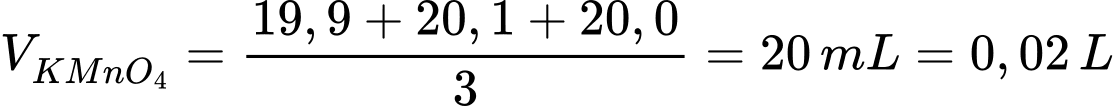
Phương trình phản ứng:
2KMnO4 + 5H2C2O4 + 6H+ → 2Mn2+ + 8H2O + 10CO2 + 2K+
Số mol của KMnO4 là nKMnO4 = 0,02 × 0,002 = 0,00004 mol
Từ phương trình hóa học số mol của H2C2O4 là 0,0001 mol
Nồng độ Co (mol/L) của dung dịch H2C2O4 ban đầu là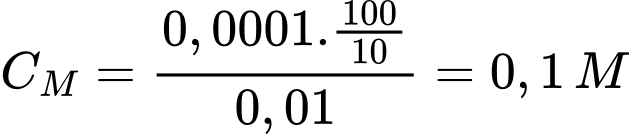
⟹ Điền đáp án 0,1
Thể tích trung bình của KMnO4 là
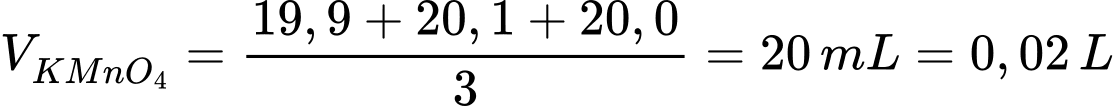
Phương trình phản ứng:
2KMnO4 + 5H2C2O4 + 6H+ → 2Mn2+ + 8H2O + 10CO2 + 2K+
Số mol của KMnO4 là nKMnO4 = 0,02 × 0,002 = 0,00004 mol
Từ phương trình hóa học số mol của H2C2O4 là 0,0001 mol
Nồng độ Co (mol/L) của dung dịch H2C2O4 ban đầu là
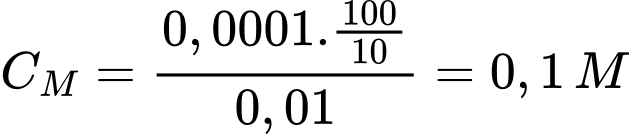
⟹ Điền đáp án 0,1
Câu 9 [830109]: Để xác định nồng độ dung dịch NaOH người ta tiến hành: cân 1,26 gam oxalic acid ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 mL. Lấy 10 mL dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) (acid đã bị trung hòa hết) thì hết 20 mL dung dịch NaOH. Nồng độ dung dịch NaOH đã dùng là bao nhiêu (làm tròn kết quả đến hàng phần trăm)?
Phương trình phản ứng:
H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
Số mol của oxalic acid là nH2C2O4 = 1,26 : 126 = 0,01 mol
Số mol của oxalic acid trong 10 mL dung dịch là
nH2C2O4 = 0,001 mol
Từ phương trình hóa học số mol của NaOH là nNaOH = 0,002 mol
Đổi 20 mL = 0,02 L
Nồng độ dung dịch NaOH đã dùng là
CM(NaOH) = 0,002 : 0,02 = 0,1 M.
⟹ Điền đáp án 0,1
H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
Số mol của oxalic acid là nH2C2O4 = 1,26 : 126 = 0,01 mol
Số mol của oxalic acid trong 10 mL dung dịch là
nH2C2O4 = 0,001 mol
Từ phương trình hóa học số mol của NaOH là nNaOH = 0,002 mol
Đổi 20 mL = 0,02 L
Nồng độ dung dịch NaOH đã dùng là
CM(NaOH) = 0,002 : 0,02 = 0,1 M.
⟹ Điền đáp án 0,1
Câu 10 [830107]: Để xác định hàm lượng của acetic acid trong một loại giấm ăn, một học sinh pha loãng loại giấm ăn đó 10 lần rồi tiến hành chuần độ 10 mL giấm ăn sau pha loãng bằng dung dịch NaOH 0,1 M, thu được kết quả như bảng sau:

Biết khối lượng riêng của nước và acetic acid lần lượt là 1 g/mL và 1,05 g/mL. Tính hàm lượng % về thể tích acetic acid có trong loại giấm đó; biết trong thành phần giấm ăn chỉ có acetic acid phản ứng với NaOH.

Biết khối lượng riêng của nước và acetic acid lần lượt là 1 g/mL và 1,05 g/mL. Tính hàm lượng % về thể tích acetic acid có trong loại giấm đó; biết trong thành phần giấm ăn chỉ có acetic acid phản ứng với NaOH.
Thể tích trung bình của NaOH là 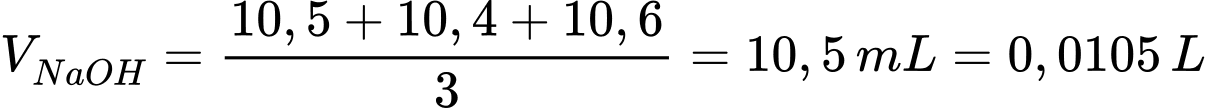
Số mol của NaOH là nNaOH = 0,0105 × 0,1 = 0,00105 mol
Theo phương trình số mol của acetic acid là nCH3COOH = 0,00105 mol
Khối lượng của acetic acid trong ban đầu là mCH3COOH = 0,00105 × 60 × 10 = 0,63 gam
Thể tích của acetic acid trong 10 mL dung dịch ban đầu là VCH3COOH = 0,63 ÷ 1,05 = 6 mL
Hàm lượng % về thể tích acetic acid có trong loại giấm đó là
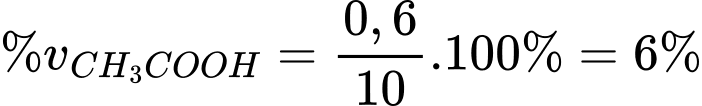 .
.
⟹ Điền đáp án 6
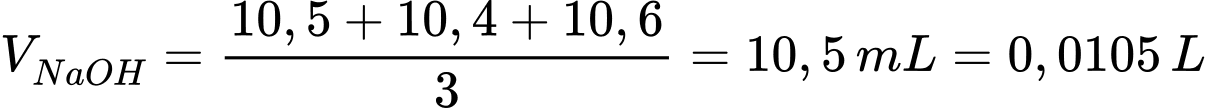
Số mol của NaOH là nNaOH = 0,0105 × 0,1 = 0,00105 mol
Theo phương trình số mol của acetic acid là nCH3COOH = 0,00105 mol
Khối lượng của acetic acid trong ban đầu là mCH3COOH = 0,00105 × 60 × 10 = 0,63 gam
Thể tích của acetic acid trong 10 mL dung dịch ban đầu là VCH3COOH = 0,63 ÷ 1,05 = 6 mL
Hàm lượng % về thể tích acetic acid có trong loại giấm đó là
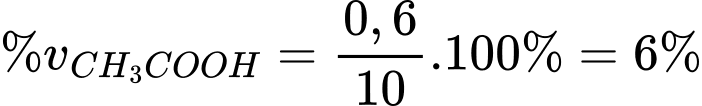 .
. ⟹ Điền đáp án 6
Câu 11 [830119]: Tiến hành chuẩn độ dung dịch NaOH chưa biết nồng độ bằng dung dịch chuẩn HCl 0,1 M với chất chỉ thị phenolphtalein như sau:
Bước 1: Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 – 2 giọt phenolphtalein.
Bước 2: Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
Bước 3: Mở khóa burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) cho đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
Bước 4: Ghi lại thể tích dung dịch NaOH đã dùng.
Nếu nồng độ sodium hydroxide ban đầu là 0,08 M thì khi kết thúc chuẩn độ, thể tích dung dịch NaOH đã sử dụng là bao nhiêu?
Bước 1: Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 – 2 giọt phenolphtalein.
Bước 2: Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
Bước 3: Mở khóa burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) cho đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
Bước 4: Ghi lại thể tích dung dịch NaOH đã dùng.
Nếu nồng độ sodium hydroxide ban đầu là 0,08 M thì khi kết thúc chuẩn độ, thể tích dung dịch NaOH đã sử dụng là bao nhiêu?
Phương trình phản ứng:
NaOH + HCl → NaCl + H2O
Đổi 10 mL = 0,01 L
Số mol của HCl là nHCl = 0,01.0,1 = 0,001 mol
Từ phương trình hóa học số mol của NaOH là 0,001 mol
Thể tích dung dịch NaOH đã sử dụng là:
VNaOH = 0,001 : 0,08 = 0,0125 L = 12,5mL
⟹ Điền đáp án 12,5
NaOH + HCl → NaCl + H2O
Đổi 10 mL = 0,01 L
Số mol của HCl là nHCl = 0,01.0,1 = 0,001 mol
Từ phương trình hóa học số mol của NaOH là 0,001 mol
Thể tích dung dịch NaOH đã sử dụng là:
VNaOH = 0,001 : 0,08 = 0,0125 L = 12,5mL
⟹ Điền đáp án 12,5
Câu 12 [830121]: Aspirin được sử dụng làm thuốc giảm đau, hạ sốt có thành phần chính là acetyl salixylic acid (o–CH3COO–C6H4–COOH) và các tá dược. Cho 1,0 gam aspirin vào 30 mL ethanol và lắc đều thu được dung dịch X. Cho X tác dụng với 40 mL dung dịch NaOH 1 M đun nóng, khi phản ứng xảy ra hoàn toàn đưa về nhiệt độ phòng thu được dung dịch Y. Thêm vài giọt phenolphtalein vào dung dịch Y thấy dung dịch xuất hiện màu hồng. Sau đó thêm từ từ dung dịch HCl 0,5 M vào đến khi dung dịch mất màu hồng thì hết 53 mL. Phần trăm theo khối lượng của acetyl salixylic acid trong mẫu aspirin ban đầu là x%. Giá trị của x là bao nhiêu (kết quả làm tròn đến hàng đơn vị, giả sử các thành phần khác trong aspirin không tham gia vào các phản ứng trên)?
Phương trình phản ứng:
CH3COOC6H4COOH + 3NaOH → CH3COONa + NaOC6H4COONa + 2H2O
HCI + NaOH → NaCl + H2O
Số mol của NaOH và HCl lần lượt là
nNaOH = 0,04 mol;
nHCl = 0,053 × 0,5 = 0,0265 mol
Từ phương trình hóa học số mol của acetyl salixylic acid
→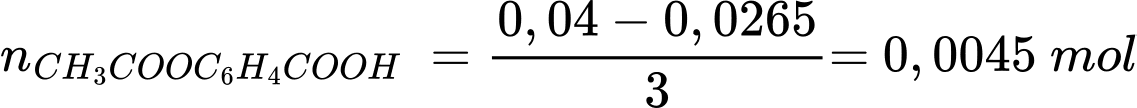
→ %CH3COOC6H4COOH = 0,0045 × 180 × 100% : 1 = 81%
⟹ Điền đáp án 81
CH3COOC6H4COOH + 3NaOH → CH3COONa + NaOC6H4COONa + 2H2O
HCI + NaOH → NaCl + H2O
Số mol của NaOH và HCl lần lượt là
nNaOH = 0,04 mol;
nHCl = 0,053 × 0,5 = 0,0265 mol
Từ phương trình hóa học số mol của acetyl salixylic acid
→
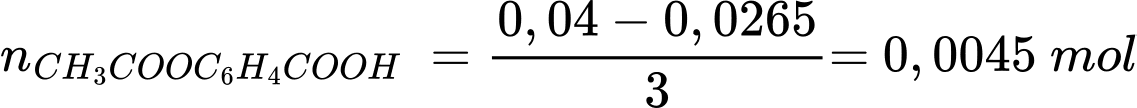
→ %CH3COOC6H4COOH = 0,0045 × 180 × 100% : 1 = 81%
⟹ Điền đáp án 81
Câu 13 [830112]: Tôm thẻ chân trắng là loài thủy sản mang lại thu nhập cao cho người nuôi tôm. Tuy nhiên hiện nay với việc mật độ nuôi ngày càng tăng, chất lượng nước ngày càng bị suy giảm, các thông số môi trường đã trở nên cực kỳ quan trọng đối với sức khỏe tôm. Một trong những chỉ tiêu mà bà con rất ít quan tâm đến nhưng lại có sự ảnh hưởng xuyên suốt từ đầu vụ đến cuối vụ nuôi là pH, pH là chỉ tiêu đo độ hoạt động của ion hydrogen trong nước (H+) hay thể hiện tính acid hay base của nước. Khi pH vượt ngưỡng có ảnh hưởng bất lợi trên tôm như làm tôm chậm lột, suy giảm miễn dịch, stress. Mất cân bằng áp suất thẩm thấu, ... Nồng độ pH phù hợp với độ pH máu của tôm, cá để chúng sinh sống và phát triển tốt nhất khi giá trị pH của nước dao động từ 7,5 – 8,5.
Do sụp tảo, mưa nhiều, rửa trôi phèn vào ao nuôi cũng làm giảm pH xuống 4. Lượng vôi sống cần thiết để điều chỉnh pH của nước về 8 khi xử lí 100 m3 nước là m gam. Tính giá trị của m (làm tròn kết quả đến hàng đơn vị).
Do sụp tảo, mưa nhiều, rửa trôi phèn vào ao nuôi cũng làm giảm pH xuống 4. Lượng vôi sống cần thiết để điều chỉnh pH của nước về 8 khi xử lí 100 m3 nước là m gam. Tính giá trị của m (làm tròn kết quả đến hàng đơn vị).
100 m3 nước ở pH = 4 chứa nH+= 100000 × 10-4 = 10mol
→ Cần 10 mol OH- để trung hòa lượng H+ này.
100 m3 nước ở pH = 8 chứa nOH- = 100000.108-14 = 0,1 mol
→ Tổng số mol OH- cần sử dụng là nOH- = 10 + 0,1 = 10,1 mol
CaO + H2O → Ca(OH)2
Từ phương trình hóa học → nCaO = nCa(OH)2 = 10,1/2 = 5,05 mol
→ mCaO = 5,05 × 56 = 282,8 gam
⟹ Điền đáp án 282
→ Cần 10 mol OH- để trung hòa lượng H+ này.
100 m3 nước ở pH = 8 chứa nOH- = 100000.108-14 = 0,1 mol
→ Tổng số mol OH- cần sử dụng là nOH- = 10 + 0,1 = 10,1 mol
CaO + H2O → Ca(OH)2
Từ phương trình hóa học → nCaO = nCa(OH)2 = 10,1/2 = 5,05 mol
→ mCaO = 5,05 × 56 = 282,8 gam
⟹ Điền đáp án 282
Câu 14 [830105]: Một oleum có công thức H2SO4.nSO3. Hòa tan 7,605 gam oleum vào nước thành 1,0 L dung dịch X. Sau đó lấy 10 mL dung dịch X cho vào bình tam giác, thêm vài giọt dung dịch phenolphathalein. Nhỏ từ từ dung dịch NaOH 0,10 M chứa trên burette vào bình tam giác đến khi dung dịch xuất hiện màu hồng nhạt bên trong 10 giây, đọc thể tích NaOH đã dùng trên burette. Lặp lại thí nghiệm 3 lần, các giá trị thể tích NaOH đọc được lần lượt là 17,9 mL; 18,0 mL; 18,10 mL. Giá trị của n là bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
H2SO4.nSO3 + nH2O → (n+1)H2SO4
2NaOH + H2SO4 → Na2SO4 + H2O
Thể tích trung bình của NaOH là
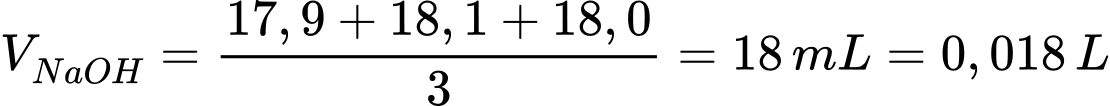
Số mol của NaOH là nNaOH = 0,018.0,1 = 0,0018 mol
Từ phương trình hóa học số mol của NaOH là 0,0009 mol
Ta có:
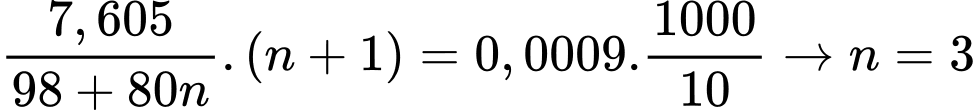
⟹ Điền đáp án 3
2NaOH + H2SO4 → Na2SO4 + H2O
Thể tích trung bình của NaOH là
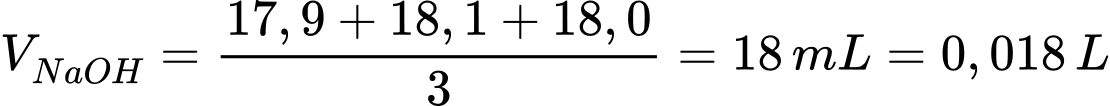
Số mol của NaOH là nNaOH = 0,018.0,1 = 0,0018 mol
Từ phương trình hóa học số mol của NaOH là 0,0009 mol
Ta có:
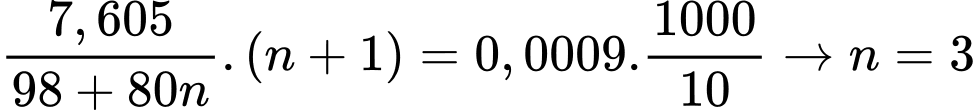
⟹ Điền đáp án 3
Câu 15 [830115]: Hàm lượng cho phép của lưu huỳnh (sulfur) trong nhiên liệu là 0,3% về khối lượng. Để xác định hàm lượng lưu huỳnh trong một loại nhiên liệu người ta lấy 100,0 gam nhiên liệu đó và đốt cháy hoàn toàn. Khí tạo thành chỉ chứa carbon dioxide, sulfur dioxide và hơi nước được dẫn vào nước tạo ra 500,0 mL dung dịch. Biết rằng tất cả sulfur dioxide đã tan vào dung dịch. Lấy 10,0 mL dung dịch này cho tác dụng với dung dịch KMnO4 5,00×10–3 mol/L thì thể tích dung dịch KMnO4 cần dùng là 12,5 mL. Phần trăm khối lượng của lưu huỳnh trong nhiên liệu trên là bao nhiêu?
Phương trình phản ứng:
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Đổi 12,5 mL = 0,0125 L
Số mol của KMnO4 là nKMnO4 = 0,0125 × 0,005 = 0,0000625 mol
Từ phương trình hóa học số mol của SO2 là 1,5625.10-4 mol
Phần trăm khối lượng của lưu huỳnh trong nhiên liệu là
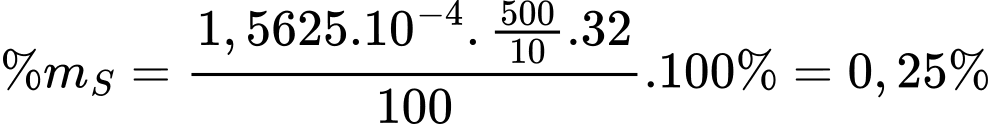
⟹ Điền đáp án 0,25
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Đổi 12,5 mL = 0,0125 L
Số mol của KMnO4 là nKMnO4 = 0,0125 × 0,005 = 0,0000625 mol
Từ phương trình hóa học số mol của SO2 là 1,5625.10-4 mol
Phần trăm khối lượng của lưu huỳnh trong nhiên liệu là
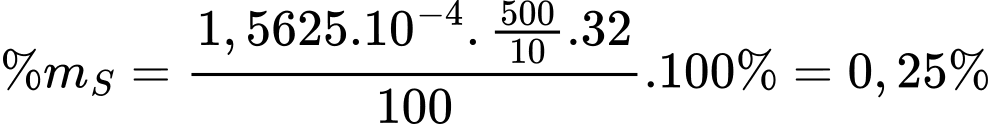
⟹ Điền đáp án 0,25
Câu 16 [830120]: Để xác định hàm lượng khí độc CO trong không khí người ta làm như sau: Lấy 23,0 L không khí (có khối lượng riêng d = 1,2 g/L). Dẫn toàn bộ mẫu khí đó đi từ từ qua thiết bị có ống đựng với lượng dư I2O5 được đốt nóng để oxi hóa toàn bộ lượng CO có trong mẫu thành CO2 và I2, lượng I2 thành hơi và được hấp thụ hết vào bình đựng lượng dư KI tạo ra phức chất KI3. Sau đó chuẩn độ KI3 bằng Na2S2O3 thì cần vừa đủ 11,0 mL dung dịch Na2S2O3 0,002 M. Theo các phương trình hóa học sau:
5CO + I2O5 → I2 + 5CO2;
KI + I2 → KI3;
I3– + 2S2O32– → 3I– +S4O62–
Biết rằng ppm là số microgam (10–6 gam) chất trong 1 gam mẫu. Hàm lượng CO trong mẫu không khí trên theo số ppm CO là bao nhiêu (làm tròn kết quả đến hàng phần mười)?
5CO + I2O5 → I2 + 5CO2;
KI + I2 → KI3;
I3– + 2S2O32– → 3I– +S4O62–
Biết rằng ppm là số microgam (10–6 gam) chất trong 1 gam mẫu. Hàm lượng CO trong mẫu không khí trên theo số ppm CO là bao nhiêu (làm tròn kết quả đến hàng phần mười)?
(1) 5CO + I2O5 → I2 + 5CO2;
(2) KI + I2 → KI3;
(3) I3– + 2S2O32– → 3I– +S4O62–
Đổi 11 mL = 0,011 L
Số mol của Na2S2O3 là n Na2S2O3 = 0,011 × 0,002 = 0,000022 mol
Từ phương trình hóa học số mol của CO là 5,5.10-5 mol
Khối lượng của không khí là mkhí = 23 × 1,2 = 27,6 gam
Số microgam (10–6 gam) chất trong 1 gam mẫu là
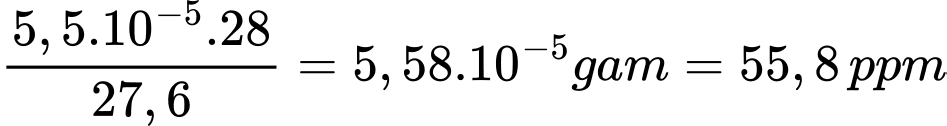
⟹ Điền đáp án 55,8
(2) KI + I2 → KI3;
(3) I3– + 2S2O32– → 3I– +S4O62–
Đổi 11 mL = 0,011 L
Số mol của Na2S2O3 là n Na2S2O3 = 0,011 × 0,002 = 0,000022 mol
Từ phương trình hóa học số mol của CO là 5,5.10-5 mol
Khối lượng của không khí là mkhí = 23 × 1,2 = 27,6 gam
Số microgam (10–6 gam) chất trong 1 gam mẫu là
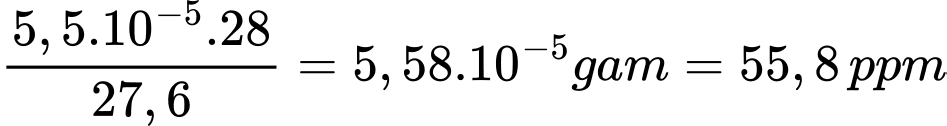
⟹ Điền đáp án 55,8
Câu 17 [705922]: Sulfuric acid là một trong những hoá chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hoá chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được điều chế qua các giai đoạn sau:
(1) 4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
(2) 2SO2(g) + O2(g) ⇌ 2SO3(g)
(3) H2SO4(aq) + nSO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
Dùng sulfuric acid 98% hấp thụ SO3(g) trong giai đoạn (3), quá trình này được thực hiện trong tháp tiếp xúc. Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 L dung dịch sulfuric acid, sau đó tiến hành chuẩn độ 10,00 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Công thức của oleum trên có dạng H2SO4.nSO3. Xác định giá trị của n (Làm tròn đến số nguyên).
(1) 4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
(2) 2SO2(g) + O2(g) ⇌ 2SO3(g)
(3) H2SO4(aq) + nSO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
Dùng sulfuric acid 98% hấp thụ SO3(g) trong giai đoạn (3), quá trình này được thực hiện trong tháp tiếp xúc. Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 L dung dịch sulfuric acid, sau đó tiến hành chuẩn độ 10,00 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Công thức của oleum trên có dạng H2SO4.nSO3. Xác định giá trị của n (Làm tròn đến số nguyên).
H2SO4.nSO3 + nH2O → (n+1)H2SO4
2NaOH + H2SO4 → Na2SO4 + 2H2O
Đổi 20,01 mL = 0,02001 L; 1 L = 1000 mL
Số mol của NaOH là nNaOH = 0,02001.0,1 = 0,002001 mol
Từ phương trình hóa học số mol của H2SO4 là nH2SO4 = 0,0010005 mol
Số mol của oleum trong 10 mL là
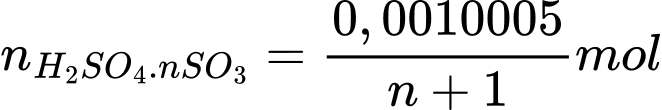
Khối lượng của oleum là
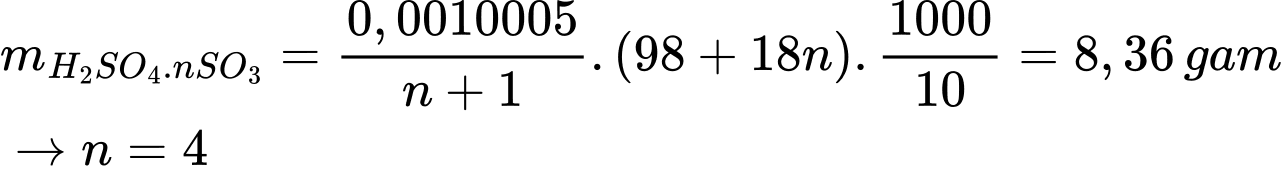
⟹Điền đáp án : 4
2NaOH + H2SO4 → Na2SO4 + 2H2O
Đổi 20,01 mL = 0,02001 L; 1 L = 1000 mL
Số mol của NaOH là nNaOH = 0,02001.0,1 = 0,002001 mol
Từ phương trình hóa học số mol của H2SO4 là nH2SO4 = 0,0010005 mol
Số mol của oleum trong 10 mL là
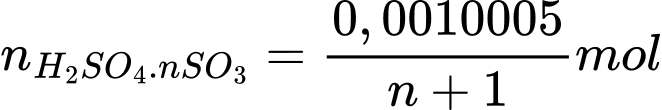
Khối lượng của oleum là
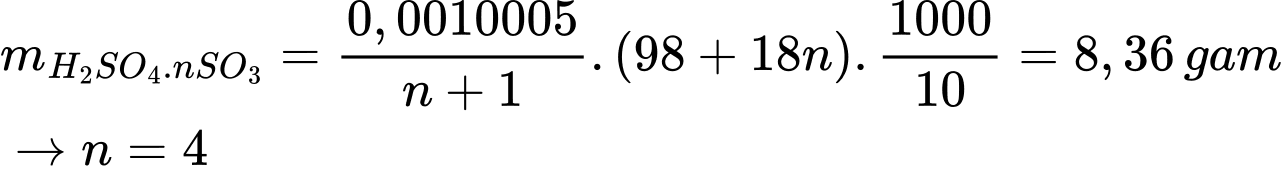
⟹Điền đáp án : 4
Câu 18 [830122]: Cyanide (CN–) là một loại chất độc hại thường được tìm thấy trong nước thải của các công ty khai thác quặng kim loại vàng. Do cyanide có khả năng tạo phức mạnh với kim loại, các công ty khai thác mỏ đã kiếm được lợi nhuận khổng lồ từ việc sử dụng cyanide để tách Au từ quặng của nó. Theo tiêu chuẩn Việt Nam, hàm lượng cyanide trong nước thải của các nhà máy phải xử lí trong khoảng 0,05 – 0,2 mg/L trước khi thải ra môi trường. Phân tích một mẫu nước thải của một nhà máy người ta đo được hàm lượng ion cyanide là x mg/L. Để làm giảm hàm lượng cyanide đến 0,12 mg/L người ta sục khí Cl2 vào nước thải trong môi trường có pH = 9. Khi đó cyanide chuyển thành nitrogen không độc theo sơ đồ phản ứng:
CN– + OH– + Cl2 → CO2 + Cl– + H2O + N2
Biết thể tích khí chlorine (ở đkc) cần thiết để xử lí cyanide trong 1000 m3 nước thải trên là 232,40625 m³. Giá trị của x bằng bao nhiêu (làm tròn kết quả đến hàng phần mười)?
CN– + OH– + Cl2 → CO2 + Cl– + H2O + N2
Biết thể tích khí chlorine (ở đkc) cần thiết để xử lí cyanide trong 1000 m3 nước thải trên là 232,40625 m³. Giá trị của x bằng bao nhiêu (làm tròn kết quả đến hàng phần mười)?
Phương trình phản ứng:
2CN- + 5Cl2 + 8OH- → N2 + 2CO2 + 10Cl- + 4H2O
Số mol của Cl2 là nCl2 = 232,40625 × 1000/24,79 = 9375 mol
Từ phương trình hóa học số mol của CN- là nCN- = 3750 mol
Số gam CN- có trong 1 lít nươc thải là:
375029 : 106 = 0,0975 gam = 97,5 mg
Giá trị của x là 97,5 + 0,12 ≈ 97,6 mg
⟹ Điền đáp án 97,6
2CN- + 5Cl2 + 8OH- → N2 + 2CO2 + 10Cl- + 4H2O
Số mol của Cl2 là nCl2 = 232,40625 × 1000/24,79 = 9375 mol
Từ phương trình hóa học số mol của CN- là nCN- = 3750 mol
Số gam CN- có trong 1 lít nươc thải là:
375029 : 106 = 0,0975 gam = 97,5 mg
Giá trị của x là 97,5 + 0,12 ≈ 97,6 mg
⟹ Điền đáp án 97,6
Câu 19 [830099]: Để xác định hàm lượng oxygen (O2) tan trong nước, người ta lấy 100,0 mL nước rồi cho ngay manganese sulphate (MnSO4, dư) và sodium hydroxide (NaOH) vào nước. Sau khi lắc kĩ (không cho tiếp xúc với không khí), manganese(II) hydroxide (Mn(OH)2) bị O2 oxi hóa thành manganese oxohydroxide (MnO(OH)2). Thêm acid (dư) và cho tiếp potassium iodide (KI, dư) vào hỗn hợp, thì ion idodine (I–) bị MnO(OH)2 oxi hóa thành iodine (I2). Lượng I2 sinh ra phản ứng vừa đủ với 10,5 ml dung dịch Na2S2O3 0,01 M (sodium thiosulphate). Biết các phản ứng xảy ra như sau:
Mn2+ + 2OH– → Mn(OH)2 (1)
2Mn(OH)2 + O2 → 2MnO(OH)2 (2)
MnO(OH)2 + 2I– + 4H+ → Mn2+ + I2 + 3H2O (3)
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI (4)
Hàm lượng O2 tan trong nước (tính theo mg O2/1 L) là a. Giá trị của a là bao nhiêu (làm tròn kết quả đến hàng phần mười)?
Mn2+ + 2OH– → Mn(OH)2 (1)
2Mn(OH)2 + O2 → 2MnO(OH)2 (2)
MnO(OH)2 + 2I– + 4H+ → Mn2+ + I2 + 3H2O (3)
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI (4)
Hàm lượng O2 tan trong nước (tính theo mg O2/1 L) là a. Giá trị của a là bao nhiêu (làm tròn kết quả đến hàng phần mười)?
(1) Mn2+ + 2OH– → Mn(OH)2
(2) 2Mn(OH)2 + O2 → 2MnO(OH)2
(3) MnO(OH)2 + 2I– + 4H+ → Mn2+ + I2 + 3H2O
(4) I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Đổi 10,5 mL = 0,0105 L
Số mol của Na2S2O3 là nNa2S2O3 = 0,0105 × 0,01 = 0,000105 mol
Từ phương trình hóa học số mol của O2 là 0,00002625 mol
Hàm lượng O2 tan trong nước (tính theo mg O2/1 L)
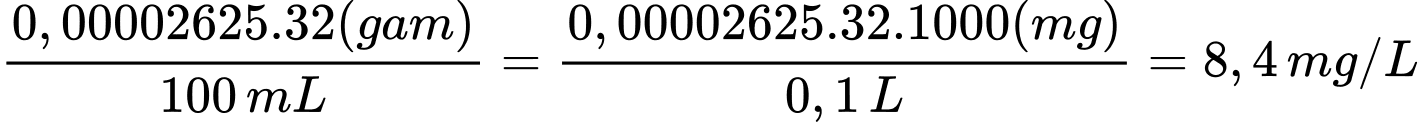 .
.
⟹ Điền đáp án 8,4
(2) 2Mn(OH)2 + O2 → 2MnO(OH)2
(3) MnO(OH)2 + 2I– + 4H+ → Mn2+ + I2 + 3H2O
(4) I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Đổi 10,5 mL = 0,0105 L
Số mol của Na2S2O3 là nNa2S2O3 = 0,0105 × 0,01 = 0,000105 mol
Từ phương trình hóa học số mol của O2 là 0,00002625 mol
Hàm lượng O2 tan trong nước (tính theo mg O2/1 L)
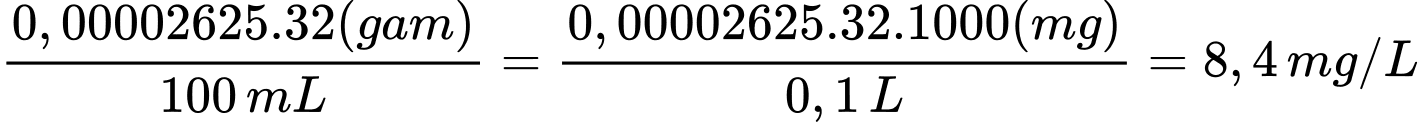 .
.⟹ Điền đáp án 8,4
Câu 20 [703024]: Trong quá trình chế biến sản phẩm đông lạnh xuất khẩu cần sử dụng chlorine trong qua trình sơ chế nguyên liệu và diệt vi sinh vật. Thị trường lớn như Mỹ và Châu Âu, được xem là thị trường khó tính, nên tiêu chuẩn chất lượng được kiểm soát chặt chẽ trước khi nhập nguyên liệu và sau khi thành phẩm, đóng gói. Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1mg/l. Phương pháp chuẩn độ iodine – thiosulfate được dùng để xác định dư lượng chlorile trong thực phẩm theo phương trình:
Cl2 + 2KI 2KCl + I2.
2KCl + I2.
Sau đó, I2 được nhận biết bằng hồ tinh bột I2 bị khử bởi dung dịch chuẩn sodiumthiosulfate theo phương trình:
I2 + 2Na2S2O3 2NaI + Na2 S4O6.
2NaI + Na2 S4O6.
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Công ty A lấy 100 mL mẫu dung dịch tiến hành chuẩn độ bằng dung dịch Na2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,42 mL ( dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại microburette 1 mL, vạch chia 0,01 mL). Nồng độ chlorine (mg/L) có trong 1 lít dung dịch trên là bao nhiêu (làm tròn đến hàng phần trăm)?
Cl2 + 2KI
 2KCl + I2.
2KCl + I2.Sau đó, I2 được nhận biết bằng hồ tinh bột I2 bị khử bởi dung dịch chuẩn sodiumthiosulfate theo phương trình:
I2 + 2Na2S2O3
 2NaI + Na2 S4O6.
2NaI + Na2 S4O6.Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Công ty A lấy 100 mL mẫu dung dịch tiến hành chuẩn độ bằng dung dịch Na2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,42 mL ( dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại microburette 1 mL, vạch chia 0,01 mL). Nồng độ chlorine (mg/L) có trong 1 lít dung dịch trên là bao nhiêu (làm tròn đến hàng phần trăm)?
Đổi 0,42 mL = 4,2.10-4 L
Cl2 + 2KI → 2KCl + I2 (1)
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 (2)
Số mol của Na2S2O3 phản ứng là:
4,2.10-4 . 0,01 = 4,2.10-6 (mol)
Từ phương trình hóa học (1) và (2) số mol của Cl2 trong 100ml mẫu dung dịch là 2,1.10-6 (mol)
Khối lượng của Cl2 là: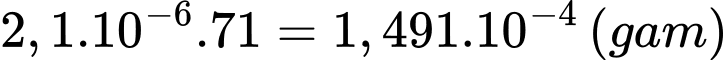
Nồng độ chlorine trong 1 L dung dịch là:
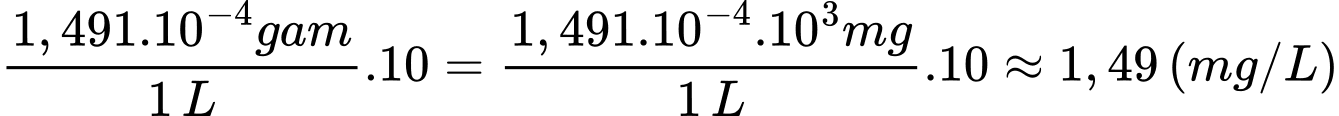
⇒ Điền đáp án: 1,49
Cl2 + 2KI → 2KCl + I2 (1)
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 (2)
Số mol của Na2S2O3 phản ứng là:
4,2.10-4 . 0,01 = 4,2.10-6 (mol)
Từ phương trình hóa học (1) và (2) số mol của Cl2 trong 100ml mẫu dung dịch là 2,1.10-6 (mol)
Khối lượng của Cl2 là:
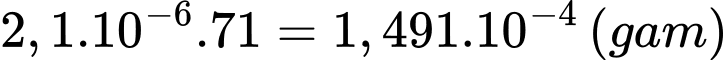
Nồng độ chlorine trong 1 L dung dịch là:
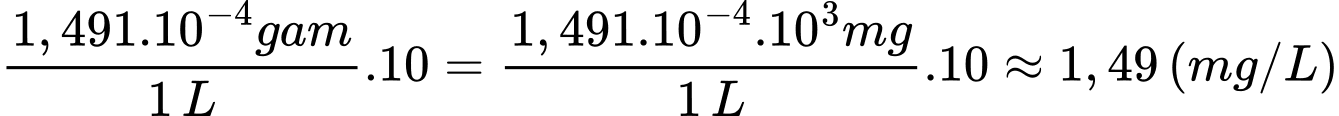
⇒ Điền đáp án: 1,49