Sử dụng thông tin ở bảng dưới đây để trả lời các câu 1 – 2:
Cho các cặp oxi hoá – khử và thể điện cực chuẩn tương ứng:
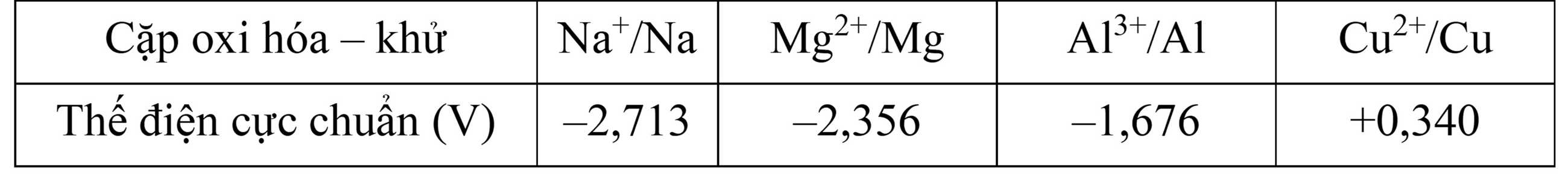
Cho các cặp oxi hoá – khử và thể điện cực chuẩn tương ứng:
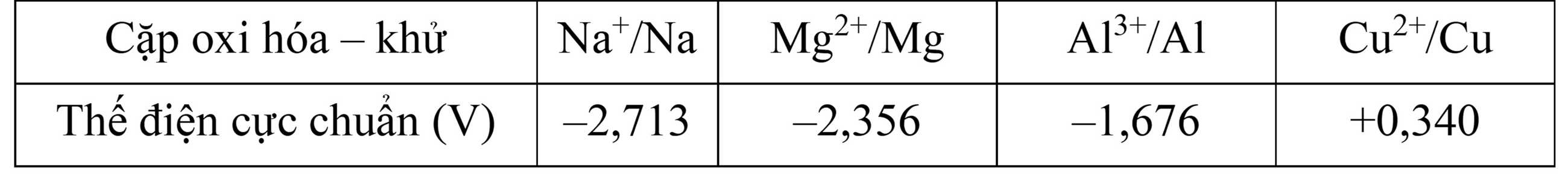
Câu 1 [829769]: Ion kim loại nào sau đây bị khử tại cathode khi điện phân (với điện graphite) dung dịch muối sulfate tương ứng?
A, Mg2+.
B, Na+.
C, Cu2+.
D, Al3+.
Các kim loại mạnh có thế khử chuẩn càng âm thì sẽ được điều chế bằng phương pháp điện phân nóng chảy như Na, Mg, Al.
Ion kim loại bị khử tại cathode khi điện phân (với điện cực graphite) dung dịch muối sulfate tương ứng là Cu.
Điện phân dung dịch CuSO4
Cathode (-) Cu2+ + 2e → Cu
Anode (+) 2H2O → 4H+ + O2 + 4e
Phương trình điện phân: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2.
⟹ Chọn đáp án C Đáp án: C
Ion kim loại bị khử tại cathode khi điện phân (với điện cực graphite) dung dịch muối sulfate tương ứng là Cu.
Điện phân dung dịch CuSO4
Cathode (-) Cu2+ + 2e → Cu
Anode (+) 2H2O → 4H+ + O2 + 4e
Phương trình điện phân: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2.
⟹ Chọn đáp án C Đáp án: C
Câu 2 [829772]: Thí nghiệm điện phân nóng chảy riêng biệt 3 ion kim loại Na+, Mg2+ và Al3+. Nếu ở thí nghiệm điện phân ion Na+ thu được 3,45 gam kim loại thì ở các thí nghiệm còn lại khối lượng kim loại lớn nhất có thể thu được tại một điện cực là bao nhiêu? Giả sử các thí nghiệm được thiết lập ở cùng điều kiện.
A, 3,45 gam.
B, 1,80 gam.
C, 1,35 gam.
D, 1,00 gam.
Nếu ở thí nghiệm điện phân ion Na+ thu được 3,45 gam kim loại
→ Số mol electron trao đổi đối với các thí nghiệm điện phân các kim loại là như nhau
Số mol của Na là nNa = 3,45 ÷ 23 = 0,15 mol
Cathode (-) Na+ + 1e → Na
Số mol electron trao đổi là ne = 0,15 mol
Xét điện phân Mg2+
Cathode (-) Mg2+ + 2e → Mg
Số mol của Mg là nMg = 0,075 mol
→ Khối lượng của kim loại Mg là mMg = 0,075.24 = 1,8 gam
Xét điện phân Al3+
Cathode (-) Al3+ + 3e → Al
Số mol của Al là nAl = 0,05 mol
→ Khối lượng của kim loại Al là mMg = 0,05 × 27 = 1,35 gam
→ Khối lượng kim loại lớn nhất có thể thu được tại một điện cực là 1,8 gam.
⟹ Chọn đáp án B Đáp án: B
→ Số mol electron trao đổi đối với các thí nghiệm điện phân các kim loại là như nhau
Số mol của Na là nNa = 3,45 ÷ 23 = 0,15 mol
Cathode (-) Na+ + 1e → Na
Số mol electron trao đổi là ne = 0,15 mol
Xét điện phân Mg2+
Cathode (-) Mg2+ + 2e → Mg
Số mol của Mg là nMg = 0,075 mol
→ Khối lượng của kim loại Mg là mMg = 0,075.24 = 1,8 gam
Xét điện phân Al3+
Cathode (-) Al3+ + 3e → Al
Số mol của Al là nAl = 0,05 mol
→ Khối lượng của kim loại Al là mMg = 0,05 × 27 = 1,35 gam
→ Khối lượng kim loại lớn nhất có thể thu được tại một điện cực là 1,8 gam.
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin dưới đây để trả lời các câu 3 – 4:
Ở 25°C, nhúng một thanh Zn vào cốc đựng dung dịch ZnSO4 1 M (cốc 1), nhúng một thanh Cu vào cốc đựng dung dịch CuSO4 1 M (cốc 2). Nối thanh Zn và thanh Cu bằng dây dẫn, lắp một vôn kế để đo hiệu điện thế. Đóng kín mạch bằng cầu muối chứa dung dịch bão hoà KNO3.
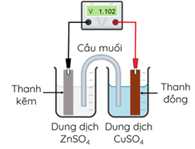
Ở 25°C, nhúng một thanh Zn vào cốc đựng dung dịch ZnSO4 1 M (cốc 1), nhúng một thanh Cu vào cốc đựng dung dịch CuSO4 1 M (cốc 2). Nối thanh Zn và thanh Cu bằng dây dẫn, lắp một vôn kế để đo hiệu điện thế. Đóng kín mạch bằng cầu muối chứa dung dịch bão hoà KNO3.

Câu 3 [829773]: Khi pin hoạt động, sự di chuyển ion nào sau đây là đúng?
A, Ion K+ di chuyển từ cầu muối về cốc 1.
B, Ion NO3– di chuyển từ cầu muối về cốc 1.
C, Ion Zn2+ di chuyển cốc 1 sang cốc 2.
D, Ion Cu2+ di chuyển cốc 2 sang cốc 1.
Quá trình xảy ra trong pin
Cathode (+) Cu2+ + 2e → Cu
Anode (-) Zn → Zn2+ + 2e
→ Phản ứng trong pin: Cu2+ + Zn → Cu + Zn2+
Khi pin hoạt động, sự di chuyển ion NO3- từ cầu muối di chuyển vào dung dịch ZnSO4; K+ di chuyển từ cầu muối vào dung dịch CuSO4.
⟹ Chọn đáp án B Đáp án: B
Cathode (+) Cu2+ + 2e → Cu
Anode (-) Zn → Zn2+ + 2e
→ Phản ứng trong pin: Cu2+ + Zn → Cu + Zn2+
Khi pin hoạt động, sự di chuyển ion NO3- từ cầu muối di chuyển vào dung dịch ZnSO4; K+ di chuyển từ cầu muối vào dung dịch CuSO4.
⟹ Chọn đáp án B Đáp án: B
Câu 4 [829774]: Dựa vào sức điện động của pin và biết 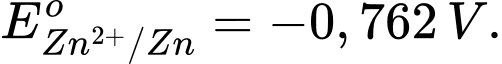 Thế điện cực chuẩn của Cu2+/Cu là bao nhiêu?
Thế điện cực chuẩn của Cu2+/Cu là bao nhiêu?
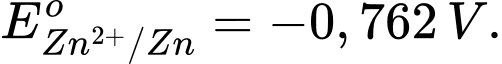 Thế điện cực chuẩn của Cu2+/Cu là bao nhiêu?
Thế điện cực chuẩn của Cu2+/Cu là bao nhiêu? A, 0,340 V.
B, 0,762 V.
C, 1,124 V.
D, 1,864 V.
Quá trình xảy ra trong pin
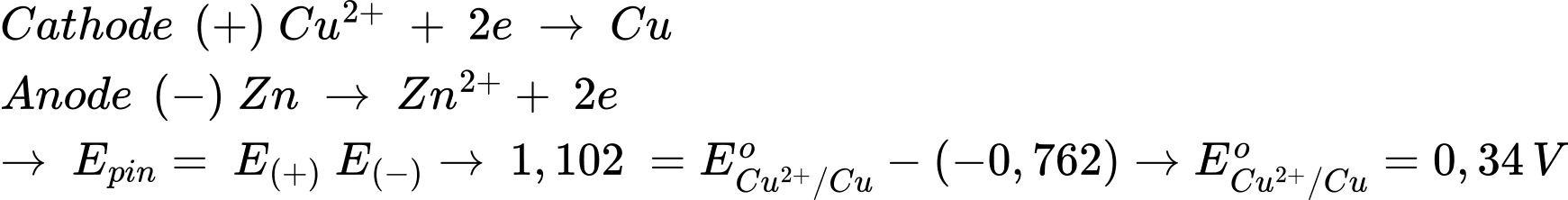
⟹ Chọn đáp án A Đáp án: A
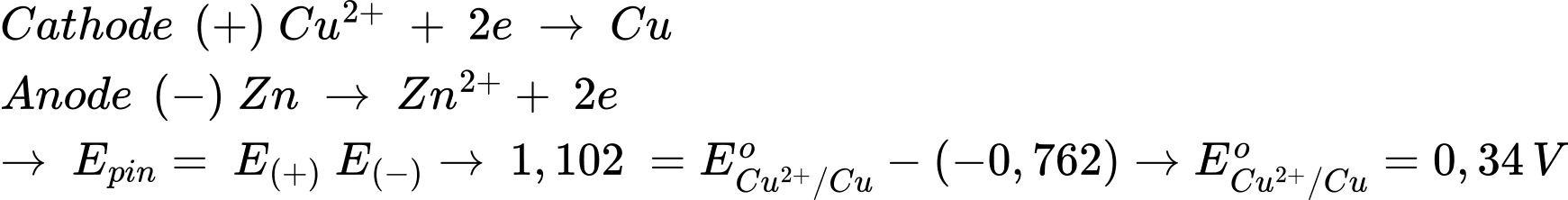
⟹ Chọn đáp án A Đáp án: A
Sử dụng thông tin dưới đây để trả lời các câu 5 – 6:
Một pin điện hoá Zn – H2 được thiết lập ở các điều kiện như hình vẽ sau:
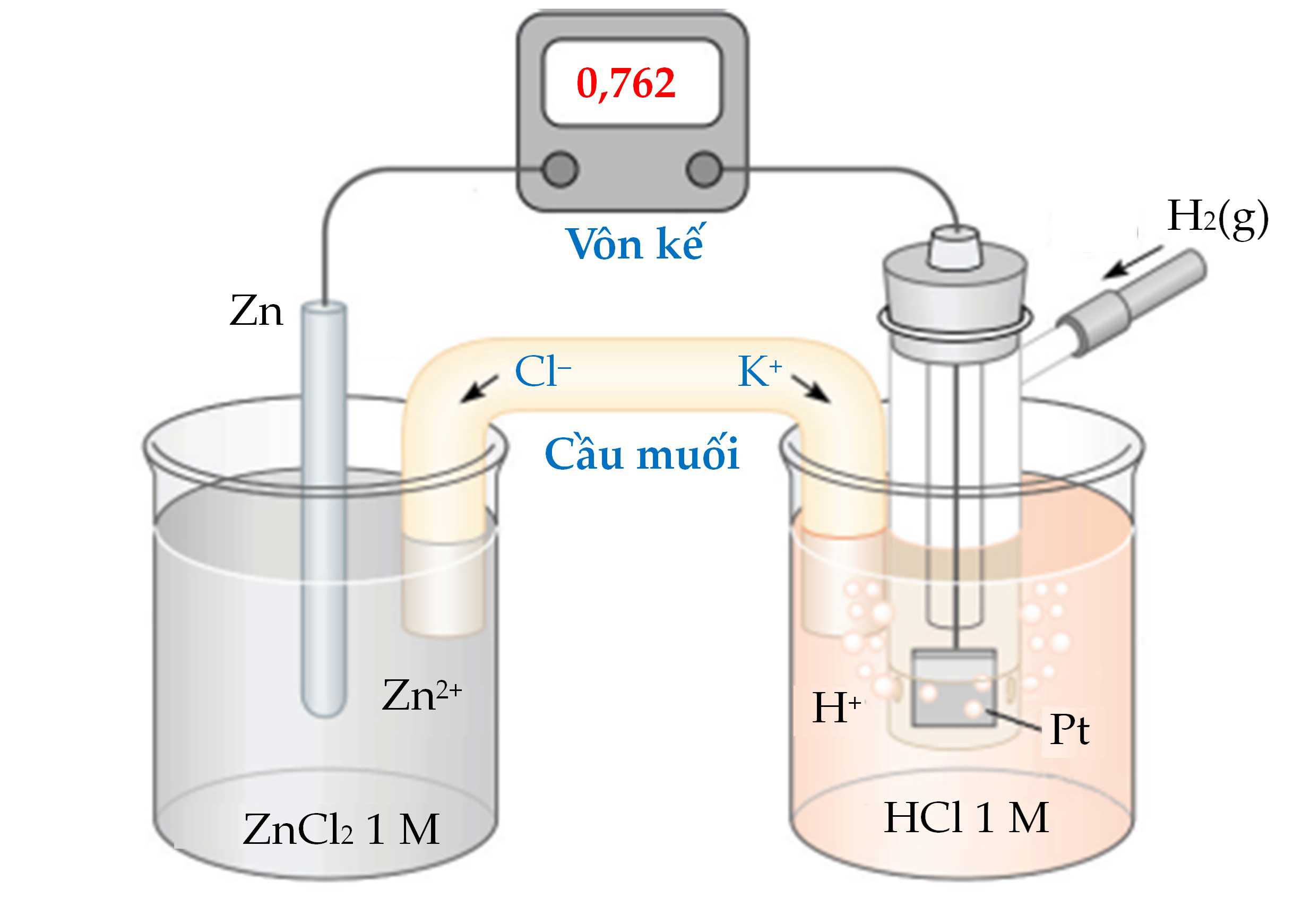
Một pin điện hoá Zn – H2 được thiết lập ở các điều kiện như hình vẽ sau:

Câu 5 [829775]: Mô tả nào sau đây không chính xác những gì đang xảy ra trong điện cực Zn2+/Zn?
A, Điện cực mất khối lượng.
B, Nồng độ ion Zn2+ tăng.
C, Điện cực xảy ra quá trình nhường e.
D, Thế điện cực chuẩn mang giá trị dương.
Quá trình xảy ra trong pin
Cathode (+) 2H+ + 2e → H2
Anode (-) Zn → Zn2+ + 2e
→ Phản ứng trong pin: 2H+ + Zn → H2 + Zn2+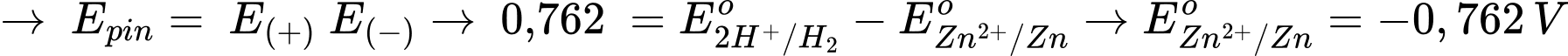
Phân tích các đáp án:
✔️A - Đúng. Điện cực mất khối lượng.
✔️B – Đúng. Nồng độ ion Zn2+ tăng.
✔️C – Đúng. Điện cực xảy ra quá trình nhường e.
❌D – Sai. Thế điện cực chuẩn mang giá trị âm.
⟹ Chọn đáp án D Đáp án: D
Cathode (+) 2H+ + 2e → H2
Anode (-) Zn → Zn2+ + 2e
→ Phản ứng trong pin: 2H+ + Zn → H2 + Zn2+
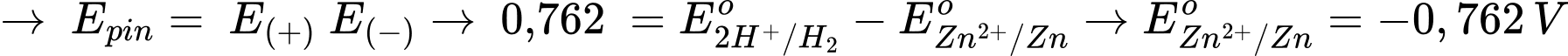
Phân tích các đáp án:
✔️A - Đúng. Điện cực mất khối lượng.
✔️B – Đúng. Nồng độ ion Zn2+ tăng.
✔️C – Đúng. Điện cực xảy ra quá trình nhường e.
❌D – Sai. Thế điện cực chuẩn mang giá trị âm.
⟹ Chọn đáp án D Đáp án: D
Câu 6 [829778]: Giả sử có x ion Zn2+ bị điện phân, để bảo toàn điện tích thì tổng số lượng ion âm và ion dương di chuyển từ cầu muối về cathode và anode là bao nhiêu?
A, 1x+1.
B, 2x+2.
C, 3x–1.
D, 4x.
Khi điện phân dung dịch chứa Zn2+
Quá trình xảy ra trong quá trình điện phân
Cathode (+) Zn2+ + 2e → Zn
Anode (-) H2O → 4H+ + 4e + O2
→ Khi dung dịch có x mol Zn2+ bị điện phân
→ Từ quá trình điện phân bị mất đi x mol Zn2+ và tạo ra 2x mol H+
→ Để bảo toàn điện tích thì tổng số lượng ion âm và ion dương di chuyển từ cầu muối về cathode và anode là 2x + 2x = 4x mol.
⟹ Chọn đáp án D Đáp án: D
Quá trình xảy ra trong quá trình điện phân
Cathode (+) Zn2+ + 2e → Zn
Anode (-) H2O → 4H+ + 4e + O2
→ Khi dung dịch có x mol Zn2+ bị điện phân
→ Từ quá trình điện phân bị mất đi x mol Zn2+ và tạo ra 2x mol H+
→ Để bảo toàn điện tích thì tổng số lượng ion âm và ion dương di chuyển từ cầu muối về cathode và anode là 2x + 2x = 4x mol.
⟹ Chọn đáp án D Đáp án: D
Sử dụng thông tin trong bảng dưới đây để trả lời các câu 7 – 8:
Cho biết sức điện động chuẩn của các pin sau:
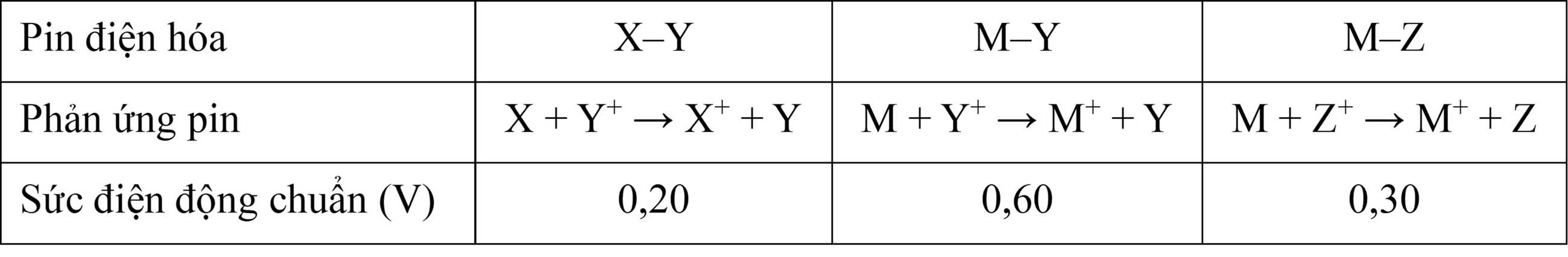
Cho biết sức điện động chuẩn của các pin sau:
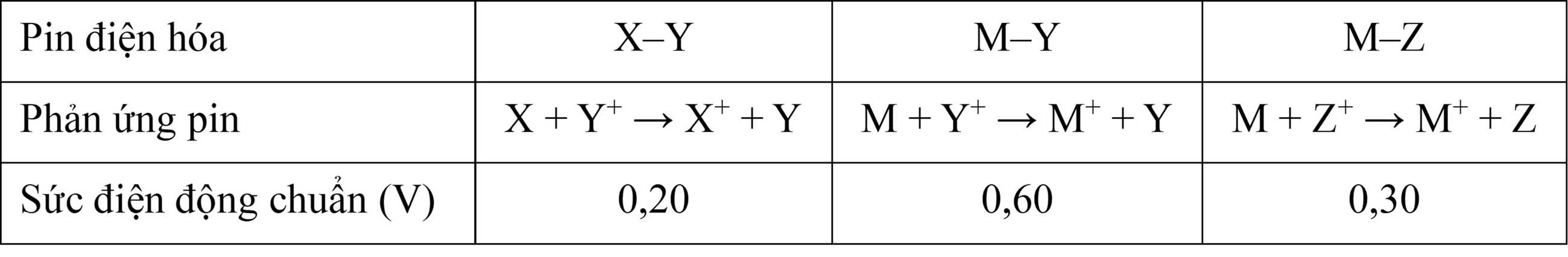
Câu 7 [829780]: Sự sắp xếp nào đúng với tính khử của các kim loại X, Y, Z, M?
A, M < Z < Y < X.
B, Y < X < Z < M.
C, X < Y < M < Z.
D, X < Y < Z < M.
Pin X-Y: X + Y+ → X+ + Y
→ X mạnh hơn Y
→ EX-Y = EY – EX = 0,2 V (1)
Pin M–Y: M + Y+ → M+ + Y
→ M mạnh hơn Y
→ EM-Y = EY – EM = 0,6 V (2)
Pin M-Z: M + Z+ → M+ + Z
→ M mạnh hơn Z
→ EM-Z = EZ – EM = 0,3 V (3)
Ta có:
EM-Y > EM-Z → nên tính khử của Y < Z.
EM-Y > EX-Y → nên tính khử của X < M.
→ Sự sắp xếp nào đúng với tính khử của các kim loại X, Y, Z, M là M > Z > X > Y.
⟹ Chọn đáp án B
Đáp án: B
→ X mạnh hơn Y
→ EX-Y = EY – EX = 0,2 V (1)
Pin M–Y: M + Y+ → M+ + Y
→ M mạnh hơn Y
→ EM-Y = EY – EM = 0,6 V (2)
Pin M-Z: M + Z+ → M+ + Z
→ M mạnh hơn Z
→ EM-Z = EZ – EM = 0,3 V (3)
Ta có:
EM-Y > EM-Z → nên tính khử của Y < Z.
EM-Y > EX-Y → nên tính khử của X < M.
→ Sự sắp xếp nào đúng với tính khử của các kim loại X, Y, Z, M là M > Z > X > Y.
⟹ Chọn đáp án B
Đáp án: B
Câu 8 [829782]: Sức điện động chuẩn của pin điện hóa M–X có giá trị là bao nhiêu V?
A, 0,2 V.
B, 0,4 V.
C, 0,8 V.
D, 1,0 V.
Các em ơi, chú ý💥
Nhập liệu câu này trong sách của chúng ta đang bị lỗi, vì vậy các em sửa giống trên web để chọn đáp án nhé́!
Sách mới không tránh khỏi những lỗi sai nên rất mong sự góp ý yêu thương của các em để nhóm tác giả hoàn thiện sách cho lần tái bản sau nha. Cảm ơn các em nhiều.
Khi tạo pin M-X từ pin (2) và pin (1)
→ EM-X = Epin(2) - Epin(1) = (EY - EM) – (EY - EX) = 0,6 – 0,2 = 0,4 V (5).
⟹ Chọn đáp án B Đáp án: B
Khi tạo pin M-X từ pin (2) và pin (1)
→ EM-X = Epin(2) - Epin(1) = (EY - EM) – (EY - EX) = 0,6 – 0,2 = 0,4 V (5).
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin trong bảng dưới đây để trả lời các câu 9 – 10:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
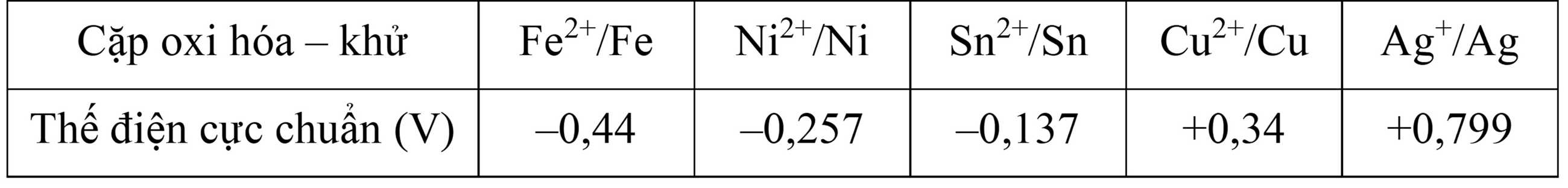
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
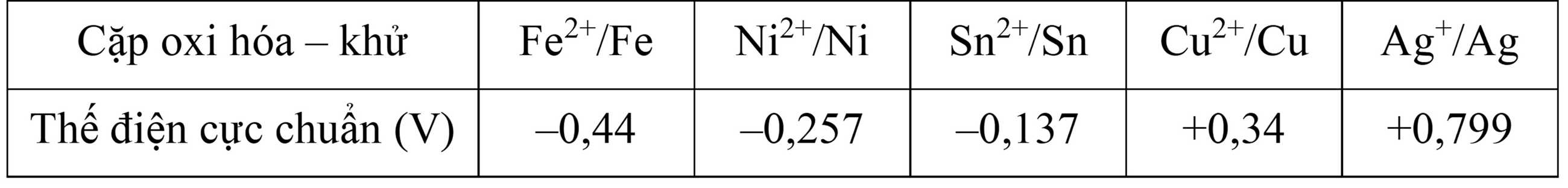
Câu 9 [829783]: Khả năng nhường electron của kim loại nào trong số các cặp oxi hóa – khử trên là lớn nhất?
A, Cu.
B, Ag.
C, Fe.
D, Ni.
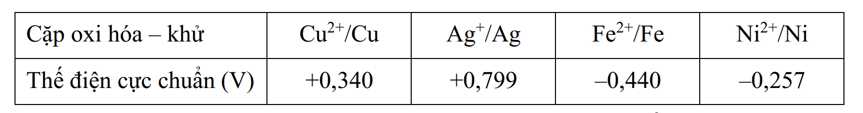
Giá trị thế điện cực càng nhỏ → Tính khử của kim loại càng mạnh → Khả năng nhường electron càng tốt
→ Kim loại có khả năng nhường electron tốt nhất là Fe.
⟹ Chọn đáp án C
⟹ Chọn đáp án C
Câu 10 [829785]: Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là bao nhiêu?
A, 1,239V.
B, 1,560V.
C, 0,183V.
D, 0,780V.
Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là cặp Fe-Ag
Quá trình xảy ra trong pin
Anode (-) Fe → Fe2+ + 2e
Cathode (+) Ag+ + 1e → Ag
→ Epin = E(+) – E(-) = 0,799 – (-0,44) = 1,239 V.
⟹ Chọn đáp án A Đáp án: A
Quá trình xảy ra trong pin
Anode (-) Fe → Fe2+ + 2e
Cathode (+) Ag+ + 1e → Ag
→ Epin = E(+) – E(-) = 0,799 – (-0,44) = 1,239 V.
⟹ Chọn đáp án A Đáp án: A
Sử dụng thông tin dưới đây để trả lời các câu 11 – 12:
Pin Galvani được coi là nguồn điện hoá học đầu tiên mà con người phát minh ra. Pin Galvani Zn – Cu được biểu diễn ở hình sau:
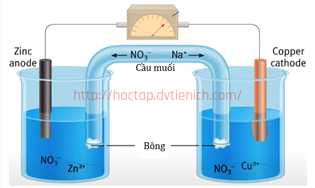
Biết thế điện cực chuẩn của cặp oxi hoá – khử Zn2+/Zn là –0,76 V và Cu2+/Cu là +0,340 V.
Pin Galvani được coi là nguồn điện hoá học đầu tiên mà con người phát minh ra. Pin Galvani Zn – Cu được biểu diễn ở hình sau:

Biết thế điện cực chuẩn của cặp oxi hoá – khử Zn2+/Zn là –0,76 V và Cu2+/Cu là +0,340 V.
Câu 11 [829795]: Phát biểu nào sau đây không đúng?
A, Khi pin hoạt động, khối lượng thanh Zn giảm dần.
B, Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu.
C, Cầu muối đóng vai trò khép kín mạch và trung hoà điện tích của dung dịch ở hai điện cực.
D, Điện cực âm xảy ra quá trình khử Zn, điện cực dương xảy ra quá trình oxi hóa ion Cu2+.
Ta có: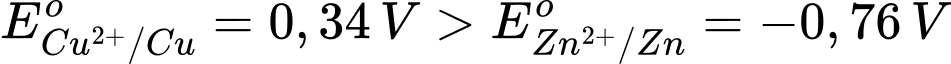
Quá trình xảy ra trong pin
Anode (-) Zn → Zn2+ + 2e
Cathode (+) Cu2+ + 2e → Cu
→ Epin = E(+) – E(-) = 0,34 – (-0,76) = 1,1 V
Phân tích các đáp án:
✔️A – Đúng. Khi pin hoạt động, khối lượng thanh Zn giảm dần.
✔️B – Đúng. Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu.
✔️C - Đúng. Cầu muối là bộ phận giúp khép kín mạch điện và duy trì sự trung hòa điện tích tại các điện cực trong quá trình điện phân hoặc hoạt động của pin. Nó cho phép các ion dương và âm di chuyển đến điện cực tương ứng để cân bằng sự thay đổi điện tích do phản ứng oxi hóa - khử gây ra.
❌D – Sai. Điện cực âm xảy ra quá trình oxi hóa Zn, điện cực dương xảy ra quá trình khử ion Cu2+.
⟹ Chọn đáp án D Đáp án: D
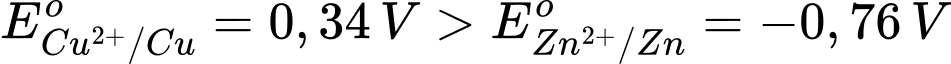
Quá trình xảy ra trong pin
Anode (-) Zn → Zn2+ + 2e
Cathode (+) Cu2+ + 2e → Cu
→ Epin = E(+) – E(-) = 0,34 – (-0,76) = 1,1 V
Phân tích các đáp án:
✔️A – Đúng. Khi pin hoạt động, khối lượng thanh Zn giảm dần.
✔️B – Đúng. Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu.
✔️C - Đúng. Cầu muối là bộ phận giúp khép kín mạch điện và duy trì sự trung hòa điện tích tại các điện cực trong quá trình điện phân hoặc hoạt động của pin. Nó cho phép các ion dương và âm di chuyển đến điện cực tương ứng để cân bằng sự thay đổi điện tích do phản ứng oxi hóa - khử gây ra.
❌D – Sai. Điện cực âm xảy ra quá trình oxi hóa Zn, điện cực dương xảy ra quá trình khử ion Cu2+.
⟹ Chọn đáp án D Đáp án: D
Câu 12 [829797]: Nếu thay điện cực của cặp oxi hóa khử Zn2+/Zn bằng Fe2+/Fe, cả hai trường hợp đều được thiết lập ở điều kiện chuẩn thì sức điện động chuẩn của pin chêch lệch so với trước khi thay là bao nhiêu? Biết thế điện cực chuẩn của cặp oxi hoá – khử Fe2+/Fe là –0,44 V.
A, 0,10 V.
B, 0,32 V.
C, 0,78 V.
D, 1,20 V.
Ta có: 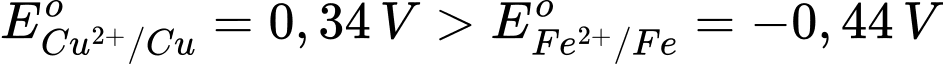
Quá trình xảy ra trong pin
Anode (-) Fe → Fe2+ + 2e
Cathode (+) Cu2+ + 2e → Cu
→ Epin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V.
⟹ Chọn đáp án C
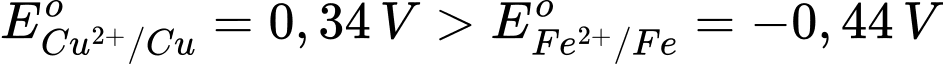
Quá trình xảy ra trong pin
Anode (-) Fe → Fe2+ + 2e
Cathode (+) Cu2+ + 2e → Cu
→ Epin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V.
⟹ Chọn đáp án C
Sử dụng thông tin trong bảng dưới đây để trả lời các câu 13 – 14:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
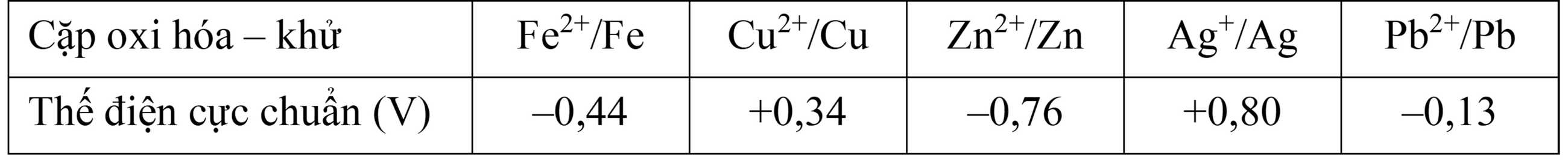
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
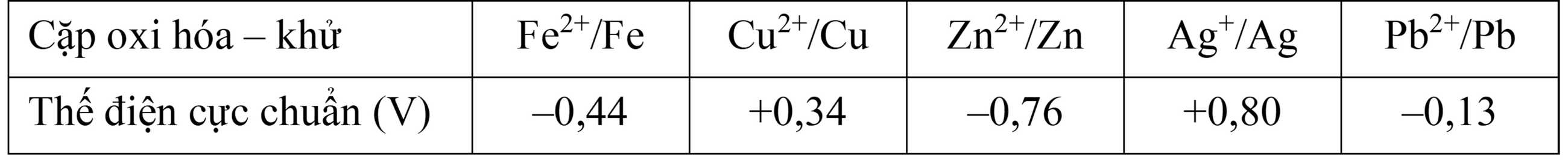
Câu 13 [829790]: Kim loại Cu có thể khử được bao nhiêu ion kim loại thuộc các cặp oxi hóa – khử trên?
A, 1.
B, 2.
C, 3.
D, 4.
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
Nếu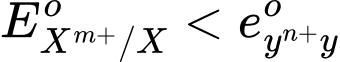 ="" thì="" tính="" khử:="" x=""> Y; tính oxi hóa: Xm+ < Yn+.
="" thì="" tính="" khử:="" x=""> Y; tính oxi hóa: Xm+ < Yn+.
→ Kim loại Cu có thể khử được Ag.
⟹ Chọn đáp án A
Đáp án: A
Nếu
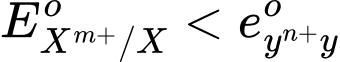 ="" thì="" tính="" khử:="" x=""> Y; tính oxi hóa: Xm+ < Yn+.
="" thì="" tính="" khử:="" x=""> Y; tính oxi hóa: Xm+ < Yn+.→ Kim loại Cu có thể khử được Ag.
⟹ Chọn đáp án A
Đáp án: A
Câu 14 [829794]: Sức điện động chuẩn của pin điện hoá gồm hai điện cực M2+/M và Ag+/Ag bằng 0,936 V. Kim loại M là kim loại nào sau đây?
A, Cu.
B, Fe.
C, Ni.
D, Sn.
Từ bảng số liệu ta nhận thấy Ag+/Ag có thế điện cực chuẩn lớn nhất
Quá trình xảy ra trong pin
Anode (-) M → M2+ + 2e
Cathode (+) Ag+ + 1e → Ag
→ Epin = E(+) – E(-) = 0,799 – E(-) = 0,936 V
→ E(-) = –0,137 V
→ Kim loại M tương ứng là Sn.
⟹ Chọn đáp án D Đáp án: D
Quá trình xảy ra trong pin
Anode (-) M → M2+ + 2e
Cathode (+) Ag+ + 1e → Ag
→ Epin = E(+) – E(-) = 0,799 – E(-) = 0,936 V
→ E(-) = –0,137 V
→ Kim loại M tương ứng là Sn.
⟹ Chọn đáp án D Đáp án: D
Sử dụng đoạn thông tin dưới đây để trả lời câu 15 – 16:
Cho bảng thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
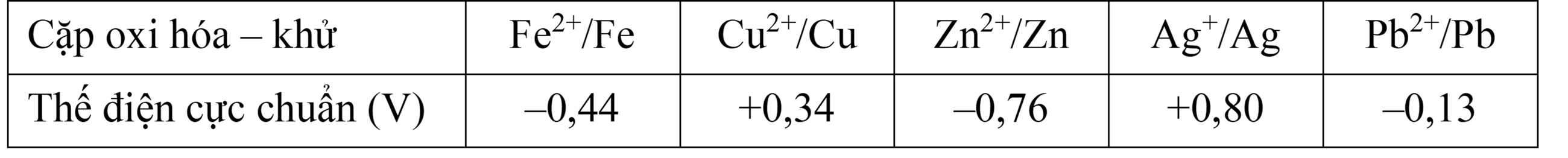
Thiết lập một pin Galvani nối với bóng đèn hình vẽ dưới đây:
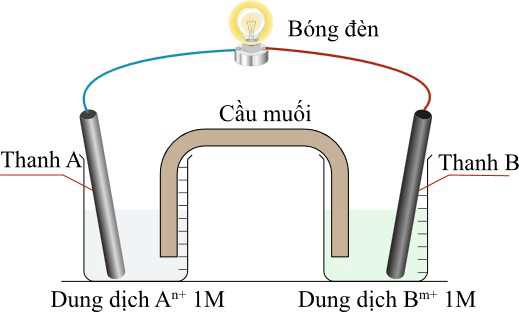
Trong đó 2 điện cực A và B là hai trong số các cặp oxi hóa – khử bên trên. Giả sử một bóng đèn cần tối thiểu 1,5 V để hoạt động.
Thiết lập một pin Galvani nối với bóng đèn hình vẽ dưới đây:

Trong đó 2 điện cực A và B là hai trong số các cặp oxi hóa – khử bên trên. Giả sử một bóng đèn cần tối thiểu 1,5 V để hoạt động.
Câu 15 [702618]: Nếu dung dịch A và B được thiết lập từ các cặp oxi hoá khử là Fe2+/Fe và Ag+/Ag ở điều kiện chuẩn thì quá trình xảy ra ở cực âm là
A, Fe(s)  Fe2+(aq) +2e.
Fe2+(aq) +2e.
 Fe2+(aq) +2e.
Fe2+(aq) +2e.B, Fe2+(aq) + 2e  Fe(s).
Fe(s).
 Fe(s).
Fe(s).C, Ag+(aq) + 1e  Ag(s).
Ag(s).
 Ag(s).
Ag(s).D, Ag(s)  Ag+(aq) + 1e.
Ag+(aq) + 1e.
 Ag+(aq) + 1e.
Ag+(aq) + 1e.
Pin Galvani gồm hai điện cực được nối với nhau bằng cầu muối. Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá kim loại và ở điện cực dương (cathode) xảy ra quá trình khử cation.
Cực dương là kim loại có thế điện cực lớn hơn, cực âm là kim loại có thế điện cực nhỏ hơn.
Vì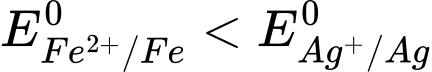 nên cực âm là Fe.
nên cực âm là Fe.
Cực dương là kim loại có thế điện cực lớn hơn, cực âm là kim loại có thế điện cực nhỏ hơn.
Vì
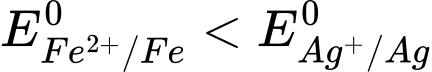 nên cực âm là Fe.
nên cực âm là Fe.Khi pin hoạt động, ở điện cực âm (anode) xảy ra quá trình oxi hoá kim loại: Fe(s) → Fe2+(aq)+ 2e.
⇒ Chọn đáp án A
⇒ Chọn đáp án A
Câu 16 [702619]: Có bao nhiêu cách tạo ra pin Galvani được thiết lập từ hai cặp oxi hóa – khử trong số các cặp trong bảng trên để bóng đèn hoạt động?
A, 1.
B, 2.
C, 3.
D, 4.
Để bóng đèn hoạt động thì cần tối thiểu 1,5 V. Ta xét bảng hiệu điện thế của các cặp oxi hoá - khử như sau:
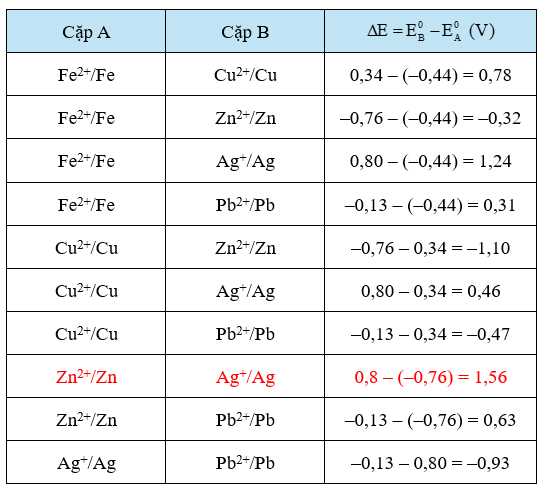
Vậy chỉ có 1 cặp oxi hóa – khử có hiệu điện thế lớn hơn 1,5: Ag được tạo ra ở cực dương, Zn2+ được tạo ra ở cực âm.
⇒ Chọn đáp án A Đáp án: A

Vậy chỉ có 1 cặp oxi hóa – khử có hiệu điện thế lớn hơn 1,5: Ag được tạo ra ở cực dương, Zn2+ được tạo ra ở cực âm.
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Cho bảng thông tin sau:
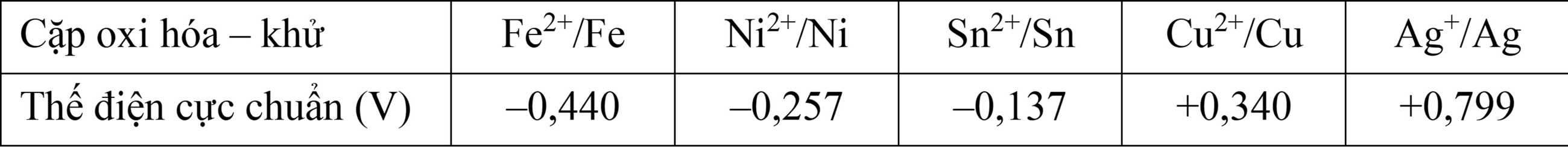
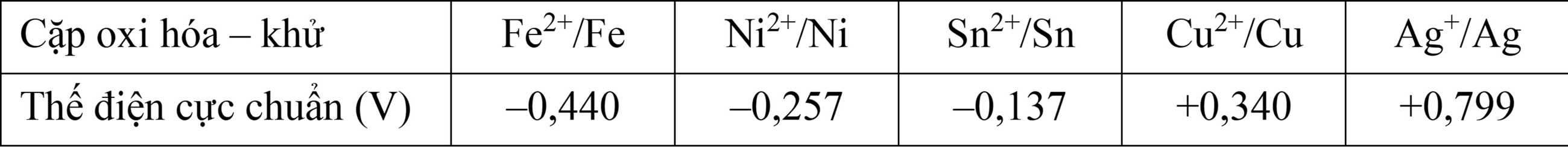
Câu 17 [702815]: Trong các ion kim loại có trong bảng trên, ở điều kiện chuẩn ion nào có tính oxi hóa mạnh nhất?
A, Ag+.
B, Cu2+.
C, Fe2+.
D, Ni2+.
Kim loại có thế điện cực chuẩn càng âm thì càng có tính khử mạnh, càng dương thì tính tính oxi hoá càng mạnh.
Thấy giá trị thế điện cực chuẩn của cặp oxi hoá - khử Ag+/Ag là dương nhất nên Ag+ có tính oxi hoá mạnh nhất.
⇒ Chọn đáp án A Đáp án: A
Thấy giá trị thế điện cực chuẩn của cặp oxi hoá - khử Ag+/Ag là dương nhất nên Ag+ có tính oxi hoá mạnh nhất.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [702816]: Biết sức điện động chuẩn của pin điện hoá gồm hai điện cực M2+/M và Ag+/Ag bằng 1,056 V. Kim loại nào sau đây phù hợp với M?
A, Fe.
B, Sn.
C, Ni.
D, Cu.
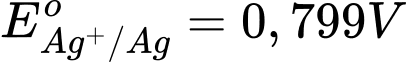 giá trị thế điện cực dương nhất → Ag+/Ag là cực dương, cathode
giá trị thế điện cực dương nhất → Ag+/Ag là cực dương, cathodeSức điện động của pin trên.
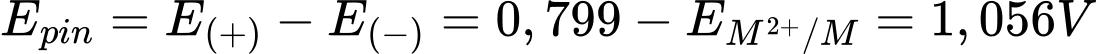
→
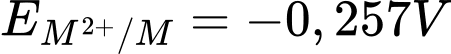 → Cặp oxi hóa khử phù hợp Ni2+/Ni
→ Cặp oxi hóa khử phù hợp Ni2+/Ni → Kim loại phù hợp là Ni
⇒ Chọn đáp án C Đáp án: C
Sử dụng đoạn thông tin dưới đây để trả lời câu 19 – 20:
MgCl2 nóng chảy có thể bị phân hủy thành các nguyên tố nếu như đặt một điện áp đủ lớn vào hai điện cực trơ. Sản phẩm của phản ứng là Mg nóng chảy (ở cực âm) và khí Cl2 (ở cực dương). Cho bảng thế điện cực chuẩn của các bán phản ứng như sau:
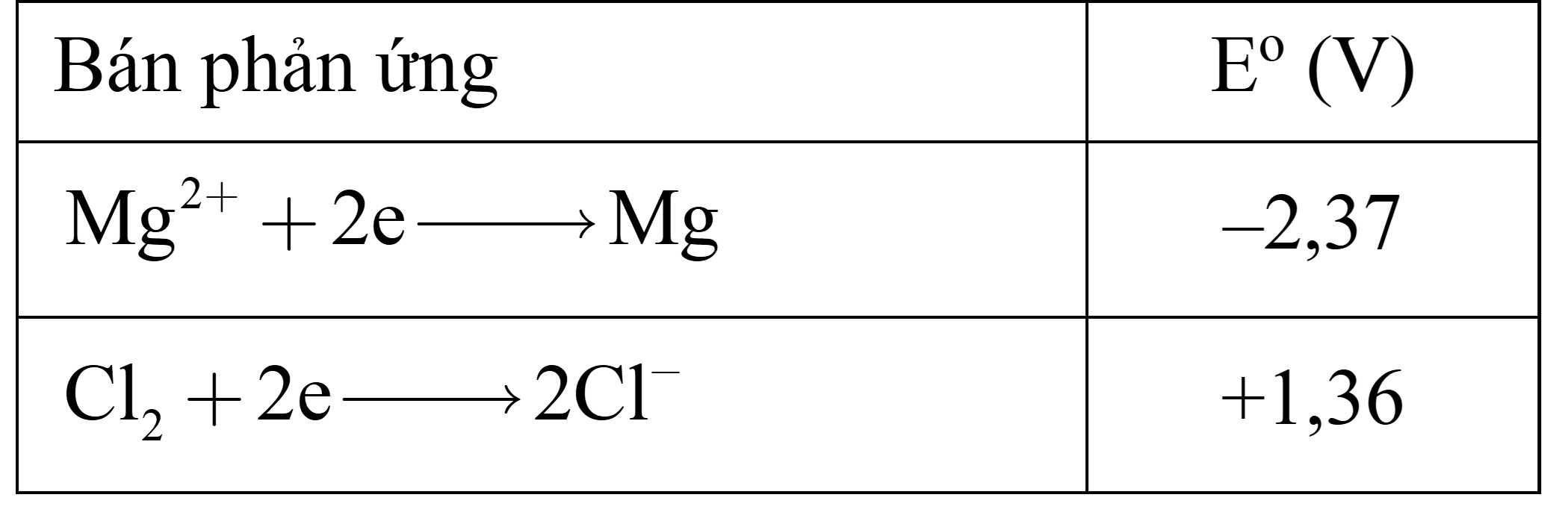

Câu 19 [703013]: Giả sử các chất ở điều kiện chuẩn. Hiệu điện thế tối thiểu cần đặt vào để phản ứng điện phân xảy ra là
A, 3,73 V.
B, 1,01 V.
C, 2,16 V.
D, 3,43 V.
MgCl2 –(đpnc)→ Mg + Cl2
Cathode (–): Mg2+ + 2e → Mg
Anode (+): 2Cl– → Cl2 + 2e
→ E = –2,37 – 1,26 = –3,73 V
→ Hiệu điện thế tối thiểu cần đặt vào để phản ứng điện phân là 3,73 V
⇒ Chọn đáp án A Đáp án: A
Cathode (–): Mg2+ + 2e → Mg
Anode (+): 2Cl– → Cl2 + 2e
→ E = –2,37 – 1,26 = –3,73 V
→ Hiệu điện thế tối thiểu cần đặt vào để phản ứng điện phân là 3,73 V
⇒ Chọn đáp án A Đáp án: A
Câu 20 [703014]: Nếu dòng điện trong bình được giữ ở mức không đổi 5 A, giả sử hằng số Faraday bằng 96485 C thì mất bao nhiêu giây để tạo ra 2,00 gam Mg(l) ở cực âm?
A, 2160.
B, 4190.
C, 3180.
D, 3216.
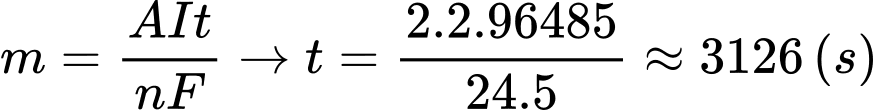
⇒ Chọn đáp án D Đáp án: D
[TK 2025]: Sử dụng thông tin ở bảng dưới đây để trả lời các câu 21 - 22:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:


Câu 21 [680869]: Trong số các ion kim loại gồm Fe2+, Cu2+ và Zn2+, ở điều kiện chuẩn ion nào có tính oxi hóa yếu hơn Ag2+, nhưng mạnh hơn Pb2+?
A,
Fe2+, Cu2+, Zn2+.
B, Fe2+, Cu2+.
C, Zn2+.
D, Cu2+.
Ta có
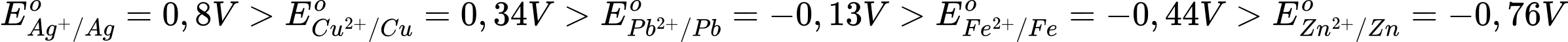
→ Thấy rằng chỉ có Cu2+/Cu có thế điện cực chuẩn nhỏ hơn Ag+/Ag và lớn hơn Pb2+/Pb
→ Cu2+ có tính oxi hóa mạnh hơn Pb2+/Pb và yếu hơn Ag+/Ag.
⇒ Chọn đáp án D
Đáp án: D
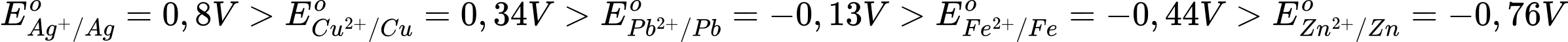
→ Thấy rằng chỉ có Cu2+/Cu có thế điện cực chuẩn nhỏ hơn Ag+/Ag và lớn hơn Pb2+/Pb
→ Cu2+ có tính oxi hóa mạnh hơn Pb2+/Pb và yếu hơn Ag+/Ag.
⇒ Chọn đáp án D
Đáp án: D
Câu 22 [680870]: Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là
A, 1,24 V.
B, 1,56 V.
C, 1,60 V.
D, 0,93 V.
Sức điện động lớn nhất của pin galvani thiết lặp từ cặp Zn2+/Zn và Ag+/Ag
Với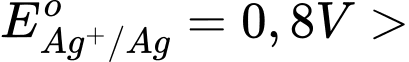
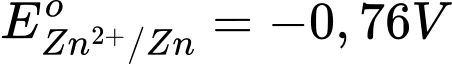 → Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
→ Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
Zn + 2Ag+ → Zn2+ + 2Ag
Phản ứng trong pin:
Cathode (+): Ag+ +1e → Ag
Anode (-): Zn → Zn2+ + 2e
Sức điện của pin là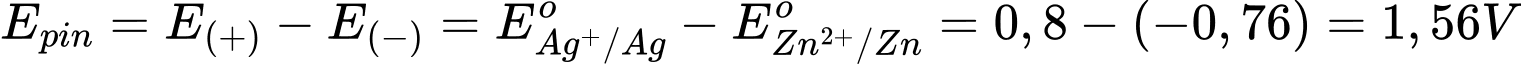
⇒ Chọn đáp án B Đáp án: B
Với
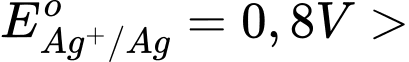
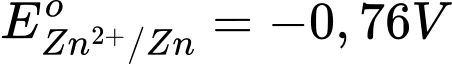 → Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
→ Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)Zn + 2Ag+ → Zn2+ + 2Ag
Phản ứng trong pin:
Cathode (+): Ag+ +1e → Ag
Anode (-): Zn → Zn2+ + 2e
Sức điện của pin là
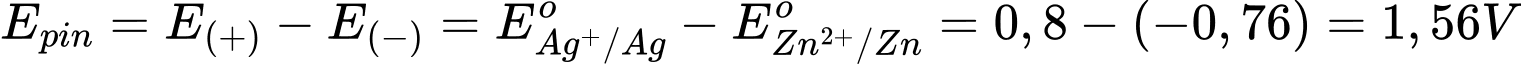
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời câu 23 – 24:
Cho giá trị thế điện cực chuẩn của một số cặp oxi hóa – khử trong bảng sau:


Câu 23 [703828]: Phản ứng hóa học nào sau đây không xảy ra?
A, 2Al(s) + 3Cu2+(aq)  2Al3+(aq) + 3Cu(s).
2Al3+(aq) + 3Cu(s).
 2Al3+(aq) + 3Cu(s).
2Al3+(aq) + 3Cu(s).B, Cu(s) + 2Ag+(aq)  Cu2+(aq) + 2Ag(s).
Cu2+(aq) + 2Ag(s).
 Cu2+(aq) + 2Ag(s).
Cu2+(aq) + 2Ag(s).C, 2Ag+(aq) + Pb2+(aq)  Pb4+(aq) + 2Ag(s).
Pb4+(aq) + 2Ag(s).
 Pb4+(aq) + 2Ag(s).
Pb4+(aq) + 2Ag(s).D, 2Cu(s) + Pb4+(aq)  2Cu2+(aq) + Pb2+(aq).
2Cu2+(aq) + Pb2+(aq).
 2Cu2+(aq) + Pb2+(aq).
2Cu2+(aq) + Pb2+(aq).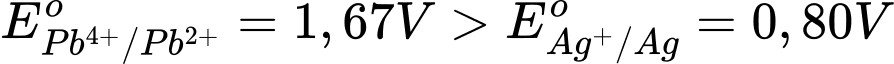
→ Theo quy tắc 𝞪, dạng oxi hóa mạnh sẽ phản ứng với dạng khử mạnh.
2Ag(s) + Pb4+(aq) ⟶ Pb2+(aq) + 2Ag+(aq).
⟹ Chọn đáp án C Đáp án: C
Câu 24 [703829]: Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là
A, 1,67 V.
B, 4,05 V.
C, 2,46 V.
D, 3,33 V.
Cặp oxi hóa - khử tạo pin galvani có sức điện động lớn nhất là Al3+/Al và Pb4+/Pb2+.
Phản ứng trong pin galvani:
2Al(s) + 3Pb4+(aq) ⟶ 2Al3+(aq) + 3Pb2+(aq)
Cathode (-): Pb4+(aq) + 2e ⟶ Pb2+(aq)
Anode (+): Al(s) ⟶ Al3+ + 3e
→ Epin = E(+) – E(-) = 1,67 – (–1,66) = 3,33 V
⇒ Chọn đáp án D Đáp án: D
Phản ứng trong pin galvani:
2Al(s) + 3Pb4+(aq) ⟶ 2Al3+(aq) + 3Pb2+(aq)
Cathode (-): Pb4+(aq) + 2e ⟶ Pb2+(aq)
Anode (+): Al(s) ⟶ Al3+ + 3e
→ Epin = E(+) – E(-) = 1,67 – (–1,66) = 3,33 V
⇒ Chọn đáp án D Đáp án: D
Sử dụng đoạn thông tin dưới đây để trả lời câu 25 – 26
Một pin Gavani được thiết lập dựa trên hai bán phản ứng chuẩn sau:
Cd2+(aq) + 2e $\xrightarrow[{}]{{}}$ Cd(s) E = – 0,40 V.
Sn2+(aq) + 2e $\xrightarrow[{}]{{}}$ Sn(s) E = – 0,14 V.
Cd2+(aq) + 2e $\xrightarrow[{}]{{}}$ Cd(s) E = – 0,40 V.
Sn2+(aq) + 2e $\xrightarrow[{}]{{}}$ Sn(s) E = – 0,14 V.
Câu 25 [704030]: Ở anode pin diễn ra
A, sự khử ion Sn2+.
B, sự mất electron của Cd.
C, quá trình oxi hóa Sn.
D, quá trình khử ion Cd2+.
Phản ứng tại anode là sự oxi hóa (mất electron). Vì thế điện cực chuẩn của Cd thấp hơn, Cd sẽ bị oxi hóa tại anode.
Phản ứng tại anode: Cd → Cd2+ + 2e
⇒ Chọn đáp án B Đáp án: B
Phản ứng tại anode: Cd → Cd2+ + 2e
⇒ Chọn đáp án B Đáp án: B
Câu 26 [704031]: Giá trị sức điện động lớn nhất của pin trên là bao nhiêu?
A, 0,26 V.
B, 0,54 V.
C, 0,36 V.
D, 0,40 V.
Ta có: 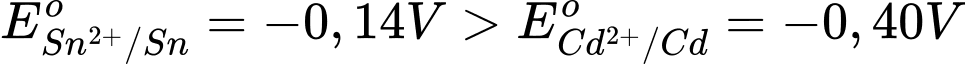
→ Cd là điện cực anode, Sn là điện cực cathode.
Phản ứng hóa học Sn2+ + Cd ⟶Sn + Cd2+
Anode (-): Cd ⟶Cd2+ + 2e
Cathode (+): Sn2+ + 2e ⟶Sn
→ Sức điện động của pin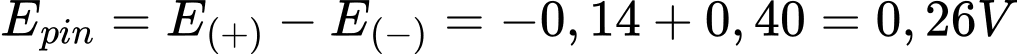
⇒ Chọn đáp án A Đáp án: A
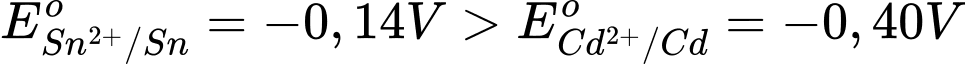
→ Cd là điện cực anode, Sn là điện cực cathode.
Phản ứng hóa học Sn2+ + Cd ⟶Sn + Cd2+
Anode (-): Cd ⟶Cd2+ + 2e
Cathode (+): Sn2+ + 2e ⟶Sn
→ Sức điện động của pin
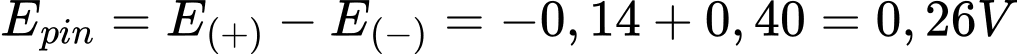
⇒ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 27 – 28:
Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
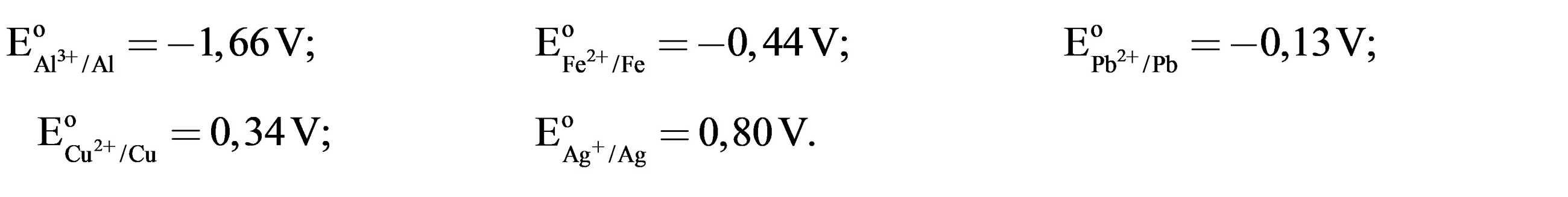
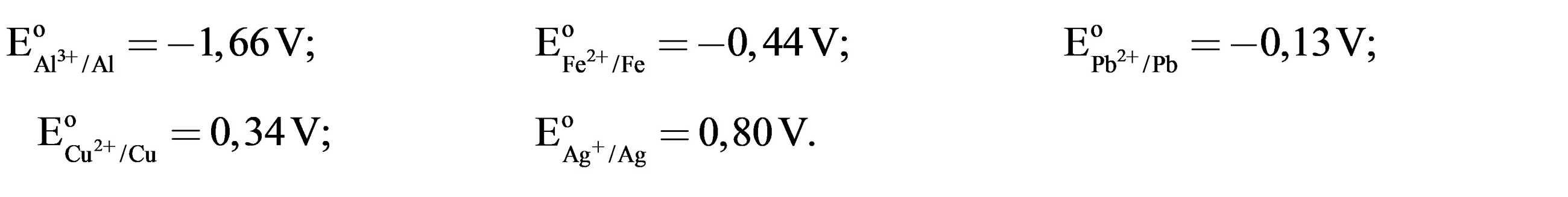
Câu 27 [704182]: Trong số các kim loại: Fe, Pb, Ag và Al, kim loại nào hoạt động mạnh hơn kim loại Cu?
A, Fe, Pb.
B, Al, Ag.
C, Fe, Pb, Al.
D, Fe.
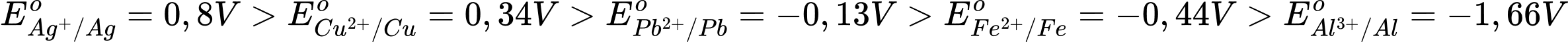
Kim loại có độ hoạt động mạnh hơn Cu là những kim loại có thế điện cực chuẩn nhỏ hơn Cu
→ Pb, Fe, Al hoạt động mạnh hơn Cu.
⇒ Chọn đáp án C Đáp án: C
Câu 28 [704183]: Sức điện động chuẩn nhỏ nhất của pin Valgani được thiết lập từ hai cặp oxi hóa khử trong số các cặp trên có giá trị là
A, 0,46 V.
B, 0,21 V.
C, 0,31 V.
D, 0,47 V.
Sức điện động nhỏ nhất của pin galvani thiết lặp từ cặp Fe2+/Fe và Pb2+/Pb
Với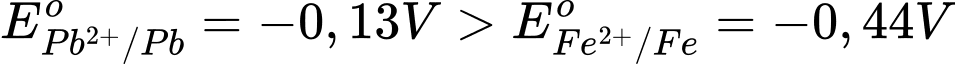 → Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
→ Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
Fe + Pb+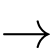 Fe2+ + Pb
Fe2+ + Pb
Phản ứng trong pin:
Cathode (+) Pb2+ + 2e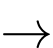 Pb
Pb
Anode (-) Fe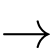 Fe2+ + 2e
Fe2+ + 2e
Sức điện của pin là: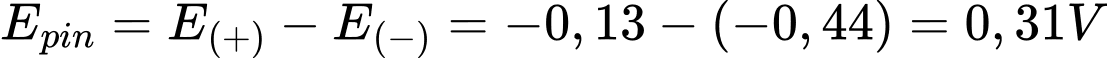
⇒ Chọn đáp án C Đáp án: C
Với
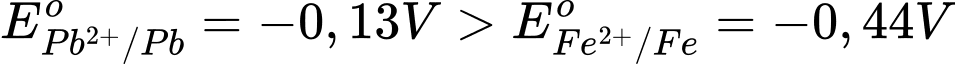 → Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
→ Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)Fe + Pb+
 Fe2+ + Pb
Fe2+ + PbPhản ứng trong pin:
Cathode (+) Pb2+ + 2e
 Pb
Pb Anode (-) Fe
 Fe2+ + 2e
Fe2+ + 2eSức điện của pin là:
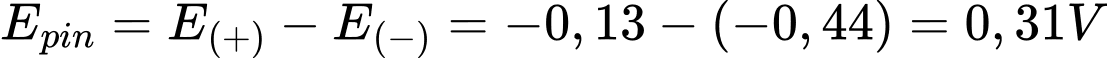
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 29 – 30:
Cho bảng giá trị năng lượng liên kết trung bình sau:
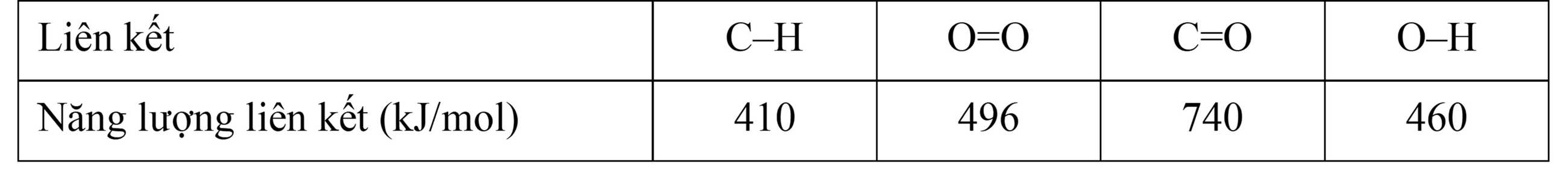

Câu 29 [703951]: Tổng năng lượng cần thiết để phá vỡ liên kết trong 1 mol phân tử CH4 là
A, 410 kJ.
B, 820 kJ.
C, 205 kJ.
D, 1640 kJ.
Công thức cấu tạo của CH4 như sau:
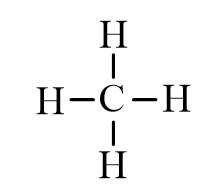
Trong phân tử có 4 liên kết C-H nên năng lượng cần thiết phá vỡ liên kết trong CH4 là: 410 x 4 = 1640 (kJ)
⇒ Chọn đáp án D Đáp án: D

Trong phân tử có 4 liên kết C-H nên năng lượng cần thiết phá vỡ liên kết trong CH4 là: 410 x 4 = 1640 (kJ)
⇒ Chọn đáp án D Đáp án: D
Câu 30 [703952]: Tính biến thiên enthalpy của phản ứng sau:
CH4(g) + 2O2(g) CO2(g) + 2H2O(g).
CO2(g) + 2H2O(g).
CH4(g) + 2O2(g)
 CO2(g) + 2H2O(g).
CO2(g) + 2H2O(g). A, –688 kJ/mol.
B, +688 kJ/mol.
C, –344 kJ/mol.
D, +344 kJ/mol.
CH4(g) + O2(g)  CO2(g) + 2H2O
CO2(g) + 2H2O
Biến thiên enthalpy của phản ứng là
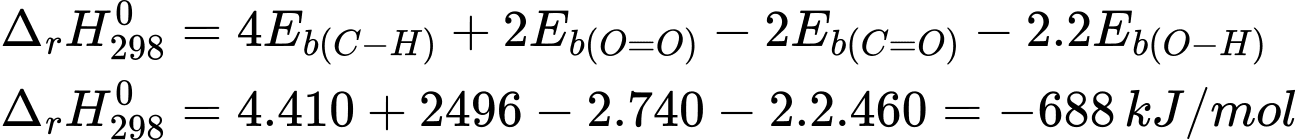
⇒ Chọn đáp án A Đáp án: A
 CO2(g) + 2H2O
CO2(g) + 2H2OBiến thiên enthalpy của phản ứng là
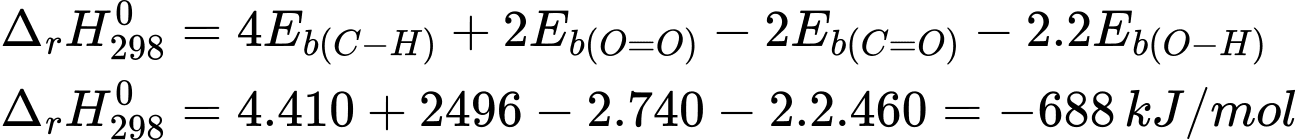
⇒ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 31 – 32:
Nồng độ tổng cộng của Ca2+ và Mg2+ trong mẫu nước cứng được xác định bằng cách chuẩn độ 1 lít mẫu nước bằng dung dịch EDTA4– (EDTA4– có khả năng tạo phức với hai cation):
Mg2+ + EDTA4– → [Mg(EDTA)]2–
Ca2+ + EDTA4– → [Ca(EDTA)]2–
Cần 31,5 mL dung dịch EDTA4– 0,0104 M để đạt đến điểm cuối trong quá trình chuẩn độ. Sau đó, mẫu 1 lít thứ hai được xử lý bằng ion sulfate để kết tủa Ca2+ dưới dạng calcium sulfate kết tủa, loại bỏ kết tủa. Sau đó, chuẩn độ Mg2+ bằng 18,7 mL dung dịch EDTA4– 0,0104 M.
Mg2+ + EDTA4– → [Mg(EDTA)]2–
Ca2+ + EDTA4– → [Ca(EDTA)]2–
Cần 31,5 mL dung dịch EDTA4– 0,0104 M để đạt đến điểm cuối trong quá trình chuẩn độ. Sau đó, mẫu 1 lít thứ hai được xử lý bằng ion sulfate để kết tủa Ca2+ dưới dạng calcium sulfate kết tủa, loại bỏ kết tủa. Sau đó, chuẩn độ Mg2+ bằng 18,7 mL dung dịch EDTA4– 0,0104 M.
Câu 31 [704303]: Nguyên tử kim loại trung tâm trong cả hai phức chất [Mg(EDTA)]2– và [Ca(EDTA)]2– đều có số oxi hóa là
A, -2.
B, 0.
C, +1.
D, +2.
- Nguyên tử kim loại trung tâm trong cả hai phức chất [Mg(EDTA)]2– và [Ca(EDTA)]2– đều là Mg và Ca, thuộc nhóm kim loại kiềm thổ trong bảng tuần hoàn.
- Vì EDTA là một phối tử không thay đổi điện tích tổng, nên số oxi hóa của kim loại trong cả hai phức chất này chính là điện tích của ion kim loại trước khi tạo phức, cụ thể là:
+ Mg có số oxi hóa là +2.
+ Ca cũng có số oxi hóa là +2.
Vậy số oxi hóa của nguyên tử kim loại trung tâm trong cả hai phức chất đều là +2.
⇒ Chọn đáp án D Đáp án: D
- Vì EDTA là một phối tử không thay đổi điện tích tổng, nên số oxi hóa của kim loại trong cả hai phức chất này chính là điện tích của ion kim loại trước khi tạo phức, cụ thể là:
+ Mg có số oxi hóa là +2.
+ Ca cũng có số oxi hóa là +2.
Vậy số oxi hóa của nguyên tử kim loại trung tâm trong cả hai phức chất đều là +2.
⇒ Chọn đáp án D Đáp án: D
Câu 32 [704304]: Nồng độ của Mg2+ và Ca2+ trong nước cứng theo mg/L lần lượt là
A, 1,9448×10–4 và 1,3312×10–4.
B, 4,6675 và 5,3248.
C, 8,6258×10–3 và 4,2458×10–3.
D, 1,2458 và 2,4871.
Đổi 31,5 mL = 0,0315 L; 18,7 mL = 0,0187 L
(1) Mg2+ + EDTA4- → [Mg(EDTA)]2-
(2) Ca2+ + EDTA4- → [Ca(EDTA)]2-
+ Xử lí lần 1 thông qua mol của EDTA4- xác định tổng mol của 2 ion Ca2+ và Mg2+
Từ PTHH số mol của tổng mol của 2 ion Ca2+ và Mg2+ là:
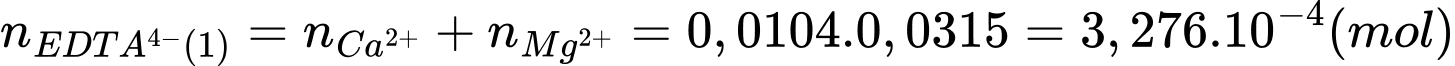
+ Xử lí lần 2: việc tạo kết tủa của ion Ca2+ thành CaSO4 nên thông qua mol của EDTA4- xác định mol của Mg2+
Số mol của Mg2+ là: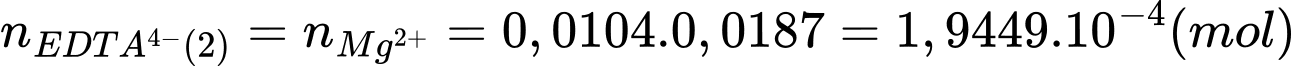
Số mol của Ca2+ trong nước cứng là:
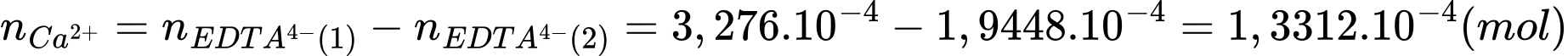
Nồng độ của Mg2+ và Ca2+ trong mẫu nước cứng theo mg/L lần lượt là 4,6675 và 5,3248 mg/L
Nồng độ Mg2+: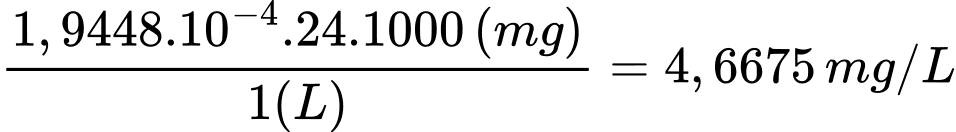
Nồng độ Ca2+: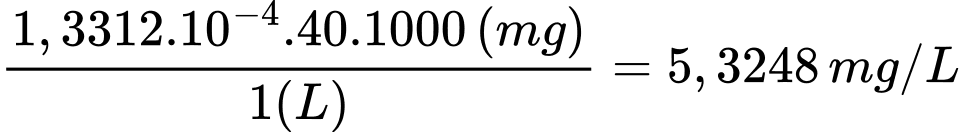
⇒ Chọn đáp án B Đáp án: B
(1) Mg2+ + EDTA4- → [Mg(EDTA)]2-
(2) Ca2+ + EDTA4- → [Ca(EDTA)]2-
+ Xử lí lần 1 thông qua mol của EDTA4- xác định tổng mol của 2 ion Ca2+ và Mg2+
Từ PTHH số mol của tổng mol của 2 ion Ca2+ và Mg2+ là:
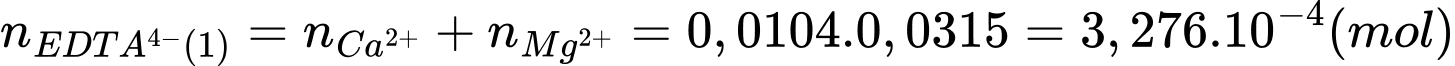
+ Xử lí lần 2: việc tạo kết tủa của ion Ca2+ thành CaSO4 nên thông qua mol của EDTA4- xác định mol của Mg2+
Số mol của Mg2+ là:
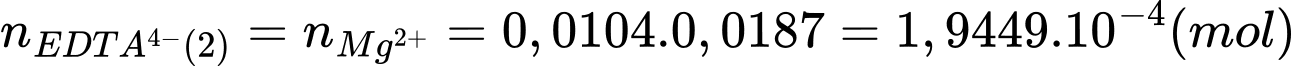
Số mol của Ca2+ trong nước cứng là:
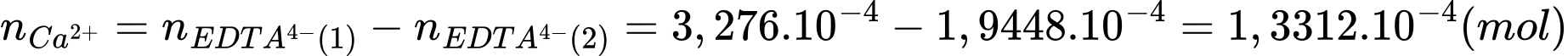
Nồng độ của Mg2+ và Ca2+ trong mẫu nước cứng theo mg/L lần lượt là 4,6675 và 5,3248 mg/L
Nồng độ Mg2+:
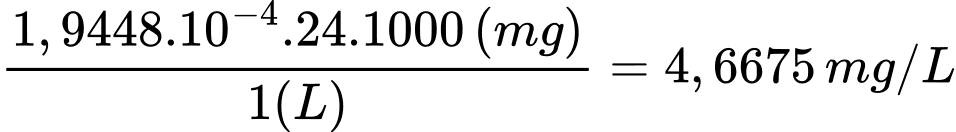
Nồng độ Ca2+:
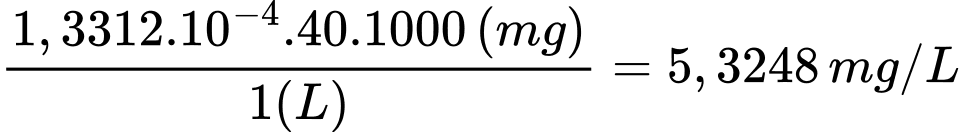
⇒ Chọn đáp án B Đáp án: B
Sử dụng đoạn thông tin dưới đây để trả lời câu 33 – 34:
Một mẫu nước cứng có nồng độ các ion Na+; Ca2+; Mg2+, Cl–; SO42– và HCO3– tương ứng là 1,2 mM; 3,0 mM; 1,0 mM; 0,6 mM; 0,01 mM và x mM (1 mM = 1 mmol/L), ngoài ra không chứa ion nào khác.
Câu 33 [705576]: Cách nào sau đây không thể làm mất tính cứng của loại nước nào?
A, Sử dụng Na3PO4.
B, Đun sôi.
C, Sử dụng Ca(OH)2.
D, Sử dụng Na2CO3.
Nước cứng tạm thời (do Ca(HCO3)2 và Mg(HCO3)2): có thể khử bằng cách đun sôi.
Nước cứng vĩnh cửu ( do MgSO4, CaCl2, MgCl2): không thể khử bằng đun sôi, cần dùng hóa chất.
⟹ Chọn đáp án B Đáp án: B
Nước cứng vĩnh cửu ( do MgSO4, CaCl2, MgCl2): không thể khử bằng đun sôi, cần dùng hóa chất.
⟹ Chọn đáp án B Đáp án: B
Câu 34 [705577]: Tổng khối lượng chất tan còn lại sau khi đun sôi kỹ 2 lít mẫu nước cứng trên là bao nhiêu? Giả sử các muối MgCO3, CaCO3 hầu như không tan trong nước.
A, 134,52
B, 123,6.
C, 142,2.
D, 141,0 mg.
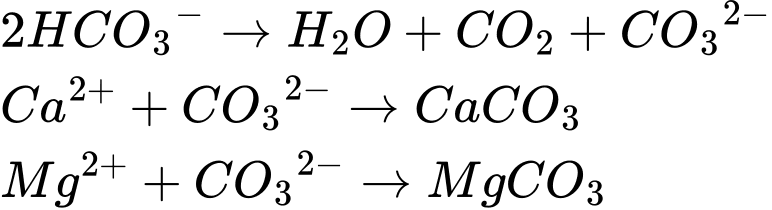
Trong 2L có: Na+ : 2,4mM; Ca2+ : 6,0mM; Mg2+ : 2,0mM; Cl- : 1,2mM; SO42-: 0,02mM; HCO3- : 2x
Bảo toàn điện tích:
1nNa+ + 2nCa2+ + 2nMg2+ = 1nCl- + 2nSO42- + 1nHCO3-
2,4 + 2. 6,0 + 2. 2,0 = 1. 1,2 + 2. 0,02 + 2x
⟹ x = 8,58mM
⟹ Dung dịch sau phản ứng còn:
Na+ : 2,4mM ; Cl- : 1,2mM ; SO42- : 0,02mM ; CO32-: 0,58mM
Khối lượng chất rắn:
m = mNa+ + mCl- + mSO42- + mCO32-
= 2,4 × 23 + 1,2 × 35,5 + 96 × 0,02 + 0,58 × 60
= 134,52
⟹ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 35 – 36:
Trong phòng thí nghiệm, một học sinh nhúng thanh đồng có khối lượng 12,340 gam vào
255 mL dung dịch AgNO3 0,125 M. Biết thế điện cực chuẩn của cặp oxi hoá - khử Cu2+/Cu nhỏ hơn Ag+/Ag.
Câu 35 [704353]: Phát biểu nào sau đây về thí nghiệm trên của học sinh không đúng?
A, Dung dịch chuyển từ không màu sang màu xanh.
B, Ag+ có tính oxi hóa mạnh hơn Cu2+.
C, Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 1.
D, Khối lượng thanh đồng sau phản ứng có khối lượng lớn hơn so với ban đầu.
Phân tích các phát biểu:
✔️ A. Đúng. Trong dung dịch AgNO3, Ag+ không màu nhưng khi Cu tham gia phản ứng, Cu2+ được sinh ra và tạo ra màu xanh trong dung dịch.
✔️ B. Đúng. Thế điện cực chuẩn của cặp Ag+/Ag là 0,799 V, còn của cặp Cu2+/Cu là 0,34 V. Vì thế, Ag+ có tính oxi hóa mạnh hơn Cu2+, dễ dàng nhận electron hơn.
❌ C. Sai. Phản ứng xảy ra như sau: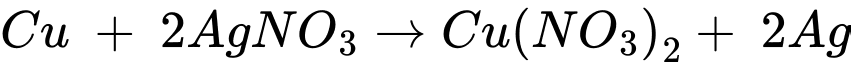 .
.
→ Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 2.
✔️ D. Đúng. Trong thí nghiệm, một lượng Ag giải phóng đã bám vào thanh đồng nên khối lượng thanh đồng sau phản ứng lớn hơn so với ban đầu.
⇒ Chọn đáp án C Đáp án: C
✔️ A. Đúng. Trong dung dịch AgNO3, Ag+ không màu nhưng khi Cu tham gia phản ứng, Cu2+ được sinh ra và tạo ra màu xanh trong dung dịch.
✔️ B. Đúng. Thế điện cực chuẩn của cặp Ag+/Ag là 0,799 V, còn của cặp Cu2+/Cu là 0,34 V. Vì thế, Ag+ có tính oxi hóa mạnh hơn Cu2+, dễ dàng nhận electron hơn.
❌ C. Sai. Phản ứng xảy ra như sau:
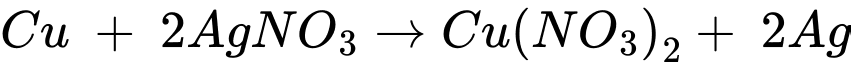 .
.→ Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 2.
✔️ D. Đúng. Trong thí nghiệm, một lượng Ag giải phóng đã bám vào thanh đồng nên khối lượng thanh đồng sau phản ứng lớn hơn so với ban đầu.
⇒ Chọn đáp án C Đáp án: C
Câu 36 [704354]: Giả sử toàn bộ lượng Ag giải phóng đều bám vào thanh đồng thì khi kết thúc phản ứng khối lượng của thanh đồng là
A, 14,7625 gam.
B, 14,4775 gam.
C, 13,5775 gam.
D, 13,7425 gam.
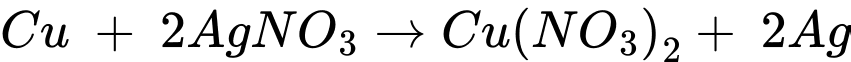
Đổi 255 mL = 0,255 mL
Số mol của AgNO3 và Cu lần lượt là
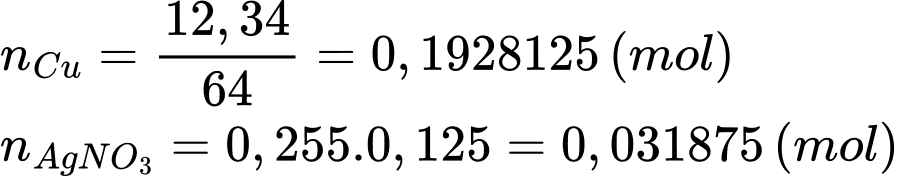
Khối lượng của thanh đồng sau phản ứng là
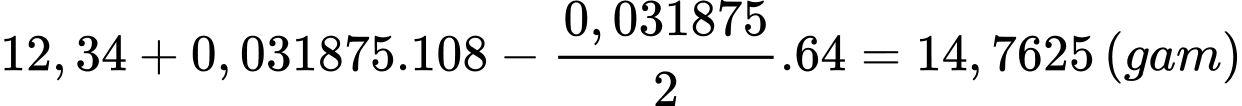
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 37 – 38:
Cho bảng giá trị thế điện cực chuẩn 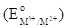 của các cặp oxi hóa – khử như sau:
của các cặp oxi hóa – khử như sau:
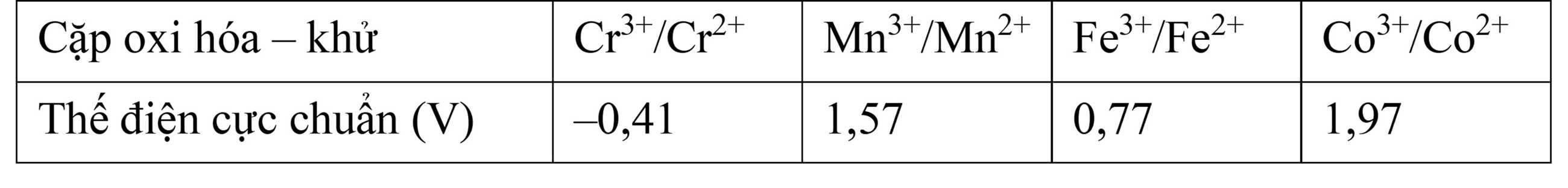
 của các cặp oxi hóa – khử như sau:
của các cặp oxi hóa – khử như sau: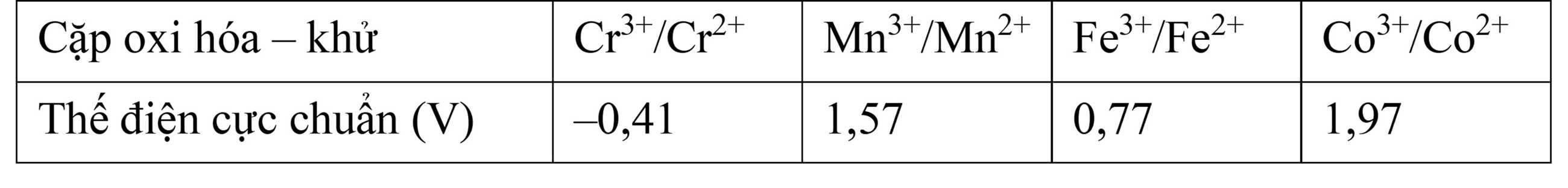
Câu 37 [705693]: Kim loại nào thay đổi trạng thái oxi hoá từ +2 lên +3 dễ nhất?
A, Cr.
B, Mn.
C, Fe.
D, Co.
Nguyên tắc: Thế điện cực chuẩn càng lớn → chất càng có xu hướng nhận e dễ hơn (bị khử), còn quá trình oxi hóa sẽ khó xảy ra hơn.Ngược lại, thế điện cực chuẩn càng nhỏ → chất càng dễ bị oxi hóa (mất e) từ +2 lên +3.
Từ bảng giá trị thế điện cực chuẩn ta thấy được cặp Cr3+/Cr2+ có giá trị thế điện cực nhỏ nhất nên có tính khử mạnh nhất nên sẽ dễ dàng mất electron thay đổi trạng thái số oxi hóa từ +2 lên +3.
⇒ Chọn đáp án A Đáp án: A
Câu 38 [705694]: Giá trị thế điện cực chuẩn của các cặp oxi hóa – khử có được là do điện cực của mỗi cặp oxi hóa – khử được ghép với điện cực hydrogen chuẩn và quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,00 V. Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì thế điện cực chuẩn lớn nhất trong các cặp oxi hóa – khử trên là
A, 2,07 V.
B, 2,47 V.
C, 3,05 V.
D, 4,84 V.
Khi pin được thiết lập, sức điện động của pin luôn dương.
Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì giá trị thế điện cực của các cặp oxi – khử sẽ tăng đi 0,50 V
Ta có bảng giá trị thế điện cực mới:
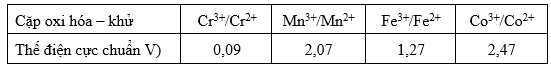
Giá trị thế điện cực chuẩn lớn nhất là 2,47 V của Co3+/Co2+.
⇒ Chọn đáp án B Đáp án: B
Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì giá trị thế điện cực của các cặp oxi – khử sẽ tăng đi 0,50 V
Ta có bảng giá trị thế điện cực mới:

Giá trị thế điện cực chuẩn lớn nhất là 2,47 V của Co3+/Co2+.
⇒ Chọn đáp án B Đáp án: B
Sử dụng đoạn thông tin dưới đây để trả lời câu 39 – 40:
Lưu huỳnh (sulfur) là phi kim đa hóa trị phổ biến, hiện diện trong một số amino acid và là tiền chất của nhiều hóa chất công nghiệp quan trọng, bao gồm H2SO4. H2SO4 là acid khoáng phổ biến với nhiều ứng dụng, một trong số đó là làm chất điện li trong pin.
Trong pin chì-acid của xe hơi, các phản ứng sau xảy ra:
▪ anode: Pb(s) → Pb2+(aq) + 2e;
▪ cathode: PbO2(s) + 4H+(aq) + 2e → Pb2+(aq) + 2H2O(l).
Trong pin chì-acid của xe hơi, các phản ứng sau xảy ra:
▪ anode: Pb(s) → Pb2+(aq) + 2e;
▪ cathode: PbO2(s) + 4H+(aq) + 2e → Pb2+(aq) + 2H2O(l).
Câu 39 [705787]: Khi pin hoạt động giải phóng năng lượng,
A, nồng độ H+ giảm dần.
B, nồng độ Pb2+ giảm dần.
C, khối lượng Pb rắn giảm.
D, khối lượng PbO2 rắn giảm.
Phản ứng tại mỗi điện cực:
Anode (cực âm - nơi oxi hóa xảy ra): Pb(s) ⟶ Pb2+(aq) + 2e
→ Chì kim loại bị oxi hóa thành ion Pb2+, làm nồng độ Pb²⁺ tăng.
Cathode (cực dương - nơi khử xảy ra): PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l)
→ PbO2 rắn bị tiêu hao để tạo ra Pb2+.
→ H+ bị tiêu hao, làm nồng độ H+ giảm.
Phân tích các đáp án:
❌ A. Sai. Ở cathode, ion H+ bị tiêu hao trong phản ứng với PbO2 nên nồng độ H+ giảm chứ không tăng.
✔️ B. Đúng. Cả hai điện cực đều tạo ra Pb2+ trong dung dịch, làm nồng độ Pb2+ tăng.
❌ C. Đúng. Pb ở anode bị oxi hóa thành Pb2+, tức là Pb bị ăn mòn, khối lượng giảm chứ không tăng.
❌ D. Sai. PbO2 rắn ở cathode bị tiêu hao để tạo Pb2+, nên khối lượng giảm.
⇒ Chọn đáp án B Đáp án: B
Anode (cực âm - nơi oxi hóa xảy ra): Pb(s) ⟶ Pb2+(aq) + 2e
→ Chì kim loại bị oxi hóa thành ion Pb2+, làm nồng độ Pb²⁺ tăng.
Cathode (cực dương - nơi khử xảy ra): PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l)
→ PbO2 rắn bị tiêu hao để tạo ra Pb2+.
→ H+ bị tiêu hao, làm nồng độ H+ giảm.
Phân tích các đáp án:
❌ A. Sai. Ở cathode, ion H+ bị tiêu hao trong phản ứng với PbO2 nên nồng độ H+ giảm chứ không tăng.
✔️ B. Đúng. Cả hai điện cực đều tạo ra Pb2+ trong dung dịch, làm nồng độ Pb2+ tăng.
❌ C. Đúng. Pb ở anode bị oxi hóa thành Pb2+, tức là Pb bị ăn mòn, khối lượng giảm chứ không tăng.
❌ D. Sai. PbO2 rắn ở cathode bị tiêu hao để tạo Pb2+, nên khối lượng giảm.
⇒ Chọn đáp án B Đáp án: B
Câu 40 [705788]: Cho 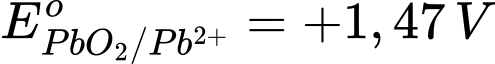 và
và 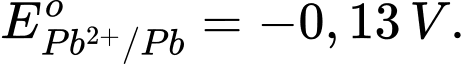 Tính giá trị Eo của pin.
Tính giá trị Eo của pin.
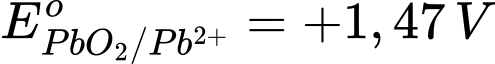 và
và 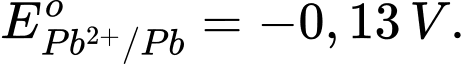 Tính giá trị Eo của pin.
Tính giá trị Eo của pin. A, 0,48 V.
B, 0,85 V.
C, 1,34 V.
D, 1,60 V.
Eopin = Eocathode – Eoanode = 1,47 – (–0,13) = 1,60 V
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Sử dụng đoạn thông tin dưới đây để trả lời câu 41 – 42:
Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hoá lithium - iodine (gồm hai cặp oxi hoá khử Li+/Li và I2/2I–). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Khi pin hoạt động, lithium bị oxi hoá và iodine bị khử. Biết 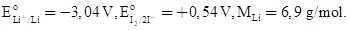 Điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s).
Điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s).
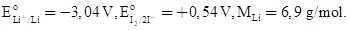 Điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s).
Điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s).
Câu 41 [705446]: Cho các nhận định sau, nhận định nào không đúng?
A, Iodine là cathode, lithium là anode.
B, Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-
C, Sức điện động chuẩn của pin là 3,58 V.
D, Cực dương xảy ra quá trình: Li → Li+ + 1e, cực âm xảy ra quá trình: I2 + 2e →2I-.
Ta có: 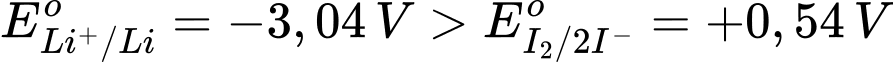 → Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
→ Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
Quá trình xảy ra trong pin:
Cathode (+): I2 + 2e ⟶ 2I–
Anode (–): Li ⟶ Li+ + 1e
Phản ứng trong pin: 2Li + I2 ⟶ 2Li+ + 2I–
⟶ Epin = E(+) – E(–) = 0,54 – (–3,04) = 3,58 V
Phân tích các nhận định:
✔️ A. Đúng. Iodine là cathode, lithium là anode.
✔️ B. Đúng. Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-.
✔️ C. Đúng. Sức điện động chuẩn của pin là 3,58 V.
❌ D. Sai. Cực dương xảy ra quá trình: I2 + 2e →2I-, cực âm xảy ra quá trình: Li → Li+ + 1e.
⇒ Chọn đáp án D Đáp án: D
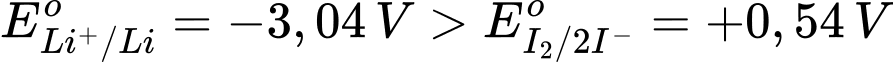 → Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
→ Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)Quá trình xảy ra trong pin:
Cathode (+): I2 + 2e ⟶ 2I–
Anode (–): Li ⟶ Li+ + 1e
Phản ứng trong pin: 2Li + I2 ⟶ 2Li+ + 2I–
⟶ Epin = E(+) – E(–) = 0,54 – (–3,04) = 3,58 V
Phân tích các nhận định:
✔️ A. Đúng. Iodine là cathode, lithium là anode.
✔️ B. Đúng. Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-.
✔️ C. Đúng. Sức điện động chuẩn của pin là 3,58 V.
❌ D. Sai. Cực dương xảy ra quá trình: I2 + 2e →2I-, cực âm xảy ra quá trình: Li → Li+ + 1e.
⇒ Chọn đáp án D Đáp án: D
Câu 42 [705447]: Nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong bao nhiêu ngày?
A, 648 ngày.
B, 1554 ngày.
C, 378 ngày.
D, 965 ngày.
Với t (thời gian, đơn vị: giây). Gọi a là số ngày cần tìm, đổi sang giây ta được: a × 24 × 3600 = t (giây)
Áp dụng định luật Faraday, ta có:
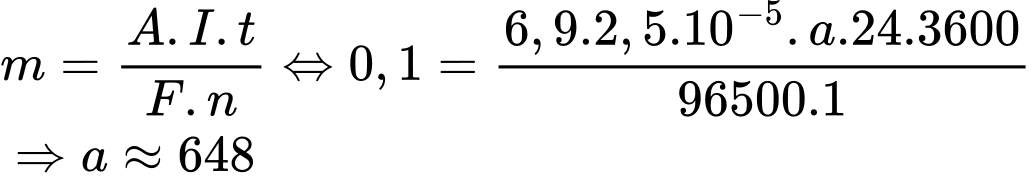
Vậy nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong 648 ngày.
⇒ Chọn đáp án A Đáp án: A
Áp dụng định luật Faraday, ta có:
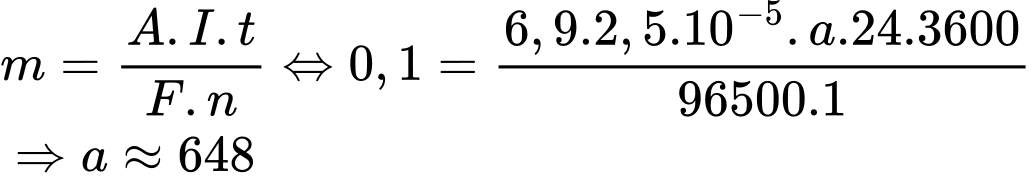
Vậy nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong 648 ngày.
⇒ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 43 – 44:
Serotonin là một chất dẫn truyền thần kinh quan trọng, ảnh hưởng đến tâm trạng, hành vi, ăn uống, giấc ngủ và nhiều chức năng cơ thể khác. Sự thiếu hụt serotonin có thể gây ra tình trạng trầm cảm.

Câu 43 [705813]: Số nguyên tử hydrogen trong phân tử serotonin là
A, 10.
B, 12.
C, 14.
D, 16.
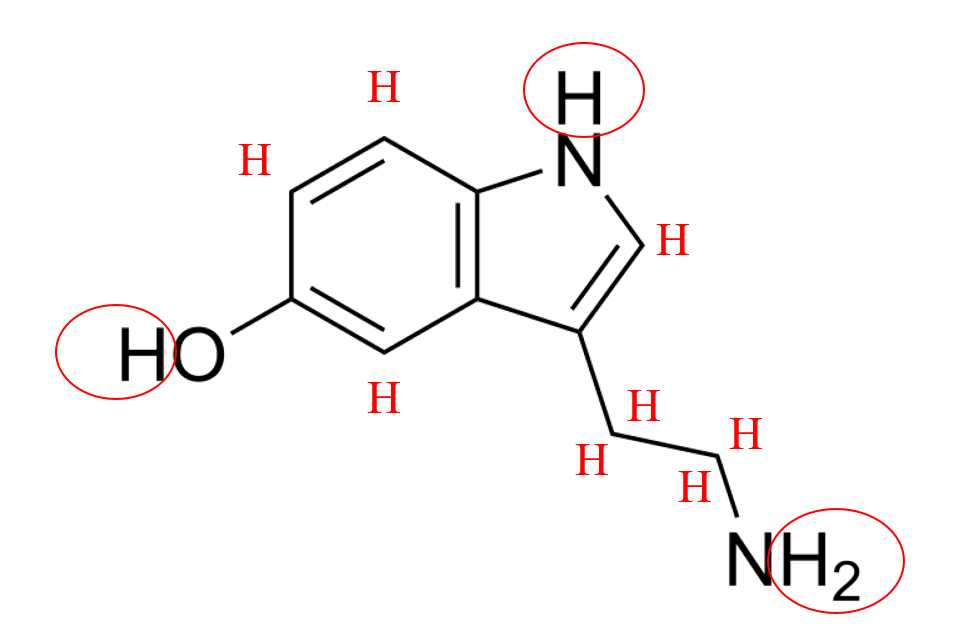
Tổng số hydrogen có trong Serotonin là 12
⟹ Chọn đáp án B
Câu 44 [705814]: 26,4 gam serotonin phản ứng vừa đủ với x mol NaOH. Giá trị của x là bao nhiêu?
A, 0,15 mol.
B, 0,3 mol.
C, 0,1 mol.
D, 0,2 mol.
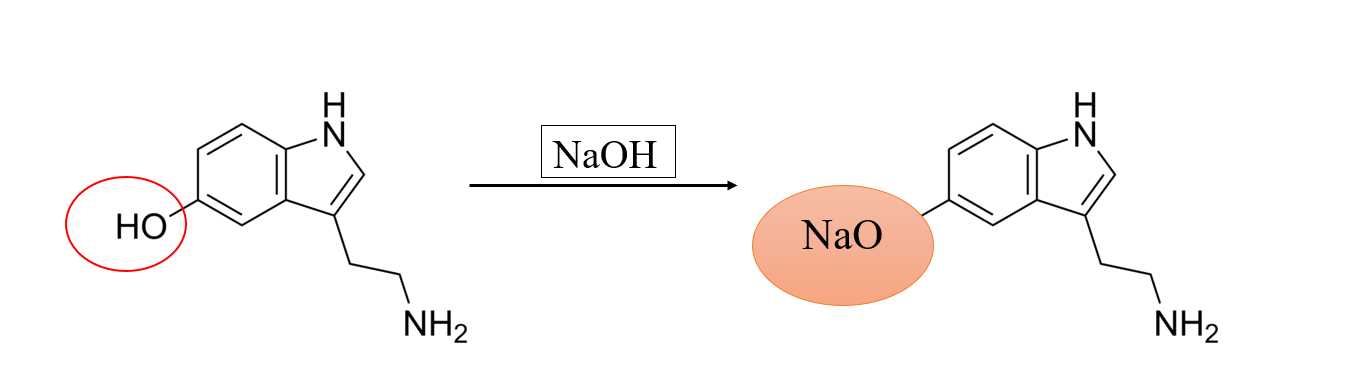
Phản ứng với NaOH vào nhóm OH của Serotonin. Serotonin có 1 nhóm OH => phản ứng với 1 NaOH
Số mol serotonin = m : M = 0,15 mol = n NaOH
⟹Chọn đáp án A
Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 45 – 46:
Kết quả phân tích nguyên tố của một α-amino acid X như sau: %C = 46,06%; %H = 8,74%; %N = 13,59% (về khối lượng); còn lại là oxygen. Trên phổ khối lượng của X có mảnh ion [m/z] lớn nhất có giá trị 103.
Câu 45 [705890]: Số nguyên tử carbon có trong một phân tử X là
A, 4.
B, 9.
C, 2.
D, 3.
Ta có : %O = 100% - 46,06% - 8,74% - 13,59% = 31,61%
Gọi công thức phân tử của X là: CxHyOzNt
Phổ khối lượng MX có mảnh ion (m/z) có giá trị lớn nhất bằng 103 ⟹ MX = 103.
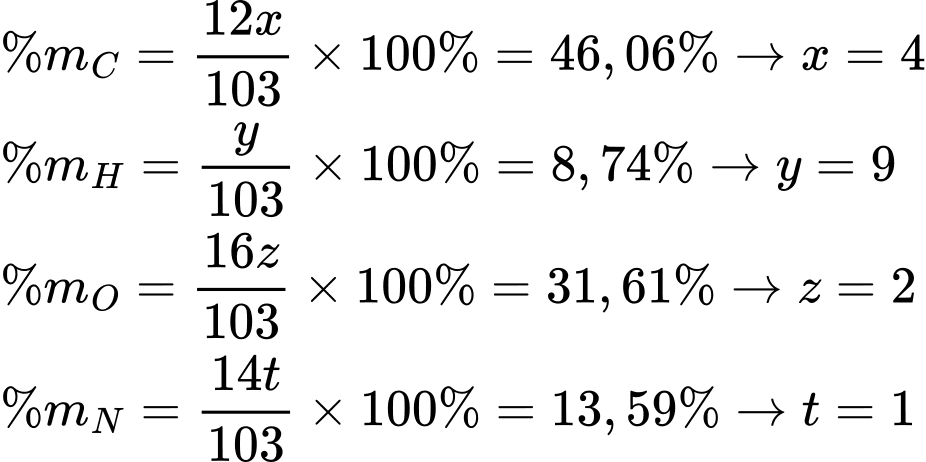
Công thức phân tử của X là: C4H9O2N
X có số nguyên tử carbon là: 4
⟹ Chọn đáp án A Đáp án: A
Gọi công thức phân tử của X là: CxHyOzNt
Phổ khối lượng MX có mảnh ion (m/z) có giá trị lớn nhất bằng 103 ⟹ MX = 103.
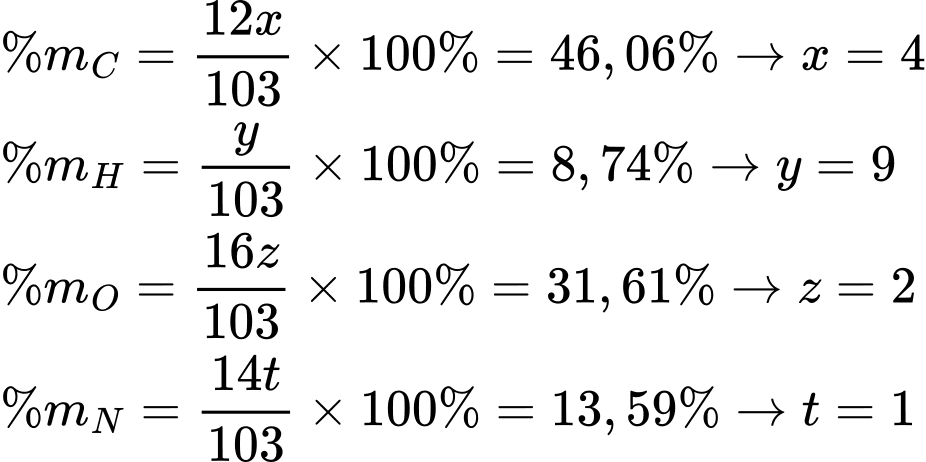
Công thức phân tử của X là: C4H9O2N
X có số nguyên tử carbon là: 4
⟹ Chọn đáp án A Đáp án: A
Câu 46 [705891]: Cho 20,6 gam X tác dụng hoàn toàn với dung dịch HCl, sau phản ứng thu được bao nhiêu gam muối?
A, 27,9 gam.
B, 24,25 gam.
C, 25 gam.
D, 29,5 gam.
Gọi công thức của amino acid X là CxHyOzNt
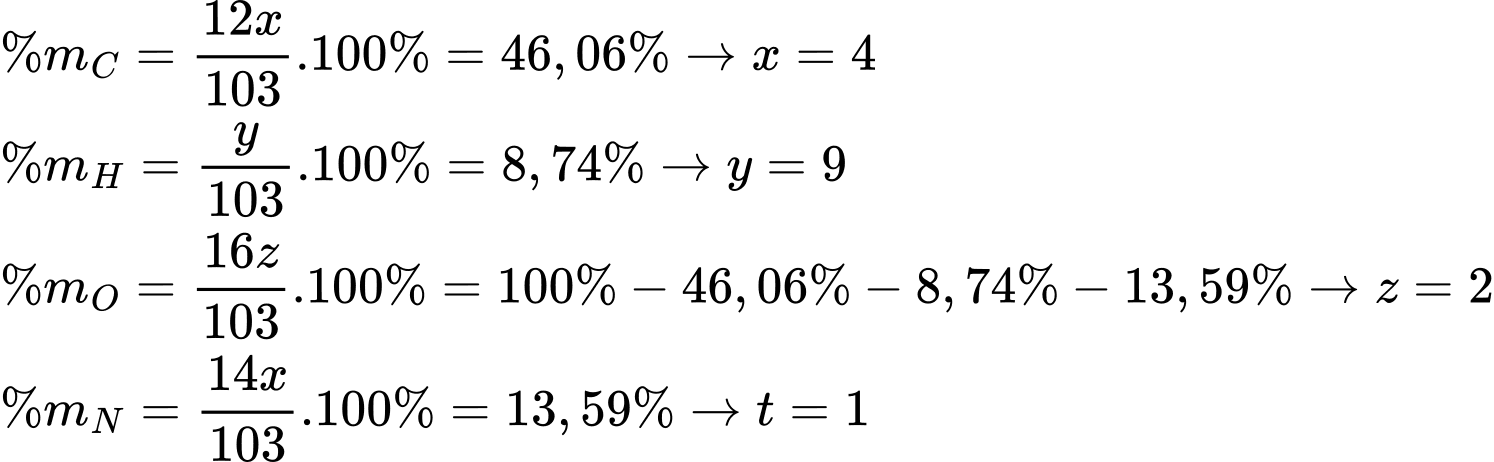
Công thức phân tử của amino acid X là C4H9O2N
C4H9O2N + HCl ⟶ C4H10O2NCl
Số mol của C4H9O2N là nC4H9O2N = 20,6 : 103 = 0,2 mol
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 139,5 = 27,9 gam
⟹ Chọn đáp án A Đáp án: A
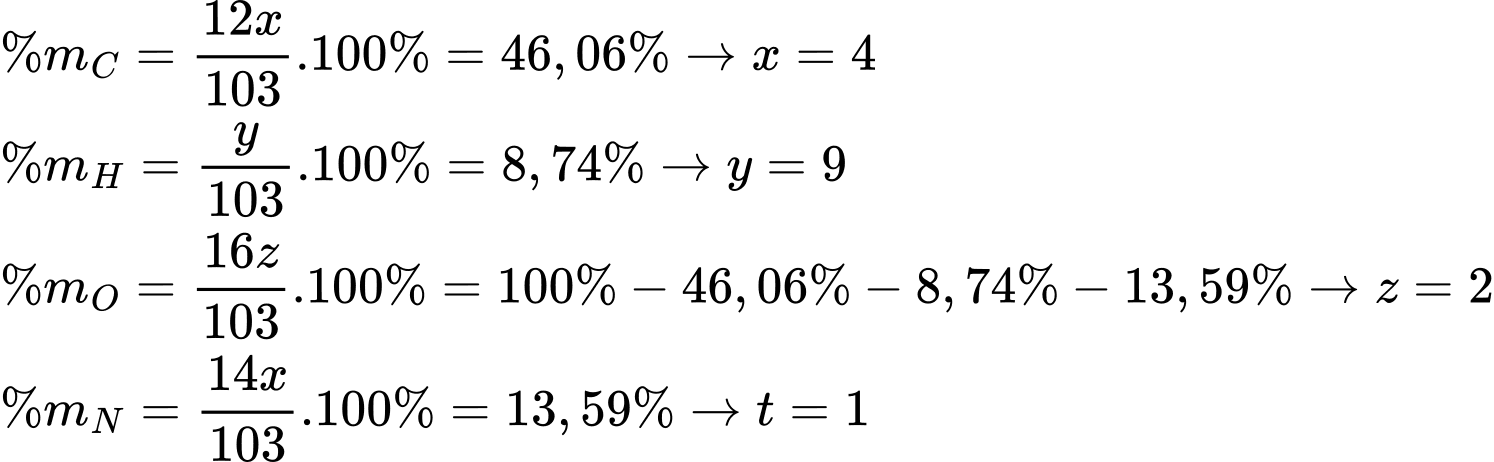
Công thức phân tử của amino acid X là C4H9O2N
C4H9O2N + HCl ⟶ C4H10O2NCl
Số mol của C4H9O2N là nC4H9O2N = 20,6 : 103 = 0,2 mol
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 139,5 = 27,9 gam
⟹ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 47 – 48:
Leucine là một trong những amino acid thiết yếu, cơ thể không thể tự tổng hợp được mà phải lấy từ thức ăn. Leucine được tìm thấy có trong thịt, cá, gia cầm. Leucine có khả năng kích thích sự tổng hợp protein, giúp cơ thể để xây dựng cơ bắp. Công thức cấu tạo của leucine được cho trong hình vẽ bên.
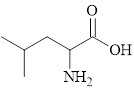

Câu 47 [705840]: Leucine không tham gia phản ứng với dung dịch nào dưới đây?
A, dung dịch NaOH.
B, Dung dịch HCl.
C, Ethanol (xúc tác H2SO4 đặc).
D, Dung dịch NaCl.
- Tính acid – base: Amino acid vừa tác dụng với acid mạnh tạo muối ammonium, vừa tác dụng được với base mạnh tạo muối carboxylate. Vì thế, amino acid là những hợp chất lưỡng tính.
- Phản ứng tạo ester của nhóm – COOH: Tương tự như carboxylic acid, amino acid có thể tác dụng với alcohol khi có mặt xúc tác acid mạnh để tạo thành ester.
Phân tích các đáp án:
✔️A. NaOH là base
✔️B. HCl là acid
✔️C. Ethanol là alcohol
❌D. NaCl là muối
⟹ Chọn đáp án D Đáp án: D
- Phản ứng tạo ester của nhóm – COOH: Tương tự như carboxylic acid, amino acid có thể tác dụng với alcohol khi có mặt xúc tác acid mạnh để tạo thành ester.
Phân tích các đáp án:
✔️A. NaOH là base
✔️B. HCl là acid
✔️C. Ethanol là alcohol
❌D. NaCl là muối
⟹ Chọn đáp án D Đáp án: D
Câu 48 [705841]: Cho 0,2 mol leucine tham gia phản ứng với dung dịch KOH vừa đủ, dung dịch thu được đem cô cạn thu được bao nhiêu gam muối?
A, 34,0.
B, 30,8.
C, 30,8.
D, 33,8.
Phương trình phản ứng:
CH3CH(CH3)CH2CH(NH2)COOH + KOH → CH3CH(CH3)CH2CH(NH2)COOK + H2O
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 169 = 33,8 gam
⟹ Chọn đáp án D Đáp án: D
CH3CH(CH3)CH2CH(NH2)COOH + KOH → CH3CH(CH3)CH2CH(NH2)COOK + H2O
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 169 = 33,8 gam
⟹ Chọn đáp án D Đáp án: D
Sử dụng thông tin dưới đây, trả lời câu hỏi số 49 – 50
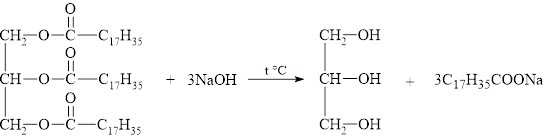
Tiến hành đun nóng 100 kg một loại chất béo chứa 80% tristearin, còn lại là các tạp chất không phản ứng với dung dịch NaOH theo phương trình sau:

Câu 49 [705937]: Phản ứng trên thuộc loại phản ứng nào?
A, trung hòa.
B, xà phòng hóa.
C, ester hóa.
D, lên men.
Trong công nghiệp, để sản xuất xà phòng, người ta thường đun chất béo (mỡ động vật, dầu thực vật) với dung dịch kiềm đặc ở nhiệt độ cao (phản ứng xà phòng hóa). Sau phản ứng, hỗn hợp muối của acid béo được tách ra bằng cách cho dung dịch muối ăn bảo hoà và hỗn hợp sản phẩm. các muối của acid béo nổi lên, được lấy ra sau đó được trọn với chất phụ gia để làm xà phòng. Phần dung dịch còn lại đem tách và thu hồi glycerol.
(C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
⟹ Chọn đáp án B Đáp án: B
(C17H35COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
⟹ Chọn đáp án B Đáp án: B
Câu 50 [705938]: Sau khi thực hiện phản ứng trên thu được bao nhiêu kilogam sodium stearate? (Biết hiệu suất phản ứng là 90%.)
A, 91,684.
B, 82,515.
C, 74,264.
D, 24,754.
Phương trình phản ứng:
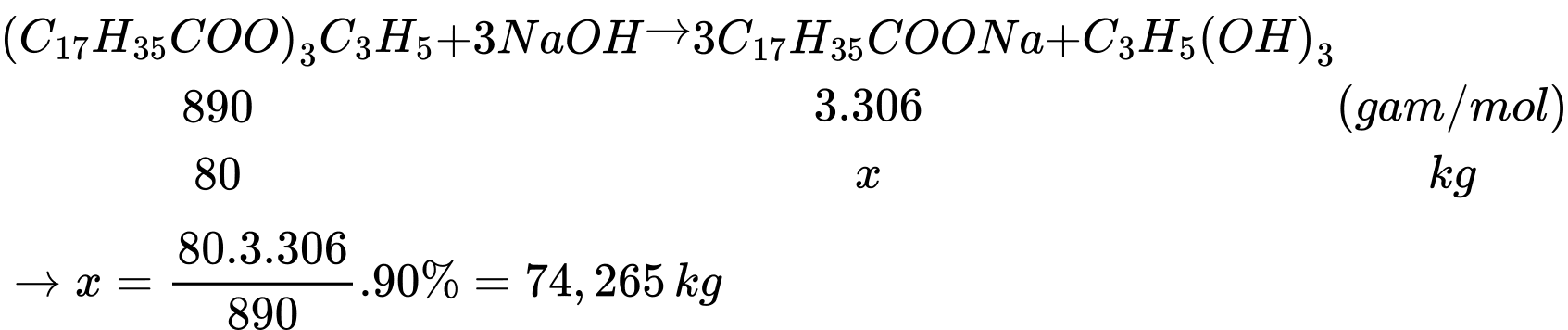
⟹ Chọn đáp án C Đáp án: C
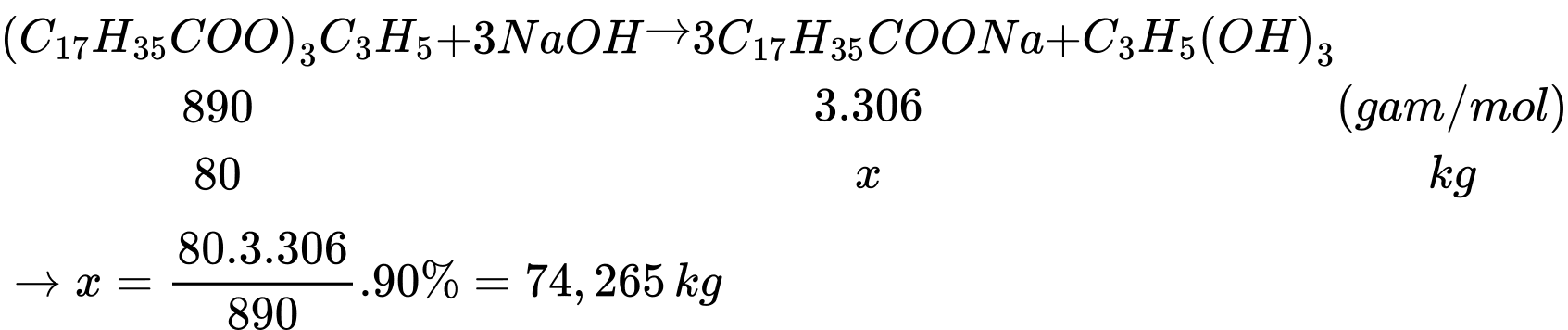
⟹ Chọn đáp án C Đáp án: C