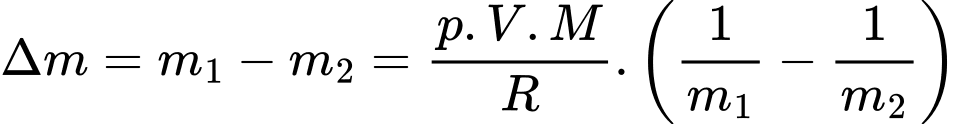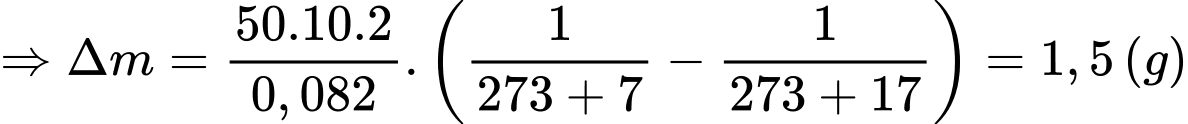Câu 1 [817488]: Gọi p là áp suất, V là thể tích, R là hằng số khí lí tưởng, k là hằng số Boltzmann và T là nhiệt độ tuyệt đối. Số mol khí có trong một khối lượng chất khí cho trước được xác định bởi biểu thức
A, 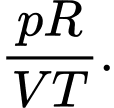
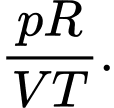
B, 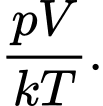
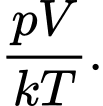
C, 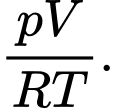
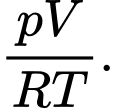
D, pV.
Theo phương trình Clapeyron: 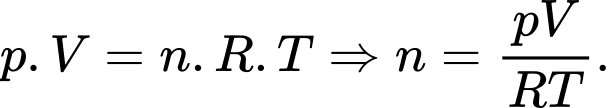
Chọn C Đáp án: C
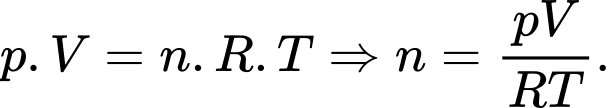
Chọn C Đáp án: C
Câu 2 [817492]: Xét một lượng khí lí tưởng đang có thể tích V, áp suất p và nhiệt độ tuyệt đối T, R là hằng số khí lí tưởng. Trong mối quan hệ 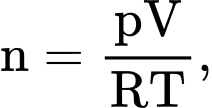 n là
n là
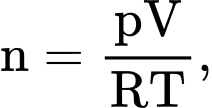 n là
n là A, khối lượng 1 phân tử.
B, tổng số phân tử.
C, mật độ phân tử.
D, số mol khí.
Xét một lượng khí lí tưởng đang có thể tích V, áp suất p và nhiệt độ tuyệt đối T, R là hằng số khí lí tưởng. Trong mối quan hệ 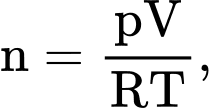 n là số mol khí.
n là số mol khí.
Chọn D Đáp án: D
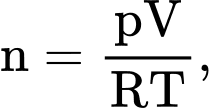 n là số mol khí.
n là số mol khí.Chọn D Đáp án: D
Câu 3 [817493]: Hãy chọn câu đúng. Hằng số của các khí R có giá trị bằng tích của áp suất và thể tích của
A, một mol khí ở nhiệt độ bất kì.
B, chia cho số mol ở 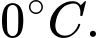
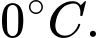
C, một mol khí ở nhiệt độ bất kì chia cho nhiệt độ tuyệt đối.
D, một mol khí ở 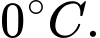
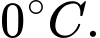
Hằng số của các khí R có giá trị bằng 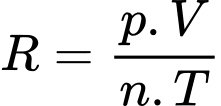 là tích của áp suất và thể tích của một mol khí ở nhiệt độ bất kì chia cho nhiệt độ tuyệt đối.
là tích của áp suất và thể tích của một mol khí ở nhiệt độ bất kì chia cho nhiệt độ tuyệt đối.
Chọn C Đáp án: C
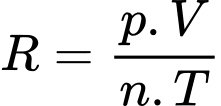 là tích của áp suất và thể tích của một mol khí ở nhiệt độ bất kì chia cho nhiệt độ tuyệt đối.
là tích của áp suất và thể tích của một mol khí ở nhiệt độ bất kì chia cho nhiệt độ tuyệt đối.Chọn C Đáp án: C
Câu 4 [817494]: Hai bình kín có thể tích bằng nhau đều chứa khí lí tưởng ở cùng một nhiệt độ. Khối lượng khí trong hai bình bằng nhau nhưng khối lượng một phân tử khí của bình 1 lớn gấp hai lần khối lượng một phân tử khí ở bình 2. Áp suất khí ở bình 1
A, gấp bốn lần áp suất khí ở bình 2.
B, bằng một nửa áp suất khí ở bình 2.
C, gấp hai lần áp suất khí ở bình 2.
D, bằng áp suất khí ở bình 2.
Khối lượng một phân tử khí của bình 1 lớn gấp hai lần khối lượng một phân tử khí ở bình 2 và khối lượng khí lí tưởng trong hai bình bằng nhau nên số phân tử khí của hai bình lần lượt là 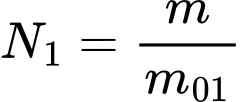 và
và 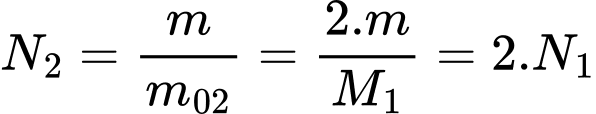 br>
Theo phương trình Clapeyron:
br>
Theo phương trình Clapeyron: 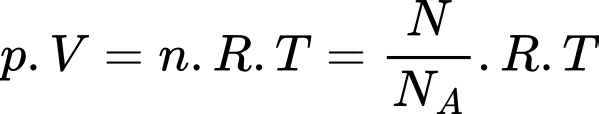
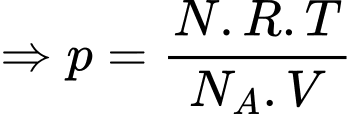 Ta có:
Ta có: 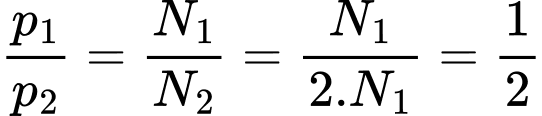
Chọn B Đáp án: B
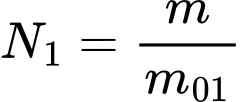 và
và 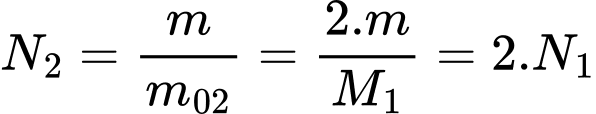 br>
Theo phương trình Clapeyron:
br>
Theo phương trình Clapeyron: 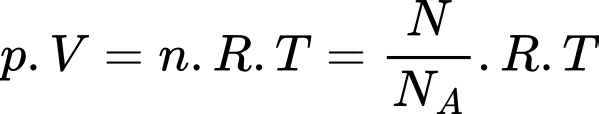
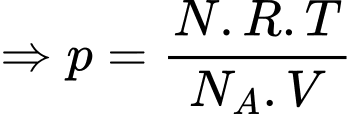 Ta có:
Ta có: 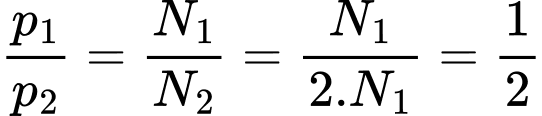
Chọn B Đáp án: B
Câu 5 [709699]: Trong sơ đồ, đường đứt nét X biểu thị sự thay đổi của áp suất, p, theo nhiệt độ tuyệt đối, T, đối với 1 mol khí lý tưởng trong một bình chứa có thể tích cố định. Đường nào, A, B, C hay D biểu diễn sự biến thiên của 2 mol khí trong cùng một bình chứa?
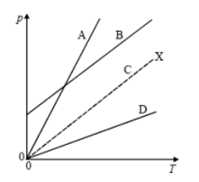

A, Đường A.
B, Đường B.
C, Đường C.
D, Đường D.
Có: 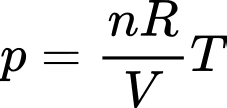
Số mol n tăng 2 lần
=> Hệ số góc phương trình trên tăng 2 lần nên góc lệch tăng
=> Chọn A Đáp án: A
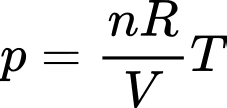
Số mol n tăng 2 lần
=> Hệ số góc phương trình trên tăng 2 lần nên góc lệch tăng
=> Chọn A Đáp án: A
Câu 6 [817495]: Có 14 g chất khí lí tưởng đựng trong bình kín có thể tích 1 lít. Đun nóng đến 127 oC, áp suất trong bình là 16,62.105 Pa. Khí đó là khí gì?
A, Hidrogen.
B, Oxygen.
C, Nitrogen.
D, Helium.
Theo phương trình Clapeyron: 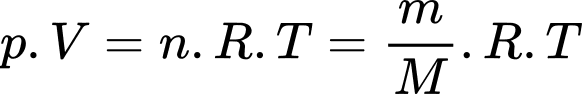
 Khối lượng mol của khí đó là:
Khối lượng mol của khí đó là: 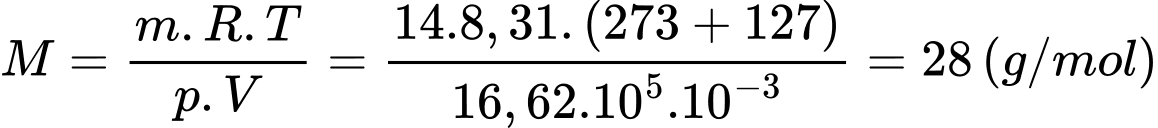
Khí đó là khí Nitrogen.
Chọn C Đáp án: C
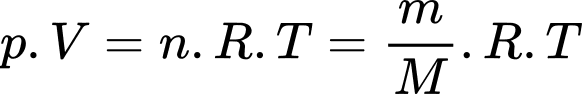
 Khối lượng mol của khí đó là:
Khối lượng mol của khí đó là: 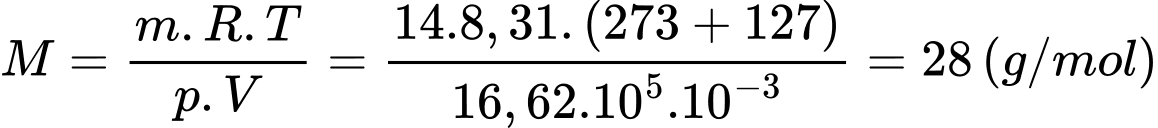
Khí đó là khí Nitrogen.
Chọn C Đáp án: C
Câu 7 [817497]: Có bao nhiêu mol khí nitơ trong một bình kín có dung tích 0,75 lít ở 26 oC và ở áp suất 760 mmHg. Biết R = 0,082 atm.lít/mol.K.
A, 1,06 mol.
B, 0,02 mol.
C, 0,15 mol.
D, 0,03 mol.
Phương trình Clapeyron: 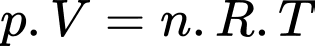
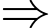 Số nol khí Nito là
Số nol khí Nito là 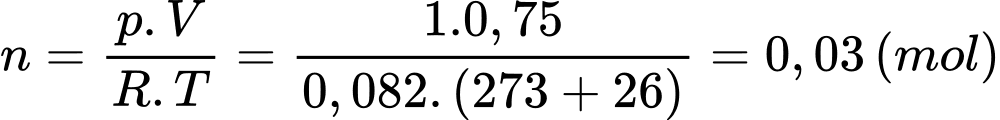
Chọn D Đáp án: D
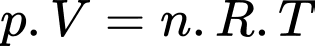
 Số nol khí Nito là
Số nol khí Nito là 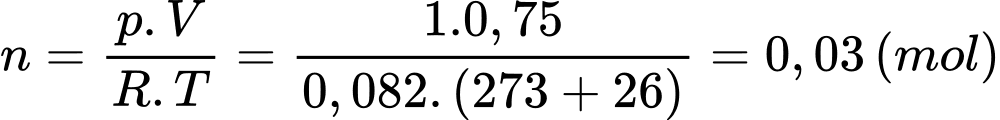
Chọn D Đáp án: D
Câu 8 [817498]: Cho khối lượng riêng của không khí ở điều kiện tiêu chuẩn là 1,29 kg/m3. Coi không khí như một chất khí thuần nhất. Khối lượng mol của không khí xấp xỉ bằng
A, 42,5 g/mol.
B, 28,9 g/mol.
C, 35,7 g/mol.
D, 16,8 g/mol.
Phương trình Clapeyron: 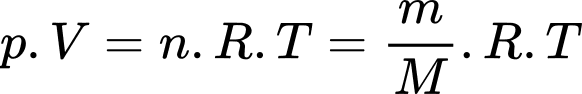
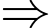 Khối lượng mol của không khí xấp xỉ bằng
Khối lượng mol của không khí xấp xỉ bằng 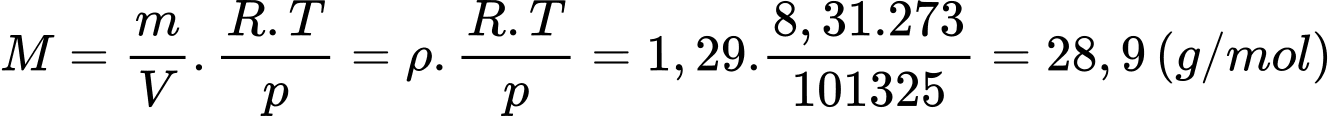
Chọn B Đáp án: B
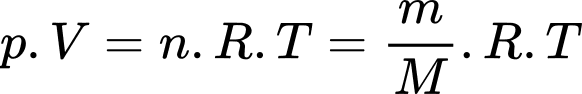
 Khối lượng mol của không khí xấp xỉ bằng
Khối lượng mol của không khí xấp xỉ bằng 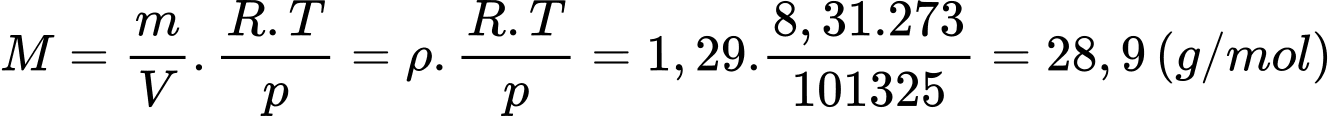
Chọn B Đáp án: B
Câu 9 [817499]: Ở điều kiện tiêu chuẩn: 1 mol khí ở 0 0C có áp suất 1 atm và thể tích là 22,4 lít. Hỏi một bình có dung tích 5 lít chứa 0,5 mol khí ở nhiệt độ 0 0C có áp suất là bao nhiêu?
A, 1,25 atm.
B, 3,52 atm.
C, 5,3 atm.
D, 2,24 atm.
Theo phương trình Clapeyron: 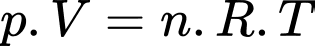
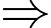 Hằng số khí lí tưởng là
Hằng số khí lí tưởng là 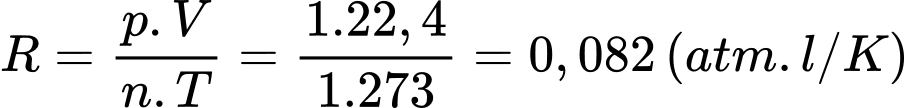
Theo phương trình Clapeyron: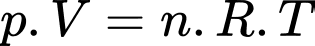
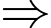 Một bình có dung tích 5 lít chứa 0,5 mol khí ở nhiệt độ 0 0C có áp suất là
Một bình có dung tích 5 lít chứa 0,5 mol khí ở nhiệt độ 0 0C có áp suất là 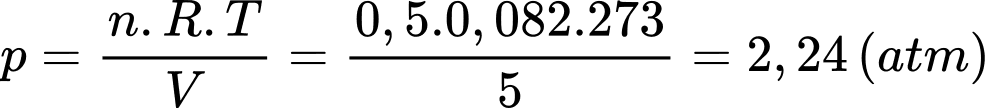
Chọn D Đáp án: D
 Hằng số khí lí tưởng là
Hằng số khí lí tưởng là 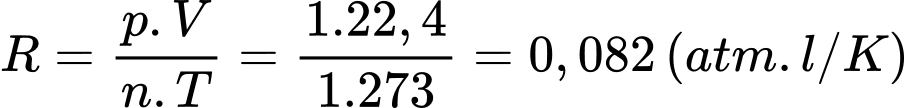
Theo phương trình Clapeyron:
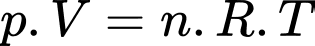
 Một bình có dung tích 5 lít chứa 0,5 mol khí ở nhiệt độ 0 0C có áp suất là
Một bình có dung tích 5 lít chứa 0,5 mol khí ở nhiệt độ 0 0C có áp suất là 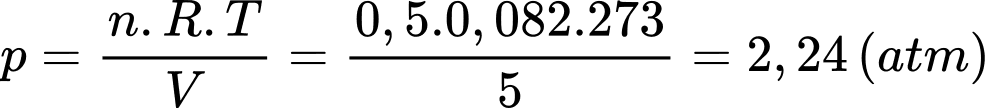
Chọn D Đáp án: D
Câu 10 [817500]: Có 1,5 mol khí lí tưởng chứa trong một bình có thể tích 20 lít ở nhiệt độ 47 °C. Áp suất khí trong bình có giá trị
A, 199,44.103 Pa.
B, 194,94.103 Pa.
C, 149,49.103 Pa.
D, 919,44.103 Pa.
Theo phương trình Clapeyron: 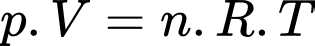
 Áp suất khí trong bình có giá trị
Áp suất khí trong bình có giá trị 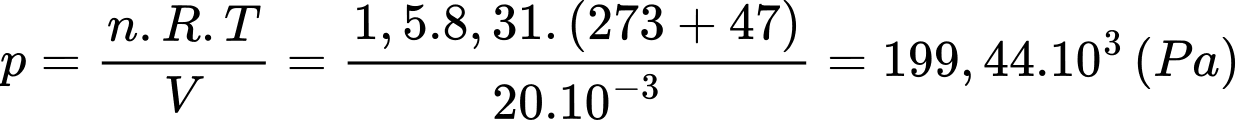
Chọn A Đáp án: A
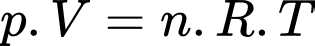
 Áp suất khí trong bình có giá trị
Áp suất khí trong bình có giá trị 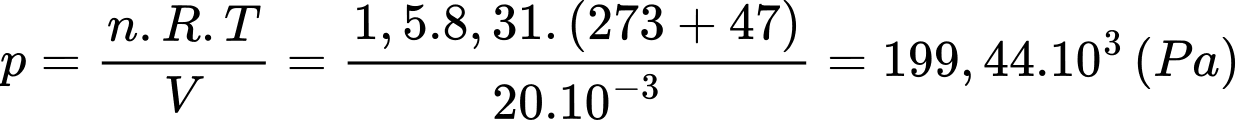
Chọn A Đáp án: A
Câu 11 [817502]: Một bình chứa khí oxygen dung tích 10 lít ở áp suất 250 kPa và nhiệt độ 27 °C. Xem gần đúng oxygen trong trường hợp này là khí lý tưởng và khối lượng mol là 32 g/mol. Khối lượng khí oxygen trong bình bằng
A, 22,4 g.
B, 32,1 g.
C, 25,8 g.
D, 12,6 g.
Theo phương trình Clapeyron: 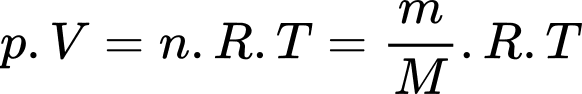
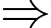 Khối lượng khí oxygen trong bình bằng
Khối lượng khí oxygen trong bình bằng 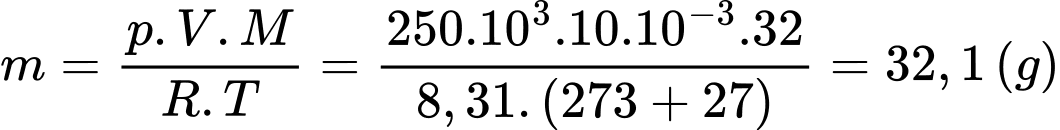
Chọn B Đáp án: B
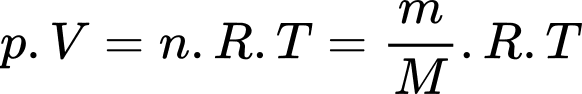
 Khối lượng khí oxygen trong bình bằng
Khối lượng khí oxygen trong bình bằng 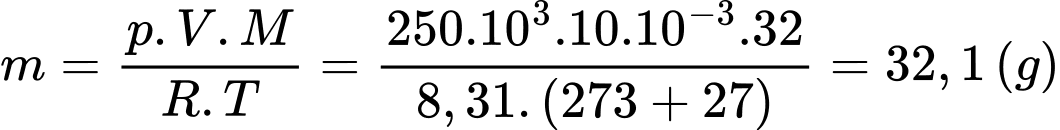
Chọn B Đáp án: B
Câu 12 [817503]: Một bình có thể tích V = 20 lít chứa một hỗn hợp khí gồm Hydrogen và Helium ở nhiệt độ t = 20 °C dưới áp suất p = 200 kPa. Khối lượng của hỗn hợp khí là m = 5 gam. Biết khối lượng mol của Hydrogen là 2 g và của Heli là 4 g. Khối lượng của mỗi chất khí trong hỗn hợp là
A, 1,6 gam, 3,4 gam.
B, 1,0 gam, 4,0 gam.
C, 2,0 gam, 3,0 gam.
D, 2,2 gam, 2,8 gam.
Theo phương trình Clapeyron: 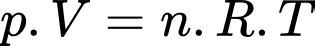
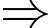 Số mol khí trong bình là
Số mol khí trong bình là
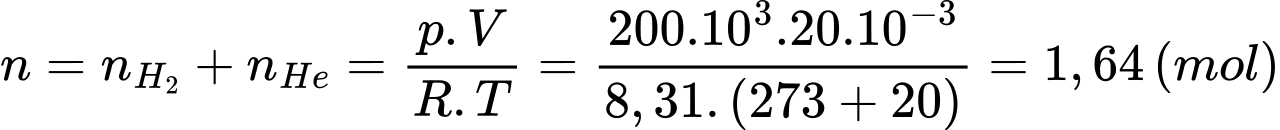
Ta có: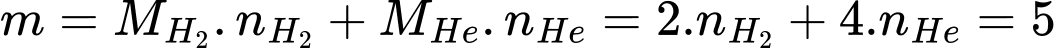 Giải hệ ta có:
Giải hệ ta có: 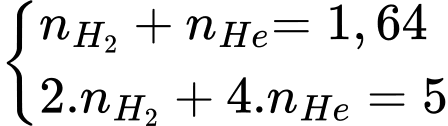
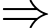 Số mol của Hydrogen và Heli lần lượt là
Số mol của Hydrogen và Heli lần lượt là 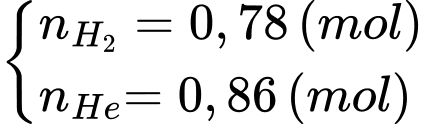
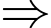 Khối lượng của mỗi chất khí trong hỗn hợp là
Khối lượng của mỗi chất khí trong hỗn hợp là 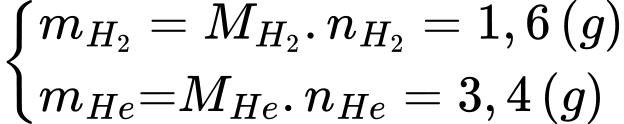
Chọn A Đáp án: A
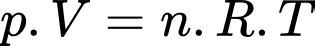
 Số mol khí trong bình là
Số mol khí trong bình là
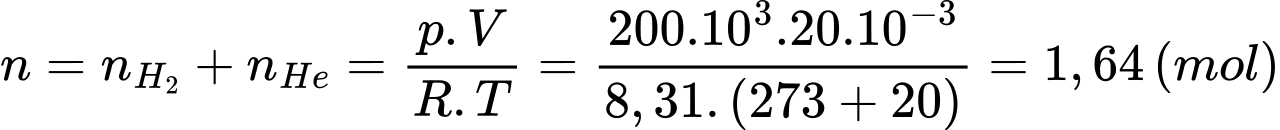
Ta có:
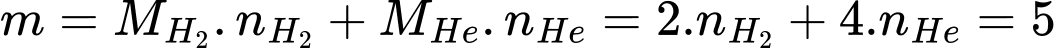 Giải hệ ta có:
Giải hệ ta có: 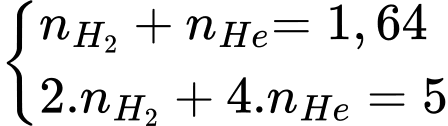
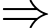 Số mol của Hydrogen và Heli lần lượt là
Số mol của Hydrogen và Heli lần lượt là 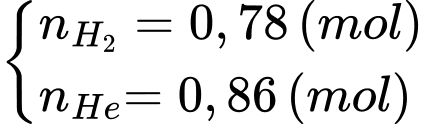
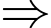 Khối lượng của mỗi chất khí trong hỗn hợp là
Khối lượng của mỗi chất khí trong hỗn hợp là 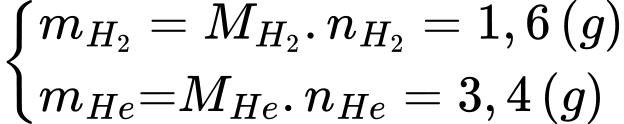
Chọn A Đáp án: A
Câu 13 [817506]: Biết không khí có khối lượng mol là 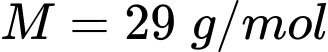 và khối lượng riêng
và khối lượng riêng 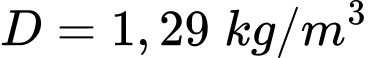 ;
; 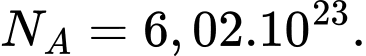 Một học sinh hít một hơi thật sâu và hít vào khoảng
Một học sinh hít một hơi thật sâu và hít vào khoảng  Một hơi hít sâu như vậy có bao nhiêu phân tử không khí được hít vào?
Một hơi hít sâu như vậy có bao nhiêu phân tử không khí được hít vào?
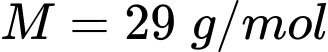 và khối lượng riêng
và khối lượng riêng 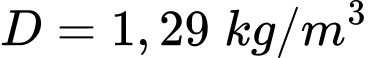 ;
; 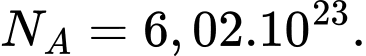 Một học sinh hít một hơi thật sâu và hít vào khoảng
Một học sinh hít một hơi thật sâu và hít vào khoảng  Một hơi hít sâu như vậy có bao nhiêu phân tử không khí được hít vào?
Một hơi hít sâu như vậy có bao nhiêu phân tử không khí được hít vào? A, 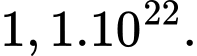
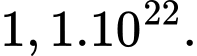
B, 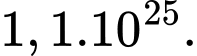
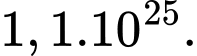
C, 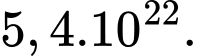
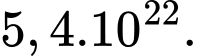
D, 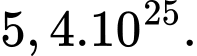
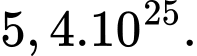
Số mol khí được xác định bằng công thức: 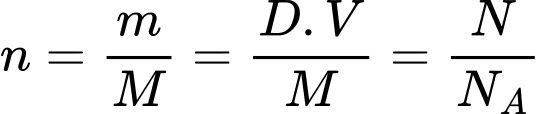
 Một hơi hít sâu như vậy có
Một hơi hít sâu như vậy có 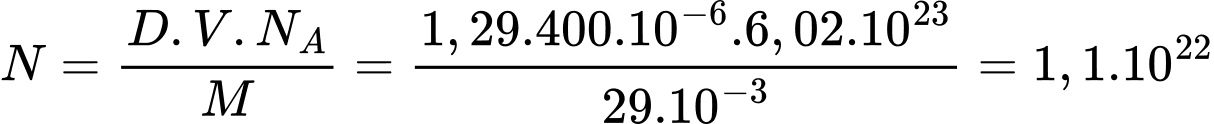 phân tử không khí được hít vào.
phân tử không khí được hít vào.
Chọn A Đáp án: A
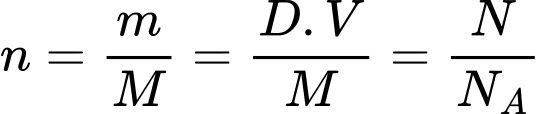
 Một hơi hít sâu như vậy có
Một hơi hít sâu như vậy có 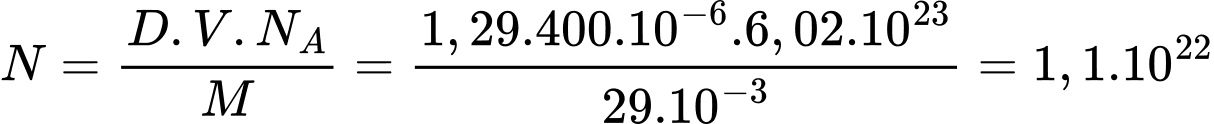 phân tử không khí được hít vào.
phân tử không khí được hít vào.Chọn A Đáp án: A
Câu 14 [817507]: Một máy hút chân không làm giảm áp suất khí nitrogen trong một bình kín tới 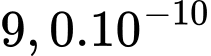 Pa ở nhiệt độ
Pa ở nhiệt độ  Cho
Cho 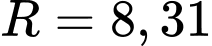 J/(mol.K);
J/(mol.K); 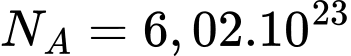 mol
mol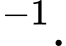 Số phân tử khí trong thể tích 1,0 cm
Số phân tử khí trong thể tích 1,0 cm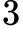 xấp xỉ là
xấp xỉ là
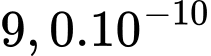 Pa ở nhiệt độ
Pa ở nhiệt độ  Cho
Cho 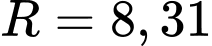 J/(mol.K);
J/(mol.K); 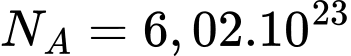 mol
mol Số phân tử khí trong thể tích 1,0 cm
Số phân tử khí trong thể tích 1,0 cm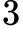 xấp xỉ là
xấp xỉ là A, 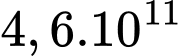 phân tử.
phân tử.
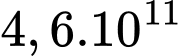 phân tử.
phân tử.B, 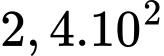 phân tử.
phân tử.
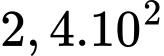 phân tử.
phân tử.C, 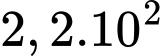 phân tử.
phân tử.
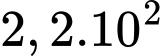 phân tử.
phân tử.D, 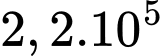 phân tử.
phân tử.
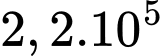 phân tử.
phân tử.
Theo phương trình Clapeyron: 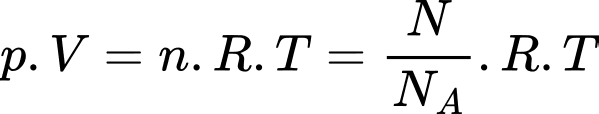
 Số phân tử khí trong thể tích 1,0 cm
Số phân tử khí trong thể tích 1,0 cm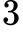 xấp xỉ là
xấp xỉ là 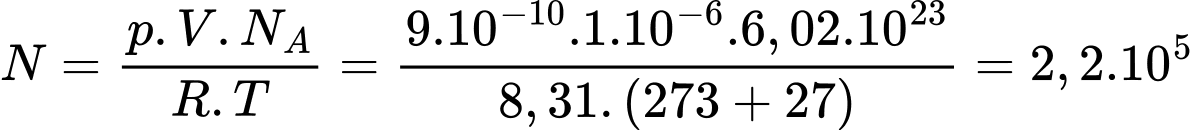
Chọn D Đáp án: D
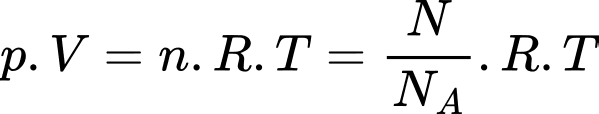
 Số phân tử khí trong thể tích 1,0 cm
Số phân tử khí trong thể tích 1,0 cm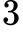 xấp xỉ là
xấp xỉ là 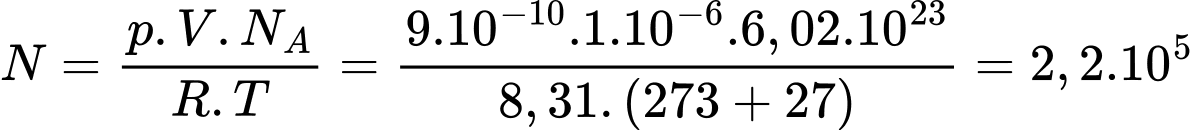
Chọn D Đáp án: D
Câu 15 [817508]: Phòng thí nghiệm có 1 gam khí hydrogen được đựng trong bình có thể tích là 4 lít. Cho khối lượng mol của khí Hydrogen là 2 gam/mol, cho hằng số Avogadro là 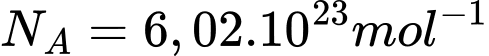 , mật độ phân tử của chất khí hydrogen xấp xỉ là
, mật độ phân tử của chất khí hydrogen xấp xỉ là
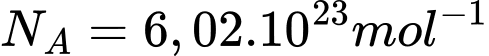 , mật độ phân tử của chất khí hydrogen xấp xỉ là
, mật độ phân tử của chất khí hydrogen xấp xỉ là A, 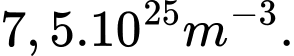
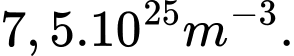
B, 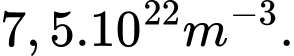
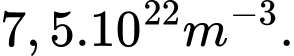
C, 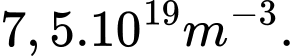
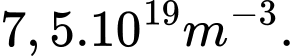
D, 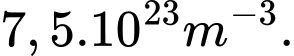
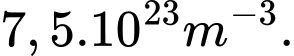
Số nol khí được xác định bằng công thức: 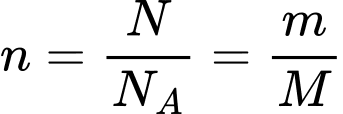
 Số hạt nhân trong 1g khí hydrogen là
Số hạt nhân trong 1g khí hydrogen là 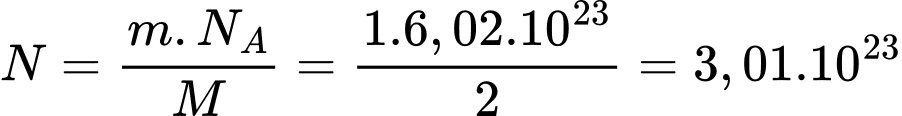 hạt
hạt
Mật độ phân tử của chất khí hydrogen xấp xỉ là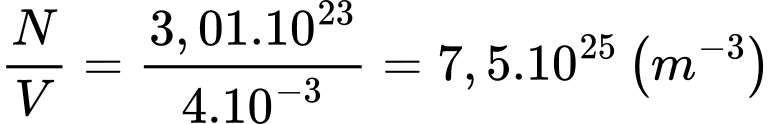
Chọn A Đáp án: A
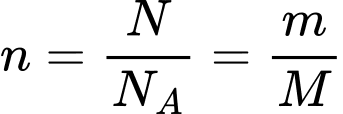
 Số hạt nhân trong 1g khí hydrogen là
Số hạt nhân trong 1g khí hydrogen là 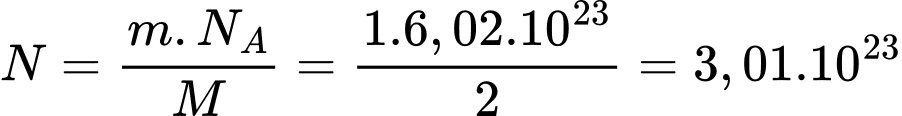 hạt
hạtMật độ phân tử của chất khí hydrogen xấp xỉ là
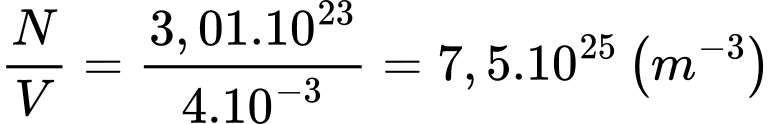
Chọn A Đáp án: A
Câu 16 [817515]: Một căn phòng có thể tích 50 m3. Khi tăng nhiệt độ của phòng từ 20 °C đến 30 °C thì khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là bao nhiêu kg? Coi áp suất khí trong phòng không đổi. Biết khối lượng riêng của không khí ở 20 °C là 1,2 kg/m3.
A, 1,98 kg.
B, 30,00 kg.
C, 2,05 kg.
D, 20,00 kg.
Khối lượng khí trong phòng vào ban đầu là 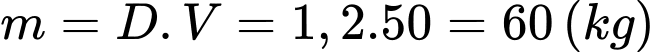
Theo phương trình Clapeyron: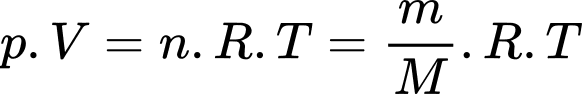
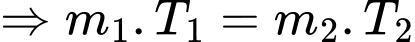
 Khối lượng khí khi tăng nhiệt độ là
Khối lượng khí khi tăng nhiệt độ là 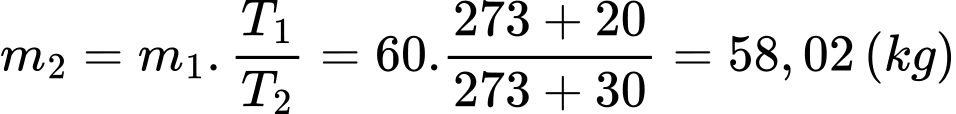
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là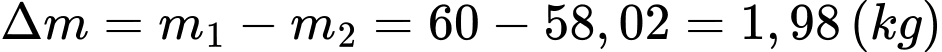
Chọn A Đáp án: A
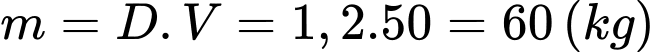
Theo phương trình Clapeyron:
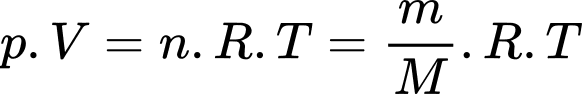
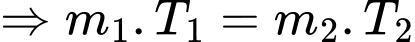
 Khối lượng khí khi tăng nhiệt độ là
Khối lượng khí khi tăng nhiệt độ là 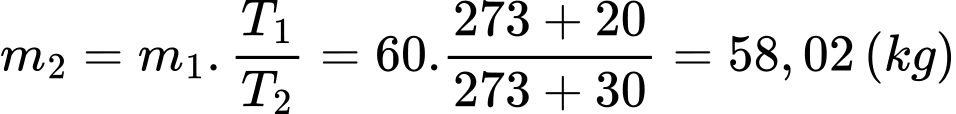
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là
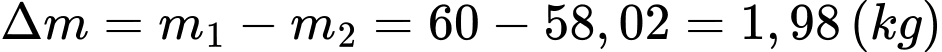
Chọn A Đáp án: A
Câu 17 [817516]: Ở độ cao 11,5 km, nhiệt độ không khí là -56 °C và khối lượng riêng không khí là 0,36 kg/m³. Cho khối lượng mol của không khí là 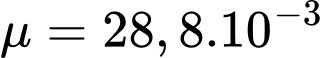 kg/mol. Xem không khí ở độ cao này như khí lí tưởng có hằng số
kg/mol. Xem không khí ở độ cao này như khí lí tưởng có hằng số 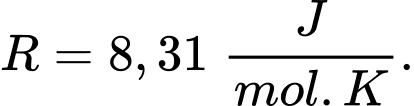 Áp suất của khí quyển ở độ cao này là
Áp suất của khí quyển ở độ cao này là
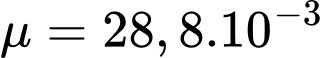 kg/mol. Xem không khí ở độ cao này như khí lí tưởng có hằng số
kg/mol. Xem không khí ở độ cao này như khí lí tưởng có hằng số 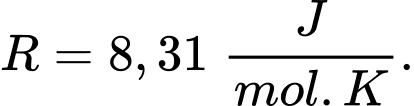 Áp suất của khí quyển ở độ cao này là
Áp suất của khí quyển ở độ cao này là A, 21,36 kPa.
B, 22,80 kPa.
C, 21,64 kPa.
D, 22,54 kPa.
Theo phương trình Clapeyron: 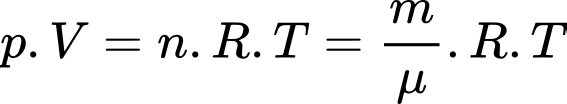
 Áp suất của khí quyển ở độ cao này là
Áp suất của khí quyển ở độ cao này là 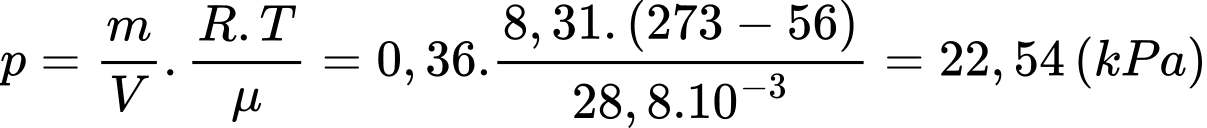
Chọn D Đáp án: D
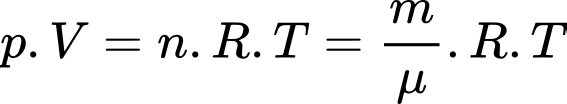
 Áp suất của khí quyển ở độ cao này là
Áp suất của khí quyển ở độ cao này là 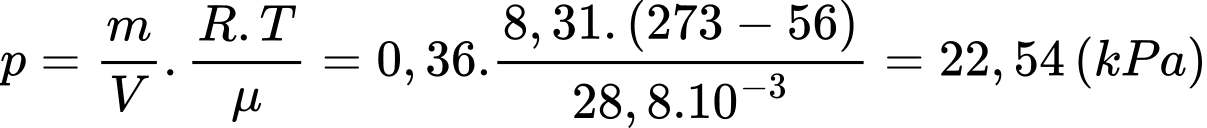
Chọn D Đáp án: D
Câu 18 [817518]: Một bình chứa 4,5 lít khí hydrogen  ở nhiệt độ 24°C, áp suất
ở nhiệt độ 24°C, áp suất 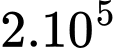 Pa. Người ta tăng nhiệt độ của khí hiđrô lên tới 28°C. Vì bình này không kín nên có một phần khí hydrogen thoát ra ngoài, coi áp suất khí trong bình không thay đổi. Biết khối lượng mol của phân tử hydrogen là
Pa. Người ta tăng nhiệt độ của khí hiđrô lên tới 28°C. Vì bình này không kín nên có một phần khí hydrogen thoát ra ngoài, coi áp suất khí trong bình không thay đổi. Biết khối lượng mol của phân tử hydrogen là 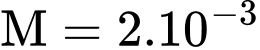 kg/mol. Khối lượng khí hydrogen thoát ra ngoài xấp xỉ
kg/mol. Khối lượng khí hydrogen thoát ra ngoài xấp xỉ
 ở nhiệt độ 24°C, áp suất
ở nhiệt độ 24°C, áp suất 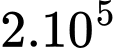 Pa. Người ta tăng nhiệt độ của khí hiđrô lên tới 28°C. Vì bình này không kín nên có một phần khí hydrogen thoát ra ngoài, coi áp suất khí trong bình không thay đổi. Biết khối lượng mol của phân tử hydrogen là
Pa. Người ta tăng nhiệt độ của khí hiđrô lên tới 28°C. Vì bình này không kín nên có một phần khí hydrogen thoát ra ngoài, coi áp suất khí trong bình không thay đổi. Biết khối lượng mol của phân tử hydrogen là 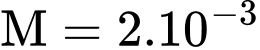 kg/mol. Khối lượng khí hydrogen thoát ra ngoài xấp xỉ
kg/mol. Khối lượng khí hydrogen thoát ra ngoài xấp xỉ A, 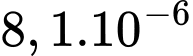 kg.
kg.
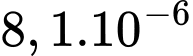 kg.
kg.B, 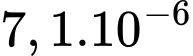 kg.
kg.
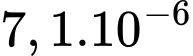 kg.
kg.C, 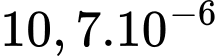 kg.
kg.
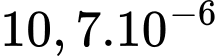 kg.
kg.D, 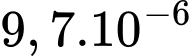 kg.
kg.
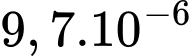 kg.
kg.
Theo phương trình Clapeyron: 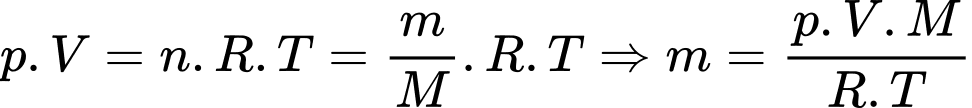
Khối lượng khí tương ứng với nhiệt độ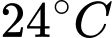 và
và 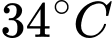 lần lượt là
lần lượt là 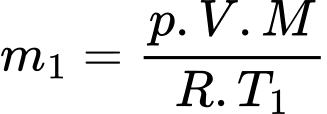 và
và 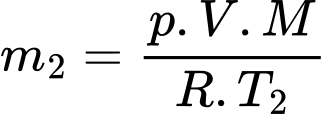
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là
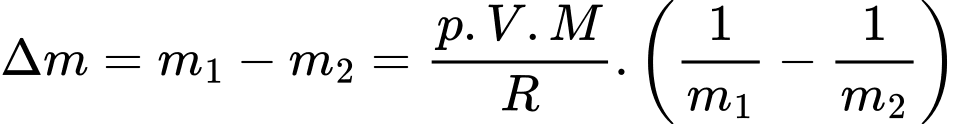
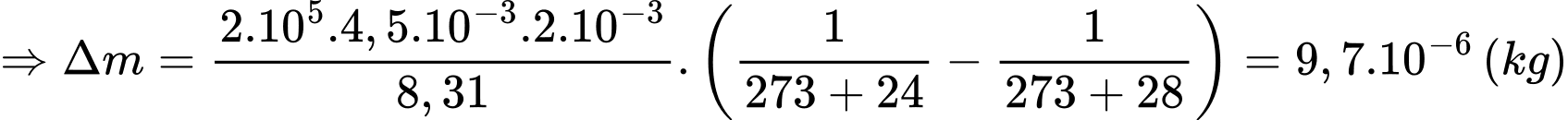
Chọn D Đáp án: D
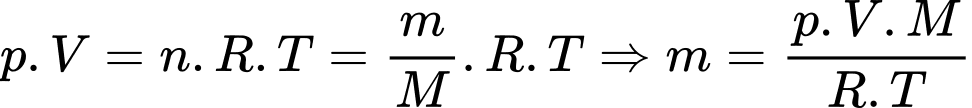
Khối lượng khí tương ứng với nhiệt độ
 và
và 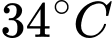 lần lượt là
lần lượt là 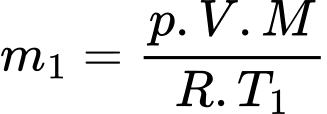 và
và 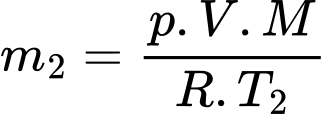
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là
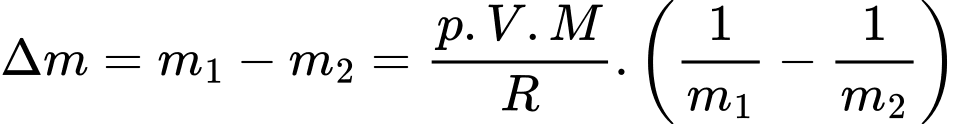
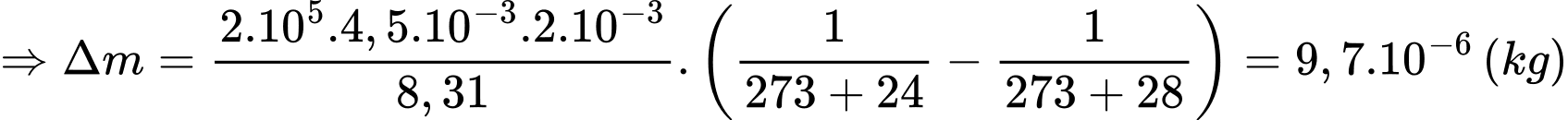
Chọn D Đáp án: D
Câu 19 [817521]: Người ta chứa 1,2 mol khí Oxygen trong một bình kín có thể tích 50 lít ở nhiệt độ 27 °C.
a) Đúng: Nhiệt độ khí trong bình theo thang Kelvin là 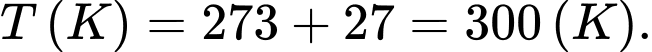
b) Đúng: Theo phương trình Clapeyron: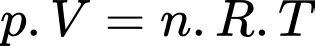
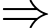 Áp suất khí trong bình bằng
Áp suất khí trong bình bằng 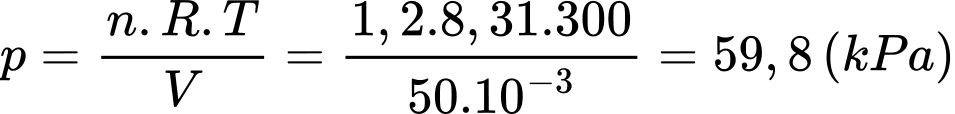
c) Đúng: Số phân tử khí trong bình xấp xỉ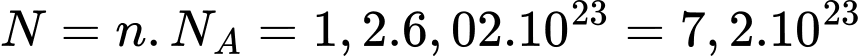 phân tử.
phân tử.
d) Sai: Phương trình trạng thái khí lí tưởng: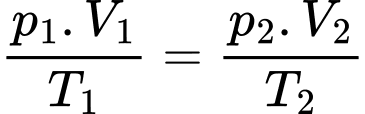
 Nếu đưa toàn bộ lượng khí này qua một bình khác có thể tích 30 lít vẫn ở 27 °C thì áp suất khí trong bình có giá trị
Nếu đưa toàn bộ lượng khí này qua một bình khác có thể tích 30 lít vẫn ở 27 °C thì áp suất khí trong bình có giá trị 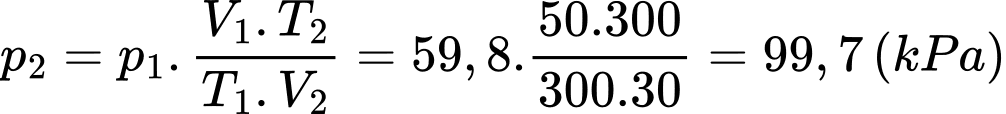
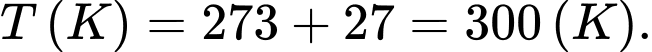
b) Đúng: Theo phương trình Clapeyron:
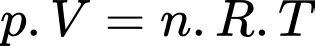
 Áp suất khí trong bình bằng
Áp suất khí trong bình bằng 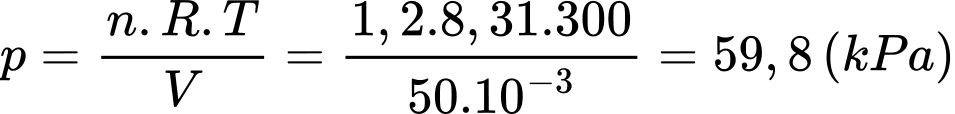
c) Đúng: Số phân tử khí trong bình xấp xỉ
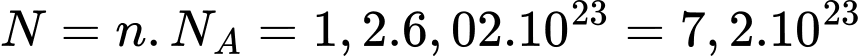 phân tử.
phân tử.d) Sai: Phương trình trạng thái khí lí tưởng:
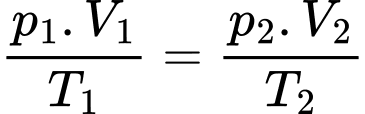
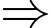 Nếu đưa toàn bộ lượng khí này qua một bình khác có thể tích 30 lít vẫn ở 27 °C thì áp suất khí trong bình có giá trị
Nếu đưa toàn bộ lượng khí này qua một bình khác có thể tích 30 lít vẫn ở 27 °C thì áp suất khí trong bình có giá trị 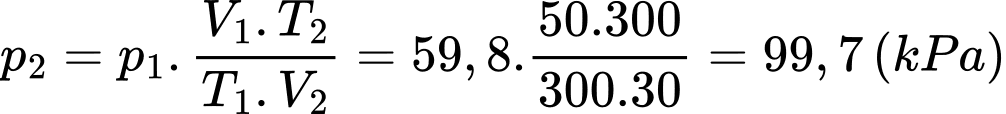
Câu 20 [817522]: Đỉnh Phan-xi-păng nằm trên dãy núi Hoàng Liên Sơn cao 3147 m so với mặt nước biển. Giả sử mỗi khi lên cao thêm 10,00 m, áp suất khí quyển giảm 1,000 mmHg và nhiệt độ trên đỉnh núi là 10,00 °C. Áp suất khí quyển ở mặt nước biển là 760,0 mmHg. Khối lượng riêng của không khí ở điều kiện tiêu chuẩn có nhiệt độ 0 °C và áp suất 760,0 mmHg là 1,290 kg/m3. Biết 760,0 mmHg = 100,0 kPa. Cho R = 8,31 J/(mol. K).
a) Đúng: Theo phương trình Clapeyron: 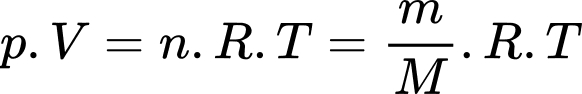
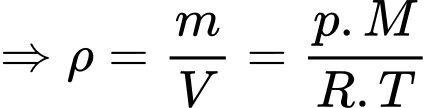
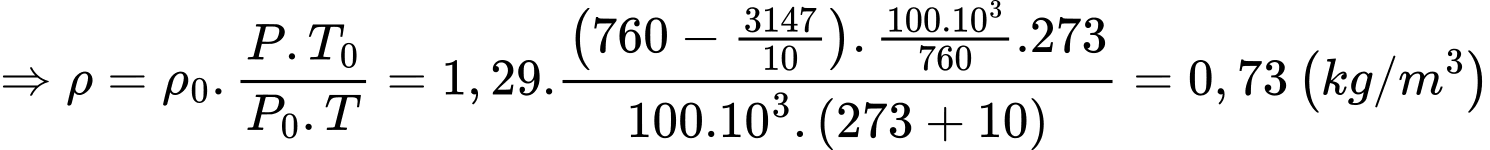
Theo phương trình Clapeyron: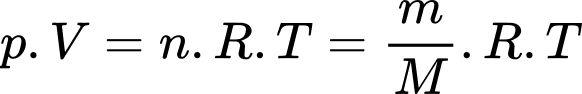
 Khối lượng mol của không khí trên đỉnh Phan-xi-păng là
Khối lượng mol của không khí trên đỉnh Phan-xi-păng là 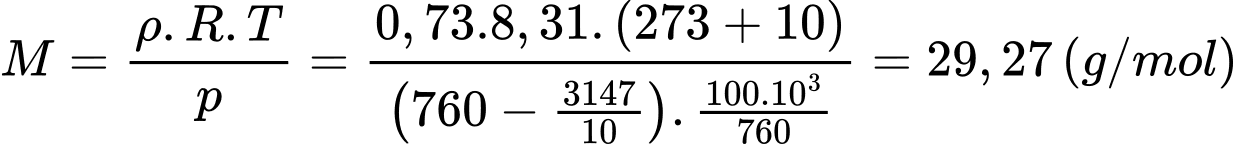
b) Đúng: Áp suất khí quyển trên đỉnh núi Phan-xi-păng là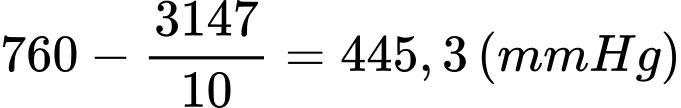
c) Đúng: Theo phương trình Clapeyron: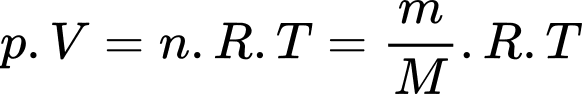
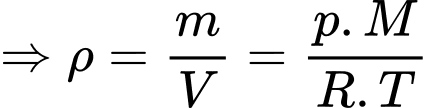
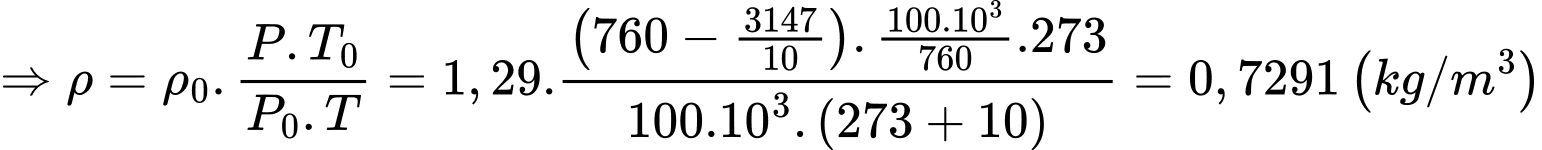
d) Sai: Ta có: Theo phương trình Clapeyron: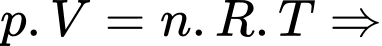
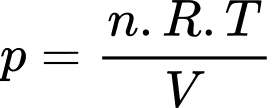
Nếu giữ nguyên nhiệt độ của một lượng khí xác định đựng trong một bình kín thì khi di chuyển lượng khí đó từ đỉnh núi xuống mặt đất, áp suất của lượng khí nói trên đựng trong bình là không đổi
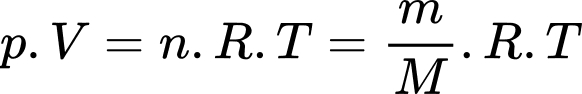
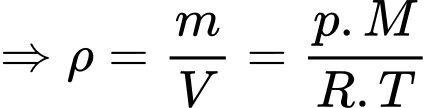
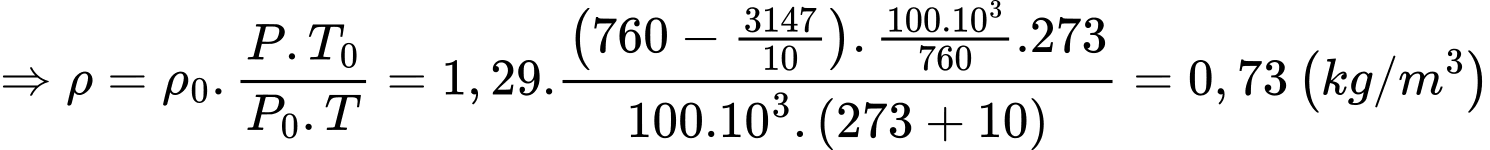
Theo phương trình Clapeyron:
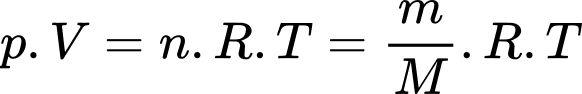
 Khối lượng mol của không khí trên đỉnh Phan-xi-păng là
Khối lượng mol của không khí trên đỉnh Phan-xi-păng là 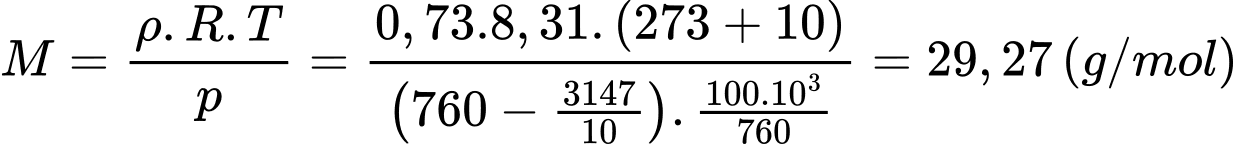
b) Đúng: Áp suất khí quyển trên đỉnh núi Phan-xi-păng là
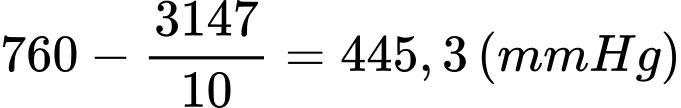
c) Đúng: Theo phương trình Clapeyron:
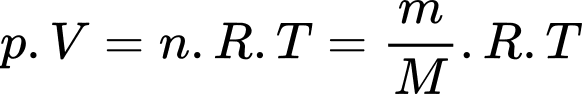
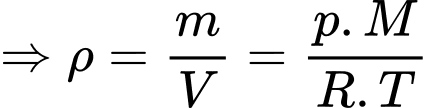
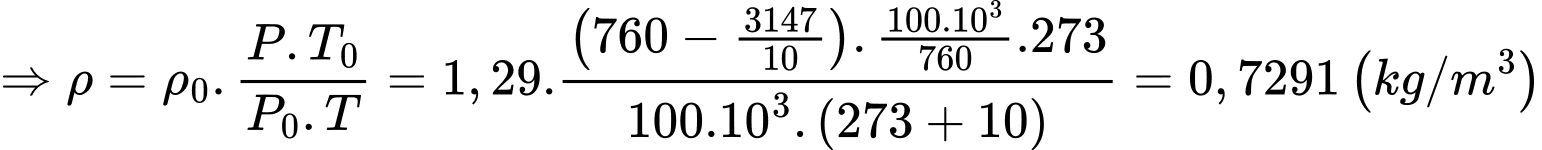
d) Sai: Ta có: Theo phương trình Clapeyron:
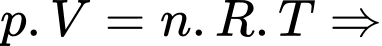
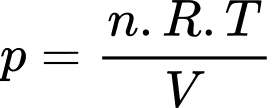
Nếu giữ nguyên nhiệt độ của một lượng khí xác định đựng trong một bình kín thì khi di chuyển lượng khí đó từ đỉnh núi xuống mặt đất, áp suất của lượng khí nói trên đựng trong bình là không đổi
Câu 21 [817530]: Trong ô tô, người ta thường đặt ở hệ thống tay lái một thiết bị nhằm bảo vệ người lái xe khi xe gặp tai nạn, gọi là "túi khí". Túi khí được chế tạo bằng vật liệu co giãn, chịu được áp suất lớn. Trong túi khí thường chứa chất NaN3, khi xe va chạm mạnh vào vật cản thì hệ thống cảm biến của xe sẽ kích thích chất rắn này làm nó phân huỷ tạo thành Na và khí N2. Khí N2 được tạo thành có tác dụng làm phồng túi lên, giúp người lái xe không bị va chạm trực tiếp vào hệ thống lái. Biết trong túi chứa 100 g NaN3.


a) Đúng: Cứ 2 phân tử NaN3 (Natri azua) phân hủy thì có 3 phân tử khí N2 (nitrogen) được tạo ra. Phương trình phản ứng là 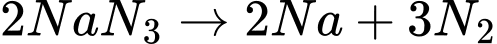
b) Sai: Số mol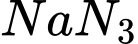 tham gia phân hủy là
tham gia phân hủy là 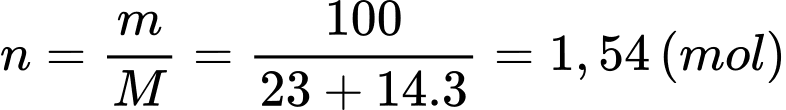
c) Đúng: Lượng chất khí N2 được giải phóng khi xảy ra phản ứng phân huỷ NaN3 bằng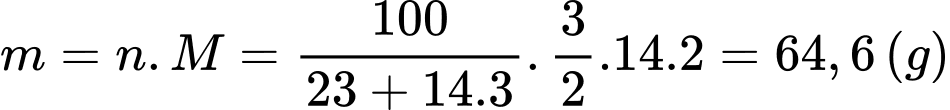
d) Sai: Theo phương trình Clapeyron: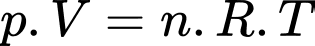
 Áp suất của khí N2 trong túi khí khi đã phồng lên, biết nhiệt độ là 30 °C bằng
Áp suất của khí N2 trong túi khí khi đã phồng lên, biết nhiệt độ là 30 °C bằng 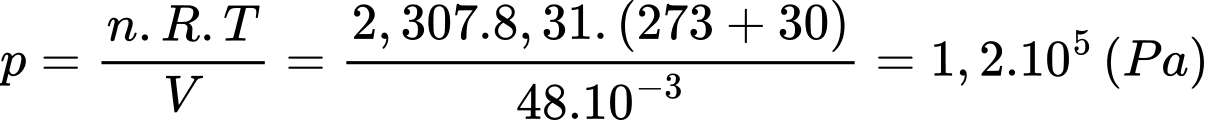
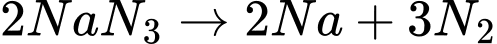
b) Sai: Số mol
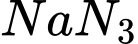 tham gia phân hủy là
tham gia phân hủy là 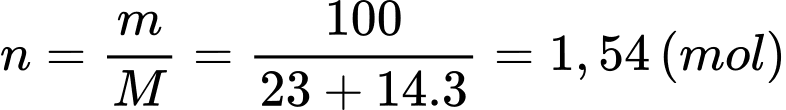
c) Đúng: Lượng chất khí N2 được giải phóng khi xảy ra phản ứng phân huỷ NaN3 bằng
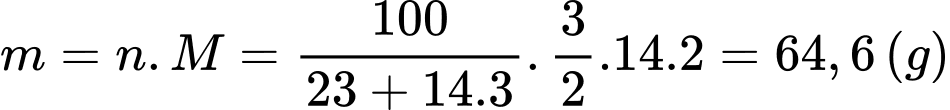
d) Sai: Theo phương trình Clapeyron:
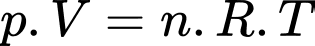
 Áp suất của khí N2 trong túi khí khi đã phồng lên, biết nhiệt độ là 30 °C bằng
Áp suất của khí N2 trong túi khí khi đã phồng lên, biết nhiệt độ là 30 °C bằng 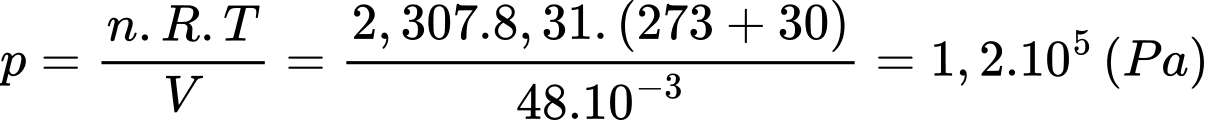
Câu 22 [817532]: Một căn phòng có thể tích 120 m3, lúc đầu không khí trong phòng có nhiệt độ 27 °C và áp suất 105 Pa. Sau đó, nhiệt độ trong phòng tăng thêm 10 °C và áp suất không khí trong phòng tăng 3%. Coi không khí là khí lý tưởng, khối lượng mol của không khí là 29 g/mol. Cho hằng số khí R = 8,31 (J/mol. K).
a) Đúng: Theo phương trình Clapeyron: 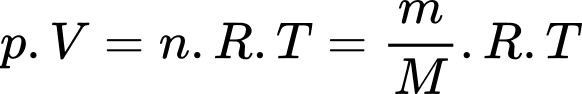
 Khối lượng không khí ban đầu trong phòng là
Khối lượng không khí ban đầu trong phòng là 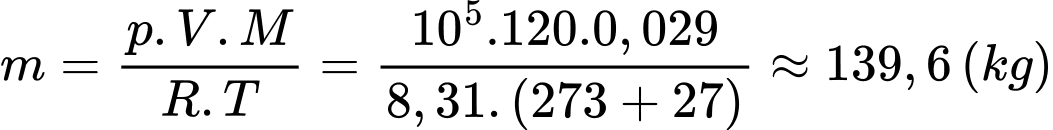
b) Đúng: Khối lượng riêng của không khí ban đầu trong phòng là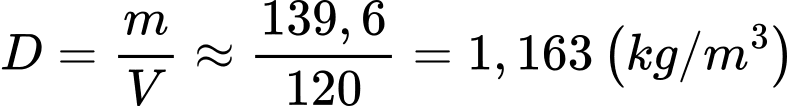
c) Sai: Theo phương trình Clapeyron: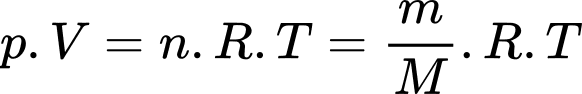
 Khối lượng không khí trong phòng lúc sau là
Khối lượng không khí trong phòng lúc sau là 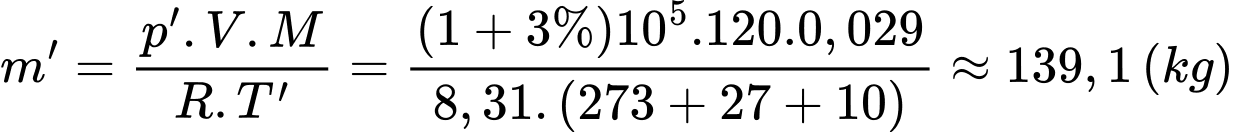
d) Đúng: Khối lượng khí thoát ra khỏi phòng là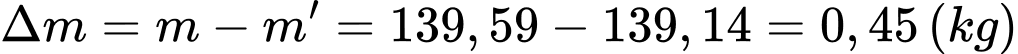
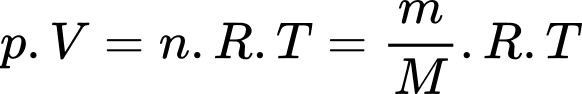
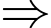 Khối lượng không khí ban đầu trong phòng là
Khối lượng không khí ban đầu trong phòng là 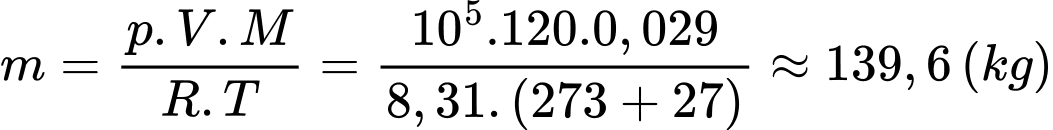
b) Đúng: Khối lượng riêng của không khí ban đầu trong phòng là
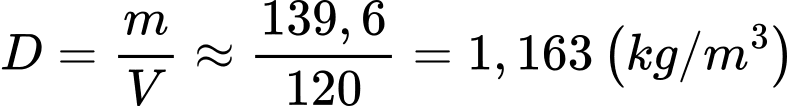
c) Sai: Theo phương trình Clapeyron:
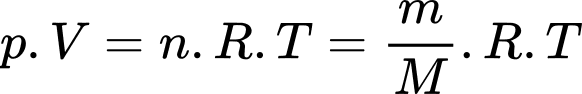
 Khối lượng không khí trong phòng lúc sau là
Khối lượng không khí trong phòng lúc sau là 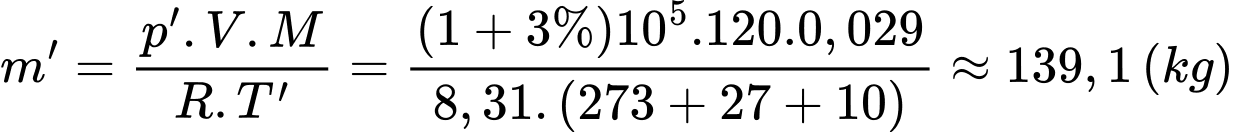
d) Đúng: Khối lượng khí thoát ra khỏi phòng là
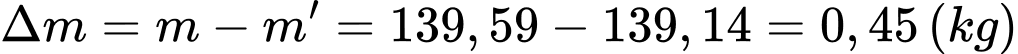
Câu 23 [817536]: Một nhà máy điều chế khí oxygen và sau đó san sang các bình có dung tích 5000 lít. Khí oxygen được bơm vào các bình ở điều kiện tiêu chuẩn (0°C, 1 atm). Sau 30 phút bơm thu được một bình chứa khí ở nhiệt độ 24°C và áp suất 1,1 atm. Coi quá trình bơm diễn ra đều đặn và liên tục.


a) Sai: Theo phương trình Clapeyron: 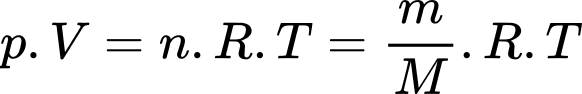
 Khối lượng khí oxygen đã bơm vào bình là
Khối lượng khí oxygen đã bơm vào bình là
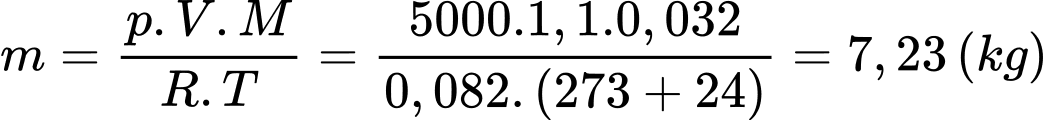
b) Sai: Trong quá trình bơm thể tích khí trong bình là thể tích bình và luôn không đổi, khối lượng và áp suất khí trong bình tăng lên.
c) Đúng: Khối lượng riêng của khí trong bình sau 30 phút bơm là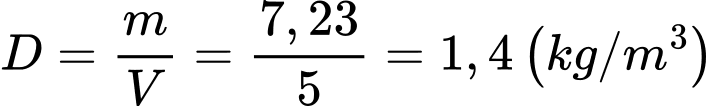
d) Đúng: Khối lượng khí bơm vào bình sau mỗi giây là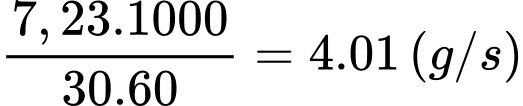
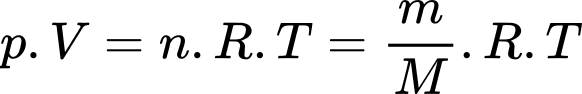
 Khối lượng khí oxygen đã bơm vào bình là
Khối lượng khí oxygen đã bơm vào bình là 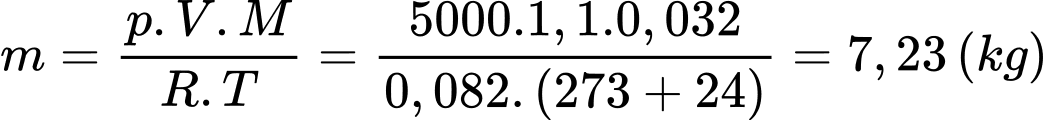
b) Sai: Trong quá trình bơm thể tích khí trong bình là thể tích bình và luôn không đổi, khối lượng và áp suất khí trong bình tăng lên.
c) Đúng: Khối lượng riêng của khí trong bình sau 30 phút bơm là
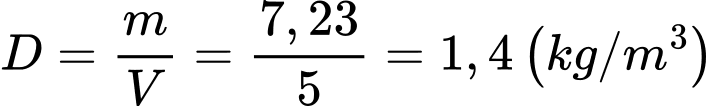
d) Đúng: Khối lượng khí bơm vào bình sau mỗi giây là
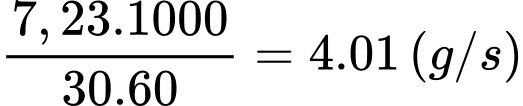
Câu 24 [817537]: Bóng thám không chứa khí hydrogen sẽ bị nổ khi thể tích tăng đến 39,5 m3 ở áp suất 27640 Pa. Một bóng thám không được thả vào không gian, có thể tích 15,8 m3, ở nhiệt độ 27 °C và áp suất 105000 Pa.
a) Đúng: Phương trình trạng thái khí lí tưởng: 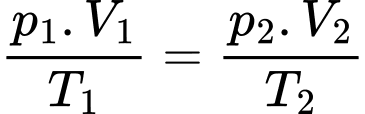
 Thể tích của bóng ở điều kiện tiêu chuẩn xấp xỉ bằng
Thể tích của bóng ở điều kiện tiêu chuẩn xấp xỉ bằng 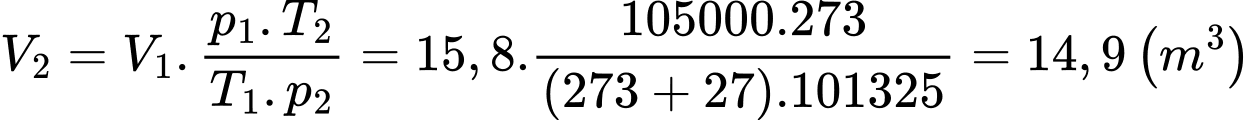
b) Sai: Theo phương trình Clapeyron: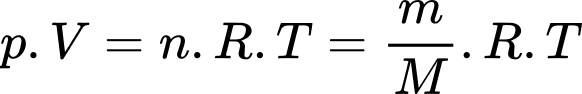
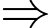 Khối lượng của khí hydrogen trong bóng xấp xỉ bằng
Khối lượng của khí hydrogen trong bóng xấp xỉ bằng 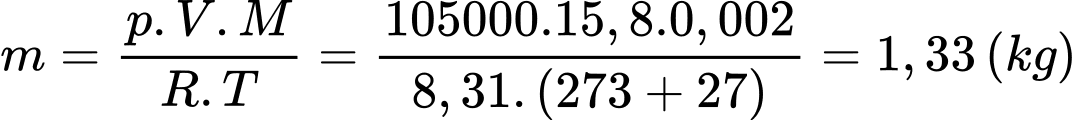
c) Sai: Phương trình trạng thái khí lí tưởng: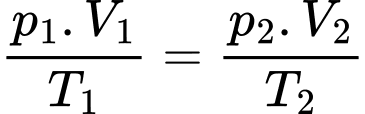
 Khi bóng lên cao, ở nhiệt độ 7 °C và áp suất 67000 Pa thì thể tích của bóng xấp xỉ bằng
Khi bóng lên cao, ở nhiệt độ 7 °C và áp suất 67000 Pa thì thể tích của bóng xấp xỉ bằng 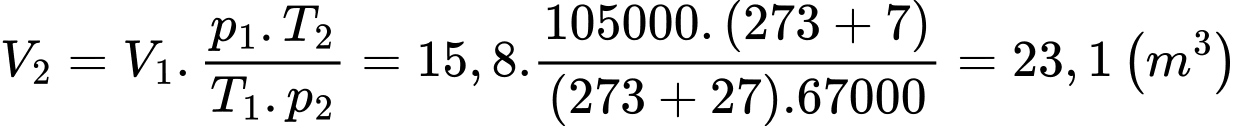
d) Đúng: Phương trình trạng thái khí lí tưởng: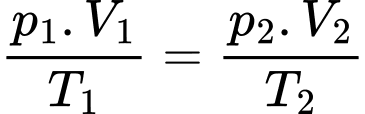
 Nhiệt độ khi bóng bị nổ xấp xỉ bằng
Nhiệt độ khi bóng bị nổ xấp xỉ bằng 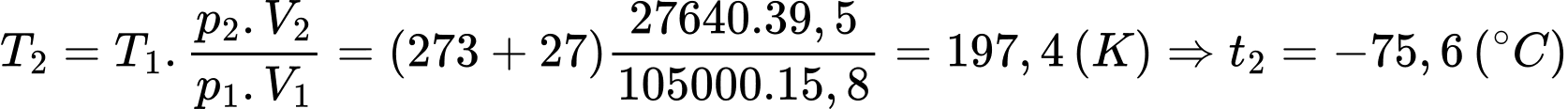
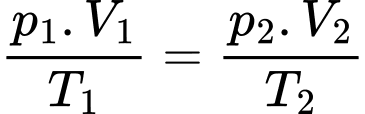
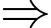 Thể tích của bóng ở điều kiện tiêu chuẩn xấp xỉ bằng
Thể tích của bóng ở điều kiện tiêu chuẩn xấp xỉ bằng 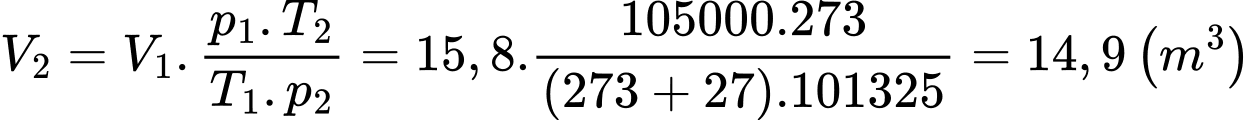
b) Sai: Theo phương trình Clapeyron:
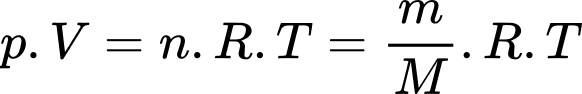
 Khối lượng của khí hydrogen trong bóng xấp xỉ bằng
Khối lượng của khí hydrogen trong bóng xấp xỉ bằng 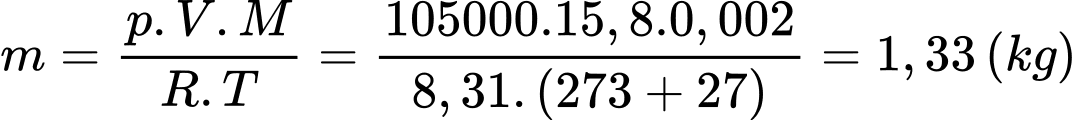
c) Sai: Phương trình trạng thái khí lí tưởng:
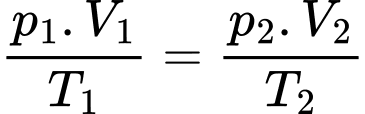
 Khi bóng lên cao, ở nhiệt độ 7 °C và áp suất 67000 Pa thì thể tích của bóng xấp xỉ bằng
Khi bóng lên cao, ở nhiệt độ 7 °C và áp suất 67000 Pa thì thể tích của bóng xấp xỉ bằng 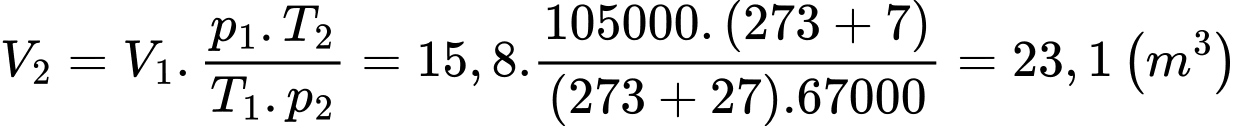
d) Đúng: Phương trình trạng thái khí lí tưởng:
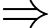 Nhiệt độ khi bóng bị nổ xấp xỉ bằng
Nhiệt độ khi bóng bị nổ xấp xỉ bằng 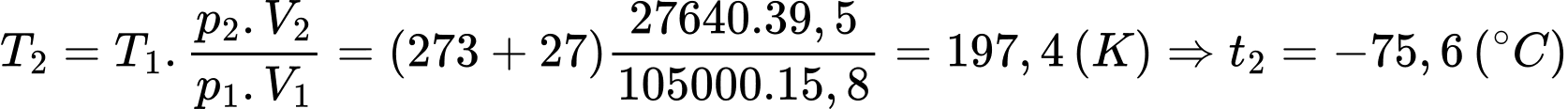
Câu 25 [817539]: Đưa một lượng khí lí tưởng vào trong bình kín có thể tích 40 lít và nhiệt độ 600 K thì áp suất khí trong bình là 3,0 atm. Số mol khí trong bình bằng bao nhiêu? Làm tròn kết quả đến hai chữ số sau dấu phẩy.
Theo phương trình Clapeyron: 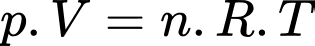
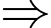 Số mol khí trong bình bằng
Số mol khí trong bình bằng
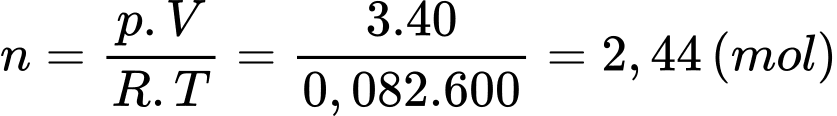
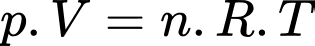
 Số mol khí trong bình bằng
Số mol khí trong bình bằng
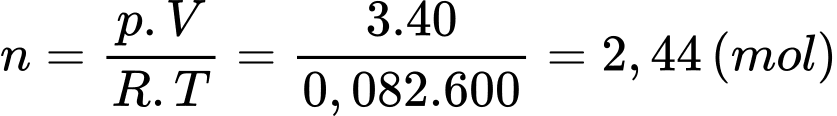
Câu 26 [817540]: Có bao nhiêu kilogam (kg) khí oxygen (xem là khí lí tưởng) chứa trong bình cầu thể tích 200 lít ở nhiệt độ 27 °C và áp suất khí trong bình là 100 kPa. Biết khí oxygen có khối lượng mol 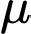 = 32 g/mol, hằng số khí
= 32 g/mol, hằng số khí 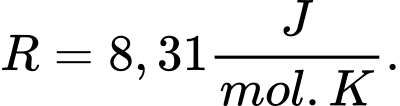 Kết quả lấy đến hai chữ số sau dấu phẩy thập phân.
Kết quả lấy đến hai chữ số sau dấu phẩy thập phân.
 = 32 g/mol, hằng số khí
= 32 g/mol, hằng số khí 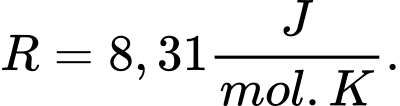 Kết quả lấy đến hai chữ số sau dấu phẩy thập phân.
Kết quả lấy đến hai chữ số sau dấu phẩy thập phân.
Theo phương trình Clapeyron: 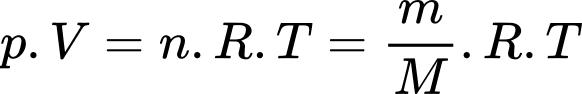
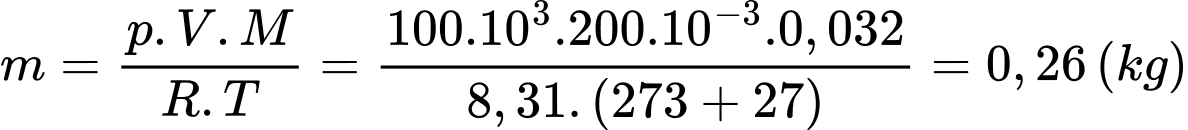
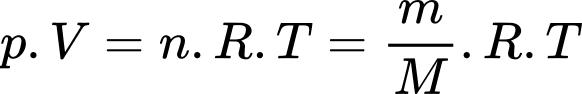
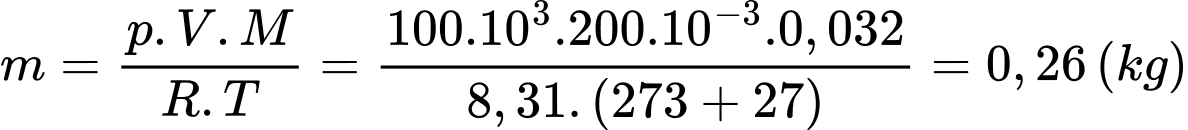
Câu 27 [817541]: Biết khối lượng riêng của không khí ở 0 °C và 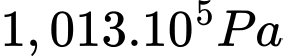 là 1,29 kg/m3. Tính khối lượng riêng của không khí ở nhiệt độ
là 1,29 kg/m3. Tính khối lượng riêng của không khí ở nhiệt độ 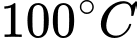 và áp suất
và áp suất 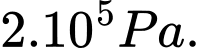 (đơn vị kg/m3, làm tròn 2 chữ số sau dấu phẩy thập phân).
(đơn vị kg/m3, làm tròn 2 chữ số sau dấu phẩy thập phân).
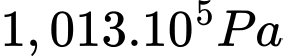 là 1,29 kg/m3. Tính khối lượng riêng của không khí ở nhiệt độ
là 1,29 kg/m3. Tính khối lượng riêng của không khí ở nhiệt độ 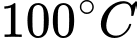 và áp suất
và áp suất 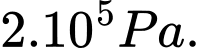 (đơn vị kg/m3, làm tròn 2 chữ số sau dấu phẩy thập phân).
(đơn vị kg/m3, làm tròn 2 chữ số sau dấu phẩy thập phân).
Theo phương trình Clapeyron: 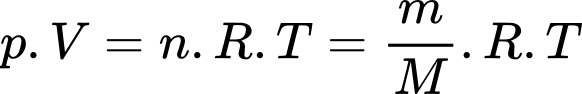
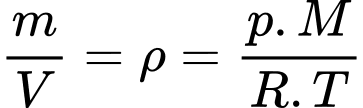
 Khối lượng riêng của không khí ở nhiệt độ
Khối lượng riêng của không khí ở nhiệt độ 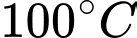 và áp suất
và áp suất 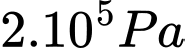 là
là 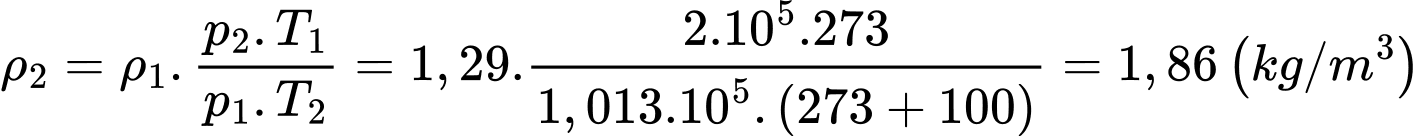
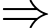
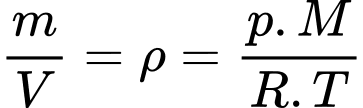
 Khối lượng riêng của không khí ở nhiệt độ
Khối lượng riêng của không khí ở nhiệt độ 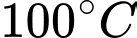 và áp suất
và áp suất 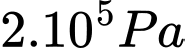 là
là 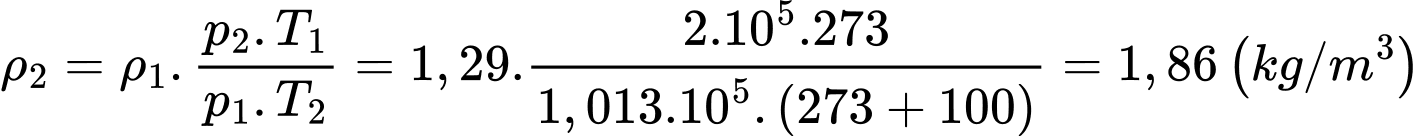
Câu 28 [817546]: Trong một bình kín dung tích 20 lít có chứa 4,4 kg khí cacbonic ở nhiệt độ 27 °C. Biết thể tích của một mol khí ở điều kiện chuẩn là Vo = 22,4 lít. Áp suất của khí trong bình bằng bao nhiêu atm? Cho khối lượng nguyên tử của khí cacbonic là 44 g/mol. (Kết quả được làm tròn đến phần nguyên)
Theo phương trình Clapeyron: 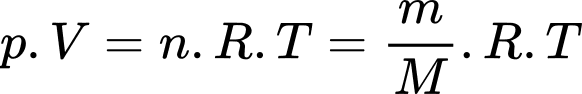
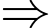 Áp suất của khí trong bình bằng
Áp suất của khí trong bình bằng
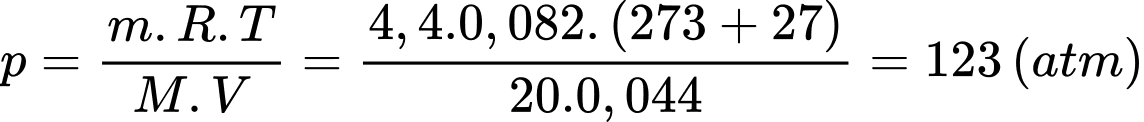
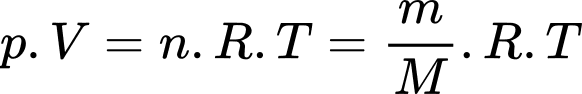
 Áp suất của khí trong bình bằng
Áp suất của khí trong bình bằng
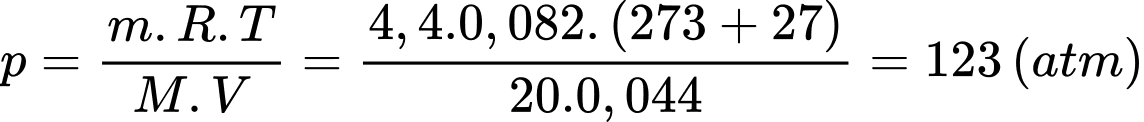
Câu 29 [817549]: Sử dụng một cái bơm để bơm không khí vào một quả bóng rổ, mỗi lần bơm được 0,3 g vào bóng. Sau 40 lần bơm, quả bóng có bán kính 10 cm, ở nhiệt độ 25 °C. Khối lượng mol của không khí bằng 29 g/mol. Áp suất của khí trong bóng sau bơm bằng bao nhiêu atm (kết quả làm tròn lấy 2 số sau dấu phẩy thập phân)?
Theo phương trình Clapeyron: 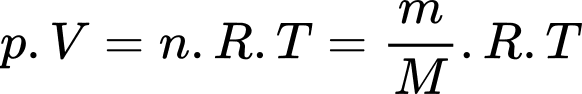
 Áp suất của khí trong bóng sau bơm bằng
Áp suất của khí trong bóng sau bơm bằng
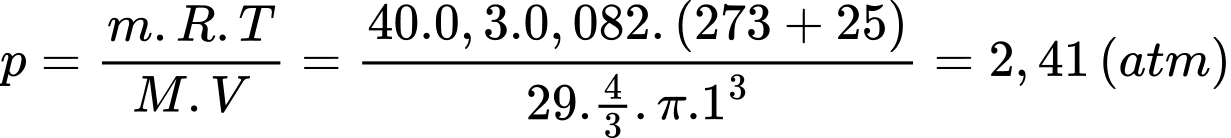
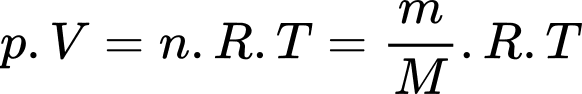
 Áp suất của khí trong bóng sau bơm bằng
Áp suất của khí trong bóng sau bơm bằng 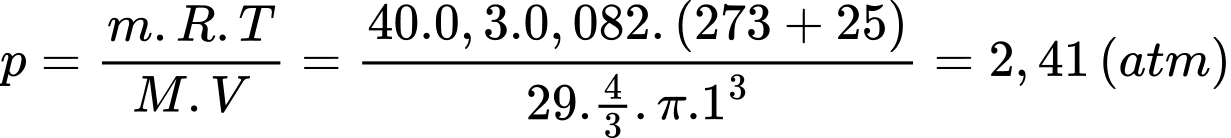
Câu 30 [817550]: Một bình có thể tích 0,12 m3 chứa khí hydrogen ở nhiệt độ 32 °C, có áp suất 2.105 Pa. Biết số Avogadro 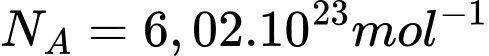 , hằng số khí lí tưởng
, hằng số khí lí tưởng 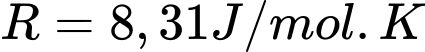 và xem khí hydrogen là khí lí tưởng. Số phân tử khí hydrogen chứa trong bình là
và xem khí hydrogen là khí lí tưởng. Số phân tử khí hydrogen chứa trong bình là 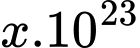 phân tử. Tính giá trị của x (làm tròn kết quả đến chữ số hàng đơn vị).
phân tử. Tính giá trị của x (làm tròn kết quả đến chữ số hàng đơn vị).
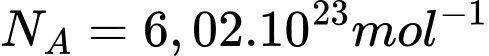 , hằng số khí lí tưởng
, hằng số khí lí tưởng 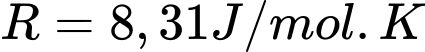 và xem khí hydrogen là khí lí tưởng. Số phân tử khí hydrogen chứa trong bình là
và xem khí hydrogen là khí lí tưởng. Số phân tử khí hydrogen chứa trong bình là 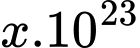 phân tử. Tính giá trị của x (làm tròn kết quả đến chữ số hàng đơn vị).
phân tử. Tính giá trị của x (làm tròn kết quả đến chữ số hàng đơn vị).
Theo phương trình Clapeyron: 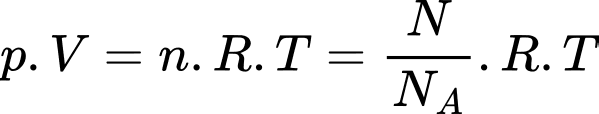
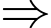 Số phân tử khí hydrogen chứa trong bình là
Số phân tử khí hydrogen chứa trong bình là 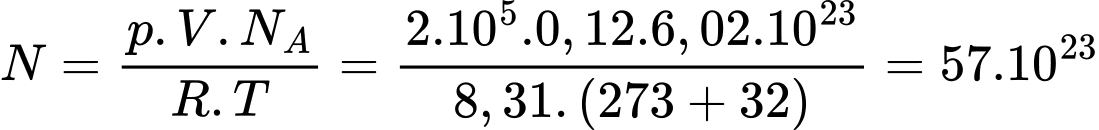 phân tử
phân tử
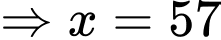
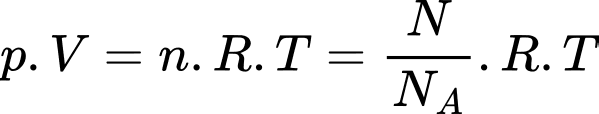
 Số phân tử khí hydrogen chứa trong bình là
Số phân tử khí hydrogen chứa trong bình là 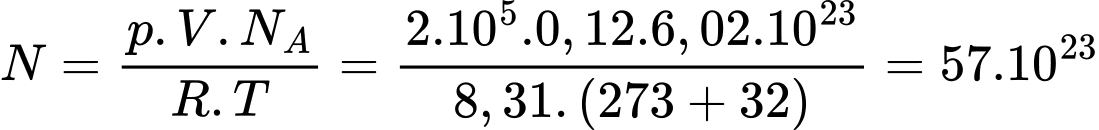 phân tử
phân tử
Câu 31 [817553]: Thông thường, phổi của một người trưởng thành có thể tích khoảng 5,7(ℓ). Biết không khí trong phổi có áp suất bằng áp suất khí quyển 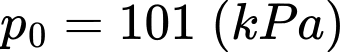 và nhiệt độ là 37 °C. Giả sử oxygen chiếm 21% số phân tử không khí có trong phổi. Cho biết:
và nhiệt độ là 37 °C. Giả sử oxygen chiếm 21% số phân tử không khí có trong phổi. Cho biết: 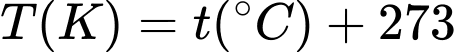 ;
; 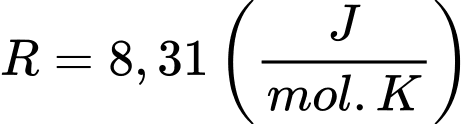 ;
; 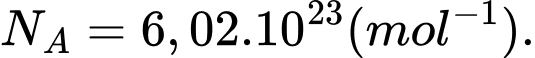 Số phân tử oxygen có trong phổi là
Số phân tử oxygen có trong phổi là 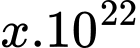 . Tìm x (làm tròn kết quả đến chữ số hàng phần mười).
. Tìm x (làm tròn kết quả đến chữ số hàng phần mười).
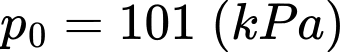 và nhiệt độ là 37 °C. Giả sử oxygen chiếm 21% số phân tử không khí có trong phổi. Cho biết:
và nhiệt độ là 37 °C. Giả sử oxygen chiếm 21% số phân tử không khí có trong phổi. Cho biết: 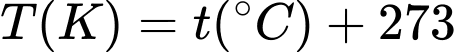 ;
; 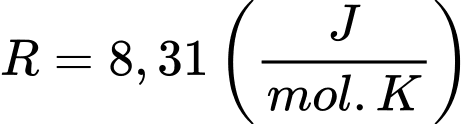 ;
; 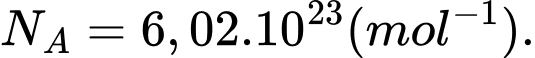 Số phân tử oxygen có trong phổi là
Số phân tử oxygen có trong phổi là 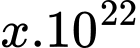 . Tìm x (làm tròn kết quả đến chữ số hàng phần mười).
. Tìm x (làm tròn kết quả đến chữ số hàng phần mười).
Theo phương trình Clapeyron: 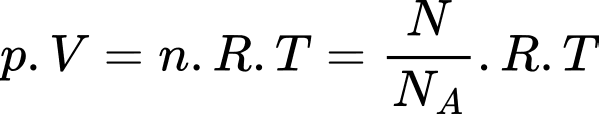
 Số phân tử oxygen có trong phổi là
Số phân tử oxygen có trong phổi là 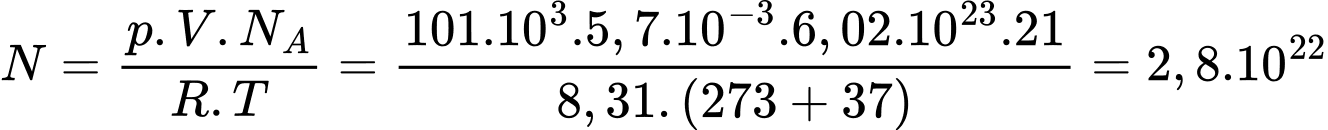 phân tử.
phân tử.
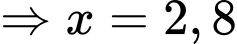
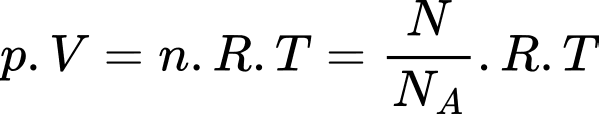
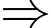 Số phân tử oxygen có trong phổi là
Số phân tử oxygen có trong phổi là 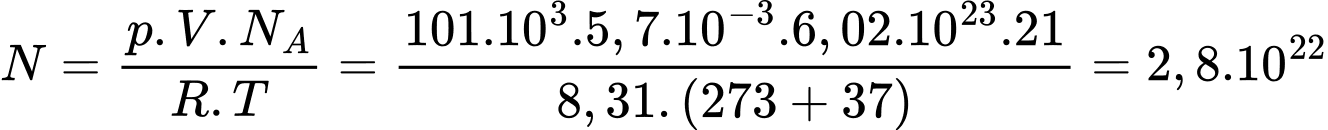 phân tử.
phân tử.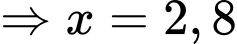
Câu 32 [817554]: Những quả bóng bay được bơm khí Helium đến áp suất 121 200 N/m2, thể tích 5 lít và nhiệt độ 27 °C. Biết hằng số của chất khí là 8,31 J/mol.K. Mỗi quả bóng bay được bơm bao nhiêu mol khí Helium? (Làm tròn kết quả đến chữ số hàng phần trăm).
Theo phương trình Clapeyron: 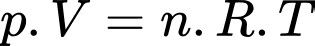
 Mỗi quả bóng bay được bơm
Mỗi quả bóng bay được bơm 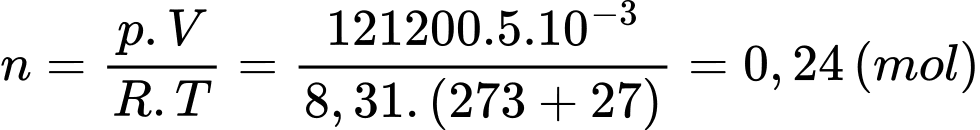 khí Helium
khí Helium
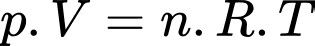
 Mỗi quả bóng bay được bơm
Mỗi quả bóng bay được bơm 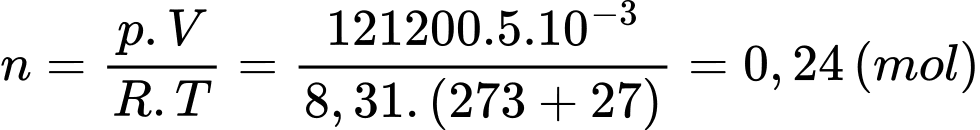 khí Helium
khí Helium
Câu 33 [817555]: Cho biết khối lượng riêng của không khí ở điều kiện tiêu chuẩn (áp suất 1atm và nhiệt độ 0 °C) là 1,29 kg/m3. Biết áp suất p, thể tích V và nhiệt độ T của khí thỏa mãn hệ thức 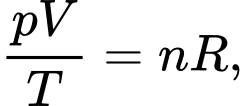 với n là số mol của khí và R là một hằng số, R = 8,31 J/mol.K. Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng bao nhiêu g/mol? (làm tròn kết quả đến chữ số hàng phần mười).
với n là số mol của khí và R là một hằng số, R = 8,31 J/mol.K. Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng bao nhiêu g/mol? (làm tròn kết quả đến chữ số hàng phần mười).
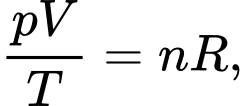 với n là số mol của khí và R là một hằng số, R = 8,31 J/mol.K. Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng bao nhiêu g/mol? (làm tròn kết quả đến chữ số hàng phần mười).
với n là số mol của khí và R là một hằng số, R = 8,31 J/mol.K. Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng bao nhiêu g/mol? (làm tròn kết quả đến chữ số hàng phần mười).
Theo phương trình Clapeyron: 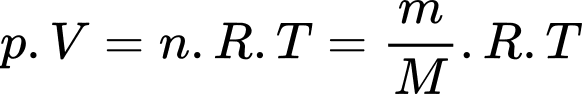
 Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng
Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng
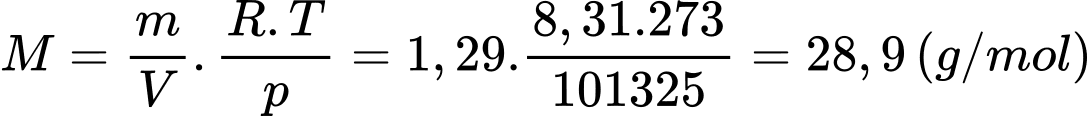
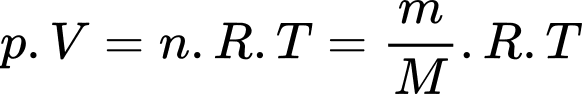
 Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng
Coi không khí như một chất khí thuần nhất, khối lượng mol của không khí bằng
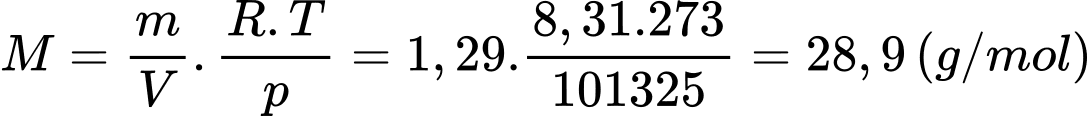
Sử dụng các thông tin sau cho Câu 34 và Câu 35:
Một vận động viên leo núi khi thở đều cần hít vào 2 g không khí trong mỗi nhịp thở. Coi rằng dưới chân núi, không khí ở điều kiện tiêu chuẩn có áp suất là 760 mmHg , nhiệt độ là 0 °C, khối lượng riêng là 1,29 kg/m3.
Câu 34 [817556]: Khi ở điều kiện tiêu chuẩn, thể tích không khí mà người này hít vào trong mỗi nhịp thở là bao nhiêu lít (làm tròn kết quả đến chữ số hàng phần mười)?
Khi ở điều kiện tiêu chuẩn, thể tích không khí mà người này hít vào trong mỗi nhịp thở là 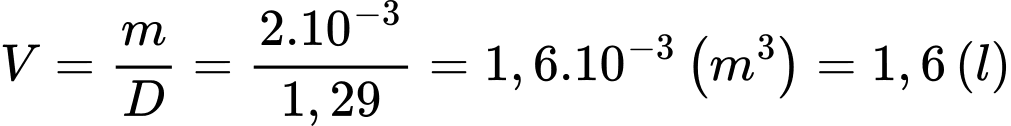
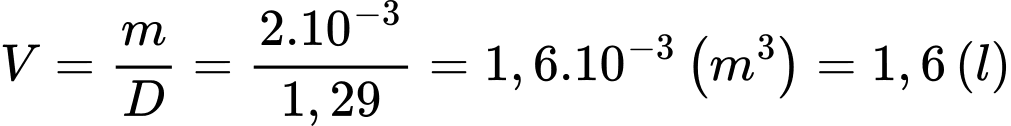
Câu 35 [817558]: Ngày 15/12/2024, người này leo lên đỉnh Fansipan cao 3143 m và đo được nhiệt độ là -8°C, biết rằng mỗi khi lên cao thêm 10 m thì áp suất khí quyển giảm 1 mmHg. Thể tích không khí mà người này phải hít vào trong mỗi nhịp thở tại đỉnh Fansipan là bao nhiêu lít (làm tròn kết quả đến chữ số hàng phần mười)?
Theo phương trình trạng thái khí lí tưởng: 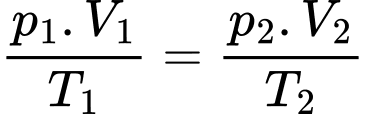
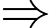 Thể tích không khí mà người này phải hít vào trong mỗi nhịp thở tại đỉnh Fansipan là
Thể tích không khí mà người này phải hít vào trong mỗi nhịp thở tại đỉnh Fansipan là 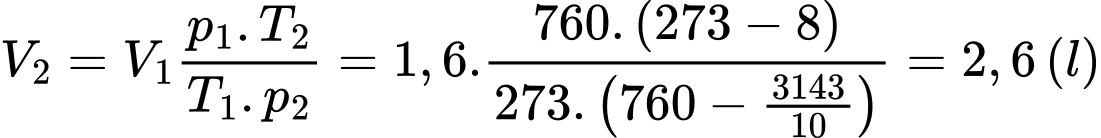
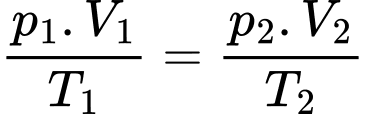
 Thể tích không khí mà người này phải hít vào trong mỗi nhịp thở tại đỉnh Fansipan là
Thể tích không khí mà người này phải hít vào trong mỗi nhịp thở tại đỉnh Fansipan là 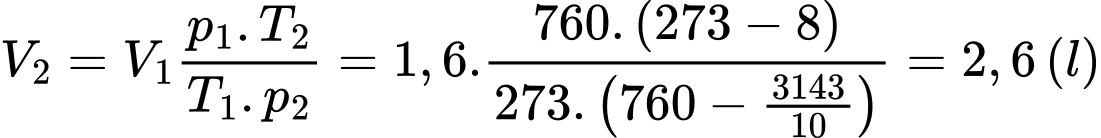
Câu 36 [817559]: Khí cầu có dung tích 328 m3 được bơm khí hydrogen. Khi bơm xong, hydrogen trong khí cầu có nhiệt độ 27 °C áp suất 1,5 atm (1 atm = 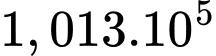 Pa). Cho khối lượng mol của khí hydrogen là 2 g/mol. Tính khối lượng khí hydrogen trong khí cầu theo đơn vị kg (làm tròn kết quả đến hàng đơn vị).
Pa). Cho khối lượng mol của khí hydrogen là 2 g/mol. Tính khối lượng khí hydrogen trong khí cầu theo đơn vị kg (làm tròn kết quả đến hàng đơn vị).
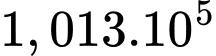 Pa). Cho khối lượng mol của khí hydrogen là 2 g/mol. Tính khối lượng khí hydrogen trong khí cầu theo đơn vị kg (làm tròn kết quả đến hàng đơn vị).
Pa). Cho khối lượng mol của khí hydrogen là 2 g/mol. Tính khối lượng khí hydrogen trong khí cầu theo đơn vị kg (làm tròn kết quả đến hàng đơn vị).
Theo phương trình Clapeyron: 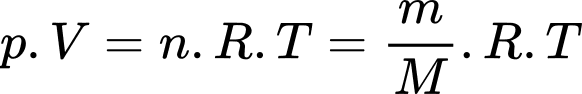
 Khối lượng khí hydrogen trong khí cầu là
Khối lượng khí hydrogen trong khí cầu là
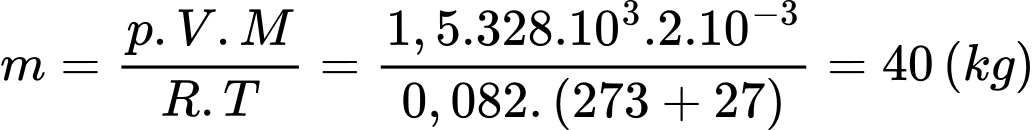
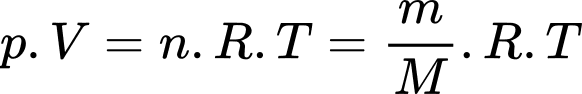
 Khối lượng khí hydrogen trong khí cầu là
Khối lượng khí hydrogen trong khí cầu là
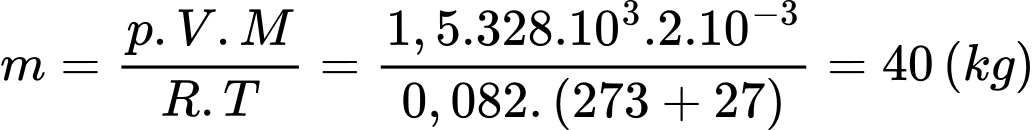
Câu 37 [817560]: Một bình có dung tích V = 10 lít chứa một lượng khí hydrogen bị nén ở áp suất p = 50 atm và nhiệt độ 7 °C. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17 °C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra theo đơn vị gam? (kết quả làm tròn đến chữ số hàng phần mười). Biết hằng số khí lí tưởng là R = 0,082 atm/mol. K; khối lượng mol của hydrogen là M = 2 g/mol.
Theo phương trình Clapeyron: 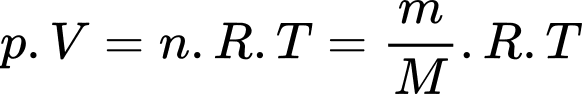
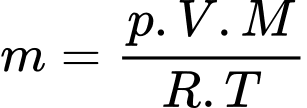
Khối lượng khí tương ứng với nhiệt độ và
và 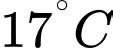 lần lượt là
lần lượt là 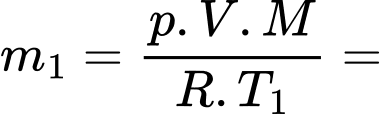 và
và 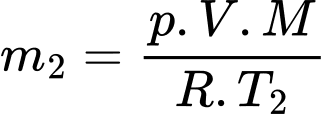
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là
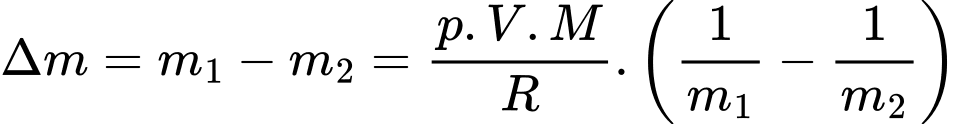
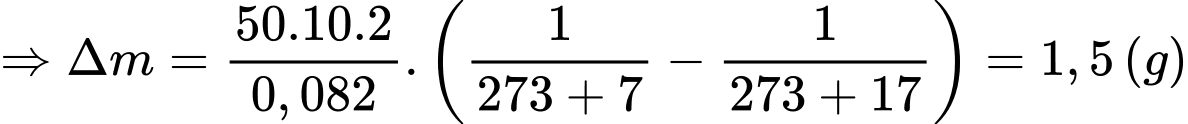
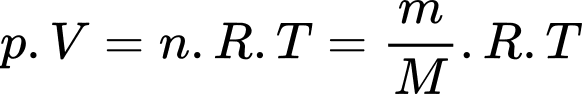
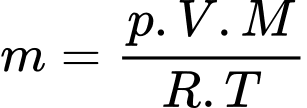
Khối lượng khí tương ứng với nhiệt độ
 và
và 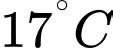 lần lượt là
lần lượt là 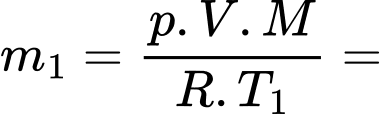 và
và 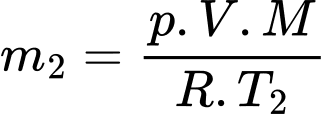
Khối lượng không khí (coi là khí lí tưởng) thoát ra khỏi căn phòng là