PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704002]: “Phức chất là hợp chất có chứa ...(1)... và các ...(2)..., nó có thể mang điện tích hoặc không mang điện tích”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, ion kim loại, phân tử nước.
B, kim loại kiềm, ion âm.
C, nguyên tử trung tâm, phân tử liên kết.
D, nguyên tử trung tâm, phối tử.
Phức chất là hợp chất có chứa nguyên tử trung tâm (có thể là kim loại hoặc cation kim loại) và các phối tử liên kết với nguyên tử trung tâm bằng liên kết phối trí, nó có thể mang điện tích hoặc không mang điện tích.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 2 [560812]: Diêm tiêu potassium được dùng chế tạo thuốc nổ đen (làm mìn phá đá), đồng thời được dùng làm phân bón, cung cấp nguyên tố nitrogen và potassium cho cây trồng. Công thức hóa học của diêm tiêu potassium là
A, KNO3.
B, K2CO3.
C, KCl.
D, K2SO4.
Diêm tiêu potassium cung cấp nguyên tố nitrogen và potassium cho cây trồng nên trong phân tử phải có cả nguyên tố N và K.
Loại các đáp án B, C, D vì không có N.
Công thức hóa học của diêm tiêu potassium là KNO3.
⇒ Chọn đáp án A Đáp án: A
Loại các đáp án B, C, D vì không có N.
Công thức hóa học của diêm tiêu potassium là KNO3.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [309469]: Polyacrylonitrile có thành phân hóa học gồm các nguyên tố là
A, C, H.
B, C, H, Cl.
C, C, H. N.
D, C, H, N, O.
Polyacrylonitrile có công thức [-CH2CH(CN)-]n.
⇒ Thành phần hóa học gồm các nguyên tố: C, H, N.
⇒ Chọn đáp án C Đáp án: C
⇒ Thành phần hóa học gồm các nguyên tố: C, H, N.
⇒ Chọn đáp án C Đáp án: C
Câu 4 [560623]: Trong cầu chì có một đoạn dây kim loại, thường là kim loại lead (chì) có tác dụng ngắt dòng điện khỏi thiết bị khi có sự cố gia tăng nhiệt. Ứng dụng trên dựa vào tính chất vật lí nào của kim loại lead?
A, Do lead có nhiệt độ nóng chảy thấp.
B, Do lead mềm, dẫn điện tốt.
C, Do lead có giá thành rẻ.
D, Do lead dẻo, dễ dát mỏng.
Nhờ có nhiệt độ nóng chảy thấp nên chì được sử dụng làm dây chảy trong cầu chì, khi hiện tượng đoản mạch xảy ra thì nhiệt độ tăng cao làm nóng chảy chì.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 5 [704003]: Tetraphosphorus (P4), còn gọi là phosphorus trắng, là một dạng thù hình phổ biến của phosphorus (Z = 15). Đây là chất rắn sáp, trong suốt, có màu trắng hoặc vàng nhạt khi tiếp xúc với ánh sáng. P4 cực kì độc hại và có thể gây ra các vấn đề sức khỏe nghiêm trọng nếu tiếp xúc hoặc nuốt phải. Cấu trúc nào sau đây phù hợp với tetraphosphorus?
A, 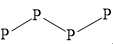
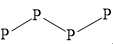
B, 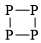
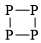
C, 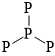

D, 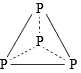

Cấu hình electron của phosphorus (Z = 15): 1s2 2s2 2p6 3s2 3p3 → P có 5 electron lớp ngoài cùng nên thuộc nhóm VA, có xu hướng nhận thêm 3 electron (3 liên kết) để đạt cấu hình bền vững của khí hiếm (nhóm VIIIA).
Xét các cấu trúc đề bài cho:
A. Mỗi nguyên tử P chỉ có 1 hoặc 2 liên kết → Không thoả mãn.
B. Mỗi nguyên tử P chỉ có 2 liên kết → Không thoả mãn.
C. Có các nguyên tử P chỉ có 1 liên kết → Không thoả mãn.
D. Mỗi nguyên tử P đều có 3 liên kết → Thoả mãn.
⇒ Chọn đáp án D
Đáp án: D
Xét các cấu trúc đề bài cho:
A. Mỗi nguyên tử P chỉ có 1 hoặc 2 liên kết → Không thoả mãn.
B. Mỗi nguyên tử P chỉ có 2 liên kết → Không thoả mãn.
C. Có các nguyên tử P chỉ có 1 liên kết → Không thoả mãn.
D. Mỗi nguyên tử P đều có 3 liên kết → Thoả mãn.
⇒ Chọn đáp án D
Đáp án: D
Câu 6 [982224]: Cặp chất nào sau đây gây nên tính cứng tạm thời của nước?
A, Na2SO4, KCl.
B, Mg(HCO3)2, Ca(HCO3)2.
C, NaCl, KCl.
D, Na2SO4, K2SO4.
HD: Bài học phân loại nước cứng:
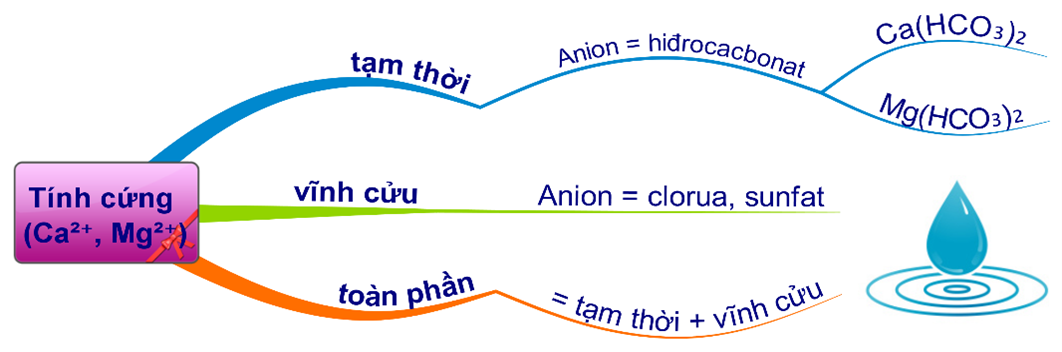
Mg(HCO3)2, Ca(HCO3)2 gây nên tính cứng tạm thời của nước.
⇝ Chọn đáp án B Đáp án: B

Mg(HCO3)2, Ca(HCO3)2 gây nên tính cứng tạm thời của nước.
⇝ Chọn đáp án B Đáp án: B
Câu 7 [308520]: Tên gốc-chức của amine có công thức cấu tạo CH3–CH2–NH2 là
A, ethylamine.
B, N-methylethylamine.
C, methylethanamine.
D, diethylamine.
Tên gốc chức = tên gốc hydrocarbon + amine
CH3-CH2-: Gốc ethyl ⇒ Tên gọi: ethylamine.
⇒ Chọn đáp án A Đáp án: A
CH3-CH2-: Gốc ethyl ⇒ Tên gọi: ethylamine.
⇒ Chọn đáp án A Đáp án: A
Câu 8 [308343]: Loại đường nào có nhiều trong mía và củ cải đường?
A, Saccharose.
B, Cellulose.
C, Fructose.
D, Glucose.
HD: Thông tin quen thuộc:
✔️ A. Saccharose có nhiều trong mía, củ cải đường, hoa thốt nốt,...
❌ B. Cellulose: bông, đay,...
❌ C. Fructose: nhiều trong mật ong, tạo vị ngọt sắc.
❌ D. Glucose: có nhiều trong quả nho chín (đường nho).
⇒ Chọn đáp án A Đáp án: A
✔️ A. Saccharose có nhiều trong mía, củ cải đường, hoa thốt nốt,...
❌ B. Cellulose: bông, đay,...
❌ C. Fructose: nhiều trong mật ong, tạo vị ngọt sắc.
❌ D. Glucose: có nhiều trong quả nho chín (đường nho).
⇒ Chọn đáp án A Đáp án: A
Câu 9 [304837]: Thuỷ phân ester CH3CH2CH2COOC2H5 trong môi trường base KOH thì thu được sản phẩm gồm các chất là
A, CH3CH2COOK và C2H5OH.
B, CH3CH2CH2COONa và C2H5OH.
C, CH3CH2CH2COOK và C2H5OH.
D, CH3COOK và C2H5OH.
Hình thức đơn giản rút gọn cách phân tích phản ứng thủy phân ester trong môi trường kiềm:
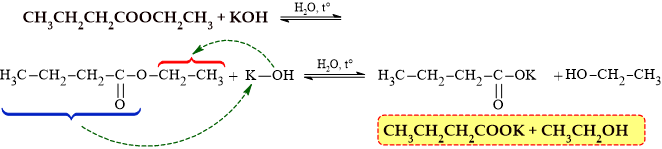
⟹ sản phẩm thu được gồm potassium butanoate CH3CH2CH3COONa và ethanol CH3CH2OH
⟹ Chọn đáp án C Đáp án: C

⟹ sản phẩm thu được gồm potassium butanoate CH3CH2CH3COONa và ethanol CH3CH2OH
⟹ Chọn đáp án C Đáp án: C
Câu 10 [704004]: Quy trình Haber được phát triển vào năm 1915 và bao gồm việc bổ sung nitrogen và hydrogen để tạo thành ammonia. Ammonia được tạo ra sau đó được sử dụng làm nguyên liệu để sản xuất phân bón:
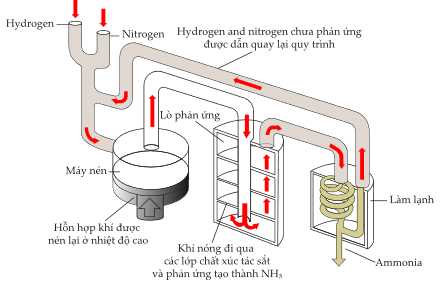
(*) N2(g) + 3H2(g)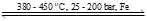 2NH3(g);
2NH3(g); 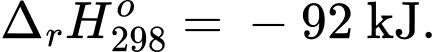
Cho các phát biểu sau:
(a) Chiều thuận của phản ứng (*) là quá trình tỏa nhiệt.
(b) Khi tăng áp suất, cân bằng của phản ứng (*) chuyển dịch theo chiều nghịch.
(c) Chất xúc tác (Fe) giúp phản ứng nhanh đạt trạng thái cân bằng.
(d) NH3 có nhiệt độ sôi cao hơn N2 và H2.
(e) N2 và H2 dư có thể được đưa trở lại hỗn hợp ban đầu để tái sử dụng.
Số phát biểu đúng là

(*) N2(g) + 3H2(g)
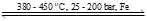 2NH3(g);
2NH3(g); 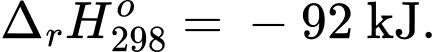
Cho các phát biểu sau:
(a) Chiều thuận của phản ứng (*) là quá trình tỏa nhiệt.
(b) Khi tăng áp suất, cân bằng của phản ứng (*) chuyển dịch theo chiều nghịch.
(c) Chất xúc tác (Fe) giúp phản ứng nhanh đạt trạng thái cân bằng.
(d) NH3 có nhiệt độ sôi cao hơn N2 và H2.
(e) N2 và H2 dư có thể được đưa trở lại hỗn hợp ban đầu để tái sử dụng.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) Đúng. Giá trị biến thiên enthalpy của phản ứng là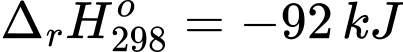 nên chiều thuận của phản ứng là tỏa nhiệt.
nên chiều thuận của phản ứng là tỏa nhiệt.
❌ (b) Sai. Theo nguyên lí chuyển dịch cân bằng, khi tăng áp suất cân bằng của phản ứng chuyển dịch theo chiều giảm áp suất là chiều thuận.
✔️ (c) Đúng. Fe là chất xúc tác có vai trò đẩy nhanh tốc độ phản ứng, giúp phản ứng nhanh đạt trạng thái cân bằng.
✔️ (d) Đúng. Nhiệt độ sôi của NH3, H2 và N2 lần lượt là -33,34 oC, -252,9 oC và -195,8 oC.
✔️ (e) Đúng. Trong chu trình tại nơi làm lạnh để ngưng tụ NH3 thì phần khí N2 và H2 chưa phản ứng sẽ dẫn quay lại đầu chu trình để điều chế NH3.
Có 4 phát biểu đúng là (a) (c) (d) (e)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Giá trị biến thiên enthalpy của phản ứng là
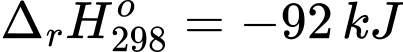 nên chiều thuận của phản ứng là tỏa nhiệt.
nên chiều thuận của phản ứng là tỏa nhiệt.❌ (b) Sai. Theo nguyên lí chuyển dịch cân bằng, khi tăng áp suất cân bằng của phản ứng chuyển dịch theo chiều giảm áp suất là chiều thuận.
✔️ (c) Đúng. Fe là chất xúc tác có vai trò đẩy nhanh tốc độ phản ứng, giúp phản ứng nhanh đạt trạng thái cân bằng.
✔️ (d) Đúng. Nhiệt độ sôi của NH3, H2 và N2 lần lượt là -33,34 oC, -252,9 oC và -195,8 oC.
✔️ (e) Đúng. Trong chu trình tại nơi làm lạnh để ngưng tụ NH3 thì phần khí N2 và H2 chưa phản ứng sẽ dẫn quay lại đầu chu trình để điều chế NH3.
Có 4 phát biểu đúng là (a) (c) (d) (e)
⇒ Chọn đáp án D Đáp án: D
Câu 11 [561120]: Trong phản ứng thuận nghịch dưới đây:
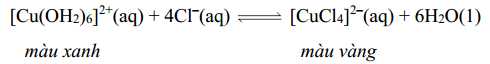
Việc tăng nồng độ Cl–(aq) ảnh hưởng thế nào đến sự thay đổi màu của dung dịch?
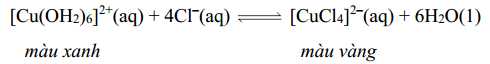
Việc tăng nồng độ Cl–(aq) ảnh hưởng thế nào đến sự thay đổi màu của dung dịch?
A, Màu của dung dịch có xu hướng chuyển sang màu xanh.
B, Màu của dung dịch có xu hướng chuyển sang màu vàng.
C, Màu của dung dịch có xu hướng chuyển sang màu đỏ.
D, Màu của dung dịch có xu hướng chuyển sang màu hồng.
Theo nguyên lí chuyển dịch cân bằng, khi tăng nồng độ Cl- thì cân bằng sẽ chuyển dịch theo chiều giảm nồng độ Cl- (chiều thuận), nên dung dịch sẽ chuyển từ màu xanh sang màu vàng.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 12 [704005]: Cấu tạo hóa học là …… giữa các nguyên tử trong phân tử. Nội dung phù hợp điền vào chỗ trống là
A, thứ tự liên kết.
B, phản ứng.
C, lực tương tác yếu.
D, tỉ lệ số lượng.
Trong hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó được gọi là cấu tạo hóa học. Sự thay đổi thứ tự liên kết sẽ tạo ra một hợp chất khác.
→ Cấu tạo hóa học là thứ tự liên kết giữa các nguyên tử trong phân tử.
⇒ Chọn đáp án A Đáp án: A
→ Cấu tạo hóa học là thứ tự liên kết giữa các nguyên tử trong phân tử.
⇒ Chọn đáp án A Đáp án: A
Câu 13 [704006]: Phản ứng của benzene với dung dịch gồm nitric acid đặc và sulfuric acid đặc tạo thành nitrobenzene.
Cơ chế của phản ứng như sau:
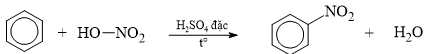
▪ Giai đoạn 1: Quá trình tạo ra tác nhân electrophile NO2+.

▪ Giai đoạn 2: Quá trình tương tác giữa benzene và tác nhân electrophile NO2+.
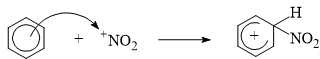
▪ Giai đoạn 3: Quá trình tách proton để tạo thành sản phẩm.

Phát biểu nào sau đây đúng?
Cơ chế của phản ứng như sau:
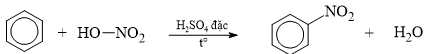
▪ Giai đoạn 1: Quá trình tạo ra tác nhân electrophile NO2+.

▪ Giai đoạn 2: Quá trình tương tác giữa benzene và tác nhân electrophile NO2+.
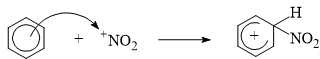
▪ Giai đoạn 3: Quá trình tách proton để tạo thành sản phẩm.

Phát biểu nào sau đây đúng?
A, Giai đoạn 1, nguyên tử H của HNO3 kết hợp với nhóm OH của H2SO4 tạo thành H2O.
B, Giai đoạn 2 có sự phá vỡ 3 liên kết π trong phân tử benzene.
C, Giai đoạn 2, sản phẩm tạo thành có điện tích là +2.
D, Giai đoạn 3 có sự tạo thành 1 liên kết π và phá vỡ 1 liên kết σ.
Phân tích các phát biểu:
❌ A. Sai. Giai đoạn 1, nguyên tử OH của HNO3 kết hợp với nhóm H của H2SO4 tạo thành H2O.
❌ B. Sai. Giai đoạn 2, chỉ xảy ra sự phá vỡ 1 liên kết π trong phân tử benzene.
❌ C. Sai. Ban đầu benzene không mang điện tích, NO2+ mang điện tích là +1 nên sản phẩm sinh ra có điện tích là +1 chứ không phải +2.
✔️ D. Đúng. Giai đoạn 3 có sự tạo thành 1 liên kết π và phá vỡ 1 liên kết σ.
⇒ Chọn đáp án D Đáp án: D
❌ A. Sai. Giai đoạn 1, nguyên tử OH của HNO3 kết hợp với nhóm H của H2SO4 tạo thành H2O.
❌ B. Sai. Giai đoạn 2, chỉ xảy ra sự phá vỡ 1 liên kết π trong phân tử benzene.
❌ C. Sai. Ban đầu benzene không mang điện tích, NO2+ mang điện tích là +1 nên sản phẩm sinh ra có điện tích là +1 chứ không phải +2.
✔️ D. Đúng. Giai đoạn 3 có sự tạo thành 1 liên kết π và phá vỡ 1 liên kết σ.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [303501]: Chất nào sau đây chứa nhóm chức khác với các chất còn lại?
A, 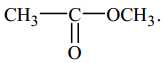
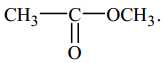
B, 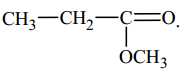
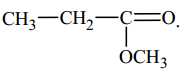
C, 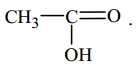

D, 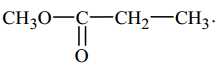
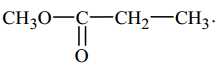
Quan sát lại hình thức chức acid và ester sau:
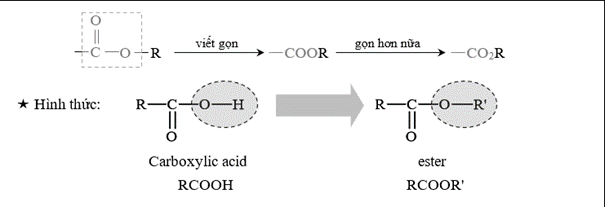
⟹ A, B và D chứa nhóm chức ester; còn đáp án C. CH3COOH chứa nhóm chức carboxylic acid
⟹ Chọn đáp án C Đáp án: C

⟹ A, B và D chứa nhóm chức ester; còn đáp án C. CH3COOH chứa nhóm chức carboxylic acid
⟹ Chọn đáp án C Đáp án: C
Câu 15 [704007]: “Amine là dẫn xuất của ...(1)..., trong đó nguyên tử ...(2)... trong phân tử ammonia được thay thế bằng gốc hydrocarbon”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, amino acid, carbon.
B, ammonium, hydrogen.
C, ammonium, carbon.
D, ammonia, hydrogen.
- Phân tử ammonia (NH3) nguyên tử nitrogen liên kết với ba nguyên tử hydrogen.
- Trong amine, một hoặc nhiều nguyên tử hydrogen của NH3 được thay thế bằng các gốc hydrocarbon nên amine là dẫn xuất của ammonia.
⇒ Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
⇒ Chọn đáp án D Đáp án: D
- Trong amine, một hoặc nhiều nguyên tử hydrogen của NH3 được thay thế bằng các gốc hydrocarbon nên amine là dẫn xuất của ammonia.
⇒ Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
⇒ Chọn đáp án D Đáp án: D
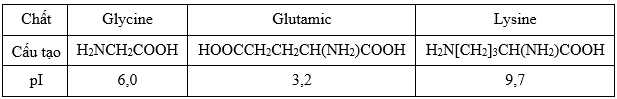
Câu 16 [704008]: Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Khi đặt trong một điện trường dạng anion sẽ di chuyển về cực (+) còn dạng cation sẽ di chuyển về cực (–). Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pl của các chất sau:
Trong các giá trị pH cho dưới đây, giá trị nào là tối ưu nhất để tách ba chất trên ra khỏi dung dịch hỗn hợp của chúng?

Trong các giá trị pH cho dưới đây, giá trị nào là tối ưu nhất để tách ba chất trên ra khỏi dung dịch hỗn hợp của chúng?
A, pH = 14,0.
B, pH = 9,7.
C, pH = 3,2.
D, pH = 6,0.
Glycine có pI = pH = 6,0 → Glycine hầu như không di chuyển về 2 bên điện cực.
Glutamic acid có pI = 3,2 < pH = 6,0 → Glutamic acid tồn tại trong dung dịch dưới dạng anion nên glutamic acid di chuyển về phía cực dương.
Lysine có pI = 9,7 > pH = 6,0 → Lysine tồn tại trong dung dịch dưới dạng cation nên lysine di chuyển về phía cực âm.
→ pH = 6,0 sẽ là môi trường tối ưu tách được 3 𝞪-amino acid.Đặt hỗn hợp các amino acid gồm lysine, glycine và glutamic acid ở pH = 6,0 vào trong một điện trường.
Sự di chuyển của α-amino acid dưới tác dụng của điện trường ở pH = 6
⇒ Chọn đáp án D Đáp án: D
Glutamic acid có pI = 3,2 < pH = 6,0 → Glutamic acid tồn tại trong dung dịch dưới dạng anion nên glutamic acid di chuyển về phía cực dương.
Lysine có pI = 9,7 > pH = 6,0 → Lysine tồn tại trong dung dịch dưới dạng cation nên lysine di chuyển về phía cực âm.
→ pH = 6,0 sẽ là môi trường tối ưu tách được 3 𝞪-amino acid.Đặt hỗn hợp các amino acid gồm lysine, glycine và glutamic acid ở pH = 6,0 vào trong một điện trường.

Sự di chuyển của α-amino acid dưới tác dụng của điện trường ở pH = 6
⇒ Chọn đáp án D Đáp án: D
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 - 18:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:


Câu 17 [680869]: Trong số các ion kim loại gồm Fe2+, Cu2+ và Zn2+, ở điều kiện chuẩn ion nào có tính oxi hóa yếu hơn Ag2+, nhưng mạnh hơn Pb2+?
A,
Fe2+, Cu2+, Zn2+.
B, Fe2+, Cu2+.
C, Zn2+.
D, Cu2+.
Ta có
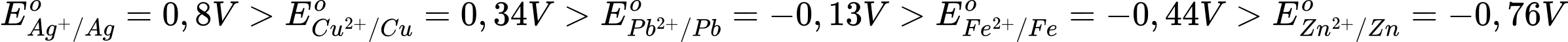
→ Thấy rằng chỉ có Cu2+/Cu có thế điện cực chuẩn nhỏ hơn Ag+/Ag và lớn hơn Pb2+/Pb
→ Cu2+ có tính oxi hóa mạnh hơn Pb2+/Pb và yếu hơn Ag+/Ag.
⇒ Chọn đáp án D
Đáp án: D
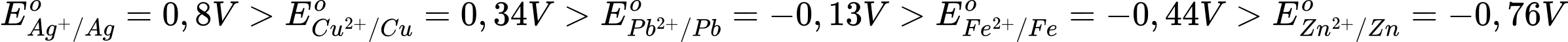
→ Thấy rằng chỉ có Cu2+/Cu có thế điện cực chuẩn nhỏ hơn Ag+/Ag và lớn hơn Pb2+/Pb
→ Cu2+ có tính oxi hóa mạnh hơn Pb2+/Pb và yếu hơn Ag+/Ag.
⇒ Chọn đáp án D
Đáp án: D
Câu 18 [680870]: Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa - khử trong số các cặp trên là
A, 1,24 V.
B, 1,56 V.
C, 1,60 V.
D, 0,93 V.
Sức điện động lớn nhất của pin galvani thiết lặp từ cặp Zn2+/Zn và Ag+/Ag
Với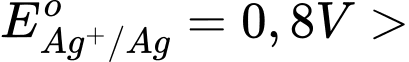
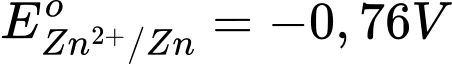 → Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
→ Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
Zn + 2Ag+ → Zn2+ + 2Ag
Phản ứng trong pin:
Cathode (+): Ag+ +1e → Ag
Anode (-): Zn → Zn2+ + 2e
Sức điện của pin là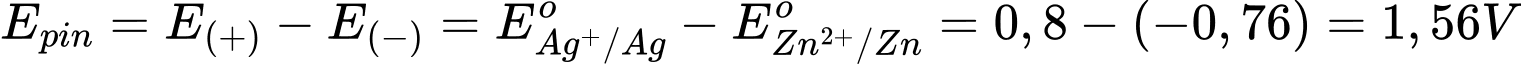
⇒ Chọn đáp án B Đáp án: B
Với
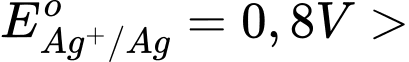
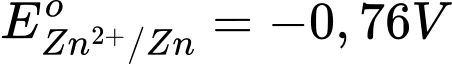 → Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)
→ Zn đóng vai trò là anode (-) và Ag đóng vai trò là cathode (+)Zn + 2Ag+ → Zn2+ + 2Ag
Phản ứng trong pin:
Cathode (+): Ag+ +1e → Ag
Anode (-): Zn → Zn2+ + 2e
Sức điện của pin là
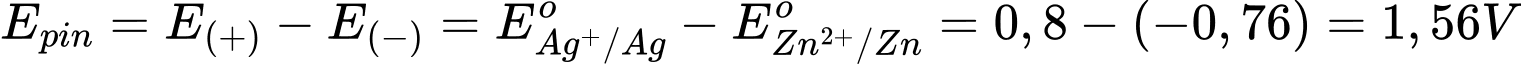
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 19 [704009]: Cho một ít bột nhôm vào muỗng đốt hoá chất rồi đốt trên ngọn lửa đèn cồn. Khi một phần bột nhôm trong muỗng cháy đỏ thì đưa nhanh muỗng vào bình chứa oxygen dư. Bột nhôm cháy nhanh và phát ra ánh sáng màu trắng rất mạnh, tạo thành hợp chất A.
Chất A là Al2O3
4Al + 3O2 2Al2O3
2Al2O3
Quá trình oxi hóa: Al → Al3+ + 3e
Quá trình khử O2 + 4e → 2O2-
Phân tích các phát biểu:
❌ a. Sai. Nhôm bị oxi hoá tạo thành hợp chất Al2O3.
✔️ b. Đúng. Gọi số oxi hoá của Al là x, số oxi hoá của oxi trong các hợp chất là -2. Tổng số oxi hoá trong một hợp chất bằng 0 nên ta có:
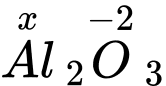 : x.2 + (-2).3 = 0 → x = +3.
: x.2 + (-2).3 = 0 → x = +3.
✔️ c. Đúng. Bột nhôm cháy nhanh và phát ra ánh sáng màu trắng rất mạnh chứng tỏ phản ứng xảy ra mãnh liệt và toả nhiều nhiệt nên Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trị âm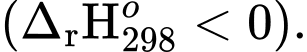
✔️ d. Đúng. Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+/Al và O2/2O2–.
4Al + 3O2
 2Al2O3
2Al2O3Quá trình oxi hóa: Al → Al3+ + 3e
Quá trình khử O2 + 4e → 2O2-
Phân tích các phát biểu:
❌ a. Sai. Nhôm bị oxi hoá tạo thành hợp chất Al2O3.
✔️ b. Đúng. Gọi số oxi hoá của Al là x, số oxi hoá của oxi trong các hợp chất là -2. Tổng số oxi hoá trong một hợp chất bằng 0 nên ta có:
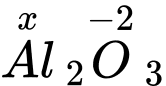 : x.2 + (-2).3 = 0 → x = +3.
: x.2 + (-2).3 = 0 → x = +3.✔️ c. Đúng. Bột nhôm cháy nhanh và phát ra ánh sáng màu trắng rất mạnh chứng tỏ phản ứng xảy ra mãnh liệt và toả nhiều nhiệt nên Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trị âm
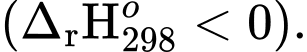
✔️ d. Đúng. Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+/Al và O2/2O2–.
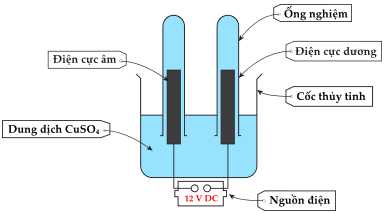
Câu 20 [704010]: Quá trình điện phân dung dịch CuSO4 được tiến hành như sau:
▪ Bước 1: Đổ dung dịch copper(II) sulfate vào cốc thủy tinh.
▪ Bước 2: Đặt hai thanh than chì vào dung dịch copper(II) sulfate.
▪ Bước 3: Gắn một điện cực vào cực âm của nguồn điện và điện cực còn lại vào cực dương.
▪ Bước 4: Đổ đầy dung dịch copper(II) sulfate vào hai ống nghiệm nhỏ và đặt một ống nghiệm lên mỗi điện cực như trong sơ đồ.
▪ Bước 5: Bật nguồn điện và quan sát hiện tượng xảy ra ở mỗi điện cực.
▪ Bước 1: Đổ dung dịch copper(II) sulfate vào cốc thủy tinh.
▪ Bước 2: Đặt hai thanh than chì vào dung dịch copper(II) sulfate.
▪ Bước 3: Gắn một điện cực vào cực âm của nguồn điện và điện cực còn lại vào cực dương.
▪ Bước 4: Đổ đầy dung dịch copper(II) sulfate vào hai ống nghiệm nhỏ và đặt một ống nghiệm lên mỗi điện cực như trong sơ đồ.
▪ Bước 5: Bật nguồn điện và quan sát hiện tượng xảy ra ở mỗi điện cực.

Khi điện phân dung dịch CuSO4
Ở anode (+) 2H2O → O2 + 4e + 4H+
Ở cathode (-) Cu2+ + 2e → Cu
Phương trình: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Phân tích các phát biểu:
❌ (a) Sai. Cathode có hiện tượng thấy một lớp chất rắn bám lên điện cực chứ không tan.
✔️ (b) Đúng. Vì bên điện cực anode xảy ra quá trình điện phân nước tạo ra O2 nên khi cho tàn đóm vào sẽ bùng cháy.
❌ (c) Sai. Quá trình mô hình trên không hình thành pin điện hóa nên không phát sinh dòng điện để làm sáng bóng đèn.
❌ (d) Sai. Nồng độ dung dịch CuSO4 trong dung dịch giảm dần sau khi điện phân.
Ở anode (+) 2H2O → O2 + 4e + 4H+
Ở cathode (-) Cu2+ + 2e → Cu
Phương trình: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Phân tích các phát biểu:
❌ (a) Sai. Cathode có hiện tượng thấy một lớp chất rắn bám lên điện cực chứ không tan.
✔️ (b) Đúng. Vì bên điện cực anode xảy ra quá trình điện phân nước tạo ra O2 nên khi cho tàn đóm vào sẽ bùng cháy.
❌ (c) Sai. Quá trình mô hình trên không hình thành pin điện hóa nên không phát sinh dòng điện để làm sáng bóng đèn.
❌ (d) Sai. Nồng độ dung dịch CuSO4 trong dung dịch giảm dần sau khi điện phân.
Câu 21 [704011]: Nồng độ đường trong máu có thể được xác định bằng phương pháp Hagedorn – Jensen. Phương pháp này dựa vào phản ứng của Na3[Fe(CN)6] oxi hoá đường glucose có trong máu thành gluconic acid C5H11O5COOH (C6H12O7). Quy trình phân tích như sau:
▪ Bước 1: Lấy 0,20 mL mẫu máu cho vào bình tam giác, thêm 5,00 mL dung dịch Na3[Fe(CN)6] 4,012 mmol/L rồi đun cách thuỷ thu được dung dịch A.
▪ Bước 2: Thêm lần lượt dung dịch KI dư, ZnCl2 dư và CH3COOH vào dung dịch A.
▪ Bước 3: Sau khi các phản ứng xảy ra hoàn toàn, lượng I2 sinh ra tồn tại dưới dạng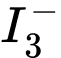 được chuẩn độ bằng dung dịch Na2S2O3 4,00 mmol/L. Biết rằng phép chuẩn độ cần dùng vừa đủ 3,28 mL dung dịch Na2S2O3 và pH của máu là 7,4.
được chuẩn độ bằng dung dịch Na2S2O3 4,00 mmol/L. Biết rằng phép chuẩn độ cần dùng vừa đủ 3,28 mL dung dịch Na2S2O3 và pH của máu là 7,4.
Giả thiết các thành phần khác có trong máu không ảnh hưởng đến kết quả thí nghiệm. Các phương trình xảy ra như sau:
(1)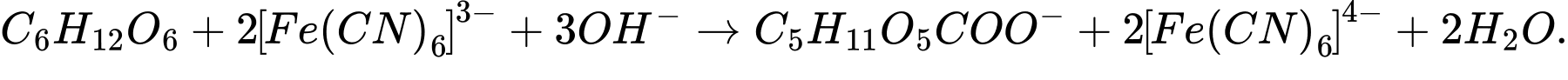
(2)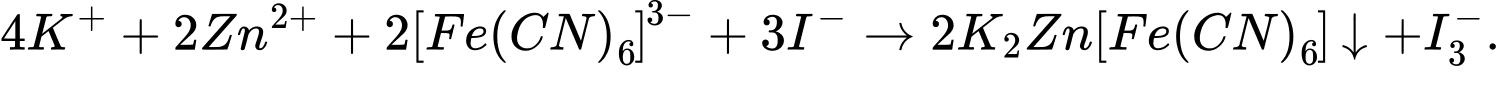
(3)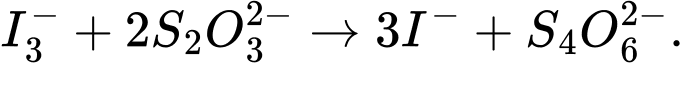
▪ Bước 1: Lấy 0,20 mL mẫu máu cho vào bình tam giác, thêm 5,00 mL dung dịch Na3[Fe(CN)6] 4,012 mmol/L rồi đun cách thuỷ thu được dung dịch A.
▪ Bước 2: Thêm lần lượt dung dịch KI dư, ZnCl2 dư và CH3COOH vào dung dịch A.
▪ Bước 3: Sau khi các phản ứng xảy ra hoàn toàn, lượng I2 sinh ra tồn tại dưới dạng
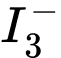 được chuẩn độ bằng dung dịch Na2S2O3 4,00 mmol/L. Biết rằng phép chuẩn độ cần dùng vừa đủ 3,28 mL dung dịch Na2S2O3 và pH của máu là 7,4.
được chuẩn độ bằng dung dịch Na2S2O3 4,00 mmol/L. Biết rằng phép chuẩn độ cần dùng vừa đủ 3,28 mL dung dịch Na2S2O3 và pH của máu là 7,4.Giả thiết các thành phần khác có trong máu không ảnh hưởng đến kết quả thí nghiệm. Các phương trình xảy ra như sau:
(1)
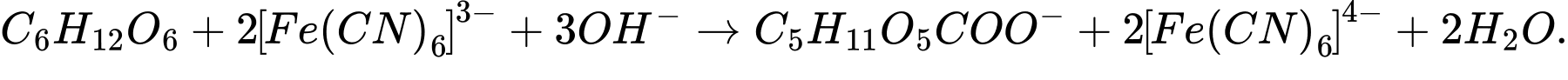
(2)
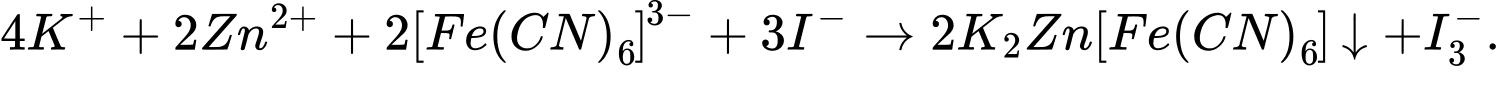
(3)
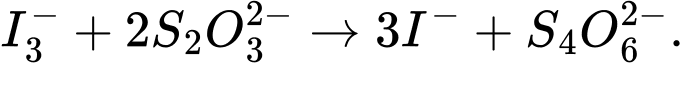
(1) C6H12O6 + 2[Fe(CN)6]3- + 3OH- ⟶ C5H11O5COO- + 2[Fe(CN)6]4- + 2H2O
(2) 4K+ + 2Zn2+ + 2[Fe(CN)6]3- + 3I- ⟶ 2K2Zn[Fe(CN)6]↓ + I3-
(3) I3- + 2S2O32- ⟶ 2I- + S4O62-
Đổi 3,28 mL = 3,28.10-3 L; 5 mL = 5.10-3 L
Số mol của Na2S2O3 là: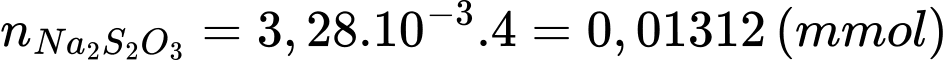
Từ phương trình (2) và (3) số mol của [Fe(CN)6]3- là: 0,01312 (mmol)
Số mol của [Fe(CN)6]3- ban đầu là: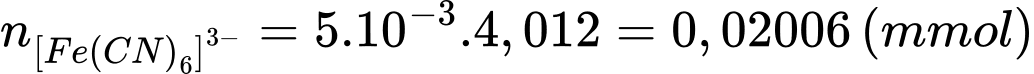
Số mol của glucose trong máu là: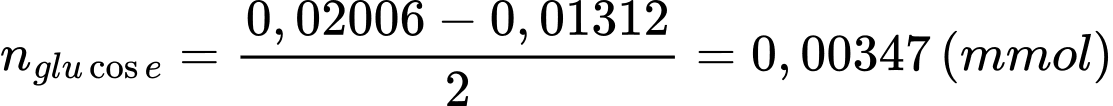
Nồng độ mg/mL của glucose trong máu là: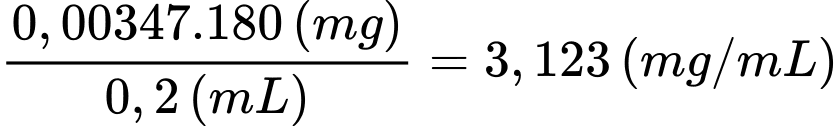
Phân tích các phát biểu:
✔️ (a) Đúng. Số oxi hóa của Fe từ +3 giảm xuống thành +2 sau phản ứng, nên Na3[Fe(CN)6] đóng vai trò là chất oxi hóa.
✔️ (b) Đúng. Nồng độ (mg/mL) của glucose có trong mẫu máu là 3,123.
❌ (c) Sai. Không thể dùng FeCl3 và Fe(NO3)3 vì sẽ tạo kết tủa với OH- không xác định hàm lượng của glucose trong máu.
✔️ (d) Đúng. Mục đích CH3COOH được thêm vào để tạo môi trường acid và trung hòa lượng OH– còn dư của phản ứng số (1)
(2) 4K+ + 2Zn2+ + 2[Fe(CN)6]3- + 3I- ⟶ 2K2Zn[Fe(CN)6]↓ + I3-
(3) I3- + 2S2O32- ⟶ 2I- + S4O62-
Đổi 3,28 mL = 3,28.10-3 L; 5 mL = 5.10-3 L
Số mol của Na2S2O3 là:
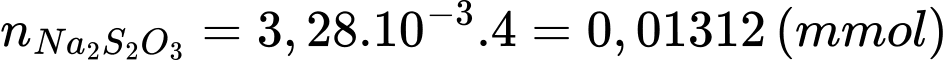
Từ phương trình (2) và (3) số mol của [Fe(CN)6]3- là: 0,01312 (mmol)
Số mol của [Fe(CN)6]3- ban đầu là:
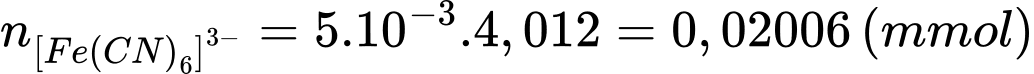
Số mol của glucose trong máu là:
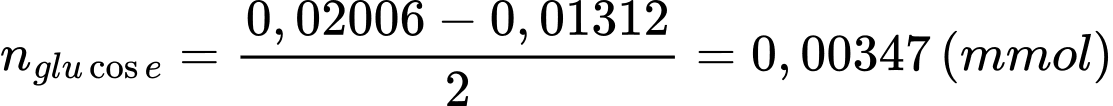
Nồng độ mg/mL của glucose trong máu là:
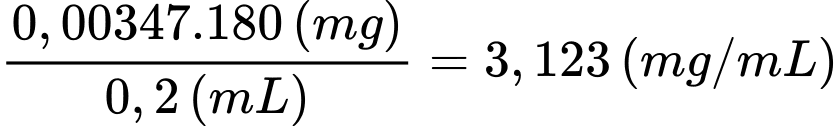
Phân tích các phát biểu:
✔️ (a) Đúng. Số oxi hóa của Fe từ +3 giảm xuống thành +2 sau phản ứng, nên Na3[Fe(CN)6] đóng vai trò là chất oxi hóa.
✔️ (b) Đúng. Nồng độ (mg/mL) của glucose có trong mẫu máu là 3,123.
❌ (c) Sai. Không thể dùng FeCl3 và Fe(NO3)3 vì sẽ tạo kết tủa với OH- không xác định hàm lượng của glucose trong máu.
✔️ (d) Đúng. Mục đích CH3COOH được thêm vào để tạo môi trường acid và trung hòa lượng OH– còn dư của phản ứng số (1)
Câu 22 [704012]: Cho cấu tạo của hai hợp chất A và B như sau:

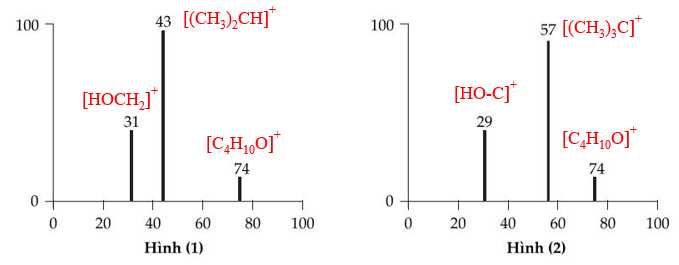
Phổ khối (MS) của mỗi hợp chất được hiển thị bên dưới:
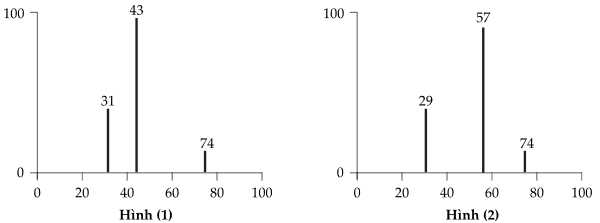

Phổ khối (MS) của mỗi hợp chất được hiển thị bên dưới:

Phân tích các phát biểu:
✔️ a. Đúng. hai hợp chất A và B có cùng công thức phân tử là C4H10O, đều là alcohol no, đơn chức mạch hở nên là đồng phân cấu tạo của nhau.
❌ b. Sai. Hình (1) là phổ khối lượng (MS) tương ứng của hợp chất B.
❌ c. Phổ MS ở hình (2) chỉ cho biết phân tử khối của hợp chất. Để biết hợp chất có nhóm chức OH thì phải thông qua phổ IR.
✔️ d. Đúng. Trong trường hợp trên, dựa vào phổ khối lượng (MS) có thể dùng để phân biệt hai hợp chất A và B.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704013]: Một nhóm sinh viên được giao bài tập yêu cầu chuẩn bị một mẫu copper(II) sunfate từ copper(II) carbonate. Phản ứng để chế tạo thuốc này như sau:
CuCO3(s) + H₂SO4(aq) + 5H2O(l) → CuSO4.5H2O(s) + H2O(I) + CO2(g)
Nhóm chuẩn bị 2,5 gam copper(II) carbonate và 45 mL sulfuric acid 1 M, sau phản ứng thu được 4,6 gam sản phẩm CuSO4.5H2O. Hiệu suất của phản ứng là bao nhiêu phần trăm?
CuCO3(s) + H₂SO4(aq) + 5H2O(l) → CuSO4.5H2O(s) + H2O(I) + CO2(g)
Nhóm chuẩn bị 2,5 gam copper(II) carbonate và 45 mL sulfuric acid 1 M, sau phản ứng thu được 4,6 gam sản phẩm CuSO4.5H2O. Hiệu suất của phản ứng là bao nhiêu phần trăm?
CuCO3(s) + H2SO4(aq) + 5H2O(l) ⟶ CuSO4.5H2O(s) + H2O(l) + CO2(g)
Số mol của copper(II) carbonate là:
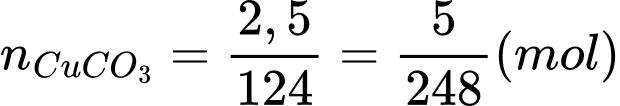
Khối lượng của CuSO4.5H2O tạo thành theo lí thuyết là:
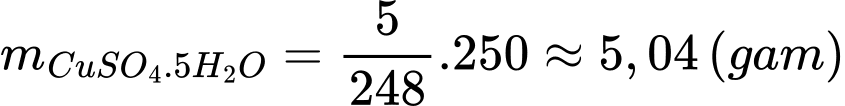
Hiệu suất của phản ứng là:
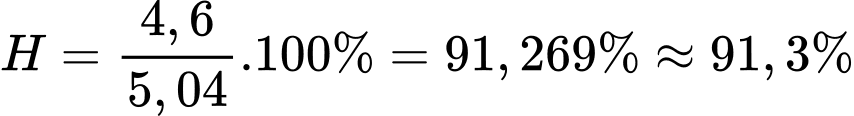
⇒ Điền đáp án: 91,3
Số mol của copper(II) carbonate là:
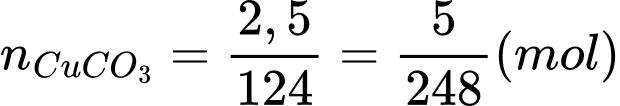
Khối lượng của CuSO4.5H2O tạo thành theo lí thuyết là:
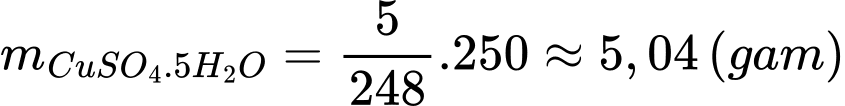
Hiệu suất của phản ứng là:
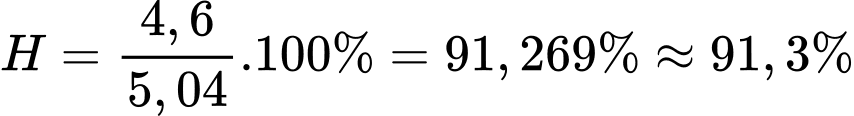
⇒ Điền đáp án: 91,3
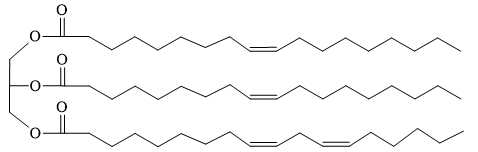
Câu 24 [704014]: Trong thành phần của dầu oliu có chứa một số chất béo, trong đó chủ yếu là chất X có cấu trúc như hình dưới đây.
Đun nóng chất béo X với dung dịch KOH thu được hỗn hợp hai muối potassium Y và Z. Giá trị khối lượng phân tử lớn nhất của muối postassium thu được là bao nhiêu?

Đun nóng chất béo X với dung dịch KOH thu được hỗn hợp hai muối potassium Y và Z. Giá trị khối lượng phân tử lớn nhất của muối postassium thu được là bao nhiêu?
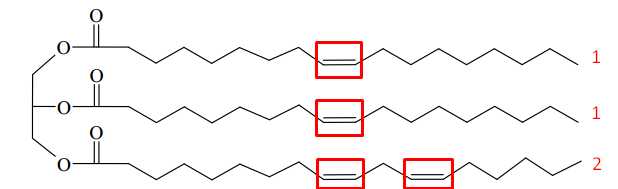
Từ cấu trúc của chất béo X thấy X được tạo nên từ 2 loại acid béo:
+ Loại 1 có 1 liên kết π có CTPT CnH2n-1COOH, có 17 carbon nên CTPT của acid 1 là C17H33COOH ⟶ Muối tạo thành từ acid này và potassium là C17H33COOK (M = 320).
+ Loại 2 có 2 liên kết π có CTPT CnH2n-3COOH, có 17 carbon nên CTPT của acid 1 là C17H31COOH ⟶ Muối tạo thành từ acid này và potassium là C17H31COOK (M = 318).
⇒ Giá trị khối lượng phân tử lớn nhất của muối postassium thu được là 320 (gam/mol).
⇒ Điền đáp án: 320
Câu 25 [704015]: Kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 với thuốc thử được ghi lại ở bảng sau:
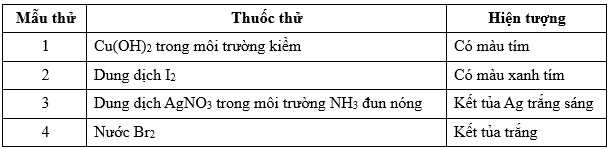
Gán số thứ tự các mẫu thử trên ứng với các chất: hồ tinh bột, lòng trắng trứng, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự các mẫu thử trên ứng với các chất: hồ tinh bột, lòng trắng trứng, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
⭐ Mẫu thử 1 là lòng trắng trứng chứa nhiều protein nên có phản ứng màu biuret của protein với Cu(OH)2/OH-.
⭐ Mẫu thử 2 là hồ tinh bột có phản ứng với dung dịch I2 thu được dung dịch có màu xanh tím đặc trưng.
⭐ Mẫu thử 3 là glucose phản ứng với AgNO3/NH3 thu được được kết tủa Ag: C6H12O6 + 2AgNO3 + 3NH3 + H2O → CH2OH(CHOH)4COONH4 + 2Ag + 2NH4NO3
⭐ Mẫu thử 4 là aniline phản ứng với dung dịch Br2 thu được kết tủa trắng.
Số thứ tự các mẫu thử trên ứng với các chất là: hồ tinh bột (2), lòng trắng trứng (1), glucose (3), aniline (4).
⇒ Điền đáp án: 2134
⭐ Mẫu thử 2 là hồ tinh bột có phản ứng với dung dịch I2 thu được dung dịch có màu xanh tím đặc trưng.
⭐ Mẫu thử 3 là glucose phản ứng với AgNO3/NH3 thu được được kết tủa Ag: C6H12O6 + 2AgNO3 + 3NH3 + H2O → CH2OH(CHOH)4COONH4 + 2Ag + 2NH4NO3
⭐ Mẫu thử 4 là aniline phản ứng với dung dịch Br2 thu được kết tủa trắng.
Số thứ tự các mẫu thử trên ứng với các chất là: hồ tinh bột (2), lòng trắng trứng (1), glucose (3), aniline (4).
⇒ Điền đáp án: 2134
Câu 26 [704016]: Cho biết có bao nhiêu amine bậc hai có công thức phân tử C5H13N?
Amine bậc hai có công thức phân tử C5H13N có 6 đồng phân cấu tạo như sau:
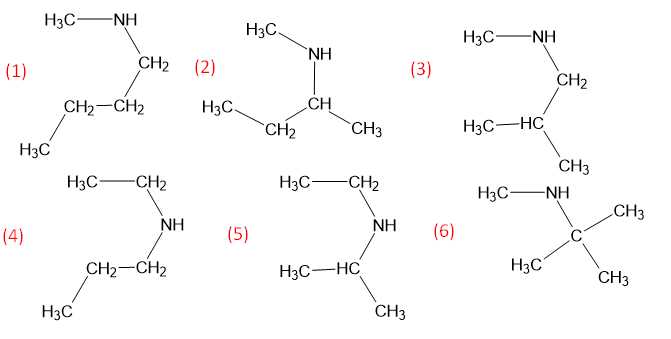
⇒ Điền đáp án: 6

⇒ Điền đáp án: 6
Câu 27 [704017]: Acquy chứa chì thường được sử dụng trong ô tô. Để giảm lượng chì và các hợp chất nguy hiểm thải ra bãi chôn lấp khi những bình acquy này bị vứt bỏ, người ta đã đề xuất thay thế chì bằng carbon monoxide. Phản ứng xảy ra trong pin khi hoạt động như sau:
PbO2(s) + CO(g) + H2SO4(aq) → PbSO4(s) + CO2(g) + H2O.
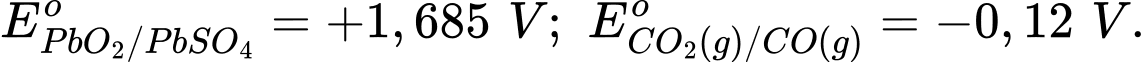
Nếu khối lượng riêng của dung dịch sulfuric acid trong acquy giảm từ 1,3 g/mL (40% H2SO4 theo khối lượng) xuống 1,2 g/mL (20% H2SO4 theo khối lượng) trong quá trình sử dụng, hãy xác định điện lượng của acquy đã tạo ra theo đơn vị ampere.giờ. Biết thể tích của acquy là 3,0 lít và thể tích thay đổi không đáng kể. (Làm tròn kết quả đến phần nguyên)
PbO2(s) + CO(g) + H2SO4(aq) → PbSO4(s) + CO2(g) + H2O.
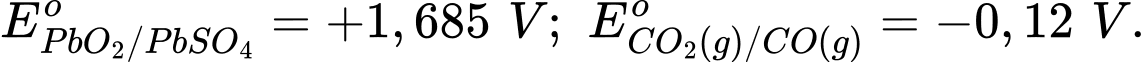
Nếu khối lượng riêng của dung dịch sulfuric acid trong acquy giảm từ 1,3 g/mL (40% H2SO4 theo khối lượng) xuống 1,2 g/mL (20% H2SO4 theo khối lượng) trong quá trình sử dụng, hãy xác định điện lượng của acquy đã tạo ra theo đơn vị ampere.giờ. Biết thể tích của acquy là 3,0 lít và thể tích thay đổi không đáng kể. (Làm tròn kết quả đến phần nguyên)
mH2SO4 ban đầu = V.D.C%= 3000. 1,3.40% = 1560
mH2SO4 sau phản ứng=V.D.C%=3000. 1,2. 20%= 720
⇒ ∆m = 1560 - 720= 840 g
⇒ nH2SO4= 8,57
⇒ ne trao đổi= 2.nH2SO4= 17,14 mol
mH2SO4 sau phản ứng=V.D.C%=3000. 1,2. 20%= 720
⇒ ∆m = 1560 - 720= 840 g
⇒ nH2SO4= 8,57
⇒ ne trao đổi= 2.nH2SO4= 17,14 mol
Q = ne . F = 17,14 . 96500 = 1654810 A.s
⇒ Đổi: 1654810/3600 = 460 A.h
⇒ Điền đáp án: 460
⇒ Điền đáp án: 460
Câu 28 [704018]: Thực phẩm đóng hộp tự sôi (self-heating food packaging) là sản phẩm đóng gói tiện dụng, nhanh chóng với khả năng làm nóng bên trong thực phẩm mà không cần nguồn nhiệt bên ngoài hoặc nguồn điện. Nguồn nhiệt thương mại để đóng gói thực phẩm: vôi sống và nước, có đặc điểm là giá thành rẻ cũng như nguồn cung sẵn có, thường được FDA công nhận là an toàn. Kim loại magnesium dạng bột mịn với một lượng nhỏ sắt và muối ăn, hoạt động bằng cách thêm nước.
Một gói làm nóng thức ăn có trong lẩu tự sôi, chứa khoảng 10 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước, xảy ra phản ứng, phản ứng này toả nhiều nhiệt và làm nóng phần nước lẩu bên trên.
Mg(s) + H2O(l) → Mg(OH)2(s) + H2(g)
Biết rằng enthalpy tạo thành chuẩn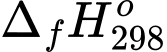 của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
Một gói làm nóng thức ăn có trong lẩu tự sôi, chứa khoảng 10 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước, xảy ra phản ứng, phản ứng này toả nhiều nhiệt và làm nóng phần nước lẩu bên trên.
Mg(s) + H2O(l) → Mg(OH)2(s) + H2(g)
Biết rằng enthalpy tạo thành chuẩn
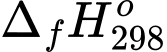 của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 kJ/mol và –285,8 kJ/mol. Gói FRH trên có thể làm nóng bao nhiêu mL nước từ 30 °C lên 100 °C (làm tròn kết quả đến hàng đơn vị hay đến số tự nhiên gần nhất). Biết nhiệt dung của nước khoảng 4,2 J/(g.°C), giả sử phần nước bên trên chỉ nhận được tối đa 60% lượng nhiệt toả ra, phần nhiệt còn lại làm nóng các vật dụng khác và thất thoát vào môi trường.
Mg(s) + 2H2O(l) ⟶ Mg(OH)2(s) + H2(g)
Biến thiên ethalpy chuẩn của phản ứng trên là:
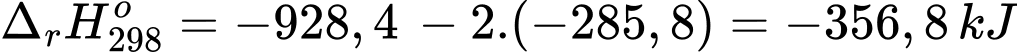
Số mol của Mg trong gói tự sôi trên là:
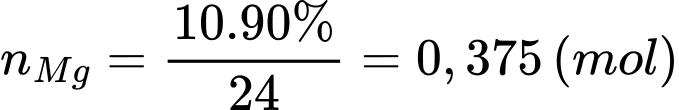
Lượng nhiệt tỏa ra khi sử dụng 1 mol Mg là 356,8 kJ
Lượng nhiệt tỏa ra khi sử dụng 0,375 mol Mg làm nóng nước là:
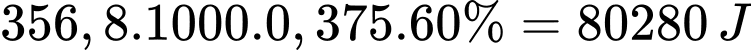
Khối lượng nước tối đa làm nóng từ 0,375 mol Mg là:
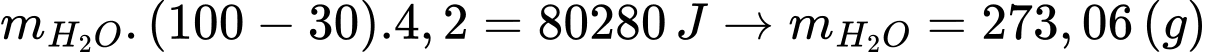
Thể tích nước là:
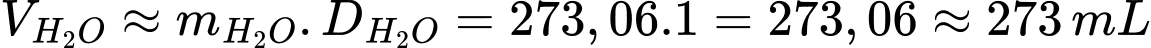
⇒ Điền đáp án: 273
Biến thiên ethalpy chuẩn của phản ứng trên là:
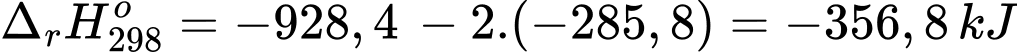
Số mol của Mg trong gói tự sôi trên là:
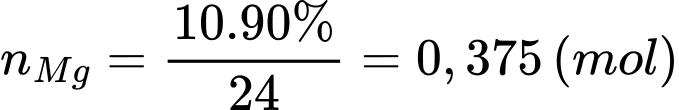
Lượng nhiệt tỏa ra khi sử dụng 1 mol Mg là 356,8 kJ
Lượng nhiệt tỏa ra khi sử dụng 0,375 mol Mg làm nóng nước là:
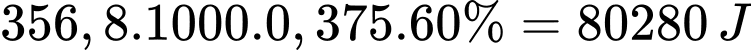
Khối lượng nước tối đa làm nóng từ 0,375 mol Mg là:
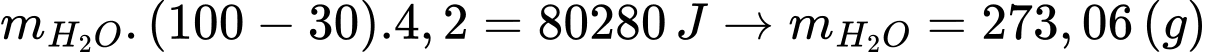
Thể tích nước là:
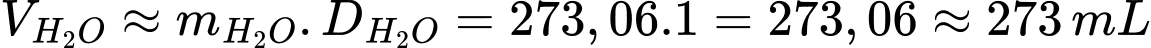
⇒ Điền đáp án: 273