PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704019]: “Trong pin điện hoá, điện năng được sinh ra từ phản ứng ..(1).. là một quá trình ..(2)..”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, oxi hoá, không tự diễn biến.
B, oxi hoá - khử, tự diễn biến.
C, khử, tự diễn biến.
D, trao đổi, oxi hóa - khử.
- Trong pin điện hóa, điện năng được sinh ra nhờ vào sự chuyển đổi năng lượng hóa học thành năng lượng điện. Phản ứng xảy ra trong pin là một phản ứng oxi hóa - khử do có sự chuyển electron từ chất khử (bị oxi hóa) sang chất oxi hóa (bị khử).
- Phản ứng trong pin điện hóa là một phản ứng tự diễn biến, tức là nó có thể diễn ra mà không cần cung cấp năng lượng từ bên ngoài.
⇒ Trong pin điện hoá, điện năng được sinh ra từ phản ứng oxi hoá - khử là một quá trình tự diễn biến.
⇒ Chọn đáp án B Đáp án: B
- Phản ứng trong pin điện hóa là một phản ứng tự diễn biến, tức là nó có thể diễn ra mà không cần cung cấp năng lượng từ bên ngoài.
⇒ Trong pin điện hoá, điện năng được sinh ra từ phản ứng oxi hoá - khử là một quá trình tự diễn biến.
⇒ Chọn đáp án B Đáp án: B
Câu 2 [560810]: Sodium hydrogencarbonate được dùng làm thuốc giảm đau dạ dày do thừa acid. Công thức của Sodium hydrogencarbonate là
A, KHCO3.
B, Na2CO3.
C, K2CO3.
D, NaHCO3.
Sodium hydrogencarbonate (NaHCO3), còn gọi là baking soda, có tính chất lưỡng tính, có thể phản ứng với cả acid và base.
Tên của các hợp chất còn lại:
A. KHCO3: Patossium hydrogencarbonate
B. Na2CO3: Sodium carbonate
C. K2CO3: Patossium carbonate
D. NaHCO3: Sodium hydrogencarbonate
⇒ Chọn đáp án D Đáp án: D
Tên của các hợp chất còn lại:
A. KHCO3: Patossium hydrogencarbonate
B. Na2CO3: Sodium carbonate
C. K2CO3: Patossium carbonate
D. NaHCO3: Sodium hydrogencarbonate
⇒ Chọn đáp án D Đáp án: D
Câu 3 [704020]: Polymer nào sau đây chỉ chứa nguyên tố carbon và hydrogen?
A, PE.
B, PVC.
C, Cao su buna-N.
D, Tơ olon.
Phân tích thành phần các polymer:
A. PE (polyethylene): Chỉ chứa nguyên tố C và H
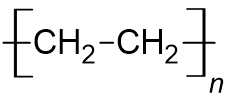
B. PVC (poly(vinyl chloride)): Chứa các nguyên tố C, H và Cl
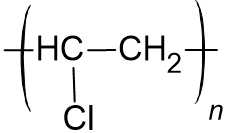
C. Cao su buna-N: Chứa các nguyên tố C, H và N
-(-CH2-CH=CH-CH2-CH(CN)-CH2-)n
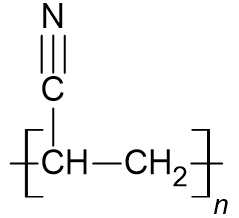
D. Tơ olon: Chứa các nguyên tố C, H và N
⇒ Chọn đáp án A Đáp án: A
A. PE (polyethylene): Chỉ chứa nguyên tố C và H
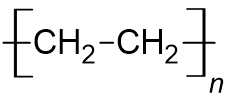
B. PVC (poly(vinyl chloride)): Chứa các nguyên tố C, H và Cl

C. Cao su buna-N: Chứa các nguyên tố C, H và N
-(-CH2-CH=CH-CH2-CH(CN)-CH2-)n
D. Tơ olon: Chứa các nguyên tố C, H và N

⇒ Chọn đáp án A Đáp án: A
Câu 4 [704021]: Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho kim loại sodium vào dung dịch zinc sulfate dư.
Thí nghiệm 2: Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate dư.
Thí nghiệm 3: Nhiệt phân hoàn toàn calcium carbonate ở nhiệt độ cao.
Thí nghiệm 4: Dẫn khí hydrogen dư đi qua bột copper(II) oxide nung nóng.
Sau khi các phản ứng kết thúc, các thí nghiệm thu được kim loại là
Thí nghiệm 1: Cho kim loại sodium vào dung dịch zinc sulfate dư.
Thí nghiệm 2: Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate dư.
Thí nghiệm 3: Nhiệt phân hoàn toàn calcium carbonate ở nhiệt độ cao.
Thí nghiệm 4: Dẫn khí hydrogen dư đi qua bột copper(II) oxide nung nóng.
Sau khi các phản ứng kết thúc, các thí nghiệm thu được kim loại là
A, thí nghiệm 1 và 2.
B, thí nghiệm 3 và 4.
C, thí nghiệm 2 và 4.
D, thí nghiệm 1 và 3.
Các phản ứng xảy ra như sau:
⍟ Thí nghiệm 1: 2Na + 2H2O 2NaOH + H2
2NaOH + H2
2NaOH + ZnSO4 Na2SO4 + Zn(OH)2
Na2SO4 + Zn(OH)2
2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
⍟ Thí nghiệm 2: Fe(NO3)2 + AgNO3 Fe(NO3)3 + Ag
Fe(NO3)3 + Ag
⍟ Thí nghiệm 3: CaCO3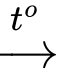 CaO + CO2
CaO + CO2
⍟ Thí nghiệm 4: CuO + H2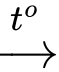 Cu + H2O
Cu + H2O
⟶ Chỉ có thí nghiệm 2 và thí nghiệm 4 thu được kim loại sau phản ứng.
⇒ Chọn đáp án C Đáp án: C
⍟ Thí nghiệm 1: 2Na + 2H2O
 2NaOH + H2
2NaOH + H22NaOH + ZnSO4
 Na2SO4 + Zn(OH)2
Na2SO4 + Zn(OH)22NaOH + Zn(OH)2
 Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O⍟ Thí nghiệm 2: Fe(NO3)2 + AgNO3
 Fe(NO3)3 + Ag
Fe(NO3)3 + Ag⍟ Thí nghiệm 3: CaCO3
 CaO + CO2
CaO + CO2⍟ Thí nghiệm 4: CuO + H2
 Cu + H2O
Cu + H2O⟶ Chỉ có thí nghiệm 2 và thí nghiệm 4 thu được kim loại sau phản ứng.
⇒ Chọn đáp án C Đáp án: C
Câu 5 [704022]: Cấu hình electron nào sau đây ứng với nguyên tố có độ âm điện lớn nhất?
A, 1s22s22p5.
B, 1s22s22p6.
C, 1s22s22p63s1.
D, 1s22s2.
Phân tích các nguyên tố:
A.1s22s22p5 → có 7e lớp ngoài cùng → là nguyên tố phi kim
B. 1s22s22p6 → có 8e lớp ngoài cùng → là nguyên tố khí hiếm
C. 1s22s22p63s1 → có 1e lớp ngoài cùng → là nguyên tố kim loại
D. 1s22s2 → có 2e lớp ngoài cùng → là nguyên tố kim loại
Độ âm điện của các chất được sắp xếp theo chiều giảm dần như sau: Phi kim > Kim loại > Khí hiếm.
⇒ Chọn đáp án A Đáp án: A
A.1s22s22p5 → có 7e lớp ngoài cùng → là nguyên tố phi kim
B. 1s22s22p6 → có 8e lớp ngoài cùng → là nguyên tố khí hiếm
C. 1s22s22p63s1 → có 1e lớp ngoài cùng → là nguyên tố kim loại
D. 1s22s2 → có 2e lớp ngoài cùng → là nguyên tố kim loại
Độ âm điện của các chất được sắp xếp theo chiều giảm dần như sau: Phi kim > Kim loại > Khí hiếm.
⇒ Chọn đáp án A Đáp án: A
Câu 6 [704023]: Kim loại nào đây phản ứng chậm với nước ở điều kiện thường?
A, Na.
B, Ba.
C, K.
D, Mg.
- Na, Ba, K là các kim loại có tính khử mạnh nên phản ứng mạnh với nước.
2Na + 2H2O ⟶ 2NaOH + H2
2K + 2H2O ⟶ 2KOH + H2
Ba+ 2H2O ⟶ Ba(OH)2 + H2
- Ở nhiệt độ thường, Mg phản ứng rất chậm với nước vì nó có lớp màng oxide (MgO) mỏng bảo vệ bề mặt, ngăn cản nước tiếp xúc trực tiếp với kim loại.
⇒ Chọn đáp án D Đáp án: D
2Na + 2H2O ⟶ 2NaOH + H2
2K + 2H2O ⟶ 2KOH + H2
Ba+ 2H2O ⟶ Ba(OH)2 + H2
- Ở nhiệt độ thường, Mg phản ứng rất chậm với nước vì nó có lớp màng oxide (MgO) mỏng bảo vệ bề mặt, ngăn cản nước tiếp xúc trực tiếp với kim loại.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [704024]: Phương pháp nào sau đây không dùng để xác định phân tử khối của một chất?
A, Phương pháp xác định tỉ khối hơi/khí.
B, Phương pháp xác định qua độ hạ băng điểm.
C, Phương pháp phổ khối lượng (MS).
D, Phương pháp phổ hồng ngoại (IR).
Phổ hồng ngoại (hay quang phổ hồng ngoại, tiếng Anh: Infrared Spectroscopy, viết tắt là phổ IR) là phép đo sự tương tác của bức xạ hồng ngoại với vật chất bằng hiện tượng hấp thụ, phát xạ hoặc phản xạ. Phổ IR được sử dụng để nghiên cứu và xác định hóa chất hoặc nhóm chức ở dạng rắn, lỏng hoặc khí.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 8 [304839]: Thủy phân etser X trong dung dịch acid, thu được CH3COOH và CH3OH. Công thức cấu tạo của X là
A, HCOOC2H5.
B, CH3COOC2H5.
C, C2H5COOCH3.
D, CH3COOCH3.
Phân tích phản ứng:
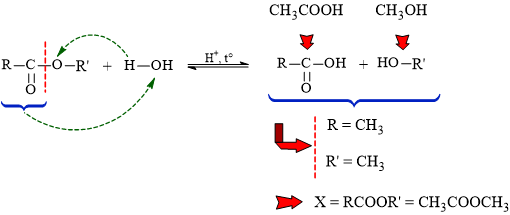
⟹ Vậy ester X là methyl acetate: CH3COOCH3
⟹ Chọn đáp án D Đáp án: D

⟹ Vậy ester X là methyl acetate: CH3COOCH3
⟹ Chọn đáp án D Đáp án: D
Câu 9 [308506]: Trong phân tử chất nào sau đây có chứa nguyên tố nitrogen?
A, Glucose.
B, Ethyl acetate.
C, Methylamine.
D, Saccharose.
Công thức phân tử của:
❌A. Glucose: C6H12O6
❌B. Ethyl acetate: C4H8O
✔️C. Methylamine: CH5N
❌D. Saccharose:C12H22O11
⇒ Phân tử của Methylamine chứa nguyên tố nitrogen.
⇒ Chọn đáp án C Đáp án: C
❌A. Glucose: C6H12O6
❌B. Ethyl acetate: C4H8O
✔️C. Methylamine: CH5N
❌D. Saccharose:C12H22O11
⇒ Phân tử của Methylamine chứa nguyên tố nitrogen.
⇒ Chọn đáp án C Đáp án: C
Câu 10 [308409]: Phân tử tinh bột được cấu tạo từ các gốc
A, β-fructose.
B, α-fructose.
C, β-glucose.
D, α-glucose.
HD: Tinh bột là polysaccharide, gồm hai poymer nhỏ hơn là amylose và amylopectin. Tinh bột có công thức phân tử là (C6H10O5)n được tạo bởi các mắt xích α-glucose
⇝ Chọn đáp án D Đáp án: D
⇝ Chọn đáp án D Đáp án: D
Câu 11 [704025]: Kim loại magnesium và hợp kim của nó là những chất nguy hiểm dễ nổ; chúng rất dễ cháy ở dạng tinh khiết khi nóng chảy. Ở nhiệt độ này, kim loại magnesium phản ứng được với các chất có thể coi là trơ như H2O, SiO2, CO2,… Tuy nhiên, để bắt đầu phản ứng cháy, kim loại magnesium cần phải được cung cấp một nguồn năng lượng nhiệt ban đầu và do đó khi ở nhiệt độ phòng thì magnesium sẽ ít tham gia phản ứng. Năng lượng tỏa ra khi kim loại magnesium rất lớn, nó phát ra ánh sáng trắng sáng chứa tia cực tím có thể gây tổn thương vĩnh viễn cho mắt. Các đám cháy kim loại magnesium gần như không thể bị dập tắt mà chỉ có thể hạn chế bằng cách không để đám cháy lan rộng và đợi cho kim loại magnesium phản ứng hết. Cho các phát biểu sau:
(a) Cần sử dụng kính an toàn có bảo vệ mắt khi đốt magnesium.
(b) Các đám cháy magnesium tỏa ra một lượng nhiệt rất lớn.
(c) Có thể dập tắt các đám cháy kim loại magnesium bằng nước, cát.
(d) Khi có đám cháy kim loại cần làm mát các khu vực tiếp xúc và đảm bảo đám cháy không lan sang các khu vực xung quanh.
Các phát biểu đúng là
(a) Cần sử dụng kính an toàn có bảo vệ mắt khi đốt magnesium.
(b) Các đám cháy magnesium tỏa ra một lượng nhiệt rất lớn.
(c) Có thể dập tắt các đám cháy kim loại magnesium bằng nước, cát.
(d) Khi có đám cháy kim loại cần làm mát các khu vực tiếp xúc và đảm bảo đám cháy không lan sang các khu vực xung quanh.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (b), (d).
C, (a), (c), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Khi cháy magnisium phát ra ánh sáng chứa tia cực tím có thể gây tổn thương cho mắt.
✔️ (b) Đúng. Khi cháy magnisium tỏa ra lượng nhiệt rất lớn.
❌ (c) Sai. Không dùng nước, cát khô để dập tắt đám cháy magie vì magie phản ứng với nước, cát nóng sinh ra hydrogen, silicon có thể xảy ra một vụ nổ hơi làm văng các kim loại này đi khắp nơi dẫn đến đám cháy lan rộng.
Mg + H2O MgO + H2
MgO + H2
SiO2 + 2Mg 2MgO + Si
2MgO + Si
✔️ (d) Đúng. Đám cháy Mg gần như không thể dập tắt, chỉ có thể hạn chế bằng cách không để đám cháy lan rộng và đợi cho kim loại Mg phản ứng hết.
⟶ Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Khi cháy magnisium phát ra ánh sáng chứa tia cực tím có thể gây tổn thương cho mắt.
✔️ (b) Đúng. Khi cháy magnisium tỏa ra lượng nhiệt rất lớn.
❌ (c) Sai. Không dùng nước, cát khô để dập tắt đám cháy magie vì magie phản ứng với nước, cát nóng sinh ra hydrogen, silicon có thể xảy ra một vụ nổ hơi làm văng các kim loại này đi khắp nơi dẫn đến đám cháy lan rộng.
Mg + H2O
 MgO + H2
MgO + H2SiO2 + 2Mg
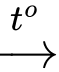 2MgO + Si
2MgO + Si✔️ (d) Đúng. Đám cháy Mg gần như không thể dập tắt, chỉ có thể hạn chế bằng cách không để đám cháy lan rộng và đợi cho kim loại Mg phản ứng hết.
⟶ Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 12 [704026]: Phát biểu nào sau đây về sulfur dioxide (SO2) là không đúng?
A, Có độc tính đối với con người.
B, Dùng để tẩy trắng giấy, vải, sợi, đường.
C, Phản ứng được với đá vôi ở ngay nhiệt độ thường.
D, Được tạo thành từ hoạt động của núi lửa trong tự nhiên.
Phân tích các phát biểu:
✔️A. Đúng. Sulfur dioxide là khí độc, hít thở không khí chứa sulfur dioxide vượt ngưỡng cho phép sẽ gây viêm đường hô hấp.
✔️B. Đúng. Do có khả năng tẩy trắng và diệt khuẩn, sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,...
❌ C. Sai. Sulfur dioxide phản ứng với đá vôi cần cung cấp nhiệt độ.
✔️D. Đúng. SO2 chủ yếu được phát sinh từ các hoạt động công nghiệp như đốt cháy nhiên liệu hóa thạch (than, dầu, khí tự nhiên) và từ các quá trình luyện kim. Trong tự nhiên, SO2 cũng được thải ra qua các hiện tượng phun trào núi lửa.
⇒ Chọn đáp án C Đáp án: C
✔️A. Đúng. Sulfur dioxide là khí độc, hít thở không khí chứa sulfur dioxide vượt ngưỡng cho phép sẽ gây viêm đường hô hấp.
✔️B. Đúng. Do có khả năng tẩy trắng và diệt khuẩn, sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,...
❌ C. Sai. Sulfur dioxide phản ứng với đá vôi cần cung cấp nhiệt độ.
✔️D. Đúng. SO2 chủ yếu được phát sinh từ các hoạt động công nghiệp như đốt cháy nhiên liệu hóa thạch (than, dầu, khí tự nhiên) và từ các quá trình luyện kim. Trong tự nhiên, SO2 cũng được thải ra qua các hiện tượng phun trào núi lửa.
⇒ Chọn đáp án C Đáp án: C
Câu 13 [704027]: Các đồng phân của pentane C5H12 đều có phương trình đốt cháy là
C5H12 + 8O2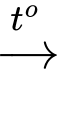 5CO2 + 6H2O
5CO2 + 6H2O
Tuy nhiên các giá trị ∆Ho cho sự đốt cháy của ba đồng phân pentane là khác nhau:
CH3CH2CH2CH2CH3 = –3536 kJ/mol
(CH3)2CHCH2CH3 = –3529 kJ/mol
(CH3)4C = –3515 kJ/mol
Từ các kết quả trên, một giả thuyết được đưa ra: “Cấu tạo mạch của các đồng phân alkane ảnh hưởng đến độ bền của một hợp chất, mạch càng nhiều nhánh thì độ bền càng lớn”. Giả sử giả thuyết này đúng với các hợp chất alkane, đồng phân nào sau đây của C8H18 (octane) là bền nhất?
C5H12 + 8O2
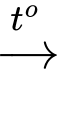 5CO2 + 6H2O
5CO2 + 6H2OTuy nhiên các giá trị ∆Ho cho sự đốt cháy của ba đồng phân pentane là khác nhau:
CH3CH2CH2CH2CH3 = –3536 kJ/mol
(CH3)2CHCH2CH3 = –3529 kJ/mol
(CH3)4C = –3515 kJ/mol
Từ các kết quả trên, một giả thuyết được đưa ra: “Cấu tạo mạch của các đồng phân alkane ảnh hưởng đến độ bền của một hợp chất, mạch càng nhiều nhánh thì độ bền càng lớn”. Giả sử giả thuyết này đúng với các hợp chất alkane, đồng phân nào sau đây của C8H18 (octane) là bền nhất?
A, n-octane.
B, 2-methylheptane.
C, 2,3,4-trimethylpentane.
D, 1,2,3-trimethylpentane.
Cấu tạo mạch của các đồng phân alkane ảnh hưởng đến độ bền của một hợp chất. Mạch càng nhiều nhánh thì độ bền càng lớn.
Cấu trúc các đồng phân của C8H18 (octane) như sau:
A. n-octane:
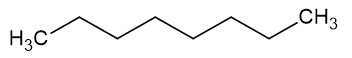
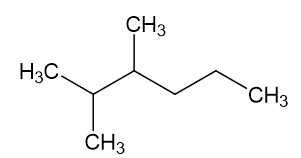
B. 2-methylheptane:
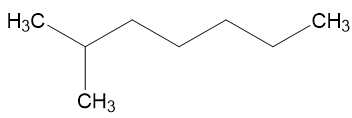
C. 2,3,4-trimethylpentane:
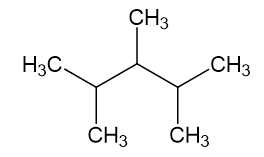
D. 2,3-trimethylpentane:
⟶ Đồng phân 2,3,4-trimethylpentane có nhiều nhánh nhất nên sẽ bền nhất.
⇒ Chọn đáp án C Đáp án: C
Cấu trúc các đồng phân của C8H18 (octane) như sau:
A. n-octane:

B. 2-methylheptane:

C. 2,3,4-trimethylpentane:

D. 2,3-trimethylpentane:

⟶ Đồng phân 2,3,4-trimethylpentane có nhiều nhánh nhất nên sẽ bền nhất.
⇒ Chọn đáp án C Đáp án: C
Câu 14 [304093]: Ester nào sau đây là ester no, đơn chức, mạch hở?
A, CH3COOC6H5.
B, HCOOCH=CH2.
C, CH3COOCH3.
D, (HCOO)2C2H4.
HD: phân tích cấu tạo các chất trong 4 phương án:
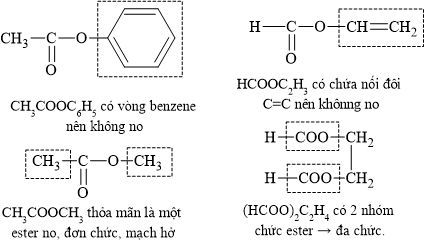
⇒ ester no đơn chức, mạch hở là CH3COOOCH3
⇝ Chọn đáp án C Đáp án: C

⇒ ester no đơn chức, mạch hở là CH3COOOCH3
⇝ Chọn đáp án C Đáp án: C
Câu 15 [704028]: “Peptide là những hợp chất hữu cơ được hình thành từ các đơn vị …(1)… liên kết với nhau qua liên kết …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, α-amine, peptide (-CONH-).
B, α-hydroxy acid, ester (-COO-).
C, α-carbonyl acid, ether (-C-O-C-).
D, α-amino aicd, peptide (-CONH-).
Các α-amino acid kết nối với nhau để tạo thành chuỗi peptide thông qua liên kết giữa nhóm carboxyl (-COOH) của một amino acid với nhóm amin (-NH2) của amino acid kế tiếp, gọi là liên kết peptide (-CONH-).
Peptide là những hợp chất hữu cơ được hình thành từ các đơn vị α-amino acid liên kết với nhau qua liên kết peptide (-CONH-).
⇒ Chọn đáp án D Đáp án: D
Peptide là những hợp chất hữu cơ được hình thành từ các đơn vị α-amino acid liên kết với nhau qua liên kết peptide (-CONH-).
⇒ Chọn đáp án D Đáp án: D
Câu 16 [704029]: Histidine là một trong 20 loại amino acid có trong protein. Phân tử histidine được proton hóa hoàn toàn được hiển thị ở đây, trong đó các con số biểu thị Ka của các nhóm tương ứng:
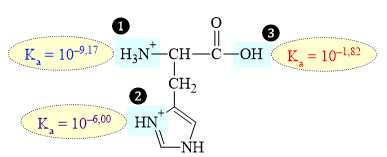
Biết rằng ion H+ đầu tiên sẽ tách ra khỏi nhóm acid mạnh nhất, sau đó là nhóm acid mạnh tiếp theo,… Sau khi tách ion H+ của nhóm nào thì tạo ra được phân tử trung hòa về điện?

Biết rằng ion H+ đầu tiên sẽ tách ra khỏi nhóm acid mạnh nhất, sau đó là nhóm acid mạnh tiếp theo,… Sau khi tách ion H+ của nhóm nào thì tạo ra được phân tử trung hòa về điện?
A, Nhóm ❶.
B, Nhóm ❷.
C, Nhóm ❸.
D, Không tách H+.
Ka càng lớn tính acid càng mạnh → thứ tự tách H+ là 3 > 2 > 1.
Quá trình proton hóa hoàn toàn phân tử histidine được diễn ra như sau:
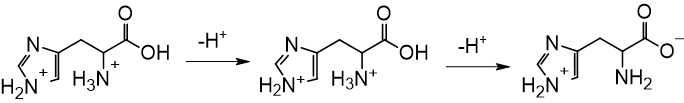
Từ đó thấy được sau khi tách ion H+ của nhóm số 2 thì tạo ra được phân tử trung hòa về điện.
⇒ Chọn đáp án B Đáp án: B
Quá trình proton hóa hoàn toàn phân tử histidine được diễn ra như sau:

Từ đó thấy được sau khi tách ion H+ của nhóm số 2 thì tạo ra được phân tử trung hòa về điện.
⇒ Chọn đáp án B Đáp án: B
Sử dụng đoạn thông tin dưới đây để trả lời câu 17 và câu 18:
Một pin Gavani được thiết lập dựa trên hai bán phản ứng chuẩn sau:
Cd2+(aq) + 2e → Cd(s) E = – 0,40 V.
Sn2+(aq) + 2e → Sn(s) E = – 0,14 V.
Cd2+(aq) + 2e → Cd(s) E = – 0,40 V.
Sn2+(aq) + 2e → Sn(s) E = – 0,14 V.
Câu 17 [704030]: Ở anode pin diễn ra
A, sự khử ion Sn2+.
B, sự mất electron của Cd.
C, quá trình oxi hóa Sn.
D, quá trình khử ion Cd2+.
Phản ứng tại anode là sự oxi hóa (mất electron). Vì thế điện cực chuẩn của Cd thấp hơn, Cd sẽ bị oxi hóa tại anode.
Phản ứng tại anode: Cd → Cd2+ + 2e
⇒ Chọn đáp án B Đáp án: B
Phản ứng tại anode: Cd → Cd2+ + 2e
⇒ Chọn đáp án B Đáp án: B
Câu 18 [704031]: Giá trị sức điện động lớn nhất của pin trên là bao nhiêu?
A, 0,26 V.
B, 0,54 V.
C, 0,36 V.
D, 0,40 V.
Ta có: 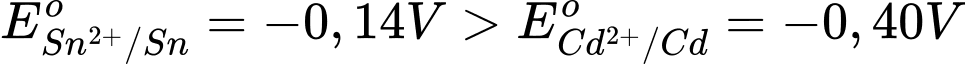
→ Cd là điện cực anode, Sn là điện cực cathode.
Phản ứng hóa học Sn2+ + Cd ⟶Sn + Cd2+
Anode (-): Cd ⟶Cd2+ + 2e
Cathode (+): Sn2+ + 2e ⟶Sn
→ Sức điện động của pin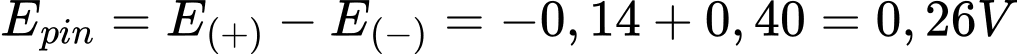
⇒ Chọn đáp án A Đáp án: A
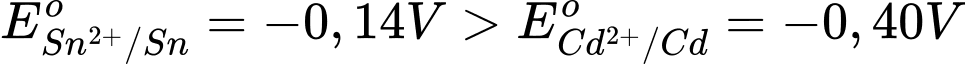
→ Cd là điện cực anode, Sn là điện cực cathode.
Phản ứng hóa học Sn2+ + Cd ⟶Sn + Cd2+
Anode (-): Cd ⟶Cd2+ + 2e
Cathode (+): Sn2+ + 2e ⟶Sn
→ Sức điện động của pin
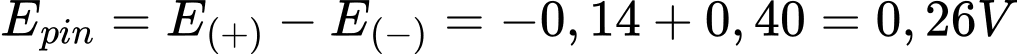
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704032]: Trong các phòng thí nghiệm, khi pha chế dung dịch của ion Fe3+ thường sẽ không thu được nồng độ theo như mong muốn về mặt tính toán lí thuyết. Lí do là vì trong dung dịch nước, ion Fe3+ bị hydrate hóa và thủy phân theo cân bằng sau:
Fe3+ + 6H2O → [Fe(H2O)6]3+
[Fe(H2O)6]3+ + H2O [Fe(OH)(H2O)5]2+ + H3O+; Ka = 10–2,56
[Fe(OH)(H2O)5]2+ + H3O+; Ka = 10–2,56
Tiến hành hòa tan 4g Fe2(SO4)3 vào nước để tạo thành 100 mL dung dịch X.
Fe3+ + 6H2O → [Fe(H2O)6]3+
[Fe(H2O)6]3+ + H2O
 [Fe(OH)(H2O)5]2+ + H3O+; Ka = 10–2,56
[Fe(OH)(H2O)5]2+ + H3O+; Ka = 10–2,56Tiến hành hòa tan 4g Fe2(SO4)3 vào nước để tạo thành 100 mL dung dịch X.
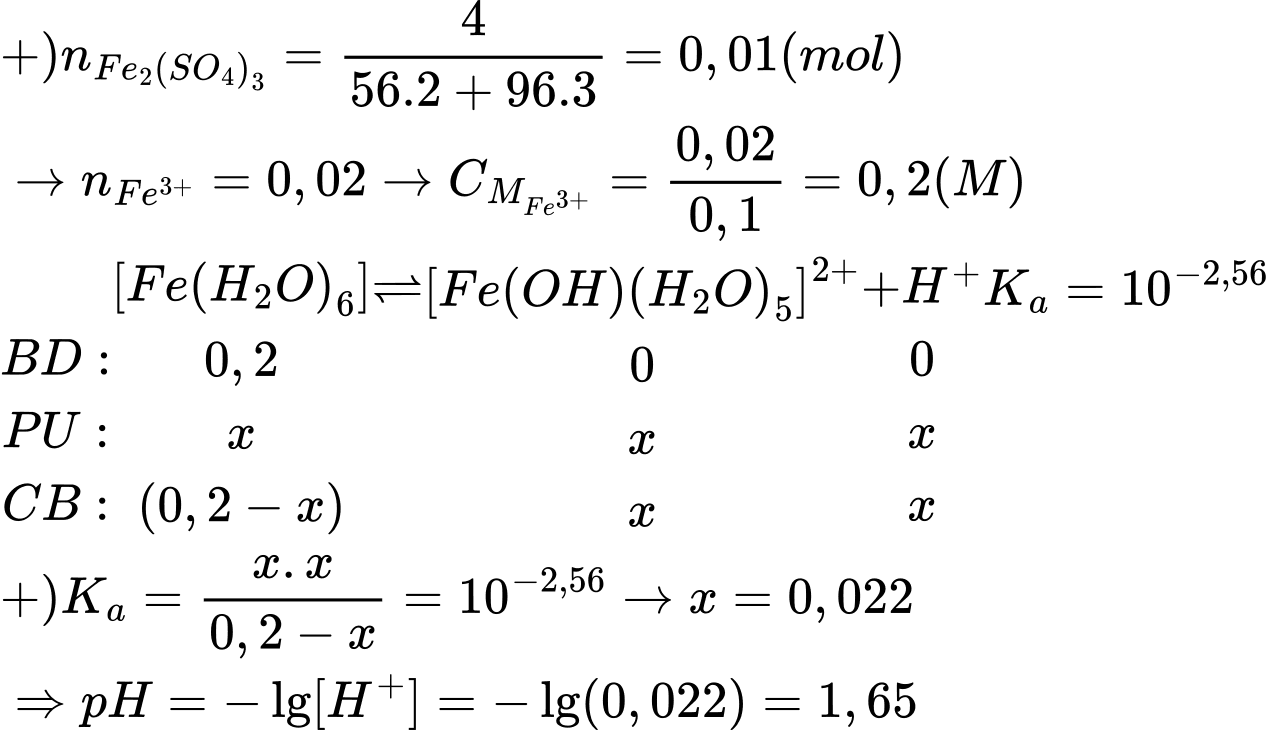
Phân tích các phát biểu:
✔️ a. Đúng. Theo thuyết Brønsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion. → Fe3+ đóng vai trò là acid theo thuyết Brønsted – Lowry vì nhường đi H+.
❌ b. Sai. Giá trị pH của dung dịch là 1,65.
❌ c. Sai. Phần trăm [Fe(H2O)6]3+ bị thủy phân là:
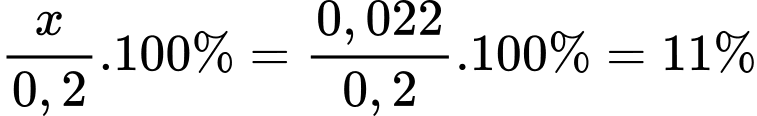
✔️ d. Đúng. Khi thêm HCl vào cân bằng, cân bằng sẽ chuyển dịch theo chiều làm giảm H+ (chính là H3O+), là chiều nghịch nên hạn chế được quá trình thủy phân.
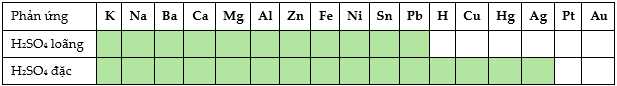
Câu 20 [704033]: Dung dịch sulfuric acid H2SO4 ở nồng độ loãng và đặc thể hiện khả năng oxi hóa rất khác nhau do đó các kim loại cũng sẽ thể hiện khả năng phản ứng khác nhau khi tương tác với chúng, điều này được thể hiện trong biểu đồ sau:
Đồng thời tiến hành thí nghiệm sau:
▪ Bước 1: Chuẩn bị hai ống nghiệm có ghi số (1) và (2).
▪ Ống nghiệm (1) chứa dung dịch sulfuric acid loãng 10 %.
▪ Ống nghiệm (2) chứa dung dịch sulfuric acid đặc 70 %.
⇝ Cho vào cả hai ống nghiệm một lá đồng.
▪ Bước 2: Đậy mỗi ống nghiệm bằng bông tẩm nước.
▪ Bước 3: Đun hai ống nghiệm trên ngọn lửa đèn cồn. Sau một thời gian, dùng mẩu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Đồng thời tiến hành thí nghiệm sau:

▪ Bước 1: Chuẩn bị hai ống nghiệm có ghi số (1) và (2).
▪ Ống nghiệm (1) chứa dung dịch sulfuric acid loãng 10 %.
▪ Ống nghiệm (2) chứa dung dịch sulfuric acid đặc 70 %.
⇝ Cho vào cả hai ống nghiệm một lá đồng.
▪ Bước 2: Đậy mỗi ống nghiệm bằng bông tẩm nước.
▪ Bước 3: Đun hai ống nghiệm trên ngọn lửa đèn cồn. Sau một thời gian, dùng mẩu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Phân tích các phát biểu:
❌ a. Sai. Ở ống nghiệm (1) chứa dung dịch H2SO4 loãng không có khả năng phản ứng với Cu nên không xảy ra phản ứng hóa học.
✔️ b. Đúng. Phản ứng của Cu với H2SO4 đặc tạo ra SO2, NaOH trong bông sẽ phản ứng với SO2 ngăn cho SO2 thoát ra ngoài:
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
SO2 + 2NaOH Na2SO3 + H2O
Na2SO3 + H2O
❌ c. Sai. Ống nghiệm (1) không xảy ra phản ứng hóa học nên acid còn nguyên, mẫu giấy quỳ tím kiểm tra pH trên ống nghiệm (1) chuyển thành màu xanh.
❌ d. Sai. Phản ứng của Cu với H2SO4 đặc tạo ra SO2 chứng minh 2H+,SO4/SO2,H2O có tính oxi hóa mạnh hơn Cu2+/Cu.
❌ a. Sai. Ở ống nghiệm (1) chứa dung dịch H2SO4 loãng không có khả năng phản ứng với Cu nên không xảy ra phản ứng hóa học.
✔️ b. Đúng. Phản ứng của Cu với H2SO4 đặc tạo ra SO2, NaOH trong bông sẽ phản ứng với SO2 ngăn cho SO2 thoát ra ngoài:
Cu + 2H2SO4 đặc
 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2OSO2 + 2NaOH
 Na2SO3 + H2O
Na2SO3 + H2O❌ c. Sai. Ống nghiệm (1) không xảy ra phản ứng hóa học nên acid còn nguyên, mẫu giấy quỳ tím kiểm tra pH trên ống nghiệm (1) chuyển thành màu xanh.
❌ d. Sai. Phản ứng của Cu với H2SO4 đặc tạo ra SO2 chứng minh 2H+,SO4/SO2,H2O có tính oxi hóa mạnh hơn Cu2+/Cu.
Câu 21 [704034]: Saccharose có phản ứng với copper(II) hydroxide tương tự như glucose, thí nghiệm được tiến hành như sau:
▪ Bước 1: Cho vào ống nghiệm khoảng 0,5 mL dung dịch NaOH 10 % và khoảng 0,5 mL dung dịch CuSO4 5 %, lắc đều.
▪ Bước 2: Thêm tiếp vào ống nghiệm khoảng 4 mL dung dịch saccharose 3 %, lắc đều ống nghiệm đến khi thu được dung dịch đồng nhất (nếu còn chất rắn thì thêm tiếp dung dịch saccharose).
▪ Bước 3: Đun nóng dung dịch trong ống nghiệm.
▪ Bước 1: Cho vào ống nghiệm khoảng 0,5 mL dung dịch NaOH 10 % và khoảng 0,5 mL dung dịch CuSO4 5 %, lắc đều.
▪ Bước 2: Thêm tiếp vào ống nghiệm khoảng 4 mL dung dịch saccharose 3 %, lắc đều ống nghiệm đến khi thu được dung dịch đồng nhất (nếu còn chất rắn thì thêm tiếp dung dịch saccharose).
▪ Bước 3: Đun nóng dung dịch trong ống nghiệm.
Phân tích các phát biểu:
✔️ a. Đúng. Mục đích của bước 1 là hình thành kết tủa nên có thể bỏ qua bước 1 và thêm trực tiếp dung dịch saccharose vào kết tủa Cu(OH)2.
✔️ b. Đúng. Tại bước 2 đã có phản ứng của dung dịch saccharose với Cu(OH)2:
2C12H22O11 + Cu(OH)2 ⟶ [Cu(C12H21O11)2] + 2H2O
✔️ c. Đúng. Saccharose có phản ứng với Cu(OH)2 chứng tỏ phân tử saccharose có ít nhất 2 nhóm OH liền kề.
❌ d. Sai. Phân tử saccharose không có khả năng mở vòng → không có nhóm chức aldehyde nên không phản ứng Cu(OH)2/OH- để tạo được Cu2O.
✔️ a. Đúng. Mục đích của bước 1 là hình thành kết tủa nên có thể bỏ qua bước 1 và thêm trực tiếp dung dịch saccharose vào kết tủa Cu(OH)2.
✔️ b. Đúng. Tại bước 2 đã có phản ứng của dung dịch saccharose với Cu(OH)2:
2C12H22O11 + Cu(OH)2 ⟶ [Cu(C12H21O11)2] + 2H2O
✔️ c. Đúng. Saccharose có phản ứng với Cu(OH)2 chứng tỏ phân tử saccharose có ít nhất 2 nhóm OH liền kề.
❌ d. Sai. Phân tử saccharose không có khả năng mở vòng → không có nhóm chức aldehyde nên không phản ứng Cu(OH)2/OH- để tạo được Cu2O.
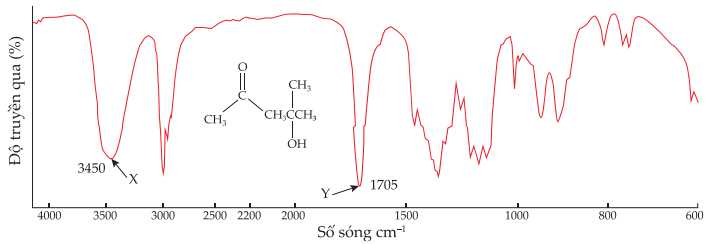
Câu 22 [704035]: 4-Hydroxy-4-methylpentan-2-one được sử dụng trong chất pha loãng sơn mài, thuốc nhuộm, trong sản xuất lụa và da nhân tạo. Cấu tạo và phổ hồng ngoại của hợp chất 4-hydroxy-4-methylpentan-2-one được cho dưới đây:
4-Hydroxy-4-methylpentan-2-one thường được điều chế từ acetone và acetaldehyde theo phương trình hóa học:
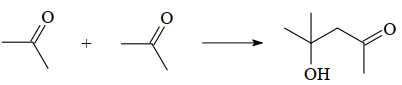

4-Hydroxy-4-methylpentan-2-one thường được điều chế từ acetone và acetaldehyde theo phương trình hóa học:
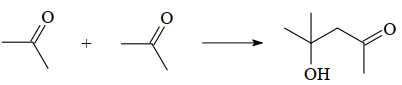
Phân tích các phát biểu:
✔️ a. Đúng. Tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trưng ở khoảng 3600-3300 cm-1.
✔️ b. Đúng. Trong phân tử X có nhiều liên kết C-H, các tín hiệu của liên kết C-H vẫn sẽ được thể hiện trên phổ hồng ngoại nhưng không thể xác định rõ vị trí của các liên kết C-H.
✔️ c. Đúng. Các chất tham gia và sản phẩm hữu cơ đều có nhóm C=O của ketone nên đều có tín hiệu Y ở số sóng 1705 cm–1.
✔️ d. Đúng. Chất sản phẩm có nhóm OH và C=O, nên sẽ có tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trung 3650-3200 cm-1 và nhóm C=O của ketone nằm trong hấp 1725-1700 cm-1.
Phân tử acetone chỉ có nhóm C=O nằm trong hấp 1725-1700 cm-1.
✔️ a. Đúng. Tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trưng ở khoảng 3600-3300 cm-1.
✔️ b. Đúng. Trong phân tử X có nhiều liên kết C-H, các tín hiệu của liên kết C-H vẫn sẽ được thể hiện trên phổ hồng ngoại nhưng không thể xác định rõ vị trí của các liên kết C-H.
✔️ c. Đúng. Các chất tham gia và sản phẩm hữu cơ đều có nhóm C=O của ketone nên đều có tín hiệu Y ở số sóng 1705 cm–1.
✔️ d. Đúng. Chất sản phẩm có nhóm OH và C=O, nên sẽ có tín hiệu của nhóm O-H (alcohol) có số sóng hấp thụ đặc trung 3650-3200 cm-1 và nhóm C=O của ketone nằm trong hấp 1725-1700 cm-1.
Phân tử acetone chỉ có nhóm C=O nằm trong hấp 1725-1700 cm-1.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704036]: Một mẫu quặng bauxite có chứa 40% Al2O3. Người ta dùng 500 tấn quặng bauxite để điều chế nhôm bằng phương pháp điện phân nóng chảy Al2O3, giả sử toàn bộ lượng nhôm điều chế được dùng để sản xuất một loại dây cáp nhôm thì sản xuất được x km cáp. Biết rằng khối lượng nhôm trong 1 km dây cáp là 1074 kg và hiệu suất của quá trình điều chế nhôm là 80%. Giá trị của x là bao nhiêu (làm tròn đến )?
Đổi 500 tấn = 500000 kg
Khối lượng của Al2O3 là 500000.40% = 200000 kg
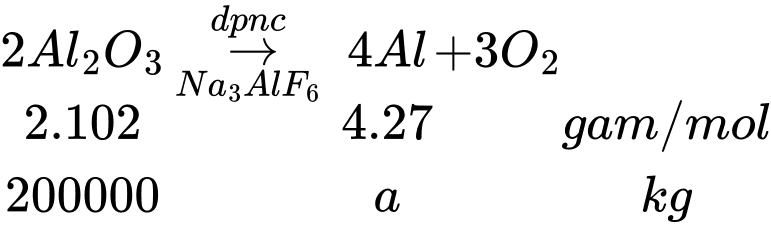
Khối lượng nhôm thu được là:
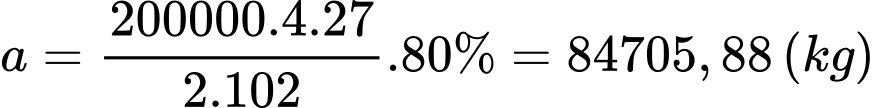
Chiều dài của dây cáp là:
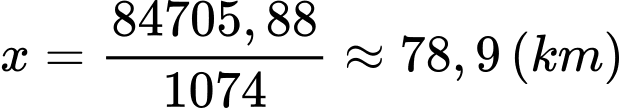
⇒ Điền đáp án: 78,9
Khối lượng của Al2O3 là 500000.40% = 200000 kg
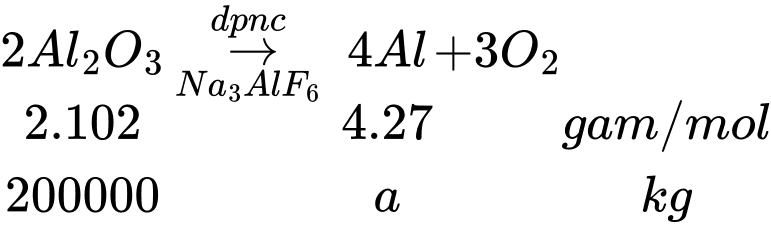
Khối lượng nhôm thu được là:
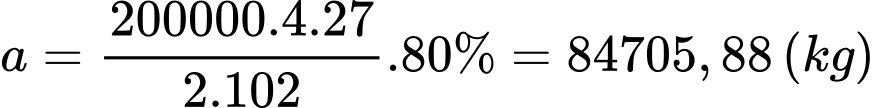
Chiều dài của dây cáp là:
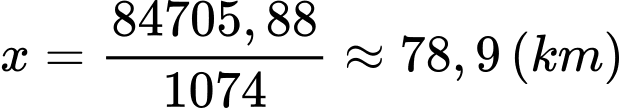
⇒ Điền đáp án: 78,9
Câu 24 [704037]: Chất béo E có phân tử khối là 858, thuỷ phân hoàn toàn 1 mol E trong dung dịch NaOH dư, thu được 1 mol muối sodium palmitate và 2 mol sodium oleate. Biết phân tử khối của sodium palmitate là 278, giá trị phân tử khối của sodium oleate là bao nhiêu?
Phản ứng tổng quát khi thủy phân chất béo E trong NaOH là:
(RCOO)3C3H5 + 3NaOH ⟶ 1 Sodium palmitate + 2 Sodium oleate + C3H5(OH)3
Bảo toàn khối lượng ta có:
M(RCOO)3C3H5 + 3MNaOH = MSodium palmitate + 2MSodium oleate + MC3H5(OH)3
⇔ 858 + 3.40 = 278 + 2MSodium oleate + 92
⇔ MSodium oleate = 304 (g/mol)
⇒ Điền đáp án: 304
(RCOO)3C3H5 + 3NaOH ⟶ 1 Sodium palmitate + 2 Sodium oleate + C3H5(OH)3
Bảo toàn khối lượng ta có:
M(RCOO)3C3H5 + 3MNaOH = MSodium palmitate + 2MSodium oleate + MC3H5(OH)3
⇔ 858 + 3.40 = 278 + 2MSodium oleate + 92
⇔ MSodium oleate = 304 (g/mol)
⇒ Điền đáp án: 304
Câu 25 [704038]: Ứng với công thức phân tử C4H9NO2 có bao nhiêu amino acid là đồng phân cấu tạo của nhau?
Công thức phân tử C4H9NO2 có 5 amino acid là đồng phân cấu tạo của nhau như sau:
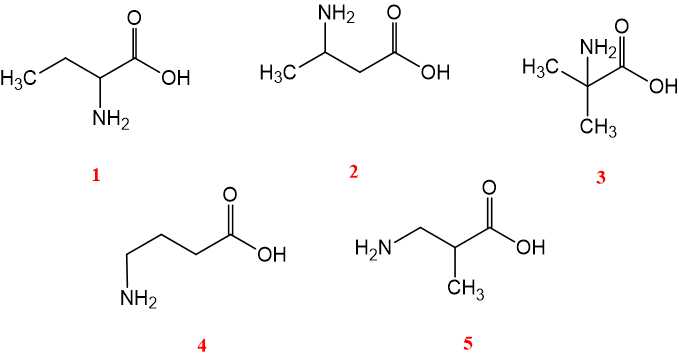
⇒ Điền đáp án: 5

⇒ Điền đáp án: 5
Câu 26 [704039]: Một nhóm học sinh tiến hành nhận biết ion kim loại Ca2+ trong dung dịch muối theo các bước trong một quy trình như sau:
(1) Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl để hòa tan kết tủa, lắc đều.
(2) Thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3 lắc đều thì xuất hiện kết tủa.
(3) Quan sát màu sắc của kết tủa và hiện tượng các bong bóng khí xuất hiện.
(4) Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2.
Gán số thứ tự các bước trên theo dãy bốn số để có thứ tự quy trình đúng (ví dụ: 1234, 4321, ...).
(1) Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl để hòa tan kết tủa, lắc đều.
(2) Thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3 lắc đều thì xuất hiện kết tủa.
(3) Quan sát màu sắc của kết tủa và hiện tượng các bong bóng khí xuất hiện.
(4) Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2.
Gán số thứ tự các bước trên theo dãy bốn số để có thứ tự quy trình đúng (ví dụ: 1234, 4321, ...).
Quy trình nhận biết ion kim loại Ca2+ trong dung dịch muối theo các bước sau:
Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2 ⟶ (4)
Bước 2: Thêm từ từ cho đến hết 10 giọt dung dịch Na2CO3 lắc đều thì xuất hiện kết tủa ⟶ (2)
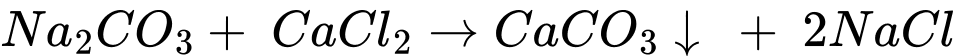
Bước 3: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl để hòa tan kết tủa, lắc đều ⟶ (1)
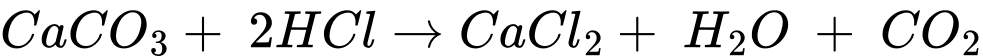
Bước 4: Quan sát màu sắc của kết tủa và hiện tượng các bong bóng khí xuất hiện ⟶ (3)
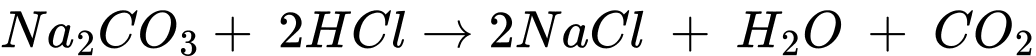
⇒ Điền đáp án: 4213
Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2 ⟶ (4)
Bước 2: Thêm từ từ cho đến hết 10 giọt dung dịch Na2CO3 lắc đều thì xuất hiện kết tủa ⟶ (2)
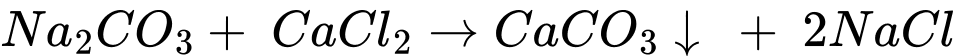
Bước 3: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl để hòa tan kết tủa, lắc đều ⟶ (1)
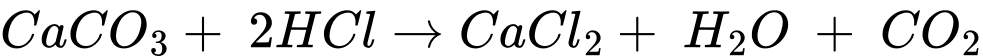
Bước 4: Quan sát màu sắc của kết tủa và hiện tượng các bong bóng khí xuất hiện ⟶ (3)
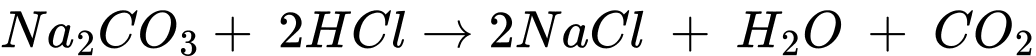
⇒ Điền đáp án: 4213
Câu 27 [704040]: Hydrocarbon Q mạch hở là chất khí ở điều kiện thường, tỉ lệ phần trăm về khối lượng của nguyên tố C và H lần lượt là 92,31% và 7,69%. Trong phổ khối khối lượng của Q có peak ion phân tử [Q+] có giá trị m/z = 26. Khí Q được ủng dụng trong hàn và cắt kim loại do nhiệt độ ngọn lửa khi Q cháy trong oxygen có thể lên tới 3000 °C. Một người thợ cắt một tấm thép dày 4 mm với diện tích S (m) cần dùng hết 49,58 lít khí Q (ở đkc). Biết rằng, đốt cháy 1 mol Q tỏa ra lượng nhiệt là 1250 kJ, có 25% nhiệt đốt cháy bị thất thoát ra môi trường và để cắt mỗi cm tấm thép trên cần cung cấp 75 J năng lượng nhiệt. Tính S.
Đốt cháy 1 mol Q nhiệt lượng tỏa ra là 1250 kJ
Số mol của Q là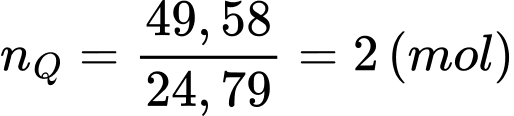
Đổi 4 mm = 0,4 cm; S m2 = 10000S cm2
Nhiệt lượng thất thoát ra ngoài môi trường là 25% nên hiệu suất chuyển hóa nhiệt là 75%
Thể tích của tấm thép là:
V = 0,4.10 000S = 4000S (cm3)
Biết rằng để cắt mỗi cm3 của tấm thép cần cung cấp nhiệt lượng là 75 J.
Nhiệt lượng cần dùng để cắt tấm thép là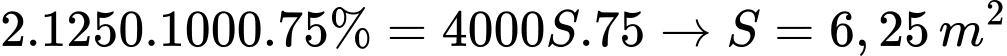
⇒ Điền đáp án: 6,25
Số mol của Q là
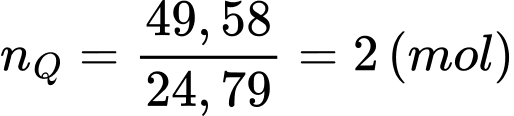
Đổi 4 mm = 0,4 cm; S m2 = 10000S cm2
Nhiệt lượng thất thoát ra ngoài môi trường là 25% nên hiệu suất chuyển hóa nhiệt là 75%
Thể tích của tấm thép là:
V = 0,4.10 000S = 4000S (cm3)
Biết rằng để cắt mỗi cm3 của tấm thép cần cung cấp nhiệt lượng là 75 J.
Nhiệt lượng cần dùng để cắt tấm thép là
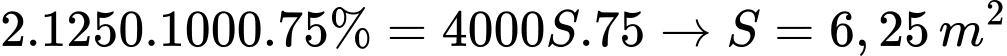
⇒ Điền đáp án: 6,25
Câu 28 [704041]: Một mẫu phân bón chứa nguyên tố phosphorus. Tiến hành các bước thí nghiệm để tính hàm lượng phosphorus (P) trong mẫu phân bón trên:
Bước 1: Phân tích 2,684 gam mẫu phân bón và toàn bộ nguyên tố phosphorus được hìnhthành dưới dạng kết tủa (NH4)3PO4.12 MoO3.2HNO3.H2O.
Bước 2: Chia lượng kết tủa làm 100 phần bằng nhau, lấy 1 phần hòa tan trong 50,0 mL dungdịch NaOH 0,5196 M, xảy ra phản ứng theo phương trình:
(NH4)3PO4.12MoO3.2HNO3.H2O + 56NaOH ⟶24Na2MoO4 + 4NaNO3 + 2Na2HPO4 + 6NH3 +34H2O.
Bước 3: Lượng dư NaOH được trung hòa vừa đủ bởi 20,5 mL HCl 0,5 M.
Tính hàm lượng phosphorus (P) (theo gam) trong 2,684 gam phân bón ban đầu (làm tròn đến hàng phần mười).
Bước 1: Phân tích 2,684 gam mẫu phân bón và toàn bộ nguyên tố phosphorus được hìnhthành dưới dạng kết tủa (NH4)3PO4.12 MoO3.2HNO3.H2O.
Bước 2: Chia lượng kết tủa làm 100 phần bằng nhau, lấy 1 phần hòa tan trong 50,0 mL dungdịch NaOH 0,5196 M, xảy ra phản ứng theo phương trình:
(NH4)3PO4.12MoO3.2HNO3.H2O + 56NaOH ⟶24Na2MoO4 + 4NaNO3 + 2Na2HPO4 + 6NH3 +34H2O.
Bước 3: Lượng dư NaOH được trung hòa vừa đủ bởi 20,5 mL HCl 0,5 M.
Tính hàm lượng phosphorus (P) (theo gam) trong 2,684 gam phân bón ban đầu (làm tròn đến hàng phần mười).
(NH4)3PO4.12MoO3.2HNO3.H2O + 56NaOH ⟶24Na2MoO4 + 4NaNO3 + 2Na2HPO4 + 6NH3 +34H2O (*)
 (**)
(**)
Đổi 50 mL = 0,05 L; 20,5 mL = 0,0205 L
Số mol của NaOH là:
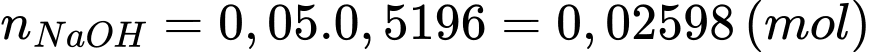
Số mol của HCl phản ứng với lượng dư NaOH là:
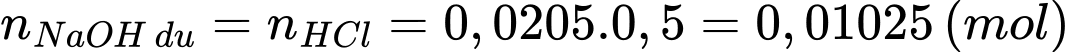
Số mol NaOH tham gia phản ứng (*) là:
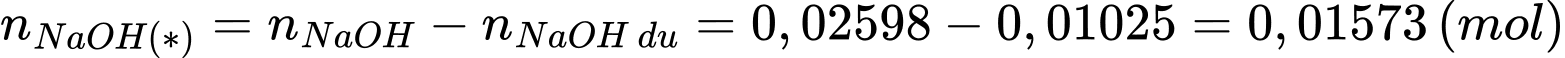
Bảo toàn nguyên tố P:

Hàm lượng phosphorus (P) trong 2,684 gam là:
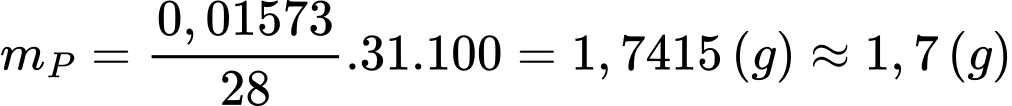
⇒ Điền đáp án: 1,7
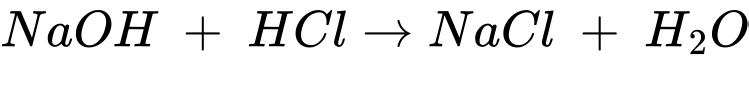 (**)
(**)Đổi 50 mL = 0,05 L; 20,5 mL = 0,0205 L
Số mol của NaOH là:
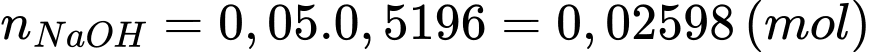
Số mol của HCl phản ứng với lượng dư NaOH là:
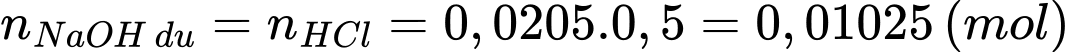
Số mol NaOH tham gia phản ứng (*) là:
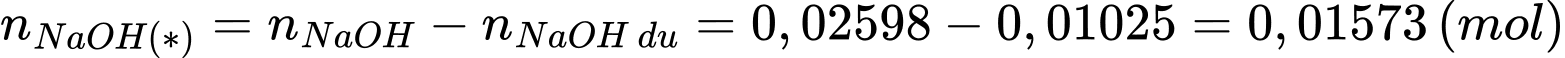
Bảo toàn nguyên tố P:

Hàm lượng phosphorus (P) trong 2,684 gam là:
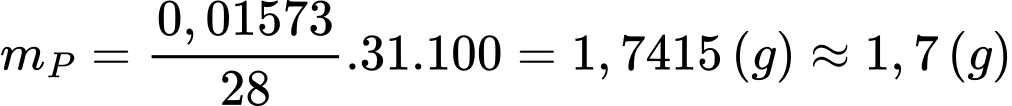
⇒ Điền đáp án: 1,7