PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704176]: “Kim loại có vẻ sáng lấp lánh (tính ánh kim) là do các ...(1)... trong tinh thể ...(2)... hầu hết những tia sáng mà mắt còn người nhìn thấy được." Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, cation, phản xạ.
B, electron tự do, phản xạ.
C, cation, hấp thụ.
D, electron tự do, hấp thụ.
Trong tinh thể kim loại, các nguyên tử kim loại sắp xếp theo một mạng tinh thể chặt chẽ. Các electron ở lớp ngoài cùng (electron hóa trị) không bị giữ chặt bởi hạt nhân mà di chuyển tự do trong mạng tinh thể, tạo thành "đám mây electron". Những electron tự do này có khả năng dao động và tương tác với ánh sáng khi nó chiếu vào bề mặt kim loại.
→ Kim loại có vẻ sáng lấp lánh (tính ánh kim) là do các electron tự do trong tinh thể phản xạ hầu hết những tia sáng mà mắt còn người nhìn thấy được.
⇒ Chọn đáp án B Đáp án: B
→ Kim loại có vẻ sáng lấp lánh (tính ánh kim) là do các electron tự do trong tinh thể phản xạ hầu hết những tia sáng mà mắt còn người nhìn thấy được.
⇒ Chọn đáp án B Đáp án: B
Câu 2 [560799]: Cho một mẩu nhỏ postassium vào nước thu được dung dịch. Giá trị pH của dung dịch sau phản ứng có thể nhận giá trị nào dưới đây?
A, pH = 11.
B, pH = 2.
C, pH = 7.
D, pH = 6.
2K + 2H2O  2KOH + H2
2KOH + H2
Phản ứng của K với nước sinh ra KOH tạo môi trường base (kiềm) mạnh nên dung dịch sau phản ứng có thể có giá trị pH = 11.
⇒ Chọn đáp án A Đáp án: A
 2KOH + H2
2KOH + H2Phản ứng của K với nước sinh ra KOH tạo môi trường base (kiềm) mạnh nên dung dịch sau phản ứng có thể có giá trị pH = 11.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [309483]: Phân tử polymer nào sau đây chỉ chứa hai nguyên tố C và H?
A, Poly(vinyl acetate).
B, Polyethylene.
C, Polyacrylonitrile.
D, Poly(vinyl chloride).
Phân tích các đáp án:
❌A. Poly(vinyl acetate): [-CH2-CH(OOCCH3)-]n: chứa các nguyên tố C, H và O.
✔️B. Polyethylene: (-CH2-CH2-)n: chỉ chứa hai nguyên tố C và H.
❌C. Polyacrylonitrile: [-CH2-CH(CN)-]n: chứa các nguyên tố C, H và N.
❌D. Poly(vinyl chloride): [-CH2-CH(Cl)-]n: chứa các nguyên tố C, H và Cl.
⇒ Chọn đáp án B Đáp án: B
❌A. Poly(vinyl acetate): [-CH2-CH(OOCCH3)-]n: chứa các nguyên tố C, H và O.
✔️B. Polyethylene: (-CH2-CH2-)n: chỉ chứa hai nguyên tố C và H.
❌C. Polyacrylonitrile: [-CH2-CH(CN)-]n: chứa các nguyên tố C, H và N.
❌D. Poly(vinyl chloride): [-CH2-CH(Cl)-]n: chứa các nguyên tố C, H và Cl.
⇒ Chọn đáp án B Đáp án: B
Câu 4 [560741]: Tại sao hợp kim được sử dụng phổ biến và rộng rãi?
A, Hợp kim cải thiện các thuộc tính còn hạn chế của kim loại.
B, Hợp kim làm cho kim loại phản ứng mạnh hơn.
C, Hợp kim làm cho kim loại ít độc hơn.
D, Hợp kim có giá thành rẻ hơn kim loại nguyên chất.
Hợp kim có nhiều tính chất hoá học tương tự kim loại thành phần nhưng tính chất vật lí thường khác nhau nhiều do đó hợp kim được sử dụng phổ biến trong đời sống và sản xuất.
+ Hợp kim có những tính chất vật lí chung như tính ánh kim, dẫn điện, dẫn nhiệt …
+ Độ cứng của hợp kim thường cứng hơn độ cứng của kim loại thành phần trong hợp kim và độ dẻo thường kém hơn.
+ Nhiệt độ nóng chảy của hợp kim tuỳ thuộc vào thành phần và cấu tạo tinh thể của hợp kim, nhưng khác so với kim loại thành phần trong hợp kim.
⇒ Hợp kim cải thiện các thuộc tính còn hạn chế của kim loại.
⇒ Chọn đáp án A Đáp án: A
+ Hợp kim có những tính chất vật lí chung như tính ánh kim, dẫn điện, dẫn nhiệt …
+ Độ cứng của hợp kim thường cứng hơn độ cứng của kim loại thành phần trong hợp kim và độ dẻo thường kém hơn.
+ Nhiệt độ nóng chảy của hợp kim tuỳ thuộc vào thành phần và cấu tạo tinh thể của hợp kim, nhưng khác so với kim loại thành phần trong hợp kim.
⇒ Hợp kim cải thiện các thuộc tính còn hạn chế của kim loại.
⇒ Chọn đáp án A Đáp án: A
Câu 5 [246576]: Nguyên tố nào sau đây thuộc khối nguyên tố d?
A, 19K.
B, 20Ca.
C, 24Cr.
D, 18Ar.
Cấu hình electron của các nguyên tố được viết như sau:
❌ A. 19K: 1s22s22p63s23p64s1 có electron cuối cùng điền vào phân lớp s.
❌ B. 20Ca: 1s22s22p63s23p64s2 có electron cuối cùng điền vào phân lớp s.
✔️ C. 24Cr: 1s22s22p63s23p63d54s1 có electron cuối cùng điền vào phân lớp d.
❌ D. 18Ar: 1s22s22p63s23p6 có electron cuối cùng điền vào phân lớp p.
⇒ Chọn đáp án C Đáp án: C
❌ A. 19K: 1s22s22p63s23p64s1 có electron cuối cùng điền vào phân lớp s.
❌ B. 20Ca: 1s22s22p63s23p64s2 có electron cuối cùng điền vào phân lớp s.
✔️ C. 24Cr: 1s22s22p63s23p63d54s1 có electron cuối cùng điền vào phân lớp d.
❌ D. 18Ar: 1s22s22p63s23p6 có electron cuối cùng điền vào phân lớp p.
⇒ Chọn đáp án C Đáp án: C
Câu 6 [61754]: Trong các khoáng vật dưới đây, khoáng vật nào không chứa CaCO3?
A, Calcite.
B, Dolomite.
C, Đá hoa.
D, Magnesite.
HD: Thành phần chính của các khoảng vật:
✔️ A. Calcite: CaCO3.
✔️ B. Dolomite: CaCO3.MgCO3.
✔️ C. Đá hoa: CaCO3.
❌ D. Magnesite: MgCO3.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Calcite: CaCO3.
✔️ B. Dolomite: CaCO3.MgCO3.
✔️ C. Đá hoa: CaCO3.
❌ D. Magnesite: MgCO3.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [561035]: M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
• Nguyên tử có 4 electron độc thân.
• Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
• Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
• Nguyên tử có 4 electron độc thân.
• Có nhiều số oxi hoá trong các hợp chất, trong đó có số oxi hoá +2 và +3.
• Ở dạng đơn chất, là kim loại nặng.
M là nguyên tố nào sau đây?
A, Cr.
B, Ni.
C, Fe.
D, Cu.
Cấu hình electron và sự phân bố electron ở các ô orbital của các nguyên tố như sau:
❌ A. Cr (Z = 24)
+ Cấu hình electron: [Ar] 3d5 4s1
+ Ô orbital:
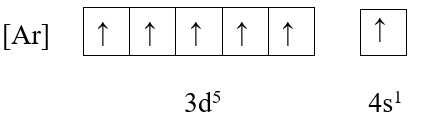
→ Có 6 electron độc thân
❌ B. Ni (Z = 28)
+ Cấu hình electron: [Ar] 3d8 4s2
+ Ô orbital:
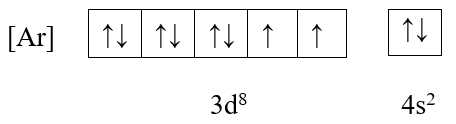
→ Có 2 electron độc thân
✔️ C. Fe (Z = 26)
+ Cấu hình electron: [Ar] 3d6 4s2
+ Ô orbital:
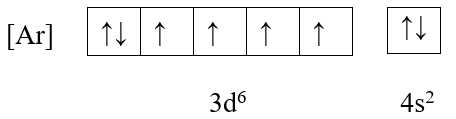
→ Có 4 electron độc thân
❌ D. Cu (Z = 29)
Cấu hình electron: [Ar] 3d10 4s1
+ Ô orbital:
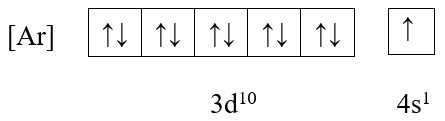
→ Có 1 electron độc thân
Vì nguyên tử M có 4 electron độc thân nên chỉ Fe là thỏa mãn. Fe có 4 electron độc thân, có số oxi hóa +2 và +3 trong hợp chất và là kim loại nặng.
⇒ Chọn đáp án C Đáp án: C
❌ A. Cr (Z = 24)
+ Cấu hình electron: [Ar] 3d5 4s1
+ Ô orbital:

→ Có 6 electron độc thân
❌ B. Ni (Z = 28)
+ Cấu hình electron: [Ar] 3d8 4s2
+ Ô orbital:

→ Có 2 electron độc thân
✔️ C. Fe (Z = 26)
+ Cấu hình electron: [Ar] 3d6 4s2
+ Ô orbital:

→ Có 4 electron độc thân
❌ D. Cu (Z = 29)
Cấu hình electron: [Ar] 3d10 4s1
+ Ô orbital:

→ Có 1 electron độc thân
Vì nguyên tử M có 4 electron độc thân nên chỉ Fe là thỏa mãn. Fe có 4 electron độc thân, có số oxi hóa +2 và +3 trong hợp chất và là kim loại nặng.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [704177]: Kết quả ghi phổ MS của acetone (CH3COCH3) cho biết ion phân tử [CH3COCH3+] có giá trị m/z nào sau đây?
A, 57.
B, 58.
C, 60.
D, 59.
Trong phổ MS mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và có giá trị bằng phân tử khối của chất nghiên cứu nên kết quả ghi phổ MS của acetone (CH3COCH3) cho biết ion phân tử [CH3COCH3+] có giá trị m/z bằng 58.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 9 [704178]: Một số hydrocarbon trong bình gas tạo với không khí hỗn hợp nổ ngay ở nồng độ rất thấp: pentane C5H12 là 1,4%; butane C4H10 là 1,6%, methane CH4 là 4,4% vì phản ứng cháy của các hydrocarbon đều tỏa rất nhiều nhiệt, tốc độ phản ứng nhanh nên thể tích không khí giãn nở đột ngột và gây ra vụ nổ hóa học. Cho các phát biểu sau:
(a) Các hydrocarbon không có mùi nhưng khí gas lại có mùi hắc là do nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng, giúp phát hiện khí gas khi xảy ra rò rỉ.
(b) Khi thấy có “mùi gas” báo hiệu có gas rò rỉ, nhanh chóng dùng bật lửa hoặc bật công tắc đèn… để tìm vị trí gas bị rò rỉ.
(c) Không nên dùng tay trần để tìm vị trí gas rò rỉ vì có thể cháy tĩnh điện hoặc nguồn nhiệt từ cơ thể (dù nhỏ) cũng có thể gây cháy nổ trong điều kiện nồng độ khí gas cao.
(d) Khi phát hiện vị trí rò rỉ thì dùng băng keo quấn lại, di chuyển bình gas đến vị trí an toàn, nơi thông gió, tránh xa nguồn nhiệt rồi báo cơ sở gas xử lí.
Các phát biểu đúng là
(a) Các hydrocarbon không có mùi nhưng khí gas lại có mùi hắc là do nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng, giúp phát hiện khí gas khi xảy ra rò rỉ.
(b) Khi thấy có “mùi gas” báo hiệu có gas rò rỉ, nhanh chóng dùng bật lửa hoặc bật công tắc đèn… để tìm vị trí gas bị rò rỉ.
(c) Không nên dùng tay trần để tìm vị trí gas rò rỉ vì có thể cháy tĩnh điện hoặc nguồn nhiệt từ cơ thể (dù nhỏ) cũng có thể gây cháy nổ trong điều kiện nồng độ khí gas cao.
(d) Khi phát hiện vị trí rò rỉ thì dùng băng keo quấn lại, di chuyển bình gas đến vị trí an toàn, nơi thông gió, tránh xa nguồn nhiệt rồi báo cơ sở gas xử lí.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (b), (d).
C, (b), (c), (d).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Đặc tính của khí gas là không màu, không mùi, không vị nhưng người dùng vẫn ngửi thấy mùi gas khi nó thoát ra bên ngoài. Lý do là trong quá trình sản xuất các chuyên gia đã pha trộn thêm mùi trứng thối, bắp cải thối lẫn vào khí gas để có thể phát hiện và xử lý kịp thời nếu có sự cố rò rỉ gas. Do khứu giác của con người nhạy cảm gấp nhiều lần với mùi khó chịu nên dễ phát hiện rỏ rỉ khí gas.
❌ (b) Sai. Khí gas dễ cháy, nếu dùng bật lửa hay bật công tắc đèn tìm nơi rò rỉ khí gas sẽ gây cháy nổ.
✔️ (c) Đúng. tĩnh điện được sinh ra khi 2 bề mặt vật liệu tiếp xúc và tách ra nhau. Cụ thể khi con người di chuyển, tĩnh điện đã được nạp lên cơ thể từ 1 kV -5 kV do ma sát giữa giày/dép (thông thường) và bề mặt sàn (thông thường). Điện áp tĩnh này sẽ tồn tại trên cơ thể con người, chúng có thể truyền đi khi con người được nối đất hoặc tiếp xúc, chạm vào đối tượng dẫn điện nên khi dùng tay trần vẫn có nguy cơ gây cháy nổ khi tiếp xúc với khí gas.
✔️ (d) Đúng. Cách làm trên ngăn khí gas tiếp xúc với nguồn nhiệt gây cháy nổ.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Đặc tính của khí gas là không màu, không mùi, không vị nhưng người dùng vẫn ngửi thấy mùi gas khi nó thoát ra bên ngoài. Lý do là trong quá trình sản xuất các chuyên gia đã pha trộn thêm mùi trứng thối, bắp cải thối lẫn vào khí gas để có thể phát hiện và xử lý kịp thời nếu có sự cố rò rỉ gas. Do khứu giác của con người nhạy cảm gấp nhiều lần với mùi khó chịu nên dễ phát hiện rỏ rỉ khí gas.
❌ (b) Sai. Khí gas dễ cháy, nếu dùng bật lửa hay bật công tắc đèn tìm nơi rò rỉ khí gas sẽ gây cháy nổ.
✔️ (c) Đúng. tĩnh điện được sinh ra khi 2 bề mặt vật liệu tiếp xúc và tách ra nhau. Cụ thể khi con người di chuyển, tĩnh điện đã được nạp lên cơ thể từ 1 kV -5 kV do ma sát giữa giày/dép (thông thường) và bề mặt sàn (thông thường). Điện áp tĩnh này sẽ tồn tại trên cơ thể con người, chúng có thể truyền đi khi con người được nối đất hoặc tiếp xúc, chạm vào đối tượng dẫn điện nên khi dùng tay trần vẫn có nguy cơ gây cháy nổ khi tiếp xúc với khí gas.
✔️ (d) Đúng. Cách làm trên ngăn khí gas tiếp xúc với nguồn nhiệt gây cháy nổ.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
Câu 10 [304799]: Ester tạo ra mùi thơm của chuối chín được gọi là 3-methylbutyl ethanoate. Công thức cấu tạo của hợp chất này được cho dưới đây:
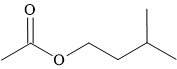
Carboxylic acid nào đã cấu tạo nên ester trên?

Carboxylic acid nào đã cấu tạo nên ester trên?
A, C2H3COOH.
B, CH3COOH.
C, C4H9COOH.
D, C2H5COOH.
HD: Phân tích cấu tạo của ester:
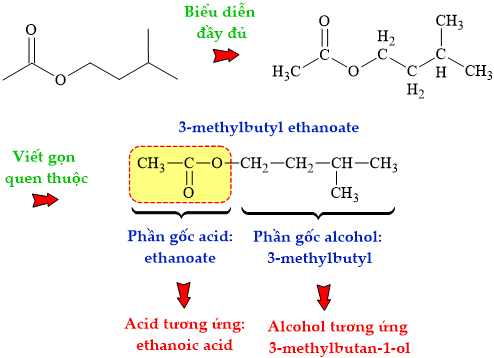
⇒ Carboxylic acid cấu tạo nên ester là ethanoic acid (acetic acid): CH3COOH
⇝ Chọn đáp án B Đáp án: B

⇒ Carboxylic acid cấu tạo nên ester là ethanoic acid (acetic acid): CH3COOH
⇝ Chọn đáp án B Đáp án: B
Câu 11 [308555]: Amine nào sau đây tồn tại ở trạng thái khí ở điều kiện thường?
A, aniline.
B, isopropylamine.
C, butylamine.
D, trimethylamine.
Ở điều kiện thường các amine như methylamine, dimethylamine, ethylamine, trimethyl amine là chất khí ở điều kiện thường.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 12 [308236]: Carbohydrate nào sau đây thuộc loại disaccharide?
A, Cellulose.
B, Amylose.
C, Saccharose.
D, Glucose.
HD: Bài học phân loại hợp chất carbohydrate:
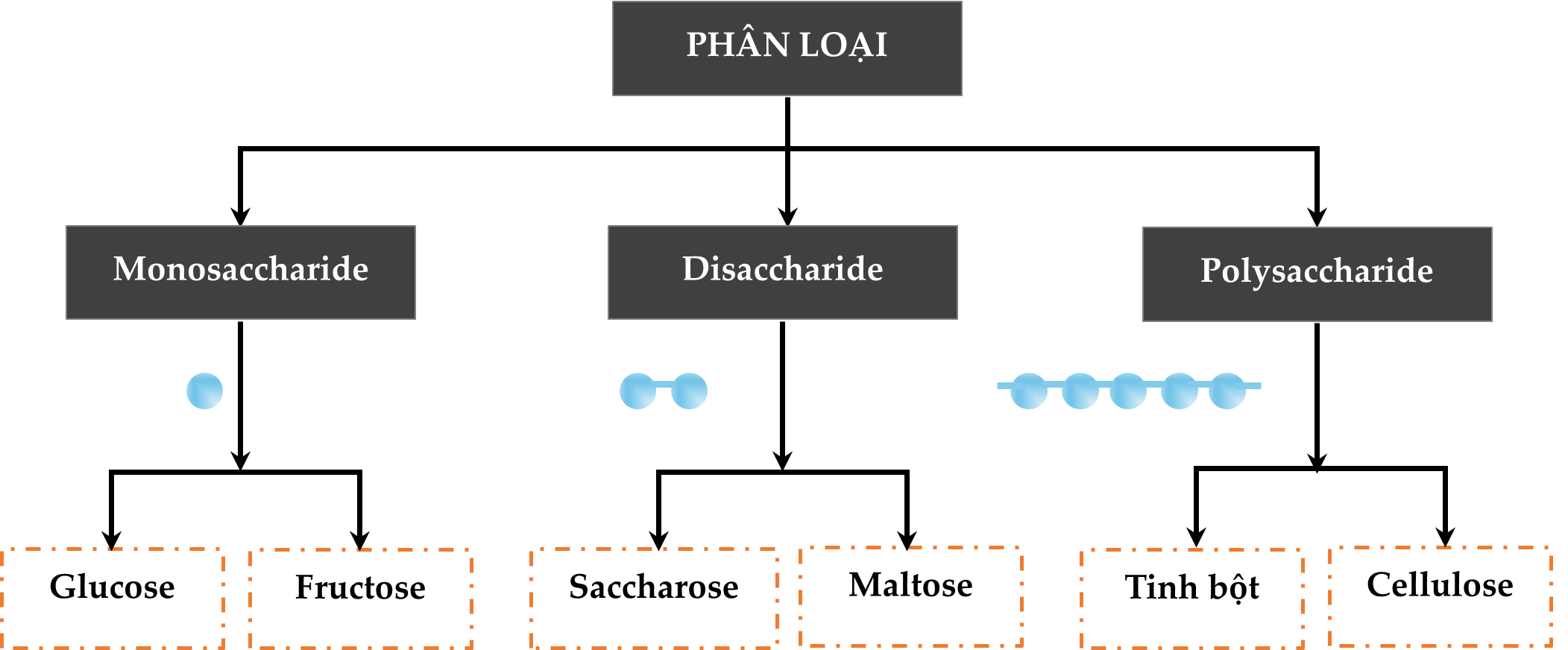
⇒ Saccharose là một loại disaccharide
⇝ Chọn đáp án C. Đáp án: C

⇒ Saccharose là một loại disaccharide
⇝ Chọn đáp án C. Đáp án: C
Câu 13 [704179]: Phản ứng cộng HCN vào hợp chất carbonyl thu được sản phẩm cyanohydrin.

Cơ chế của phản ứng như sau:
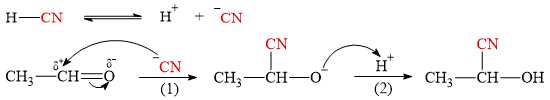
Phát biểu nào sau đây không đúng?

Cơ chế của phản ứng như sau:

Phát biểu nào sau đây không đúng?
A, HCN tan được trong nước và là chất điện li yếu.
B, Giai đoạn (1) có sự tạo thành 1 liên kết σ.
C, Giai đoạn (2), ion H+ có thể lấy từ sự điện li HCN.
D, O có độ âm điện lớn nên C (trong C=O) sẽ có mật độ điện tích âm lớn nhất.
Phân tích các phát biểu:
✔️ A. Đúng. HCN tan được trong nước và là chất điện li yếu do HCN phân li không hoàn toàn, xảy ra phản ứng thuận nghịch.
✔️ B. Đúng. Giai đoạn (1) có sự tạo thành 1 liên kết σ.
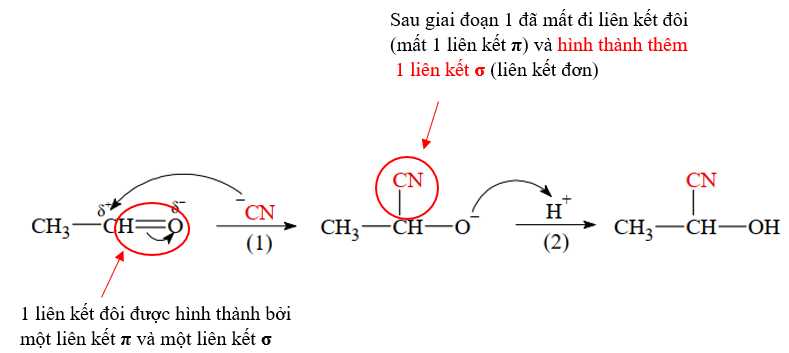
✔️ C. Đúng. Giai đoạn (2), ion H+ có thể lấy từ sự điện li HCN: HCN ⇌ H+ + CN-
❌ D. Sai. O có độ âm điện lớn nên sẽ hút electron mạnh hơn, electron sẽ tập trung ở O dẫn đến C (trong C=O) sẽ có mật độ điện tích dương lớn nhất.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. HCN tan được trong nước và là chất điện li yếu do HCN phân li không hoàn toàn, xảy ra phản ứng thuận nghịch.
✔️ B. Đúng. Giai đoạn (1) có sự tạo thành 1 liên kết σ.

✔️ C. Đúng. Giai đoạn (2), ion H+ có thể lấy từ sự điện li HCN: HCN ⇌ H+ + CN-
❌ D. Sai. O có độ âm điện lớn nên sẽ hút electron mạnh hơn, electron sẽ tập trung ở O dẫn đến C (trong C=O) sẽ có mật độ điện tích dương lớn nhất.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [303495]: Chất nào sau đây chứa nhóm chức ester?
A, HCOOC2H5.
B, CH3COCH3.
C, C2H5CHO.
D, C3H7OH.
Phân tích các đáp án:
✔️ A. HCOOC2H5 chứa nhóm chức ester –COOC–.
❌ B. CH3COCH3 chứa nhóm chức ketone >C=O.
❌ C. C2H5CHO chứa nhóm chức aldehyde –CHO.
❌ D. C3H7OH chứa nhóm chức alcohol –OH.
⇒ Chọn đáp án A Đáp án: A
✔️ A. HCOOC2H5 chứa nhóm chức ester –COOC–.
❌ B. CH3COCH3 chứa nhóm chức ketone >C=O.
❌ C. C2H5CHO chứa nhóm chức aldehyde –CHO.
❌ D. C3H7OH chứa nhóm chức alcohol –OH.
⇒ Chọn đáp án A Đáp án: A
Câu 15 [704180]: “Protein là hợp chất …(1)… được cấu tạo từ một hay nhiều chuỗi …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, cao phân tử, polypeptide.
B, polymer, polyamide.
C, phức tạp, amide.
D, thiết yếu, peptide.
- Protein thuộc nhóm các hợp chất cao phân tử (polymer sinh học), vì chúng có khối lượng phân tử rất lớn (hàng ngàn đến hàng triệu đơn vị khối lượng nguyên tử).
- Thành phần cơ bản của protein là các amino acid liên kết với nhau tạo thành chuỗi dài hay còn gọi là chuỗi polypeptide.
⇒ Protein là hợp chất cao phân tử được cấu tạo từ một hay nhiều chuỗi polypeptide.
⇒ Chọn đáp án A Đáp án: A
- Thành phần cơ bản của protein là các amino acid liên kết với nhau tạo thành chuỗi dài hay còn gọi là chuỗi polypeptide.
⇒ Protein là hợp chất cao phân tử được cấu tạo từ một hay nhiều chuỗi polypeptide.
⇒ Chọn đáp án A Đáp án: A
Câu 16 [704181]: Amino acid là những thành phần xây dựng lên protein. Hãy xem xét glycine (NH2CH2COOH). Tùy thuộc vào độ pH của dung dịch, glycine có thể tồn tại ở một trong ba dạng có thể:
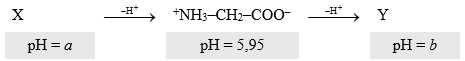
Cho các phát biểu sau:
(a) Ở pH = 5,95, glycine tồn tại ở dạng ion lưỡng cực.
(b) Giá trị pH a lớn hơn giá trị pH b.
(c) Ở pH = a, dạng tồn tại của glycine có tổng điện tích là +2.
(d) Ở pH = b, dạng tồn tại của glycine sẽ di chuyển về phía cực dương trong quá trình điện di.
Số phát biểu đúng là
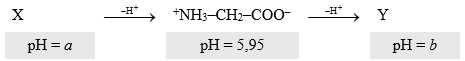
Cho các phát biểu sau:
(a) Ở pH = 5,95, glycine tồn tại ở dạng ion lưỡng cực.
(b) Giá trị pH a lớn hơn giá trị pH b.
(c) Ở pH = a, dạng tồn tại của glycine có tổng điện tích là +2.
(d) Ở pH = b, dạng tồn tại của glycine sẽ di chuyển về phía cực dương trong quá trình điện di.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
(a) Đúng. Từ dạng tồn tại trên, pH = 5,95, glycine tồn tại dạng ion lưỡng cực.
(b) Sai. Tại pH = a glycine tồn tại dạng cation, Tại pH = b glycine tồn tại dạng anion nên pH = a < pH = b.
(c) Sai. pH = a dạng tồn tại của glycine là +NH3CH2COOH có điện tích +1.
(d) Đúng. pH = b dạng tồn tai của glycine là dạng anion H2NCH2CHOO- nên sẽ di chuyển về phía cực dương trong quá trình điện di.
Các phát biểu đúng là (a) (d)
⇒ Chọn đáp án B Đáp án: B
(a) Đúng. Từ dạng tồn tại trên, pH = 5,95, glycine tồn tại dạng ion lưỡng cực.
(b) Sai. Tại pH = a glycine tồn tại dạng cation, Tại pH = b glycine tồn tại dạng anion nên pH = a < pH = b.
(c) Sai. pH = a dạng tồn tại của glycine là +NH3CH2COOH có điện tích +1.
(d) Đúng. pH = b dạng tồn tai của glycine là dạng anion H2NCH2CHOO- nên sẽ di chuyển về phía cực dương trong quá trình điện di.
Các phát biểu đúng là (a) (d)
⇒ Chọn đáp án B Đáp án: B
Sử dụng đoạn thông tin dưới đây để trả lời câu 17 và câu 18:
Cho thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
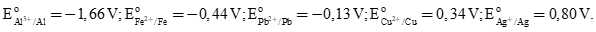
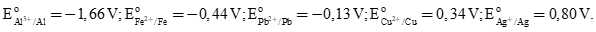
Câu 17 [704182]: Trong số các kim loại: Fe, Pb, Ag và Al, kim loại nào hoạt động mạnh hơn kim loại Cu?
A, Fe, Pb.
B, Al, Ag.
C, Fe, Pb, Al.
D, Fe.
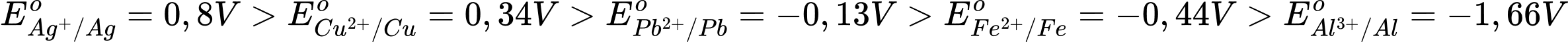
Kim loại có độ hoạt động mạnh hơn Cu là những kim loại có thế điện cực chuẩn nhỏ hơn Cu
→ Pb, Fe, Al hoạt động mạnh hơn Cu.
⇒ Chọn đáp án C Đáp án: C
Câu 18 [704183]: Sức điện động chuẩn nhỏ nhất của pin Valgani được thiết lập từ hai cặp oxi hóa khử trong số các cặp trên có giá trị là
A, 0,46 V.
B, 0,21 V.
C, 0,31 V.
D, 0,47 V.
Sức điện động nhỏ nhất của pin galvani thiết lặp từ cặp Fe2+/Fe và Pb2+/Pb
Với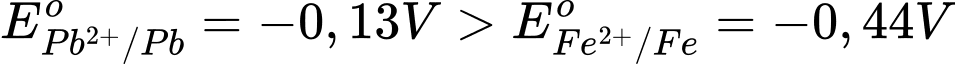 → Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
→ Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
Fe + Pb+ Fe2+ + Pb
Fe2+ + Pb
Phản ứng trong pin:
Cathode (+) Pb2+ + 2e Pb
Pb
Anode (-) Fe Fe2+ + 2e
Fe2+ + 2e
Sức điện của pin là: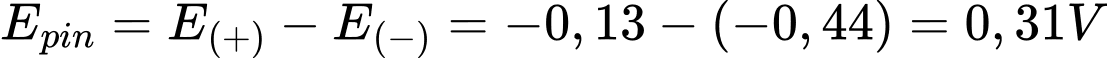
⇒ Chọn đáp án C Đáp án: C
Với
 → Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)
→ Fe đóng vai trò là anode (-) và Pb đóng vai trò là cathode (+)Fe + Pb+
 Fe2+ + Pb
Fe2+ + PbPhản ứng trong pin:
Cathode (+) Pb2+ + 2e
 Pb
Pb Anode (-) Fe
 Fe2+ + 2e
Fe2+ + 2eSức điện của pin là:
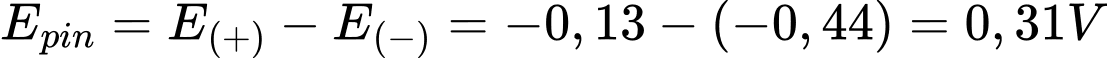
⇒ Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704184]: Kim loại có khả năng tác dụng được với các phi kim trong các điều kiện phù hợp. Tiến hành hai thí nghiệm sau:
▪ Thí nghiệm 1: Dùng kẹp gắp dây kim loại magnesium, đốt nóng trong không khí.
▪ Thí nghiệm 2: Lấy sợi dây sắt cuốn thành hình lò xo. Dùng kẹp gắp dây sắt, nung nóng đỏ sợi dây sắt trên ngọn lửa đèn cồn, đưa nhanh vào bình chứa khí chlorine.
▪ Thí nghiệm 1: Dùng kẹp gắp dây kim loại magnesium, đốt nóng trong không khí.
▪ Thí nghiệm 2: Lấy sợi dây sắt cuốn thành hình lò xo. Dùng kẹp gắp dây sắt, nung nóng đỏ sợi dây sắt trên ngọn lửa đèn cồn, đưa nhanh vào bình chứa khí chlorine.
Thí nghiệm 1: 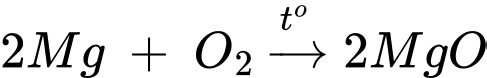
Khi đốt cháy kim loại Magnessium bằng oxygen không khí thì phản ứng xảy ra mãnh liệt, tỏa nhiều nhiệt, phát ra ánh sáng chói và giàu tia tử ngoại.
Thí nghiệm 2: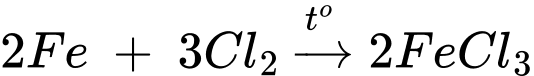
Hiện tượng là sắt cháy sáng và tạo ra khói màu vàng nâu.
Phân tích các phát biểu:
✔️ a. Đúng. Thí nghiệm 1 phản ứng xuất hiện ánh sáng chói và tia tử ngoại.
❌ b. Sai. Thí nghiệm 2, Fe bị oxi hóa lên số oxi hóa +3.
✔️ c. Đúng. Mg có số oxi hóa tăng từ 0 lên +2 và Fe có số oxi hóa tăng từ 0 lên +3 nên cả hai thí nghiệm đều chứng minh tính khử của kim loại.
❌ d. Sai. Hiện tượng khói màu vàng nâu do có FeCl3 sinh ra nên khi thay sợi dây sắt ở thí nghiệm 2 bằng dây magnesium thì hiện tượng thu được không có khói màu vàng nâu.
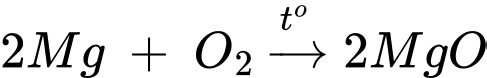
Khi đốt cháy kim loại Magnessium bằng oxygen không khí thì phản ứng xảy ra mãnh liệt, tỏa nhiều nhiệt, phát ra ánh sáng chói và giàu tia tử ngoại.
Thí nghiệm 2:
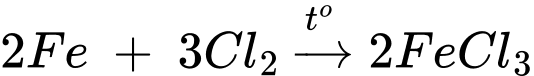
Hiện tượng là sắt cháy sáng và tạo ra khói màu vàng nâu.
Phân tích các phát biểu:
✔️ a. Đúng. Thí nghiệm 1 phản ứng xuất hiện ánh sáng chói và tia tử ngoại.
❌ b. Sai. Thí nghiệm 2, Fe bị oxi hóa lên số oxi hóa +3.
✔️ c. Đúng. Mg có số oxi hóa tăng từ 0 lên +2 và Fe có số oxi hóa tăng từ 0 lên +3 nên cả hai thí nghiệm đều chứng minh tính khử của kim loại.
❌ d. Sai. Hiện tượng khói màu vàng nâu do có FeCl3 sinh ra nên khi thay sợi dây sắt ở thí nghiệm 2 bằng dây magnesium thì hiện tượng thu được không có khói màu vàng nâu.
Câu 20 [704185]: Enzyme amylase là một protein có khả năng xúc tác cho phản ứng thủy phân tinh bột. Hoạt tính xúc tác của enzyme càng cao thì phản ứng thủy phân tinh bột diễn ra càng nhanh. Hoạt tính xúc tác của enzyme phụ thuộc vào các yếu tố như nhiệt độ, pH. Một nhóm học sinh dự đoán "pH càng tăng thì hoạt tính xúc tác của enzyme amylase càng cao". Từ đó, học sinh tiến hành thí nghiệm ở nhiệt độ không đổi nhưng thay đổi pH của môi trường để kiểm tra dự đoán trên như sau:
Bước 1: Thêm 2,0 mL dung dịch một loại enzyme amylase vào một ống nghiệm chứa 5,0 mL dung dịch có vai trò duy trì ổn định pH bằng 5.
Bước 2: Thêm tiếp 2,0 mL dung dịch tinh bột vào ống nghiệm trên, lắc đều.
Bước 3: Sau khoảng mỗi 10 giây, dùng ống hút lấy 1-2 giọt hỗn hợp phản ứng trong ống nghiệm và cho vào đĩa sứ chứa sẵn dung dịch iodine, quan sát để từ đó xác định thời gian tinh bột thủy phân hết.
Lặp lại thí nghiệm theo ba bước trên, chỉ thay đổi pH dung dịch trong Bước 1 lần lượt là 6; 7; 8; 9.
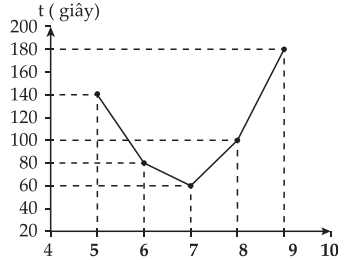
Nhóm học sinh ghi lại kết quả thời gian t (giây) mà tinh bột thủy phân hết trong môi trường pH = 5; 6; 7; 8; 9 và vẽ đồ thị như hình bên.
Bước 1: Thêm 2,0 mL dung dịch một loại enzyme amylase vào một ống nghiệm chứa 5,0 mL dung dịch có vai trò duy trì ổn định pH bằng 5.
Bước 2: Thêm tiếp 2,0 mL dung dịch tinh bột vào ống nghiệm trên, lắc đều.
Bước 3: Sau khoảng mỗi 10 giây, dùng ống hút lấy 1-2 giọt hỗn hợp phản ứng trong ống nghiệm và cho vào đĩa sứ chứa sẵn dung dịch iodine, quan sát để từ đó xác định thời gian tinh bột thủy phân hết.
Lặp lại thí nghiệm theo ba bước trên, chỉ thay đổi pH dung dịch trong Bước 1 lần lượt là 6; 7; 8; 9.
Nhóm học sinh ghi lại kết quả thời gian t (giây) mà tinh bột thủy phân hết trong môi trường pH = 5; 6; 7; 8; 9 và vẽ đồ thị như hình bên.

Phân tích các phát biểu:
❌ a. Sai. Ở bước 3 nếu dung dịch iodine chuyển sang màu xanh tính nghĩa là tinh bột chưa thủy phân hết nên đã hấp phụ iodine tạo ra màu xanh tím. Nếu tinh bột thủy phân hết thì ở bước 3 dung dịch iodine sẽ không đổi màu.
❌ b. Sai. Theo số liệu thu được, phản ứng thủy phân tinh bột ở pH = 9 diễn ra trong 200 giây chậm hơn quá trình thủy phân tinh bột ở pH = 8 diễn ra trong 100 giây.
✔️ c. Đúng. Tại pH = 7 quá trình thủy phân tinh bột là nhanh nhất, chỉ mất 60 giây để thủy phân tinh bột.
❌ d. Sai. Từ kết quả thí nghiệm trên giá trị pH tối ưu thủy phân là 7, khi tăng pH thì thời gian thủy phân tăng dần.
❌ a. Sai. Ở bước 3 nếu dung dịch iodine chuyển sang màu xanh tính nghĩa là tinh bột chưa thủy phân hết nên đã hấp phụ iodine tạo ra màu xanh tím. Nếu tinh bột thủy phân hết thì ở bước 3 dung dịch iodine sẽ không đổi màu.
❌ b. Sai. Theo số liệu thu được, phản ứng thủy phân tinh bột ở pH = 9 diễn ra trong 200 giây chậm hơn quá trình thủy phân tinh bột ở pH = 8 diễn ra trong 100 giây.
✔️ c. Đúng. Tại pH = 7 quá trình thủy phân tinh bột là nhanh nhất, chỉ mất 60 giây để thủy phân tinh bột.
❌ d. Sai. Từ kết quả thí nghiệm trên giá trị pH tối ưu thủy phân là 7, khi tăng pH thì thời gian thủy phân tăng dần.
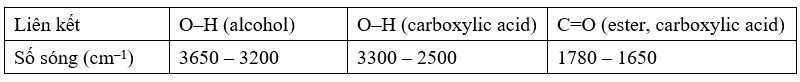
Câu 21 [704186]: Từ một loại tinh dầu thảo mộc, người ta tách được hợp chất hữu cơ A (cynamaldehyde) có mùi thơm của quế. Bằng phương pháp phân tích nguyên tố, người ta thấy rằng A chứa 81,82% C và 6,06% H về khối lượng, còn lại là O. Phổ MS cho thấy A có phân tử khối bằng 132. Trên phổ IR của A có một tín hiệu đặc trưng ở 1746 cm–1. A có phản ứng tráng bạc, làm mất màu dung dịch Br2/CCl4 và khi bị oxi hoá bằng dung dịch KMnO4 nóng, thu được benzoic acid. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:

Gọi công thức của A có dạng CxHyOz
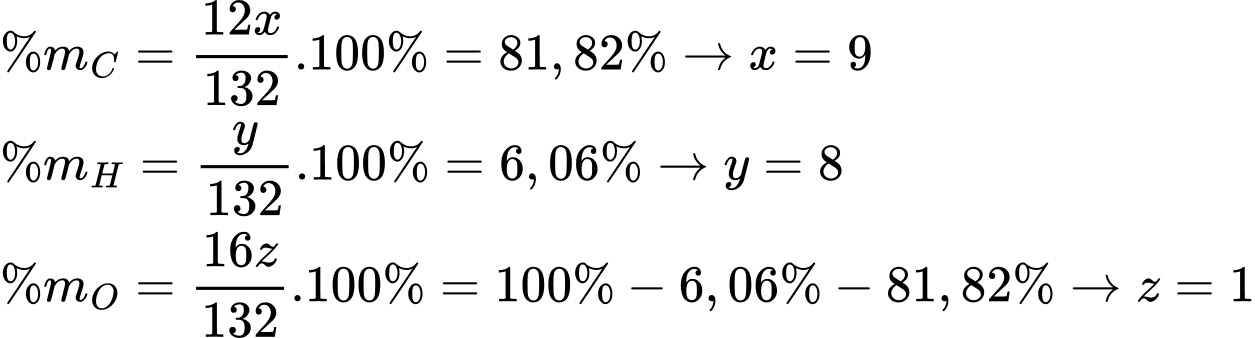
Công thức phân tử của A là C9H8O
+) Độ bất bão hòa của A là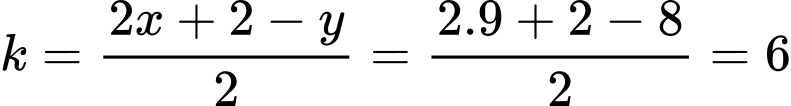
+) A có phản ứng tráng bạc → A có nhóm chức aldehyde
+) A làm mất màu dung dịch Br2/CCl4 → Trong phân tử A có liên kết C=C
+) A phản ứng được với dung dịch KMnO4 tạo ra benzoic acid → trong công thức cấu tạo có vòng benzene.
→ π + v = 6, trong đó vòng benzene chứa 4π nên mạch ngoài chứa 2π.
→ Công thức cấu tạo của A là: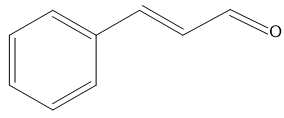
Phân tích các phát biểu:
❌ (a) Sai. Trên phổ IR của A có thể hiện tín hiệu đặt trưng của liên kết C=O nhưng không khẳng định được A có nhóm chức –COO vì C=O còn có thể của aldehyde (–CHO) hay carboxylic acid (–COOH)...
✔️ (b) Đúng. A có phản ứng tráng bạc nên A có nhóm chức aldehyde, phân tử chứa liên kết C=C.
❌(c) Sai. Khi A bị oxi hóa bằng dung dịch KMnO4 nóng, thu được benzoic acid, chứng tỏ A là dẫn xuất một lần thế của benzene do chỉ thế 1 H của A.
❌ (d) Sai. A tác dụng với tác nhân khử LiAlH4 cho sản phẩm alcohol bậc 1 do A là aldehyde. Khử ketone mới thu được sản phẩm là alcohol bậc 2.
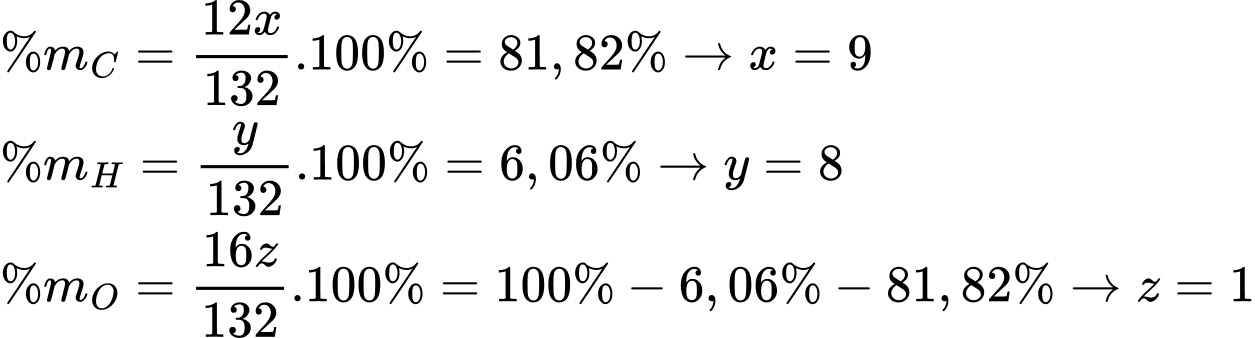
Công thức phân tử của A là C9H8O
+) Độ bất bão hòa của A là
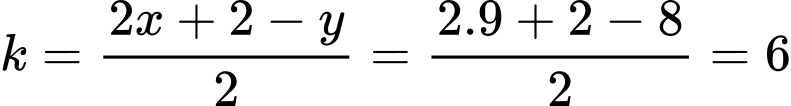
+) A có phản ứng tráng bạc → A có nhóm chức aldehyde
+) A làm mất màu dung dịch Br2/CCl4 → Trong phân tử A có liên kết C=C
+) A phản ứng được với dung dịch KMnO4 tạo ra benzoic acid → trong công thức cấu tạo có vòng benzene.
→ π + v = 6, trong đó vòng benzene chứa 4π nên mạch ngoài chứa 2π.
→ Công thức cấu tạo của A là:

Phân tích các phát biểu:
❌ (a) Sai. Trên phổ IR của A có thể hiện tín hiệu đặt trưng của liên kết C=O nhưng không khẳng định được A có nhóm chức –COO vì C=O còn có thể của aldehyde (–CHO) hay carboxylic acid (–COOH)...
✔️ (b) Đúng. A có phản ứng tráng bạc nên A có nhóm chức aldehyde, phân tử chứa liên kết C=C.
❌(c) Sai. Khi A bị oxi hóa bằng dung dịch KMnO4 nóng, thu được benzoic acid, chứng tỏ A là dẫn xuất một lần thế của benzene do chỉ thế 1 H của A.
❌ (d) Sai. A tác dụng với tác nhân khử LiAlH4 cho sản phẩm alcohol bậc 1 do A là aldehyde. Khử ketone mới thu được sản phẩm là alcohol bậc 2.
Câu 22 [704187]: Nghiên cứu khả năng phản ứng của dung dịch copper(II) sulfate loãng với hydrochloric acid đặc được thực hiện như sau: Thêm khoảng 2 mL dung dịch HCl vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4. Màu sắc của ống nghiệm được theo dõi (từ trái sang phải) như hình bên dưới.


Phân tích các phát biểu:
✔️ (a) Đúng. Trong dung dịch ion Cu2+ tồn tại dưới dạng phức chất aqua [(Cu(H2O)6)]2+ khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hoá học dạng sau:
Cu2+ + 6H2O ⟶ [(Cu(H2O)6)]2+
✔️ (b) Đúng. Ở những điều kiện phù hợp, các anion và phân tử như OH, X- (halide), NH3,... có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất. Chẳng hạn, anion OH- hoặc Cl- có thể thay thế phối tử H2O trong các phức chất.
[(Cu(H2O)6)]2+ + 4HCl ⇌ [CuCl4]2- + 6H2O + 4H+
✔️ (c) Đúng. Tại trạng thái cân bằng tồn tại cả 2 dạng [(Cu(H2O)6)]2+ và [CuCl4]2- nên dung dịch có màu xanh lục.
❌ (d) Sai. Phản ứng trên không chứng minh được HCl có tính acid mạnh hơn H2SO4, chỉ chứng tỏ ion Cl- có khả năng thay thế phối tử H2O trong phức chất.
✔️ (a) Đúng. Trong dung dịch ion Cu2+ tồn tại dưới dạng phức chất aqua [(Cu(H2O)6)]2+ khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hoá học dạng sau:
Cu2+ + 6H2O ⟶ [(Cu(H2O)6)]2+
✔️ (b) Đúng. Ở những điều kiện phù hợp, các anion và phân tử như OH, X- (halide), NH3,... có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất. Chẳng hạn, anion OH- hoặc Cl- có thể thay thế phối tử H2O trong các phức chất.
[(Cu(H2O)6)]2+ + 4HCl ⇌ [CuCl4]2- + 6H2O + 4H+
✔️ (c) Đúng. Tại trạng thái cân bằng tồn tại cả 2 dạng [(Cu(H2O)6)]2+ và [CuCl4]2- nên dung dịch có màu xanh lục.
❌ (d) Sai. Phản ứng trên không chứng minh được HCl có tính acid mạnh hơn H2SO4, chỉ chứng tỏ ion Cl- có khả năng thay thế phối tử H2O trong phức chất.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704188]: Lên men glucose để điều chế ethyl alcohol (khối lượng riêng của ethyl alcohol nguyên chất là 0,8 g/mL), hiệu suất phản ứng lên men ethyl alcohol là 80%. Để thu được 100 lít rượu vang 12° thì khối lượng glucose cần dùng?
Đổi 100 L = 100000 mL
Khối lượng ethanol trong rượu là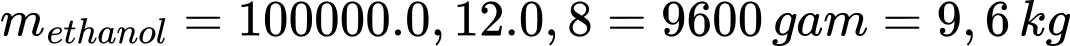
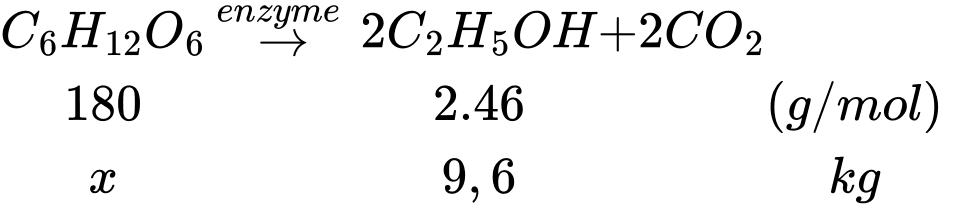
Khối lượng glucose cần dùng là:
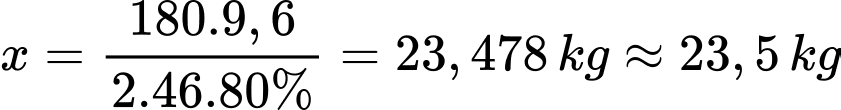
⇒ Điền đáp án: 23,5
Khối lượng ethanol trong rượu là
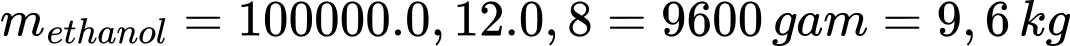
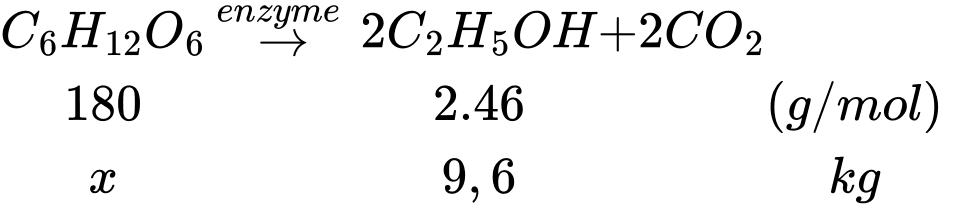
Khối lượng glucose cần dùng là:
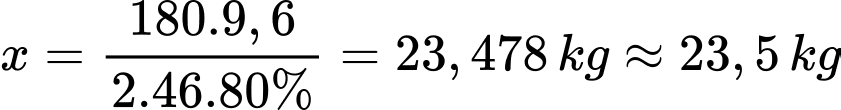
⇒ Điền đáp án: 23,5
Câu 24 [704189]: Arachidonic acid thuộc loại acid béo không bão hòa có công thức cấu tạo sau như hình bên. Có bao nhiêu liên kết đôi C=C trong arachidonic acid?
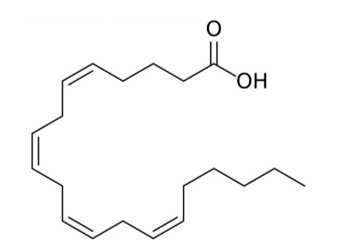

Phân tử Arachidonic acid có 4 liên kết đôi C=C ở các vị trí như sau:
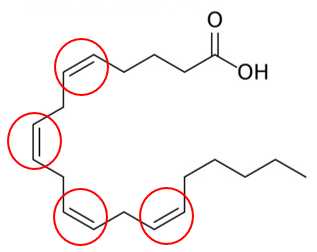
⇒ Điền đáp án: 4

⇒ Điền đáp án: 4
Câu 25 [704190]: Dung dịch của các kim loại kiềm thường không màu và tính chất hóa học của chúng cũng tương tự nhau nên rất khó để có thể nhận biết được các ion kim loại kiềm. Một phương pháp hữu ích có thể được sử dụng để xác định ion kim loại kiềm là đốt cháy dung dịch muối trên ngọn lửa và quan sát màu sắc tương ứng. Các bước trong quy trình thực hiện này như sau:
(1) Đưa que đốt bằng platinum đã nhúng dung dịch lên ngọn lửa đèn khí.
(2) Chuẩn bị dung dịch các muối lithium chloride, sodium chloride, potassium chloride nồng độ khoảng 25%.
(3) Quan sát màu ngọn lửa để phân biệt màu sắt đặc trưng của các muối ion kim loại kiềm.
(4) Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào các dung dịch muối.
Hãy sắp xếp số thứ tự các bước để thực hiện quy trình phân biệt các ion kim loại kiềm và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
(1) Đưa que đốt bằng platinum đã nhúng dung dịch lên ngọn lửa đèn khí.
(2) Chuẩn bị dung dịch các muối lithium chloride, sodium chloride, potassium chloride nồng độ khoảng 25%.
(3) Quan sát màu ngọn lửa để phân biệt màu sắt đặc trưng của các muối ion kim loại kiềm.
(4) Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào các dung dịch muối.
Hãy sắp xếp số thứ tự các bước để thực hiện quy trình phân biệt các ion kim loại kiềm và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
Phương pháp dùng màu ngọn lửa để xác định các ion kim loại kiềm được tiến hành theo các bước như sau:
Bước 1: Chuẩn bị:
Chuẩn bị dung dịch các muối lithium chloride, sodium chloride, potassium chloride nồng độ khoảng 25% → ứng với (2)
Bước 2: Lấy dung dịch muối để chuẩn bị đốt:
Nhúng đầu que đốt bằng platinum đã được rửa sạch (do Pt trơ về mặt hóa học) bằng nước vào các dung dịch muối. → ứng với (4)
Bước 3: Thực hiện đốt:
Đưa que đốt bằng platinum đã nhúng dung dịch muối lên ngọn lửa đèn khí → ứng với (1)
Bước 4: Quan sát:
Quan sát màu ngọn lửa để phân biệt màu sắc đặc trưng của các muối ion kim loại kiềm. → ứng với (3)
⇒ Điền đáp án: 2413
Bước 1: Chuẩn bị:
Chuẩn bị dung dịch các muối lithium chloride, sodium chloride, potassium chloride nồng độ khoảng 25% → ứng với (2)
Bước 2: Lấy dung dịch muối để chuẩn bị đốt:
Nhúng đầu que đốt bằng platinum đã được rửa sạch (do Pt trơ về mặt hóa học) bằng nước vào các dung dịch muối. → ứng với (4)
Bước 3: Thực hiện đốt:
Đưa que đốt bằng platinum đã nhúng dung dịch muối lên ngọn lửa đèn khí → ứng với (1)
Bước 4: Quan sát:
Quan sát màu ngọn lửa để phân biệt màu sắc đặc trưng của các muối ion kim loại kiềm. → ứng với (3)
⇒ Điền đáp án: 2413
Câu 26 [704191]: Cho các amine có công thức cấu tạo sau:
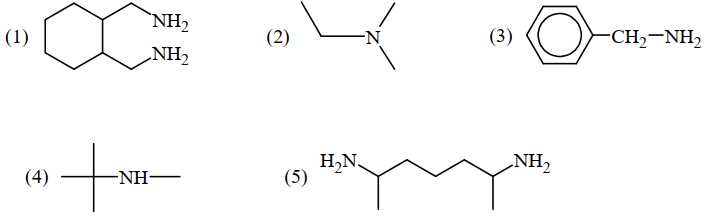
Có bao nhiêu amine bậc hai?

Có bao nhiêu amine bậc hai?
Amine bậc một có nhóm chức dạng –NH2 đính với một gốc hydrocarbon: (1) (3) (5)
Amine bậc hai có nhóm chức dạng –NH– đính với hai gốc hydrocarbon: (4)
Amine bậc ba có nhóm chức dạng ≡N đính với ba gốc hydrocarbon: (2)
→ Có 1 amine bậc hai
⇒ Điền đáp án: 1
Amine bậc hai có nhóm chức dạng –NH– đính với hai gốc hydrocarbon: (4)
Amine bậc ba có nhóm chức dạng ≡N đính với ba gốc hydrocarbon: (2)
→ Có 1 amine bậc hai
⇒ Điền đáp án: 1
Câu 27 [704192]: Trong phản ứng hóa học, đại lượng enthalpy  đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước:
đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước: 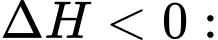 phản ứng tỏa nhiệt,
phản ứng tỏa nhiệt, 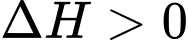 phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
Khí carbonic sinh ra từ các quá trình cháy là một trong những nguyên nhân chính gây hiệu ứng nhà kính. Hiện nay, nồng độ CO2 trong khí quyển là 0,035% so với cách đây 300 năm là 0,028%. Nếu nồng độ CO2 tăng 25% thì góp phần tăng nhiệt độ toàn cầu 0,5 oC. Do đó, các biện pháp làm giảm thiểu sự phát thải CO2 là vấn đề lớn của toàn thế giới.Tính tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane.
 đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước:
đặc trưng cho nhiệt tỏa ra hay thu vào của phản ứng với quy ước: 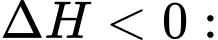 phản ứng tỏa nhiệt,
phản ứng tỏa nhiệt, 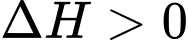 phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau:
phản ứng thu nhiệt. Hầu hết các phản ứng cháy nhiên liệu đều tỏa nhiệt rất mạnh. Methane và carbon cháy theo các phương trình sau: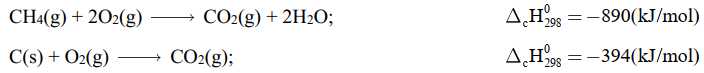
Khí carbonic sinh ra từ các quá trình cháy là một trong những nguyên nhân chính gây hiệu ứng nhà kính. Hiện nay, nồng độ CO2 trong khí quyển là 0,035% so với cách đây 300 năm là 0,028%. Nếu nồng độ CO2 tăng 25% thì góp phần tăng nhiệt độ toàn cầu 0,5 oC. Do đó, các biện pháp làm giảm thiểu sự phát thải CO2 là vấn đề lớn của toàn thế giới.Tính tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane.
* Đốt cháy CH4:
Cứ 1 mol CH4 bị đốt cháy, tức 1 mol CO2 sinh ra sẽ tạo ra 890 kJ
→ 1kJ được sinh ra bởi 1/890 mol CH4 và phát thải ra 1/890 mol CO2.
* Đốt cháy C:
Cứ 1 mol CO2 tạo thành sẽ phát thải ra môi trường 394 kJ
→ Phát thải ra 1 kJ thì cần 1/394 mol CO2.
Tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane là:
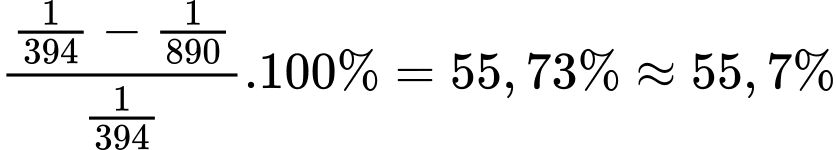
⇒ Điền đáp án: 55,7
Cứ 1 mol CH4 bị đốt cháy, tức 1 mol CO2 sinh ra sẽ tạo ra 890 kJ
→ 1kJ được sinh ra bởi 1/890 mol CH4 và phát thải ra 1/890 mol CO2.
* Đốt cháy C:
Cứ 1 mol CO2 tạo thành sẽ phát thải ra môi trường 394 kJ
→ Phát thải ra 1 kJ thì cần 1/394 mol CO2.
Tỉ lệ giảm phát thải khí CO2 (tính cho 1 kJ) khi đốt cháy than và methane là:
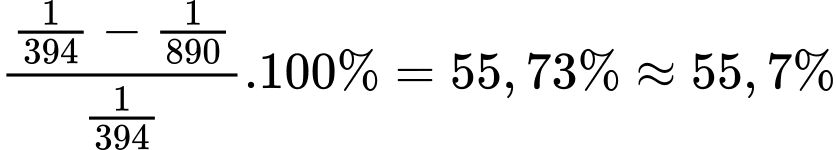
⇒ Điền đáp án: 55,7
Câu 28 [704193]: Cyanide (CN–) là một chất cực độc, liều lượng gây chết người của chất này là 200 - 300 mg/L nước. Hàm lượng ion cyanide trong nước thải từ bể mạ điện nằm trong khoảng 58 - 510 mg/L nên cần phải được xử lí đến hàm lượng 0,05 - 0,2 mg/L (tiêu chuẩn Việt Nam) trước khi thải ra môi trường. Phân tích một mẫu nước thải từ nhà máy mạ điện người ta đo được hàm lượng ion cyanide là 78,2 mg/L. Để loại cyanide đến hàm lượng 0,2 mg/L người ta sục khí chlorine vào nước thải trong môi trường pH = 9. Khi đó cyanide chuyển thành nitrogen không độc :
2CN– + 8OH– + 5Cl2 ⟶ 2CO2 + 10Cl– + 4H2O + N2
Tính thể tích chlorine (theo L, ở đkc) cần thiết để khử cyanide trong 1m3 nước thải trên đến hàm lượng 0,2 mg/L (làm tròn đến hàng đơn vị).
2CN– + 8OH– + 5Cl2 ⟶ 2CO2 + 10Cl– + 4H2O + N2
Tính thể tích chlorine (theo L, ở đkc) cần thiết để khử cyanide trong 1m3 nước thải trên đến hàm lượng 0,2 mg/L (làm tròn đến hàng đơn vị).
Đổi 1 m3 = 1000 L
2CN– + 8OH– + 5Cl2 ⟶ 2CO2 + 10Cl– + 4H2O + N2
Khối lượng ion cyanide đã xử lí là
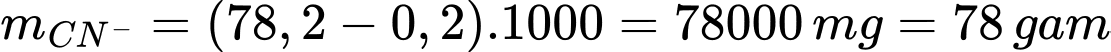
Số mol của CN– là:
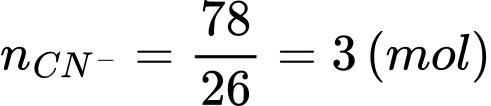
Thể tích khí chlorine cần thiết để khử ion cyanide là:
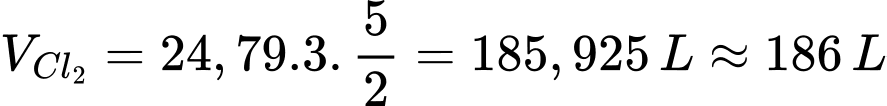
⇒ Điền đáp án: 186
2CN– + 8OH– + 5Cl2 ⟶ 2CO2 + 10Cl– + 4H2O + N2
Khối lượng ion cyanide đã xử lí là
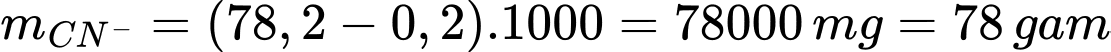
Số mol của CN– là:
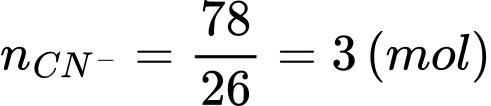
Thể tích khí chlorine cần thiết để khử ion cyanide là:
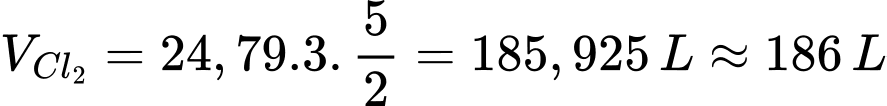
⇒ Điền đáp án: 186