PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704294]: “Bạc là kim loại ...(1)... tốt nhất, tiếp sau bạc là đồng, vàng và nhôm,... Tuy nhiên, nhôm và đồng thường được sử dụng làm ...(2)... hơn”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, dẫn nhiệt, ruột phích.
B, dẫn điện, dây tóc bóng đèn.
C, sắt, dây dẫn điện.
D, dẫn điện, dây dẫn điện.
Bạc là kim loại dẫn điện tốt nhất, tiếp sau bạc là đồng, vàng và nhôm,... Tuy nhiên, nhôm và đồng thường được sử dụng làm dây dẫn điện hơn
- Bạc là kim loại dẫn điện tốt nhất do các electron tự do trong mạng tinh thể bạc di chuyển rất dễ dàng, giảm thiểu sự cản trở và tổn thất năng lượng. Tuy nhiên, bạc lại đắt và hiếm, nên không được sử dụng phổ biến trong các ứng dụng như làm dây dẫn điện.
- Thay vào đó, đồng và nhôm thường được chọn vì các lý do sau:
+) Đồng có độ dẫn điện cao, chỉ đứng sau bạc.Giá thành thấp hơn bạc nhiều, dễ gia công và có độ bền cao, phù hợp cho dây dẫn điện trong các ứng dụng phổ thông.
+) Nhôm dẫn điện kém hơn đồng nhưng lại nhẹ hơn nhiều.Giá thành rẻ hơn và không bị oxi hóa nhanh như đồng nên thường được sử dụng trong các ứng dụng cần tiết kiệm trọng lượng như đường dây tải điện cao thế.
⇒ Chọn đáp án D Đáp án: D
- Bạc là kim loại dẫn điện tốt nhất do các electron tự do trong mạng tinh thể bạc di chuyển rất dễ dàng, giảm thiểu sự cản trở và tổn thất năng lượng. Tuy nhiên, bạc lại đắt và hiếm, nên không được sử dụng phổ biến trong các ứng dụng như làm dây dẫn điện.
- Thay vào đó, đồng và nhôm thường được chọn vì các lý do sau:
+) Đồng có độ dẫn điện cao, chỉ đứng sau bạc.Giá thành thấp hơn bạc nhiều, dễ gia công và có độ bền cao, phù hợp cho dây dẫn điện trong các ứng dụng phổ thông.
+) Nhôm dẫn điện kém hơn đồng nhưng lại nhẹ hơn nhiều.Giá thành rẻ hơn và không bị oxi hóa nhanh như đồng nên thường được sử dụng trong các ứng dụng cần tiết kiệm trọng lượng như đường dây tải điện cao thế.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [704295]: Muối Fe2(SO4)3 dễ tan trong nước, khi kết tinh thường ở dạng ngậm nước như Fe2(SO4)3.9H2O. Tên gọi của Fe2(SO4)3 là
A, iron(II) sulfide.
B, iron(III) sulfate.
C, iron(II) sulfate.
D, iron(III) sulfite.
Fe2(SO4)3 là muối tạo bởi cation Fe3+ (iron hóa trị III) và anion SO42− (sulfate).
Do đó, tên gọi của Fe2(SO4)3 là iron(III) sulfate.
Các chất còn lại có công thức như sau:
A. iron(II) sulfide: FeS.
C. iron(II) sulfate: FeSO4.
D. iron(III) sulfite: Fe2(SO3)3.
⇒ Chọn đáp án B Đáp án: B
Do đó, tên gọi của Fe2(SO4)3 là iron(III) sulfate.
Các chất còn lại có công thức như sau:
A. iron(II) sulfide: FeS.
C. iron(II) sulfate: FeSO4.
D. iron(III) sulfite: Fe2(SO3)3.
⇒ Chọn đáp án B Đáp án: B
Câu 3 [309515]: Monomer được dùng để điều chế polystirene (PS) là
A, C6H5CH=CH2.
B, CH2=CHCH=CH2.
C, CH2=CH2.
D, CH2=CHCH3.
Polystirene được điều chế bằng cách trùng hợp stirene:
nC6H5CH=CH2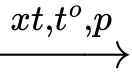 [-CH2-CH(C6H5)-]n
[-CH2-CH(C6H5)-]n
⇒ Chọn đáp án A Đáp án: A
nC6H5CH=CH2
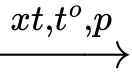 [-CH2-CH(C6H5)-]n
[-CH2-CH(C6H5)-]n⇒ Chọn đáp án A Đáp án: A
Câu 4 [560489]: Hãy xem xét ba pin điện, mỗi pin đều có cấu tạo như sơ đồ dưới đây:
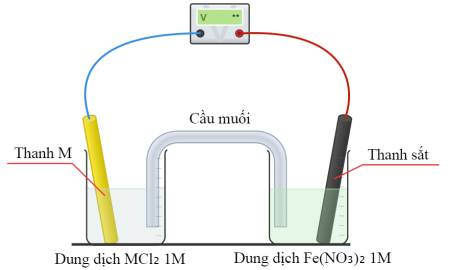
Trong mỗi pin điện, một nửa pin chứa dung dịch Fe(NO3)2(aq) 1,0 M với điện cực Fe. Thành phần của nửa pin còn lại như sau:
• Pin 1: Dung dịch CuCl2(aq) 1,0 M với điện cực Cu.
• Pin 2: Dung dịch NiCl2(aq) 1,0 M với điện cực Ni.
• Pin 3: Dung dịch ZnCl2(aq) 1,0 M với điện cực Zn.
Sắt đóng vai trò là cực dương trong (các) pin điện nào?

Trong mỗi pin điện, một nửa pin chứa dung dịch Fe(NO3)2(aq) 1,0 M với điện cực Fe. Thành phần của nửa pin còn lại như sau:
• Pin 1: Dung dịch CuCl2(aq) 1,0 M với điện cực Cu.
• Pin 2: Dung dịch NiCl2(aq) 1,0 M với điện cực Ni.
• Pin 3: Dung dịch ZnCl2(aq) 1,0 M với điện cực Zn.
Sắt đóng vai trò là cực dương trong (các) pin điện nào?
A, Pin 1.
B, Pin 2.
C, Pin 3.
D, Pin 1 và 2.
Vì sắt đóng vai trò là cực dương (cathode)
⇒ Điện cực anode phải có Eo bé hơn Eo Fe2+/Fe = -0,44
Biết: Eo Cu2+/Cu = +0,34 (V);
Eo Ni2+/Ni = -0,257 (V);
Eo Zn2+/Zn = -0,76 (V)
➝ Nhận thấy Eo Zn2+/Zn < Eo Fe2+/Fe
➝ Pin 3 là đáp án đúng.
⇒ Chọn đáp án C Đáp án: C
⇒ Điện cực anode phải có Eo bé hơn Eo Fe2+/Fe = -0,44
Biết: Eo Cu2+/Cu = +0,34 (V);
Eo Ni2+/Ni = -0,257 (V);
Eo Zn2+/Zn = -0,76 (V)
➝ Nhận thấy Eo Zn2+/Zn < Eo Fe2+/Fe
➝ Pin 3 là đáp án đúng.
⇒ Chọn đáp án C Đáp án: C
Câu 5 [246706]: Nguyên tử của nguyên tố B thuộc chu kì 3, nhóm VIIA. Cấu hình electron thu gọn nào sau đây phù hợp với nguyên tố B?
A, [Ne]3s23p4.
B, [Ar]3s23p5.
C, [Ne]3s23p5.
D, [Ar]4s24p5.
Nguyên tố B thuộc chu kì 3 ⇒ có 3 lớp electron.
Thuộc nhóm VIIA ⇒ Có 7 electron lớp ngoài cùng.
⟶ Cấu hình electron của B là: [Ne]3s23p5.
⇒ Chọn đáp án C Đáp án: C
Thuộc nhóm VIIA ⇒ Có 7 electron lớp ngoài cùng.
⟶ Cấu hình electron của B là: [Ne]3s23p5.
⇒ Chọn đáp án C Đáp án: C
Câu 6 [560907]: Thuốc diệt chuột cân phải không tan trong nước mưa nhưng hòa tan ở độ pH thấp của chất chứa trong dạ dày. Hợp chất barium nào thích hợp để dùng làm thuộc diệt chuột?
A, Barium carbonate.
B, Barium chloride.
C, Barium hydroxide.
D, Barium sulfate.
Barium carbonate BaCO3 không tan trong nước mưa (pH trung tính) nhưng sẽ hòa tan trong môi trường có độ pH thấp, như trong dạ dày, tạo ra barium ion (Ba2+) có tính độc hại. Khi chuột nuốt phải barium carbonate, nó sẽ bị hòa tan trong dạ dày, giải phóng barium ion gây độc cho cơ thể.
❌ B. Barium chloride (BaCl2): Là một muối tan trong nước, không có đặc tính phù hợp với yêu cầu của thuốc diệt chuột.
❌ C. Barium hydroxide (Ba(OH)2): Là một base mạnh, tan trong nước và có tính kiềm cao, không phù hợp để làm thuốc diệt chuột.
❌ D. Barium sulfate (BaSO4): Là một muối không tan trong nước và cũng không có tính độc hại ở nồng độ bình thường, không phù hợp với mục đích diệt chuột.
⟹ Chọn đáp án A. Đáp án: A
❌ B. Barium chloride (BaCl2): Là một muối tan trong nước, không có đặc tính phù hợp với yêu cầu của thuốc diệt chuột.
❌ C. Barium hydroxide (Ba(OH)2): Là một base mạnh, tan trong nước và có tính kiềm cao, không phù hợp để làm thuốc diệt chuột.
❌ D. Barium sulfate (BaSO4): Là một muối không tan trong nước và cũng không có tính độc hại ở nồng độ bình thường, không phù hợp với mục đích diệt chuột.
⟹ Chọn đáp án A. Đáp án: A
Câu 7 [186755]: Acid X là hóa chất quan trọng trong nhiều ngành như sản xuất phân bón, luyện kim, chất dẻo, acquy, chất tẩy rửa…Trong phòng thí nghiệm acid X còn được dùng làm chất hút ẩm. Chất X là
A, H3PO4.
B, HNO3.
C, H2SO4.
D, HCl.
Acid này chính là acid sulfuric (H2SO4), vì:
- Ứng dụng rộng rãi:
+) H2SO4 là nguyên liệu chính để sản xuất phân bón (superphosphate, ammonium sulfate).
+) Dùng trong luyện kim để tẩy gỉ kim loại.
+) Làm chất điện li trong acquy chì.
+) Tham gia sản xuất nhựa, chất dẻo và chất tẩy rửa.
- Tính chất hút ẩm mạnh:H2SO4 có tính hút nước mạnh do đặc tính khử nước của nó, nên được dùng làm chất hút ẩm trong phòng thí nghiệm.
⇒ Chọn đáp án C Đáp án: C
- Ứng dụng rộng rãi:
+) H2SO4 là nguyên liệu chính để sản xuất phân bón (superphosphate, ammonium sulfate).
+) Dùng trong luyện kim để tẩy gỉ kim loại.
+) Làm chất điện li trong acquy chì.
+) Tham gia sản xuất nhựa, chất dẻo và chất tẩy rửa.
- Tính chất hút ẩm mạnh:H2SO4 có tính hút nước mạnh do đặc tính khử nước của nó, nên được dùng làm chất hút ẩm trong phòng thí nghiệm.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [304841]: Thủy phân etser nào sau đây trong dung dịch NaOH thu được sodium formate?
A, CH3COOC3H7.
B, CH3COOCH3.
C, HCOOC2H5.
D, CH3COOC2H5.
Phân tích phản ứng thủy phân ester trong môi trường base:
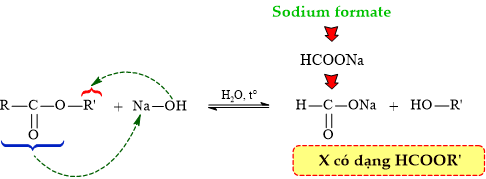
⇒ Quan sát 4 đáp án thì C. HCOOC2H5 thỏa mãn ⟹ Chọn đáp án C.
Còn lại các đáp án khác:
❌ A. CH3COOC3H7 + NaOH ––to→ CH3COONa (sodium acetate) + C3H7OH.
❌ B. CH3COOCH3 + NaOH ––to→ CH3COONa (sodium acetate) + CH3OH.
❌ D. CH3COOC2H5 + NaOH ––to→ CH3COONa (sodium acetate) + C2H5OH. Đáp án: C

⇒ Quan sát 4 đáp án thì C. HCOOC2H5 thỏa mãn ⟹ Chọn đáp án C.
Còn lại các đáp án khác:
❌ A. CH3COOC3H7 + NaOH ––to→ CH3COONa (sodium acetate) + C3H7OH.
❌ B. CH3COOCH3 + NaOH ––to→ CH3COONa (sodium acetate) + CH3OH.
❌ D. CH3COOC2H5 + NaOH ––to→ CH3COONa (sodium acetate) + C2H5OH. Đáp án: C
Câu 9 [704296]: Hợp chất nào sau đây là tên gọi của một amino acid?
A, Ethanoic acid.
B, Alanine.
C, DNA.
D, Amylase.
❌ A. Ethanoic acid là carboxylic acid.
✔️ B. Alanine là amino acid.
❌ C. DNA là những nucleic acid, cùng với protein, lipid và carbohydrate cao phân tử (polysaccharide) đều là những đại phân tử sinh học chính có vai trò quan trọng thiết yếu đối với mọi dạng sống được biết đến.
❌ D. Amylase là tên gọi của một nhóm enzyme (một loại protein) do tuyến tụy và các tuyến nước bọt sản xuất.
⇒ Chọn đáp án B Đáp án: B
✔️ B. Alanine là amino acid.
❌ C. DNA là những nucleic acid, cùng với protein, lipid và carbohydrate cao phân tử (polysaccharide) đều là những đại phân tử sinh học chính có vai trò quan trọng thiết yếu đối với mọi dạng sống được biết đến.
❌ D. Amylase là tên gọi của một nhóm enzyme (một loại protein) do tuyến tụy và các tuyến nước bọt sản xuất.
⇒ Chọn đáp án B Đáp án: B
Câu 10 [704297]: Số nguyên tử carbon trong một phân tử maltose là
A, 5.
B, 12.
C, 11.
D, 22.
Saccharose và maltose là disaccharide có công thức phân tử chung: C12H22O11, là đồng phân của nhau.
Trong một phân tử maltose có 12 nguyên tử carbon.
⇒ Chọn đáp án B Đáp án: B
Trong một phân tử maltose có 12 nguyên tử carbon.
⇒ Chọn đáp án B Đáp án: B
Câu 11 [704298]: Khi liên kết C–X bị phân cắt mà cặp electron dùng chung thuộc về nguyên tử C sẽ sinh ra một anion có điện tích âm trên nguyên tử C nên anion đó được gọi là carbanion (kí hiệu là 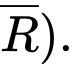
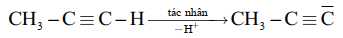
Các gốc carbanion thường rất kém bền, thường tồn tại trong một khoảng thời gian rất ngắn (vài phần nghìn giây). Mật độ electron tồn tại trên nguyên tử carbon càng lớn thì carbanion càng kém bền. Biết rằng các nhóm methyl CH3 mang hiệu ứng đẩy electron. Cho các gốc carbanion như sau:
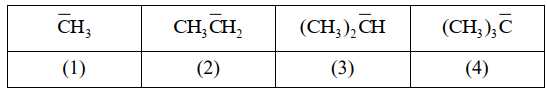
Dãy được sắp xếp theo độ bền của các gốc carbanion tăng dần là
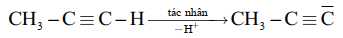
Các gốc carbanion thường rất kém bền, thường tồn tại trong một khoảng thời gian rất ngắn (vài phần nghìn giây). Mật độ electron tồn tại trên nguyên tử carbon càng lớn thì carbanion càng kém bền. Biết rằng các nhóm methyl CH3 mang hiệu ứng đẩy electron. Cho các gốc carbanion như sau:

Dãy được sắp xếp theo độ bền của các gốc carbanion tăng dần là
A, (1) < (2) < (3) < (4).
B, (2) < (3) < (4) < (1).
C, (4) < (3) < (2) < (1).
D, (2) < (4) < (1) < (3).
Các gốc carbanion thường rất kém bền, tồn tại trong khoảng thời gian rất ngắn. Mật độ electron tồn tại trên nguyên tử carbon càng lớn thì carbanion càng kém bền, nhóm CH3 mang hiệu ứng đẩy electron nên gốc càng nhiều nhóm CH3 thì mật độ electron trên phân tử C càng nhiều.
⇒ Độ bền của các carbanion theo thứ tự tăng dần sau (4) < (3) < (2) < (1).
⇒ Chọn đáp án C Đáp án: C
⇒ Độ bền của các carbanion theo thứ tự tăng dần sau (4) < (3) < (2) < (1).
⇒ Chọn đáp án C Đáp án: C
Câu 12 [304116]: Ethyl acetate có công thức là
A, C2H5COOCH3.
B, CH3COOCH3.
C, CH3COOC2H5.
D, C2H3COOCH3.
Phân tích tên gọi: ethyl acetate.
• Ethyl là gốc CH3CH2–.
• Acetate là gốc acid: CH3COO
⇒ Ghép lại cấu tạo ester: CH3COOCH2CH3 hay viết gọn CH3COOC2H5
⟹ Chọn đáp án C Đáp án: C
• Ethyl là gốc CH3CH2–.
• Acetate là gốc acid: CH3COO
⇒ Ghép lại cấu tạo ester: CH3COOCH2CH3 hay viết gọn CH3COOC2H5
⟹ Chọn đáp án C Đáp án: C
Câu 13 [704299]: Năm 2020 tại cảng biển thành phố Beirut, thủ đô của Liban đã xảy ra hai vụ nổ liên tiếp. Nguyên nhân gây ra bở vụ nổ của 2750 tấn ammonium nitrate, NH4NO3 (một loại đạm thông thường trong nông nghiệp). Vụ nổ này gây ra thiệt hại rất lớn về người và của.
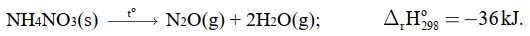
Phát biểu nào sau đây không đúng?
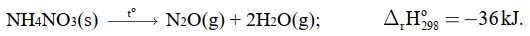
Phát biểu nào sau đây không đúng?
A, Sự thu nhiệt của phản ứng có thể gây nổ.
B, Khí và nhiệt sinh ra làm thể tích giãn nở đột ngột.
C, Có thể sử dụng nước để hạ nhiệt độ đám cháy.
D, Khi lưu trữ NH4NO3 cần tránh xa các chất dễ cháy và tránh xa nguồn nhiệt.
Phân tích các phát biểu:
❌ A. Sai. Phản ứng có biến thiên enthalpy dương, là phản ứng thu nhiệt. Tuy nhiên, chính sự tỏa nhiệt từ môi trường bên ngoài (như ngọn lửa hoặc nhiệt độ cao) mới có thể kích hoạt phản ứng, gây phân hủy NH4NO3 và tạo ra một lượng lớn khí (N2O, H2O). Áp suất tăng đột ngột do thể tích khí sinh ra là nguyên nhân gây nổ, không phải do bản thân phản ứng thu nhiệt.
✔️ B. Đúng. Phản ứng sinh ra N2O(g) và H2O(g), đồng thời tỏa nhiệt từ sự phân hủy khi có các điều kiện kích hoạt. Các khí này làm thể tích giãn nở đột ngột, gây áp suất cực lớn dẫn đến vụ nổ.
✔️ C. Đúng. Nước có thể làm giảm nhiệt độ và ngăn chặn phản ứng dây chuyền. Vì vậy, đây là một biện pháp hợp lý trong trường hợp nguy cơ cháy lan hoặc nổ NH4NO3.
✔️ D. Đúng. NH4NO3 là chất oxi hóa mạnh. Nếu tiếp xúc với các chất dễ cháy hoặc nhiệt độ cao, nó có thể phân hủy mạnh, sinh nhiệt và khí, dễ dẫn đến cháy hoặc nổ.
⇒ Chọn đáp án A Đáp án: A
❌ A. Sai. Phản ứng có biến thiên enthalpy dương, là phản ứng thu nhiệt. Tuy nhiên, chính sự tỏa nhiệt từ môi trường bên ngoài (như ngọn lửa hoặc nhiệt độ cao) mới có thể kích hoạt phản ứng, gây phân hủy NH4NO3 và tạo ra một lượng lớn khí (N2O, H2O). Áp suất tăng đột ngột do thể tích khí sinh ra là nguyên nhân gây nổ, không phải do bản thân phản ứng thu nhiệt.
✔️ B. Đúng. Phản ứng sinh ra N2O(g) và H2O(g), đồng thời tỏa nhiệt từ sự phân hủy khi có các điều kiện kích hoạt. Các khí này làm thể tích giãn nở đột ngột, gây áp suất cực lớn dẫn đến vụ nổ.
✔️ C. Đúng. Nước có thể làm giảm nhiệt độ và ngăn chặn phản ứng dây chuyền. Vì vậy, đây là một biện pháp hợp lý trong trường hợp nguy cơ cháy lan hoặc nổ NH4NO3.
✔️ D. Đúng. NH4NO3 là chất oxi hóa mạnh. Nếu tiếp xúc với các chất dễ cháy hoặc nhiệt độ cao, nó có thể phân hủy mạnh, sinh nhiệt và khí, dễ dẫn đến cháy hoặc nổ.
⇒ Chọn đáp án A Đáp án: A
Câu 14 [704300]: “Khi thay đổi mạch carbon, vị trí nhóm chức hoặc số nhóm …(1)… liên kết với nguyên tử …(2)… thu được các đồng phân amine”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, chức, hydrogen.
B, chức, carbon.
C, thế, carbon.
D, thế, nitrogen.
Khi thay đổi mạch carbon, vị trí nhóm chức hoặc số nhóm thế liên kết với nguyên tử nitrogen thu được các đồng phân amine
Giải thích:
Amine là hợp chất hữu cơ có chứa nhóm chức NH2, hoặc nhóm chứa nitrogen liên kết với các gốc hydrocarbon. Các đồng phân của amine được tạo ra khi có sự thay đổi:
- Thay đổi độ dài hoặc cấu trúc của mạch carbon gắn với nguyên tử nitrogen.
- Vị trí nhóm chức.
- Số nhóm alkyl liên kết với nguyên tử nitrogen.
⇒ Chọn đáp án D Đáp án: D
Giải thích:
Amine là hợp chất hữu cơ có chứa nhóm chức NH2, hoặc nhóm chứa nitrogen liên kết với các gốc hydrocarbon. Các đồng phân của amine được tạo ra khi có sự thay đổi:
- Thay đổi độ dài hoặc cấu trúc của mạch carbon gắn với nguyên tử nitrogen.
- Vị trí nhóm chức.
- Số nhóm alkyl liên kết với nguyên tử nitrogen.
⇒ Chọn đáp án D Đáp án: D
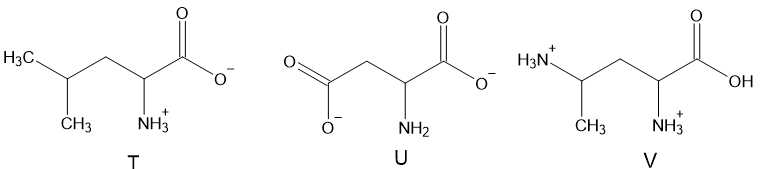
Câu 15 [704301]: Dung dịch X gồm ba amino acid có cấu tạo như dưới đây:
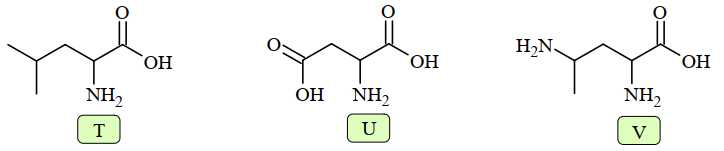
Dung dịch X được thiết lập ở pH = 5,91 và thấm lên một tờ giấy, rồi nối tờ giấy với hai điện cực của nguồn điện một chiều thu được kết quả như sau.
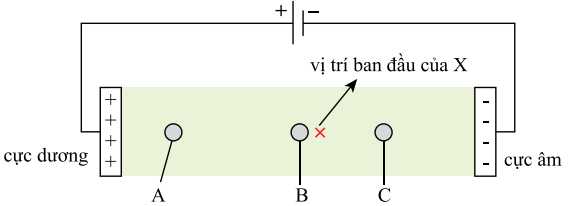
Cho các nhận định sau:
(a) Ở pH = 5,91, T gần như không di chuyển trong điện trường.
(b) Tại môi trường có pH = 5,91, tổng điện tích của U là –1.
(c) Do có phân tử khối lớn nên tại pH = 5,91, chất ở vị trí B gần như không di chuyểntrong điện trường.
(d) Các chất ở các vị trí A, B, C, lần lượt là V, T, U.
Số nhận định đúng là

Dung dịch X được thiết lập ở pH = 5,91 và thấm lên một tờ giấy, rồi nối tờ giấy với hai điện cực của nguồn điện một chiều thu được kết quả như sau.

Cho các nhận định sau:
(a) Ở pH = 5,91, T gần như không di chuyển trong điện trường.
(b) Tại môi trường có pH = 5,91, tổng điện tích của U là –1.
(c) Do có phân tử khối lớn nên tại pH = 5,91, chất ở vị trí B gần như không di chuyểntrong điện trường.
(d) Các chất ở các vị trí A, B, C, lần lượt là V, T, U.
Số nhận định đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Tại pH = 5,91 dạng tồn tại của amino acid trong dung dịch như sau::
Sử dụng phương pháp điện di trong dung dịch tại pH = 5,91
- Tại vị trí B là T không mang điện nên T gần như không di chuyển trong điện trường.
- A là U có dạng anion nên sẽ di chuyển về phía cực dương.
- C là V có dạng cation nên sẽ di chuyển về phía cực âm.
✔️ (a) Đúng. Ở pH = 5,91, T gần như không di chuyển trong điện trường.
✔️(b) Đúng. Tại pH = 5,91 tổng điện tích của U là -1
❌ (c) Sai. Tại vị trí B là T không mang điện nên T gần như không di chuyển trong điện trường.
❌ (d) Sai. Các chất ở các vị trí A, B, C, lần lượt là U, T, V.
⇒ Chọn đáp án B Đáp án: B

Sử dụng phương pháp điện di trong dung dịch tại pH = 5,91
- Tại vị trí B là T không mang điện nên T gần như không di chuyển trong điện trường.
- A là U có dạng anion nên sẽ di chuyển về phía cực dương.
- C là V có dạng cation nên sẽ di chuyển về phía cực âm.
✔️ (a) Đúng. Ở pH = 5,91, T gần như không di chuyển trong điện trường.
✔️(b) Đúng. Tại pH = 5,91 tổng điện tích của U là -1
❌ (c) Sai. Tại vị trí B là T không mang điện nên T gần như không di chuyển trong điện trường.
❌ (d) Sai. Các chất ở các vị trí A, B, C, lần lượt là U, T, V.
⇒ Chọn đáp án B Đáp án: B
Câu 16 [704302]: Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của hợp chất X là 158. Chất X có thể là
A, 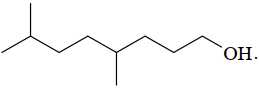

B, 

C, 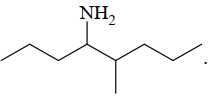

D, 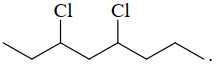

✔️ A. (CH3)2CH[CH2]2CH(CH3)[CH2]3OH có phân tử khối: 158 gam/mol
❌ B. CH3CH2C(CH3)C[CH2]3CH3 có phân tử khối: 126 gam/mol
❌ C. CH3[CH2]2CH(NH2)C(CH3)[CH2]2CH3 có phân tử khối: 143 gam/mol
❌ D. CH3CH2CH(Cl)CH2CH(Cl)[CH2]2CH3 có phân tử khối: 183 gam/mol
⇒ Chọn đáp án A Đáp án: A
❌ B. CH3CH2C(CH3)C[CH2]3CH3 có phân tử khối: 126 gam/mol
❌ C. CH3[CH2]2CH(NH2)C(CH3)[CH2]2CH3 có phân tử khối: 143 gam/mol
❌ D. CH3CH2CH(Cl)CH2CH(Cl)[CH2]2CH3 có phân tử khối: 183 gam/mol
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Nồng độ tổng cộng của Ca2+ và Mg2+ trong mẫu nước cứng được xác định bằng cách chuẩn độ 1,0 L mẫu nước bằng dung dịch EDTA4– (EDTA4– có khả năng tạo phức với hai cation):
Mg2+ + EDTA4– → [Mg(EDTA)]2–
Ca2+ + EDTA4– → [Ca(EDTA)]2–
Cần 31,5 mL dung dịch EDTA4– 0,0104 M để đạt đến điểm cuối trong quá trình chuẩn độ. Sau đó, mẫu 0,100 L thứ hai được xử lý bằng ion sulfate để kết tủa Ca2+ dưới dạng calcium sulfate, loại bỏ kết tủa. Sau đó, chuẩn độ Mg2+ bằng 18,7 mL dung dịch EDTA4– 0,0104 M.
Mg2+ + EDTA4– → [Mg(EDTA)]2–
Ca2+ + EDTA4– → [Ca(EDTA)]2–
Cần 31,5 mL dung dịch EDTA4– 0,0104 M để đạt đến điểm cuối trong quá trình chuẩn độ. Sau đó, mẫu 0,100 L thứ hai được xử lý bằng ion sulfate để kết tủa Ca2+ dưới dạng calcium sulfate, loại bỏ kết tủa. Sau đó, chuẩn độ Mg2+ bằng 18,7 mL dung dịch EDTA4– 0,0104 M.
Câu 17 [704303]: Nguyên tử kim loại trung tâm trong cả hai phức chất [Mg(EDTA)]2– và [Ca(EDTA)]2– đều có số oxi hóa là
A, -2.
B, 0.
C, +1.
D, +2.
- Nguyên tử kim loại trung tâm trong cả hai phức chất [Mg(EDTA)]2– và [Ca(EDTA)]2– đều là Mg và Ca, thuộc nhóm kim loại kiềm thổ trong bảng tuần hoàn.
- Vì EDTA là một phối tử không thay đổi điện tích tổng, nên số oxi hóa của kim loại trong cả hai phức chất này chính là điện tích của ion kim loại trước khi tạo phức, cụ thể là:
+ Mg có số oxi hóa là +2.
+ Ca cũng có số oxi hóa là +2.
Vậy số oxi hóa của nguyên tử kim loại trung tâm trong cả hai phức chất đều là +2.
⇒ Chọn đáp án D Đáp án: D
- Vì EDTA là một phối tử không thay đổi điện tích tổng, nên số oxi hóa của kim loại trong cả hai phức chất này chính là điện tích của ion kim loại trước khi tạo phức, cụ thể là:
+ Mg có số oxi hóa là +2.
+ Ca cũng có số oxi hóa là +2.
Vậy số oxi hóa của nguyên tử kim loại trung tâm trong cả hai phức chất đều là +2.
⇒ Chọn đáp án D Đáp án: D
Câu 18 [704304]: Nồng độ của Mg2+ và Ca2+ trong nước cứng theo mg/L lần lượt là
A, 1,9448×10–4 và 1,3312×10–4.
B, 4,6675 và 5,3248.
C, 8,6258×10–3 và 4,2458×10–3.
D, 1,2458 và 2,4871.
Đổi 31,5 mL = 0,0315 L; 18,7 mL = 0,0187 L
(1) Mg2+ + EDTA4- → [Mg(EDTA)]2-
(2) Ca2+ + EDTA4- → [Ca(EDTA)]2-
+ Xử lí lần 1 thông qua mol của EDTA4- xác định tổng mol của 2 ion Ca2+ và Mg2+
Từ PTHH số mol của tổng mol của 2 ion Ca2+ và Mg2+ là:
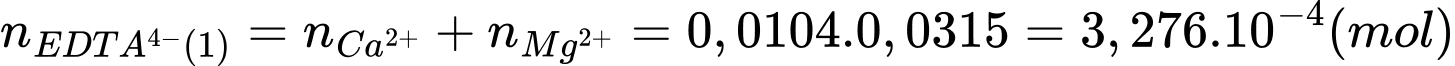
+ Xử lí lần 2: việc tạo kết tủa của ion Ca2+ thành CaSO4 nên thông qua mol của EDTA4- xác định mol của Mg2+
Số mol của Mg2+ là: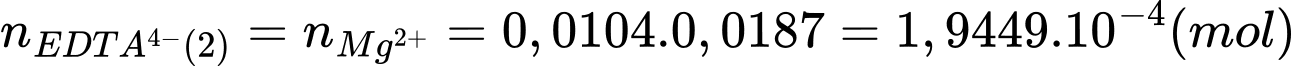
Số mol của Ca2+ trong nước cứng là:
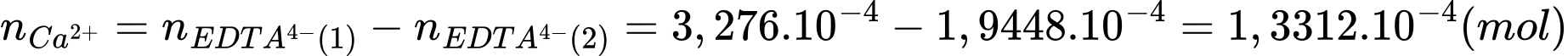
Nồng độ của Mg2+ và Ca2+ trong mẫu nước cứng theo mg/L lần lượt là 4,6675 và 5,3248 mg/L
Nồng độ Mg2+: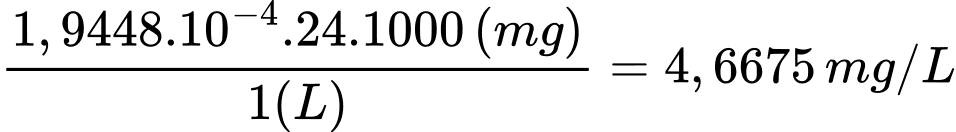
Nồng độ Ca2+: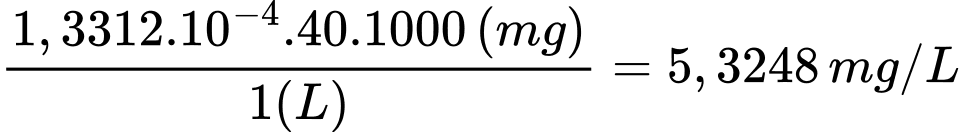
⇒ Chọn đáp án B Đáp án: B
(1) Mg2+ + EDTA4- → [Mg(EDTA)]2-
(2) Ca2+ + EDTA4- → [Ca(EDTA)]2-
+ Xử lí lần 1 thông qua mol của EDTA4- xác định tổng mol của 2 ion Ca2+ và Mg2+
Từ PTHH số mol của tổng mol của 2 ion Ca2+ và Mg2+ là:
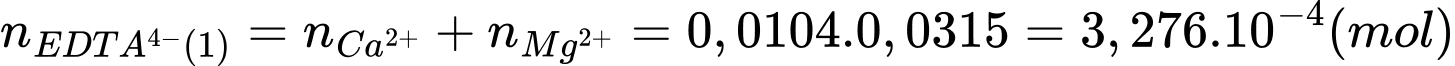
+ Xử lí lần 2: việc tạo kết tủa của ion Ca2+ thành CaSO4 nên thông qua mol của EDTA4- xác định mol của Mg2+
Số mol của Mg2+ là:
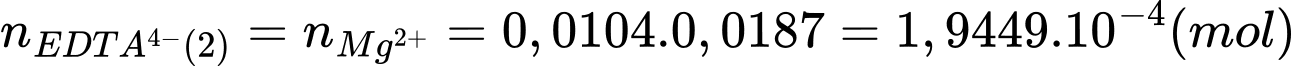
Số mol của Ca2+ trong nước cứng là:
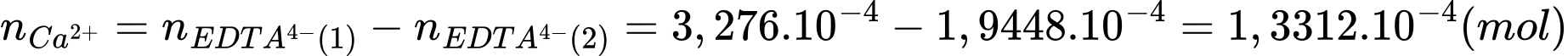
Nồng độ của Mg2+ và Ca2+ trong mẫu nước cứng theo mg/L lần lượt là 4,6675 và 5,3248 mg/L
Nồng độ Mg2+:
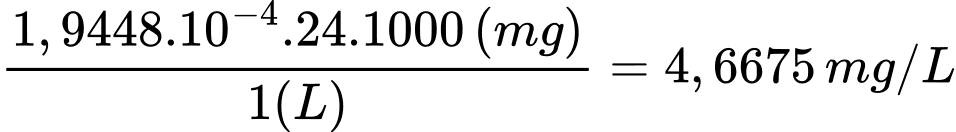
Nồng độ Ca2+:
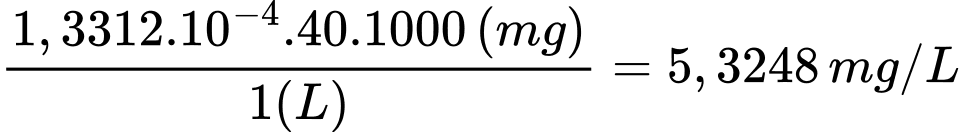
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704305]: Khả năng hoạt động hóa học của hai kim loại có thể được so sánh thông quá thí nghiệm như sau:
Bước 1: Chuẩn bị một đinh sắt đã được đánh sạch bề mặt, một dung dịch copper(II) sulfate 1 M được đựng trong cốc thuỷ tinh.
Bước 2: Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch copper(II) sulfate 1 M. Sau khoảng 10 phút thì quan sát hiện tượng.
Bước 1: Chuẩn bị một đinh sắt đã được đánh sạch bề mặt, một dung dịch copper(II) sulfate 1 M được đựng trong cốc thuỷ tinh.
Bước 2: Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch copper(II) sulfate 1 M. Sau khoảng 10 phút thì quan sát hiện tượng.
Fe + CuSO4 → FeSO4 + Cu
Quá trình oxi hóa Fe → Fe2+ + 2e
Quá trình khử Cu2+ + 2e → Cu
Phân tích các phát biểu:
✔️ (a) Đúng. Sau phản ứng sinh ra kim loại Cu màu nâu bám trên đinh sắt.
❌ (b) Sai. Sau phản ứng sinh ra kim loại Cu nên nồng độ của Cu2+ giảm dần.
❌ (c) Sai. Thế khử chuẩn của Fe2+/Fe nhỏ hơn thế khử chuẩn của Cu2+/Cu, Eo Mn+/M càng lớn thì tính oxi hóa của Mn+ càng mạnh; tính khử của M càng yếu
✔️ (d) Đúng. Từ hiện tượng ta thấy được Fe đã chiếm vị trí của Cu trong muối, Fe có độ hoạt động mạnh hơn Cu.
Quá trình oxi hóa Fe → Fe2+ + 2e
Quá trình khử Cu2+ + 2e → Cu
Phân tích các phát biểu:
✔️ (a) Đúng. Sau phản ứng sinh ra kim loại Cu màu nâu bám trên đinh sắt.
❌ (b) Sai. Sau phản ứng sinh ra kim loại Cu nên nồng độ của Cu2+ giảm dần.
❌ (c) Sai. Thế khử chuẩn của Fe2+/Fe nhỏ hơn thế khử chuẩn của Cu2+/Cu, Eo Mn+/M càng lớn thì tính oxi hóa của Mn+ càng mạnh; tính khử của M càng yếu
✔️ (d) Đúng. Từ hiện tượng ta thấy được Fe đã chiếm vị trí của Cu trong muối, Fe có độ hoạt động mạnh hơn Cu.
Câu 20 [704306]: Khi hydrate hóa pent-2-ene có thể thu được hai hợp chất là pentan-2-ol và pentan-3-ol.
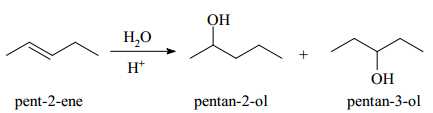
Phổ hồng ngoại (phổ IR) của pentan-2-ol (hình a) và pentan-3-ol (hình b) được cho dưới đây
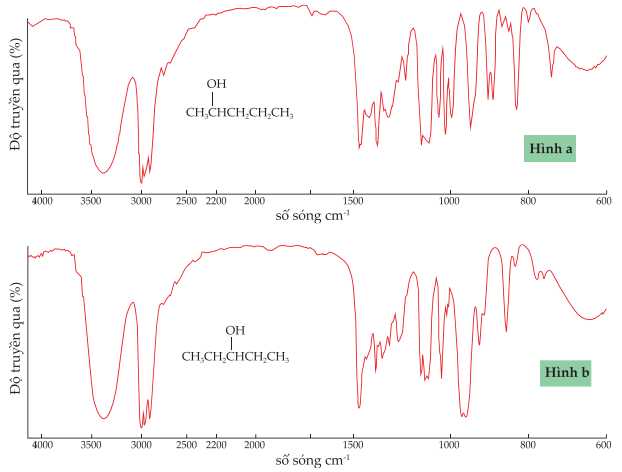

Phổ hồng ngoại (phổ IR) của pentan-2-ol (hình a) và pentan-3-ol (hình b) được cho dưới đây

Phân tích các phát biểu:
❌ (a) Sai. Phổ hồng ngoại dùng để xác định nhóm chức có trong hợp chất hữu cơ, nên khó thể xác định liên kết C-C có ở số sóng 4000 cm-1.
✔️ (b) Đúng. Số sóng hấp thụ đặc trưng của liên kết O – H nằm trong khoảng 3500 – 3200 cm-1.
✔️ (c) Đúng. Vị trí nhóm OH của pentan-2-ol được gắn ở C số 2 còn pentan-3-ol được gắn ở C số 3.
❌ (d) Sai. Phổ IR được sử dụng để nghiên cứu và xác định hóa chất hoặc nhóm chức ở dạng rắn, lỏng hoặc khí nên khó có thể phân biệt được pentan-2-ol và pentan-3-ol.
Câu 21 [704307]: Bông có thành phần chính là cellulose, một loại polysaccharide. Tiến hành thủy phân cellulose theo các bước dưới:
▪ Bước 1: Cho vào ống nghiệm (1) một nhúm nhỏ bông và khoảng 2 mL dung dịch H2SO4 70 %. Khuấy đều rồi đặt ống nghiệm vào cốc nước nóng, thỉnh thoảng dùng đũa thuỷ tinh khuấy nhẹ, cho đến khi thu được dung dịch đồng nhất.
▪ Bước 2: Để nguội, lấy 1 mL dung dịch trong ống (1) cho vào ống (2).
▪ Bước 3: Cho từ từ dung dịch NaOH 10 % vào ống nghiệm (2) đến khi môi trường có tính kiềm.
▪ Bước 4: Cho tiếp 5 giọt dung dịch CuSO4 5 %.
▪ Bước 5: Lắc đều và đun nóng nhẹ dung dịch trong ống nghiệm.
▪ Bước 1: Cho vào ống nghiệm (1) một nhúm nhỏ bông và khoảng 2 mL dung dịch H2SO4 70 %. Khuấy đều rồi đặt ống nghiệm vào cốc nước nóng, thỉnh thoảng dùng đũa thuỷ tinh khuấy nhẹ, cho đến khi thu được dung dịch đồng nhất.
▪ Bước 2: Để nguội, lấy 1 mL dung dịch trong ống (1) cho vào ống (2).
▪ Bước 3: Cho từ từ dung dịch NaOH 10 % vào ống nghiệm (2) đến khi môi trường có tính kiềm.
▪ Bước 4: Cho tiếp 5 giọt dung dịch CuSO4 5 %.
▪ Bước 5: Lắc đều và đun nóng nhẹ dung dịch trong ống nghiệm.
Bước 1:
(C6H10O5)n + nH2O nC6H12O6
nC6H12O6
(C6H10O5)n 6nC + 5nH2O
6nC + 5nH2O
C + 2H2SO4 → 2SO2 + CO2 + 2H2O
Bước 3:
2NaOH + H2SO4 → Na2SO4 + H2O
Bước 4:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Bước 5
Cu(OH)2 + 2C6H12O6 → [C6H11O6]2Cu + 2H2O
CH2OH(CHOH)4CHO + 2Cu(OH)2 + NaOH CH2OH(CHOH)4COONa + Cu2O + 3H2O
CH2OH(CHOH)4COONa + Cu2O + 3H2O
Phân tích các phát biểu:
❌ (a) Sai. Bước 1 có phản ứng thủy phân của cellulose với trong môi trường acid, cellulose không tan trong nước.
✔️ (b) Đúng. NaOH trung hòa dung dịch H2SO4 và chuẩn bị cho phản ứng với CuSO4.
❌ (c) Sai. Xuất hiện kết tủa xanh đã xảy ra ở bước 4, CuSO4 tạo kết tủa ngay khi tác dụng với NaOH.
❌ (d) Sai. Sản phẩm của phản ứng thủy phân cellulose là glucose, Glucose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
(C6H10O5)n + nH2O
 nC6H12O6
nC6H12O6(C6H10O5)n
 6nC + 5nH2O
6nC + 5nH2OC + 2H2SO4 → 2SO2 + CO2 + 2H2O
Bước 3:
2NaOH + H2SO4 → Na2SO4 + H2O
Bước 4:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Bước 5
Cu(OH)2 + 2C6H12O6 → [C6H11O6]2Cu + 2H2O
CH2OH(CHOH)4CHO + 2Cu(OH)2 + NaOH
 CH2OH(CHOH)4COONa + Cu2O + 3H2O
CH2OH(CHOH)4COONa + Cu2O + 3H2OPhân tích các phát biểu:
❌ (a) Sai. Bước 1 có phản ứng thủy phân của cellulose với trong môi trường acid, cellulose không tan trong nước.
✔️ (b) Đúng. NaOH trung hòa dung dịch H2SO4 và chuẩn bị cho phản ứng với CuSO4.
❌ (c) Sai. Xuất hiện kết tủa xanh đã xảy ra ở bước 4, CuSO4 tạo kết tủa ngay khi tác dụng với NaOH.
❌ (d) Sai. Sản phẩm của phản ứng thủy phân cellulose là glucose, Glucose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
Câu 22 [704308]: Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước theo sơ đồ sau:
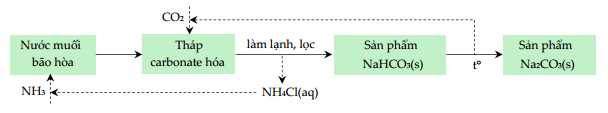
Độ tan của NaHCO3 ở t1 = 20 °C và ở t2 = 40 °C lần lượt là 9,6 g/100 g nước và 12,7 g/100 g nước.

Độ tan của NaHCO3 ở t1 = 20 °C và ở t2 = 40 °C lần lượt là 9,6 g/100 g nước và 12,7 g/100 g nước.
1. Hòa tan bão hòa NaCl trong dung dịch NH3 đặc.
2. Nung CaCO3 ở 950 - 1100 oC rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3, thực tế trong công nghiệp người ta sử dụng các phản ứng này:
CaCO3(s) → CaO(s) + CO2(g)
NaCl(s) + NH3(aq) + CO2(g) + H2O(l) → NaHCO3(s) + NH4Cl(aq)
3. Tách NaHCO3 khỏi dung dịch nhờ tính tan. Nung NaHCO3 ở nhiệt độ 450 - 500 oC thu được soda:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Quá trình nhiệt phân NaHCO3 đã giải phóng một nửa lượng CO2 đã sử dụng, khí này tiếp tục được đưa vào quá trình sản xuất. Còn sản phẩm phụ khác là NH4Cl được chế hóa với vôi tôi (Ca(OH)2) để thu lại khí NH3 và sau đó khí này cũng được đưa trở lại quá trình:
2NH4Cl(aq) + Ca(OH)2 (aq) → CaCl2 (aq) + 2NH3(g) + 2H2O(l)
Các khí CO2, NH3 bay lên được tuần hoàn trở lại, chất thải chính của quá trình là CaCl2 và một số chất không phản ứng khác. NH3 được tuần hoàn trong quá trình sản xuất, vì vậy phương pháp này còn gọi là phương pháp tuần hoàn ammonia.
Phân tích các phát biểu:
✔️ (a) Đúng. Đá vôi đóng vai trò cung cấp CO2 cho quá trình Solvay.
✔️ (b) Đúng. Phương trình hóa học chuyển hóa NaHCO3 thành Na2CO3 là:
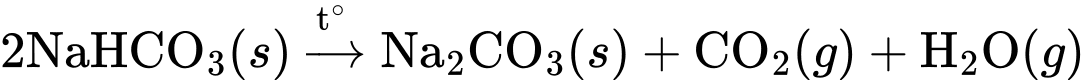
✔️ (c) Đúng. Quy trình trên CO2 chưa phản ứng, hay các khí NH3 và CO2 từ các giai đoạn sau sẽ được hồi quy về giai đoạn đầu để tiếp tục sử dụng.
❌ (d) Sai.
Số gam NaHCO3 có trong 225,4 gam dung dịch NaHCO3 ở nhiệt độ t2 là:
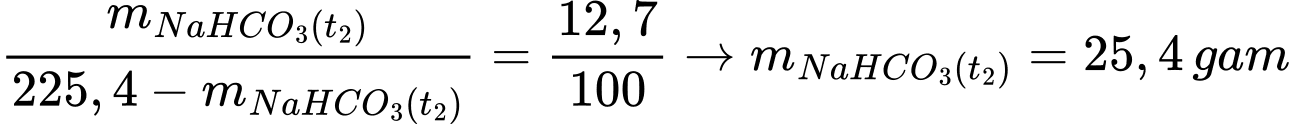
Số gam nước trong dung dịch là: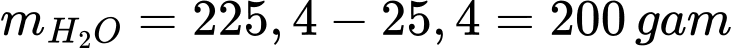
Khối lượng muối NaHCO3 trong dung dịch ở nhiệt độ t1 là:
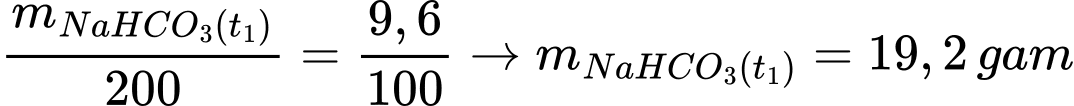
Số gam muối tách ra khi hạ nhiệt độ từ t2 xuống t1 là:
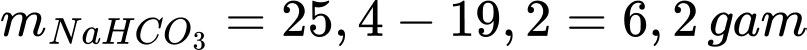
2. Nung CaCO3 ở 950 - 1100 oC rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3, thực tế trong công nghiệp người ta sử dụng các phản ứng này:
CaCO3(s) → CaO(s) + CO2(g)
NaCl(s) + NH3(aq) + CO2(g) + H2O(l) → NaHCO3(s) + NH4Cl(aq)
3. Tách NaHCO3 khỏi dung dịch nhờ tính tan. Nung NaHCO3 ở nhiệt độ 450 - 500 oC thu được soda:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Quá trình nhiệt phân NaHCO3 đã giải phóng một nửa lượng CO2 đã sử dụng, khí này tiếp tục được đưa vào quá trình sản xuất. Còn sản phẩm phụ khác là NH4Cl được chế hóa với vôi tôi (Ca(OH)2) để thu lại khí NH3 và sau đó khí này cũng được đưa trở lại quá trình:
2NH4Cl(aq) + Ca(OH)2 (aq) → CaCl2 (aq) + 2NH3(g) + 2H2O(l)
Các khí CO2, NH3 bay lên được tuần hoàn trở lại, chất thải chính của quá trình là CaCl2 và một số chất không phản ứng khác. NH3 được tuần hoàn trong quá trình sản xuất, vì vậy phương pháp này còn gọi là phương pháp tuần hoàn ammonia.
Phân tích các phát biểu:
✔️ (a) Đúng. Đá vôi đóng vai trò cung cấp CO2 cho quá trình Solvay.
✔️ (b) Đúng. Phương trình hóa học chuyển hóa NaHCO3 thành Na2CO3 là:
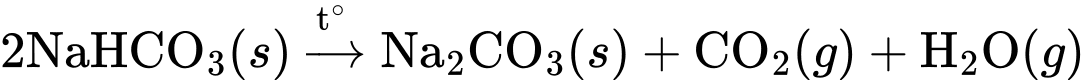
✔️ (c) Đúng. Quy trình trên CO2 chưa phản ứng, hay các khí NH3 và CO2 từ các giai đoạn sau sẽ được hồi quy về giai đoạn đầu để tiếp tục sử dụng.
❌ (d) Sai.
Số gam NaHCO3 có trong 225,4 gam dung dịch NaHCO3 ở nhiệt độ t2 là:
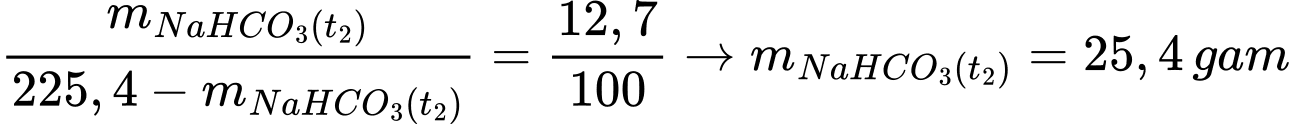
Số gam nước trong dung dịch là:
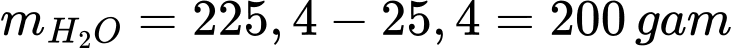
Khối lượng muối NaHCO3 trong dung dịch ở nhiệt độ t1 là:
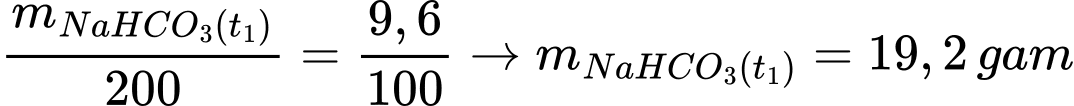
Số gam muối tách ra khi hạ nhiệt độ từ t2 xuống t1 là:
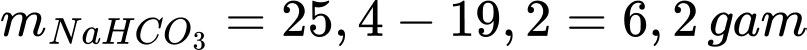
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704309]: Từ 1 tấn tinh bột ngô có thể sản xuất được V m3 xăng E5 (chứa 5% ethanol về thể tích), biết tinh bột ngô chứa 55% tinh bột, hiệu suất chung của cả quá trình điều chế ethanol là 80%, khối lượng riêng của ethanol là 0,8 g/mL. Xác định giá trị của V (làm tròn một chữ số thập phân).
Đổi 0,8 g/mL = 0,8 tấn/m3
Khối lượng tinh bột trong 1 tấn bột ngô là 0,55 tấn
Sơ đồ phản ứng:
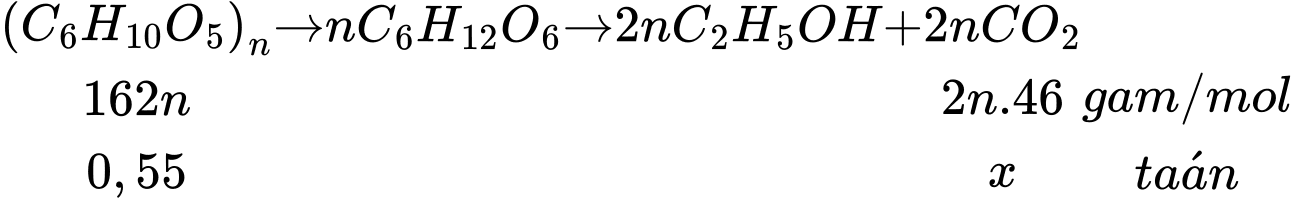
Khối lượng ethanol tạo thành là: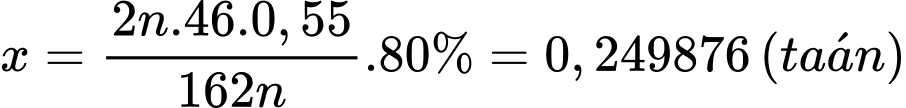
Thể tích xăng E5 là: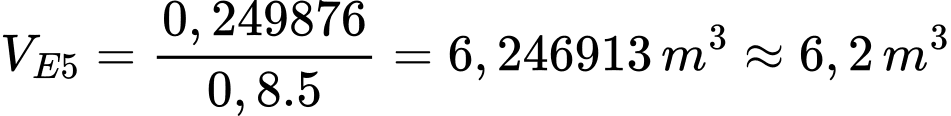
⇒ Điền đáp án: 6,2
Khối lượng tinh bột trong 1 tấn bột ngô là 0,55 tấn
Sơ đồ phản ứng:
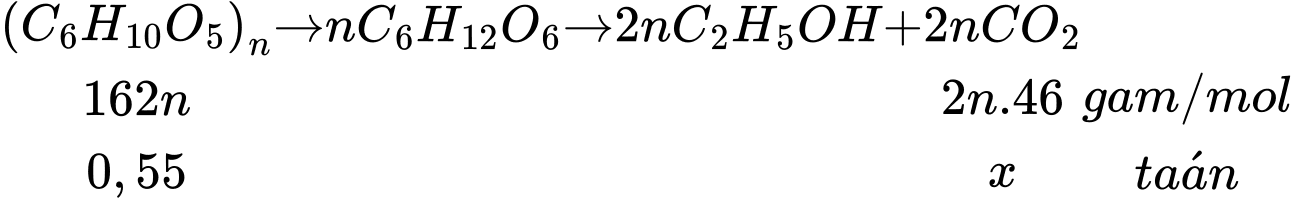
Khối lượng ethanol tạo thành là:
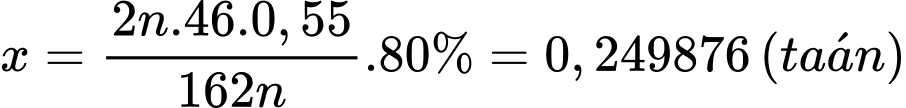
Thể tích xăng E5 là:
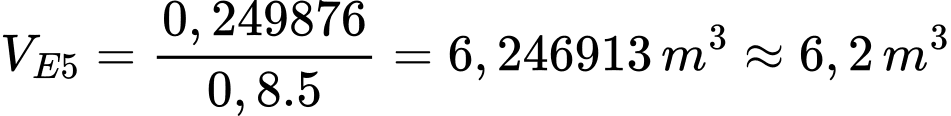
⇒ Điền đáp án: 6,2
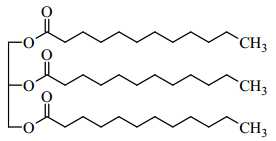
Câu 24 [704310]: Chất béo P có công thức cấu tạo như sau:
Cho P phản ứng với dung dịch NaOH, sản phẩm thu được có chứa muối sodium duy nhất của một acid béo. Phân tử khối của acid béo này là bao nhiêu?

Cho P phản ứng với dung dịch NaOH, sản phẩm thu được có chứa muối sodium duy nhất của một acid béo. Phân tử khối của acid béo này là bao nhiêu?
Chất béo P trên là triester của glycerol với acid béo C11H23COOH
Phân tử khối của acid béo là 200 gam/mol.
⇒ Điền đáp án: 200
Phân tử khối của acid béo là 200 gam/mol.
⇒ Điền đáp án: 200
Câu 25 [704311]: Các kim loại kiềm có khả năng tác dụng mãnh liệt với oxygen có mặt trong không khí và càng mạnh hơn đối với oxygen tinh khiết. Một nhóm học sinh đã tiến hành các bước thí nghiệm kiểm chứng với ba kim loại kiềm: lithium (Li), sodium (Na) và potassium (K) như sau:
(1) Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại sẽ tác dụng với oxygen trong không khí.
(2) Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
(3) Đưa nhanh muỗng chứa kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
(4) Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su).
Hãy sắp xếp số thứ tự các bước để thực hiện thí nghiệm theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
(1) Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại sẽ tác dụng với oxygen trong không khí.
(2) Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
(3) Đưa nhanh muỗng chứa kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
(4) Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su).
Hãy sắp xếp số thứ tự các bước để thực hiện thí nghiệm theo trình tự dãy bốn số (ví dụ: 1234, 4321, ...).
Các bước kiểm chứng khả năng tác dụng của kim loại kiềm với oxygen trong không khí và oxygen tinh khiết:
Bước 1: Dùng dao cắt các mẫu kim loại to bằng hạt đậu → ứng với (2)
Bước 2: Dùng kẹp lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua 1 nút cao su) → ứng với (4)
Bước 3: Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại tác dụng được với oxygen trong không khí. → ứng với (1)
Bước 4: Đưa nhanh muỗng chứa các kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. → ứng với (3)
⇒ Điền đáp án: 2413
Bước 1: Dùng dao cắt các mẫu kim loại to bằng hạt đậu → ứng với (2)
Bước 2: Dùng kẹp lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua 1 nút cao su) → ứng với (4)
Bước 3: Đốt kim loại trong muỗng trên ngọn lửa đèn cồn thì kim loại tác dụng được với oxygen trong không khí. → ứng với (1)
Bước 4: Đưa nhanh muỗng chứa các kim loại đang cháy vào bình tam giác chịu nhiệt chứa khí oxygen. → ứng với (3)
⇒ Điền đáp án: 2413
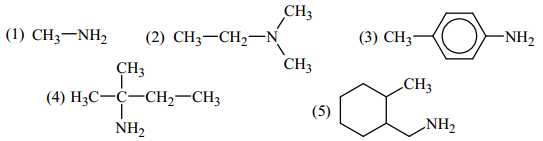
Câu 26 [704312]: Cho các amine có công thức cấu tạo sau:
Có bao nhiêu amine bậc một?

Có bao nhiêu amine bậc một?
Amine bậc một: có nhóm chức dạng –NH2 đính với một gốc hydrocarbon.
Amine bậc hai: có nhóm chức dạng –NH– đính với hai gốc hydrocarbon.
Amine bậc ba: có nhóm chức dạng ≡N đính với ba gốc hydrocarbon.
Trong các amine trên, số amine bậc một là 4 (1, 3, 4, 5). Amine số 2 là mine bậc ba.
⇒ Điền đáp án: 4
Amine bậc hai: có nhóm chức dạng –NH– đính với hai gốc hydrocarbon.
Amine bậc ba: có nhóm chức dạng ≡N đính với ba gốc hydrocarbon.
Trong các amine trên, số amine bậc một là 4 (1, 3, 4, 5). Amine số 2 là mine bậc ba.
⇒ Điền đáp án: 4
Câu 27 [704313]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Trong pin propane - oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
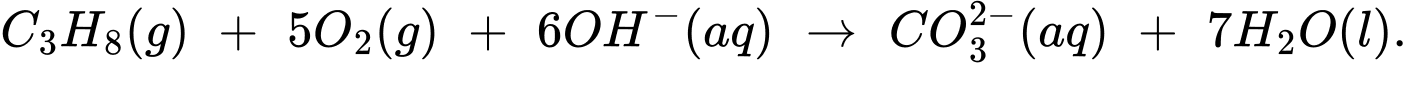
Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane - oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 110 gam propane làm nhiên liệu ở điều kiện chuẩn? Biết enthalpy tiêu chuẩn của các chất được cho trong bảng sau:
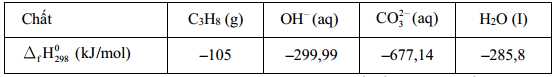
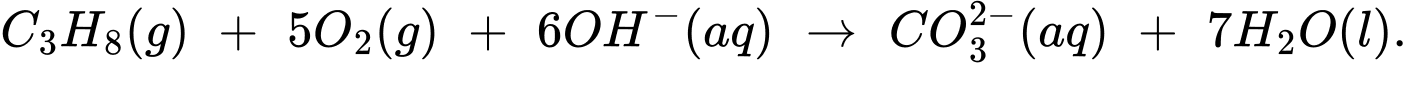
Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane - oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 110 gam propane làm nhiên liệu ở điều kiện chuẩn? Biết enthalpy tiêu chuẩn của các chất được cho trong bảng sau:

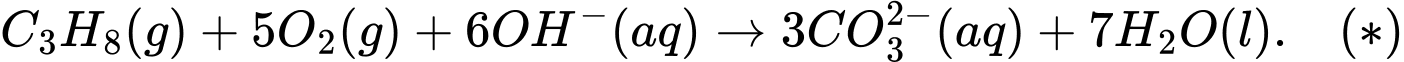
Số mol của propane là:
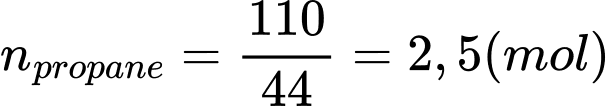
Biến thiên enthalpy của phản ứng (*) là:
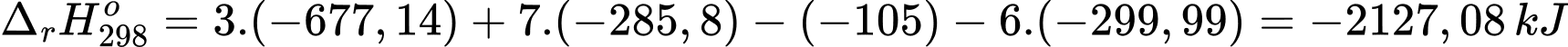
Thời gian thắp sáng bóng đèn liên tục là:
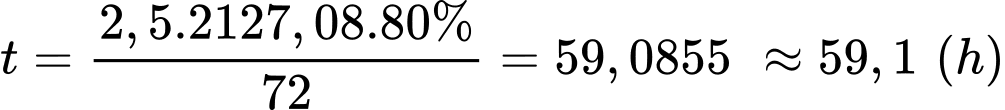
⇒ Điền đáp án: 59,1
Câu 28 [704314]: Trong phòng thí nghiệm, khi bảo quản muối sắt (II) (ví dụ sắt (II) sulfate) rất dễ bị lẫn tạp chất sắt (III). Để xác định chính xác hàm lượng muối sắt (II) trong mẫu, người ta sử dụng phương pháp chuẩn độ pemanganate. Cách tiến hành như sau:
Bước 1: Chuẩn bị dung dịch KMnO4 0,01M, rót đầy vào burret đến vạch (thiết bị đo thể tích).
Bước 2: Cân một lượng muối FeSO4 (x gam) và pha vào bình 100 ml. Sau đó hút 10,0 ml dung dịch FeSO4 đã pha cho vào bình tam giác, thêm vài giọt dung dịch acid H2SO4 vào bình thu được dung dịch A
Bước 3: Mở khóa burret chứa dung dịch KMnO4, nhỏ giọt chậm và lắc đều cho đến khi màu hồng nhạt của dung dịch KMnO4 vẫn giữ ổn định trong 30 giây.
Bước 4: Ghi lại thể tích dung dịch KMnO4 đã sử dụng (V ml). Lặp lại từ bước 1 đến bước 4 ít nhất ba lần và ghi lại các giá trị V.
Kết quả các lần làm thí nghiệm của học sinh như sau:
Tính phần trăm khối lượng FeSO4 trong mẫu biết giá trị x = 0,997. (Làm tròn kết quả đến hàng phần mười).
Bước 1: Chuẩn bị dung dịch KMnO4 0,01M, rót đầy vào burret đến vạch (thiết bị đo thể tích).
Bước 2: Cân một lượng muối FeSO4 (x gam) và pha vào bình 100 ml. Sau đó hút 10,0 ml dung dịch FeSO4 đã pha cho vào bình tam giác, thêm vài giọt dung dịch acid H2SO4 vào bình thu được dung dịch A
Bước 3: Mở khóa burret chứa dung dịch KMnO4, nhỏ giọt chậm và lắc đều cho đến khi màu hồng nhạt của dung dịch KMnO4 vẫn giữ ổn định trong 30 giây.
Bước 4: Ghi lại thể tích dung dịch KMnO4 đã sử dụng (V ml). Lặp lại từ bước 1 đến bước 4 ít nhất ba lần và ghi lại các giá trị V.
Kết quả các lần làm thí nghiệm của học sinh như sau:
Tính phần trăm khối lượng FeSO4 trong mẫu biết giá trị x = 0,997. (Làm tròn kết quả đến hàng phần mười).
Thể tích trung bình của KMnO4 sau 3 lần chuẩn độ là:
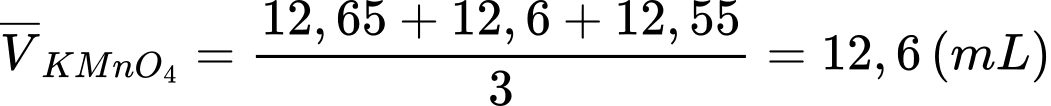 .
.
Đổi 12,6 mL = 12,6.10-3 L
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol KMnO4 tham gia phản ứng là:
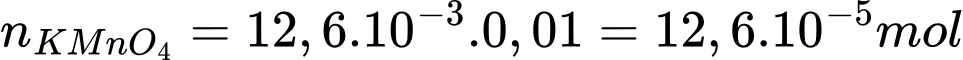
Khối lượng của FeSO4 là: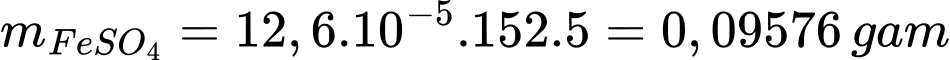
Hàm lượng FeSO4 trong mẫu là
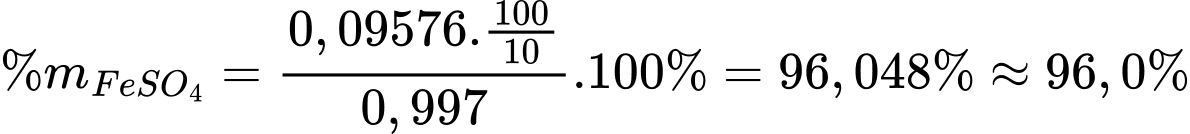
⇒ Điền đáp án: 96,0
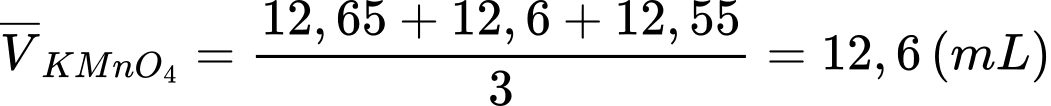 .
.Đổi 12,6 mL = 12,6.10-3 L
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol KMnO4 tham gia phản ứng là:
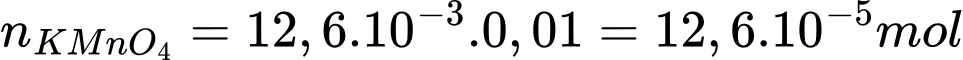
Khối lượng của FeSO4 là:
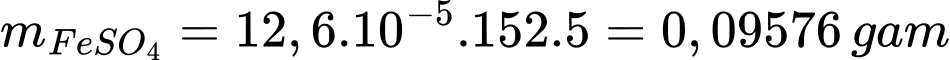
Hàm lượng FeSO4 trong mẫu là
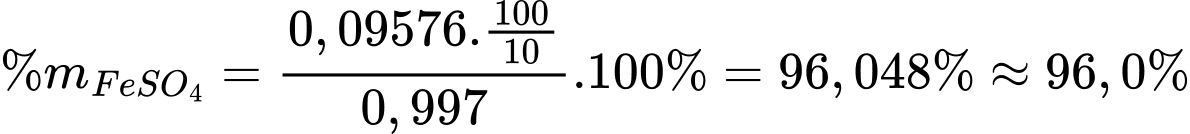
⇒ Điền đáp án: 96,0