PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704194]: “Tái chế là quá trình xử lí để tái sử dụng ...(1)... không cần thiết thành ...(2)... mang lại lợi ích cho đời sống và sản xuất”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, tài nguyên thiên nhiên, năng lượng mới.
B, rác thải, sản phẩm mới .
C, rác thải hoặc vật liệu, vật liệu mới.
D, kim loại, kim loại mới.
Tái chế là quá trình xử lí để tái sử dụng rác thải hoặc vật liệu không cần thiết thành vật liệu mới mang lại lợi ích cho đời sống và sản xuất.
Giải thích:
- Các vật liệu hoặc đồ dùng đã qua sử dụng, không còn giá trị sử dụng ban đầu hoặc bị bỏ đi, như chai nhựa, giấy cũ, kim loại phế liệu, v.v sẽ được thu gom, phân loại và làm sạch, xử lý để sản xuất ra vật liệu mới.
- Đây là một trong những phương pháp quản lý rác thải hiệu quả, góp phần bảo vệ môi trường, tiết kiệm tài nguyên và giảm thiểu ô nhiễm.
⇒ Chọn đáp án C
Đáp án: C
Giải thích:
- Các vật liệu hoặc đồ dùng đã qua sử dụng, không còn giá trị sử dụng ban đầu hoặc bị bỏ đi, như chai nhựa, giấy cũ, kim loại phế liệu, v.v sẽ được thu gom, phân loại và làm sạch, xử lý để sản xuất ra vật liệu mới.
- Đây là một trong những phương pháp quản lý rác thải hiệu quả, góp phần bảo vệ môi trường, tiết kiệm tài nguyên và giảm thiểu ô nhiễm.
⇒ Chọn đáp án C
Đáp án: C
Câu 2 [560811]: Soda khan (không ngậm nước) là hóa chất quan trọng trong sản xuất thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức hóa học của soda khan là
A, NaCl.
B, Na2SO4.
C, NaNO3.
D, Na2CO3.
Công thức hóa học của soda khan là Na2CO3 (Sodium carbonat).
Tên các chất còn lại:
A. NaCl: Sodium chloride (hay còn gọi là muối ăn).
B. Na2SO4: Sodium sulfate
C. NaNO3: Sodium nitrate
⟹ Chọn đáp án D Đáp án: D
Tên các chất còn lại:
A. NaCl: Sodium chloride (hay còn gọi là muối ăn).
B. Na2SO4: Sodium sulfate
C. NaNO3: Sodium nitrate
⟹ Chọn đáp án D Đáp án: D
Câu 3 [704195]: Cho dung dịch chứa amino acid X tồn tại ở dạng ion lưỡng cực:
H3N+CH(CH3)COO–
Đặt dung dịch này trong một điện trường. Khi đó:
H3N+CH(CH3)COO–
Đặt dung dịch này trong một điện trường. Khi đó:
A, Chất X sẽ di chuyển về phía cực âm của điện trường.
B, Chất X sẽ di chuyển về phía cực dương của điện trường.
C, Chất X gần như không di chuyển dưới tác dụng của điện trường.
D, Chất X chuyển hoàn toàn về dạng phân tử H2NCH(CH3)COOH dưới tác dụng của điện trường.
Amino acid X tồn tại dạng ion lưỡng cực H3N+CH(CH3)COO–, tổng điện tích bằng 0 nên gần như không di chuyển trong điện trường.
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 4 [704196]: Phản ứng nào sau đây không phải là phản ứng oxi hóa khử?
A, Fe2+(aq) + Ag+(aq) → Fe3+(aq) + Ag(s).
B, Fe(s) + 2H+(aq) → Fe2+(aq) + H2(g).
C, 3Cu(s) + 8H+(aq) + 2NO3–(aq) → 3Cu2+(aq) + 2NO(g) + H2O(l).
D, Fe3O4(s) + 8H+(aq) → Fe2+(aq) + 2Fe3+(aq) + 4H2O(l).
Phân tích các đáp án:
✔️ A.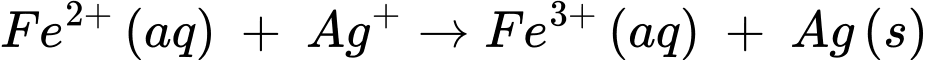
Quá trình oxi hóa: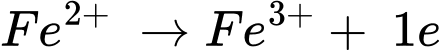
Quá trình khử: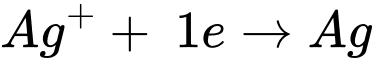
✔️ B.
Quá trình oxi hóa: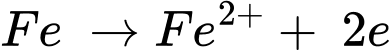
Quá trình khử: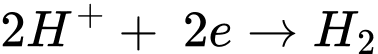
✔️ C.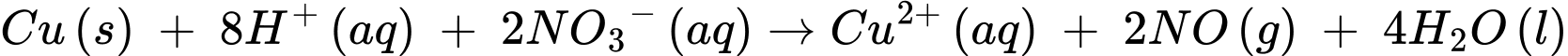
Quá trình oxi hóa: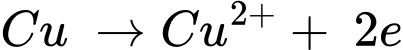
Quá trình khử: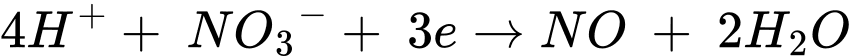
❌ D.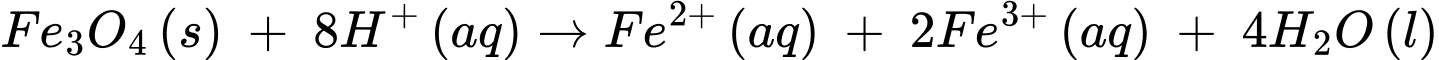
(Fe3O4 = FeO.Fe2O3)
Khi cho Fe3O4 vào HCl, coi như cho hỗn hợp FeO, Fe2O3 tác dụng với HCl. Sau phản ứng tạo 2 muối FeCl2, FeCl3, tức là sắt không đổi hoá trị. Vậy phản ứng không phải phản ứng oxi hoá khử.
Số oxi hoá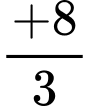 chỉ là số oxi hoá trung bình.
chỉ là số oxi hoá trung bình.
⇒ Chọn đáp án D Đáp án: D
✔️ A.
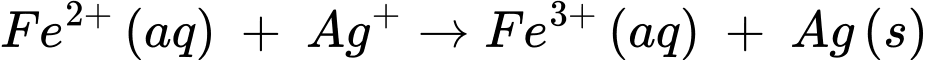
Quá trình oxi hóa:
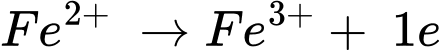
Quá trình khử:
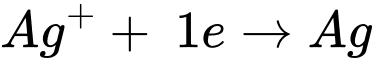
✔️ B.

Quá trình oxi hóa:
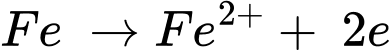
Quá trình khử:
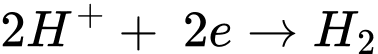
✔️ C.
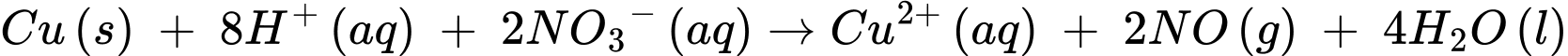
Quá trình oxi hóa:
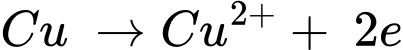
Quá trình khử:
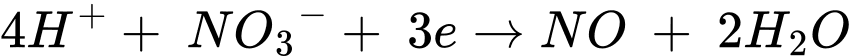
❌ D.
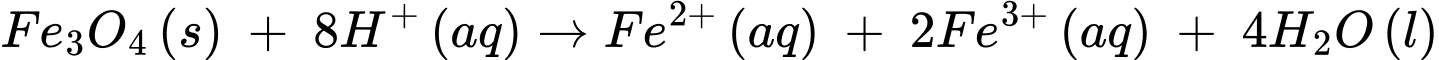
(Fe3O4 = FeO.Fe2O3)
Khi cho Fe3O4 vào HCl, coi như cho hỗn hợp FeO, Fe2O3 tác dụng với HCl. Sau phản ứng tạo 2 muối FeCl2, FeCl3, tức là sắt không đổi hoá trị. Vậy phản ứng không phải phản ứng oxi hoá khử.
Số oxi hoá
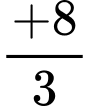 chỉ là số oxi hoá trung bình.
chỉ là số oxi hoá trung bình. ⇒ Chọn đáp án D Đáp án: D
Câu 5 [704197]: Số electron hóa trị của nguyên tử iron (sắt, Fe, Z = 26) là
A, 8.
B, 2.
C, 3.
D, 5.
Nếu cấu hình electron có dạng: (n – 1)dansb thì số electron hóa trị = a + b (Với n là STT lớp electron)
Cấu hình electron của Fe 1s22s22p63s23p63d64s2
⟶ Số electron hóa trị của Fe là: 6 + 2 = 8.
⇒ Chọn đáp án A Đáp án: A
Cấu hình electron của Fe 1s22s22p63s23p63d64s2
⟶ Số electron hóa trị của Fe là: 6 + 2 = 8.
⇒ Chọn đáp án A Đáp án: A
Câu 6 [233830]: Nước tự nhiên chứa nhiều những cation nào sau đây được gọi là nước cứng?
A, Na+, Al3+.
B, Na+, K+.
C, Al3+, K+.
D, Ca2+, Mg2+.
HD: Nước cứng là nước có chứa nhiều ion Ca2+ và Mg2+.
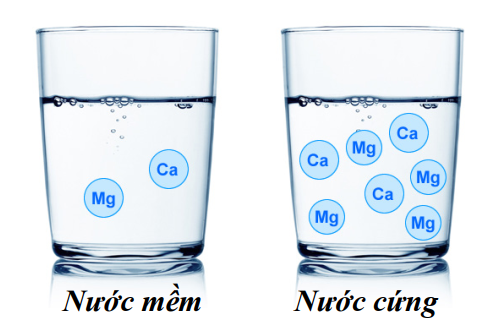
⇝ Chọn đáp án D. Đáp án: D

⇝ Chọn đáp án D. Đáp án: D
Câu 7 [704198]: Tính chất vật lí nào sau đây được quan tâm khi tách hai chất lỏng tan vào nhau bằng phương pháp chưng cất?
A, Nhiệt độ sôi của chất.
B, Nhiệt độ nóng chảy của chất.
C, Tính tan của chất trong nước.
D, Màu sắc của chất.
Phương pháp chưng cất được sử dụng để tách các chất lỏng tan vào nhau dựa trên sự khác biệt về nhiệt độ sôi. Khi hỗn hợp được đun nóng, chất lỏng có nhiệt độ sôi thấp hơn sẽ bay hơi trước. Hơi này sau đó được làm lạnh và ngưng tụ lại thành chất lỏng tinh khiết.
Các yếu tố khác như nhiệt độ nóng chảy, tính tan trong nước, hay màu sắc không ảnh hưởng trực tiếp đến quá trình chưng cất.
⇒ Chọn đáp án A Đáp án: A
Các yếu tố khác như nhiệt độ nóng chảy, tính tan trong nước, hay màu sắc không ảnh hưởng trực tiếp đến quá trình chưng cất.
⇒ Chọn đáp án A Đáp án: A
Câu 8 [704199]: Thuỷ phân methyl acrylate CH2=CHCOOCH3 trong môi trường base NaOH thì thu được sản phẩm gồm các chất là
A, HCOONa và CH2=CHCH2OH.
B, CH3COOH và CH2=CHOH.
C, CH2=CHCH2ONa và HCOOH.
D, CH2=CHCOONa và CH3OH.
Thuỷ phân methyl acrylate CH2=CHCOOCH3 trong môi trường base NaOH xảy ra như sau:

⟶ Sản phẩm thu được gồm các chất: CH2=CHCOONa và CH3OH.
⇒ Chọn đáp án D Đáp án: D

⟶ Sản phẩm thu được gồm các chất: CH2=CHCOONa và CH3OH.
⇒ Chọn đáp án D Đáp án: D
Câu 9 [704200]: Mưa acid được tạo ra khi các chất thải của ngành công nghiệp không được xử lí và đưa thẳng vào khí quyển, tại đó chúng phản ứng để tạo thành acid.
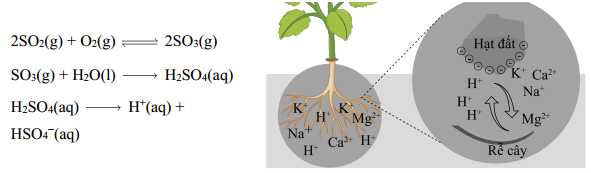
Trong đất có chứa nhiều ion có lợi cho cây trồng như magnesium và potassium. Khi mưa acid rơi xuống, các ion H+ trong mưa đẩy các ion này ra khỏi đất. Đồng thời ion H+ tồn tại trong đất và làm cho đất bị chua. Phát biểu nào sau đây không đúng?

Trong đất có chứa nhiều ion có lợi cho cây trồng như magnesium và potassium. Khi mưa acid rơi xuống, các ion H+ trong mưa đẩy các ion này ra khỏi đất. Đồng thời ion H+ tồn tại trong đất và làm cho đất bị chua. Phát biểu nào sau đây không đúng?
A, Mưa acid làm giá trị pH của đất tăng lên.
B, Cứ 2 ion H+ có thể thay thế và đẩy 1 ion Mg2+ ra khỏi đất.
C, Có thể xử lí đất bị chua bằng cách rắc đá vôi.
D, Nồng độ SO2 trong khí đủ lớn có thể kiểm tra bằng quỳ tím ẩm.
Phân tích các phát biểu:
❌ A. Sai. Mưa acid chứa ion H+, khi rơi xuống đất sẽ làm tăng nồng độ ion H+ trong đất, dẫn đến giảm giá trị pH (làm đất chua).
✔️ B. Đúng. Ion H+ có hóa trị 1, còn ion Mg2+ có hóa trị 2, do đó cứ hai ion H+ có thể đẩy một ion Mg2+ ra khỏi đất (dựa trên cân bằng điện tích).
✔️ C. Đúng. Đá vôi () có tính kiềm, khi phản ứng với sẽ trung hòa độ chua của đất, tăng giá trị pH.
✔️ D. Đúng. SO2 hòa tan trong nước tạo thành acid yếu (H2SO3), làm quỳ tím chuyển đỏ. Vì vậy, quỳ tím ẩm có thể kiểm tra SO2 trong không khí.
⇒ Chọn đáp án A Đáp án: A
❌ A. Sai. Mưa acid chứa ion H+, khi rơi xuống đất sẽ làm tăng nồng độ ion H+ trong đất, dẫn đến giảm giá trị pH (làm đất chua).
✔️ B. Đúng. Ion H+ có hóa trị 1, còn ion Mg2+ có hóa trị 2, do đó cứ hai ion H+ có thể đẩy một ion Mg2+ ra khỏi đất (dựa trên cân bằng điện tích).
✔️ C. Đúng. Đá vôi () có tính kiềm, khi phản ứng với sẽ trung hòa độ chua của đất, tăng giá trị pH.
✔️ D. Đúng. SO2 hòa tan trong nước tạo thành acid yếu (H2SO3), làm quỳ tím chuyển đỏ. Vì vậy, quỳ tím ẩm có thể kiểm tra SO2 trong không khí.
⇒ Chọn đáp án A Đáp án: A
Câu 10 [704201]: Phản ứng tổng hợp ammonia trong công nghiệp hiện nay là
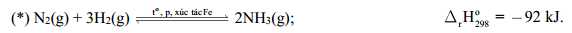
Đồ thị phần trăm chuyển hóa NH3 phụ thuộc vào nhiệt độ và áp suất tổng của phản ứng (*) được cho dưới đây:
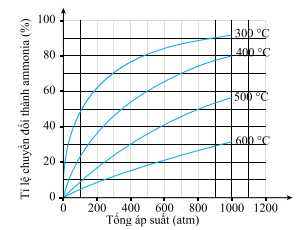
Bỏ qua các yếu về tốc độ phản ứng, nếu áp suất là 200 atm thì nhiệt độ nào sau đây sẽ được chọn để phần trăm chuyển hóa NH3 là cao nhất?
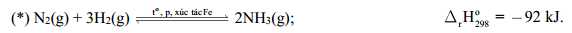
Đồ thị phần trăm chuyển hóa NH3 phụ thuộc vào nhiệt độ và áp suất tổng của phản ứng (*) được cho dưới đây:

Bỏ qua các yếu về tốc độ phản ứng, nếu áp suất là 200 atm thì nhiệt độ nào sau đây sẽ được chọn để phần trăm chuyển hóa NH3 là cao nhất?
A, 300 oC.
B, 400 oC.
C, 500 oC.
D, 600 oC.
Xét hiệu suất tại áp suất 200 atm:
- Tại 300 oC, hiệu suất chuyển hóa NH3 hơn 60% ⟶ Cao nhất.
- Tại 400 oC, hiệu suất chuyển hóa NH3 gần 40%.
- Tại 500 oC, hiệu suất chuyển hóa NH3 gần 20%.
- Tại 600 oC, hiệu suất chuyển hóa NH3 gần 10%.
⇒ Chọn đáp án A Đáp án: A
- Tại 300 oC, hiệu suất chuyển hóa NH3 hơn 60% ⟶ Cao nhất.
- Tại 400 oC, hiệu suất chuyển hóa NH3 gần 40%.
- Tại 500 oC, hiệu suất chuyển hóa NH3 gần 20%.
- Tại 600 oC, hiệu suất chuyển hóa NH3 gần 10%.
⇒ Chọn đáp án A Đáp án: A
Câu 11 [704202]: Hợp chất nào sau đây không phải là protein?
A, Hemoglobin.
B, Heroine.
C, Fibroin.
D, Cellulase.
✔️ A. Hemoglobin là một loại protein trong máu, có vai trò vận chuyển oxygen từ phổi đến các mô và cơ quan.
❌ B. Heroine là một hợp chất ma túy tổng hợp, không phải protein. Công thức hóa học của nó là C21H23NO5.
✔️ C. Fibroin là một loại protein cấu trúc, thành phần chính trong tơ tằm.
✔️ D. Cellulase là một enzyme (protein) tham gia phân hủy cellulose thành đường đơn.
⇒ Chọn đáp án B Đáp án: B
❌ B. Heroine là một hợp chất ma túy tổng hợp, không phải protein. Công thức hóa học của nó là C21H23NO5.
✔️ C. Fibroin là một loại protein cấu trúc, thành phần chính trong tơ tằm.
✔️ D. Cellulase là một enzyme (protein) tham gia phân hủy cellulose thành đường đơn.
⇒ Chọn đáp án B Đáp án: B
Câu 12 [308241]: Carbohydrate có cấu tạo như hình bên thuộc loại nào sau đây?
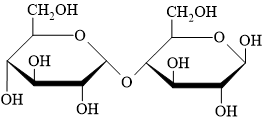

A, Monosaccharide.
B, Disaccharide.
C, Polysaccharide.
D, Ester.
HD: Đây là dạng mạch vòng của hợp chất carbohydrate. Một cách trực quan: 1 vòng ⇄ monosaccharide; 2 vòng ⇄ disaccharide và nhiều vòng ⇄ polysaccharide.
Theo đó, ở câu hỏi này quan sát thấy có 2 vòng nên hợp chất thuộc loại disaccharide ⇝ Chọn đáp án B. ♦
p/s: Cụ thể, cấu tạo được cho tương ứng là maltose (được tạo thành từ 2 đơn vị monosaccharide α-glucose liên kết với nhau):
 Đáp án: B
Đáp án: B
Theo đó, ở câu hỏi này quan sát thấy có 2 vòng nên hợp chất thuộc loại disaccharide ⇝ Chọn đáp án B. ♦
p/s: Cụ thể, cấu tạo được cho tương ứng là maltose (được tạo thành từ 2 đơn vị monosaccharide α-glucose liên kết với nhau):
 Đáp án: B
Đáp án: B
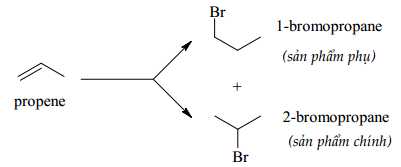
Câu 13 [704203]: Phản ứng giữa propene với HBr lại sinh ra sản phẩm chính là 2-bromopropane (theo quy tắc Markovnikov).
Cơ chế chung của phản ứng xảy ra như sau:
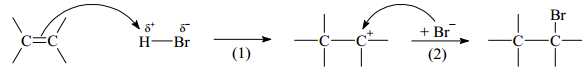
Theo quy tắc Markovnikov, ở giai đoạn (1) sẽ tạo thành các gốc carbocation; gốc nào bền hơn sẽ ưu tiên + Br– ở giai đoạn (2) tạo thành sản phẩm chính.
Cho các phát biểu sau:
(a) Phản ứng giữa propene với HBr thuộc loại phản ứng cộng.
(b) Giai đoạn (2), Br– sẽ cộng vào nguyên tử carbon mang điện tích dương.
(c) Gốc carbocation có điện tích dương ở carbon bậc II sẽ bền hơn ở carbon bậc I.
(d) Số gốc carbocation tạo thành ở giai đoạn (1) luôn nhỏ hơn số sản phẩm hữu cơ tạo thành sau phản ứng.
Trong các phát biểu trên, các phát biểu đúng là

Cơ chế chung của phản ứng xảy ra như sau:

Theo quy tắc Markovnikov, ở giai đoạn (1) sẽ tạo thành các gốc carbocation; gốc nào bền hơn sẽ ưu tiên + Br– ở giai đoạn (2) tạo thành sản phẩm chính.
Cho các phát biểu sau:
(a) Phản ứng giữa propene với HBr thuộc loại phản ứng cộng.
(b) Giai đoạn (2), Br– sẽ cộng vào nguyên tử carbon mang điện tích dương.
(c) Gốc carbocation có điện tích dương ở carbon bậc II sẽ bền hơn ở carbon bậc I.
(d) Số gốc carbocation tạo thành ở giai đoạn (1) luôn nhỏ hơn số sản phẩm hữu cơ tạo thành sau phản ứng.
Trong các phát biểu trên, các phát biểu đúng là
A, (a), (b), (c).
B, (a), (b), (d).
C, (b), (c), (d).
D, (a), (c), (d).
Phản ứng xảy ra các giai đoạn như sau:
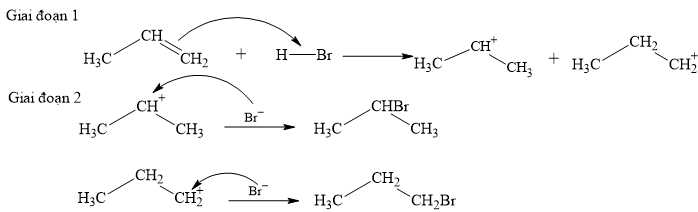
Phân tích các phát biểu:
✔️ (a) Đúng. Alkene dễ dàng tham gia phản ứng cộng vào liên kết C=C tạo thành hợp chất no tương ứng, do trong liên kết C=C có liên kết kém bền dễ bị phá vớ nên dễ tham gia phản ứng cộng.
✔️ (b) Đúng. Từ cơ chế ta thấy Br- sẽ cộng vào nguyên tử carbon mang điện tích dương.
✔️ (c) Đúng. Độ bền tương đối của carbocation thường tăng khi bậc của nguyên tử carbon mang điện tích dương tăng. Nên gốc carbocation có điện tích dương ở carbon bậc II sẽ bền hơn ở carbon bậc I.
❌ (d) Sai. Số gốc carbocation tạo thành ở giai đoạn (1) luôn bằng số sản phẩm hữu cơ tạo thành sau phản ứng.
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án A Đáp án: A

Phân tích các phát biểu:
✔️ (a) Đúng. Alkene dễ dàng tham gia phản ứng cộng vào liên kết C=C tạo thành hợp chất no tương ứng, do trong liên kết C=C có liên kết kém bền dễ bị phá vớ nên dễ tham gia phản ứng cộng.
✔️ (b) Đúng. Từ cơ chế ta thấy Br- sẽ cộng vào nguyên tử carbon mang điện tích dương.
✔️ (c) Đúng. Độ bền tương đối của carbocation thường tăng khi bậc của nguyên tử carbon mang điện tích dương tăng. Nên gốc carbocation có điện tích dương ở carbon bậc II sẽ bền hơn ở carbon bậc I.
❌ (d) Sai. Số gốc carbocation tạo thành ở giai đoạn (1) luôn bằng số sản phẩm hữu cơ tạo thành sau phản ứng.
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án A Đáp án: A
Câu 14 [304117]: Ethyl propionate là ester có mùi thơm của dứa. Công thức của ethyl propionate là
A, HCOOC2H5.
B, C2H5COOC2H5.
C, C2H5COOCH3.
D, CH3COOCH3.
Phân tích tên gọi: ethyl propionate.
• Ethyl là gốc CH3CH2–.
• Propionate là gốc acid: CH3CH2COO
⇒ Ghép lại cấu tạo ester: CH3CH2COOCH2CH3 hay viết gọn C2H5COOC2H5
⟹ Chọn đáp án B. Đáp án: B
• Ethyl là gốc CH3CH2–.
• Propionate là gốc acid: CH3CH2COO
⇒ Ghép lại cấu tạo ester: CH3CH2COOCH2CH3 hay viết gọn C2H5COOC2H5
⟹ Chọn đáp án B. Đáp án: B
Câu 15 [704204]: “Polymer là những hợp chất có …(1)… lớn do có nhiều …(2)… liên kết với nhau tạo nên”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, phân tử khối, mắt xích.
B, khối lượng, phân tử.
C, kích thước, ion.
D, thể tích, monome.
Polymer là những hợp chất có phân tử khối lớn do có nhiều mắt xích liên kết với nhau tạo nên.
Giải thích:
- Polymer có phân tử khối rất lớn, thường từ vài nghìn đến hàng triệu đơn vị khối lượng nguyên tử (amu). Điều này là do chúng được hình thành từ hàng trăm hoặc hàng nghìn monomer liên kết với nhau.
- Mắt xích là đơn vị cơ bản, hay monomer, lặp đi lặp lại để tạo nên polymer.
⇒ Chọn đáp án A Đáp án: A
Giải thích:
- Polymer có phân tử khối rất lớn, thường từ vài nghìn đến hàng triệu đơn vị khối lượng nguyên tử (amu). Điều này là do chúng được hình thành từ hàng trăm hoặc hàng nghìn monomer liên kết với nhau.
- Mắt xích là đơn vị cơ bản, hay monomer, lặp đi lặp lại để tạo nên polymer.
⇒ Chọn đáp án A Đáp án: A
Câu 16 [704205]: Biểu đồ dưới đây cho thấy cách cellulose và tinh bột có thể được chuyển đổi thành ethylene, có thể được sử dụng để tạo ra nhiều loại polyme tổng hợp.
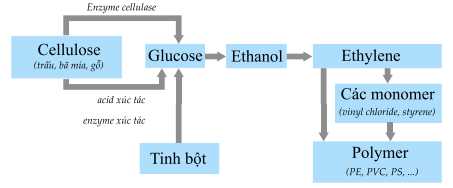
Cho các phát biểu sau:
(a) Cellulose có thể bị thủy phân trong môi trường acid hoặc enzyme cellulase.
(b) Một phân tử glucose sẽ tạo thành một phân tử ethanol nếu sử dụng xúc tác men rượu.
(c) Phân tử ethanol tham gia phản ứng tách nước H2O để tạo thành phân tử ethylene.
(d) Phân tử ethylene có số nguyên tử carbon giống với polymer polyethylene.
Các phát biểu đúng là

Cho các phát biểu sau:
(a) Cellulose có thể bị thủy phân trong môi trường acid hoặc enzyme cellulase.
(b) Một phân tử glucose sẽ tạo thành một phân tử ethanol nếu sử dụng xúc tác men rượu.
(c) Phân tử ethanol tham gia phản ứng tách nước H2O để tạo thành phân tử ethylene.
(d) Phân tử ethylene có số nguyên tử carbon giống với polymer polyethylene.
Các phát biểu đúng là
A, (a), (c).
B, (b), (d).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Phản ứng thủy phân cellulose xảy ra khi có đun nóng với xúc tác acid vô cơ (hoặc enzyme cellulase). Sản phẩm cuối cùng là glucose.
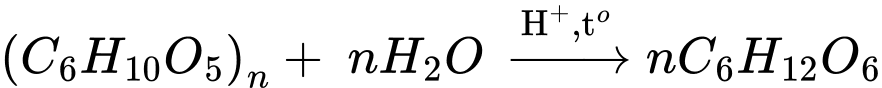
❌ (b) Sai. Một phân tử glucose sẽ tạo ra 2 phân tử ethanol.
Lên men rượu: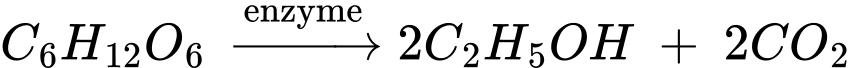
✔️ (c) Đúng. Phản ứng tách nước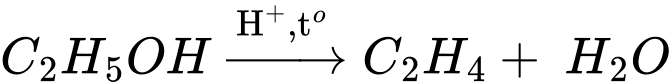
❌ (d) Sai. Polymer là những hợp chất có phân tử khối rất lớn do nhiều đơn vị nhỏ (gọi là mắt xích) liên kết với nhau nên số nguyên tử carbon của polymer gấp nhiều lần số nguyên tử carbon của monomer.
Các phát biểu đúng là (a) (c)
⇒ Chọn đáp án A Đáp án: A
✔️ (a) Đúng. Phản ứng thủy phân cellulose xảy ra khi có đun nóng với xúc tác acid vô cơ (hoặc enzyme cellulase). Sản phẩm cuối cùng là glucose.
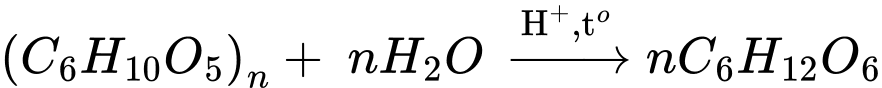
❌ (b) Sai. Một phân tử glucose sẽ tạo ra 2 phân tử ethanol.
Lên men rượu:
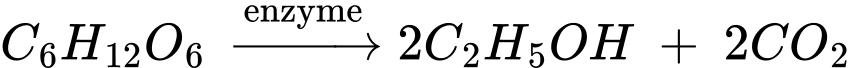
✔️ (c) Đúng. Phản ứng tách nước
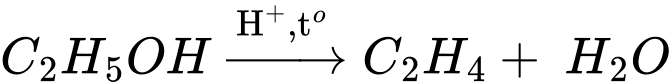
❌ (d) Sai. Polymer là những hợp chất có phân tử khối rất lớn do nhiều đơn vị nhỏ (gọi là mắt xích) liên kết với nhau nên số nguyên tử carbon của polymer gấp nhiều lần số nguyên tử carbon của monomer.
Các phát biểu đúng là (a) (c)
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Acetic acid thuộc loại acid yếu do khả năng phân li ion H+ không hoàn toàn, quá trình phân li của acetic acid được cho như sau:


Câu 17 [704206]: Trong các phát biểu sau dưới đây, phát biểu nào đúng?
A, Môi trường dung dịch acetic acid có độ pH lớn hơn 7.
B, Dung dịch tại thời điểm cân bằng chỉ chứa ion CH3COO– và ion H+.
C, Tại thời điểm cân bằng, nồng độ [CH3COOH] bằng nồng độ [H+].
D, Hằng số phân li Ka càng lớn thì acid đó càng mạnh.
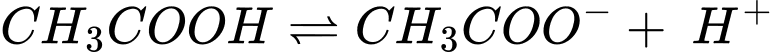
Phân tích các phát biểu:
❌ A. Sai. Quá trình phân li acetic acid sinh ra H+ tạo môi trường acid nên pH của dung dịch acetic acid nhỏ hơn 7
❌ B. Sai. Acetic acid là acid yếu, quá trình phân li không hòa toàn nên tại thời điểm cân bằng dung dịch không chỉ chứa ion CH3COO- và H+ mà còn chứa một phần CH3COOH chưa bị phân li.
❌ C. Sai. Tại thời điểm cân bằng nồng độ của [CH3COOH] không bằng nồng độ của [H+] mà nồng độ của [CH3COO-] bằng với nồng độ [H+]
✔️ D. Đúng. Hằng số Ka càng lớn thì hiệu suất phân li ra H+ càng lớn dẫn đến pH giảm độ acid tăng.
⇒ Chọn đáp án D Đáp án: D
Câu 18 [704207]: Nồng độ ban đầu của CH3COOH là 0,1 M, nếu tăng nồng độ ban đầu lên 2 lần thì nồng độ H+ tại thời điểm cân bằng tăng bao nhiêu lần?
A, 1,42 lần.
B, 1,67 lần.
C, 1,56 lần.
D, 2 lần.
Tại nồng độ của dung dịch CH3COOH 0,1M
Gọi x là nồng độ H+ phân li của CH3COOH 0,1M
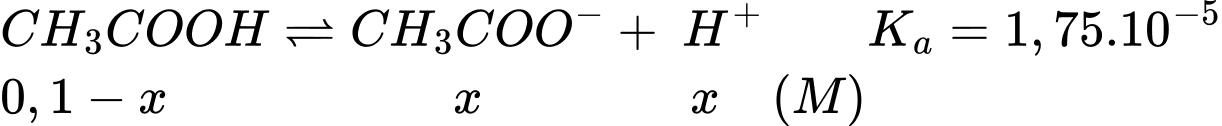
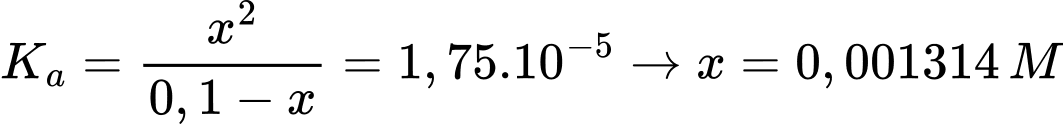
Tại nồng độ của dung dịch CH3COOH 0,2M
Gọi y là nồng độ H+ phân li của CH3COOH 0,2M
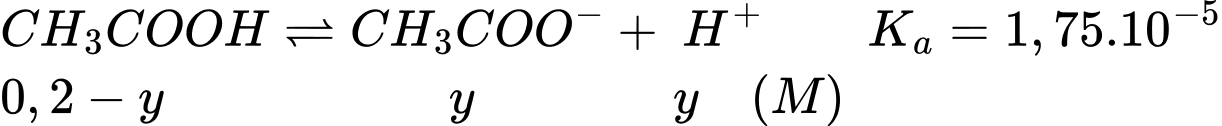
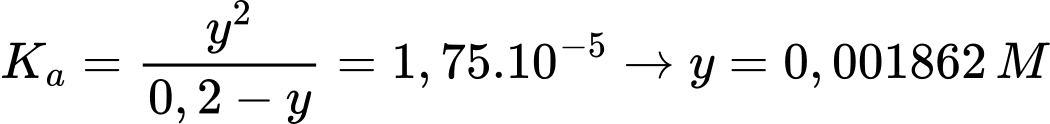
Khi tăng nồng độ lên acetic acid lên gấp đôi thì thì nồng độ H+ tăng số lần là:
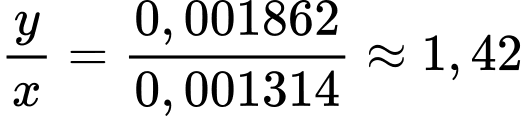 (lần)
(lần)
⇒ Chọn đáp án A Đáp án: A
Gọi x là nồng độ H+ phân li của CH3COOH 0,1M
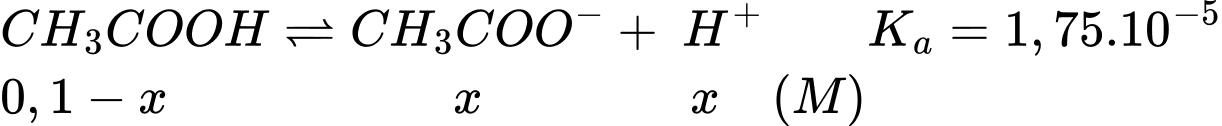
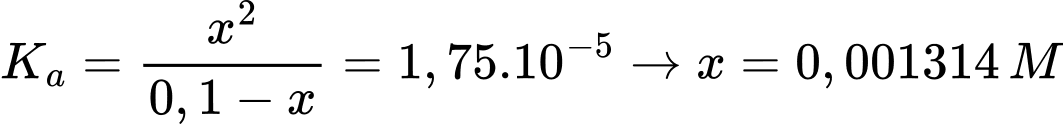
Tại nồng độ của dung dịch CH3COOH 0,2M
Gọi y là nồng độ H+ phân li của CH3COOH 0,2M
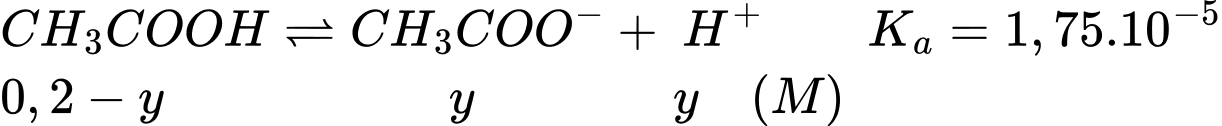
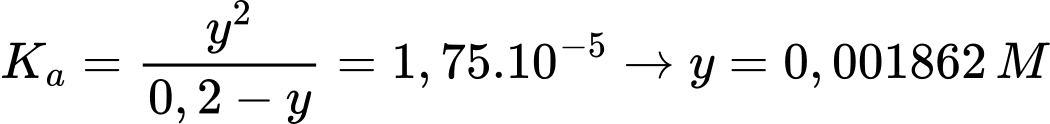
Khi tăng nồng độ lên acetic acid lên gấp đôi thì thì nồng độ H+ tăng số lần là:
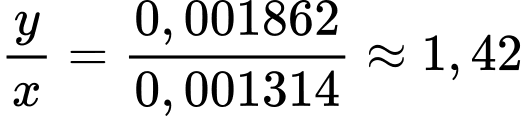 (lần)
(lần)
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704208]: Một số kim loại có khả năng tan, đồng thời phản ứng với dung dịch acid HCl từ đó thể hiện được tính khử đặc trưng của các kim loại. Tiến hành thí nghiệm sau:
Cho vào hai ống nghiệm mỗi ống khoảng 5 mL dung dịch HCl 1 M.
▪ Ống nghiệm (1): Thêm tiếp một lá đồng vào ống nghiệm.
▪ Ống nghiệm (2): Thêm tiếp một băng magnesium vào ống nghiệm.
Cho vào hai ống nghiệm mỗi ống khoảng 5 mL dung dịch HCl 1 M.
▪ Ống nghiệm (1): Thêm tiếp một lá đồng vào ống nghiệm.
▪ Ống nghiệm (2): Thêm tiếp một băng magnesium vào ống nghiệm.
Thí nghiệm 1: Cu không phản ứng với dung dịch HCl, không có hiện tượng hóa học
Thí nghiệm 2: Mg tan dần trong dung dịch HCl, có khí không màu thoát ra khỏi chất lỏng.
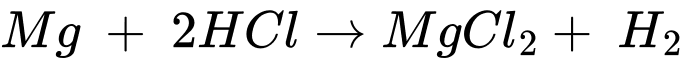
Quá trình oxi hóa: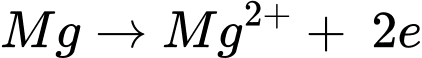
Quá trình khử: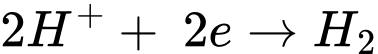
Phân tích các phát biểu:
✔️ A. Đúng. Đồng không phản ứng với dung dịch HCl vì thế khử chuẩn của cặp Cu2+/Cu (0,34) lớn hơn thế khử chuẩn của cặp 2H+/H2 (0,00). Đồng không đủ mạnh để khử H+ thành H2, nên không có hiện tượng xảy ra.
✔️ B. Đúng. Mg phản ứng với HCl, tạo thành MgCl2 và khí H2:
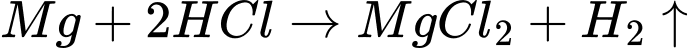
✔️ C. Đúng.Thế khử chuẩn của Mg2+/Mg là −2,37 V, nhỏ hơn thế khử chuẩn của 2H+/H2 0,00 V.
✔️ D. Đúng. Mg phản ứng được với HCl trong khi Cu không phản ứng được với HCl → Mg có tính khử mạnh hơn Cu.
Thí nghiệm 2: Mg tan dần trong dung dịch HCl, có khí không màu thoát ra khỏi chất lỏng.
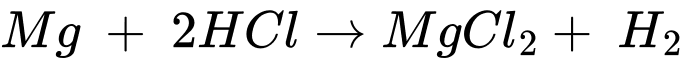
Quá trình oxi hóa:
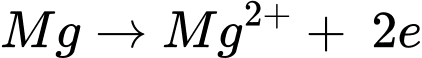
Quá trình khử:
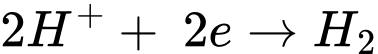
Phân tích các phát biểu:
✔️ A. Đúng. Đồng không phản ứng với dung dịch HCl vì thế khử chuẩn của cặp Cu2+/Cu (0,34) lớn hơn thế khử chuẩn của cặp 2H+/H2 (0,00). Đồng không đủ mạnh để khử H+ thành H2, nên không có hiện tượng xảy ra.
✔️ B. Đúng. Mg phản ứng với HCl, tạo thành MgCl2 và khí H2:
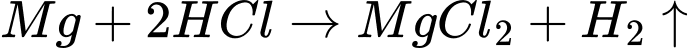
✔️ C. Đúng.Thế khử chuẩn của Mg2+/Mg là −2,37 V, nhỏ hơn thế khử chuẩn của 2H+/H2 0,00 V.
✔️ D. Đúng. Mg phản ứng được với HCl trong khi Cu không phản ứng được với HCl → Mg có tính khử mạnh hơn Cu.
Câu 20 [704209]: Nghiên cứu phản ứng tạo màu của protein với nitric acid được tiến hành thí nghiệm như sau:
▪ Bước 1: Cho vào ống nghiệm khoảng 1,0 mL dung dịch lòng trắng trứng và khoảng 1 mL dung dịch HNO3 đặc.
▪ Bước 2: Lắc đều hỗn hợp, sau đó để yên ống nghiệm trong khoảng 1 - 2 phút.
Hiện tượng thu được là hình thành chất rắn có màu do một số đơn vị amino acid chứa vòng benzene trong phân tử protein có thể tham gia phản ứng với dung dịch HNO3 đặc.
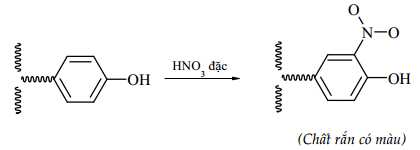
▪ Bước 1: Cho vào ống nghiệm khoảng 1,0 mL dung dịch lòng trắng trứng và khoảng 1 mL dung dịch HNO3 đặc.
▪ Bước 2: Lắc đều hỗn hợp, sau đó để yên ống nghiệm trong khoảng 1 - 2 phút.
Hiện tượng thu được là hình thành chất rắn có màu do một số đơn vị amino acid chứa vòng benzene trong phân tử protein có thể tham gia phản ứng với dung dịch HNO3 đặc.

Phân tích các phát biểu:
✔️ (a) Đúng. Một số đơn vị amino acid chứa vòng benzene trong protein có thể tham gia phản ứng với dung dịch HNO3 đặc tạo thành hợp chất rắn có màu vàng, đồng thời protein bị đông tụ tạo thành kết tủa.
✔️ (b) Đúng. Sau khi thế nguyên tử H của vòng benzene bằng nhóm NO2 thu được hợp chất mới không tan trong nước.
❌ (c) Sai. Pentapeptide tạo từ các amino acid không có vòng benzene nên không có phản ứng HNO3 tạo kết tủa vàng.
✔️ (d) Đúng. Protein có thể bị đông tụ dưới tác dụng của nhiệt, acid, base hoặc ion kim loại nặng. Sự đông tụ này xảy ra do cấu tạo ban đầu của protein bị biến đổi.
✔️ (a) Đúng. Một số đơn vị amino acid chứa vòng benzene trong protein có thể tham gia phản ứng với dung dịch HNO3 đặc tạo thành hợp chất rắn có màu vàng, đồng thời protein bị đông tụ tạo thành kết tủa.
✔️ (b) Đúng. Sau khi thế nguyên tử H của vòng benzene bằng nhóm NO2 thu được hợp chất mới không tan trong nước.
❌ (c) Sai. Pentapeptide tạo từ các amino acid không có vòng benzene nên không có phản ứng HNO3 tạo kết tủa vàng.
✔️ (d) Đúng. Protein có thể bị đông tụ dưới tác dụng của nhiệt, acid, base hoặc ion kim loại nặng. Sự đông tụ này xảy ra do cấu tạo ban đầu của protein bị biến đổi.
Câu 21 [704210]: Lindane hay hexachlorane là chất có tác dụng trừ sâu mạnh, từng được sử dụng phổ biến trong nông nghiệp và làm dược phẩm (trị ghẻ, diệt chấy,...). Tuy nhiên, do là chất độc phân huỷ rất chậm trong tự nhiên nên vào năm 2009, hexachlorane đã bị đưa vào phụ lục cấm sản xuất và sử dụng của Công ước Stockholm về các chất ô nhiễm hữu cơ khó phân huỷ và bị cấm sử dụng tại 169 quốc gia trên thế giới. Thành phần phần trăm khối lượng của các nguyên tố có trong hexachlorane là: 24,78% C; 2,08% H và 73,14% Cl. Dựa vào phổ MS, xác định được phân tử khối của hexachlorane là 288 (ứng với 35Cl) hoặc 300 (ứng với 37Cl). Trong tự nhiên, 35Cl chiếm 75,77% số lượng nguyên tử còn 37Cl chiếm 24,23% số lượng nguyên tử.
Nguyên tử khối trung bình của chlorine là:
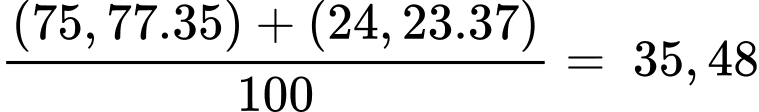
Tỉ lệ về số nguyên tử C : H : Cl có trong phân tử hexachlorane là:
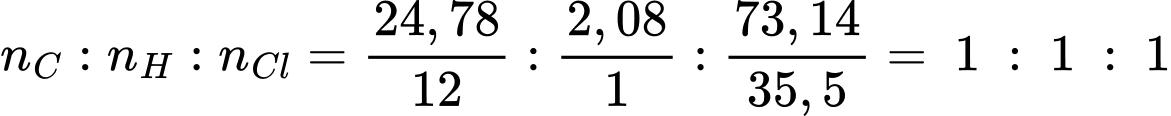
→ Công thức thực nghiệm của Lindane là CHCl.
+) Với 35Cl, hexachlorane có phân tử khối 288: (CHCl)n = 288 → n = 6
+) Tương tự, với 37Cl, hexachlorane có phân tử khối 300: (CHCl)n = 300 → n = 6
Vậy công thức phân tử của hexaclorane là C6H6Cl6.
Phân tích các phát biểu:
❌ (a) Sai. Đồng vị 35Cl ít hơn 2 neutron so với 37Cl.
✔️ (b) Đúng. Nguyên tử khối trung bình của Cl là 35,48.
✔️ (c) Đúng. Hexachlorane có chứa 6 nguyên tử Cl.
❌ (d) Sai. Công thức phân tử của hexaclorane là C6H6Cl6.
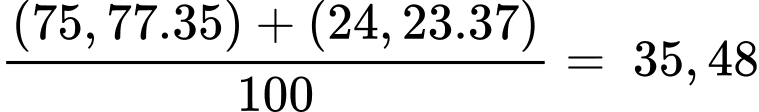
Tỉ lệ về số nguyên tử C : H : Cl có trong phân tử hexachlorane là:
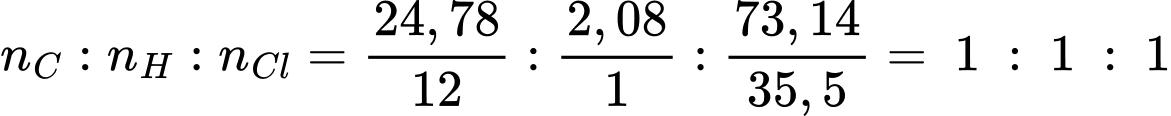
→ Công thức thực nghiệm của Lindane là CHCl.
+) Với 35Cl, hexachlorane có phân tử khối 288: (CHCl)n = 288 → n = 6
+) Tương tự, với 37Cl, hexachlorane có phân tử khối 300: (CHCl)n = 300 → n = 6
Vậy công thức phân tử của hexaclorane là C6H6Cl6.
Phân tích các phát biểu:
❌ (a) Sai. Đồng vị 35Cl ít hơn 2 neutron so với 37Cl.
✔️ (b) Đúng. Nguyên tử khối trung bình của Cl là 35,48.
✔️ (c) Đúng. Hexachlorane có chứa 6 nguyên tử Cl.
❌ (d) Sai. Công thức phân tử của hexaclorane là C6H6Cl6.
Câu 22 [704211]: Một pin Galvani có cấu tạo như sau:
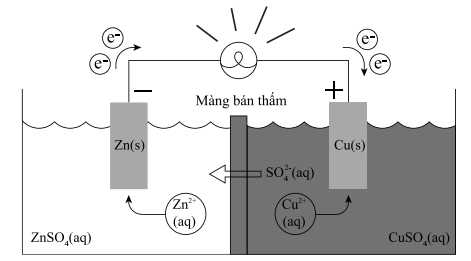
Trong đó, màng bán thẩm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan trong dung dịch là 1,00 M. Cho biết: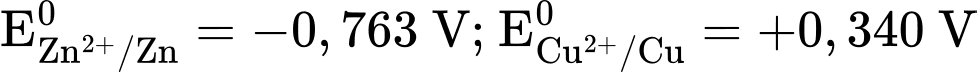 .
.

Trong đó, màng bán thẩm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan trong dung dịch là 1,00 M. Cho biết:
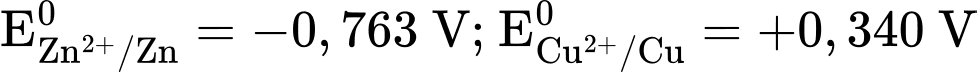 .
.
Phản ứng trong pin galvani
☆ Cathode (+)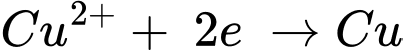
☆ Anode (-)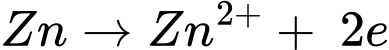
→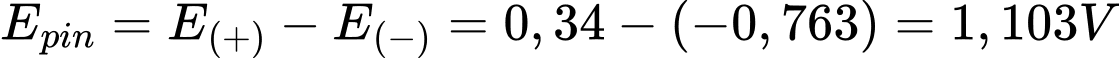
Phản ứng chung trong pin:
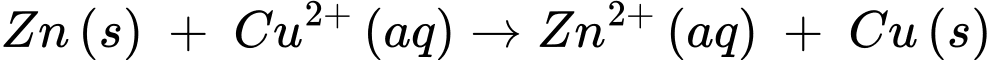
Phân tích các phát biểu:
❌ (a) Sai. Nguyên tử khối của Zn và Cu lần lượt là 65 gam/mol và 64 gam/mol, từ PTHH cứ 1 mol Zn mất đi sẽ có 1 mol Cu sinh ra nên khối lượng điện cực Zn mất đi sẽ lớn hơn Cu sinh ra.
✔️ (b) Đúng. Từ phản ứng trong pin, ta thấy ở cathode, nồng độ Cu2+ giảm nên để cân bằng điện tích thì nồng độ SO42- phải tăng. Ngược lại ở anode, nồng độ Zn2+ tăng nên nồng độ SO42- phải giảm để cân bằng điện tích.
✔️ (c) Đúng. Sức điện động chuẩn của pin là 1,103 V.
✔️ (d) Đúng. Phản ứng chung xảy ra trong pin điện là Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
☆ Cathode (+)
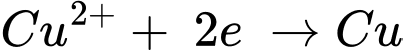
☆ Anode (-)
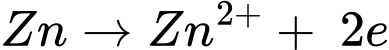
→
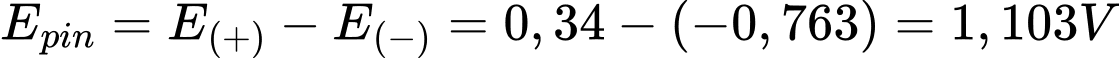
Phản ứng chung trong pin:
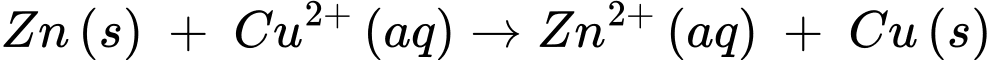
Phân tích các phát biểu:
❌ (a) Sai. Nguyên tử khối của Zn và Cu lần lượt là 65 gam/mol và 64 gam/mol, từ PTHH cứ 1 mol Zn mất đi sẽ có 1 mol Cu sinh ra nên khối lượng điện cực Zn mất đi sẽ lớn hơn Cu sinh ra.
✔️ (b) Đúng. Từ phản ứng trong pin, ta thấy ở cathode, nồng độ Cu2+ giảm nên để cân bằng điện tích thì nồng độ SO42- phải tăng. Ngược lại ở anode, nồng độ Zn2+ tăng nên nồng độ SO42- phải giảm để cân bằng điện tích.
✔️ (c) Đúng. Sức điện động chuẩn của pin là 1,103 V.
✔️ (d) Đúng. Phản ứng chung xảy ra trong pin điện là Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704212]: Một mẫu nước cứng có nồng độ các ion như sau: Ca2+ x M; Mg2+ y M; HCO3– 0,005 M; Cl– 0,004 M; SO42– 0,001 M. Để làm mềm 10 L nước này cần dùng tối thiểu bao nhiêu gam sodium carbonate? (Làm tròn kết quả đến hàng phần mười)
Phản ứng của nước cứng với sodium carbonate xảy ra như sau:
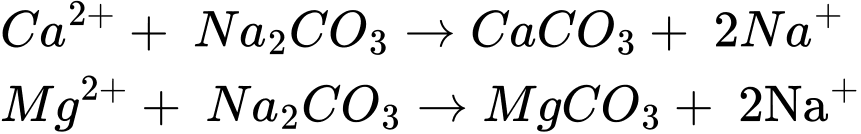
Số mol của Ca2+ và Mg2+ trong 10 L nước cứng lần lượt là 10x và 10y mol
Từ PTHH ta có:
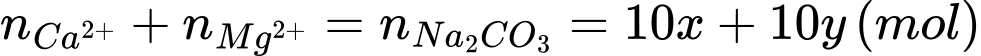
Áp dụng định luật bảo toàn điện tích:
20x + 20y = 0,005.10 + 0,004.10 + 0,001.10.2
→ 10x + 10y = 0,055 (mol)
Khối lượng Na2CO3 cần dùng để làm mềm 10 L nước cứng trên là
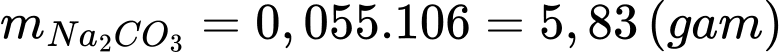 ≈ 5,8 gam.
≈ 5,8 gam.
⇒ Điền đáp án: 5,8
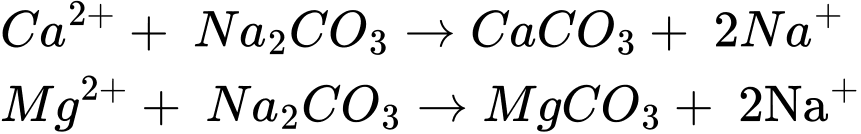
Số mol của Ca2+ và Mg2+ trong 10 L nước cứng lần lượt là 10x và 10y mol
Từ PTHH ta có:
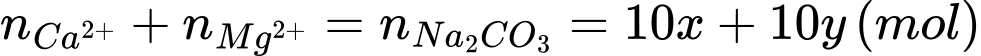
Áp dụng định luật bảo toàn điện tích:
20x + 20y = 0,005.10 + 0,004.10 + 0,001.10.2
→ 10x + 10y = 0,055 (mol)
Khối lượng Na2CO3 cần dùng để làm mềm 10 L nước cứng trên là
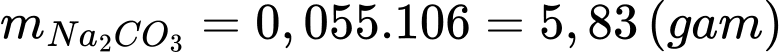 ≈ 5,8 gam.
≈ 5,8 gam.⇒ Điền đáp án: 5,8
Câu 24 [704213]: Hydrogen hoá hoàn toàn trilinolein có công thức (C17H31COO)3C3H5 trong điều kiện xúc tác Ni, đun nóng, thu được chất béo E. Phân tử khối của chất béo E là bao nhiêu?
Hydrogen hoá hoàn toàn trilinolein có công thức (C17H31COO)3C3H5 trong điều kiện xúc tác Ni, đun nóng thì phản ứng xảy ra như sau:
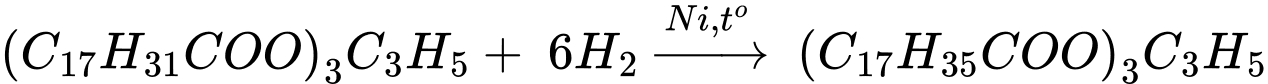
Chất béo E có công thức (C17H35COO)3C3H5
→ Phân tử khối của chất béo E là 890 gam/mol.
⇒ Điền đáp án: 890
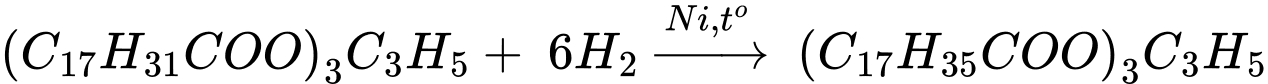
Chất béo E có công thức (C17H35COO)3C3H5
→ Phân tử khối của chất béo E là 890 gam/mol.
⇒ Điền đáp án: 890
Câu 25 [704214]: Có một mẫu benzoic acid (C6H5COOH) bị lẫn một ít cát. Để thu được acid tinh khiết, một bạn học sinh đã tiến hành các bước sau:
(1) Đun nóng hỗn hợp với nước đến khi lượng chất rắn không tan thêm nữa.
(2) Lọc lấy tinh thể, làm khô thu lấy benzoic acid tinh khiết.
(3) Để nguội dung dịch để có tinh thể hình kim không màu của benzoic acid tách ra.
(4) Đem lọc nhanh để loại bỏ chất rắn và thu lấy dung dịch.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình tinh chế benzoic acid (ví dụ: 1234, 4321, ...).
(1) Đun nóng hỗn hợp với nước đến khi lượng chất rắn không tan thêm nữa.
(2) Lọc lấy tinh thể, làm khô thu lấy benzoic acid tinh khiết.
(3) Để nguội dung dịch để có tinh thể hình kim không màu của benzoic acid tách ra.
(4) Đem lọc nhanh để loại bỏ chất rắn và thu lấy dung dịch.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình tinh chế benzoic acid (ví dụ: 1234, 4321, ...).
Quá trình tinh chế benzoic acid lẫn một ít cát được diễn ra như sau:
Bước 1: Dun nóng hỗn hợp với nước đến khi lượng chất rắn không tan thêm nữa. → ứng với (1)
Bước 2: Đem lọc nhanh loại bỏ chất rắn và thu lấy dung dịch. → ứng với (4)
Bước 3: Để nguội dung dịch để có tinh thể hình kim không màu của benzoic acid tách ra. → ứng với (3)
Bước 4: Lọc lấy tinh thể, làm khô thu lấy benzoic acid tinh khiết → ứng với (2)
⇒ Điền đáp án: 1432
Bước 1: Dun nóng hỗn hợp với nước đến khi lượng chất rắn không tan thêm nữa. → ứng với (1)
Bước 2: Đem lọc nhanh loại bỏ chất rắn và thu lấy dung dịch. → ứng với (4)
Bước 3: Để nguội dung dịch để có tinh thể hình kim không màu của benzoic acid tách ra. → ứng với (3)
Bước 4: Lọc lấy tinh thể, làm khô thu lấy benzoic acid tinh khiết → ứng với (2)
⇒ Điền đáp án: 1432
Câu 26 [704215]: Phân tử amino acid Y (no, mạch hở, có khối lượng 117 g/mol) chứa một nhóm thế amino và một nhóm chức carboxyl. Số đồng phân cấu tạo của Y thuộc loại α-amino acid là
Gọi công thức của amino acid Y no, mạch hở phân tử có 1 nhóm COOH và 1 nhóm NH2 là CnH2n+1NO2
Phân tử khối của Y là:
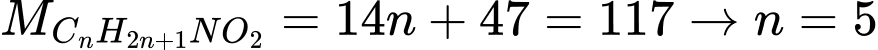
Công thức phân tử của Y là C5H11NO2
Các đồng phân α-amino acid (NH2 gắn ở C số 2) của Y là:
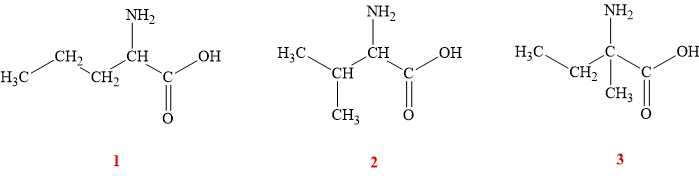
⇒ Điền đáp án: 3
Phân tử khối của Y là:
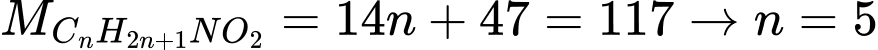
Công thức phân tử của Y là C5H11NO2
Các đồng phân α-amino acid (NH2 gắn ở C số 2) của Y là:

⇒ Điền đáp án: 3
Câu 27 [704216]: Một động cơ X sử dụng nhiên liệu xăng có 4 xilanh. Nhiên liệu xăng (giả sử thành phần chỉ là isooctane có công thức C8H18) cùng với không khí (chứa 21,0% thể tích O2 và 79,0% thể tích N2) được đưa vào 4 xilanh để đốt cháy. Ban đầu, mỗi xilanh đốt cháy hết hỗn hợp gồm 0,399 gam nhiên liệu xăng và 0,325 mol không khí. Biết rằng, nhiên liệu không phản ứng với N2, chỉ phản ứng với O2 sinh ra sản phẩm là hỗn hợp gồm CO, CO2 và hơi H2O.
Sau khi nhiên liệu được đốt cháy hoàn toàn, hỗn hợp khí thoát ra hết khỏi xilanh gọi là khí thải. Biết rằng 10% lượng nhiên liệu khi bị đốt cháy chuyển thành CO, còn lại chuyển thành CO2.
Dựa theo dữ liệu đề bài, tính lượng nhiệt tỏa ra môi trường của động cơ X. Biết rằng, mỗi xilanh khi đốt cháy hoàn toàn 1,000 mol nhiên liệu xăng sẽ giải phóng ra lượng nhiệt là 4924,656 kJ, trong đó 45% lượng nhiệt này dùng sinh công để động cơ X hoạt động, lượng nhiệt còn lại tỏa ra môi trường.
Sau khi nhiên liệu được đốt cháy hoàn toàn, hỗn hợp khí thoát ra hết khỏi xilanh gọi là khí thải. Biết rằng 10% lượng nhiên liệu khi bị đốt cháy chuyển thành CO, còn lại chuyển thành CO2.
Dựa theo dữ liệu đề bài, tính lượng nhiệt tỏa ra môi trường của động cơ X. Biết rằng, mỗi xilanh khi đốt cháy hoàn toàn 1,000 mol nhiên liệu xăng sẽ giải phóng ra lượng nhiệt là 4924,656 kJ, trong đó 45% lượng nhiệt này dùng sinh công để động cơ X hoạt động, lượng nhiệt còn lại tỏa ra môi trường.
Phương trình phản ứng
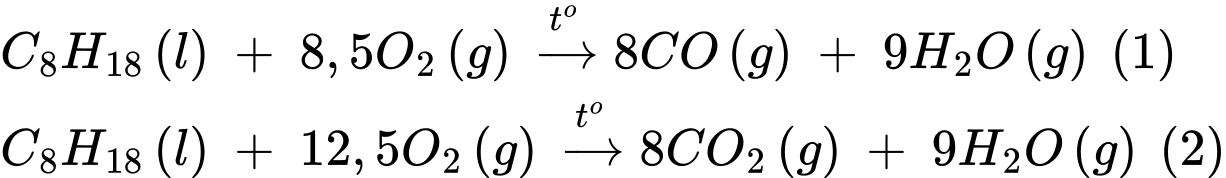
Số mol của C8H18 là 0,0035 mol
Lượng nhiệt tỏa ra môi trường của động cơ X là:
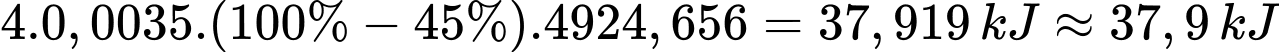
⇒ Điền đáp án: 37,9
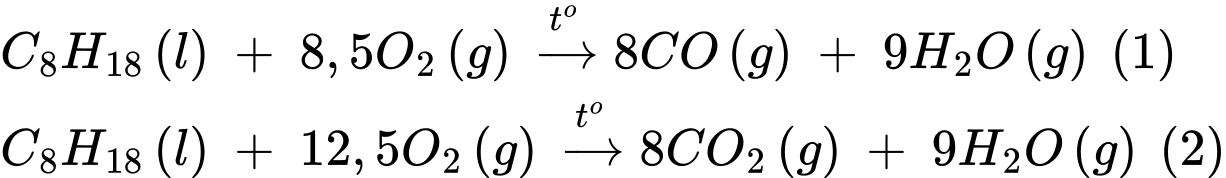
Số mol của C8H18 là 0,0035 mol
Lượng nhiệt tỏa ra môi trường của động cơ X là:
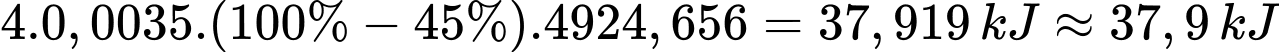
⇒ Điền đáp án: 37,9
Câu 28 [704217]: Trong quá trình bảo quản, muối FeSO4.7H2O thường bị oxi hoá bởi oxi không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Để xác định lượng Fe(II) bị oxi hoá người ta hoà tan một lượng X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y, lọc kết tủa, sấy khô rồi đem cân thu được 4,66 gam chất rắn.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25 mL dung dịch Y, thu được dung dịch Z. Chuẩn độ dung dịch Z bằng dung dịch chuẩn KMnO4 0,1 M đến khi đầu xuất hiện màu hồng (tồn tại khoảng 20 giây) thì hết 13,5 mL.
Phần trăm Fe(II) trong lượng muối ban đầu đã bị oxi hoá trong không khí là a%. Tính giá trị của a.
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y, lọc kết tủa, sấy khô rồi đem cân thu được 4,66 gam chất rắn.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25 mL dung dịch Y, thu được dung dịch Z. Chuẩn độ dung dịch Z bằng dung dịch chuẩn KMnO4 0,1 M đến khi đầu xuất hiện màu hồng (tồn tại khoảng 20 giây) thì hết 13,5 mL.
Phần trăm Fe(II) trong lượng muối ban đầu đã bị oxi hoá trong không khí là a%. Tính giá trị của a.
Đổi 13,5 mL = 0,0135 L
⭐ Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y, thu được 4,66 gam kết tủa → kết tủa là BaSO4.
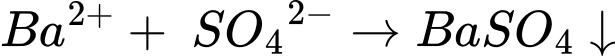
Số mol của kết tủa là: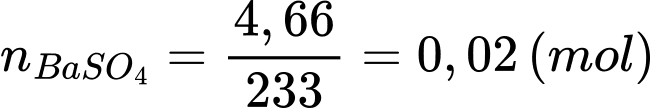
+) Số mol của H2SO4 trong 25 mL dung dịch là:
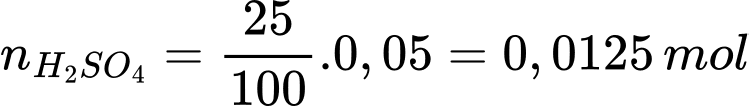
+) Bảo toàn nhóm SO42- trong 100 mL là:
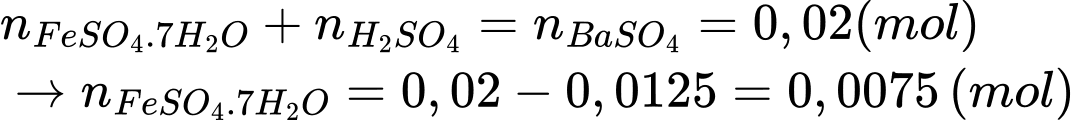
⭐Thí nghiệm 2: phần FeSO4 trong hỗn hợp X sẽ phản ứng với dung dịch KMnO4
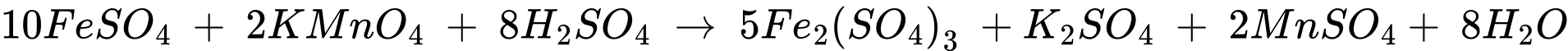
+) Số mol của KMnO4 phản ứng là:
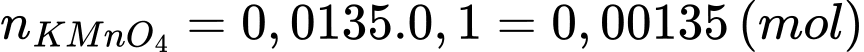
+) Số mol của FeSO4 phản ứng là:
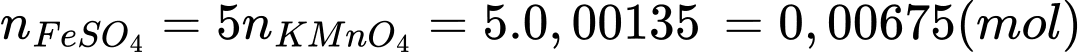
+) Phần trăm Fe(II) trong lượng muối bị oxi hóa trong không khí là
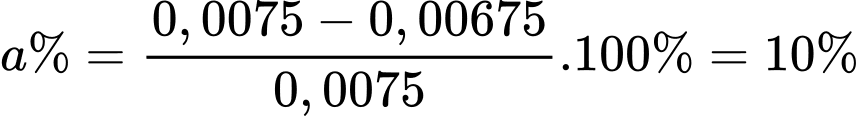
⇒ Điền đáp án: 10,0
⭐ Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y, thu được 4,66 gam kết tủa → kết tủa là BaSO4.
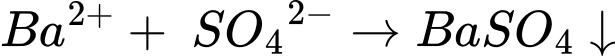
Số mol của kết tủa là:
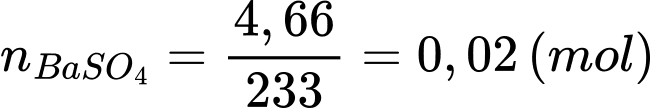
+) Số mol của H2SO4 trong 25 mL dung dịch là:
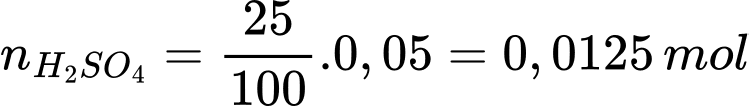
+) Bảo toàn nhóm SO42- trong 100 mL là:
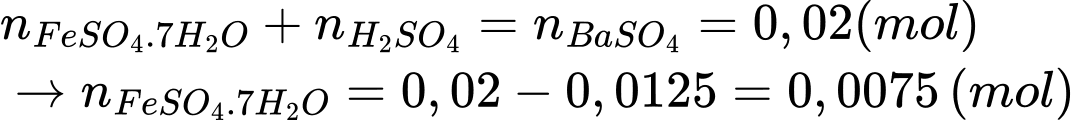
⭐Thí nghiệm 2: phần FeSO4 trong hỗn hợp X sẽ phản ứng với dung dịch KMnO4
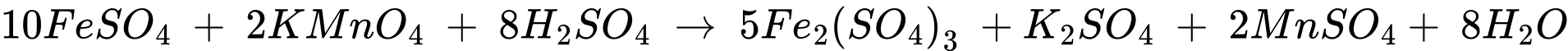
+) Số mol của KMnO4 phản ứng là:
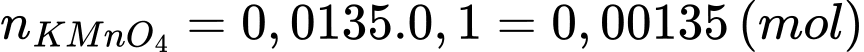
+) Số mol của FeSO4 phản ứng là:
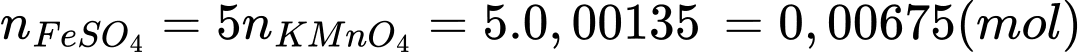
+) Phần trăm Fe(II) trong lượng muối bị oxi hóa trong không khí là
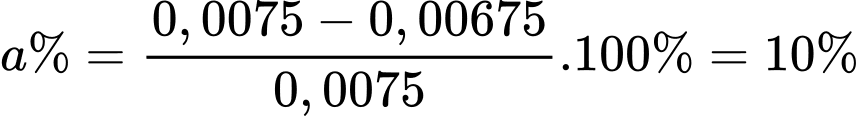
⇒ Điền đáp án: 10,0