PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704344]: “Các kim loại nhóm IA đều ...(1)... nóng chảy và có nhiệt độ nóng chảy ...(2)... so với các kim loại nhóm khác”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, khó, cao hơn.
B, dễ, thấp hơn.
C, khó, sắp xỉ.
D, dễ, cao hơn.
Kim loại nhóm IA (kim loại kiềm) có cấu trúc mạng tinh thể kim loại lỏng lẻo, liên kết kim loại yếu do chỉ có một electron hóa trị. Điều này làm cho chúng dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại khác.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 2 [704345]: Iron(III) hydroxide là chất rắn màu nâu đỏ. Công thức iron(III) hydroxide là
A, Fe(OH)2.
B, Fe(OH)3.
C, FeCO3.
D, Fe3O4.
Tên gọi của các hợp chất là:
❌A. Fe(OH)2: Iron (II) hydroxide
✔️B. Fe(OH)3: Iron (III) hydroxide
❌C. FeCO3: Iron (II) carbonate
❌D. Fe3O4: Magnetite
⇒ Chọn đáp án B Đáp án: B
❌A. Fe(OH)2: Iron (II) hydroxide
✔️B. Fe(OH)3: Iron (III) hydroxide
❌C. FeCO3: Iron (II) carbonate
❌D. Fe3O4: Magnetite
⇒ Chọn đáp án B Đáp án: B
Câu 3 [309478]: Polymer nào sau đây có thành phần hóa học gồm các nguyên tố C, H và O?
A, Poly(vinyl chloride).
B, Polyacrylonitrile.
C, Poly(methyl methacrylate).
D, Polyethylene.
Phân tích các đáp án:
❌A. Poli(vinyl clorua): (-CH2-CHCl-)n ⟹ Chứa C, H, Cl.
❌B. Poliacrilonitrin: (-CH2-CHCN-)n ⟹ Chứa C, H, N.
✔️C. Poli(metyl metacrylat): (-CH2-C(CH3)(COOCH3)-)n ⟹ Chứa C, H, O.
❌D. Polietilen: (-CH2-CH2-)n ⟹ Chứa C, H.
⇒ Chọn đáp án C Đáp án: C
❌A. Poli(vinyl clorua): (-CH2-CHCl-)n ⟹ Chứa C, H, Cl.
❌B. Poliacrilonitrin: (-CH2-CHCN-)n ⟹ Chứa C, H, N.
✔️C. Poli(metyl metacrylat): (-CH2-C(CH3)(COOCH3)-)n ⟹ Chứa C, H, O.
❌D. Polietilen: (-CH2-CH2-)n ⟹ Chứa C, H.
⇒ Chọn đáp án C Đáp án: C
Câu 4 [704346]: Thuỷ phân tripeptide X bằng xúc tác enzyme thu được hỗn hợp gồm alanine, lysine và glutamic acid. Đặt hỗn hợp sản phẩm trong điện trường ở pH = 6,0. Phát biểu nào sau đây về sự di chuyển của các amino acid dưới tác dụng của điện trường là đúng?
A, Cả ba amino acid đều di chuyển về phía cực âm.
B, Cả ba amino acid đều di chuyển về phía cực dương.
C, Có hai amino acid di chuyển về phía cực âm.
D, Một amino acid không di chuyển; mỗi một điện cực có một amino acid di chuyển về.
Đặt hỗn hợp các amino acid gồm lysine, alanine và glutamic acid ở pH = 6,0 vào trong một điện trường.
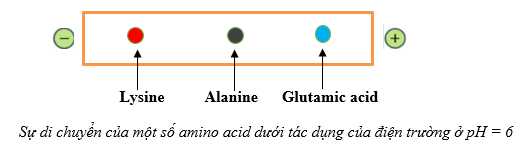
⭐ Alanine hầu như không dịch chuyển do trong pH = 6 tồn tại chủ yếu ở dạng lưỡng cực.
⭐ Lysine dịch chuyển về cực âm do trong pH = 6 tồn tại chủ yếu ở dạng cation.
⭐ Glutamic acid dịch chuyển về cực dương do trong pH = 6 tồn tại chủ yếu ở dạng anion.
⇒ Chọn đáp án D Đáp án: D

⭐ Alanine hầu như không dịch chuyển do trong pH = 6 tồn tại chủ yếu ở dạng lưỡng cực.
⭐ Lysine dịch chuyển về cực âm do trong pH = 6 tồn tại chủ yếu ở dạng cation.
⭐ Glutamic acid dịch chuyển về cực dương do trong pH = 6 tồn tại chủ yếu ở dạng anion.
⇒ Chọn đáp án D Đáp án: D
Câu 5 [560603]: Kim loại dễ bị kéo dài, dát mỏng, dễ bị bẻ cong do có tính chất vật lí đặc trưng là
A, tính dẫn điện.
B, tính dẫn nhiệt.
C, tính dẻo.
D, có ánh kim.
Kim loại có tính chất vật lý đặc trưng là tính dẻo, cho phép chúng có thể kéo dài và dát mỏng, dễ bị bẻ cong.
Các tính chất còn lại:
A. Tính dẫn điện: Do sự di chuyển tự do của electron trong kim loại.
B. Tính dẫn nhiệt: Do sự truyền động năng qua mạng tinh thể và electron tự do.
D. Tính ánh kim: Do sự phản xạ ánh sáng trên bề mặt kim loại.
⇒ Chọn đáp án C Đáp án: C
Các tính chất còn lại:
A. Tính dẫn điện: Do sự di chuyển tự do của electron trong kim loại.
B. Tính dẫn nhiệt: Do sự truyền động năng qua mạng tinh thể và electron tự do.
D. Tính ánh kim: Do sự phản xạ ánh sáng trên bề mặt kim loại.
⇒ Chọn đáp án C Đáp án: C
Câu 6 [560409]: Cho quá trình oxi hóa – khử của Fe2+ với Fe3+ như sau:
Fe3+ + e ⇌ Fe2+
Biểu diễn cặp oxi hóa – khử của quá trình trên là A, Fe3+/Fe.
B, Fe2+/Fe.
C, Fe2+/Fe3+.
D, Fe3+/Fe2+.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe2+.
⇒ Chọn đáp án D Đáp án: D
→ Cặp oxi hoá - khử của quá trình là Fe3+/Fe2+.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [704347]: Từ quặng apatite đã tinh luyện, sử dụng sulfuric acid đặc (H2SO4) hoặc phosphoric acid (H3PO4) với lượng phù hợp, ta thu được Ca(H2PO4)2 là thành phần chủ yếu của phân bón superphosphate. Sử dụng loại phân bón này sẽ gây ảnh hưởng gì cho đất?
A, Làm tăng độ chua của đất.
B, Làm đất dễ bị xói lở.
C, Làm tăng độ phèn của đất.
D, Không gây ảnh hưởng gì.
Phân bón superphosphate (Ca(H2PO4)2) có tính acid yếu, vì nó được sản xuất bằng cách phản ứng với H2SO4 (sulfuric acid) hoặc H3PO4 (phosphoric acid).
⟶ Khi phân bón này được đưa vào đất, nó có thể giải phóng ion H+, gây tăng độ chua của đất (giảm pH đất).
⇒ Chọn đáp án A
Đáp án: A
⟶ Khi phân bón này được đưa vào đất, nó có thể giải phóng ion H+, gây tăng độ chua của đất (giảm pH đất).
⇒ Chọn đáp án A
Đáp án: A
Câu 8 [304842]: Etser nào sau đây tác dụng với dung dịch NaOH thu được sodium acetate?
A, HCOOCH3.
B, CH3COOC2H5.
C, C2H5COOCH3.
D, HCOOC2H5.
Phân tích phản ứng thủy phân ester trong môi trường base:
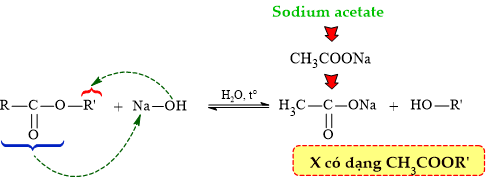
⇒ Quan sát 4 đáp án ⇝ ester thỏa mãn là CH3COOC2H5 ⟹ Chọn đáp án B.
► Còn lại các phương án khác:
❌ A. HCOOCH3 + NaOH ––to→ HCOONa (sodium formate) + CH3OH.
❌ C. C2H5COOCH3 + NaOH ––to→ C2H5COONa (sodium propionate) + CH3OH.
❌ D. HCOOC2H5 + NaOH ––to→ HCOONa + C2H5OH. Đáp án: B

⇒ Quan sát 4 đáp án ⇝ ester thỏa mãn là CH3COOC2H5 ⟹ Chọn đáp án B.
► Còn lại các phương án khác:
❌ A. HCOOCH3 + NaOH ––to→ HCOONa (sodium formate) + CH3OH.
❌ C. C2H5COOCH3 + NaOH ––to→ C2H5COONa (sodium propionate) + CH3OH.
❌ D. HCOOC2H5 + NaOH ––to→ HCOONa + C2H5OH. Đáp án: B
Câu 9 [704348]: Tháng 6 năm 2013, Hà Nội xảy ra vụ cháy kinh hoàng tại trạm xăng trên đường Trần Hưng Đạo (quận Hoàn Kiếm, Hà Nội). Nguyên nhân ban đầu của vụ cháy được xác định là do rò rỉ xăng trong quá trình chuyển xăng từ xe bồn xuống bể chứa của cây xăng. Sức nóng của đám cháy có lúc lên đến hơn 1.000 oC, lực lượng cứu hỏa vừa dùng bọt chữa cháy để dập lửa, dùng cát ngăn xăng nhưng cũng vừa bơm nước để làm mát cho lực lượng cứu hỏa. Điểm chớp cháy của một chất là nhiệt độ thấp nhất ở áp suất khí quyển mà hơi của chất đó sẽ bốc cháy trong không khí khi tiếp xúc với nguồn lửa. Điểm chớp cháy của xăng là –43 oC, dầu hoả là 38 – 72 oC. Cho các phát biểu sau:
(a) Sử dụng bọt chữa cháy để bao phủ bề mặt xăng. Lớp bọt này cách ly xăng khỏi nguồn oxygen trong không khí, ngăn ngọn lửa tiếp tục cháy.
(b) Cát được sử dụng để chặn dòng chảy của xăng, tránh xăng cháy lan ra các khu vực lân cận.
(c) Nước được dùng để dập đám cháy xăng dầu là vì nước nhẹ hơn sẽ nổi trên bề mặt xăng, đồng thời giảm nhiệt độ của các khu vực lân cận.
(d) Ở điều kiện phòng (khoảng 25 oC), xăng có nguy cơ cháy nổ cao hơn so với dầu hỏa.Các phát biểu đúng là
(a) Sử dụng bọt chữa cháy để bao phủ bề mặt xăng. Lớp bọt này cách ly xăng khỏi nguồn oxygen trong không khí, ngăn ngọn lửa tiếp tục cháy.
(b) Cát được sử dụng để chặn dòng chảy của xăng, tránh xăng cháy lan ra các khu vực lân cận.
(c) Nước được dùng để dập đám cháy xăng dầu là vì nước nhẹ hơn sẽ nổi trên bề mặt xăng, đồng thời giảm nhiệt độ của các khu vực lân cận.
(d) Ở điều kiện phòng (khoảng 25 oC), xăng có nguy cơ cháy nổ cao hơn so với dầu hỏa.Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (b), (d).
C, (b), (c), (d).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Sử dụng bọt chữa cháy để tạo lớp phủ cách ly bề mặt xăng với oxy trong không khí, làm ngọn lửa không thể duy trì sự cháy. Bọt chữa cháy được phát minh bởi nhà hóa học người Nga Alexander Loran vào năm 1902.
✔️ (b) Đúng. Cát có tác dụng hấp thụ nhiệt và có thể ngăn vật liệu cháy tiếp xúc với oxygen. Nhờ đó, quá trình cháy không thể duy trì và nhanh bị dập tắt. Khi xảy ra cháy, mọi người nên tìm cát xúc vào đám lửa để ngăn chất lỏng cháy lan ra.
❌ (c) Sai. Xăng, dầu nhẹ hơn nước; khi dùng nước để dập đám cháy thì xăng, dầu sẽ nổi lên trên mặt nước, lan rộng theo nước tràn làm cho đám cháy trở lên mãnh liệt hơn.
✔️ (d) Đúng. Điểm chớp cháy là nhiệt độ thấp nhất mà một chất lỏng có thể tự bốc hơi và tạo thành hỗn hợp dễ cháy với không khí khi tiếp xúc với ngọn lửa hoặc nguồn nhiệt. Điểm chớp cháy của xăng là -43 oC nghĩa là xăng dễ bốc cháy hơn nhiều so với dầu hỏa (điểm chớp cháy 38–72 oC) nên ở điều kiện phòng khoảng 25 oC xăng có nguy cơ cháy nổ cao hơn so với dầu hỏa.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Sử dụng bọt chữa cháy để tạo lớp phủ cách ly bề mặt xăng với oxy trong không khí, làm ngọn lửa không thể duy trì sự cháy. Bọt chữa cháy được phát minh bởi nhà hóa học người Nga Alexander Loran vào năm 1902.
✔️ (b) Đúng. Cát có tác dụng hấp thụ nhiệt và có thể ngăn vật liệu cháy tiếp xúc với oxygen. Nhờ đó, quá trình cháy không thể duy trì và nhanh bị dập tắt. Khi xảy ra cháy, mọi người nên tìm cát xúc vào đám lửa để ngăn chất lỏng cháy lan ra.
❌ (c) Sai. Xăng, dầu nhẹ hơn nước; khi dùng nước để dập đám cháy thì xăng, dầu sẽ nổi lên trên mặt nước, lan rộng theo nước tràn làm cho đám cháy trở lên mãnh liệt hơn.
✔️ (d) Đúng. Điểm chớp cháy là nhiệt độ thấp nhất mà một chất lỏng có thể tự bốc hơi và tạo thành hỗn hợp dễ cháy với không khí khi tiếp xúc với ngọn lửa hoặc nguồn nhiệt. Điểm chớp cháy của xăng là -43 oC nghĩa là xăng dễ bốc cháy hơn nhiều so với dầu hỏa (điểm chớp cháy 38–72 oC) nên ở điều kiện phòng khoảng 25 oC xăng có nguy cơ cháy nổ cao hơn so với dầu hỏa.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 10 [704349]: Những quá trình nào sau đây làm thay đổi thành phần hydrocarbon sau quá trình lọc dầu?
A, Quá trình tiền xử lí và quá trình chưng cất.
B, Quá trình tiền xử lí và quá trình reforming.
C, Quá trình cracking và quá trình reforming.
D, Quá trình chưng cất và quá trình cracking.
Quá trình làm thay đổi thành phần hydrocarbon sau quá trình lọc dầu: Quá trình cracking và quá trình reforming.
- Quá trình cracking là quá trình phá vỡ các phân tử alkane mạch dài thành các hydrocarbon (alkane, alkene) mạch ngắn hơn.
- Quá trình reforming là quá trình sắp xếp lại mạch hydrocarbon để tạo ra nhiều hydrocarbon mạch nhánh.
⇒ Chọn đáp án C Đáp án: C
- Quá trình cracking là quá trình phá vỡ các phân tử alkane mạch dài thành các hydrocarbon (alkane, alkene) mạch ngắn hơn.
- Quá trình reforming là quá trình sắp xếp lại mạch hydrocarbon để tạo ra nhiều hydrocarbon mạch nhánh.
⇒ Chọn đáp án C Đáp án: C
Câu 11 [308522]: Tên gọi của amine có công thức cấu tạo CH3–NH–CH2–CH3 là
A, methylethylamine.
B, ethylamine.
C, methylethanamine.
D, ethylmethylamine.
Amine được gọi tên theo danh pháp gốc–chức:
Tên gốc–chức của amine = Tên gốc hydrocarbon + amine
Amine có công thức cấu tạo CH3–NH–CH2–CH3:
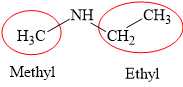
Tên gọi của amine là: ethylmethylamine.
⇒ Chọn đáp án D Đáp án: D
Tên gốc–chức của amine = Tên gốc hydrocarbon + amine
Amine có công thức cấu tạo CH3–NH–CH2–CH3:

Tên gọi của amine là: ethylmethylamine.
⇒ Chọn đáp án D Đáp án: D
Câu 12 [308349]: Trong phân tử saccharose, gốc glucose liên kết với gốc fructose qua nguyên tử đóng vai trò cầu nối là
A, carbon.
B, hydrogen.
C, oxygen.
D, nitrogen.
HD: Quan sát cấu tạo của saccharose:
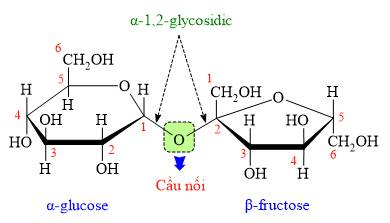
⇒ Trả lời: gốc glucose liên kết với gốc fructose qua nguyên tử đóng vai trò cầu nối là oxygen (O)
⇝ Chọn đáp án C Đáp án: C

⇒ Trả lời: gốc glucose liên kết với gốc fructose qua nguyên tử đóng vai trò cầu nối là oxygen (O)
⇝ Chọn đáp án C Đáp án: C
Câu 13 [301986]: Chất nào sau đây chứa nhóm chức ester?
A, CH3COOH.
B, CH3COOC2H5.
C, CH3CHO.
D, C2H5OH.
Quan sát hình thức ester:
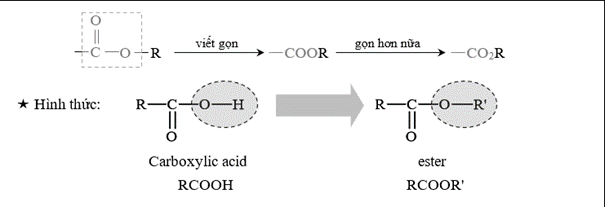
⇒ CH3COOC2H5 chứa nhóm chức ester.
Còn lại:
❌ A. CH3COOH chứa nhóm chức acid COOH.
❌ C. CH3CHO chứa nhóm chức aldehyde CHO.
❌ D. C2H5OH chứa nhóm chức alcohol OH.
⇝ Chọn đáp án B Đáp án: B

⇒ CH3COOC2H5 chứa nhóm chức ester.
Còn lại:
❌ A. CH3COOH chứa nhóm chức acid COOH.
❌ C. CH3CHO chứa nhóm chức aldehyde CHO.
❌ D. C2H5OH chứa nhóm chức alcohol OH.
⇝ Chọn đáp án B Đáp án: B
Câu 14 [704350]: Ở điều kiện thường, các amino acid tồn tại ở dạng ...(1)..., do đó chúng có nhiệt độ nóng chảy cao và ...(2)... trong nước. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, ion lưỡng cực, tan tốt.
B, lỏng, ít tan.
C, khí, tan tốt.
D, ion lưỡng cực, không tan.
Ở điều kiện thường, các amino acid tồn tại ở dạng ion lưỡng cực, do đó chúng có nhiệt độ nóng chảy cao và tan tốt trong nước.
Giải thích:
Ở điều kiện thường, các amino acid tồn tại ở dạng ion lưỡng cực. Đây là dạng trong đó nhóm amino (–NH2) nhận proton trở thành –NH3+ và nhóm carboxyl (–COOH) mất proton trở thành –COO–. Dạng ion này làm cho amino acid có:
+) Nhiệt độ nóng chảy cao: Do lực hút tĩnh điện mạnh giữa các ion lưỡng cực.
+) Tan tốt trong nước: Do khả năng tạo liên kết hydrogen với nước.
⇒ Chọn đáp án A Đáp án: A
Giải thích:
Ở điều kiện thường, các amino acid tồn tại ở dạng ion lưỡng cực. Đây là dạng trong đó nhóm amino (–NH2) nhận proton trở thành –NH3+ và nhóm carboxyl (–COOH) mất proton trở thành –COO–. Dạng ion này làm cho amino acid có:
+) Nhiệt độ nóng chảy cao: Do lực hút tĩnh điện mạnh giữa các ion lưỡng cực.
+) Tan tốt trong nước: Do khả năng tạo liên kết hydrogen với nước.
⇒ Chọn đáp án A Đáp án: A
Câu 15 [704351]: Phản ứng giữa but-1-ene với HBr xảy ra như sau:
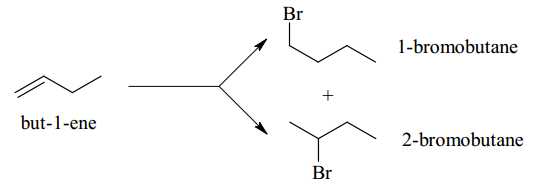
▪ Giai đoạn 1 là quá trình phản ứng của H+ với C=C, tạo thành hai carbocation trung gian:
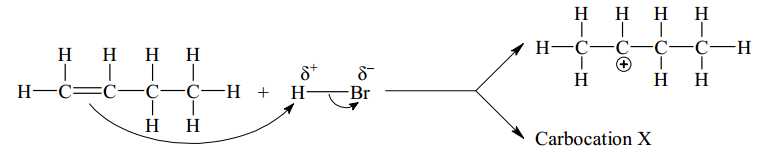
Một carbocation nhận Br– tạo sản phẩm 1-bromobutane, carbocation còn lại nhận nhận Br– tạo sản phẩm 2-bromobutane. Hãy cho biết công thức cấu tạo phù hợp của carbocation X.

▪ Giai đoạn 1 là quá trình phản ứng của H+ với C=C, tạo thành hai carbocation trung gian:
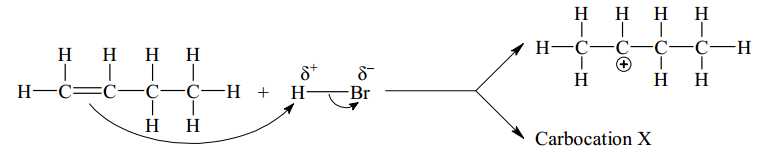
Một carbocation nhận Br– tạo sản phẩm 1-bromobutane, carbocation còn lại nhận nhận Br– tạo sản phẩm 2-bromobutane. Hãy cho biết công thức cấu tạo phù hợp của carbocation X.
A, 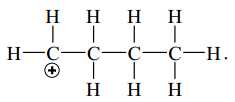

B, 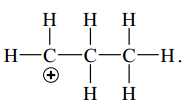

C, 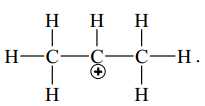

D, 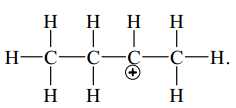

Quá trình phản ứng của H+ với C=C, tạo thành hai carbocation trung gian. Phản ứng diễn ra như sau:
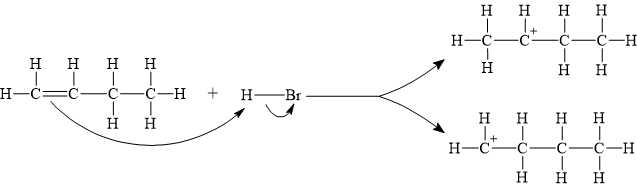
⇒ Chọn đáp án A Đáp án: A

⇒ Chọn đáp án A Đáp án: A
Câu 16 [704352]: Khi vừa hoà tan phèn nhôm – kali có công thức K2SO4.Al2(SO4)3.24H2O vào nước thu được dung dịch chứa K+, [Al(OH2)6]3+ và SO42–. Sau đó, một phần phức chất aqua chuyển thành phức chất không tan theo phương trình hoá học sau:
[Al(OH2)6]3+(aq) + 3H2O(1)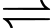 [Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
[Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
Có các phát biểu sau đây:
(1) Trong dung dịch có diễn ra quá trình phân li và quá trình hình thành phức chất.
(2) Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
(3) Giá trị n ở phức chất trong cân bằng (*) là 1.
(4) Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
(5) Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng (*) giúp giải thích ứng dụng làm trong nước của phèn nhôm – kali.
Các phát biểu đúng là
[Al(OH2)6]3+(aq) + 3H2O(1)
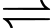 [Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)
[Al(OH)3(OH2)3]n+(s) + 3H3O+(aq)Có các phát biểu sau đây:
(1) Trong dung dịch có diễn ra quá trình phân li và quá trình hình thành phức chất.
(2) Chỉ có nguyên tố chuyển tiếp mới tạo được phức chất aqua.
(3) Giá trị n ở phức chất trong cân bằng (*) là 1.
(4) Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
(5) Trong thực tế, sự hình thành phức chất từ phản ứng thuận của cân bằng (*) giúp giải thích ứng dụng làm trong nước của phèn nhôm – kali.
Các phát biểu đúng là
A, (1), (4), (5).
B, (1), (2), (3).
C, (3), (5).
D, (2), (4), (5).
(1) 
(2)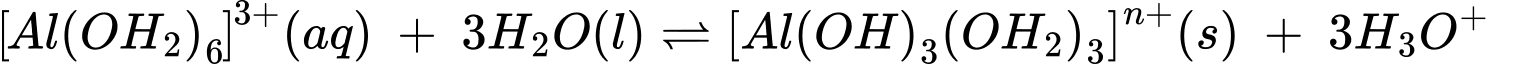
Phân tích các phát biểu:
✔️ (1) Đúng. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+, quá trình (2) là quá trình phân lí của phức chất tạo ion H3O+.
(2) Sai. Trong dung dịch, cation kim loại chuyển tiếp tồn tại ở dạng phức chất aqua. Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. Do đó dựa vào các dấu hiệu như màu sắc bị thay đổi, sự xuất hiện kết tủa, kết tủa bị hoà tan,… người ta có thể dự đoán phức chất trong dung dịch được tạo thành.
(3) Sai. Giá trị n = 0, trong [Al(OH)3(OH2)3]3+ có Al3+ và 3OH-
✔️ (4) Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
✔️ (5) Đúng. Kết tủa [Al(OH)3(OH2)3]3+ được tạo ra khi khuấy phèn vào nước đã kết dính các hạt đất nhỏ lơ lửng trong nước đục thành các hát đất to hơn, nặng và chìm xuống làm trong nước. Phèn chua rất cần cho việc xử lí nước đục ở các vùng lũ để có nước dùng cho sinh hoạt của con người.
Các phát biểu đúng là (1) (4) (5)
⇒ Chọn đáp án A Đáp án: A
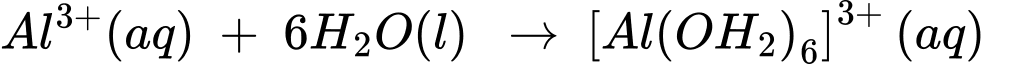
(2)
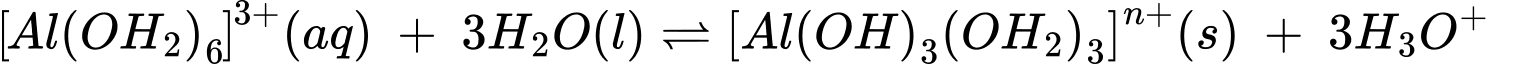
Phân tích các phát biểu:
✔️ (1) Đúng. Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+, quá trình (2) là quá trình phân lí của phức chất tạo ion H3O+.
(2) Sai. Trong dung dịch, cation kim loại chuyển tiếp tồn tại ở dạng phức chất aqua. Hầu hết phức chất aqua của ion kim loại chuyển tiếp dãy thứ nhất đều có màu. Do đó dựa vào các dấu hiệu như màu sắc bị thay đổi, sự xuất hiện kết tủa, kết tủa bị hoà tan,… người ta có thể dự đoán phức chất trong dung dịch được tạo thành.
(3) Sai. Giá trị n = 0, trong [Al(OH)3(OH2)3]3+ có Al3+ và 3OH-
✔️ (4) Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion. Trong phản ứng thuận của cân bằng (*), phức chất aqua đóng vai trò acid theo Brønsted - Lowry.
✔️ (5) Đúng. Kết tủa [Al(OH)3(OH2)3]3+ được tạo ra khi khuấy phèn vào nước đã kết dính các hạt đất nhỏ lơ lửng trong nước đục thành các hát đất to hơn, nặng và chìm xuống làm trong nước. Phèn chua rất cần cho việc xử lí nước đục ở các vùng lũ để có nước dùng cho sinh hoạt của con người.
Các phát biểu đúng là (1) (4) (5)
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Trong phòng thí nghiệm, một học sinh nhúng thanh đồng có khối lượng 12,340 gam vào 255 mL dung dịch AgNO3 0,125 M. Biết thế điện cực chuẩn của cặp oxi hoá - khử Cu2+/Cu nhỏ hơn Ag+/Ag.
Câu 17 [704353]: Phát biểu nào sau đây về thí nghiệm trên của học sinh không đúng?
A, Dung dịch chuyển từ không màu sang màu xanh.
B, Ag+ có tính oxi hóa mạnh hơn Cu2+.
C, Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 1.
D, Khối lượng thanh đồng sau phản ứng có khối lượng lớn hơn so với ban đầu.
Phân tích các phát biểu:
✔️ A. Đúng. Trong dung dịch AgNO3, Ag+ không màu nhưng khi Cu tham gia phản ứng, Cu2+ được sinh ra và tạo ra màu xanh trong dung dịch.
✔️ B. Đúng. Thế điện cực chuẩn của cặp Ag+/Ag là 0,799 V, còn của cặp Cu2+/Cu là 0,34 V. Vì thế, Ag+ có tính oxi hóa mạnh hơn Cu2+, dễ dàng nhận electron hơn.
❌ C. Sai. Phản ứng xảy ra như sau: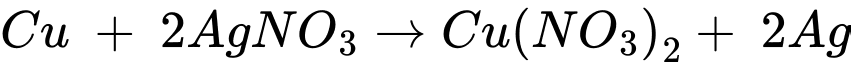 .
.
→ Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 2.
✔️ D. Đúng. Trong thí nghiệm, một lượng Ag giải phóng đã bám vào thanh đồng nên khối lượng thanh đồng sau phản ứng lớn hơn so với ban đầu.
⇒ Chọn đáp án C Đáp án: C
✔️ A. Đúng. Trong dung dịch AgNO3, Ag+ không màu nhưng khi Cu tham gia phản ứng, Cu2+ được sinh ra và tạo ra màu xanh trong dung dịch.
✔️ B. Đúng. Thế điện cực chuẩn của cặp Ag+/Ag là 0,799 V, còn của cặp Cu2+/Cu là 0,34 V. Vì thế, Ag+ có tính oxi hóa mạnh hơn Cu2+, dễ dàng nhận electron hơn.
❌ C. Sai. Phản ứng xảy ra như sau:
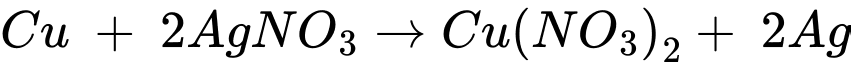 .
.→ Tỉ lệ số mol Cu và AgNO3 tham gia phản ứng là 1 : 2.
✔️ D. Đúng. Trong thí nghiệm, một lượng Ag giải phóng đã bám vào thanh đồng nên khối lượng thanh đồng sau phản ứng lớn hơn so với ban đầu.
⇒ Chọn đáp án C Đáp án: C
Câu 18 [704354]: Giả sử toàn bộ lượng Ag giải phóng đều bám vào thanh đồng thì khi kết thúc phản ứng khối lượng của thanh đồng là
A, 14,7625 gam.
B, 14,4775 gam.
C, 13,5775 gam.
D, 13,7425 gam.
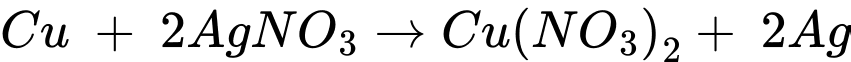
Đổi 255 mL = 0,255 mL
Số mol của AgNO3 và Cu lần lượt là
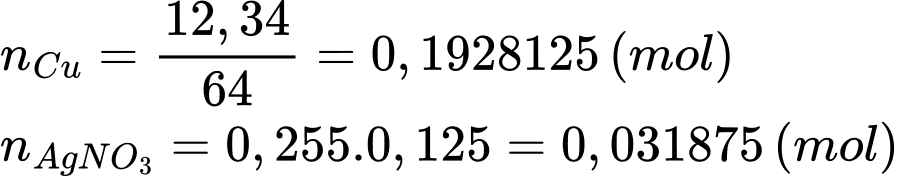
Khối lượng của thanh đồng sau phản ứng là
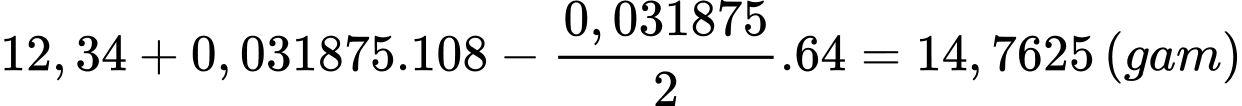
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
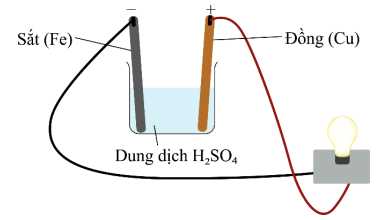
Câu 19 [704355]: Kim loại sắt được ứng dụng trong rất nhiều ngành nghề quan trọng, tuy nhiên nó lại có một nhược điểm là dễ bị ăn mòn. Để nghiên cứu về sự ăn mòn của sắt, tiến hành thiết lập thí nghiệm như hình bên dưới:
▪ Nhúng thanh sắt và thanh đồng vào cốc chứa dung dịch H2SO4 0,5 M.
▪ Dùng dây dẫn điện nối thanh sắt và thanh đồng với đèn led.
Cho thế khử chuẩn của các cặp oxi hóa khử:
Fe → Fe2+ + 2e;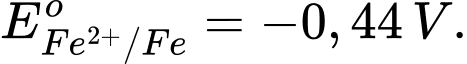
H2 → 2H+ + 2e;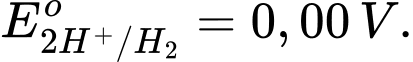
Cu → Cu2+ + 2e;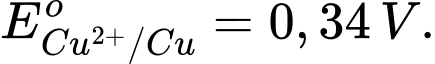
▪ Nhúng thanh sắt và thanh đồng vào cốc chứa dung dịch H2SO4 0,5 M.
▪ Dùng dây dẫn điện nối thanh sắt và thanh đồng với đèn led.

Cho thế khử chuẩn của các cặp oxi hóa khử:
Fe → Fe2+ + 2e;
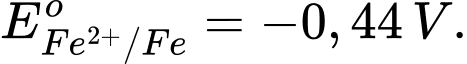
H2 → 2H+ + 2e;
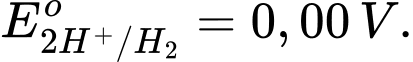
Cu → Cu2+ + 2e;
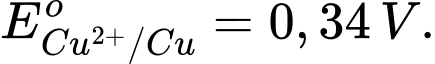
Ta có: 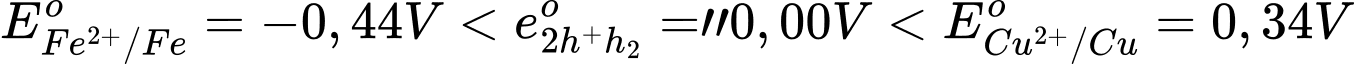 "
" Fe + H2SO4 ⟶ FeSO4 + H2
Thanh Fe bị ăn mòn (Có quá trình oxi hóa Fe thành Fe2+) và ở thanh Cu có bọt khí H2 (Có quá trình H+ thành H2)
Fe cực âm – anode: Fe ⟶ Fe2+ + 2e
Cu cực dương – cathode: 2H+ + 2e ⟶ H2
Phân tích các phát biểu:
✔️ a. Đúng. Trong ăn mòn điện hóa, sắt (Fe) có thế điện cực chuẩn thấp hơn đồng (Cu), nên sắt là anode (bị oxi hóa), còn đồng là cathode (bị khử). Tại cathode, phản ứng xảy ra là: 2H+ + 2e ⟶ H2↑.
✔️ b. Đúng. Bọt khí H2 xuất hiện ở cả hai thanh kim loại tại cathode và anode.
✔️ c. Đúng. Tại anode, Fe bị oxi hóa theo phản ứng: Fe ⟶ Fe2+ + 2e. Ion Fe2+ hòa tan vào dung dịch, làm thanh sắt tan dần.
✔️ d. Đúng. Trong môi trường acid, sắt bị ăn mòn hóa học bởi phản ứng trực tiếp với H+: Fe + 2H+ → Fe2+ + H2↑. Tuy nhiên, khi có sự xuất hiện của thanh đồng, ăn mòn điện hóa chiếm ưu thế, vì tạo thành cặp điện cực Fe-Cu và có dòng điện chạy qua.
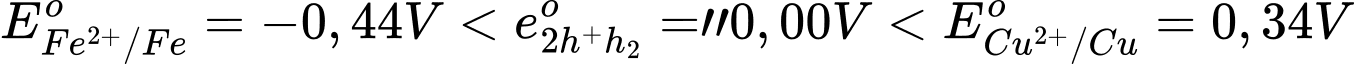 "
" Thanh Fe bị ăn mòn (Có quá trình oxi hóa Fe thành Fe2+) và ở thanh Cu có bọt khí H2 (Có quá trình H+ thành H2)
Fe cực âm – anode: Fe ⟶ Fe2+ + 2e
Cu cực dương – cathode: 2H+ + 2e ⟶ H2
Phân tích các phát biểu:
✔️ a. Đúng. Trong ăn mòn điện hóa, sắt (Fe) có thế điện cực chuẩn thấp hơn đồng (Cu), nên sắt là anode (bị oxi hóa), còn đồng là cathode (bị khử). Tại cathode, phản ứng xảy ra là: 2H+ + 2e ⟶ H2↑.
✔️ b. Đúng. Bọt khí H2 xuất hiện ở cả hai thanh kim loại tại cathode và anode.
✔️ c. Đúng. Tại anode, Fe bị oxi hóa theo phản ứng: Fe ⟶ Fe2+ + 2e. Ion Fe2+ hòa tan vào dung dịch, làm thanh sắt tan dần.
✔️ d. Đúng. Trong môi trường acid, sắt bị ăn mòn hóa học bởi phản ứng trực tiếp với H+: Fe + 2H+ → Fe2+ + H2↑. Tuy nhiên, khi có sự xuất hiện của thanh đồng, ăn mòn điện hóa chiếm ưu thế, vì tạo thành cặp điện cực Fe-Cu và có dòng điện chạy qua.
Câu 20 [704356]: Nghiên cứu tính chất hóa học của amine có thể được thực hiện qua các thí nghiệm sau:
▪ Thí nghiệm 1: Cho vào ống nghiệm (1) khoảng 1 mL dung dịch ethylamine 5 %. Lấy đũa thuỷ tinh nhúng vào dung dịch rồi chấm vào giấy quỳ tím.
▪ Thí nghiệm 2: Cho vào ống nghiệm (1) khoảng 1 mL dung dịch ethylamine 5 %. Nhúng đũa thuỷ tinh sạch vào dung dịch HCl đặc rồi đưa đầu đũa thuỷ tinh vào miệng ống nghiệm (1).
▪ Thí nghiệm 3: Cho vào ống nghiệm (2) khoảng 5 giọt dung dịch FeCl3 3 %. Vừa lắc vừa thêm từ từ đến hết 2 mL dung dịch ethylamine 5%.
▪ Thí nghiệm 4: Cho vào ống nghiệm (3) khoảng 5 giọt dung dịch CuSO4 5 %. Vừa lắc vừa thêm từ từ đến hết 4 mL dung dịch ethylamine 5%.
▪ Thí nghiệm 1: Cho vào ống nghiệm (1) khoảng 1 mL dung dịch ethylamine 5 %. Lấy đũa thuỷ tinh nhúng vào dung dịch rồi chấm vào giấy quỳ tím.
▪ Thí nghiệm 2: Cho vào ống nghiệm (1) khoảng 1 mL dung dịch ethylamine 5 %. Nhúng đũa thuỷ tinh sạch vào dung dịch HCl đặc rồi đưa đầu đũa thuỷ tinh vào miệng ống nghiệm (1).
▪ Thí nghiệm 3: Cho vào ống nghiệm (2) khoảng 5 giọt dung dịch FeCl3 3 %. Vừa lắc vừa thêm từ từ đến hết 2 mL dung dịch ethylamine 5%.
▪ Thí nghiệm 4: Cho vào ống nghiệm (3) khoảng 5 giọt dung dịch CuSO4 5 %. Vừa lắc vừa thêm từ từ đến hết 4 mL dung dịch ethylamine 5%.
Thí nghiệm 1: Dung dịch ethylamine làm quỳ tím hóa xanh do xuất hiện ion OH–.
C2H5NH2 + H2O ⇌ C2H5NH3+ + OH–.
Thí nghiệm 2: Do HCl và C2H5NH2 là những hợp chất dễ bay hơi nên chúng đã hóa hợp với nhau tạo thành tinh thể muối C2H5NH3Cl, chính tinh thể này đã tạo nên hiện tượng "khói"
C2H5NH2 + HCl ⟶ C2H5NH3Cl
Thí nghiệm 3: Xuất hiện kết tủa màu nâu đỏ là Fe(OH)3.
3C2H5NH2 + 3H2O + FeCl3 ⟶ Fe(OH)3 + 3C2H5NH3Cl
Thí nghiệm 4: Ban đầu xuất hiện kết tủa màu xanh Cu(OH)2, sau đó kết tủa tan dần tạo phức chất màu xanh.
2C2H5NH2 + 2H2O + CuSO4 ⟶ Cu(OH)2 + (C2H5NH3)2SO4
Cu(OH)2 + 4C2H5NH2 ⟶ [Cu(C2H5NH2)4](OH)2
Phân tích các phát biểu:
❌ (a) Sai. Quỳ tím không cần ẩm vì ethylamine (CH3CH2NH2) là chất lỏng dễ bay hơi, hòa tan tốt trong nước, và có khả năng làm giấy quỳ tím chuyển màu ngay cả khi giấy khô.
✔️ (b) Đúng. Thí nghiệm này dựa trên phản ứng giữa hơi ethylamine và hơi HCl, tạo khói trắng CH3CH2NH3Cl. Nếu đưa đũa nhúng ethylamine đến gần miệng lọ HCl đặc thì vẫn xảy ra hiện tượng khói trắng tương tự.
❌ (c) Sai. Trong thí nghiệm 4, dung dịch CuSO4 phản ứng với ethylamine tạo phức chất tan màu xanh đậm, chứ không tạo kết tủa.
❌ (d) Sai. Các thí nghiệm chủ yếu chứng minh tính base của amine (phản ứng làm đổi màu quỳ tím, phản ứng với HCl, phản ứng tạo phức chất với Cu2+). Ethylamine không thể hiện tính acid trong các thí nghiệm này, vì nó không có khả năng nhường proton (H+).
C2H5NH2 + H2O ⇌ C2H5NH3+ + OH–.
Thí nghiệm 2: Do HCl và C2H5NH2 là những hợp chất dễ bay hơi nên chúng đã hóa hợp với nhau tạo thành tinh thể muối C2H5NH3Cl, chính tinh thể này đã tạo nên hiện tượng "khói"
C2H5NH2 + HCl ⟶ C2H5NH3Cl
Thí nghiệm 3: Xuất hiện kết tủa màu nâu đỏ là Fe(OH)3.
3C2H5NH2 + 3H2O + FeCl3 ⟶ Fe(OH)3 + 3C2H5NH3Cl
Thí nghiệm 4: Ban đầu xuất hiện kết tủa màu xanh Cu(OH)2, sau đó kết tủa tan dần tạo phức chất màu xanh.
2C2H5NH2 + 2H2O + CuSO4 ⟶ Cu(OH)2 + (C2H5NH3)2SO4
Cu(OH)2 + 4C2H5NH2 ⟶ [Cu(C2H5NH2)4](OH)2
Phân tích các phát biểu:
❌ (a) Sai. Quỳ tím không cần ẩm vì ethylamine (CH3CH2NH2) là chất lỏng dễ bay hơi, hòa tan tốt trong nước, và có khả năng làm giấy quỳ tím chuyển màu ngay cả khi giấy khô.
✔️ (b) Đúng. Thí nghiệm này dựa trên phản ứng giữa hơi ethylamine và hơi HCl, tạo khói trắng CH3CH2NH3Cl. Nếu đưa đũa nhúng ethylamine đến gần miệng lọ HCl đặc thì vẫn xảy ra hiện tượng khói trắng tương tự.
❌ (c) Sai. Trong thí nghiệm 4, dung dịch CuSO4 phản ứng với ethylamine tạo phức chất tan màu xanh đậm, chứ không tạo kết tủa.
❌ (d) Sai. Các thí nghiệm chủ yếu chứng minh tính base của amine (phản ứng làm đổi màu quỳ tím, phản ứng với HCl, phản ứng tạo phức chất với Cu2+). Ethylamine không thể hiện tính acid trong các thí nghiệm này, vì nó không có khả năng nhường proton (H+).
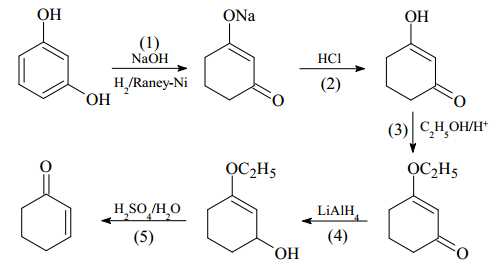
Câu 21 [704357]: Trong quy mô phòng thí nghiệm, cyclohex-2-en-1-one có thể được sản xuất qua các giai đoạn như sau:
Phổ hồng ngoại của chất X, một trong số các chất trên được cho như sau:
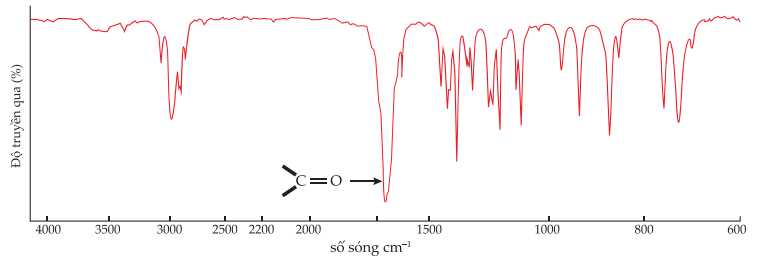

Phổ hồng ngoại của chất X, một trong số các chất trên được cho như sau:

Phân tích các phát biểu:
❌ a) Sai. Phản ứng khử trong giai đoạn (1) đã phá vỡ 2 liên kết π trong liên kết C=C để hình thành 1 liên kết π mới trong liên kết C=O.
❌ b) Sai. HCl được dùng với mục đích cung cấp ion H+ tạo môi trường để chuyển –ONa về –OH. Không thể thay acid HCl bằng muối NaCl do NaCl không cung cấp được H+.
✔️ c) Đúng. Tác nhân khử LiAlH4 chỉ khử liên kết π trong C=O, không khử liên kết π trong C=C do sau khi khử thấy liên kết C=O mất và hình thành liên kết O–H, còn liên kết C=C vẫn được giữa nguyên.
❌ d) Sai. Tín hiệu C=O trên phổ hồng ngoại có thể thuộc về 2 hợp chất khác ở giai đoạn (1) và giai đoạn (3) cũng có liên kết C=O nên nhận định thuộc về hợp chất cyclohex-2-en-1-one, sản phẩm của giai đoạn (5) là chưa đúng.
❌ a) Sai. Phản ứng khử trong giai đoạn (1) đã phá vỡ 2 liên kết π trong liên kết C=C để hình thành 1 liên kết π mới trong liên kết C=O.
❌ b) Sai. HCl được dùng với mục đích cung cấp ion H+ tạo môi trường để chuyển –ONa về –OH. Không thể thay acid HCl bằng muối NaCl do NaCl không cung cấp được H+.
✔️ c) Đúng. Tác nhân khử LiAlH4 chỉ khử liên kết π trong C=O, không khử liên kết π trong C=C do sau khi khử thấy liên kết C=O mất và hình thành liên kết O–H, còn liên kết C=C vẫn được giữa nguyên.
❌ d) Sai. Tín hiệu C=O trên phổ hồng ngoại có thể thuộc về 2 hợp chất khác ở giai đoạn (1) và giai đoạn (3) cũng có liên kết C=O nên nhận định thuộc về hợp chất cyclohex-2-en-1-one, sản phẩm của giai đoạn (5) là chưa đúng.
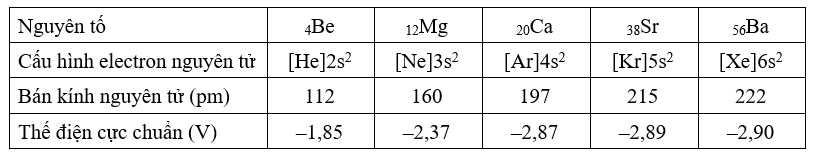
Câu 22 [704358]: Bảng dưới đây trình bày một số đặc điểm của kim loại nhóm IIA.

Phân tích các phát biểu:
✔️ a. Đúng. Các nguyên tố nhóm IIA thuộc vào nguyên tố s do có electron cuối dùng điền vào phân lớp s, có cấu hình ns2.
❌ b. Sai. Các nguyên tố nhóm IIA có cấu hình electron kết thúc ở ns2, tức là có 2 electron ở lớp vỏ ngoài cùng điền đủ vào một ô orbital nên không có electron độc thân.
✔️ c. Đúng. Khi bán kính nguyên tử tăng, lực hút electron yếu hơn, các electron ở lớp ngoài cùng dễ bị tách ra hơn. Điều này làm cho khả năng nhường electron (tính kim loại) tăng dần từ Be đến Ba.
❌ d. Sai. Barium phản ứng mạnh mẽ hơn magnesium khi tiếp xúc với nước vì các electron ngoài cùng của Ba dễ dàng bị nhường hơn.
✔️ a. Đúng. Các nguyên tố nhóm IIA thuộc vào nguyên tố s do có electron cuối dùng điền vào phân lớp s, có cấu hình ns2.
❌ b. Sai. Các nguyên tố nhóm IIA có cấu hình electron kết thúc ở ns2, tức là có 2 electron ở lớp vỏ ngoài cùng điền đủ vào một ô orbital nên không có electron độc thân.
✔️ c. Đúng. Khi bán kính nguyên tử tăng, lực hút electron yếu hơn, các electron ở lớp ngoài cùng dễ bị tách ra hơn. Điều này làm cho khả năng nhường electron (tính kim loại) tăng dần từ Be đến Ba.
❌ d. Sai. Barium phản ứng mạnh mẽ hơn magnesium khi tiếp xúc với nước vì các electron ngoài cùng của Ba dễ dàng bị nhường hơn.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704359]: Một miếng kim loại bạc (Ag) nặng 194,3 gam được đặt vào một ống đong chia độ chứa 242,0 mL nước. Thể tích nước bây giờ là 260,5 mL. Từ những dữ liệu này, khối lượng riêng của của bạc là bao nhiêu (g/cm3)? (Làm tròn kết quả đến hàng phần mười)
Thể tích tăng lên chính là thể tích của miếng kim loại bạc (Ag)
VAg = 260,5 - 242,0 = 18,5 mL = 18,5 cm3
⇒ dAg =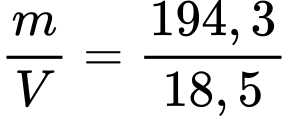 = 10,5 (g/cm3)
= 10,5 (g/cm3)
⇒ Điền đáp án: 10,5
VAg = 260,5 - 242,0 = 18,5 mL = 18,5 cm3
⇒ dAg =
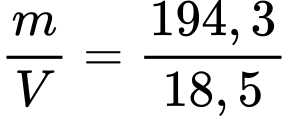 = 10,5 (g/cm3)
= 10,5 (g/cm3)⇒ Điền đáp án: 10,5
Câu 24 [704360]: Chất béo có thể được tạo thành khi kết hợp glycerol với các gốc acid béo khác nhau: có thể no, có thể không no. Cho chất béo X có công thức cấu tạo dưới đây:
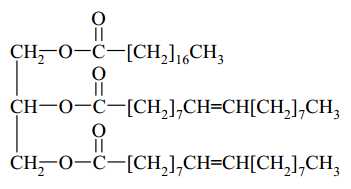
Tổng số liên kết π có trong cấu tạo phân tử X là bao nhiêu?
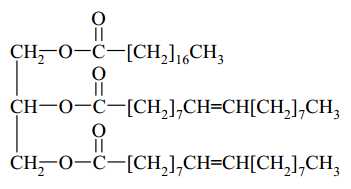
Tổng số liên kết π có trong cấu tạo phân tử X là bao nhiêu?
Mỗi liên kết đôi (=) được tạo thành từ 1 liên kết π và 1 liên kết σ.
Mỗi liên kết ba (≡) được tạo thành từ 2 liên kết π và 1 liên kết σ.
Quan sát phân tử chất béo X thấy có 3 liên kết đôi C=O và 2 liên kết đôi C=C, tổng có 5 liên kết đôi nên phân tử có 5 liên kết π.
Mỗi liên kết ba (≡) được tạo thành từ 2 liên kết π và 1 liên kết σ.
Quan sát phân tử chất béo X thấy có 3 liên kết đôi C=O và 2 liên kết đôi C=C, tổng có 5 liên kết đôi nên phân tử có 5 liên kết π.
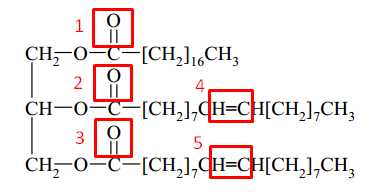
⇒ Điền đáp án: 5
Câu 25 [704361]: Thủy phân hoàn toàn 1 mol peptide X có cấu tạo Gly-Ala-Lys-Val trong môi trường NaOH thì đã có bao nhiêu mol NaOH phản ứng?
★ Khi thủy phân hoàn toàn peptide X (Gly-Ala-Lys-Val) trong môi trường NaOH, các liên kết peptide bị phá vỡ, đồng thời các nhóm chức cần được trung hòa:
+) Liên kết peptide: Peptide X có 4 amino acid được nối với nhau bởi 3 liên kết peptide. Mỗi liên kết peptide cần 1 mol NaOH để bị thủy phân nên cần 3 mol NaOH cho 3 liên kết peptide
+) Nhóm chức acid amin cần trung hòa: Lysine có nhóm NH2 ở mạch nhánh, nhóm này cũng cần 1 mol NaOH để trung hòa.
★ Phương trình hoá học xảy ra như sau:
Gly-Ala-Lys-Val + 4NaOH ⟶ Gly-Na + Ala-Na + Lys-Na + Val-Na + H2O
⟶ Thủy phân 1 mol peptide Gly-Ala-Lys-Val cần 4 mol NaOH.
⇒ Điền đáp án: 4
+) Liên kết peptide: Peptide X có 4 amino acid được nối với nhau bởi 3 liên kết peptide. Mỗi liên kết peptide cần 1 mol NaOH để bị thủy phân nên cần 3 mol NaOH cho 3 liên kết peptide
+) Nhóm chức acid amin cần trung hòa: Lysine có nhóm NH2 ở mạch nhánh, nhóm này cũng cần 1 mol NaOH để trung hòa.
★ Phương trình hoá học xảy ra như sau:
Gly-Ala-Lys-Val + 4NaOH ⟶ Gly-Na + Ala-Na + Lys-Na + Val-Na + H2O
⟶ Thủy phân 1 mol peptide Gly-Ala-Lys-Val cần 4 mol NaOH.
⇒ Điền đáp án: 4
Câu 26 [704362]: Trong một nhà máy sản xuất ammonia theo quy trình Haber, giai đoạn sản xuất khí hydrogen bằng phản ứng của methane và nước được thực hiện theo phương trình hóa học (1) như sau:
(1) CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
Phản ứng (1) là phản ứng thu nhiệt mạnh. Lượng nhiệt này được cung cấp từ quá trình đốt cháy hoàn toàn khí methane theo phương trình hóa học (2):
(2) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
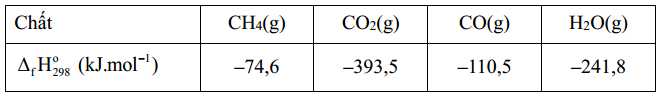
Xét các phản ứng ở điều kiện chuẩn và hiệu suất chuyển hóa của methane là 100 %. Tính khối lượng khí methane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 0,30 tấn H2(g) trong giai đoạn trên. Biết 90 % lượng nhiệt tỏa ra từ phản ứng (2) được cung cấp cho phản ứng (1) và các giá trị nhiệt tạo thành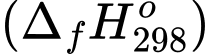 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau:
(1) CH4(g) + H2O(g)
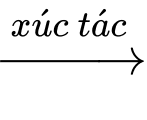 CO(g) + 3H2(g)
CO(g) + 3H2(g)Phản ứng (1) là phản ứng thu nhiệt mạnh. Lượng nhiệt này được cung cấp từ quá trình đốt cháy hoàn toàn khí methane theo phương trình hóa học (2):
(2) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Xét các phản ứng ở điều kiện chuẩn và hiệu suất chuyển hóa của methane là 100 %. Tính khối lượng khí methane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 0,30 tấn H2(g) trong giai đoạn trên. Biết 90 % lượng nhiệt tỏa ra từ phản ứng (2) được cung cấp cho phản ứng (1) và các giá trị nhiệt tạo thành
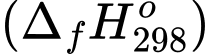 của các chất ở điều kiện chuẩn được cho trong bảng sau:
của các chất ở điều kiện chuẩn được cho trong bảng sau:
(1) 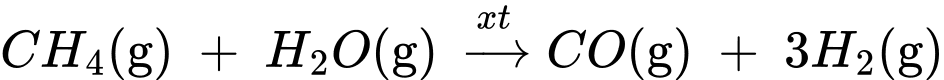
(2)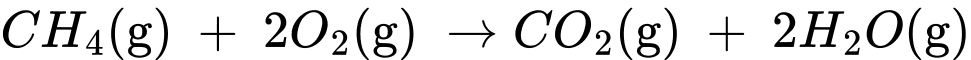
+) Biến thiên enthalpy của phản ứng (1) là:
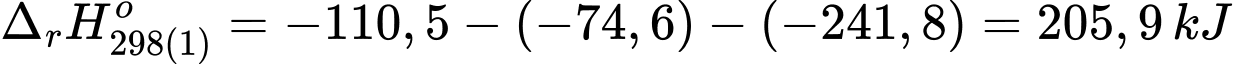
+) Biến thiên enthalpy của phản ứng (2) là:
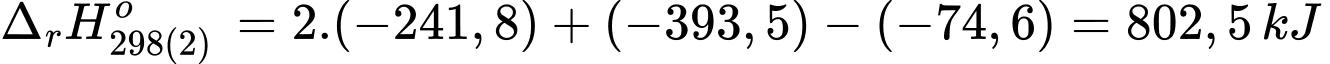
Đổi 0,3 tấn = 0,3.106 gam
+) Số mol của H2 là: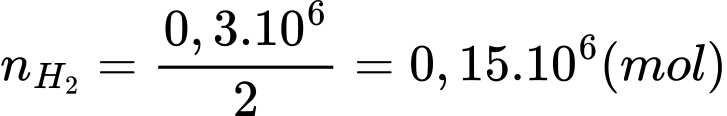
+)Lượng nhiệt thu vào của phản ứng (1) khi điều chế 0,3 tấn hydrogen là:
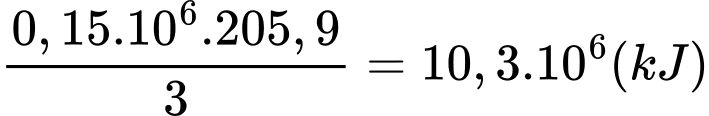
+) Lượng nhiệt toả ra của phản ứng (2) là:
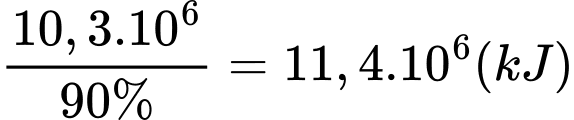
+) Số mol khí methane phản ứng (2) là:
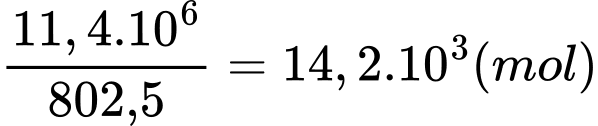
+) Khối lượng khí methane ở phản ứng (1) và (2) là:
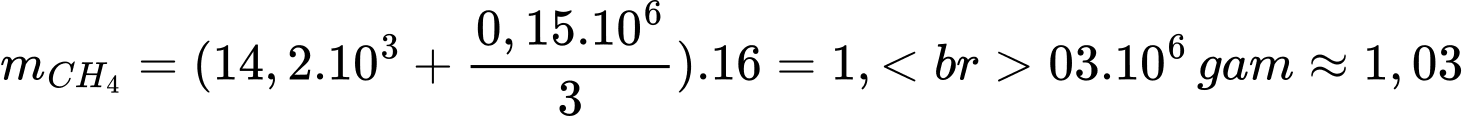 (tấn)
(tấn)
⇒ Điền đáp án: 1,03
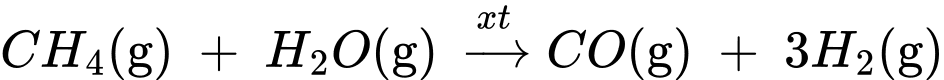
(2)
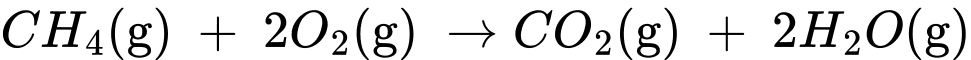
+) Biến thiên enthalpy của phản ứng (1) là:
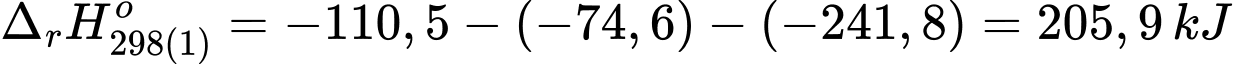
+) Biến thiên enthalpy của phản ứng (2) là:
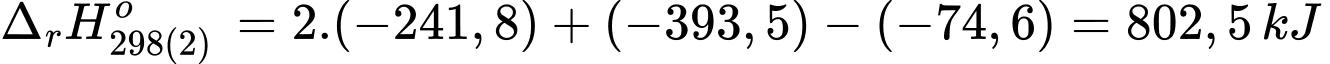
Đổi 0,3 tấn = 0,3.106 gam
+) Số mol của H2 là:
+)Lượng nhiệt thu vào của phản ứng (1) khi điều chế 0,3 tấn hydrogen là:
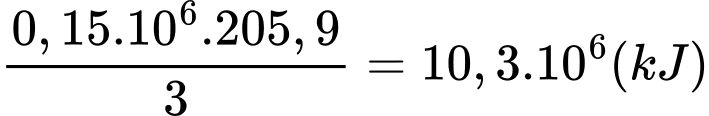
+) Lượng nhiệt toả ra của phản ứng (2) là:
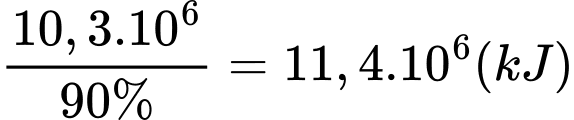
+) Số mol khí methane phản ứng (2) là:
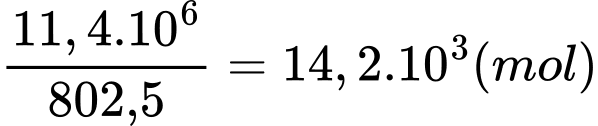
+) Khối lượng khí methane ở phản ứng (1) và (2) là:
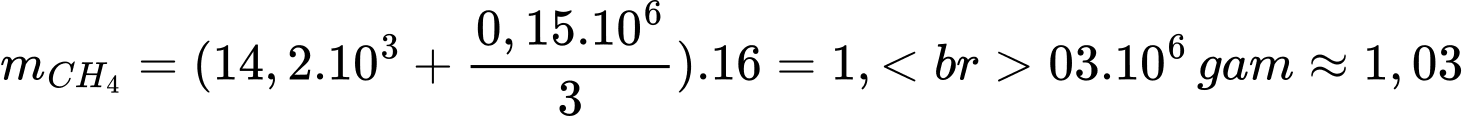 (tấn)
(tấn)⇒ Điền đáp án: 1,03
Câu 27 [704363]: Trong phòng thí nghiệm, để xác định nồng độ của một dung dịch KMnO4 được pha sẵn, người ta sử dụng phương pháp chuẩn độ oxi hóa – khử với chất chuẩn là H2C2O4 0,1 M. Phản ứng chuẩn độ diễn ra theo sơ đồ sau:
H2C2O4 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O (1)
Quy trình tiến hành chuẩn độ: Dùng pipette lấy 10,0 mL dung dịch H2C2O4 0,1 M cho vào bình tam giác, thêm khoảng 10,0 mL dung dịch H2SO4 2M, đun nóng trên bếp điện đến 70 – 80°C (không đun sôi). Cho đầy dung dịch KMnO4 cần xác định nồng độ (được pha sẵn) vào burete và điều chỉnh đến vạch số 0. Nhỏ từng giọt dung dịch KMnO4 cần xác định ở trên vào bình tam giác đựng dung dịch H2C2O4 đã acid hóa, lắc đều dung dịch tới khi có màu hồng nhạt bền khoảng 20 giây. Đọc và ghi lại thể tích KMnO4 trên burette như sau:
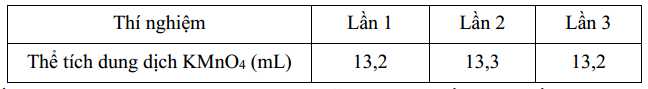
Tính nồng độ của dung dịch KMnO4 được pha sẵn (làm tròn đến hàng phần trăm).
H2C2O4 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O (1)
Quy trình tiến hành chuẩn độ: Dùng pipette lấy 10,0 mL dung dịch H2C2O4 0,1 M cho vào bình tam giác, thêm khoảng 10,0 mL dung dịch H2SO4 2M, đun nóng trên bếp điện đến 70 – 80°C (không đun sôi). Cho đầy dung dịch KMnO4 cần xác định nồng độ (được pha sẵn) vào burete và điều chỉnh đến vạch số 0. Nhỏ từng giọt dung dịch KMnO4 cần xác định ở trên vào bình tam giác đựng dung dịch H2C2O4 đã acid hóa, lắc đều dung dịch tới khi có màu hồng nhạt bền khoảng 20 giây. Đọc và ghi lại thể tích KMnO4 trên burette như sau:

Tính nồng độ của dung dịch KMnO4 được pha sẵn (làm tròn đến hàng phần trăm).
3H2SO4 + 5H2C2O4 + 2KMnO4 ⟶ 2MnSO4 + K2SO4 + 10CO2 + 8H2O
Thể tích trung bình của KMnO4 là:
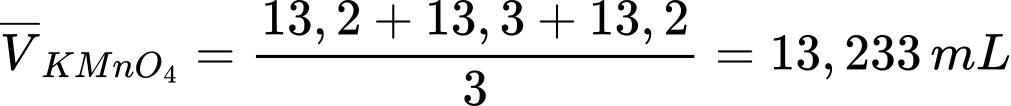
Đổi 13,233 mL = 0,013233 L; 10 mL = 0,01 L
Số mol của H2C2O4 là:
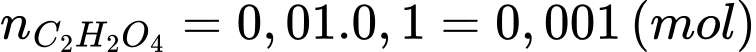
Từ phương trình hóa học số mol của KMnO4 là:
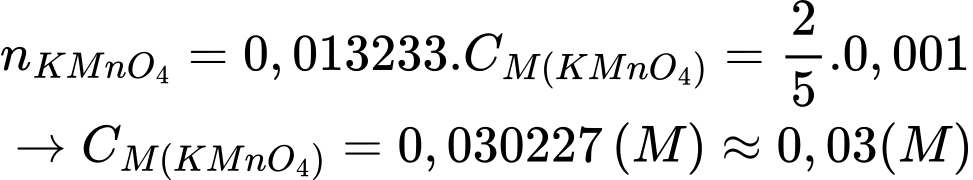
⇒ Điền đáp án: 0,03
Thể tích trung bình của KMnO4 là:
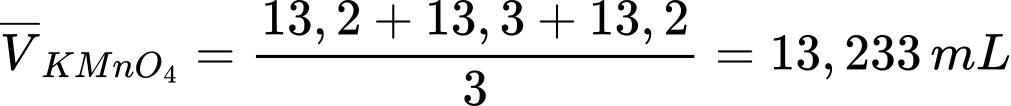
Đổi 13,233 mL = 0,013233 L; 10 mL = 0,01 L
Số mol của H2C2O4 là:
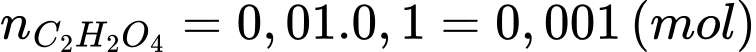
Từ phương trình hóa học số mol của KMnO4 là:
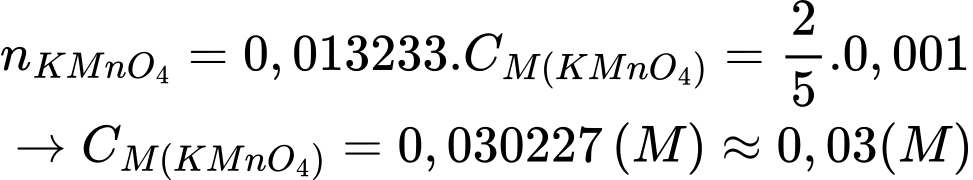
⇒ Điền đáp án: 0,03
Câu 28 [704364]: Sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch có thể được kiểm tra theo các bước trong quy trình như sau:
(1) Chuẩn bị hai ống nghiệm: Một ống nghiệm chứa khoảng 1 mL dung dịch CuSO4, ống nghiệm còn lại chứa khoảng 1 mL dung dịch FeCl3.
(2) Cho NH3 từ từ vào ống nghiệm chứa kết tủa, quan sát.
(3) Lọc lấy kết tủa cho vào hai ống nghiệm khác nhau.
(4) Cho khoảng 4 – 6 giọt dung dịch NaOH vào các ống nghiệm chứa muối.
Hãy sắp xếp số thứ tự các bước theo trình tự dãy bốn số để xác định sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch (ví dụ: 1234, 4321, ...).
(1) Chuẩn bị hai ống nghiệm: Một ống nghiệm chứa khoảng 1 mL dung dịch CuSO4, ống nghiệm còn lại chứa khoảng 1 mL dung dịch FeCl3.
(2) Cho NH3 từ từ vào ống nghiệm chứa kết tủa, quan sát.
(3) Lọc lấy kết tủa cho vào hai ống nghiệm khác nhau.
(4) Cho khoảng 4 – 6 giọt dung dịch NaOH vào các ống nghiệm chứa muối.
Hãy sắp xếp số thứ tự các bước theo trình tự dãy bốn số để xác định sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch (ví dụ: 1234, 4321, ...).
Các bước kiểm tra sự có mặt của Cu2+ và Fe3+ trong dung dịch có thể được kiểm tra theo các bước:
Bước 1: Chuẩn bị hai ống nghiệm: Một ống nghiệm chứa khoảng 1 mL dung dịch CuSO4, ống nghiệm còn lại chứa khoảng 1 mL dung dịch FeCl3 → Ứng với (1)
Bước 2: Cho khoảng 4-6 giọt dung dịch NaOH vào các ống nghiệm chứa muối → Ứng với (4)
Fe3+ + 3OH– ⟶ Fe(OH)3 (nâu đỏ)
Cu2+ + 2OH– ⟶ Cu(OH)2 (xanh)
Bước 3: Lọc lấy kết tủa cho vào hai ống nghiệm khác nhau → Ứng với (3)
Bước 4: Cho từ từ dung dịch NH3 vào ống nghiệm chứa kết tủa, quan sát → Ứng với (2)
Kết tủa Cu(OH)2 bị hòa tan trong dung dịch NH3 tạo phức màu xanh lam
Cu(OH)2 + 4NH3 ⟶[Cu(NH3)4](OH)2
⇒ Điền đáp án: 1432
Bước 1: Chuẩn bị hai ống nghiệm: Một ống nghiệm chứa khoảng 1 mL dung dịch CuSO4, ống nghiệm còn lại chứa khoảng 1 mL dung dịch FeCl3 → Ứng với (1)
Bước 2: Cho khoảng 4-6 giọt dung dịch NaOH vào các ống nghiệm chứa muối → Ứng với (4)
Fe3+ + 3OH– ⟶ Fe(OH)3 (nâu đỏ)
Cu2+ + 2OH– ⟶ Cu(OH)2 (xanh)
Bước 3: Lọc lấy kết tủa cho vào hai ống nghiệm khác nhau → Ứng với (3)
Bước 4: Cho từ từ dung dịch NH3 vào ống nghiệm chứa kết tủa, quan sát → Ứng với (2)
Kết tủa Cu(OH)2 bị hòa tan trong dung dịch NH3 tạo phức màu xanh lam
Cu(OH)2 + 4NH3 ⟶[Cu(NH3)4](OH)2
⇒ Điền đáp án: 1432