PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704365]: Do có …(1)… vừa phải và dẫn điện tốt nên đồng được sử dụng làm …(2)… trong các thiết bị và mạng lưới điện gia dụng. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, độ bền, dây dẫn.
B, độ cứng, dây dẫn.
C, tính dẻo, điện trở.
D, tính đàn hồi, dây truyền.
Do có độ cứng vừa phải và dẫn điện tốt nên đồng được sử dụng làm dây dẫn trong các thiết bị và mạng lưới điện gia dụng.
Giải thích:
- Đồng có độ dẫn điện rất cao, chỉ đứng sau bạc. Điều này giúp giảm tổn thất năng lượng khi truyền tải điện.
- Đồng không quá cứng nhưng cũng không quá mềm, vừa đủ để giữ được hình dạng ổn định trong quá trình sử dụng mà vẫn có thể dễ dàng chế tạo, uốn nắn.
⇒ Chọn đáp án B Đáp án: B
Giải thích:
- Đồng có độ dẫn điện rất cao, chỉ đứng sau bạc. Điều này giúp giảm tổn thất năng lượng khi truyền tải điện.
- Đồng không quá cứng nhưng cũng không quá mềm, vừa đủ để giữ được hình dạng ổn định trong quá trình sử dụng mà vẫn có thể dễ dàng chế tạo, uốn nắn.
⇒ Chọn đáp án B Đáp án: B
Câu 2 [560807]: Nước muối sinh lí là dung dịch nồng độ 0,9% của muối X, có tác dụng diệt khuẩn và sát trùng. Muối X là
A, NaCl.
B, NaClO.
C, Na2SO4.
D, NaNO3.
- NaClO có tính oxy hóa mạnh có thể gây hại cho các tế bào và mô sống nếu tiếp xúc lâu dài.
- Na2SO4 có thể gây mất cân bằng điện giải hoặc kích ứng trong cơ thể khi sử dụng. Nó không có tính chất diệt khuẩn và không phù hợp để duy trì sự ổn định của môi trường sinh lý.
- NaNO3 là một muối nitrat, và muối nitrat có thể tham gia vào các phản ứng tạo ra các hợp chất có thể gây độc hại nếu có mặt trong cơ thể với nồng độ cao.
⟹ NaCl là muối duy nhất trong các lựa chọn này có tính chất tương thích với cơ thể người, giúp duy trì sự cân bằng điện giải (nồng độ ion Na⁺ và Cl⁻ trong cơ thể) và không gây tác dụng phụ.
⟹ Chọn đáp án A Đáp án: A
- Na2SO4 có thể gây mất cân bằng điện giải hoặc kích ứng trong cơ thể khi sử dụng. Nó không có tính chất diệt khuẩn và không phù hợp để duy trì sự ổn định của môi trường sinh lý.
- NaNO3 là một muối nitrat, và muối nitrat có thể tham gia vào các phản ứng tạo ra các hợp chất có thể gây độc hại nếu có mặt trong cơ thể với nồng độ cao.
⟹ NaCl là muối duy nhất trong các lựa chọn này có tính chất tương thích với cơ thể người, giúp duy trì sự cân bằng điện giải (nồng độ ion Na⁺ và Cl⁻ trong cơ thể) và không gây tác dụng phụ.
⟹ Chọn đáp án A Đáp án: A
Câu 3 [704366]: Polymer dùng chế tạo thuỷ tinh hữu cơ được điều chế từ monomer nào sau đây?
A, Methyl acrylate.
B, Methyl methacrylate.
C, Methacrylic acid.
D, Vinyl acetate.
- Thủy tinh hữu cơ (PMMA) có tính trong suốt, nhẹ, bền và dễ gia công, được sử dụng rộng rãi trong các ứng dụng như kính bảo hộ, cửa sổ máy bay, biển hiệu, và các sản phẩm quang học.
- Phản ứng điều chế là quá trình trùng hợp methyl methacrylate thành PMMA:
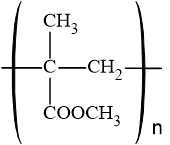
⇒ Chọn đáp án B Đáp án: B
- Phản ứng điều chế là quá trình trùng hợp methyl methacrylate thành PMMA:

⇒ Chọn đáp án B Đáp án: B
Câu 4 [560684]: Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là
A, Khử ion kim loại trong hợp chất thành nguyên tử.
B, Oxi hoá ion kim loại trong hợp chất thành nguyên tử.
C, Hoà tan các khoáng vật có trong quặng để thu được kim loại.
D, Dựa trên tính chất của kim loại như từ tính, khối lượng riêng lớn để tách chúng ra khỏi quặng.
Trong hợp chất, nguyên tố kim loại tồn tại dạng cation kim loại (Mn+) nên nguyên tắc chung để tách được nguyên tố kim loại ra khỏi hợp chất cần thực hiện phản ứng khử cation kim loại thành nguyên tử.
Đáp án: A
Mn+ + ne ⟶ M
⇒ Chọn đáp án A
Câu 5 [704367]: Nguyên tố nào sau đây nằm trong chu kì 4 nhưng không thuộc những nguyên tố chuyển tiếp dãy thứ nhất?
A, đồng (copper).
B, sắt (iron).
C, potassium.
D, nickel.
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 (Sc) đến 29 (Cu), thuộc chu kì 4.
Potassium (K; Z = 19) thuộc nhóm IA, không phải kim loại chuyển tiếp.
⇒ Chọn đáp án C
Đáp án: C
Potassium (K; Z = 19) thuộc nhóm IA, không phải kim loại chuyển tiếp.
⇒ Chọn đáp án C
Đáp án: C
Câu 6 [57709]: Khi đốt nóng, kim loại nào sau đây không tác dụng với khí O2?
A, Mg.
B, Cu.
C, Au.
D, Fe.
"Lửa thử vàng - gian nan thử sức".
Vàng (Au) có tính khử rất yếu, không bị oxi hóa trong không khí dù ở nhiệt độ nào.
⇒ Chọn đáp án C Đáp án: C
Vàng (Au) có tính khử rất yếu, không bị oxi hóa trong không khí dù ở nhiệt độ nào.
⇒ Chọn đáp án C Đáp án: C
Câu 7 [704368]: Than tổ ong hiện vẫn được một số nơi sử dụng để đun nấu. Một viên than tổ ong nặng 1200 gam có chứa 40% carbon về khối lượng. Khi đốt, than tổ ong xảy ra các phản ứng hóa học giữa carbon và oxygen trong không khí, có thể sinh ra các hạt bụi mịn và khí nhà kính CO2, góp phần vào hiện tượng ô nhiễm môi trường và biến đổi khí hậu. Cho các phát biểu sau:
(a) Nhiên liệu hóa thạch được khuyến cáo hạn chế sử dụng vì khi đốt sẽ sinh ra một số khí gây hại cho sức khỏe con người và môi trường.
(b) Phản ứng giữa carbon với oxygen trong than tổ ong chỉ tạo carbon dioxide.
(c) Khí CO sinh ra từ quá trình than tổ ong cháy có mùi đặc trưng nên dễ dàng phát hiện.
(d) Đun bếp than tổ ong trong phòng ngủ để sưởi ấm có thể gây hôn mê, bại não.
Các phát biểu đúng là
(a) Nhiên liệu hóa thạch được khuyến cáo hạn chế sử dụng vì khi đốt sẽ sinh ra một số khí gây hại cho sức khỏe con người và môi trường.
(b) Phản ứng giữa carbon với oxygen trong than tổ ong chỉ tạo carbon dioxide.
(c) Khí CO sinh ra từ quá trình than tổ ong cháy có mùi đặc trưng nên dễ dàng phát hiện.
(d) Đun bếp than tổ ong trong phòng ngủ để sưởi ấm có thể gây hôn mê, bại não.
Các phát biểu đúng là
A, (a), (d).
B, (c), (d).
C, (b), (c), (d).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Nhiên liệu hóa thạch như than tổ ong, dầu mỏ, khí đốt khi đốt cháy sẽ sinh ra các khí như CO2 (gây hiệu ứng nhà kính), CO (gây ngộ độc), SO2, NOx (gây mưa acid) và bụi mịn, đều có hại cho sức khỏe và môi trường.
❌ (b) Sai. Phản ứng giữa carbon và oxygen không chỉ tạo ra CO2 mà còn có thể tạo CO trong điều kiện thiếu oxygen (cháy không hoàn toàn):
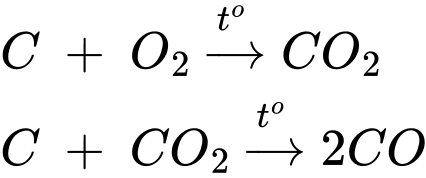
❌ (c) Sai. Khí CO là khí không màu, không mùi, rất khó phát hiện bằng giác quan. Điều này khiến nó nguy hiểm vì có thể gây ngộ độc mà không thể nhận ra.
✔️ (d) Đúng. Khi đốt than tổ ong trong không gian kín (như phòng ngủ), CO sinh ra từ quá trình cháy không hoàn toàn có thể gây ngộ độc. Ở nồng độ cao, CO có thể gây hôn mê, tổn thương não, hoặc thậm chí tử vong.
Các phát biểu đúng là (a) (d)
⇒ Chọn đáp án A Đáp án: A
✔️ (a) Đúng. Nhiên liệu hóa thạch như than tổ ong, dầu mỏ, khí đốt khi đốt cháy sẽ sinh ra các khí như CO2 (gây hiệu ứng nhà kính), CO (gây ngộ độc), SO2, NOx (gây mưa acid) và bụi mịn, đều có hại cho sức khỏe và môi trường.
❌ (b) Sai. Phản ứng giữa carbon và oxygen không chỉ tạo ra CO2 mà còn có thể tạo CO trong điều kiện thiếu oxygen (cháy không hoàn toàn):
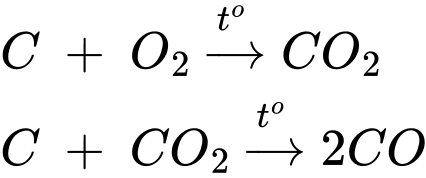
❌ (c) Sai. Khí CO là khí không màu, không mùi, rất khó phát hiện bằng giác quan. Điều này khiến nó nguy hiểm vì có thể gây ngộ độc mà không thể nhận ra.
✔️ (d) Đúng. Khi đốt than tổ ong trong không gian kín (như phòng ngủ), CO sinh ra từ quá trình cháy không hoàn toàn có thể gây ngộ độc. Ở nồng độ cao, CO có thể gây hôn mê, tổn thương não, hoặc thậm chí tử vong.
Các phát biểu đúng là (a) (d)
⇒ Chọn đáp án A Đáp án: A
Câu 8 [704369]: Ứng dụng quan trọng nhất của sulfuric acid trong công nghiệp là
A, sản xuất phân bón.
B, luyện kim.
C, sản xuất sơn, phẩm màu.
D, chế hoá dầu mỏ.
Trong công nghiệp, sulfuric acid (H2SO4) được sử dụng rộng rãi nhất để sản xuất phân bón, đặc biệt là phân superphosphate (Ca(H2PO4)2) và ammonium sulfate ((NH4)2SO4).
⟶ Đây là ứng dụng chiếm tỷ lệ lớn nhất trong tổng lượng tiêu thụ H2SO4 trên toàn cầu do nhu cầu cao từ ngành nông nghiệp.
Ngoài ra, sulfuric acid còn một số ứng dụng khác như:
+) Luyện kim (B): H2SO4 được dùng để loại bỏ oxide kim loại (tẩy gỉ).
+) Sản xuất sơn, phẩm màu (C): H2SO4 tham gia trong quá trình tổng hợp nhiều hợp chất hữu cơ.
+) Chế hóa dầu mỏ (D): Dùng trong quá trình alkyl hóa để sản xuất nhiên liệu.
⇒ Chọn đáp án A Đáp án: A
⟶ Đây là ứng dụng chiếm tỷ lệ lớn nhất trong tổng lượng tiêu thụ H2SO4 trên toàn cầu do nhu cầu cao từ ngành nông nghiệp.
Ngoài ra, sulfuric acid còn một số ứng dụng khác như:
+) Luyện kim (B): H2SO4 được dùng để loại bỏ oxide kim loại (tẩy gỉ).
+) Sản xuất sơn, phẩm màu (C): H2SO4 tham gia trong quá trình tổng hợp nhiều hợp chất hữu cơ.
+) Chế hóa dầu mỏ (D): Dùng trong quá trình alkyl hóa để sản xuất nhiên liệu.
⇒ Chọn đáp án A Đáp án: A
Câu 9 [704370]: Kết quả phân tích phổ khối lượng của phân tử chất X (một hợp chất đơn giản) có giá trị m/z của mảnh ion phân tử [M+] bằng 58. X không thể là chất nào sau đây?
A, CH2=CHCH2OH.
B, CH3CH2CHO.
C, HCOOCH3.
D, CH3COCH3.
Kết quả phân tích phổ khối lượng của phân tử chất X có giá trị m/z của mảnh ion phân tử [M+] bằng 58, phân tử khối của chất X là 58 gam/mol.
A. CH2=CHCH2OH; B. CH3CH2CHO và D. CH3COCH3 đều có phân tử khối là 58 gam/mol
C. HCOOCH3 có phân tử khối là 60 gam/mol.
⇒ Chọn đáp án C Đáp án: C
A. CH2=CHCH2OH; B. CH3CH2CHO và D. CH3COCH3 đều có phân tử khối là 58 gam/mol
C. HCOOCH3 có phân tử khối là 60 gam/mol.
⇒ Chọn đáp án C Đáp án: C
Câu 10 [305717]: Thủy phân triolein có công thức (C17H33COO)3C3H5 trong dung dịch NaOH, thu được glycerol và muối X. Công thức của X là
A, C17H35COONa.
B, CH3COONa.
C, C2H5COONa.
D, C17H33COONa.
Phản ứng tổng quát:
(RCOO)3C3H5 + 3NaOH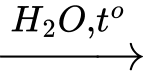 3RCOONa + C3H5(OH)3.
3RCOONa + C3H5(OH)3.
Ở câu hỏi này: (RCOO)3C3H5 = (C17H33COO)3C3H5
⇒ R = C17H33COO ⇒ Ngoài glycerol C3H5(OH)3 thì muối X tương ứng dạng RCOONa = C17H33COONa
⇒ Chọn đáp án D Đáp án: D
(RCOO)3C3H5 + 3NaOH
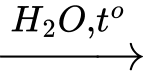 3RCOONa + C3H5(OH)3.
3RCOONa + C3H5(OH)3.Ở câu hỏi này: (RCOO)3C3H5 = (C17H33COO)3C3H5
⇒ R = C17H33COO ⇒ Ngoài glycerol C3H5(OH)3 thì muối X tương ứng dạng RCOONa = C17H33COONa
⇒ Chọn đáp án D Đáp án: D
Câu 11 [308262]: Tính khối lượng glucose trong máu của một bệnh nhân có lượng đường trong máu đo được là 190 mg/100 mL máu. Giả sử thể tích máu trong cơ thể là 5L.
A, 9,5 gam.
B, 50,0 gam.
C, 4,8 gam.
D, 34,2 gam.
HD: Lượng đường trong máu đo được là 190 mg/100 mL máu
Nghĩa là cứ 100 mL máu thì có 190 mg đường glucose.
⇒ 5 L máu ⇄ 5000 mL = 50 × 100 mL tương ứng có 50 × 190 mg đường glucose.
⇒ Tính ra 50 × 190 = 9500 mg ⇄ 9,5 gam glucose
⇝ Chọn đáp án A Đáp án: A
Nghĩa là cứ 100 mL máu thì có 190 mg đường glucose.
⇒ 5 L máu ⇄ 5000 mL = 50 × 100 mL tương ứng có 50 × 190 mg đường glucose.
⇒ Tính ra 50 × 190 = 9500 mg ⇄ 9,5 gam glucose
⇝ Chọn đáp án A Đáp án: A
Câu 12 [308473]: Nhận xét nào sau đây không đúng?
A, Vỏ bánh mì ngọt hơn ruột bánh.
B, Khi ăn cơm, nếu nhai kỹ sẽ thấy vị ngọt.
C, Nhỏ dung dịch iodine lên miếng chuối xanh xuất hiện màu xanh.
D, Cho hồ tinh bột vào muối iodine (muối dùng để chống bệnh bưới cổ) thì xuất hiện màu xanh.
Phân tích các phát biểu:
✔️ A. Đúng. Khi nướng bánh mì, lớp vỏ ngoài bị tác động bởi nhiệt độ cao hơn, xảy ra phản ứng, đường và tinh bột phân hủy thành các phân tử đường đơn, có vị ngọt hơn.
✔️ B. Đúng. Trong quá trình nhai, enzyme amylase trong nước bọt thủy phân tinh bột thành maltose (một loại đường đôi), khiến cơm có vị ngọt.
✔️ C. Đúng. Chuối xanh chứa nhiều tinh bột, khi gặp dung dịch iodine (I2), sẽ xuất hiện màu xanh đặc trưng của phức hợp tinh bột - iodine.
❌ D. Sai. Muối iodine dùng để chống bệnh bướu cổ không chứa iodine tự do (I2), mà thường chứa iodide (I–) hoặc iodate (IO3–). Những dạng này không tạo màu xanh với tinh bột.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. Khi nướng bánh mì, lớp vỏ ngoài bị tác động bởi nhiệt độ cao hơn, xảy ra phản ứng, đường và tinh bột phân hủy thành các phân tử đường đơn, có vị ngọt hơn.
✔️ B. Đúng. Trong quá trình nhai, enzyme amylase trong nước bọt thủy phân tinh bột thành maltose (một loại đường đôi), khiến cơm có vị ngọt.
✔️ C. Đúng. Chuối xanh chứa nhiều tinh bột, khi gặp dung dịch iodine (I2), sẽ xuất hiện màu xanh đặc trưng của phức hợp tinh bột - iodine.
❌ D. Sai. Muối iodine dùng để chống bệnh bướu cổ không chứa iodine tự do (I2), mà thường chứa iodide (I–) hoặc iodate (IO3–). Những dạng này không tạo màu xanh với tinh bột.
⇒ Chọn đáp án D Đáp án: D
Câu 13 [704371]: Cơ chế phản ứng của ethane với bromine, ánh sáng được cho dưới đây:
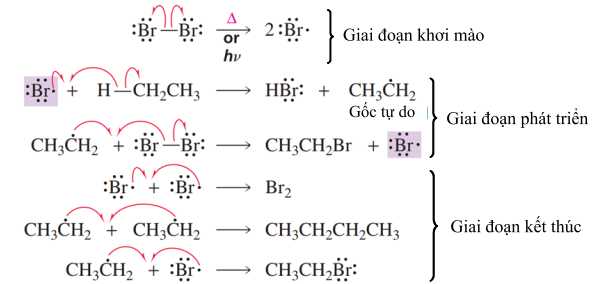
Biết rằng giai đoạn phát triển chiếm ưu thế hơn so với giai đoạn khơi mào và giai đoạn kết thúc.
Cho các phát biểu sau:
(a) Giai đoạn khơi mào, một phân tử Br2 tạo thành hai gốc tự do Br•.
(b) Trong giai đoạn phát triển mạch, số lượng gốc tự do CH3CH2• không đổi.
(c) Lượng sản phẩm CH3CH2Br sinh ra chủ yếu ở giai đoạn phát triển mạch.
(d) Hai gốc tự do kết hợp với nhau sẽ trở thành một gốc tự do.
Các phát biểu đúng là

Biết rằng giai đoạn phát triển chiếm ưu thế hơn so với giai đoạn khơi mào và giai đoạn kết thúc.
Cho các phát biểu sau:
(a) Giai đoạn khơi mào, một phân tử Br2 tạo thành hai gốc tự do Br•.
(b) Trong giai đoạn phát triển mạch, số lượng gốc tự do CH3CH2• không đổi.
(c) Lượng sản phẩm CH3CH2Br sinh ra chủ yếu ở giai đoạn phát triển mạch.
(d) Hai gốc tự do kết hợp với nhau sẽ trở thành một gốc tự do.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Trong giai đoạn khơi mào, phân tử bromine (Br2) dưới tác dụng của ánh sáng hoặc nhiệt phân cắt đồng hóa trị, tạo ra hai gốc tự do Br•.
✔️ (b) Đúng. Giai đoạn phát triển mạch là một chu trình, trong đó gốc tự do CH3CH2• liên tục được tái tạo sau khi phản ứng với Br2. Vì thế, số lượng gốc tự do CH3CH2• được duy trì ổn định.
✔️ (c) Đúng. Giai đoạn phát triển mạch là giai đoạn chiếm ưu thế, nơi các gốc tự do liên tục phản ứng với bromine và ethane, tạo ra sản phẩm chính là CH3CH2Br.
❌ (d) Sai. Khi hai gốc tự do kết hợp (ví dụ: Br• + Br• ⟶ Br2 hoặc CH3CH2• + Br• ⟶ CH3CH2Br), chúng tạo thành một chất mới, là phân tử trung hòa (không phải gốc tự do).
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án A Đáp án: A
✔️ (a) Đúng. Trong giai đoạn khơi mào, phân tử bromine (Br2) dưới tác dụng của ánh sáng hoặc nhiệt phân cắt đồng hóa trị, tạo ra hai gốc tự do Br•.
✔️ (b) Đúng. Giai đoạn phát triển mạch là một chu trình, trong đó gốc tự do CH3CH2• liên tục được tái tạo sau khi phản ứng với Br2. Vì thế, số lượng gốc tự do CH3CH2• được duy trì ổn định.
✔️ (c) Đúng. Giai đoạn phát triển mạch là giai đoạn chiếm ưu thế, nơi các gốc tự do liên tục phản ứng với bromine và ethane, tạo ra sản phẩm chính là CH3CH2Br.
❌ (d) Sai. Khi hai gốc tự do kết hợp (ví dụ: Br• + Br• ⟶ Br2 hoặc CH3CH2• + Br• ⟶ CH3CH2Br), chúng tạo thành một chất mới, là phân tử trung hòa (không phải gốc tự do).
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án A Đáp án: A
Câu 14 [304088]: Cấu tạo nào sau đây biểu diễn không phải là ester?
A, 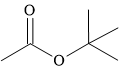

B, 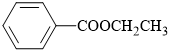
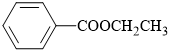
C, 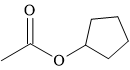

D, 

Phân tích nhóm chức trong cấu tạo các chất:
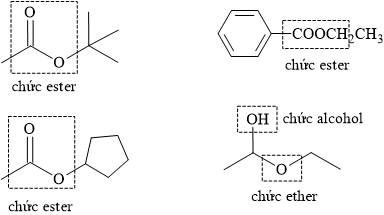
⇒ hợp chất D không chứa nhóm chức ester
⟹ Chọn đáp án D Đáp án: D

⇒ hợp chất D không chứa nhóm chức ester
⟹ Chọn đáp án D Đáp án: D
Câu 15 [704372]: “Tương tự như carboxylic acid, amino acid có thể tác dụng với ...(1)... khi có mặt xúc tác ...(2)... để tạo thành ester”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, alcohol, base mạnh.
B, amine, acid mạnh.
C, alcohol, acid mạnh.
D, aldehyde, base mạnh.
Tương tự như carboxylic acid, amino acid có thể tác dụng với alcohol khi có mặt xúc tác acid mạnh để tạo thành ester.
Giải thích:
- Amino acid có cấu trúc chung là NH2–R–COOH, trong đó nhóm –COOH là nhóm carboxyl có khả năng phản ứng với các alcohol.
- Phản ứng này thường xảy ra khi có mặt một xúc tác acid, như (sulfuric acid), vì acid này giúp làm tăng tính acid của nhóm carboxyl và tạo ra một môi trường thuận lợi để phản ứng ester hóa.
- Kết quả là ester hình thành, với một nhóm alkyl từ alcohol thay thế cho nhóm –OH của carboxyl trong amino acid.
⟶ Đây chính là phản ứng ester hóa.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
- Amino acid có cấu trúc chung là NH2–R–COOH, trong đó nhóm –COOH là nhóm carboxyl có khả năng phản ứng với các alcohol.
- Phản ứng này thường xảy ra khi có mặt một xúc tác acid, như (sulfuric acid), vì acid này giúp làm tăng tính acid của nhóm carboxyl và tạo ra một môi trường thuận lợi để phản ứng ester hóa.
- Kết quả là ester hình thành, với một nhóm alkyl từ alcohol thay thế cho nhóm –OH của carboxyl trong amino acid.
⟶ Đây chính là phản ứng ester hóa.
⇒ Chọn đáp án C Đáp án: C
Câu 16 [704373]: Dung dịch X gồm alanine (Ala), glutamic acid (Glu) và dipeptide Glu-Ala trong môi trường có pH ~ 7. Thấm dung dịch X lên một tờ giấy, rồi nối tờ giấy với hai điện cực của nguồn điện một chiều thu được kết quả như sau:
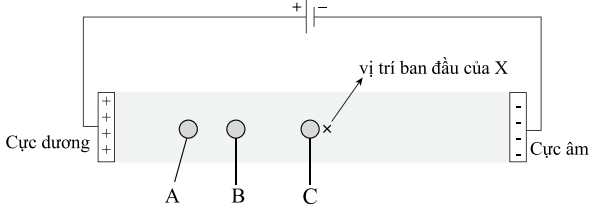
Cho các nhận định sau, nhận định nào không đúng?

Cho các nhận định sau, nhận định nào không đúng?
A, Chất C gần như không di chuyển do ở pH = 6,11, C tồn tại ở dạng trung hòa về điện.
B, Ion A di chuyển nhanh hơn ion B do khối lượng phân tử của ion A lớn hơn khối lượng phân tử của ion B.
C, Tổng điện tích trong ion của chất A, B có giá trị bằng nhau.
D, Ở môi trường pH = 12, chất A sẽ di chuyển về phía điện cực dương.
Tại pH = 6,11 dạng tồn tại của alaline, glutamic acid, dipeptide Glu-Ala như sau:
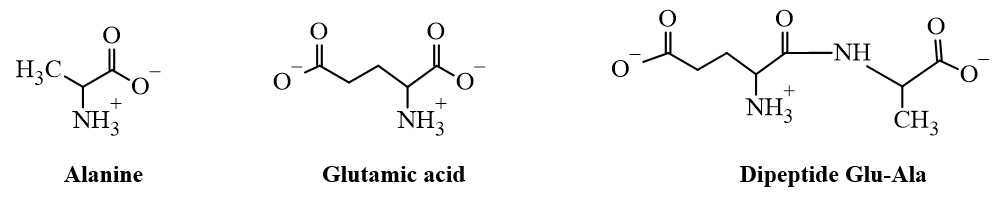
Phân tích các phát biểu:
✔️ A. Đúng. C là alanine do tại pH = 6,11 có tổng điện tích là 0 nên C gần như không di chuyển.
❌ B. Sai. A là glutamic acid sẽ di chuyển nhanh hơn về cực dương so với B là Glu-Ala do A có kích thước nhỏ hơn.
✔️ C. Đúng. A và B có cùng điện tích là glutamic acid và Glu-Ala có cùng tổng điện tích là –1.
✔️ D. Đúng. Tại pH = 12 dạng tồn tại của glutamic acid là –OOC[CH2]2C(NH2)COO–, tổng điện tích là –2 nên tại pH = 12 thì A sẽ di chuyển về phía cực dương.
⇒ Chọn đáp án B Đáp án: B

Phân tích các phát biểu:
✔️ A. Đúng. C là alanine do tại pH = 6,11 có tổng điện tích là 0 nên C gần như không di chuyển.
❌ B. Sai. A là glutamic acid sẽ di chuyển nhanh hơn về cực dương so với B là Glu-Ala do A có kích thước nhỏ hơn.
✔️ C. Đúng. A và B có cùng điện tích là glutamic acid và Glu-Ala có cùng tổng điện tích là –1.
✔️ D. Đúng. Tại pH = 12 dạng tồn tại của glutamic acid là –OOC[CH2]2C(NH2)COO–, tổng điện tích là –2 nên tại pH = 12 thì A sẽ di chuyển về phía cực dương.
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Magenisium nitrate (Mg(NO3)2) bị phân hủy khi đun nóng tạo khí NO2, O2. Một học sinh bố trí thí nghiệm để nghiệm chứng kết quả này như sau:
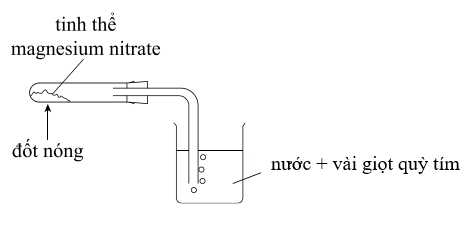

Câu 17 [704374]: Hiện tượng quan sát được ở ống nghiệm (1) và trong bình erlen (2) lần lượt là
A, (1) xuất hiện khí màu nâu; (2) có bong bóng khí và dung dịch chuyển màu đỏ.
B, (1) không có hiện tượng; (2) có bong bóng khí và dung dịch chuyển màu đỏ.
C, (1) không có hiện tượng; (2) có bong bóng khí và dung dịch không chuyển màu.
D, (1) xuất hiện khí màu nâu; (2) có bong bóng khí và dung dịch không chuyển màu.
Ống nghiệm (1) tinh thể Mg(NO3)2 bị phân hủy, có khí màu nâu đỏ thoát ra là NO2.
(1) 2Mg(NO3)2 –(to)⟶ 2MgO + 4NO2 + O2
Bình (2) có bong bóng khí tan trong nước làm dung dịch chuyển sang màu đỏ do sinh ra acid, làm đỏ quỳ tím.
(2) 4NO2 + O2 + 2H2O ⟶ 4HNO3
⇒ Chọn đáp án A Đáp án: A
(1) 2Mg(NO3)2 –(to)⟶ 2MgO + 4NO2 + O2
Bình (2) có bong bóng khí tan trong nước làm dung dịch chuyển sang màu đỏ do sinh ra acid, làm đỏ quỳ tím.
(2) 4NO2 + O2 + 2H2O ⟶ 4HNO3
⇒ Chọn đáp án A Đáp án: A
Câu 18 [704375]: Độ chênh lệch khối lượng chất rắn trong ống nghiệm trước và sau phản ứng xác định được là 0,54 gam. Lắc đều bình erlen cho các phản ứng xảy ra hoàn toàn. Theo tính toán lý thuyết thì giá trị hiển thị trên máy đo pH khi tiến hành đo là bao nhiêu? Biết thể tích dung dịch trong bình erlen sau phản ứng là 100 mL.
A, 1,0.
B, 1,5.
C, 0,8.
D, 2,0.
(1) 2Mg(NO3)2 –(to)⟶ 2MgO + 4NO2 + O2
(2) 4NO2 + O2 + 2H2O ⟶ 4HNO3
Gọi số mol của Mg(NO3)2 là x (mol)
⟶ Từ PTHH, số mol NO2 = số mol HNO3 = 2x (mol), số mol O2 = 0,5x (mol)
Khối lượng chất rắn chênh lệch trước và sau khi nung là khối lượng của NO2 và O2 thoát ra sau khi phân hủy Mg(NO3)2.
mNO2 + mO2 = 2x . 46 + 0,5x . 32 = 0,54 (g)
⟶ x = 0,005 (mol) ⟶ nHNO3 = 2x = 0,01 (mol)
Nồng độ mol của HNO3 là: CM = 0,01 ÷ 0,1 = 0,1 (M)
Giá trị pH của dung dịch đo được là:
pH = –lg[H+] = –lg(0,1) = 1,0
⇒ Chọn đáp án A Đáp án: A
(2) 4NO2 + O2 + 2H2O ⟶ 4HNO3
Gọi số mol của Mg(NO3)2 là x (mol)
⟶ Từ PTHH, số mol NO2 = số mol HNO3 = 2x (mol), số mol O2 = 0,5x (mol)
Khối lượng chất rắn chênh lệch trước và sau khi nung là khối lượng của NO2 và O2 thoát ra sau khi phân hủy Mg(NO3)2.
mNO2 + mO2 = 2x . 46 + 0,5x . 32 = 0,54 (g)
⟶ x = 0,005 (mol) ⟶ nHNO3 = 2x = 0,01 (mol)
Nồng độ mol của HNO3 là: CM = 0,01 ÷ 0,1 = 0,1 (M)
Giá trị pH của dung dịch đo được là:
pH = –lg[H+] = –lg(0,1) = 1,0
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704376]: Bốn hợp chất diethyl ether, ethanol, acetic acid, acetone được đựng trong các lọ khác nhau và được dán nhãn để phân biệt:

Tiến hành đo phổ hồng ngoại của lọ có nhãn (1) của một trong bốn chất. Kết quả phổ hồng ngoại được cho như dưới đây:
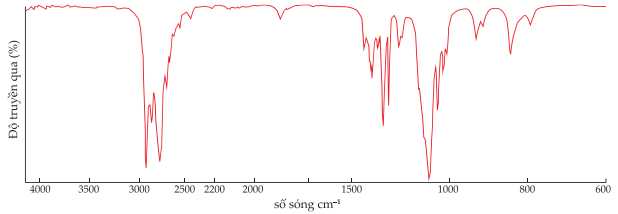

Tiến hành đo phổ hồng ngoại của lọ có nhãn (1) của một trong bốn chất. Kết quả phổ hồng ngoại được cho như dưới đây:

+) C2H5OH có tín hiệu đặc trung cho nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1.
+) CH3COOH có tín hiệu đặc trung cho nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1 và nhóm C=O (carboxylic acid) có số sóng trong khoảng 1750 – 1680 cm-1.
+) CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
Trên phổ hồng ngoại không có tín hiệu tín hiệu đặc trưng cho các chất C2H5OH, CH3COOH, CH3COCH3.
→ Chất dán nhãn (1) là C2H5OC2H5.
Phân tích các phát biểu:
✔️ (a) Đúng. CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
✔️ (b) Đúng. Nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1 và nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1.
❌ (c) Sai. Kết quả phổ hồng ngoại của hợp chất trong lọ gắn nhãn (1) thuộc về hợp chất diethyl ether như đã phân tích.
✔️ (d) Đúng. Có thể sử dụng phổ hồng ngoại để phân biệt được bốn chất tương ứng trong các lọ gắn nhãn do ba chất đều có tín hiệu đặc trưng riêng còn ether không có.
+) CH3COOH có tín hiệu đặc trung cho nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1 và nhóm C=O (carboxylic acid) có số sóng trong khoảng 1750 – 1680 cm-1.
+) CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
Trên phổ hồng ngoại không có tín hiệu tín hiệu đặc trưng cho các chất C2H5OH, CH3COOH, CH3COCH3.
→ Chất dán nhãn (1) là C2H5OC2H5.
Phân tích các phát biểu:
✔️ (a) Đúng. CH3COCH3 có tín hiệu đặc trung cho nhóm C=O (ketone) có số sóng trong khoảng 1740 – 1670 cm-1.
✔️ (b) Đúng. Nhóm -OH (alocohol) có số sóng trong khoảng 3650 – 3200 cm-1 và nhóm -OH (carboxylic acid) có số sóng trong khoảng 3000 – 2500 cm-1.
❌ (c) Sai. Kết quả phổ hồng ngoại của hợp chất trong lọ gắn nhãn (1) thuộc về hợp chất diethyl ether như đã phân tích.
✔️ (d) Đúng. Có thể sử dụng phổ hồng ngoại để phân biệt được bốn chất tương ứng trong các lọ gắn nhãn do ba chất đều có tín hiệu đặc trưng riêng còn ether không có.
Câu 20 [704377]: Trong các dung dịch luôn hòa tan một lượng nhỏ khí oxygen hoặc khi để dung dịch ngoài không khí thì khí oxygen trong không khí có thể khuyếch tán vào trong dung dịch. Các kim loại ngâm trong các dung dịch có thể bị ăn mòn và để nghiên cứu hiện tượng thì tiến hành thí nghiệm như sau:
▪ Rót dung dịch NaCl vào 2 cốc thuỷ tinh. Ngâm một đinh sắt vào cốc (1). Ngâm một đinh sắt có quấn dây kẽm vào cốc (2).
▪ Quan sát hiện tượng xảy ra sau 5 ngày.
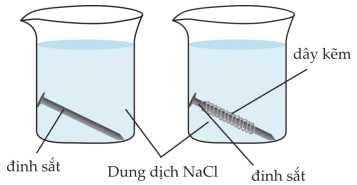
▪ Rót dung dịch NaCl vào 2 cốc thuỷ tinh. Ngâm một đinh sắt vào cốc (1). Ngâm một đinh sắt có quấn dây kẽm vào cốc (2).
▪ Quan sát hiện tượng xảy ra sau 5 ngày.

Cốc (1): Đinh sắt bị ăn mòn và chuyển sang màu vàng nâu của của FeCl3.
Do kim loại tác dụng với những chất mà nó tiếp xúc trong môi trường, trong nước muối có oxygen hòa tan.
2Fe + 3Cl2 ⟶ 2FeCl3
3Fe + 4H2O ⟶ Fe3O4 + 4H2
3Fe + 2O2 ⟶ Fe3O4
Cốc (2): Xảy ra ăn mòn điện hóa
Cathode cực dương là Fe: 2H2O + O2 + 4e ⟶ 4OH–
Anode cực âm là Zn: Zn ⟶ Zn2+ + 2e
Phân tích các phát biểu:
✔️ (a) Đúng. Trong cốc (1), đinh sắt bị ăn mòn bởi oxygen hòa tan và ion Cl– trong dung dịch NaCl, dẫn đến sự hình thành hợp chất FeCl3 có màu vàng nâu.
✔️ (b) Đúng. Ở cốc (2), dây kẽm quấn quanh đinh sắt hoạt động như một cực dương (anode), và kẽm bị oxi hóa thay vì sắt. Do đó, oxygen trong dung dịch sẽ phản ứng với kẽm trước, bảo vệ đinh sắt.
✔️ (c) Đúng. Dung dịch NaCl đóng vai trò như một chất điện li, tạo ra các ion trong dung dịch (Na+, Cl–), giúp quá trình ăn mòn điện hóa xảy ra dễ dàng hơn.
✔️ (d) Đúng. Thí nghiệm minh họa phương pháp bảo vệ điện hóa. Việc quấn dây kẽm quanh đinh sắt cho thấy kẽm bị ăn mòn thay vì sắt, đây là cách bảo vệ sắt thông qua một kim loại hoạt động hơn.
Do kim loại tác dụng với những chất mà nó tiếp xúc trong môi trường, trong nước muối có oxygen hòa tan.
2Fe + 3Cl2 ⟶ 2FeCl3
3Fe + 4H2O ⟶ Fe3O4 + 4H2
3Fe + 2O2 ⟶ Fe3O4
Cốc (2): Xảy ra ăn mòn điện hóa
Cathode cực dương là Fe: 2H2O + O2 + 4e ⟶ 4OH–
Anode cực âm là Zn: Zn ⟶ Zn2+ + 2e
Phân tích các phát biểu:
✔️ (a) Đúng. Trong cốc (1), đinh sắt bị ăn mòn bởi oxygen hòa tan và ion Cl– trong dung dịch NaCl, dẫn đến sự hình thành hợp chất FeCl3 có màu vàng nâu.
✔️ (b) Đúng. Ở cốc (2), dây kẽm quấn quanh đinh sắt hoạt động như một cực dương (anode), và kẽm bị oxi hóa thay vì sắt. Do đó, oxygen trong dung dịch sẽ phản ứng với kẽm trước, bảo vệ đinh sắt.
✔️ (c) Đúng. Dung dịch NaCl đóng vai trò như một chất điện li, tạo ra các ion trong dung dịch (Na+, Cl–), giúp quá trình ăn mòn điện hóa xảy ra dễ dàng hơn.
✔️ (d) Đúng. Thí nghiệm minh họa phương pháp bảo vệ điện hóa. Việc quấn dây kẽm quanh đinh sắt cho thấy kẽm bị ăn mòn thay vì sắt, đây là cách bảo vệ sắt thông qua một kim loại hoạt động hơn.
Câu 21 [704378]: Các kim loại nhóm IIA (trừ beryllium) phản ứng với nước tạo ra khí hydrogen và hydroxide kim loại. Mức độ của phản ứng này thường liên quan đến độ tan của hydroxide tạo thành: hydroxide có độ tan lớn hơn thì phản ứng của kim loại đó với nước thuận lợi hơn. Độ tan trong nước của các hydroxide nhóm IIA ở 20 °C cho trong bảng sau:
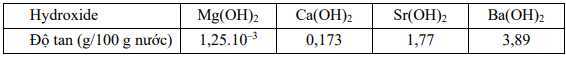

Phân tích các phát biểu:
❌ a. Sai. Phản ứng tổng quát với nước của kim loại nhóm IIA (trừ Be) là: M + 2H2O → M(OH)2 + H2.
Beryllium không phản ứng với nước, kể cả khi đun nóng.
✔️ b. Đúng. Dựa vào bảng độ tan trên, thấy độ tan của các hydroxide nhóm IIA tăng dần từ Mg(OH)2 đến Ba(OH)2.
❌ c. Sai. Mức độ của phản ứng với nước thường liên quan đến độ tan của hydroxide tạo thành: hydroxide
có độ tan lớn hơn thì phản ứng của kim loại đó với nước thuận lợi hơn nên bọt khí xuất hiện nhanh nhất trên bề mặt kim loại Ba.
❌ d. Sai. Có 3 kim loại (Ca, Sr, Ba) đều phản ứng nhanh với nước ở nhiệt độ thường.
❌ a. Sai. Phản ứng tổng quát với nước của kim loại nhóm IIA (trừ Be) là: M + 2H2O → M(OH)2 + H2.
Beryllium không phản ứng với nước, kể cả khi đun nóng.
✔️ b. Đúng. Dựa vào bảng độ tan trên, thấy độ tan của các hydroxide nhóm IIA tăng dần từ Mg(OH)2 đến Ba(OH)2.
❌ c. Sai. Mức độ của phản ứng với nước thường liên quan đến độ tan của hydroxide tạo thành: hydroxide
có độ tan lớn hơn thì phản ứng của kim loại đó với nước thuận lợi hơn nên bọt khí xuất hiện nhanh nhất trên bề mặt kim loại Ba.
❌ d. Sai. Có 3 kim loại (Ca, Sr, Ba) đều phản ứng nhanh với nước ở nhiệt độ thường.
Câu 22 [704379]: Nghiên cứu phản ứng giữa bromine với aniline được tiến hành như sau:
▪ Bước 1: Cho vào ống nghiệm 1 mL dung dịch aniline C6H5NH2.
▪ Bước 2: Thêm tiếp từ từ 0,5 – 1 mL nước bromine, vừa thêm vừa lắc.
▪ Bước 1: Cho vào ống nghiệm 1 mL dung dịch aniline C6H5NH2.
▪ Bước 2: Thêm tiếp từ từ 0,5 – 1 mL nước bromine, vừa thêm vừa lắc.
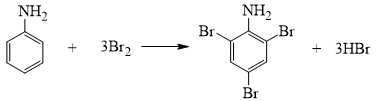
Khi cho dung dịch Br2 tác dụng với dung dịch aniline thấy xuất hiện kết tủa trắng và mất màu dung dịch bromine.
Phân tích các phát biểu:
✔️ (a) Đúng. Lắc đều để bromine và aniline trộn lẫn tốt hơn, tăng diện tích tiếp xúc giữa chúng trong quá trình phản ứng.
✔️ (b) Đúng. Khi bromine tác dụng với aniline, nhóm –NH2 làm tăng hoạt tính của nhân thơm, dẫn đến phản ứng thế 3 nguyên tử bromine vào vị trí 2, 4, 6 trên vòng benzene, tạo ra 2,4,6-tribromoaniline (C6H2NH2(Br)3) kết tủa màu trắng.
❌ (c) Sai. Phản ứng giữa bromine và aniline là phản ứng thế, không phải phản ứng cộng. Ba nguyên tử bromine thay thế 3 nguyên tử hydrogen trên vòng benzen thoe tỉ lệ 1 : 3 chứ không cộng.
✔️ (d) Đúng. Nhóm –NH2 là nhóm đẩy electron mạnh, làm tăng mật độ electron trên vòng benzene, đặc biệt tại các vị trí ortho (2,6) và para (4), giúp vòng benzene phản ứng dễ dàng hơn với bromine và ưu tiên thế ở các vị trí này.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704380]: Từ ba α-amino acid X, Y, Z (phân tử đều chỉ có 1 nhóm NH2 và 1 nhóm COOH) có thể tạo bao nhiêu dipeptide cấu tạo bởi hai gốc amino acid khác nhau?
Các dipeptide cấu tạo bởi 2 gốc amino acid khác nhau là: X-Y, Y-X, X-Z, Z-X, Y-Z, Z-Y.
⇒ Điền đáp án: 6
⇒ Điền đáp án: 6
Câu 24 [704381]: Methyl salicylate dùng làm thuốc xoa bóp giảm đau, được điều chế theo phản ứng sau:
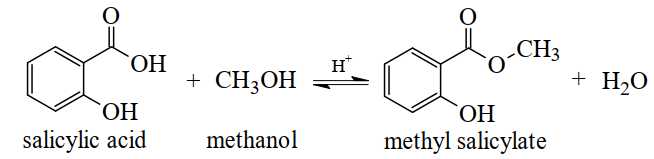
Để sản xuất 1,9 triệu tuýp thuốc xoa bóp giảm đau cần tối thiểu m tấn salicylic acid. Biết mỗi tuýp thuốc chứa 2,7 gam methyl salicylate và hiệu suất phản ứng tính theo salicylic acid là 75%. Giá trị của m là bao nhiêu?
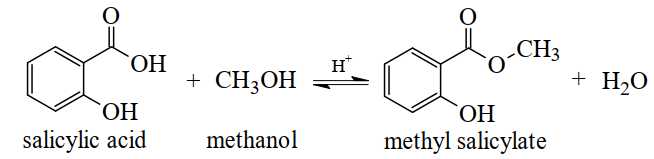
Để sản xuất 1,9 triệu tuýp thuốc xoa bóp giảm đau cần tối thiểu m tấn salicylic acid. Biết mỗi tuýp thuốc chứa 2,7 gam methyl salicylate và hiệu suất phản ứng tính theo salicylic acid là 75%. Giá trị của m là bao nhiêu?
Khối lượng methyl salicylate có trong 1,9 triệu tuýp thuốc xoa bóp giảm đau đau là:
1,9.106.2,7 = 5130000 gam = 5,13 tấn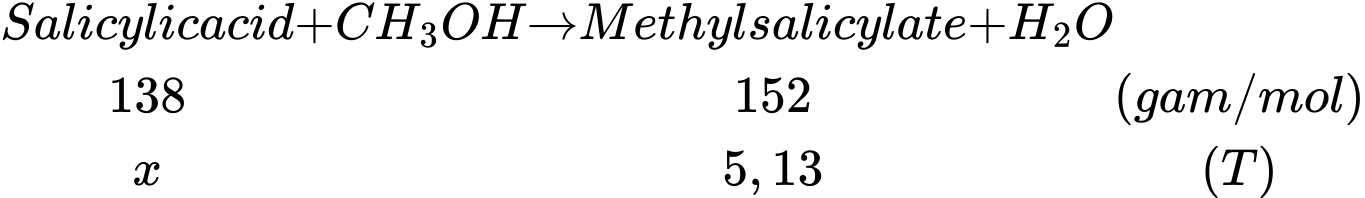
Khối lượng salicylic acid cần dùng là:
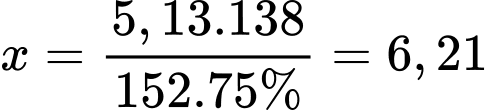 (tấn)
(tấn)
⇒ Điền đáp án: 6,21
1,9.106.2,7 = 5130000 gam = 5,13 tấn
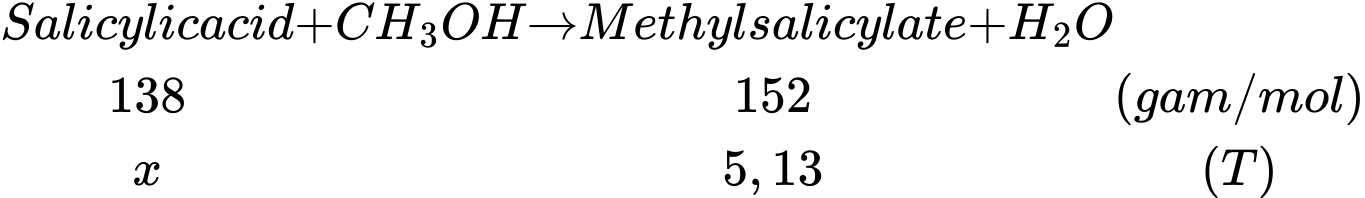
Khối lượng salicylic acid cần dùng là:
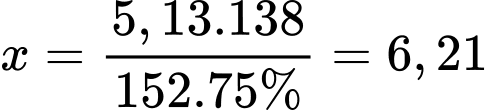 (tấn)
(tấn)
⇒ Điền đáp án: 6,21
Câu 25 [704382]: Methane, CH4, có thể được chuyển đổi thành methanol, giống như ethanol, có thể được sử dụng làm nhiên liệu. Biểu đồ mức năng lượng được hiển thị ở đây trình bày mối quan hệ giữa năng lượng của nhiên liệu và các sản phẩm oxi hóa của chúng.
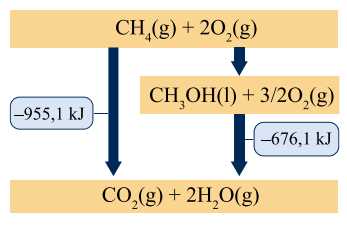
Biến thiên enthalpy khi chuyển đổi methane thành methanol trong biểu đồ trên là bao nhiêu kJ?

Biến thiên enthalpy khi chuyển đổi methane thành methanol trong biểu đồ trên là bao nhiêu kJ?
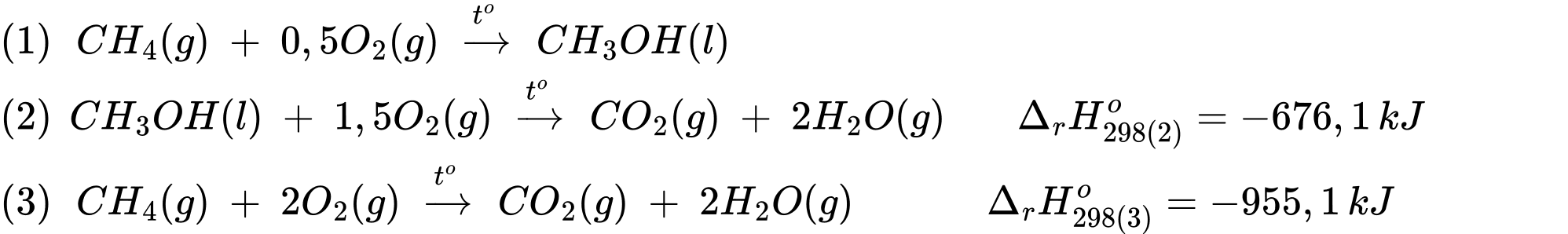
Từ phương trình (1) + phương trình (2) ta được phương trình (3)
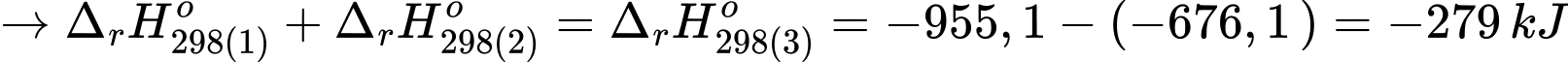
⇒ Điền đáp án: –279
Câu 26 [704383]: Alkyne là hydrocarbon không bão hòa, trong phân tử có chứa liên kết π kém bền và các tính chất hóa học của alkyne tập chung vào liên kết π này. Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
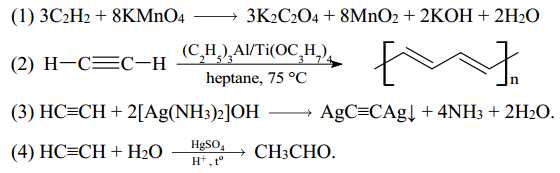
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: Phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc thử Tollens, phản ứng oxi hóa không hoàn toàn và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321, ...).
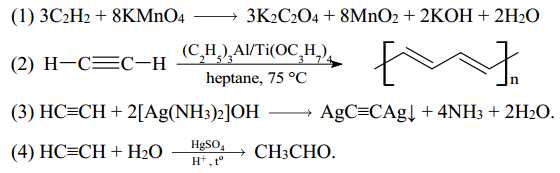
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: Phản ứng cộng, phản ứng trùng hợp, phản ứng với thuốc thử Tollens, phản ứng oxi hóa không hoàn toàn và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321, ...).
⭐ Phương trình 1:
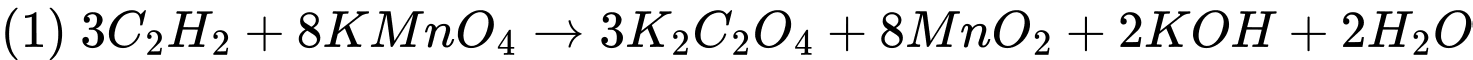
Đây là phản ứng oxi hóa không hoàn toàn, trong đó acetylen (C2H2) bị oxi hóa bởi KMnO4 tạo ra K2C2O4 (muối oxalate).
⭐ Phương trình 2:
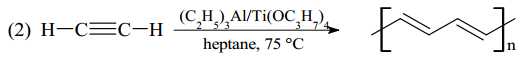
Đây là phản ứng trùng hợp, trong đó nhiều phân tử acetylen () liên kết với nhau để tạo thành một polymer.
⭐ Phương trình 3:
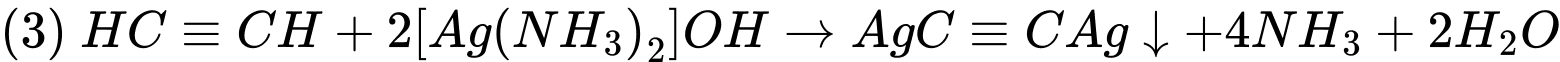
Đây là phản ứng với thuốc thử Tollens, trong đó ion bạc (Ag+) tạo kết tủa bạc acetylide (AgC≡CAg) với acetylen.
⭐ Phương trình 4:
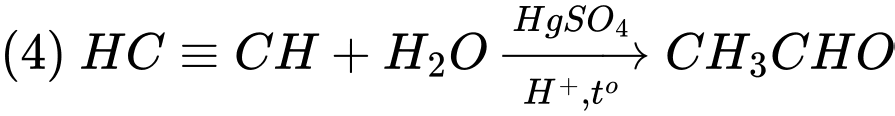
Đây là phản ứng cộng, trong đó acetylen cộng với nước (H2O) để tạo thành acetaldehyde (CH3CHO).
Thứ tự phương trình hoá học của các phản ứng theo tên gọi là:
(4) Phản ứng cộng.
(2) Phản ứng trùng hợp.
(3) Phản ứng với thuốc thử Tollens.
(1) Phản ứng oxi hóa không hoàn toàn.
⇒ Điền đáp án: 4231
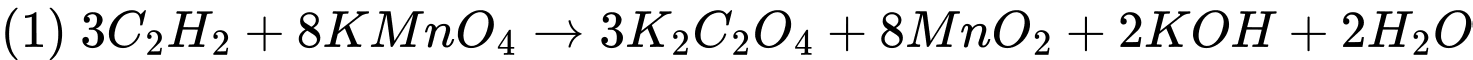
Đây là phản ứng oxi hóa không hoàn toàn, trong đó acetylen (C2H2) bị oxi hóa bởi KMnO4 tạo ra K2C2O4 (muối oxalate).
⭐ Phương trình 2:
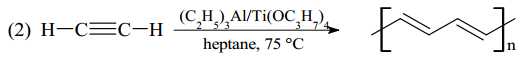
Đây là phản ứng trùng hợp, trong đó nhiều phân tử acetylen () liên kết với nhau để tạo thành một polymer.
⭐ Phương trình 3:
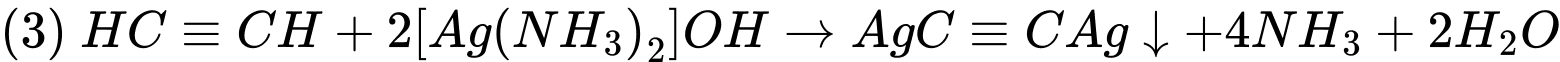
Đây là phản ứng với thuốc thử Tollens, trong đó ion bạc (Ag+) tạo kết tủa bạc acetylide (AgC≡CAg) với acetylen.
⭐ Phương trình 4:
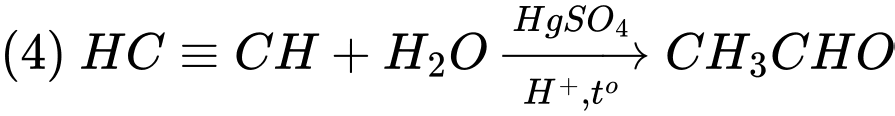
Đây là phản ứng cộng, trong đó acetylen cộng với nước (H2O) để tạo thành acetaldehyde (CH3CHO).
Thứ tự phương trình hoá học của các phản ứng theo tên gọi là:
(4) Phản ứng cộng.
(2) Phản ứng trùng hợp.
(3) Phản ứng với thuốc thử Tollens.
(1) Phản ứng oxi hóa không hoàn toàn.
⇒ Điền đáp án: 4231
Câu 27 [704384]: Phức chất [Cu(NH3)4]2+ được hình thành khi cho dung dịch NH3 tới dư vào dung dịch chứa ion Cu2+. Cần thay thế bao nhiêu phối tử NH3 bằng phối tử Cl– để thu được phức chất có điện tích là 2–?
Điện tích của phức chất được tính bằng tổng điện tích của ion trung tâm Cu2+ cộng với điện tích của các phối tử.
▪ Cu2+: Điện tích là +2.
▪ Mỗi phối tử NH3: Trung hòa (điện tích 0).
▪ Mỗi phối tử Cl−: Điện tích là −1.
Để phức chất có điện tích là −2, ta thay số lượng a phối tử NH3 bằng Cl−, khi đó:
+2 + 0 × (4 − a) − 1 × a
⇔ −2 + 2 − a = −2
⇔ a = 4
⟶ Khi thay thế 4 phối tử NH3 bằng phối tử Cl− thì phức chất sẽ mang điện tích là 2–.
[Cu(NH3)4]2+ + 4Cl− ⟶ [Cu(Cl)4]2- + 4NH3
⇒ Điền đáp án: 4
▪ Cu2+: Điện tích là +2.
▪ Mỗi phối tử NH3: Trung hòa (điện tích 0).
▪ Mỗi phối tử Cl−: Điện tích là −1.
Để phức chất có điện tích là −2, ta thay số lượng a phối tử NH3 bằng Cl−, khi đó:
+2 + 0 × (4 − a) − 1 × a
⇔ −2 + 2 − a = −2
⇔ a = 4
⟶ Khi thay thế 4 phối tử NH3 bằng phối tử Cl− thì phức chất sẽ mang điện tích là 2–.
[Cu(NH3)4]2+ + 4Cl− ⟶ [Cu(Cl)4]2- + 4NH3
⇒ Điền đáp án: 4
Câu 28 [704385]: Oxygen hòa tan (Dissolved Oxygen – DO) trong nước rất cần thiết cho sự hô hấp của các thủy sinh vật như cá, tôm, động vật lưỡng cư, côn trùng… Nồng độ DO trong các nguồn nước có thể dao động từ 0-18 mg/L, và đối với môi trường nước sạch tự nhiên giá trị này trong khoảng 8-10 mg/L. Phương pháp cải tiến azid là 1 trong những phương pháp thông dụng để xác định chỉ số DO. Nguyên lí phương pháp:
Trong môi trường kiềm Mn2+ bị oxygen hòa tan trong nước oxi hóa đến Mn4+ dưới dạng MnO2:
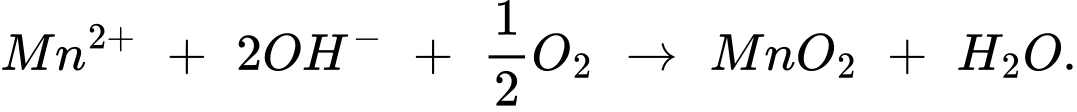
Khi có mặt H+ , Mn4+ bị khử thành Mn2+:
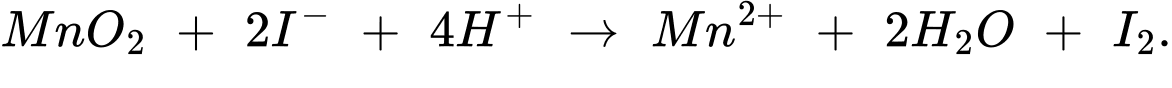
Dùng Na2S2O3 chuẩn độ lượng I2 giải phóng ra với chỉ thị là hồ tinh bột từ đó xác định được lượng oxygen hòa tan.
Dựa vào phương pháp trên người ta tiến hành xác định chỉ số DO trên 200 mL nước sông và thấy dùng hết 15,4 mL dung dịch Na2S2O3 0,025M đến khi dung dịch mất màu xanh và trở nên trắng ngà. Xác định chỉ số DO trên theo mg/L?
Trong môi trường kiềm Mn2+ bị oxygen hòa tan trong nước oxi hóa đến Mn4+ dưới dạng MnO2:
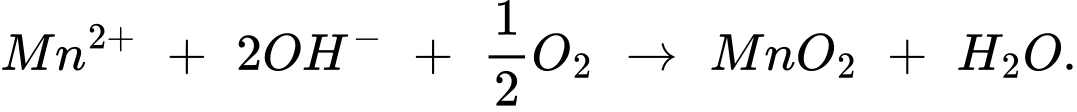
Khi có mặt H+ , Mn4+ bị khử thành Mn2+:
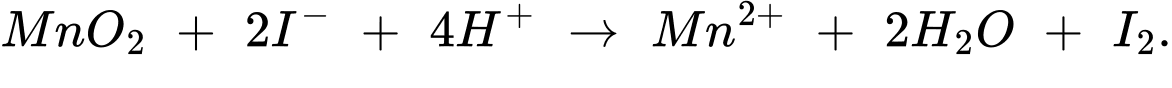
Dùng Na2S2O3 chuẩn độ lượng I2 giải phóng ra với chỉ thị là hồ tinh bột từ đó xác định được lượng oxygen hòa tan.
Dựa vào phương pháp trên người ta tiến hành xác định chỉ số DO trên 200 mL nước sông và thấy dùng hết 15,4 mL dung dịch Na2S2O3 0,025M đến khi dung dịch mất màu xanh và trở nên trắng ngà. Xác định chỉ số DO trên theo mg/L?
Đổi 200 mL = 0,2 L; 15,4 mL = 0,0154 mL
(1) Mn2+ + 2OH– + 0,5O2 ⟶ MnO2 + H2O
(2) MnO2 + 2I– + 4H+ ⟶ Mn2+ + 2H2O + I2
(3) I2 + 2S2O32– ⟶ S4O62– + 2I–
Số mol của Na2S2O3 phản ứng là:
nNa2S2O3 = 0,025 × 0,0154 = 0,000385 (mol)
Từ phương trình (1), (2) và (3) số mol của O2 trong mẫu nước là:
nO2 = nS2O32- ÷ 4 = 0,000385 ÷ 4 = 9,625×10-5 (mol)
Chỉ số DO trong mẫu nước trên là:
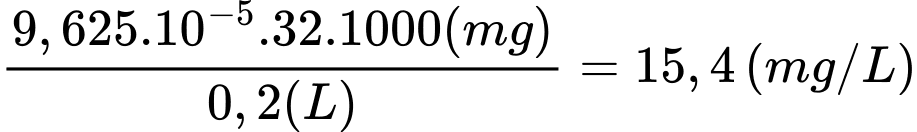
⇒ Điền đáp án: 15,4
(1) Mn2+ + 2OH– + 0,5O2 ⟶ MnO2 + H2O
(2) MnO2 + 2I– + 4H+ ⟶ Mn2+ + 2H2O + I2
(3) I2 + 2S2O32– ⟶ S4O62– + 2I–
Số mol của Na2S2O3 phản ứng là:
nNa2S2O3 = 0,025 × 0,0154 = 0,000385 (mol)
Từ phương trình (1), (2) và (3) số mol của O2 trong mẫu nước là:
nO2 = nS2O32- ÷ 4 = 0,000385 ÷ 4 = 9,625×10-5 (mol)
Chỉ số DO trong mẫu nước trên là:
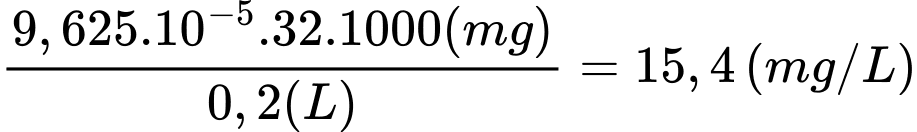
⇒ Điền đáp án: 15,4