PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [704386]: Theo IUPAC, nguyên tố chuyển tiếp là những nguyên tố có …(1)… chưa được xếp (hoặc điền) đầy …(2)… ở trạng thái nguyên tử hoặc ở trạng thái ion. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, lớp, điện tích hạt nhân.
B, phân lớp, electron.
C, phân lớp, điện tích hạt nhân.
D, lớp, electron.
Theo IUPAC, nguyên tố chuyển tiếp là những nguyên tố có phân lớp chưa được xếp (hoặc điền) đầy electron.
Giải thích:
- Theo IUPAC, một nguyên tố được gọi là nguyên tố chuyển tiếp nếu trong trạng thái nguyên tử hoặc trạng thái ion, nguyên tố đó có phân lớp d chưa được điền đầy hoàn toàn (chưa chứa đủ 10 electron). Điều này có nghĩa là số electron trong phân lớp d phải nằm trong khoảng từ 1 đến 9.
- Ví dụ:
Nguyên tố Fe (Z = 26): Cấu hình electron: Ar]3d6 4s2.
Phân lớp 3d có 6 electron → chưa đầy → Fe là nguyên tố chuyển tiếp.
⇒ Chọn đáp án B Đáp án: B
Giải thích:
- Theo IUPAC, một nguyên tố được gọi là nguyên tố chuyển tiếp nếu trong trạng thái nguyên tử hoặc trạng thái ion, nguyên tố đó có phân lớp d chưa được điền đầy hoàn toàn (chưa chứa đủ 10 electron). Điều này có nghĩa là số electron trong phân lớp d phải nằm trong khoảng từ 1 đến 9.
- Ví dụ:
Nguyên tố Fe (Z = 26): Cấu hình electron: Ar]3d6 4s2.
Phân lớp 3d có 6 electron → chưa đầy → Fe là nguyên tố chuyển tiếp.
⇒ Chọn đáp án B Đáp án: B
Câu 2 [679540]: Chất nào sau đây được dùng để khử chua đất trong nông nghiệp?
A, CaO.
B, CaSO4.
C, CaCl2.
D, Ca(NO3)2.
Đất chua (pH < 6,5) do đất bị rửa trôi bởi nước mưa, nước tưới dư thừa. Nước mang đi chất dinh dưỡng hòa tan, trong đó có chứa nhiều chất kiềm xuống tầng đất sâu, sông suối, ao hồ ⇝ làm đất mất chất kiềm ⇝ trở nên chua.
⇒ Biện pháp khắc phục là bón vôi tôi (CaO) bởi CaO + H2O → Ca(OH)2 có tính base ⇝ tăng tính kiềm cho đất cũng như giúp khử chua (loại bỏ các acid trong đất).
⇒ Chọn đáp án A Đáp án: A
⇒ Biện pháp khắc phục là bón vôi tôi (CaO) bởi CaO + H2O → Ca(OH)2 có tính base ⇝ tăng tính kiềm cho đất cũng như giúp khử chua (loại bỏ các acid trong đất).
⇒ Chọn đáp án A Đáp án: A
Câu 3 [704387]: Polypropylene là polymer được dùng chế tạo bao bì thực phẩm. Nó được tổng hợp từ propylene bằng phản ứng
A, trùng hợp.
B, trùng ngưng.
C, thế.
D, trao đổi.
Polypropylene là một polymer được tổng hợp từ monomer propylene (CH2=CH−CH3), được ứng dụng rộng rãi trong sản xuất bao bì thực phẩm, đồ gia dụng, và các sản phẩm nhựa.
Polypropylene được tổng hợp bằng phản ứng trùng hợp, các phân tử monomer propylene liên kết với nhau nhờ cơ chế mở liên kết đôi C=C, tạo thành chuỗi polymer dài:
nCH2=CH−CH3 −xt, to⟶ −[CH2−CH(CH3)]n−
Loại trừ các đáp án sai:
❌ B. Trùng ngưng: Sai, vì trùng ngưng xảy ra khi các monomer phản ứng với nhau bằng cách loại bỏ một phân tử nhỏ (như H2O hoặc HCl), ví dụ như trong tổng hợp nylon hoặc polyester. Polypropylene không hình thành theo cách này.
❌ C. Thế: Sai, vì phản ứng thế là sự thay thế một nguyên tử hoặc nhóm nguyên tử trong phân tử, không phù hợp với quá trình tạo polymer từ propylene.
❌ D. Trao đổi: Sai, vì phản ứng trao đổi thường liên quan đến sự hoán đổi nhóm chức giữa hai hợp chất, không liên quan đến phản ứng tạo polypropylene.
⇒ Chọn đáp án A Đáp án: A
Polypropylene được tổng hợp bằng phản ứng trùng hợp, các phân tử monomer propylene liên kết với nhau nhờ cơ chế mở liên kết đôi C=C, tạo thành chuỗi polymer dài:
nCH2=CH−CH3 −xt, to⟶ −[CH2−CH(CH3)]n−
Loại trừ các đáp án sai:
❌ B. Trùng ngưng: Sai, vì trùng ngưng xảy ra khi các monomer phản ứng với nhau bằng cách loại bỏ một phân tử nhỏ (như H2O hoặc HCl), ví dụ như trong tổng hợp nylon hoặc polyester. Polypropylene không hình thành theo cách này.
❌ C. Thế: Sai, vì phản ứng thế là sự thay thế một nguyên tử hoặc nhóm nguyên tử trong phân tử, không phù hợp với quá trình tạo polymer từ propylene.
❌ D. Trao đổi: Sai, vì phản ứng trao đổi thường liên quan đến sự hoán đổi nhóm chức giữa hai hợp chất, không liên quan đến phản ứng tạo polypropylene.
⇒ Chọn đáp án A Đáp án: A
Câu 4 [560690]: Với quá trình tách sodium bằng phương pháp điện phân sodium chloride nóng chảy, phát biểu nào sau đây là đúng?
A, Tại anode xảy ra quá trình khử ion Na+.
B, Tại cathode xảy ra quá trình khử ion Cl–.
C, Tại cathode xảy ra quá trình khử ion Na+.
D, Tại anode xảy ra quá trình khử ion Cl–.
Khi điện phân nóng chảy NaCl:
Anode (+) xảy ra quá trình oxi hóa: 2Cl- ⟶ Cl2 + 2e
Cathode (-) xảy ra quá trình khử: Na+ + 1e ⟶ Na
⇒ Chọn đáp án C Đáp án: C
Anode (+) xảy ra quá trình oxi hóa: 2Cl- ⟶ Cl2 + 2e
Cathode (-) xảy ra quá trình khử: Na+ + 1e ⟶ Na
⇒ Chọn đáp án C Đáp án: C
Câu 5 [57711]: Cho từ từ đến dư một lượng bột sắt vào trong bình đựng một lượng nhỏ khí clo đã được đun nóng. Sau khi các phản ứng xảy ra hoàn toàn, chất rắn thu được trong bình là
A, FeCl2 .
B, FeCl2 và FeCl3.
C, Fe và FeCl2.
D, Fe và FeCl3.
2Fe + 3Cl2 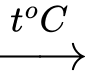 2FeCl3
2FeCl3
Chú ý: Chỉ trong dung dịch thì Fe dư mới có thể phản ứng với FeCl3 để tạo thành FeCl2:
Fe + 2FeCl3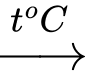 3FeCl2
3FeCl2
Vậy sau phản ứng chất rắn gồm Fe, FeCl3.
⇒ Chọn đáp án D Đáp án: D
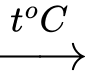 2FeCl3
2FeCl3Chú ý: Chỉ trong dung dịch thì Fe dư mới có thể phản ứng với FeCl3 để tạo thành FeCl2:
Fe + 2FeCl3
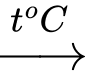 3FeCl2
3FeCl2Vậy sau phản ứng chất rắn gồm Fe, FeCl3.
⇒ Chọn đáp án D Đáp án: D
Câu 6 [704388]: Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất?
A, Tungsten (W).
B, Iron (Fe).
C, Copper (Cu).
D, Zinc (Zn).
Nhiệt độ nóng chảy của các kim loại trên là:
✩ Tungsten (W): 3422 oC.
✩ Iron (Fe): 1538 oC.
✩ Copper (Cu): 1085 oC.
✩ Zinc (Zn): 419.5 oC.
→ Tungsten có nhiệt độ nóng chảy cao nhất.
Do tungsten có cấu trúc mạng tinh thể lập phương tâm khối với liên kết kim loại rất mạnh.Năng lượng liên kết trong mạng tinh thể của tungsten là cực kỳ lớn, đòi hỏi một lượng nhiệt đáng kể để phá vỡ các liên kết này.
⇒ Chọn đáp án A
Đáp án: A
✩ Tungsten (W): 3422 oC.
✩ Iron (Fe): 1538 oC.
✩ Copper (Cu): 1085 oC.
✩ Zinc (Zn): 419.5 oC.
→ Tungsten có nhiệt độ nóng chảy cao nhất.
Do tungsten có cấu trúc mạng tinh thể lập phương tâm khối với liên kết kim loại rất mạnh.Năng lượng liên kết trong mạng tinh thể của tungsten là cực kỳ lớn, đòi hỏi một lượng nhiệt đáng kể để phá vỡ các liên kết này.
⇒ Chọn đáp án A
Đáp án: A
Câu 7 [704389]: Phổ MS của chất Y cho thấy Y có phân tử khối bằng 60. Công thức phân tử nào dưới đây không phù hợp với Y?
A, C3H8O.
B, C2H4O2.
C, C3H7F.
D, C2H8N2.
✔️ C3H8O có phân tử khối là 60 gam/mol
✔️ C2H4O2 có phân tử khối là 60 gam/mol
❌ C3H7F có phân tử khối là 62 gam/mol
✔️ C2H8N2 có phân tử khối là 60 gam/mol
Công thức phân tử nào dưới đây không phù hợp với Y là C3H7F.
⇒ Chọn đáp án C Đáp án: C
✔️ C2H4O2 có phân tử khối là 60 gam/mol
❌ C3H7F có phân tử khối là 62 gam/mol
✔️ C2H8N2 có phân tử khối là 60 gam/mol
Công thức phân tử nào dưới đây không phù hợp với Y là C3H7F.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [305422]: Thủy phân triolein có công thức (C17H33COO)3C3H5 trong dung dịch HCl, thu được glixerol và acid X. Công thức của X là
A, C17H35COOH.
B, CH3COOH.
C, C2H5COOH.
D, C17H33COOH.
Phản ứng tổng quát:
(RCOO)3C3H5 + 3H2O –––H⁺, to–→ 3RCOOH + C3H5(OH)3.
Ở câu hỏi này: (RCOO)3C3H5 = (C17H33COO)3C3H5
⇒ R = C17H33COO ⇒ acid thu được là RCOOH = C17H33COOH
⇒ Chọn đáp án D Đáp án: D
(RCOO)3C3H5 + 3H2O –––H⁺, to–→ 3RCOOH + C3H5(OH)3.
Ở câu hỏi này: (RCOO)3C3H5 = (C17H33COO)3C3H5
⇒ R = C17H33COO ⇒ acid thu được là RCOOH = C17H33COOH
⇒ Chọn đáp án D Đáp án: D
Câu 9 [308515]: Chất nào sau đây thuộc loại amine bậc hai ?
A, phenylamine.
B, methylamine.
C, dimethylamine.
D, trimethylamine.
CTCT của các amine:
❌A. phenylamine: C6H5-NH2
❌B. methylamine: CH3-NH2
✔️C. dimethylamine: CH3-NH-CH3
❌D. trimethylamine: CH3-N(CH3)-CH3
+ Các amine trong phân tử có chứa nhóm:
NH2 ⇒ amine bậc 1
NH ⇒ amine bậc 2
N ⇒ amine bậc 3
⇒ Amine bậc hai là dimethylamine
⇒ Chọn đáp án C Đáp án: C
❌A. phenylamine: C6H5-NH2
❌B. methylamine: CH3-NH2
✔️C. dimethylamine: CH3-NH-CH3
❌D. trimethylamine: CH3-N(CH3)-CH3
+ Các amine trong phân tử có chứa nhóm:
NH2 ⇒ amine bậc 1
NH ⇒ amine bậc 2
N ⇒ amine bậc 3
⇒ Amine bậc hai là dimethylamine
⇒ Chọn đáp án C Đáp án: C
Câu 10 [704390]: Quá trình sản xuất sulfuric acid được thực hiện theo các bước sau: Ở bước 1, không khí được sử dụng làm nguồn oxygen. Nguồn này rẻ và dễ kiếm. Một lượng không khí dư được sử dụng, cung cấp oxygen cần thiết cho bước 2. Điều này làm cho quá trình hiệu quả hơn vì hai chất phản ứng cho bước 2 đã được trộn lẫn với nhau. Tuy nhiên, lượng không khí được kiểm soát sao cho tỷ lệ sulfur dioxide so với oxygen ở bước 2 là 1:1.
▪ Bước 1: S(r) + O2(g) → SO2(g)
▪ Bước 2: 2SO2(g) + O2(g)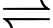 2SO3(g)
2SO3(g)
▪ Bước 3: 3SO3(g) + H2SO4(l) → H2S2O7(l)
▪ Bước 4: H2S2O7(l) + H2O(l) → 2H2SO4(l)
Cho các phát biểu sau:
(a) Ở bước 1, hỗn hợp khí thu được sau phản ứng gồm SO2 và O2 dư.
(b) Ở bước 2, SO2 trong quá trình trên đã được dùng dư để cân bằng chuyển dịch theo chiều thuận.
(c) Ở bước 3 và bước 4, S không có sự thay đổi số oxi hóa.
(d) Nếu tổng số mol SO2 và O2 khi bắt đầu trộn ở bước 2 là 2 mol thì số mol O2 đã được đưa vào ở bước 1 là 2 mol.
Các phát biểu đúng là
▪ Bước 1: S(r) + O2(g) → SO2(g)
▪ Bước 2: 2SO2(g) + O2(g)
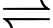 2SO3(g)
2SO3(g)▪ Bước 3: 3SO3(g) + H2SO4(l) → H2S2O7(l)
▪ Bước 4: H2S2O7(l) + H2O(l) → 2H2SO4(l)
Cho các phát biểu sau:
(a) Ở bước 1, hỗn hợp khí thu được sau phản ứng gồm SO2 và O2 dư.
(b) Ở bước 2, SO2 trong quá trình trên đã được dùng dư để cân bằng chuyển dịch theo chiều thuận.
(c) Ở bước 3 và bước 4, S không có sự thay đổi số oxi hóa.
(d) Nếu tổng số mol SO2 và O2 khi bắt đầu trộn ở bước 2 là 2 mol thì số mol O2 đã được đưa vào ở bước 1 là 2 mol.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (c), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Phương trình bước 1: S(s) + O2(g) → SO2(g).
Theo đề bài, không khí (nguồn O2) được sử dụng dư để đảm bảo quá trình hiệu quả. Vì vậy, sau phản ứng, hỗn hợp khí gồm SO2 và O2 dư.
❌ (b) Sai. Phương trình bước 2: 2SO2(g) + O2(g) ⇌ 2SO3(g).
Để phản ứng xảy ra theo chiều thuận (tạo SO3) người ta đã cung cấp không khí dư để cung cấp oxygen dư, không phải SO2 dư.
✔️ (c) Đúng. Số oxi hóa của nguyên tố S trong hợp chất SO3 và H2SO4 ở bước 3 và 6 đều có số oxi hóa là +6.
✔️ (d) Đúng. Tỉ lệ mol của SO2:O2 = 1:1, tổng mol của O2 và SO2 ở bước 2 là 2 (mol) nên nO2 = nSO2 = 1 (mol)
Theo PTHH (1): nO2 (1) = nSO2 = 1 (mol)
→ Tổng mol của O2 ở bước 1 và 2 là 2 mol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Phương trình bước 1: S(s) + O2(g) → SO2(g).
Theo đề bài, không khí (nguồn O2) được sử dụng dư để đảm bảo quá trình hiệu quả. Vì vậy, sau phản ứng, hỗn hợp khí gồm SO2 và O2 dư.
❌ (b) Sai. Phương trình bước 2: 2SO2(g) + O2(g) ⇌ 2SO3(g).
Để phản ứng xảy ra theo chiều thuận (tạo SO3) người ta đã cung cấp không khí dư để cung cấp oxygen dư, không phải SO2 dư.
✔️ (c) Đúng. Số oxi hóa của nguyên tố S trong hợp chất SO3 và H2SO4 ở bước 3 và 6 đều có số oxi hóa là +6.
✔️ (d) Đúng. Tỉ lệ mol của SO2:O2 = 1:1, tổng mol của O2 và SO2 ở bước 2 là 2 (mol) nên nO2 = nSO2 = 1 (mol)
Theo PTHH (1): nO2 (1) = nSO2 = 1 (mol)
→ Tổng mol của O2 ở bước 1 và 2 là 2 mol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án C Đáp án: C
Câu 11 [704391]: Cách làm nào sau đây là đúng trong việc khử chua đất bằng vôi và bón phân đạm cho lúa?
A, Rắc vôi bột và bón phâm đạm cùng một lúc.
B, Bón phân đạm trước rồi vài ngày sau bón vôi bột để khử chua.
C, Bón vôi khử chua trước rồi vài ngày sau mới bón phâm đạm.
D, Trộn đều vôi bột và phân đạm rồi bón.
Phân tích các đáp án:
❌ A. Sai. Khi rắc vôi bột và bón phâm đạm cùng một lúc sẽ xảy ra phản ứng giữa vôi và phân đạm, làm mất đạm.
❌ B. Sai. Khi bón vôi sau phân đạm, đạm đã có trong đất có thể bị thất thoát do phản ứng với vôi.
✔️ C. Đúng. Khi bón vôi trước, đất cần thời gian để ổn định độ pH (thường từ 7-10 ngày).Sau đó, bón phân đạm sẽ giúp giảm nguy cơ mất đạm do bay hơi hoặc phản ứng hóa học không mong muốn.
❌ D. Sai. Trộn đều vôi bột và phân đạm rồi bón làm tăng nguy cơ phản ứng hóa học giữa vôi và phân đạm, làm mất đạm.
⇒ Chọn đáp án C Đáp án: C
❌ A. Sai. Khi rắc vôi bột và bón phâm đạm cùng một lúc sẽ xảy ra phản ứng giữa vôi và phân đạm, làm mất đạm.
❌ B. Sai. Khi bón vôi sau phân đạm, đạm đã có trong đất có thể bị thất thoát do phản ứng với vôi.
✔️ C. Đúng. Khi bón vôi trước, đất cần thời gian để ổn định độ pH (thường từ 7-10 ngày).Sau đó, bón phân đạm sẽ giúp giảm nguy cơ mất đạm do bay hơi hoặc phản ứng hóa học không mong muốn.
❌ D. Sai. Trộn đều vôi bột và phân đạm rồi bón làm tăng nguy cơ phản ứng hóa học giữa vôi và phân đạm, làm mất đạm.
⇒ Chọn đáp án C Đáp án: C
Câu 12 [308314]: Trong điều kiện thích hợp glucose lên men tạo thành khí CO2 và
A, HCOOH.
B, CH3CHO.
C, CH3COOH.
D, C2H5OH.
Lên men glucose với enzyme xúc tác ở nhiệt độ thích hợp thu được khí CO2 và ethanol:
C6H12O6 –enzyme, to→ 2C2H5OH + 2CO2↑.
⇒ Chọn đáp án D Đáp án: D
C6H12O6 –enzyme, to→ 2C2H5OH + 2CO2↑.
⇒ Chọn đáp án D Đáp án: D
Câu 13 [704392]: Cho dung dịch ở pH = 6 gồm glycine, lysine và glutamic acid được kí hiệu ngẫu nhiên là X, Y, Z. Đặt dung dịch trong điện trường thì hiện tượng điện di của các amino acid được biểu diễn như hình vẽ dưới đây.
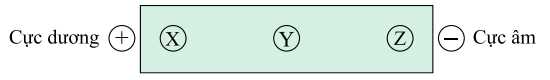
Nhận định đúng là

Nhận định đúng là
A, X tồn tại ở dạng anion, Y, Z là tồn tại ở dạng cation.
B, X có phân tử khối là 146.
C, Z là glycine.
D, Y di chuyển về cực âm khi giảm pH.
Dạng tồn tại của glycine, lysine và glutamic acid trong dung dịch pH = 6 như sau:
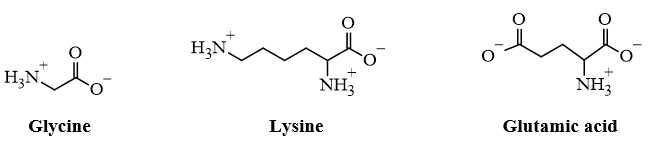
+) Glycine có tổng điện tích bằng 0 nên gần như không di chuyển trong điện trường → Glycine là Y.
+) Lysine có điện tích +1 nên sẽ di chuyển về cực âm → Lysine là Z.
+) Glutamic acid có điện tích -1 nên di chuyển về cực dương → Glutamic acid là X.
Phân tích các nhận định:
❌ A. Sai. X tồn tại ở dạng anion, Y tồn tại ở dạng ion lưỡng cực trung hoà, Z ở dạng cation.
❌ B. Sai. X là Glutamic acid có phân tử khối là 147.
❌ C. Sai. Z là lysine.
✔️ D. Đúng. Khi pH giảm, Y là glycine tồn tại ở dạng cation nên di chuyển về cực âm.
⇒ Chọn đáp án D Đáp án: D

+) Glycine có tổng điện tích bằng 0 nên gần như không di chuyển trong điện trường → Glycine là Y.
+) Lysine có điện tích +1 nên sẽ di chuyển về cực âm → Lysine là Z.
+) Glutamic acid có điện tích -1 nên di chuyển về cực dương → Glutamic acid là X.
Phân tích các nhận định:
❌ A. Sai. X tồn tại ở dạng anion, Y tồn tại ở dạng ion lưỡng cực trung hoà, Z ở dạng cation.
❌ B. Sai. X là Glutamic acid có phân tử khối là 147.
❌ C. Sai. Z là lysine.
✔️ D. Đúng. Khi pH giảm, Y là glycine tồn tại ở dạng cation nên di chuyển về cực âm.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [704393]: Các hợp chất tan trong nước (phân cực) dễ dàng được cơ thể đào thải. Ngược lại, các hợp chất không tan trong nước (không phân cực) không bị đào thải mà thay vào đó, tích tụ trong tế bào. Để tế bào không trở thành "bãi thải độc hại", các hợp chất không phân cực được đưa vào cơ thể (như thuốc, thực phẩm và chất gây ô nhiễm môi trường) phải được chuyển đổi thành các hợp chất phân cực để có thể được bài tiết. Một phản ứng gốc được thực hiện trong gan chuyển đổi các hydrocarbon không phân cực thành các alcohol phân cực. Phản ứng này được xúc tác bởi một enzyme chứa sắt gọi là cytochrome P450.
Cho các phát biểu sau:
(a) Alkane chứa các liên kết C–C và C–H không phân cực nên phân tử không phân cực.
(b) Phân tử alcohol chứa liên kết O–H kém phân cực nên cơ thể khó khăn đào thải.
(c) Enzyme cytochrome P450 bẻ gãy liên kết C–H trong phân tử alkane.
(d) Chất trung gian kết hợp với gốc tự do OH• tạo thành hợp chất alcohol.
Các phát biểu đúng là
Cho các phát biểu sau:
(a) Alkane chứa các liên kết C–C và C–H không phân cực nên phân tử không phân cực.
(b) Phân tử alcohol chứa liên kết O–H kém phân cực nên cơ thể khó khăn đào thải.
(c) Enzyme cytochrome P450 bẻ gãy liên kết C–H trong phân tử alkane.
(d) Chất trung gian kết hợp với gốc tự do OH• tạo thành hợp chất alcohol.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Alkane là một loại hợp chất hữu cơ chỉ chứa liên kết C–C và C-H. Đặc điểm chung của các liên kết này là chúng không phân cực. Các nguyên tử carbon và hydrogen có độ dẫn điện thấp, điều này có nghĩa là chúng không có khả năng thu hút mạnh các electron từ các nguyên tử khác. Do đó, không có sự tạo ra một điện tích âm hoặc dương mạnh trên phân tử alkane.
❌ (b) Sai. Liên kết O–H có độ phân cực lớn do sự chênh lệch lớn độ âm điện giữa nguyên tử O và H nên dễ dàng bị đào thải khỏi cơ thể.
✔️ (c) Đúng. Từ cơ chế ta thấy được liên kết C–H bị bẻ gãy hình thành gốc tự do trung gian sau đó sẽ hình thanh các alcohol dễ đào thải.
✔️ (d) Đúng. Từ cơ chế ta thấy được chất trung gian kết hợp với gốc tự do OH tạo thành alcohol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Alkane là một loại hợp chất hữu cơ chỉ chứa liên kết C–C và C-H. Đặc điểm chung của các liên kết này là chúng không phân cực. Các nguyên tử carbon và hydrogen có độ dẫn điện thấp, điều này có nghĩa là chúng không có khả năng thu hút mạnh các electron từ các nguyên tử khác. Do đó, không có sự tạo ra một điện tích âm hoặc dương mạnh trên phân tử alkane.
❌ (b) Sai. Liên kết O–H có độ phân cực lớn do sự chênh lệch lớn độ âm điện giữa nguyên tử O và H nên dễ dàng bị đào thải khỏi cơ thể.
✔️ (c) Đúng. Từ cơ chế ta thấy được liên kết C–H bị bẻ gãy hình thành gốc tự do trung gian sau đó sẽ hình thanh các alcohol dễ đào thải.
✔️ (d) Đúng. Từ cơ chế ta thấy được chất trung gian kết hợp với gốc tự do OH tạo thành alcohol.
Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 15 [704394]: Ester nào sau đây là ester hai chức?
A, CH3COOC2H5.
B, CH3COOCH=CH2.
C, CH2=CHCOOH.
D, (CH3COO)2C2H4.
Ester đa chức là những hợp chất ester chứa hai hoặc nhiều nhóm chức ester (−COO−) trong phân tử.
+) Các chất CH3COOC2H5 và CH3COOCH=CH2 chỉ có 1 nhóm chức −COO− trong phân tử nên là ester đơn chức.
+) Hợp chất CH2=CHCOOH là carboxylic acid, không phải ester.
+) (CH3COO)2C2H4 có 2 nhóm chức −COO− trong phân tử nên là ester hai chức.
⇒ Chọn đáp án D Đáp án: D
+) Các chất CH3COOC2H5 và CH3COOCH=CH2 chỉ có 1 nhóm chức −COO− trong phân tử nên là ester đơn chức.
+) Hợp chất CH2=CHCOOH là carboxylic acid, không phải ester.
+) (CH3COO)2C2H4 có 2 nhóm chức −COO− trong phân tử nên là ester hai chức.
⇒ Chọn đáp án D Đáp án: D
Câu 16 [704395]: Các amine có tính chất chung là tính ...(1)... nên amine tác dụng được với ...(2)... tạo muối và một số dung dịch amine làm quỳ tím chuyển màu xanh. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, acid, base.
B, lưỡng tính, nước.
C, base, acid.
D, trung tính, kim loại.
Các amine có tính chất chung là tính base nên amine tác dụng được với acid tạo muối và một số dung dịch amine làm quỳ tím chuyển màu xanh.
Giải thích:
Amine (R−NH2, R2NH, hoặc R3N) có cặp electron tự do trên nguyên tử nitrogen. Cặp electron này có khả năng nhận proton (H+) từ acid hoặc từ nước, thể hiện tính chất base yếu.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
Amine (R−NH2, R2NH, hoặc R3N) có cặp electron tự do trên nguyên tử nitrogen. Cặp electron này có khả năng nhận proton (H+) từ acid hoặc từ nước, thể hiện tính chất base yếu.
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Hình sau mô tả thí nghiệm khử 50 gam copper(II) oxide thành đồng kim loại. Sau thí nghiệm, tắt đèn khí, nhưng vẫn duy trì dòng khí hydrogen cho đến khi ống nghiệm nguội.
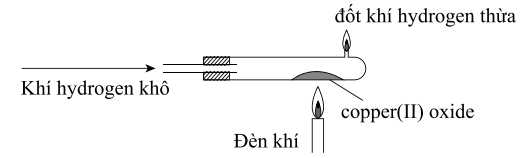

Câu 17 [704396]: Mục đích chính của việc duy trì dòng khí hydrogen là
A, tránh ống nghiệm bị nổ khi đang nóng.
B, để phản ứng xảy ra hoàn toàn.
C, ngăn đồng kim loại phản ứng với không khí.
D, đuổi hơi nước khỏi ống nghiệm.
⭐ Phản ứng trong thí nghiệm:
+) Khí hydrogen (H2) được sử dụng để khử copper(II) oxide (CuO) thành đồng kim loại (Cu):
CuO + H2 –to⟶ Cu + H2O
+) Sau phản ứng, nước được tạo thành dưới dạng hơi và đồng kim loại là sản phẩm rắn.
⭐ Lý do duy trì dòng khí hydrogen:
+) Sau khi tắt đèn khí (tức là ngừng nung nóng), ống nghiệm vẫn còn nóng.
+) Nếu không duy trì dòng khí hydrogen, đồng kim loại có thể phản ứng với oxygen trong không khí ở nhiệt độ cao, dẫn đến sự tái tạo lại CuO:
2Cu + O2 –to⟶ 2CuO
→ Duy trì dòng khí hydrogen tạo ra môi trường khử (không chứa
oxygen) bên trong ống nghiệm, ngăn đồng bị oxi hóa trở lại.
Phân tích các đáp án:
❌ A. Sai. Nổ ống nghiệm thường do áp suất tăng hoặc phản ứng mạnh, không liên quan trực tiếp đến việc duy trì hydrogen.
❌ B. Sai. Phản ứng khử đã hoàn thành trước đó.
✔️ C. Đúng. Duy trì dòng khí hydrogen tạo ra môi trường khử (không chứa
oxygen) bên trong ống nghiệm, ngăn đồng bị oxi hóa trở lại
❌ D. Sai. Dòng khí hydrogen không có tác dụng trực tiếp với việc đuổi hơi nước, vì hơi nước không ảnh hưởng đến sản phẩm đồng.
⇒ Chọn đáp án C Đáp án: C
+) Khí hydrogen (H2) được sử dụng để khử copper(II) oxide (CuO) thành đồng kim loại (Cu):
CuO + H2 –to⟶ Cu + H2O
+) Sau phản ứng, nước được tạo thành dưới dạng hơi và đồng kim loại là sản phẩm rắn.
⭐ Lý do duy trì dòng khí hydrogen:
+) Sau khi tắt đèn khí (tức là ngừng nung nóng), ống nghiệm vẫn còn nóng.
+) Nếu không duy trì dòng khí hydrogen, đồng kim loại có thể phản ứng với oxygen trong không khí ở nhiệt độ cao, dẫn đến sự tái tạo lại CuO:
2Cu + O2 –to⟶ 2CuO
→ Duy trì dòng khí hydrogen tạo ra môi trường khử (không chứa
oxygen) bên trong ống nghiệm, ngăn đồng bị oxi hóa trở lại.
Phân tích các đáp án:
❌ A. Sai. Nổ ống nghiệm thường do áp suất tăng hoặc phản ứng mạnh, không liên quan trực tiếp đến việc duy trì hydrogen.
❌ B. Sai. Phản ứng khử đã hoàn thành trước đó.
✔️ C. Đúng. Duy trì dòng khí hydrogen tạo ra môi trường khử (không chứa
oxygen) bên trong ống nghiệm, ngăn đồng bị oxi hóa trở lại
❌ D. Sai. Dòng khí hydrogen không có tác dụng trực tiếp với việc đuổi hơi nước, vì hơi nước không ảnh hưởng đến sản phẩm đồng.
⇒ Chọn đáp án C Đáp án: C
Câu 18 [704397]: Sau khi tiến hành thí nghiệm, đem cân thấy khối lượng chất rắn thu được là 42 gam. Hiệu suất của phản ứng trên là bao nhiêu?
A, 60%.
B, 80%.
C, 90%.
D, 70%.
Phản ứng hoá học: CuO + H2 –to⟶ Cu + H2O
Chất rắn trong ống chuyển từ màu đen sang màu nâu đỏ của đồng.
Khối lượng chất rắn giảm là khối lượng nguyên tố O mất đi trong CuO:
mO = 50 - 42 = 8 (gam)
Số mol của CuO đã tham gia phản ứng là:
nCuO = nO = 8 ÷ 16 = 0,5 (mol)
Hiệu suất phản ứng là: H = (0,5 × 80 ÷ 50) × 100% = 80%
⇒ Chọn đáp án B Đáp án: B
Chất rắn trong ống chuyển từ màu đen sang màu nâu đỏ của đồng.
Khối lượng chất rắn giảm là khối lượng nguyên tố O mất đi trong CuO:
mO = 50 - 42 = 8 (gam)
Số mol của CuO đã tham gia phản ứng là:
nCuO = nO = 8 ÷ 16 = 0,5 (mol)
Hiệu suất phản ứng là: H = (0,5 × 80 ÷ 50) × 100% = 80%
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [704398]: Tiến hành thử nghiệm khả năng phản ứng với nước của các kim loại kiềm (nhóm IA). Quy trình tiến hành như sau:
Chuẩn bị: Kim loại lithium, sodium, potassium, nước, dung dịch phenolphthalein.
▪ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
▪ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào chậu thuỷ tinh chứa khoảng 1/3 thể tích nước.
▪ Bước 3: Thêm vài giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Chuẩn bị: Kim loại lithium, sodium, potassium, nước, dung dịch phenolphthalein.
▪ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
▪ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào chậu thuỷ tinh chứa khoảng 1/3 thể tích nước.
▪ Bước 3: Thêm vài giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Các kim loại nhóm IA phản ứng mạnh với nước, tạo ra dung dịch kiềm và khí hydrogen: 2M + 2H2O ⟶ 2MOH + H2↑.
Mức độ phản ứng của các kim loại điển hình nhóm IA với nước:
☆ Lithium (Li): Phản ứng yếu nhất trong nhóm, sủi bọt nhẹ và tan dần trong nước.
☆ Sodium (Na): Phản ứng mạnh hơn, tạo thành khối cầu, chạy nhanh trên mặt nước do khí hydrogen thoát ra đẩy mẩu kim loại.
☆ Potassium (K): Phản ứng rất mạnh, thường bốc cháy với ngọn lửa màu tím do nhiệt độ sinh ra cao, thậm chí có thể gây nổ.
Phân tích các phát biểu:
✔️ A. Đúng. Mẩu Na phản ứng mạnh với nước, tạo thành khối cầu, chạy nhanh trên mặt nước do khí hydrogen thoát ra đẩy mẩu kim loại.
❌ B. Sai. Khả năng phản ứng với nước tăng dần từ Li đến K nên khả năng phản ứng của K mãnh liệt hơn Li.
✔️ C. Đúng. Phenolphthalein trong cả ba chậu chuyển sang màu hồng vì dung dịch sau phản ứng là kiềm MOH.
✔️ D. Đúng. Từ hiện tượng của thí nghiệm đã phân tích ở trên, có thể kết luận khả năng phản ứng của Li, Na, K với nước tăng dần.
Mức độ phản ứng của các kim loại điển hình nhóm IA với nước:
☆ Lithium (Li): Phản ứng yếu nhất trong nhóm, sủi bọt nhẹ và tan dần trong nước.
☆ Sodium (Na): Phản ứng mạnh hơn, tạo thành khối cầu, chạy nhanh trên mặt nước do khí hydrogen thoát ra đẩy mẩu kim loại.
☆ Potassium (K): Phản ứng rất mạnh, thường bốc cháy với ngọn lửa màu tím do nhiệt độ sinh ra cao, thậm chí có thể gây nổ.
Phân tích các phát biểu:
✔️ A. Đúng. Mẩu Na phản ứng mạnh với nước, tạo thành khối cầu, chạy nhanh trên mặt nước do khí hydrogen thoát ra đẩy mẩu kim loại.
❌ B. Sai. Khả năng phản ứng với nước tăng dần từ Li đến K nên khả năng phản ứng của K mãnh liệt hơn Li.
✔️ C. Đúng. Phenolphthalein trong cả ba chậu chuyển sang màu hồng vì dung dịch sau phản ứng là kiềm MOH.
✔️ D. Đúng. Từ hiện tượng của thí nghiệm đã phân tích ở trên, có thể kết luận khả năng phản ứng của Li, Na, K với nước tăng dần.
Câu 20 [704399]: Tiến hành thí nghiệm phản ứng màu biuret của lòng trắng trứng như sau:
▪ Bước 1: Cho vào ống nghiệm khoảng 1 mL dung dịch NaOH 30 %. Thêm tiếp vài giọt dung dịch CuSO4 2 %, lắc đều (có thể khuấy bằng đũa thuỷ tinh).
▪ Bước 2: Thêm vào ống nghiệm khoảng 3 mL dung dịch lòng trắng trứng, lắc hoặc khuấy đều hỗn hợp.
▪ Bước 1: Cho vào ống nghiệm khoảng 1 mL dung dịch NaOH 30 %. Thêm tiếp vài giọt dung dịch CuSO4 2 %, lắc đều (có thể khuấy bằng đũa thuỷ tinh).
▪ Bước 2: Thêm vào ống nghiệm khoảng 3 mL dung dịch lòng trắng trứng, lắc hoặc khuấy đều hỗn hợp.
⭐ Nguyên tắc phản ứng:
+) Phản ứng màu biuret xảy ra khi hợp chất chứa liên kết peptide (–CO–NH–) tác dụng với dung dịch kiềm mạnh (NaOH) và Cu2+.
+) Kết quả là tạo thành phức chất màu tím, chứng minh sự hiện diện của chuỗi peptide trong mẫu thí nghiệm.
⭐ Các hiện tượng trong thí nghiệm:
+) Bước 1: Khi cho CuSO4 vào dung dịch NaOH, xuất hiện kết tủa Cu(OH)2 màu xanh nhạt:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
+) Bước 2: Thêm dung dịch lòng trắng trứng (protein chứa liên kết peptide), kết tủa Cu(OH)2 tan, tạo thành phức chất màu tím.
Phân tích các phát biểu:
❌ (a) Sai. Ở bước 1, xuất hiện kết tủa Cu(OH)2 màu xanh nhạt chứ không phải màu đỏ gạch.
✔️ (b) Đúng. Phản ứng giữa Cu(OH)2 với các nhóm peptide –CO–NH– trong lòng trắng trứng tạo ra sản phẩm màu tím đặc trưng.
✔️ (c) Đúng. Có thể sử dụng dung dịch NaOH 10%, 20%, hoặc 30%, miễn là đủ tạo môi trường kiềm mạnh để có thể phản ứng với CuSO4 tạo ra kết tủa Cu(OH)2 thực hiện phản ứng màu buiret.
✔️ (d) Đúng. Phản ứng màu biuret xuất hiện màu tím đặc trưng nếu có ít nhất 2 liên kết peptide, chứng minh sự hiện diện của peptide trong lòng trắng trứng với số liên kết –CO–NH– lớn hơn hoặc bằng 2.
+) Phản ứng màu biuret xảy ra khi hợp chất chứa liên kết peptide (–CO–NH–) tác dụng với dung dịch kiềm mạnh (NaOH) và Cu2+.
+) Kết quả là tạo thành phức chất màu tím, chứng minh sự hiện diện của chuỗi peptide trong mẫu thí nghiệm.
⭐ Các hiện tượng trong thí nghiệm:
+) Bước 1: Khi cho CuSO4 vào dung dịch NaOH, xuất hiện kết tủa Cu(OH)2 màu xanh nhạt:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
+) Bước 2: Thêm dung dịch lòng trắng trứng (protein chứa liên kết peptide), kết tủa Cu(OH)2 tan, tạo thành phức chất màu tím.
Phân tích các phát biểu:
❌ (a) Sai. Ở bước 1, xuất hiện kết tủa Cu(OH)2 màu xanh nhạt chứ không phải màu đỏ gạch.
✔️ (b) Đúng. Phản ứng giữa Cu(OH)2 với các nhóm peptide –CO–NH– trong lòng trắng trứng tạo ra sản phẩm màu tím đặc trưng.
✔️ (c) Đúng. Có thể sử dụng dung dịch NaOH 10%, 20%, hoặc 30%, miễn là đủ tạo môi trường kiềm mạnh để có thể phản ứng với CuSO4 tạo ra kết tủa Cu(OH)2 thực hiện phản ứng màu buiret.
✔️ (d) Đúng. Phản ứng màu biuret xuất hiện màu tím đặc trưng nếu có ít nhất 2 liên kết peptide, chứng minh sự hiện diện của peptide trong lòng trắng trứng với số liên kết –CO–NH– lớn hơn hoặc bằng 2.
Câu 21 [704400]: Từ một loại tinh dầu thảo mộc, người ta tách được hợp chất hữu cơ A có mùi thơm. Bằng phương pháp phân tích nguyên tố, người ta thấy rằng A chứa 81,82% C và 6,06% H về khối lượng, còn lại là O. Phổ MS cho thấy A có phân tử khối bằng 132. Trên phổ IR của A có một tín hiệu đặc trưng ở 1 746 cm–1. Chất A có phản ứng tráng bạc, làm mất màu dung dịch Br2/CCl4 và khi bị oxi hoá bằng dung dịch KMnO4 nóng, thu được benzoic acid.
Gọi công thức của A có dạng CxHyOz
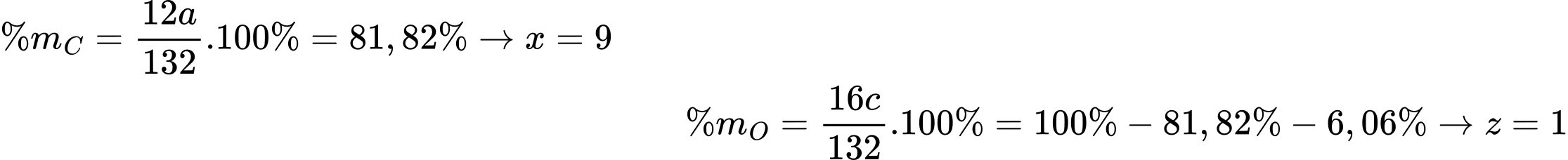
Công thức phân tử của A là C9H8O
Từ tín hiệu phổ hồng ngoại ta thấy có tín hiệu đặc trung ở 1746 cm-1 nên A có liên kết C=O.
A có phản ứng tráng bạc → A có nhóm chức –CHO
A làm mất màu dung dịch Br2/CCl4 → A có liên kết π trong mạch C
Phản ứng với dung dịch KMnO4 tạo dung dịch benzoic acid nên A có vòng benzene và có 1 nhánh ngoài vòng.
Công thức cấu tạo của A là: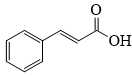
Phân tích các phát biểu:
✔️ (a) Đúng. Công thức phân tử của A là C9H8O.
✔️ (b) Đúng. Từ tín hiệu phổ hồng ngoại ta thấy có tín hiệu đặc trung ở 1746 cm-1 nên A có liên kết C=O.
❌ (c) Sai. Phản ứng làm mất màu dung dịch Br2/CCl4 chứng tỏ có liên kết đôi C=C, không liên quan trực tiếp đến nhóm aldehyde.
❌ (d) Sai. Công thức cấu tạo của A là C6H5CH=CHCHO.
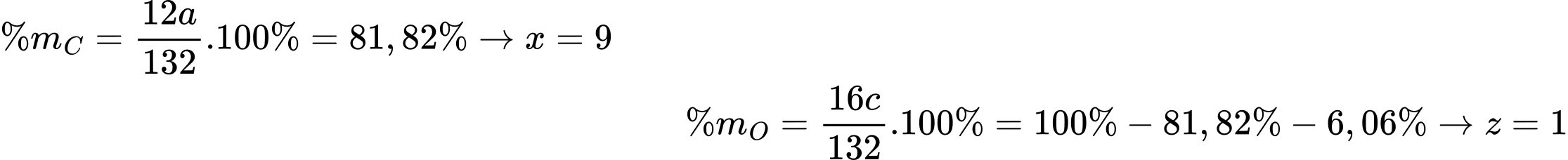
Công thức phân tử của A là C9H8O
Từ tín hiệu phổ hồng ngoại ta thấy có tín hiệu đặc trung ở 1746 cm-1 nên A có liên kết C=O.
A có phản ứng tráng bạc → A có nhóm chức –CHO
A làm mất màu dung dịch Br2/CCl4 → A có liên kết π trong mạch C
Phản ứng với dung dịch KMnO4 tạo dung dịch benzoic acid nên A có vòng benzene và có 1 nhánh ngoài vòng.
Công thức cấu tạo của A là:

Phân tích các phát biểu:
✔️ (a) Đúng. Công thức phân tử của A là C9H8O.
✔️ (b) Đúng. Từ tín hiệu phổ hồng ngoại ta thấy có tín hiệu đặc trung ở 1746 cm-1 nên A có liên kết C=O.
❌ (c) Sai. Phản ứng làm mất màu dung dịch Br2/CCl4 chứng tỏ có liên kết đôi C=C, không liên quan trực tiếp đến nhóm aldehyde.
❌ (d) Sai. Công thức cấu tạo của A là C6H5CH=CHCHO.
Câu 22 [704401]: Một nhóm học sinh tìm hiểu sự ảnh hưởng của nồng độ kim loại tại điện cực tới sức điện động của pin điện. Giả thuyết của nhóm học sinh đưa ra: “Nồng độ của ion kim loại trong dung dịch của bất kì điện cực nào giảm đều làm cho thế khử của điện cực đó giảm, dẫn đến sức điện động của pin giảm”. Để kiểm tra giả thuyết này, nhóm học sinh thiết lập một pin điện như hình bên dưới:
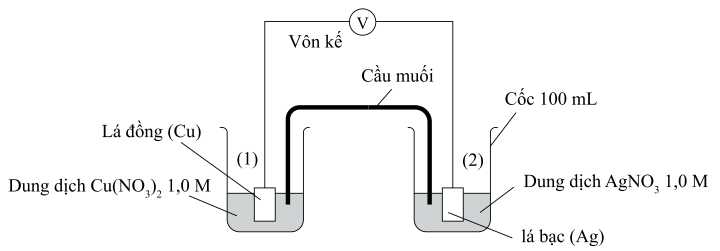
Khi pha loãng dung dịch AgNO3 tới nồng độ 0,5 M ở điện cực 2 và giữ nguyên nồng độ CuSO4 ở điện cực 1 thì thấy giá trị trên vôn kế giảm. Biết thế khử chuẩn của các điện cực:
Ag+(aq) + 1e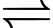 Ag(s);
Ag(s); 
Cu2+(aq) + 2e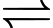 Cu(s);
Cu(s); 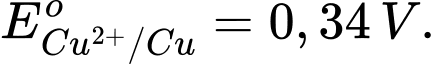

Khi pha loãng dung dịch AgNO3 tới nồng độ 0,5 M ở điện cực 2 và giữ nguyên nồng độ CuSO4 ở điện cực 1 thì thấy giá trị trên vôn kế giảm. Biết thế khử chuẩn của các điện cực:
Ag+(aq) + 1e
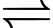 Ag(s);
Ag(s); 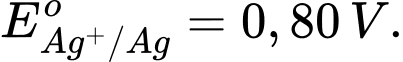
Cu2+(aq) + 2e
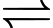 Cu(s);
Cu(s); 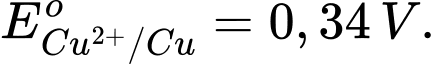
Ta có 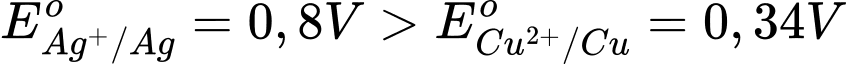
Trong pin galvani trên Ag đóng vai trò là cực dương (cathode)
Cu đóng vai trò là cực âm (anode)
Các quá trình xảy ra trong pin:
Cathode (+): Ag+ + 1e ⟶ Ag
Anode (-): Zn ⟶ Zn2+ + 2e
Phản ứng xảy ra: Zn + 2Ag+ ⟶ 2Ag + Zn2+
Phân tích các phát biểu:
✔️ (a) Đúng. Thế điện cực chuẩn của cặp Ag+/Ag (0,80) lớn hơn cặp Cu2+/Cu (0,34) nên Ag+ bị khử tại cathode.
❌ (b) Sai. Electron luôn di chuyển từ anode (Cu) sang cathode (Ag).
✔️ (c) Đúng. Cả CuSO4 1 M và Cu(NO3)2 1 M đều cung cấp ion Cu2+ với nồng độ như nhau nên không ảnh hưởng đến thế điện cực.
❌ (d) Sai. Khi pha loãng nồng độ AgNO3 thì giá trị trên vôn kế giảm nhưng nếu pha loãng nồng độ CuSO4 thì giá trị trên vôn kế lại tăng nên giả thuyết ban đầu “Nồng độ của ion kim loại trong dung dịch của bất kì điện cực nào giảm đều làm cho thế khử của điện cực đó giảm, dẫn đến sức điện động của pin giảm” là sai.
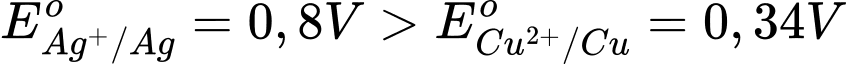
Trong pin galvani trên Ag đóng vai trò là cực dương (cathode)
Cu đóng vai trò là cực âm (anode)
Các quá trình xảy ra trong pin:
Cathode (+): Ag+ + 1e ⟶ Ag
Anode (-): Zn ⟶ Zn2+ + 2e
Phản ứng xảy ra: Zn + 2Ag+ ⟶ 2Ag + Zn2+
Phân tích các phát biểu:
✔️ (a) Đúng. Thế điện cực chuẩn của cặp Ag+/Ag (0,80) lớn hơn cặp Cu2+/Cu (0,34) nên Ag+ bị khử tại cathode.
❌ (b) Sai. Electron luôn di chuyển từ anode (Cu) sang cathode (Ag).
✔️ (c) Đúng. Cả CuSO4 1 M và Cu(NO3)2 1 M đều cung cấp ion Cu2+ với nồng độ như nhau nên không ảnh hưởng đến thế điện cực.
❌ (d) Sai. Khi pha loãng nồng độ AgNO3 thì giá trị trên vôn kế giảm nhưng nếu pha loãng nồng độ CuSO4 thì giá trị trên vôn kế lại tăng nên giả thuyết ban đầu “Nồng độ của ion kim loại trong dung dịch của bất kì điện cực nào giảm đều làm cho thế khử của điện cực đó giảm, dẫn đến sức điện động của pin giảm” là sai.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [704402]: Khi hoà tan hợp chất AgNO3 vào nước thì cation kim loại tồn tại trong dung dịch sẽ tạo thành phức chất aqua dạng tứ diện [Ag(OH2)m]+. Xác định số phối tử aqua (m) trong phức chất [Ag(OH2)m]+.
- Trong dung dịch, khi hòa tan hợp chất AgNO3 vào nước, ion Ag+ sẽ tương tác với phân tử nước để tạo thành phức chất aqua. Phức này có công thức là [Ag(H2O)m]+, trong đó m là số phân tử nước (phối tử aqua) gắn kết với ion Ag+.
- Ion bạc Ag+ có cấu trúc điện tử là [Kr]4d10 có thể tạo thành phức chất với các phân tử nước, với số phối tử (m) thường là 2 hoặc 4 trong trường hợp này.
- Đối với ion Ag+ trong dung dịch, nó có thể tạo ra phức tứ diện với 4 phân tử nước, tức là m = 4. Điều này xảy ra vì ion Ag+ có kích thước nhỏ và điện tích dương cao, có khả năng hút chặt các phân tử nước, tạo thành phức tứ diện ổn định. Do đó, số phối tử aqua (m) trong phức chất [Ag(H2O)m]+ là 4.
⇒ Điền đáp án: 4
- Ion bạc Ag+ có cấu trúc điện tử là [Kr]4d10 có thể tạo thành phức chất với các phân tử nước, với số phối tử (m) thường là 2 hoặc 4 trong trường hợp này.
- Đối với ion Ag+ trong dung dịch, nó có thể tạo ra phức tứ diện với 4 phân tử nước, tức là m = 4. Điều này xảy ra vì ion Ag+ có kích thước nhỏ và điện tích dương cao, có khả năng hút chặt các phân tử nước, tạo thành phức tứ diện ổn định. Do đó, số phối tử aqua (m) trong phức chất [Ag(H2O)m]+ là 4.
⇒ Điền đáp án: 4
Câu 24 [704403]: Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
(1) (C6H10O5)n (tinh bột) + nH2O nC6H12O6 (glucose)
nC6H12O6 (glucose)
(2) C6H12O6 (glucose) 2C2H5OH + 2CO2
2C2H5OH + 2CO2
(3) C6H12O6 (glucose) 2CH3CH(OH)COOH
2CH3CH(OH)COOH
(4) C6H12O6 (glucose) + 2[Ag(NH3)2]OH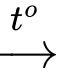 CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: lên men rượu, thủy phân, lên men lactic, tráng gương và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321,…).
(1) (C6H10O5)n (tinh bột) + nH2O
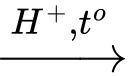 nC6H12O6 (glucose)
nC6H12O6 (glucose)(2) C6H12O6 (glucose)
 2C2H5OH + 2CO2
2C2H5OH + 2CO2(3) C6H12O6 (glucose)
 2CH3CH(OH)COOH
2CH3CH(OH)COOH(4) C6H12O6 (glucose) + 2[Ag(NH3)2]OH
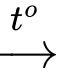 CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.Gán số thứ tự phương trình hoá học của các phản ứng theo tên gọi: lên men rượu, thủy phân, lên men lactic, tráng gương và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321,…).
Tên gọi của các phản ứng là:
(1) Phản ứng thủy phân tinh bột: mô tả sự thủy phân tinh bột thành glucose (C6H12O6) với sự có mặt của nước.
Phản ứng: (C6H10O5)n (tinh bột) + nH2O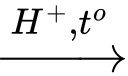 nC6H12O6 (glucose)
nC6H12O6 (glucose)
(2) Phản ứng lên men rượu: mô tả quá trình lên men glucose thành ethanol và CO2 dưới tác dụng của enzyme.
Phản ứng: C6H12O6 (glucose) 2C2H5OH + 2CO2
2C2H5OH + 2CO2
(3) Phản ứng lên men lactic acid: mô tả quá trình lên men glucose thành lactic acid (CH3CH(OH)COOH) dưới tác dụng của enzyme.
Phản ứng: C6H12O6 (glucose) 2CH3CH(OH)COOH
2CH3CH(OH)COOH
(4) Phản ứng tráng gương: là phản ứng giữa glucose và dung dịch Ag(NH3)2OH, trong đó Ag được tạo thành, thể hiện phản ứng tráng gương.
Phản ứng: C6H12O6 (glucose) + 2[Ag(NH3)2]OH CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
⇒ Thứ tự lần lượt ứng với các tên gọi phản ứng lên men rượu, thủy phân, lên men lactic, tráng gương là: 2134
⇒ Điền đáp án: 2134
(1) Phản ứng thủy phân tinh bột: mô tả sự thủy phân tinh bột thành glucose (C6H12O6) với sự có mặt của nước.
Phản ứng: (C6H10O5)n (tinh bột) + nH2O
 nC6H12O6 (glucose)
nC6H12O6 (glucose)(2) Phản ứng lên men rượu: mô tả quá trình lên men glucose thành ethanol và CO2 dưới tác dụng của enzyme.
Phản ứng: C6H12O6 (glucose)
 2C2H5OH + 2CO2
2C2H5OH + 2CO2(3) Phản ứng lên men lactic acid: mô tả quá trình lên men glucose thành lactic acid (CH3CH(OH)COOH) dưới tác dụng của enzyme.
Phản ứng: C6H12O6 (glucose)
 2CH3CH(OH)COOH
2CH3CH(OH)COOH(4) Phản ứng tráng gương: là phản ứng giữa glucose và dung dịch Ag(NH3)2OH, trong đó Ag được tạo thành, thể hiện phản ứng tráng gương.
Phản ứng: C6H12O6 (glucose) + 2[Ag(NH3)2]OH
 CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.
CH2OH(CHOH)4COONH4 + 2Ag + 3NH3 + H2O.⇒ Thứ tự lần lượt ứng với các tên gọi phản ứng lên men rượu, thủy phân, lên men lactic, tráng gương là: 2134
⇒ Điền đáp án: 2134
Câu 25 [704404]: Phân tử khối của pentapeptide mạch hở Ala-Ala-Val-Val-Gly Là bao nhiêu?
Phân tử khối của pentapeptide mạch hở Ala-Ala-Val-Val-Gly là:
M = 89 × 2 + 117 × 2 + 75 – 4 × 18 = 415 (gam/mol)
⇒ Điền đáp án: 415
M = 89 × 2 + 117 × 2 + 75 – 4 × 18 = 415 (gam/mol)
⇒ Điền đáp án: 415
Câu 26 [704405]: Hydrogen cũng là một trong những loại nhiên liệu có nhiều hữu ích trong ngành hàng không. Hydrogen có thể được điều chế từ ethanol. Ethanol có thể thu được bằng cách lên men ngô. Sơ đồ dưới đây biểu diễn quá trình chuyển hóa:
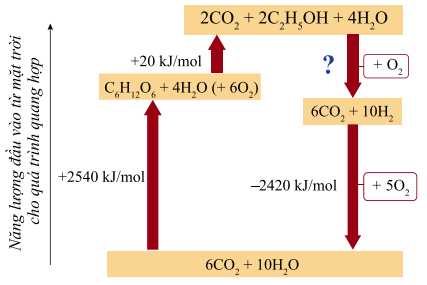
Biến thiên enthalpy khi chuyển đổi ethanol thành hydrogen trong biểu đồ trên là bao nhiêu kJ?

Biến thiên enthalpy khi chuyển đổi ethanol thành hydrogen trong biểu đồ trên là bao nhiêu kJ?
Từ sơ đồ biểu diễn quá trình chuyển hóa, ta thấy tổng năng lượng để điều chế hydrogen từ ethanol với tổng năng lượng khi lên men ngô để thu được ethanol bằng 0. Ta có:
2540 + 20 + ΔHo + (-2420)
⟶ ΔHo = 2540 + 20 + (-2420) = -140 (kJ)
⇒ Điền đáp án: -140
2540 + 20 + ΔHo + (-2420)
⟶ ΔHo = 2540 + 20 + (-2420) = -140 (kJ)
⇒ Điền đáp án: -140
Câu 27 [704406]: Benzyl salicylate được sử dụng làm chất cố định nước hoa, các sản phẩm khử mùi, kem chống nắng… Benzyl salicylate được điều chế bằng phản ứng giữa salicylic acid và benzyl alcohol theo phản ứng sau:
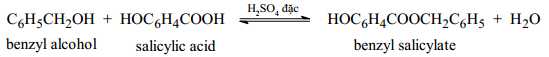
Để sản xuất 4000 (Lít) benzyl salicylate nguyên chất (D=1,17 g/mL) thì cần tối thiểu bao nhiêu (Lít) benzyl alcohol nguyên chất (D=1,04 g/mL), biết hiệu suất phản ứng tính theo benzyl alcohol là 80%? (kết quả làm tròn đến đến số nguyên hàng đơn vị)
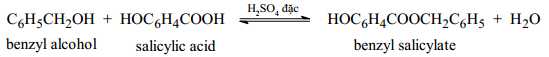
Để sản xuất 4000 (Lít) benzyl salicylate nguyên chất (D=1,17 g/mL) thì cần tối thiểu bao nhiêu (Lít) benzyl alcohol nguyên chất (D=1,04 g/mL), biết hiệu suất phản ứng tính theo benzyl alcohol là 80%? (kết quả làm tròn đến đến số nguyên hàng đơn vị)
Gọi thể tích tối thiểu của benzyl alcohol nguyên chất (D=1,04 g/mL=1,04kg/L) để sản xuất 4000 (Lít) benzyl salicylate nguyên chất (D=1,17 g/mL = 1,17 kg/L) là V (L)
→ mbenzyl alcohol = D × V =1,04V (kg) → nbenzyl alcohol = 1,04V ÷ 108 (kmol) = nbenzyl salicylate
Ta có: mbenzyl salicylate = nbenzyl salicylate × Mbenzyl salicylate × 80%
Mà mbenzyl salicylate = D × V = 4000 × 1,17 = 4680 (kg)
Hay mbenzyl salicylate = (1,04V ÷ 108) × 228 × 80% = 4680 (kg)
→ V = 2664,47 ≈ 2664 (L)
⇒ Điền đáp án: 2664
→ mbenzyl alcohol = D × V =1,04V (kg) → nbenzyl alcohol = 1,04V ÷ 108 (kmol) = nbenzyl salicylate
Ta có: mbenzyl salicylate = nbenzyl salicylate × Mbenzyl salicylate × 80%
Mà mbenzyl salicylate = D × V = 4000 × 1,17 = 4680 (kg)
Hay mbenzyl salicylate = (1,04V ÷ 108) × 228 × 80% = 4680 (kg)
→ V = 2664,47 ≈ 2664 (L)
⇒ Điền đáp án: 2664
Câu 28 [704407]: C60600 là hợp kim của đồng và nhôm. Phản ứng sau đây có thể được sử dụng để xác định hàm lượng Cu trong C60600.
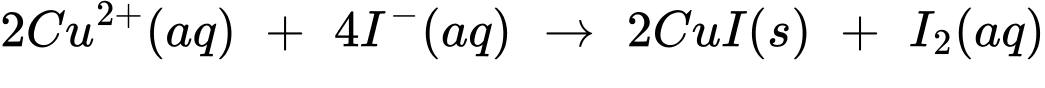
Quy trình được thực hiện như sau:
Bước 1. Hoà tan 0,5 g mẫu hợp kim C60600 trong sulfuric acid đặc, rồi pha loãng bằng nước;
Bước 2. Thêm dung dịch I- đến dư.
Bước 3. Thêm dần dung dịch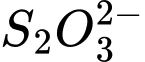 0,50 M để phản ứng với iodine theo phản ứng sau:
0,50 M để phản ứng với iodine theo phản ứng sau:
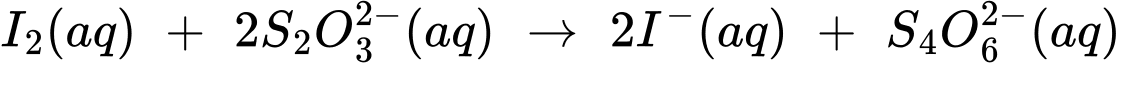
Thể tích dung dịch cần dùng để phản ứng trên xảy ra vừa đủ là 14,85 mL. Hàm lượng phần trăm khối lượng Cu trong mẫu hợp kim C60600 là bao nhiêu? (làm tròn kết quả đến phần chục).
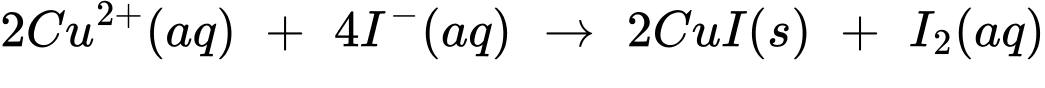
Quy trình được thực hiện như sau:
Bước 1. Hoà tan 0,5 g mẫu hợp kim C60600 trong sulfuric acid đặc, rồi pha loãng bằng nước;
Bước 2. Thêm dung dịch I- đến dư.
Bước 3. Thêm dần dung dịch
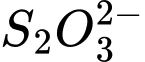 0,50 M để phản ứng với iodine theo phản ứng sau:
0,50 M để phản ứng với iodine theo phản ứng sau: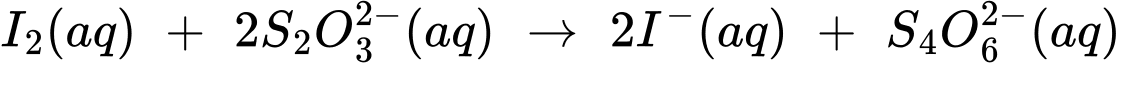
Thể tích dung dịch cần dùng để phản ứng trên xảy ra vừa đủ là 14,85 mL. Hàm lượng phần trăm khối lượng Cu trong mẫu hợp kim C60600 là bao nhiêu? (làm tròn kết quả đến phần chục).
(1) 2Cu2+(aq) + 4I–(aq) ⟶ 2CuI(s) + I2(aq)
(2) I2(aq) + 2S2O32–(aq) ⟶ 2I– + S4O62–(aq)
Đổi 14,85 mL = 0,01485 L
Số mol của Na2S2O3 là: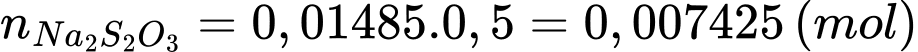
Từ phương trình (1) và (2) số mol của Cu là: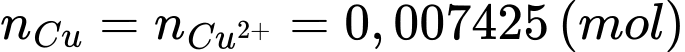
Phần trăm của Cu trong mẫu hợp kim C60600 là:
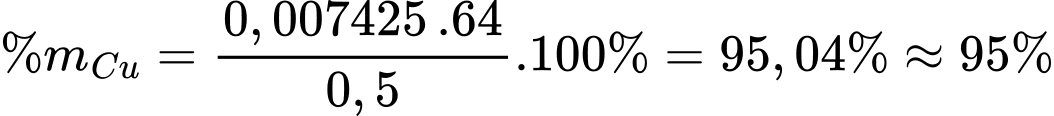
⇒ Điền đáp án: 95,0
(2) I2(aq) + 2S2O32–(aq) ⟶ 2I– + S4O62–(aq)
Đổi 14,85 mL = 0,01485 L
Số mol của Na2S2O3 là:
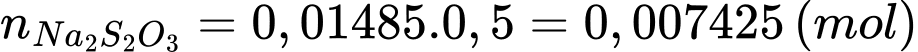
Từ phương trình (1) và (2) số mol của Cu là:
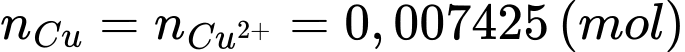
Phần trăm của Cu trong mẫu hợp kim C60600 là:
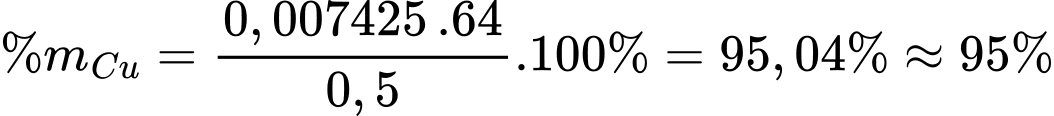
⇒ Điền đáp án: 95,0