PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705396]: Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính oxi hóa của dạng oxi hóa càng …(1)… và tính khử của dạng khử càng …(2)… Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, mạnh, yếu.
B, yếu, mạnh.
C, mạnh, mạnh.
D, yếu, yếu.
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính oxi hóa của dạng oxi hóa càng mạnh và tính khử của dạng khử càng yếu.
Giải thích:
Dựa vào đặc điểm của thế điện cực chuẩn, thế điện cực chuẩn càng lớn:
+) Dạng oxi hóa (chất nhận electron) có tính oxi hóa mạnh hơn, vì dễ dàng nhận electron.
+) Dạng khử (chất cho electron) có tính khử yếu hơn, vì khó nhường electron.
⇒ Chọn đáp án A Đáp án: A
Giải thích:
Dựa vào đặc điểm của thế điện cực chuẩn, thế điện cực chuẩn càng lớn:
+) Dạng oxi hóa (chất nhận electron) có tính oxi hóa mạnh hơn, vì dễ dàng nhận electron.
+) Dạng khử (chất cho electron) có tính khử yếu hơn, vì khó nhường electron.
⇒ Chọn đáp án A Đáp án: A
Câu 2 [705397]: Trước khi đi thi đấu các môn thể thao, các vận động viên thường xoa một ít magnesium carbonate dưới dạng bột mịn màu trắng làm tăng ma sát và hút ẩm. Công thức của magnesium carbonate là
A, MgCO3.
B, MgCl2.
C, MnCO3.
D, MnCO.
Magnesium carbonate là một muối được tạo thành từ ion Mg2+ (magnesium) và ion CO3− (carbonate).
Magnesium carbonate, thường được gọi là phấn rôm, được sử dụng như một chất làm khô mồ hôi tay cho các vận động viên leo núi đá, thể dục dụng cụ, và cử tạ để tăng ma sát và hút ẩm, giúp tay không bị trơn trượt khi thi đấu.
⇒ Chọn đáp án A Đáp án: A
Magnesium carbonate, thường được gọi là phấn rôm, được sử dụng như một chất làm khô mồ hôi tay cho các vận động viên leo núi đá, thể dục dụng cụ, và cử tạ để tăng ma sát và hút ẩm, giúp tay không bị trơn trượt khi thi đấu.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [310467]: PVC là chất rắn vô định hình, cách điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa,...PVC được tổng hợp trực tiếp từ monomer là
A, acrylonitrile.
B, vinyl chloride.
C, vinyl acetate.
D, propylene.
PVC hay Poly(vinyl chloride) là [-CH2-CH(Cl)-]n được điều chế từ monomer là vinyl chloride CH2=CH-Cl.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 4 [243475]: Khi nguyên tử sodium và nguyên tử chlorine tác dụng với nhau tạo hợp chất thì
A, năng lượng được giải phóng và liên kết ion được hình thành.
B, năng lượng được giải phóng và liên kết cộng hóa trị được hình thành.
C, năng lượng được hấp thụ và liên kết ion được hình thành.
D, năng lượng được hấp thụ và liên kết cộng hóa trị được hình thành.
Nguyên tử Na nhường 1e cho nguyên tử Cl để biến thành ion dương Na+
Na → Na+ + 1e
Mỗi nguyên tử Cl nhận 1e để biến thành ion âm Cl–
Cl + 1e → Cl–
Phản ứng hóa học: 2Na(s) + Cl2 (g)→ 2NaCl(s)
⇒ Khi nguyên tử sodium và nguyên tử chlorine tác dụng với nhau tạo hợp chất thì năng lượng được giải phóng và liên kết ion được hình thành.
⇒ Chọn đáp án A Đáp án: A
Na → Na+ + 1e
Mỗi nguyên tử Cl nhận 1e để biến thành ion âm Cl–
Cl + 1e → Cl–
Phản ứng hóa học: 2Na(s) + Cl2 (g)→ 2NaCl(s)
⇒ Khi nguyên tử sodium và nguyên tử chlorine tác dụng với nhau tạo hợp chất thì năng lượng được giải phóng và liên kết ion được hình thành.
⇒ Chọn đáp án A Đáp án: A
Câu 5 [560649]: Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch nào sau đây?
A, Cu(NO3)2.
B, Zn(NO3)2.
C, Sn(NO3)2.
D, AgNO3.
Zn và Sn bị oxi hóa bởi cation của kim loại đứng sau nó trong dãy điện hóa
⇒ Chọn dung dịch Cu(NO3)2.
Mặc dù dung dịch AgNO3 cũng có thể hòa tan kim loại Zn và Sn lẫn trong bột đồng. Nhưng phản ứng này lại tạo ra kim loại Ag ⇒ không thu được đồng tinh khiết.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn dung dịch Cu(NO3)2.
Mặc dù dung dịch AgNO3 cũng có thể hòa tan kim loại Zn và Sn lẫn trong bột đồng. Nhưng phản ứng này lại tạo ra kim loại Ag ⇒ không thu được đồng tinh khiết.
⇒ Chọn đáp án A Đáp án: A
Câu 6 [705398]: Ngoài Fe và C, thép không gỉ thường chứa thêm thành phần nào sau đây?
A, Mn, Mg.
B, Mg, Al.
C, Cr, Ni.
D, Li, Ti.
Thép không gỉ hay còn gọi là inox, là loại hợp kim có thành phần chính là sắt và carbon, tỉ lệ carbon thường từ 0,02 - 2,14%. Ngoài ra nó còn chứa từ 10,5% Chromnium và các thành phần khác như Nickel, Biobium,…
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 7 [186545]: Trong số các chất sau, chất nào vừa là muối ammonium vừa là muối nitrate?
A, KNO3.
B, NH4Cl.
C, NH4NO3.
D, CuCl2.
Muối ammonium có chứa ion NH4+
Muối nitrate có chứa ion NO3-.
Chất nào vừa là muối ammonium vừa là muối nitrate thì phải chứa cả hai ion trên .
Đáp án C Đáp án: C
Muối nitrate có chứa ion NO3-.
Chất nào vừa là muối ammonium vừa là muối nitrate thì phải chứa cả hai ion trên .
Đáp án C Đáp án: C
Câu 8 [705400]: Trên phổ MS của hai chất nào sau đây có cùng giá trị m/z của ion phân tử [M+]?
A, C2H5OH và HCOOCH3.
B, HCHO và CH3CHO.
C, C4H10 và CH3COCH3.
D, CH3OCH3 và CH3CHO.
❌ A. C2H5OH và HCOOCH3 có phân tử khối lần lượt là 46 và 60 g/mol.
❌ B. HCHO và CH3CHO có phân tử khối lần lượt là 30 và 44 g/mol.
✔️ C. C4H10 và CH3COCH3 có phân tử khối là 58 g/mol.
❌ D. CH3OCH3 và CH3CHO có phân tử khối lần lượt là 46 và 44 g/mol.
⇒ Chọn đáp án C Đáp án: C
❌ B. HCHO và CH3CHO có phân tử khối lần lượt là 30 và 44 g/mol.
✔️ C. C4H10 và CH3COCH3 có phân tử khối là 58 g/mol.
❌ D. CH3OCH3 và CH3CHO có phân tử khối lần lượt là 46 và 44 g/mol.
⇒ Chọn đáp án C Đáp án: C
Câu 9 [305721]: Thủy phân tristearin ((C17H35COO)3C3H5) trong dung dịch KOH, thu được muối có công thức là
A, CH3COOK.
B, C17H33COOK.
C, C2H5COOK.
D, C17H35COOK.
Phản ứng tổng quát:
(RCOO)3C3H5 + 3KOH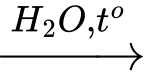 3RCOOK + C3H5(OH)3.
3RCOOK + C3H5(OH)3.
Ở câu hỏi này: (RCOO)3C3H5 = (C17H35COO)3C3H5
⇒ R = C17H35COO ⇒ Ngoài glycerol: C3H5(OH)3 thì muối tương ứng thu được có dạng RCOONa = C17H35COOK
⇒ Chọn đáp án D Đáp án: D
(RCOO)3C3H5 + 3KOH
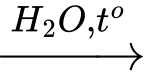 3RCOOK + C3H5(OH)3.
3RCOOK + C3H5(OH)3.Ở câu hỏi này: (RCOO)3C3H5 = (C17H35COO)3C3H5
⇒ R = C17H35COO ⇒ Ngoài glycerol: C3H5(OH)3 thì muối tương ứng thu được có dạng RCOONa = C17H35COOK
⇒ Chọn đáp án D Đáp án: D
Câu 10 [705401]: Chất tẩy rửa thông cống ăn mòn thường chứa trong thành phần một chất base mạnh như sodium hydroxide. Khi trộn với nước, sodium hydroxide rắn hòa tan, giải phóng một lượng nhiệt đáng kể và tạo ra dung dịch NaOH nóng. Dung dịch này làm tan mỡ, chất thường liên quan đến tắc nghẽn và chuyển đổi một số phân tử mỡ thành các phân tử xà phòng. Dung dịch NaOH cũng hòa tan các sợi protein trong tóc, một thành phần phổ biến khác làm đường ống bị tắc. Một số chất thông cống cũng kết hợp các mảnh nhôm nhỏ. Nhôm hòa tan trong dung dịch NaOH và tạo ra khí X. Khí sủi bọt giúp đánh bật các cục tắc nghẽn về mặt vật lý. Ngoài ra các chất tẩy rửa thông cống chứa dung dịch NaOH cũng có tính ăn mòn mạnh.
Cho các phát biểu sau
(a) Quá trình hòa tan NaOH vào nước có giá trị biến thiên enthalpy âm.
(b) Phân tử mỡ tác dụng với NaOH sinh ra các phân tử xà phòng có dạng RCOONa.
(c) Khí X được sinh ra khi cho nhôm tác dụng với dung dịch NaOH là khí oxygen.
(d) Khi sử dụng tẩy rửa thông cống cần sử dụng găng tay cao su để bao vệ tay.
Số phát biểu đúng là
Cho các phát biểu sau
(a) Quá trình hòa tan NaOH vào nước có giá trị biến thiên enthalpy âm.
(b) Phân tử mỡ tác dụng với NaOH sinh ra các phân tử xà phòng có dạng RCOONa.
(c) Khí X được sinh ra khi cho nhôm tác dụng với dung dịch NaOH là khí oxygen.
(d) Khi sử dụng tẩy rửa thông cống cần sử dụng găng tay cao su để bao vệ tay.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) Đúng. Quá trình hòa tan NaOH giải phóng một lượng nhiệt đáng kể và tạo ra dung dịch NaOH nóng, nên có giá trị enthalpy âm.
✔️ (b) Đúng. Chất béo là triester (ester 3 chức) của glycerol với các acid béo, công thức chung có dạng (RCOO)3C3H5
(RCOO)3C3H5 + 3NaOH ⟶ 3RCOONa + C3H5(OH)3
❌ (c) Sai. Phản ứng của NaOH với Al sinh ra khí H2.
2NaOH + 2Al + 2H2O ⟶ 2NaAlO2 + 3H2
✔️ (d) Đúng. Trong chất tẩy rửa chứa NaOH có khả năng ăn mòn da nên cần có găng tay bảo vệ.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Quá trình hòa tan NaOH giải phóng một lượng nhiệt đáng kể và tạo ra dung dịch NaOH nóng, nên có giá trị enthalpy âm.
✔️ (b) Đúng. Chất béo là triester (ester 3 chức) của glycerol với các acid béo, công thức chung có dạng (RCOO)3C3H5
(RCOO)3C3H5 + 3NaOH ⟶ 3RCOONa + C3H5(OH)3
❌ (c) Sai. Phản ứng của NaOH với Al sinh ra khí H2.
2NaOH + 2Al + 2H2O ⟶ 2NaAlO2 + 3H2
✔️ (d) Đúng. Trong chất tẩy rửa chứa NaOH có khả năng ăn mòn da nên cần có găng tay bảo vệ.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
Câu 11 [705402]: Để tìm hiểu cơ chế của phản ứng thủy phân ester trong môi trường acid. Một thí nghiệm đã được thực hiện như sau:
∎ Bước 1: Điều chế ethyl benzoate được làm giàu bằng đồng vị oxygen-18 trong nguyên tử oxygen của nhóm C=O.
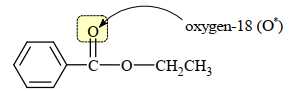
Sửa ảnh: Chuyển O-18 thành O của nhóm C=O.
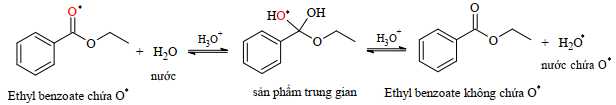
■ Bước 2: Tiến hành thủy phân ester bằng xúc tác acid trong nước không chứa đồng vị oxygen-18. Nếu dừng thí nghiệm sau khi thủy phân một phần và cô lập phần ester còn lại, thì trong lượng ester bị thu hồi, những phân tử ethyl benzoate được làm giàu oxygen-18 đã bị mất đi. Nói cách khác, một số trao đổi đã xảy ra giữa nguyên tử đồng vị oxygen-18 của ester và nguyên tử oxygen-16 của nước.
Dấu hiệu nào cho thấy nguyên tử đồng vị oxygen-18 của ester có sự trao đổi với nguyên tử oxygen-16 của nước?
∎ Bước 1: Điều chế ethyl benzoate được làm giàu bằng đồng vị oxygen-18 trong nguyên tử oxygen của nhóm C=O.

Sửa ảnh: Chuyển O-18 thành O của nhóm C=O.
■ Bước 2: Tiến hành thủy phân ester bằng xúc tác acid trong nước không chứa đồng vị oxygen-18. Nếu dừng thí nghiệm sau khi thủy phân một phần và cô lập phần ester còn lại, thì trong lượng ester bị thu hồi, những phân tử ethyl benzoate được làm giàu oxygen-18 đã bị mất đi. Nói cách khác, một số trao đổi đã xảy ra giữa nguyên tử đồng vị oxygen-18 của ester và nguyên tử oxygen-16 của nước.

Dấu hiệu nào cho thấy nguyên tử đồng vị oxygen-18 của ester có sự trao đổi với nguyên tử oxygen-16 của nước?
A, Những phân tử ethyl benzoate được làm giàu oxygen-18 đã bị mất đi.
B, Ethyl benzoate được làm giàu bằng oxygen-18 trong nhóm C=O.
C, Thủy phân ester bằng xúc tác acid trong nước có chứa đồng vị oxygen-16.
D, Phản ứng thuỷ phân ester đã được xảy ra hoàn toàn.
- Để xác định sự trao đổi giữa nguyên tử oxygen-18 của ester và oxygen-16 của nước, cần tìm dấu hiệu cho thấy sự hiện diện của oxygen-18 trong sản phẩm.
- Quá trình thủy phân ester xảy ra trong nước có chứa đồng vị oxygen-16, điều này chứng tỏ rằng có sự trao đổi giữa ester và nước.
⇒ Chọn đáp án A Đáp án: A
- Quá trình thủy phân ester xảy ra trong nước có chứa đồng vị oxygen-16, điều này chứng tỏ rằng có sự trao đổi giữa ester và nước.
⇒ Chọn đáp án A Đáp án: A
Câu 12 [308288]: Glucose, một chất còn được gọi là đường huyết có công thức phân tử C6H12O6. Công thức đơn giản nhất của glucose là
A, CH2O2.
B, CH2O.
C, CHO2.
D, C2HO.
HD: Phân tích toán học đơn giản: C6H12O6 = 6(CH2O) ⇒ công thức đơn giản nhất của glucose là CH2O
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 13 [705403]: Trong môi trường acid mạnh, glycine tồn tại chủ yếu ở dạng nào sau đây?
A, H2N-CH2-COO-.
B, H2N-CH2-COOH.
C, +H3N-CH2-COO-.
D, +H3N-CH2-COOH.
Glycine (H2N–CH2–COOH) là một amino acid với nhóm –COOH (acid) và –NH2 (base yếu). Trong môi trường acid mạnh:
+) Acid mạnh tạo ra nhiều H+, làm proton hóa (gắn thêm H+) nhóm –NH2, biến nó thành –NH3+.
+) Nhóm –COOH (acid yếu) không bị phân li trong môi trường acid mạnh.
Dạng chủ yếu của glycine là: +H3N-CH2-COOH.
⇒ Chọn đáp án D Đáp án: D
+) Acid mạnh tạo ra nhiều H+, làm proton hóa (gắn thêm H+) nhóm –NH2, biến nó thành –NH3+.
+) Nhóm –COOH (acid yếu) không bị phân li trong môi trường acid mạnh.
Dạng chủ yếu của glycine là: +H3N-CH2-COOH.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [304106]: Tên gọi của ester HCOOC2H5 là
A, Ethyl acetate.
B, Methyl formate.
C, Methyl acetate.
D, Ethyl formate.
HD: Cấu tạo HCOOC2H5 gồm:
• gốc acid: HCOO có tên là formate;
• gốc hydrocarbon C2H5 có tên là ethyl.
⇝ tên gọi tương ứng: ethyl formate
⇒ Chọn đáp án D Đáp án: D
• gốc acid: HCOO có tên là formate;
• gốc hydrocarbon C2H5 có tên là ethyl.
⇝ tên gọi tương ứng: ethyl formate
⇒ Chọn đáp án D Đáp án: D
Câu 15 [705404]: “Tinh bột là ...(1)... thiên nhiên, gồm amylose và amylopectin, có công thức phân tử là ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, peptide, (C6H10O5)n.
B, protein, C12H22O11.
C, enzyme, C12H22O11.
D, polymer, (C6H10O5)n.
Tinh bột là polymer thiên nhiên, gồm amylose và amylopectin, có công thức phân tử là (C6H10O5)n.
Giải thích:
(1) Tinh bột là một polymer tự nhiên, được tạo thành từ nhiều đơn vị glucose liên kết với nhau.
(2): (C6H10O5)n là công thức chung của tinh bột, biểu thị một chuỗi dài các đơn vị glucose được liên kết qua liên kết glycosidic.
⇒ Chọn đáp án D Đáp án: D
Giải thích:
(1) Tinh bột là một polymer tự nhiên, được tạo thành từ nhiều đơn vị glucose liên kết với nhau.
(2): (C6H10O5)n là công thức chung của tinh bột, biểu thị một chuỗi dài các đơn vị glucose được liên kết qua liên kết glycosidic.
⇒ Chọn đáp án D Đáp án: D
Câu 16 [705405]: Papain là enzyme có tác dụng thuỷ phân protein, có nhiều trong quả đu đủ. Enzyme papain rất tốt cho hệ tiêu hóa, giúp tiêu hóa các thức ăn giàu protein một cách dễ dàng hơn.
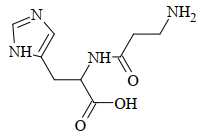
Cho các phát biểu sau:
(a) Thịt được ướp với nước ép đu đủ thì khi nấu sẽ nhanh mềm hơn.
(b) Trong phân tử papain, số nguyên tử carbon gấp 3 lần số nguyên tử oxygen.
(c) Thủy phân papain trong môi trường base, thu được hai muối của hai α-amino acid.
(d) Thủy phân hoàn toàn a mol papain trong dung dịch HCl thì số mol HCl phản ứng là 4a.
(e) Phân tử papain có chứa nhóm chức amine, carboxylic acid và peptide.
Số phát biểu đúng là

Cho các phát biểu sau:
(a) Thịt được ướp với nước ép đu đủ thì khi nấu sẽ nhanh mềm hơn.
(b) Trong phân tử papain, số nguyên tử carbon gấp 3 lần số nguyên tử oxygen.
(c) Thủy phân papain trong môi trường base, thu được hai muối của hai α-amino acid.
(d) Thủy phân hoàn toàn a mol papain trong dung dịch HCl thì số mol HCl phản ứng là 4a.
(e) Phân tử papain có chứa nhóm chức amine, carboxylic acid và peptide.
Số phát biểu đúng là
A, 4.
B, 3.
C, 2.
D, 5.
Phân tích các phát biểu:
✔️ (a) Đúng. Papain trong đu đủ có khả năng thủy phân protein trong thịt, nên thịt được ướp với nước ép rau củ sẽ mềm hơn.
✔️ (b) Đúng. Công thức phân tử của papain C9H14N4O3 với 9 nguyên tử C và 3 nguyên tử O.
❌ (c) Sai. Khi thủy phân papain chỉ thu được 1 muối của α-amino acid.
Papain được tạo từ 2 amino acid sau:
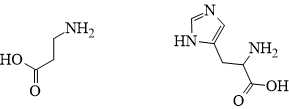
❌ (d) Sai. Nhóm NH trong vòng có cặp electron của nguyên tử N bị liên hợp vào vòng tạo thành hệ thơm rồi nên mất tính base, do đó chỉ còn các nguyên tử N còn lại tác dụng với HCl nên số mol HCl phản ứng là 3a do tỉ lệ phản ứng 1:3.
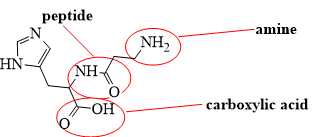
✔️ (e) Đúng. Phân tử papain có chứa nhóm chức amine, carboxylic acid và peptide ở các vị trí sau:
Các phát biểu đúng là (a) (b) (e)
⇒ Chọn đáp án B Đáp án: B
✔️ (a) Đúng. Papain trong đu đủ có khả năng thủy phân protein trong thịt, nên thịt được ướp với nước ép rau củ sẽ mềm hơn.
✔️ (b) Đúng. Công thức phân tử của papain C9H14N4O3 với 9 nguyên tử C và 3 nguyên tử O.
❌ (c) Sai. Khi thủy phân papain chỉ thu được 1 muối của α-amino acid.
Papain được tạo từ 2 amino acid sau:
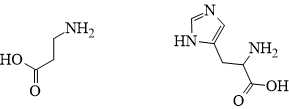
❌ (d) Sai. Nhóm NH trong vòng có cặp electron của nguyên tử N bị liên hợp vào vòng tạo thành hệ thơm rồi nên mất tính base, do đó chỉ còn các nguyên tử N còn lại tác dụng với HCl nên số mol HCl phản ứng là 3a do tỉ lệ phản ứng 1:3.
✔️ (e) Đúng. Phân tử papain có chứa nhóm chức amine, carboxylic acid và peptide ở các vị trí sau:

Các phát biểu đúng là (a) (b) (e)
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
X, Y, Z là ba kim loại có đặc điểm như sau: X có thể tác dụng với dung dịch muối nitrate của Y giải phóng Y; Z phản ứng với nước ở điều kiện thường tạo ra hydrogen; X chỉ phản ứng nước ở thể hơi ở nhiệt độ cao, giải phóng hydrogen.
Câu 17 [705406]: Các kim loại X, Y, Z lần lượt có thể là các kim loại nào sau đây?
A, Cu, Zn, Na.
B, Na, Cu, Ca.
C, Zn, Cu, Ca.
D, Zn, Ca, Ag.
Z tác dụng với nước ở điều kiện thường
→ Mức độ hoạt động hóa học của các nguyên tố trong dãy hoạt động của kim loại là Y < X < Z.
+) Đáp án A không phù hợp là do Cu yếu hơn Zn nên X không thể là Cu
+) Đáp án B không phù hợp Na tác dụng với dung dịch muối Cu(NO3)2 không thu được kim loại Cu:
2Na + 2H2O → 2NaOH + H2
2NaOH + Cu(NO3)2 → 2NaNO3 + Cu(OH)2
+) Đáp án D không phù hợp do Zn yếu hơn Ca
+) Đáp án C phù hợp thỏa mãn các đặc điểm trên
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Ca + 2H2O → Ca(OH)2 + H2
⇒ Chọn đáp án C Đáp án: C
→ Mức độ hoạt động hóa học của các nguyên tố trong dãy hoạt động của kim loại là Y < X < Z.
+) Đáp án A không phù hợp là do Cu yếu hơn Zn nên X không thể là Cu
+) Đáp án B không phù hợp Na tác dụng với dung dịch muối Cu(NO3)2 không thu được kim loại Cu:
2Na + 2H2O → 2NaOH + H2
2NaOH + Cu(NO3)2 → 2NaNO3 + Cu(OH)2
+) Đáp án D không phù hợp do Zn yếu hơn Ca
+) Đáp án C phù hợp thỏa mãn các đặc điểm trên
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Ca + 2H2O → Ca(OH)2 + H2
⇒ Chọn đáp án C Đáp án: C
Câu 18 [705407]: Cho một miếng kim loại X vào 250 mL dung dịch muối nitrate của Y có nồng độ 0,2 M. Sau khi phản ứng xảy ra hoàn toàn, số mol kim loại X đã phản ứng là bao nhiêu?
A, 0,025 mol.
B, 0,1 mol.
C, 0,05 mol.
D, 0,075 mol.
Số mol của Cu(NO3)2 là: nCu(NO3)2 = 0,25 × 0,2 = 0,05 (mol)
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Từ phương trình hóa học số mol Zn đã phản ứng là:
nCu(NO3)2 = nZn = 0,05 (mol)
⇒ Chọn đáp án C Đáp án: C
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Từ phương trình hóa học số mol Zn đã phản ứng là:
nCu(NO3)2 = nZn = 0,05 (mol)
⇒ Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [308432]: Tiến hành thí nghiệm phản ứng của hồ tinh bột với iodine theo các bước sau đây:
Bước 1: Cho vài giọt dung dịch iodine vào ống nghiệm đựng sẵn 1 – 2 mL dung dịch hồ tinh bột (hoặc nhỏ vài giọt dung dịch iodine lên mặt cắt quả chuối xanh hoặc củ khoai lang tươi, sắn tươi).
Bước 2: Đun nóng dung dịch một lát, sau đó để nguội.
Bước 1: Cho vài giọt dung dịch iodine vào ống nghiệm đựng sẵn 1 – 2 mL dung dịch hồ tinh bột (hoặc nhỏ vài giọt dung dịch iodine lên mặt cắt quả chuối xanh hoặc củ khoai lang tươi, sắn tươi).
Bước 2: Đun nóng dung dịch một lát, sau đó để nguội.
HD: Phân tích thí nghiệm:

• Bước 1: dung dịch I2 là dung dịch có màu vàng nhạt, khi tương tác với hồ tinh bột sẽ tạo thành màu xanh tím đặc trưng. Giải thích: phân tử tinh bột có tạo mạch ở dạng xoắn có lỗ rỗng (giống như lò xo):

⇝ các phân tử iot có thể chui vào và bị hấp phụ, tạo “hợp chất” màu xanh tím.
• Bước 2: khi đun nóng, các phân tử tinh bột sẽ duỗi xoắn, không thể hấp phụ được iot nữa
⇝ màu xanh tím bị mất đi. Chú ý, bước 2 không làm iot bay hơi, thăng hoa hoàn toàn được.
• Sau đó: khi làm nguội, phân tử tinh bột trở lại dạng xoắn, các phân tử iot lại bị hấp phụ, chui vào lỗ rỗng xoắn thu được “hợp chất” màu xanh tím như sau bước 1.
⇒ Phân tích các phát biểu:
✔️ a. Đúng. Theo hiện tượng phân tích trên.
❌ b. Sai. Chuối chín không có tinh bột nữa (đã chuyển hóa thành các đường như glucose, fructose ⇒ chuối chín có vị ngọt).
✔️ c. Đúng. Theo phân tích trên.
✔️ d. Đúng. Theo phân tích trên.

• Bước 1: dung dịch I2 là dung dịch có màu vàng nhạt, khi tương tác với hồ tinh bột sẽ tạo thành màu xanh tím đặc trưng. Giải thích: phân tử tinh bột có tạo mạch ở dạng xoắn có lỗ rỗng (giống như lò xo):

⇝ các phân tử iot có thể chui vào và bị hấp phụ, tạo “hợp chất” màu xanh tím.
• Bước 2: khi đun nóng, các phân tử tinh bột sẽ duỗi xoắn, không thể hấp phụ được iot nữa
⇝ màu xanh tím bị mất đi. Chú ý, bước 2 không làm iot bay hơi, thăng hoa hoàn toàn được.
• Sau đó: khi làm nguội, phân tử tinh bột trở lại dạng xoắn, các phân tử iot lại bị hấp phụ, chui vào lỗ rỗng xoắn thu được “hợp chất” màu xanh tím như sau bước 1.
⇒ Phân tích các phát biểu:
✔️ a. Đúng. Theo hiện tượng phân tích trên.
❌ b. Sai. Chuối chín không có tinh bột nữa (đã chuyển hóa thành các đường như glucose, fructose ⇒ chuối chín có vị ngọt).
✔️ c. Đúng. Theo phân tích trên.
✔️ d. Đúng. Theo phân tích trên.
Câu 20 [705408]: Các đồ dùng được mạ bạc ngày càng phổ biến hơn, chúng giúp đồ dùng trở nên sáng bóng và sang trọng, đồng thời cũng sẽ bền hơn với các tác nhân oxi hóa. Một nhóm học sinh tiến hành mạ bạc một chiếc thìa theo sơ đồ dưới đây:
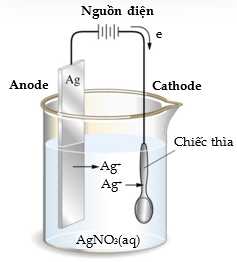
- Cân để xác định khối lượng ban đầu của chiếc thìa là 4,20 gam và thanh bạc là 10,15 gam.
- Nối chiếc thìa với một điện cực và thanh bạc với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch AgNO3 1,00 M.
Trong quá trình mạ, nồng độ dung dịch AgNO3 không đổi nên nhóm học sinh đã đưa ra giả thuyết: “Dung dịch AgNO3 là không cần thiết và có thể thay bằng nước, bổ sung thêm chất điện li như KNO3”.

- Cân để xác định khối lượng ban đầu của chiếc thìa là 4,20 gam và thanh bạc là 10,15 gam.
- Nối chiếc thìa với một điện cực và thanh bạc với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch AgNO3 1,00 M.
Trong quá trình mạ, nồng độ dung dịch AgNO3 không đổi nên nhóm học sinh đã đưa ra giả thuyết: “Dung dịch AgNO3 là không cần thiết và có thể thay bằng nước, bổ sung thêm chất điện li như KNO3”.
Theo sơ đồ mạ bạc một chiếc thìa trên:
+) Anode (cực dương): Là thanh bạc, tại đây xảy ra quá trình oxi hóa Ag(s) → Ag+ + 1e.
+) Cathode (cực âm): Là chiếc thìa, tại đây xảy ra quá trình khử Ag+ + 1e → Ag(s).
+) Dung dịch: Chứa AgNO3, cung cấp ion Ag+ cần thiết cho phản ứng khử ở cathode.
Phân tích các phát biểu:
✔️ a) Đúng. Tại anode (cực dương), xảy ra quá trình oxi hóa: Ag(s) → Ag+ + 1e.
✔️ b) Đúng. Trong quá trình mạ điện, thanh bạc bị oxi hóa thành ion Ag+ và tan vào dung dịch. Vì vậy, thanh bạc được gọi là dương cực tan.
✔️ c) Đúng. Sử dụng kim loại tinh khiết trong quá trình mạ để tăng độ bền của vật, tránh hiện tượng bong tróc lớp kim loại sau khi mạ. Trong thực tế còn tùy vào điều kiện kinh tế và mục đích mạ bạc nên có thể dùng các thanh bạc không tinh khiết nhưng trong quá trình này phải dùng bạc tinh khiết để thu được kết quả tối ưu.
✔️ d) Đúng. Trong quá trình mạ, ion Ag+ là yếu tố cần thiết để xảy ra phản ứng khử tại cathode (chiếc thìa): Ag+ + 1e → Ag(s).
Nếu thay dung dịch AgNO3 bằng nước và chất điện li như KNO3 sẽ không có ion Ag+ ban đầu để khử, làm quá trình mạ không thể khởi đầu.
+) Anode (cực dương): Là thanh bạc, tại đây xảy ra quá trình oxi hóa Ag(s) → Ag+ + 1e.
+) Cathode (cực âm): Là chiếc thìa, tại đây xảy ra quá trình khử Ag+ + 1e → Ag(s).
+) Dung dịch: Chứa AgNO3, cung cấp ion Ag+ cần thiết cho phản ứng khử ở cathode.
Phân tích các phát biểu:
✔️ a) Đúng. Tại anode (cực dương), xảy ra quá trình oxi hóa: Ag(s) → Ag+ + 1e.
✔️ b) Đúng. Trong quá trình mạ điện, thanh bạc bị oxi hóa thành ion Ag+ và tan vào dung dịch. Vì vậy, thanh bạc được gọi là dương cực tan.
✔️ c) Đúng. Sử dụng kim loại tinh khiết trong quá trình mạ để tăng độ bền của vật, tránh hiện tượng bong tróc lớp kim loại sau khi mạ. Trong thực tế còn tùy vào điều kiện kinh tế và mục đích mạ bạc nên có thể dùng các thanh bạc không tinh khiết nhưng trong quá trình này phải dùng bạc tinh khiết để thu được kết quả tối ưu.
✔️ d) Đúng. Trong quá trình mạ, ion Ag+ là yếu tố cần thiết để xảy ra phản ứng khử tại cathode (chiếc thìa): Ag+ + 1e → Ag(s).
Nếu thay dung dịch AgNO3 bằng nước và chất điện li như KNO3 sẽ không có ion Ag+ ban đầu để khử, làm quá trình mạ không thể khởi đầu.
Câu 21 [705409]: Tiến hành cho các kim loại kiềm lithium, sodium, potassium phản ứng với oxygen.
Quy trình tiến hành như sau:
∎ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
∎ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí oxygen.
∎ Bước 3: Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
Quy trình tiến hành như sau:
∎ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
∎ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí oxygen.
∎ Bước 3: Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí oxygen.
Phân tích các phát biểu:
✔️ (a) Đúng. Ở nhiệt độ thường hay nhiệt độ cao các kim loại kiềm tác dụng với oxygen tạo oxide base.
✔️ (b) Đúng. Kim loại kiềm hoạt động hóa học rất mạnh và có thể phản ứng với oxygen trong không khí ngay ở nhiệt độ thường.
Khi đốt trên ngọn lửa đèn cồn, phản ứng với oxygen trong không khí sẽ diễn ra trước khi đưa vào bình chứa oxygen nguyên chất.
✔️ (c) Đúng. Cho phần kim loại nóng chảy vào oxygen nguyên chất thì phản ứng mãnh liệt hơn do nồng độ oxygen cao hơn trong không khí dẫn đến phản ứng nhanh hơn.
✔️ (d) Đúng. Kim loại kiềm rất dễ phản ứng với oxygen và hơi nước trong không khí, đặc biệt khi kích thước mẩu kim loại quá nhỏ, diện tích tiếp xúc lớn. Do đó, kim loại có thể phản ứng hết trước khi đưa vào bình chứa khí oxygen.
✔️ (a) Đúng. Ở nhiệt độ thường hay nhiệt độ cao các kim loại kiềm tác dụng với oxygen tạo oxide base.
✔️ (b) Đúng. Kim loại kiềm hoạt động hóa học rất mạnh và có thể phản ứng với oxygen trong không khí ngay ở nhiệt độ thường.
Khi đốt trên ngọn lửa đèn cồn, phản ứng với oxygen trong không khí sẽ diễn ra trước khi đưa vào bình chứa oxygen nguyên chất.
✔️ (c) Đúng. Cho phần kim loại nóng chảy vào oxygen nguyên chất thì phản ứng mãnh liệt hơn do nồng độ oxygen cao hơn trong không khí dẫn đến phản ứng nhanh hơn.
✔️ (d) Đúng. Kim loại kiềm rất dễ phản ứng với oxygen và hơi nước trong không khí, đặc biệt khi kích thước mẩu kim loại quá nhỏ, diện tích tiếp xúc lớn. Do đó, kim loại có thể phản ứng hết trước khi đưa vào bình chứa khí oxygen.
Câu 22 [705410]: Có ba chất hữu cơ A, B và C là ba đồng phân cấu tạo của nhau. Trên phổ IR, A và B có tín hiệu đặc trưng ở vùng 1 740 – 1 670 cm–1; C có tín hiệu đặc trưng ở vùng 3 650 – 3 200 cm–1. A là hợp chất đơn chức và có phản ứng với thuốc thử Tollens, còn B thì không. Bằng các kĩ thuật phổ hiện đại, người ta thấy rằng trong phân tử của A có 6 nguyên tử hydrogen và 3 nguyên tử carbon.
Trên phổ IR, A và B có tín hiệu đặc trưng ở vùng 1 740 − 1 670 cm−1 nên A và B là hợp chất carbonyl.
C có tín hiệu đặc trưng ở vùng 3 650 − 3 200 cm−1 nên C là hợp chất alcohol. A là aldehyde đơn chức nên phân tử A chỉ có 1 nguyên tử oxygen. Vậy A, B và C có cùng công thức phân tử C3H6O.
Vì A là aldehyde và B là ketone nên A và B có công thức như sau:
A: CH3CH2CHO (propanal)
B: CH3COCH3 (acetone hay propanone)
C là alcohol nên C có công thức: CH2=CHCH2OH.
Phân tích các phát biểu:
✔️ a) Đúng. A, B, C là đồng phân cấu tạo nên chúng có cùng công thức phân tử.
✔️ b) Đúng. A là aldehyde (C=O), B là ketone (C=O). Cả hai đều có tín hiệu đặc trưng của liên kết C=O trong vùng 1 740 – 1 670 cm−1.
✔️ c) Đúng. C có công thức là CH2=CHCH2OH nên C có chứa 1 nhóm chức OH và 1 liên kết C=C.
❌ d) Sai. Khử C bằng H2 xúc tác Ni thu được CH3CH2CH2OH, sau đó oxi hóa bằng CuO sẽ thu được chất A là CH3CH2CHO
CH2=CHCH2OH + H2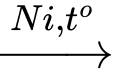 CH3CH2CH2OH
CH3CH2CH2OH
CH3CH2CH2OH + CuO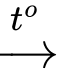 CH3CH2CHO + Cu + H2O
CH3CH2CHO + Cu + H2O
C có tín hiệu đặc trưng ở vùng 3 650 − 3 200 cm−1 nên C là hợp chất alcohol. A là aldehyde đơn chức nên phân tử A chỉ có 1 nguyên tử oxygen. Vậy A, B và C có cùng công thức phân tử C3H6O.
Vì A là aldehyde và B là ketone nên A và B có công thức như sau:
A: CH3CH2CHO (propanal)
B: CH3COCH3 (acetone hay propanone)
C là alcohol nên C có công thức: CH2=CHCH2OH.
Phân tích các phát biểu:
✔️ a) Đúng. A, B, C là đồng phân cấu tạo nên chúng có cùng công thức phân tử.
✔️ b) Đúng. A là aldehyde (C=O), B là ketone (C=O). Cả hai đều có tín hiệu đặc trưng của liên kết C=O trong vùng 1 740 – 1 670 cm−1.
✔️ c) Đúng. C có công thức là CH2=CHCH2OH nên C có chứa 1 nhóm chức OH và 1 liên kết C=C.
❌ d) Sai. Khử C bằng H2 xúc tác Ni thu được CH3CH2CH2OH, sau đó oxi hóa bằng CuO sẽ thu được chất A là CH3CH2CHO
CH2=CHCH2OH + H2
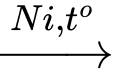 CH3CH2CH2OH
CH3CH2CH2OH
CH3CH2CH2OH + CuO
 CH3CH2CHO + Cu + H2O
CH3CH2CHO + Cu + H2O
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705411]: Khi vừa hoà tan phèn nhôm – kali có công thức K2SO4.Al2(SO4)3.24H2O vào nước thu được dung dịch chứa các ion K+, [Al(OH2)6]3+ và SO42–. Sau đó, một phần phức chất aqua chuyển thành phức chất không tan theo phương trình hoá học sau:
[Al(OH2)6]3+(aq) + nH2O(l) ⟶ [Al(OH)n(OH2)6-n](s) + nH3O+(aq) (*)
Biết rằng phức chất không tan [Al(OH)n(OH2)6-n] trung hòa về điện. Xác định giá trị của n.
Phức chất không tan [Al(OH)n(OH2)6-n] phải trung hòa về điện, nghĩa là tổng điện tích của ion Al3+ và các nhóm OH– bằng 0.
+) Ion Al3+: Mang điện tích +3.
+) Mỗi nhóm −OH: Mang điện tích −1.
⟶ Tổng điện tích của phức chất không tan là: +3 + (−1 ) × n = 0
⟶ n = 3
⇒ Phản ứng hoàn chỉnh:
[Al(OH2)6]3+(aq) + 3H2O(l) ⟶ [Al(OH)3(OH2)3](s) + 3H3O+(aq)
Phức chất không tan là [Al(OH)3(OH2)3]
⇒ Điền đáp án: 3
+) Ion Al3+: Mang điện tích +3.
+) Mỗi nhóm −OH: Mang điện tích −1.
⟶ Tổng điện tích của phức chất không tan là: +3 + (−1 ) × n = 0
⟶ n = 3
⇒ Phản ứng hoàn chỉnh:
[Al(OH2)6]3+(aq) + 3H2O(l) ⟶ [Al(OH)3(OH2)3](s) + 3H3O+(aq)
Phức chất không tan là [Al(OH)3(OH2)3]
⇒ Điền đáp án: 3
Câu 24 [705412]: Benzocain là chất gây tê cục bộ. Nó là thành phần hoạt chất trong nhiều loại thuốc mỡ gây tê không kê đơn như các sản phẩm trị loét miệng thương hiệu Orajel. Benzocain được tổng hợp từ nguyên liệu ban đầu là toluidin (H2N-C6H4-CH3) qua nhiều phản ứng, đơn giản hoá quá trình theo sơ đồ sau:
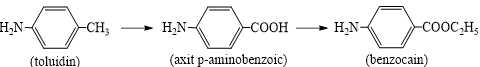
Để sản xuất một lô thuốc benzocain gồm 12500 lọ (mỗi lọ chứa 25 gam benzocain) thì cần dùng m kg toluidin. Biết hiệu suất mỗi quá trình là 75%. Giá trị của m là bao nhiêu? (kết quả làm tròn đến hàng đơn vị).


Để sản xuất một lô thuốc benzocain gồm 12500 lọ (mỗi lọ chứa 25 gam benzocain) thì cần dùng m kg toluidin. Biết hiệu suất mỗi quá trình là 75%. Giá trị của m là bao nhiêu? (kết quả làm tròn đến hàng đơn vị).
Khối lượng benzocain trong 12500 lọ thuốc là: 12500 × 25 = 312500 (g) = 312,5 (kg)
Hiệu suất mỗi quá trình là 75 % nên hiệu suất cả quá trình là: 75% × 75% = 56,25%.
Sơ đồ đơn giản hóa quá trình sản xuất benzocain từ toluidin như sau:
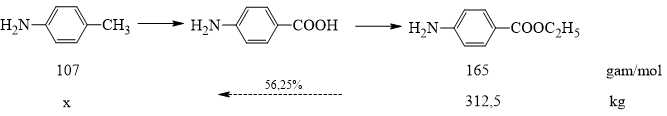
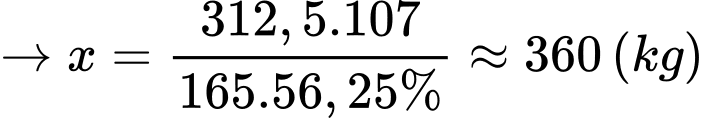
⇒ Điền đáp án: 360
Hiệu suất mỗi quá trình là 75 % nên hiệu suất cả quá trình là: 75% × 75% = 56,25%.
Sơ đồ đơn giản hóa quá trình sản xuất benzocain từ toluidin như sau:

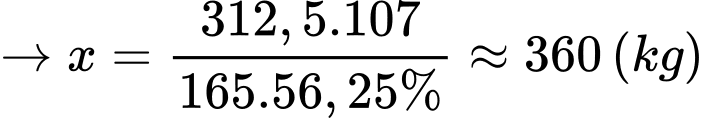
⇒ Điền đáp án: 360
Câu 25 [705413]: Benzene thương mại thu được từ quá trình chưng cất nhựa than đá chứa 3 – 5% thiophene. Thiophene được loại khỏi benzene bằng cách chiết với dung dịch sulfuric acid đậm đặc. Quá trình tinh chế này dựa trên cơ sở là phản ứng giữa sulfuric acid với thiophene xảy ra dễ dàng hơn nhiều so với benzene. Quá trình này gồm các bước:
1. Cho hỗn hợp vào trong phễu chiết, lắc đều rồi để yên.
2. Loại bỏ lớp dung dịch và tách lấy lớp benzene.
3. Lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid để tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid.
4. Rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và thu lấy benzene tinh khiết.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình tinh chế benzene (ví dụ: 1234, 4321, ...).
1. Cho hỗn hợp vào trong phễu chiết, lắc đều rồi để yên.
2. Loại bỏ lớp dung dịch và tách lấy lớp benzene.
3. Lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid để tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid.
4. Rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và thu lấy benzene tinh khiết.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình tinh chế benzene (ví dụ: 1234, 4321, ...).
Quy trình tách thiophene từ trong benzene thương mại:
Bước 1: Phải để thiophene phản ứng với H2SO4 trước, nếu không sẽ không thể tách thiophene ra khỏi benzene.
→ Lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid. → ứng với 3.
Bước 2: Hỗn hợp cần được đưa vào phễu chiết để tách lớp, do H2SO4 (có chứa thiophene-2-sulfonic acid) nặng hơn benzene và sẽ tạo thành lớp dưới.
→ Cho hỗn hợp vào phểu chiết, lắc đều rồi để yên. → ứng với 1.
Bước 3: Loại bỏ hoàn toàn lớp dung dịch H2SO4 chứa thiophene đã bị chuyển hóa thành thiophene-2-sulfonic acid, giữ lại benzene.
→ Loại bỏ lớp dung dịch và tách lấy lớp benzene. → ứng với 2.
Bước 4: Sau khi tách lớp, benzene còn sót một lượng nhỏ H2SO4. Cần rửa nhiều lần bằng nước để loại bỏ hoàn toàn acid, sau đó làm khô bằng CuSO4 khan để thu được benzene tinh khiết.
→ Rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và thu lấy benzene tinh khiết. → ứng với 4.
⇒ Điền đáp án: 3124
Bước 1: Phải để thiophene phản ứng với H2SO4 trước, nếu không sẽ không thể tách thiophene ra khỏi benzene.
→ Lắc benzene thương mại với dung dịch sulfuric acid đậm đặc, chỉ thiophene phản ứng với sulfuric acid tạo thành thiophene-2-sulfonic acid tan trong sulfuric acid. → ứng với 3.
Bước 2: Hỗn hợp cần được đưa vào phễu chiết để tách lớp, do H2SO4 (có chứa thiophene-2-sulfonic acid) nặng hơn benzene và sẽ tạo thành lớp dưới.
→ Cho hỗn hợp vào phểu chiết, lắc đều rồi để yên. → ứng với 1.
Bước 3: Loại bỏ hoàn toàn lớp dung dịch H2SO4 chứa thiophene đã bị chuyển hóa thành thiophene-2-sulfonic acid, giữ lại benzene.
→ Loại bỏ lớp dung dịch và tách lấy lớp benzene. → ứng với 2.
Bước 4: Sau khi tách lớp, benzene còn sót một lượng nhỏ H2SO4. Cần rửa nhiều lần bằng nước để loại bỏ hoàn toàn acid, sau đó làm khô bằng CuSO4 khan để thu được benzene tinh khiết.
→ Rửa nhiều lần bằng nước rồi làm khô bằng CuSO4 khan và thu lấy benzene tinh khiết. → ứng với 4.
⇒ Điền đáp án: 3124
Câu 26 [705414]: Thiết bị đẩy phi thuyền con thoi vào vũ trụ dùng nhiên liệu là hỗn hợp bột nhôm và ammonium perchlorate trong động cơ nhiên liệu rắn. Phản ứng giữa các chất xảy ra như sau:
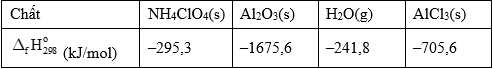
Cần khoảng 783 GJ (1 GJ = 109 J) để nâng một phi thuyền con thoi lên độ cao 88 km và bay được 320 km theo quỹ đạo parabol. Tính khối lượng nhôm (tấn) cần dùng để tạo ra lượng năng lượng 783 GJ bên trên (Làm tròn đến hàng phần mười)?
10Al(s) + 6NH4ClO4(s) → 4Al2O3(s) + 2AlCl3(s) + 3N2(g) + 12H2O(g).
Cho biết:
Cần khoảng 783 GJ (1 GJ = 109 J) để nâng một phi thuyền con thoi lên độ cao 88 km và bay được 320 km theo quỹ đạo parabol. Tính khối lượng nhôm (tấn) cần dùng để tạo ra lượng năng lượng 783 GJ bên trên (Làm tròn đến hàng phần mười)?
10Al(s) + 6NH4ClO4(s) → 4Al2O3(s) + 2AlCl3(s) + 3N2(g) + 12H2O(g).
Biến thiên enthalpy của phản ứng là:
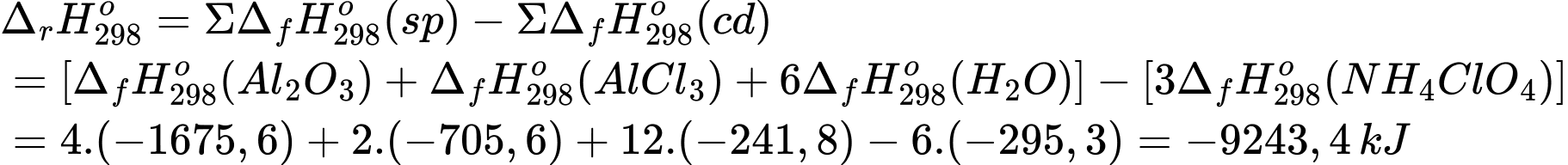
10 mol Al tham gia phản ứng tạo ra lượng nhiệt là 9243,4 kJ
Năng lượng sinh ra trên 1 mol Al là: 9243,4 ÷ 10 = 924,34 kJ
Số mol nhôm cần dùng là:
nAl = Năng lượng cần thiết ÷ Năng lượng giải phóng trên 1 mol Al = 783 × 106 ÷ 924,34 = 847,1 × 103 (mol)
→ Khối lượng nhôm cần dùng là: mAl = 797,4 × 103 × 27 = 22,87 × 106 (g) = 22,9 (tấn)
⇒ Điền đáp án: 22,9
Biến thiên enthalpy của phản ứng là:
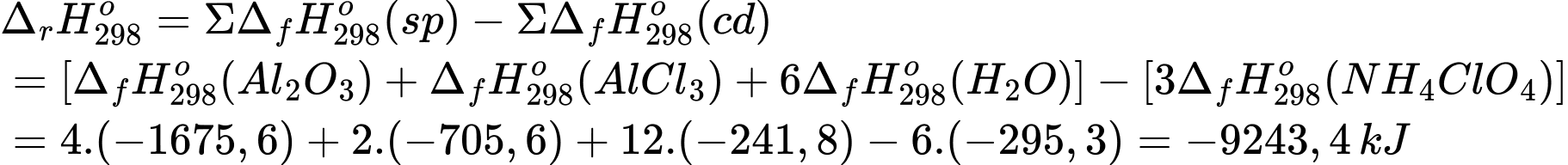
10 mol Al tham gia phản ứng tạo ra lượng nhiệt là 9243,4 kJ
Năng lượng sinh ra trên 1 mol Al là: 9243,4 ÷ 10 = 924,34 kJ
Số mol nhôm cần dùng là:
nAl = Năng lượng cần thiết ÷ Năng lượng giải phóng trên 1 mol Al = 783 × 106 ÷ 924,34 = 847,1 × 103 (mol)
→ Khối lượng nhôm cần dùng là: mAl = 797,4 × 103 × 27 = 22,87 × 106 (g) = 22,9 (tấn)
⇒ Điền đáp án: 22,9
Câu 27 [705415]: Thủy phân hoàn toàn 1 mol peptide X có cấu tạo Gly-Ala-Lys trong môi trường HCl thì đã có bao nhiêu mol HCl đã tham gia phản ứng?
Peptide X có cấu tạo Gly-Ala-Lys là một chuỗi tripeptide gồm 3 amino acid: Glycine (Gly), Alanine (Ala), và Lysine (Lys), liên kết với nhau bằng 2 liên kết peptide.
Khi thủy phân hoàn toàn peptide X trong môi trường HCl, các nhóm amine sẽ phản ứng trực tiếp với HCl. Nên phân tử tripeptide này gồm có 1 nhóm NH2 của Gly, 1 nhóm NH2 của Ala và 2 nhóm NH2 của Lys nên sẽ phản ứng với 4 mol HCl theo tỉ lệ 1 : 4 như sau:
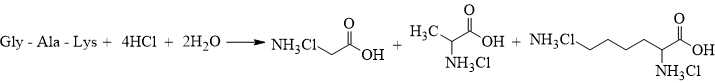
⇒ Điền đáp án: 4
Khi thủy phân hoàn toàn peptide X trong môi trường HCl, các nhóm amine sẽ phản ứng trực tiếp với HCl. Nên phân tử tripeptide này gồm có 1 nhóm NH2 của Gly, 1 nhóm NH2 của Ala và 2 nhóm NH2 của Lys nên sẽ phản ứng với 4 mol HCl theo tỉ lệ 1 : 4 như sau:

⇒ Điền đáp án: 4
Câu 28 [705416]: Trong quá trình bảo quản, một phần Fe2+ trong muối FeSO4.7H2O bị oxygen oxi hoá thành Fe3+ (chất X). Lấy 1,12 g X đem hòa vào 10,0 mL dung dịch H2SO4 1,00 M thu được dung dịch Y. Chia Y thành hai phần bằng nhau:
Phần 1. Thêm nước vào thu được 100 mL dung dịch Y1. Lượng Fe2+ trong 10,0 mL dung dịch Y1 phản ứng vừa đủ với 1,85 mL dung dịch KMnO4 0,02 M.
Phần 2. Cho qua cột chứa Zn (Hg) để khử hoàn toàn ion Fe3+ thành ion Fe2+, thêm tiếp 5 mL dung dịch H2SO4 1M và nước vào dung dịch sau khi qua cột đến 100,0 mL (dung dịch Y2). Lượng Fe trong 10,00 mL Y2 phản ứng vừa đủ với 4,0 mL dung dịch KMnO4 0,01 М.
Xác định % iron(II) đã bị oxygen trong không khí oxi hoá thành iron(III). (Làm tròn kết quả đến hàng phần mười)
Phần 1. Thêm nước vào thu được 100 mL dung dịch Y1. Lượng Fe2+ trong 10,0 mL dung dịch Y1 phản ứng vừa đủ với 1,85 mL dung dịch KMnO4 0,02 M.
Phần 2. Cho qua cột chứa Zn (Hg) để khử hoàn toàn ion Fe3+ thành ion Fe2+, thêm tiếp 5 mL dung dịch H2SO4 1M và nước vào dung dịch sau khi qua cột đến 100,0 mL (dung dịch Y2). Lượng Fe trong 10,00 mL Y2 phản ứng vừa đủ với 4,0 mL dung dịch KMnO4 0,01 М.
Xác định % iron(II) đã bị oxygen trong không khí oxi hoá thành iron(III). (Làm tròn kết quả đến hàng phần mười)
Đổi 4 mL = 0,004 L; 1,85 mL = 0,00185 L
Zn + 2Fe3+ ⟶ 2Fe2+ + Zn2+
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Phần 1:
Số mol của KMnO4 phản ứng là: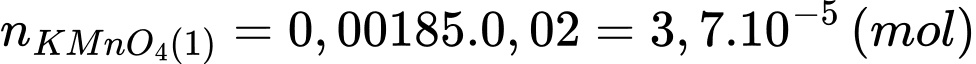
Số mol của Fe2+ trong phần 1 đã phản ứng là: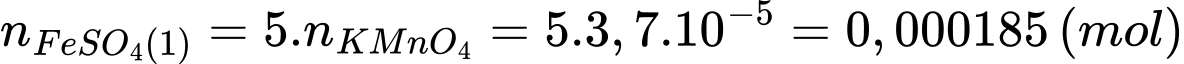
Tổng số mol Fe2+ trong phần 1 là: nFe2+ = 0,000185 × 10 = 1,85 × 10-3 (mol)
Phần 2: toàn bộ Fe3+ đã được chuyển hóa thành Fe2+
Số mol của KMnO4 phản ứng là: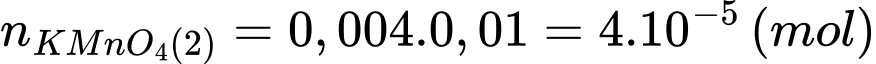
Số mol của Fe2+ trong phần 2 đã phản ứng là: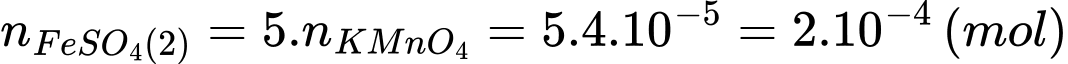
Tổng số mol Fe2+ (kể cả lượng được chuyển hóa từ Fe3+) trong phần 2 là: nFe2+ = 2.10-4 × 10 = 2 × 10-3 (mol)
→ Lượng Fe3+ đã chuyển hóa thành Fe2+ là:
2 × 10-3 – 1,85 × 10-3 = 1,5 × 10-4 (mol)
Phần trăm Fe2+ bị oxi hóa thành Fe3+ là:
⇒ Điền đáp án: 7,5
Zn + 2Fe3+ ⟶ 2Fe2+ + Zn2+
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Phần 1:
Số mol của KMnO4 phản ứng là:
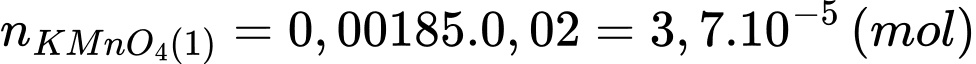
Số mol của Fe2+ trong phần 1 đã phản ứng là:
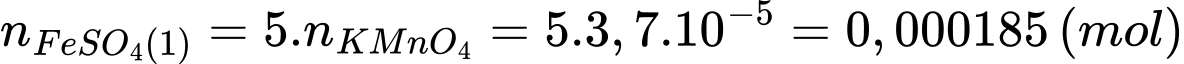
Tổng số mol Fe2+ trong phần 1 là: nFe2+ = 0,000185 × 10 = 1,85 × 10-3 (mol)
Phần 2: toàn bộ Fe3+ đã được chuyển hóa thành Fe2+
Số mol của KMnO4 phản ứng là:
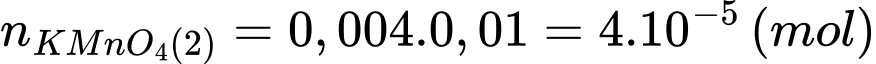
Số mol của Fe2+ trong phần 2 đã phản ứng là:
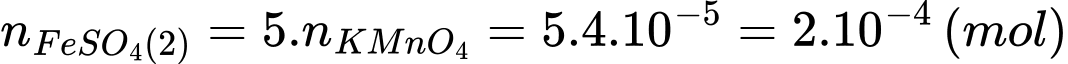
Tổng số mol Fe2+ (kể cả lượng được chuyển hóa từ Fe3+) trong phần 2 là: nFe2+ = 2.10-4 × 10 = 2 × 10-3 (mol)
→ Lượng Fe3+ đã chuyển hóa thành Fe2+ là:
2 × 10-3 – 1,85 × 10-3 = 1,5 × 10-4 (mol)
Phần trăm Fe2+ bị oxi hóa thành Fe3+ là:

⇒ Điền đáp án: 7,5