PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [304112]: Ester HCOOCH2CH2CH3 có tên là
A, Isopropyl formate.
B, Ethyl acetate.
C, Propyl acetate.
D, Propyl formate.
Phân tích cấu tạo HCOOC2H5 gồm:
• gốc acid: HCOO có tên là formate;
• gốc hydrocarbon CH3CH2CH2– có tên là propyl.
⇝ tên gọi tương ứng: propyl formate
► Chú ý: Isoproyl là gốc có nhánh (CH3)2CH–.
⇝ Chọn đáp án D Đáp án: D
• gốc acid: HCOO có tên là formate;
• gốc hydrocarbon CH3CH2CH2– có tên là propyl.
⇝ tên gọi tương ứng: propyl formate
► Chú ý: Isoproyl là gốc có nhánh (CH3)2CH–.
⇝ Chọn đáp án D Đáp án: D
Câu 2 [305732]: Dầu mỡ để lâu bị ôi, thiu là do chất béo bị
A, Cộng hydrogen thành chất béo no.
B, Khử chậm bởi oxygen không khí.
C, Thủy phân với nước trong không khí.
D, Oxi hoá chậm thành các chất có mùi khó chịu.
HD: Dầu, mỡ để lâu ngày trong không khí thường có mùi, vị khó chịu (mùi hôi, khét, vị đắng). Hiện tượng này được gọi là sự ôi mỡ, phản ứng xảy ra như sau:
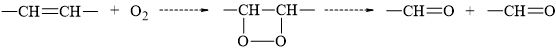
⇒ Quá trình ôi mỡ xảy ra là do gốc hydrocarbon không no có trong chất béo bị oxi hoá bởi oxygen trong không khí, sinh ra các hợp chất có mùi khó chịu và có hại cho sức khoẻ con người.
► O2 là chất oxi hóa nên chất béo sẽ là chất khử ⇝ chất béo sẽ bị oxi hóa bởi oxygen không khí
⇒ Chọn đáp án D Đáp án: D
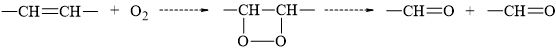
⇒ Quá trình ôi mỡ xảy ra là do gốc hydrocarbon không no có trong chất béo bị oxi hoá bởi oxygen trong không khí, sinh ra các hợp chất có mùi khó chịu và có hại cho sức khoẻ con người.
► O2 là chất oxi hóa nên chất béo sẽ là chất khử ⇝ chất béo sẽ bị oxi hóa bởi oxygen không khí
⇒ Chọn đáp án D Đáp án: D
Câu 3 [308285]: Phần trăm khối lượng của nguyên tố oxygen trong glucose là
A, 44,44%.
B, 53,33%.
C, 51,46%.
D, 49,38%.
HD: Công thức phân tử của glucose là C6H12O6 (M = 180)
⇒ Yêu cầu phần trăm khối lượng của oxygen là %mO = 16 × 6 ÷ 180 × 100% ≈ 53,33%
⇒ Chọn đáp án B Đáp án: B
⇒ Yêu cầu phần trăm khối lượng của oxygen là %mO = 16 × 6 ÷ 180 × 100% ≈ 53,33%
⇒ Chọn đáp án B Đáp án: B
Câu 4 [310466]: Màng bọc thực phẩm PE (polyethylene) hiện được sử dụng phổ biến tại các hộ gia đình để bảo quản thực phẩm. Hydrocarbon dùng để tổng hợp PE thuộc dãy đồng đẳng nào?
A, Alkyne.
B, Alkene.
C, Alkane.
D, Alkadiene.
PE (polyethylene) là sản phẩm trùng hợp của ethylene: CH2 = CH2 thuộc dāy alkene:
nH2C=CH2 –to, xt, p⟶ –(CH2-CH2)–n
⇒ Chọn đáp án B Đáp án: B
nH2C=CH2 –to, xt, p⟶ –(CH2-CH2)–n
⇒ Chọn đáp án B Đáp án: B
Câu 5 [561010]: Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố chuyển tiếp dãy thứ nhất được xếp ở
A, chu kì 3.
B, chu kì 4.
C, chu kì 5.
D, chu kì 3 và chu kì 4.
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 (Sc) đến 29 (Cu), thuộc chu kì 4.

⇒ Chọn đáp án B Đáp án: B

⇒ Chọn đáp án B Đáp án: B
Câu 6 [705417]: Nhờ có …(1)… cao, đồng thời bền trước tác động của các tác nhân …(2)… nên chromium được dùng làm lớp bảo vệ chống ăn mòn cho các dụng cụ, máy móc, thiết bị, đồ gia dụng,... Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, độ cứng, ăn mòn.
B, tính dẻo, oxi hóa.
C, độ bền, hóa học.
D, khả năng chịu nhiệt, vật lý.
Nhờ có độ cứng cao, đồng thời bền trước tác động của các tác nhân ăn mòn nên chromium được dùng làm lớp bảo vệ chống ăn mòn cho các dụng cụ, máy móc, thiết bị, đồ gia dụng,...
Giải thích:
- Chromium là một trong những kim loại cứng nhất nên giúp nó chống lại sự ăn mòn cơ học khi sử dụng trong các thiết bị hoặc đồ gia dụng, nơi thường xuyên chịu va chạm hoặc ma sát.
- Chromium có tính kháng hóa chất rất tốt. Khi tiếp xúc với không khí, một lớp màng mỏng Cr2O3 (chromium oxide) hình thành trên bề mặt. Lớp oxide này bền vững, không bị phá hủy bởi oxygen hay nước, ngăn cản sự tiếp xúc trực tiếp giữa kim loại bên trong và các tác nhân gây ăn mòn như O2, H2O, HCl, SO2,...
⇒ Chọn đáp án A Đáp án: A
Giải thích:
- Chromium là một trong những kim loại cứng nhất nên giúp nó chống lại sự ăn mòn cơ học khi sử dụng trong các thiết bị hoặc đồ gia dụng, nơi thường xuyên chịu va chạm hoặc ma sát.
- Chromium có tính kháng hóa chất rất tốt. Khi tiếp xúc với không khí, một lớp màng mỏng Cr2O3 (chromium oxide) hình thành trên bề mặt. Lớp oxide này bền vững, không bị phá hủy bởi oxygen hay nước, ngăn cản sự tiếp xúc trực tiếp giữa kim loại bên trong và các tác nhân gây ăn mòn như O2, H2O, HCl, SO2,...
⇒ Chọn đáp án A Đáp án: A
Câu 7 [705418]: Barium chloride tan tốt trong nước và có giá thành rẻ nên được sử dụng rộng rãi trong phòng thí nghiệm để nhận biết ion sulfate (SO42-). Công thức muối barium chloride là
A, BaCl2.
B, BaSO4.
C, BeCl2.
D, BeSO4.
Barium chloride (BaCl2) là một muối của barium (Ba2+) và chloride (Cl−).
Trong nước, BaCl2 tan tốt và phân li hoàn toàn thành ion Ba2+ và Cl−:
BaCl2 → Ba2+ + 2Cl−
Khi gặp ion sulfate (SO42−), ion Ba2+ sẽ tạo kết tủa trắng barium sulfate (BaSO4), không tan trong nước:
Ba2+ + SO42− → BaSO4↓
Nhờ phản ứng đặc trưng này, BaCl2 được dùng phổ biến trong phòng thí nghiệm để nhận biết ion SO42−.
⇒ Chọn đáp án A
Đáp án: A
Trong nước, BaCl2 tan tốt và phân li hoàn toàn thành ion Ba2+ và Cl−:
BaCl2 → Ba2+ + 2Cl−
Khi gặp ion sulfate (SO42−), ion Ba2+ sẽ tạo kết tủa trắng barium sulfate (BaSO4), không tan trong nước:
Ba2+ + SO42− → BaSO4↓
Nhờ phản ứng đặc trưng này, BaCl2 được dùng phổ biến trong phòng thí nghiệm để nhận biết ion SO42−.
⇒ Chọn đáp án A
Đáp án: A
Câu 8 [705419]: Khi giặt quần áo, chúng ta tận dụng đặc tính của một số phân tử nhất định để loại bỏ các phân tử khác (không mong muốn) khỏi quần áo. Mật ong dính trên quần áo có thể dễ dàng bị loại bỏ khi hòa tan vào nước. Tuy nhiên, vết dầu mỡ không dễ làm sạch như vậy.
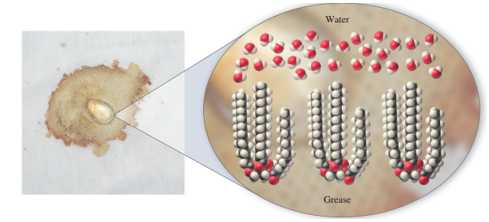
Phát biểu nào sau đây đúng?

Phát biểu nào sau đây đúng?
A, Các chất phân cực hòa tan tốt với các dung môi phân cực.
B, Phần đuôi hydrocarbon dài làm cho các phân tử dầu mỡ trở nên phân cực hơn.
C, Dầu mỡ và nước không hòa tan vì nước phân cực còn dầu mỡ không phân cực.
D, Dung dịch NaOH oxi hóa, phá vỡ cấu trúc nên có thể loại bỏ các phân tử dầu mỡ.
Phân tích các phát biểu:
❌ A. Sai. Một vài chất có độ phân cực lớn nhưng độ tan kém như BaSO4, CaCO3,… nên không thể hòa tan trong dung môi phân cực.
❌ B. Sai. Dầu, mỡ không tan trong nước do phân tử chất béo gồm toàn liên kết cộng hóa trị không phân cực nên không tạo được liên kết hydrogen với nước.
✔️ C. Đúng. Tất cả những phân tử phân cực này sẽ chỉ hòa tan trong dung môi phân cực tương tự. Ngược lại, các phân tử không phân cực sẽ chỉ tan được trong dung môi không phân cực. Nước có cấu trúc phân tử phân cực và dầu có cấu trúc phân tử không phân cực. Chính vì vậy, nước và dầu không thể hòa tan được với nhau.
❌ D. Sai. Dung dịch NaOH thủy phân hoàn toàn chất béo, phá vỡ cấu trúc nên có thể loại bỏ các phân tử dầu mỡ.
⇒ Chọn đáp án C Đáp án: C
❌ A. Sai. Một vài chất có độ phân cực lớn nhưng độ tan kém như BaSO4, CaCO3,… nên không thể hòa tan trong dung môi phân cực.
❌ B. Sai. Dầu, mỡ không tan trong nước do phân tử chất béo gồm toàn liên kết cộng hóa trị không phân cực nên không tạo được liên kết hydrogen với nước.
✔️ C. Đúng. Tất cả những phân tử phân cực này sẽ chỉ hòa tan trong dung môi phân cực tương tự. Ngược lại, các phân tử không phân cực sẽ chỉ tan được trong dung môi không phân cực. Nước có cấu trúc phân tử phân cực và dầu có cấu trúc phân tử không phân cực. Chính vì vậy, nước và dầu không thể hòa tan được với nhau.
❌ D. Sai. Dung dịch NaOH thủy phân hoàn toàn chất béo, phá vỡ cấu trúc nên có thể loại bỏ các phân tử dầu mỡ.
⇒ Chọn đáp án C Đáp án: C
Câu 9 [705420]: Quặng có chứa khoáng vật sphalerite là nguyên liệu để sản xuất
A, đồng.
B, kẽm.
C, sắt.
D, nhôm.
Trong công nghiệp, quặng sphalerite có thành phần chính là zinc sulfide (ZnS). Đây là nguyên liệu chính để điều chế kim loại kẽm (Zinc)
Quy trình sản xuất kẽm từ quặng sphalerite:
- Nung oxi hóa quặng:
Sphalerite (ZnS) được nung trong không khí để chuyển thành zinc oxide (ZnO) và giải phóng khí sulfur dioxide (SO2).
- Chuyển hóa khí SO2: Khí SO2 sinh ra có thể được sử dụng để sản xuất sulfuric acid (H2SO4).
- Khử zinc oxide: ZnO được khử bằng carbon (than cốc) ở nhiệt độ cao để thu được kim loại kẽm.
- Tinh chế kẽm: Kẽm thô thu được sau quá trình khử thường được tinh chế bằng phương pháp chưng cất hoặc điện phân để đạt độ tinh khiết cao.
⇒ Chọn đáp án B
Đáp án: B
Quy trình sản xuất kẽm từ quặng sphalerite:
- Nung oxi hóa quặng:
Sphalerite (ZnS) được nung trong không khí để chuyển thành zinc oxide (ZnO) và giải phóng khí sulfur dioxide (SO2).
- Chuyển hóa khí SO2: Khí SO2 sinh ra có thể được sử dụng để sản xuất sulfuric acid (H2SO4).
- Khử zinc oxide: ZnO được khử bằng carbon (than cốc) ở nhiệt độ cao để thu được kim loại kẽm.
- Tinh chế kẽm: Kẽm thô thu được sau quá trình khử thường được tinh chế bằng phương pháp chưng cất hoặc điện phân để đạt độ tinh khiết cao.
⇒ Chọn đáp án B
Đáp án: B
Câu 10 [705421]: Cho dung dịch các saccharide sau: fructose, glucose, saccharose. Để phân biệt các saccharide này không thể chỉ dùng các thuốc thử nào sau đây?
A, Nước bromine và dung dịch acid.
B, Thuốc thử Tollens và nước bromine.
C, Nước bromine và hồ tinh bột.
D, Nước bromine và Cu(OH)2/NaOH (t°).
Phân tích các thuốc thử:
✔️ A. Có thể phân biệt được các mẫu:
+) Cho nước bromine vào 3 dung dịch sẽ nhận biết được glucose (có nhóm chức aldehyde CHO)
+) Khi cho dung dịch acid vào 2 mẫu dung dịch còn lại, đun nóng thì saccharose sẽ bị thủy phân thành glucose và fructose. Khi này dùng nhỏ nước bromine vào 2 mẫu thì ở mẫu chứa saccharose sẽ có phản ứng (của glucose với nước bromine) nên nhận biết được saccharose
+) Mẫu còn lại không có phản ứng nào là fructose.
✔️ B. Có thể phân biệt được các mẫu:
+) Cho thuốc thử Tollens vào 3 mẫu thì chỉ có saccharose là không có phản ứng tráng bạc nên nhận biết được saccharose.
+) Khi cho nước bromine vào 2 mẫu còn lại là glu và fruc thì chỉ có glu có phản ứng nên phân biệt được 2 mẫu.
C. Không thể phân biệt được các mẫu:
+) Nước bromine nhận biết được glucose.
+) Hồ tinh bột dùng để nhận biết iodine nên không phân biệt được fructose và saccharose.
✔️ D. Có thể phân biệt được các mẫu:
+) Nước bromine nhận biết được glucose.
+) Cu(OH)2/NaOH khi được cho vào 2 mẫu fruc và saccha, đun nóng thì fructose trong môi trường kiềm bị chuyển hóa thành glucose sẽ xuất hiện kết tủa đỏ gạch Cu2O còn saccha thì không.
⇒ Chọn đáp án C Đáp án: C
✔️ A. Có thể phân biệt được các mẫu:
+) Cho nước bromine vào 3 dung dịch sẽ nhận biết được glucose (có nhóm chức aldehyde CHO)
+) Khi cho dung dịch acid vào 2 mẫu dung dịch còn lại, đun nóng thì saccharose sẽ bị thủy phân thành glucose và fructose. Khi này dùng nhỏ nước bromine vào 2 mẫu thì ở mẫu chứa saccharose sẽ có phản ứng (của glucose với nước bromine) nên nhận biết được saccharose
+) Mẫu còn lại không có phản ứng nào là fructose.
✔️ B. Có thể phân biệt được các mẫu:
+) Cho thuốc thử Tollens vào 3 mẫu thì chỉ có saccharose là không có phản ứng tráng bạc nên nhận biết được saccharose.
+) Khi cho nước bromine vào 2 mẫu còn lại là glu và fruc thì chỉ có glu có phản ứng nên phân biệt được 2 mẫu.
C. Không thể phân biệt được các mẫu:
+) Nước bromine nhận biết được glucose.
+) Hồ tinh bột dùng để nhận biết iodine nên không phân biệt được fructose và saccharose.
✔️ D. Có thể phân biệt được các mẫu:
+) Nước bromine nhận biết được glucose.
+) Cu(OH)2/NaOH khi được cho vào 2 mẫu fruc và saccha, đun nóng thì fructose trong môi trường kiềm bị chuyển hóa thành glucose sẽ xuất hiện kết tủa đỏ gạch Cu2O còn saccha thì không.
⇒ Chọn đáp án C Đáp án: C
Câu 11 [705422]: Khi chiếu sáng hoặc đun nóng hỗn hợp propane với chlorine sẽ xảy ra phản ứng thế nguyên tử hydrogen trong phân tử propane bằng nguyên tử chlorine.
• Giai đoạn khơi mào:
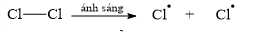
• Giai đoạn phát triển mạch:
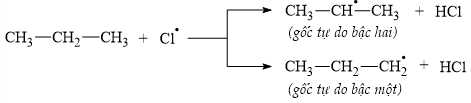
• Giai đoạn tắt mạch:
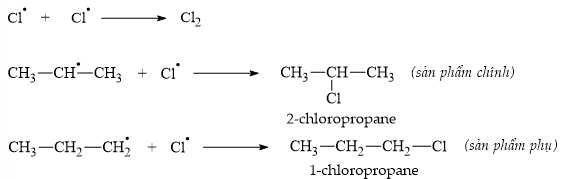
Gốc tự do bền hơn sẽ nhận Cl● tạo ra thành sản phẩm chính. Ngoài ra, sau khi phản ứng kết thúc, nhận thấy trong hỗn hợp sản phẩm có chứa n-hexane.
Cho các phát biểu sau:
(a) Giai đoạn khơi mào, mỗi nguyên tử Cl trong Cl2 nhận về 1 electron.
(b) Gốc tự do Cl● tương tác với nhóm CH2 sẽ tạo thành gốc tự do bậc 2.
(c) Gốc tự do bậc I bền hơn gốc tự do bậc II.
(d) Sản phẩm có chứa n-hexane là do hai gốc tự do bậc 1 phản ứng với nhau.
Các phát biểu đúng là
C3H8 + Cl2 → C3H7Cl + HCl
Phản ứng thế trên xảy ra theo cơ chế sau, gồm các giai đoạn sau đây:• Giai đoạn khơi mào:
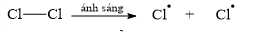
• Giai đoạn phát triển mạch:

• Giai đoạn tắt mạch:

Gốc tự do bền hơn sẽ nhận Cl● tạo ra thành sản phẩm chính. Ngoài ra, sau khi phản ứng kết thúc, nhận thấy trong hỗn hợp sản phẩm có chứa n-hexane.
Cho các phát biểu sau:
(a) Giai đoạn khơi mào, mỗi nguyên tử Cl trong Cl2 nhận về 1 electron.
(b) Gốc tự do Cl● tương tác với nhóm CH2 sẽ tạo thành gốc tự do bậc 2.
(c) Gốc tự do bậc I bền hơn gốc tự do bậc II.
(d) Sản phẩm có chứa n-hexane là do hai gốc tự do bậc 1 phản ứng với nhau.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Trong giai đoạn khơi mào, phân tử Cl₂ bị phân cắt bằng ánh sáng (quá trình quang phân), tạo ra hai gốc tự do Cl•, mỗi gốc tự do nhận một electron từ liên kết Cl–Cl.
✔️ (b) Đúng. Khi Cl• tấn công vào phân tử propane (C3H8), nó sẽ chiếm một nguyên tử H từ nhóm CH2 (ở vị trí giữa), tạo thành gốc tự do bậc 2 (CH3-CH•-CH3), vì nguyên tử C này liên kết với 2 nguyên tử C khác.
❌ (c) Sai. Gốc tự do bậc II bền hơn gốc tự do bậc I do hiệu ứng cảm ứng và siêu liên hợp từ các nhóm thế CH3 làm ổn định hóa gốc tự do.
✔️ (d) Đúng. Hai gốc tự do bậc 1 (CH3-CH2-CH2•) có thể kết hợp lại để tạo thành n-hexane (CH3-CH2-CH2-CH2-CH2-CH3).
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Trong giai đoạn khơi mào, phân tử Cl₂ bị phân cắt bằng ánh sáng (quá trình quang phân), tạo ra hai gốc tự do Cl•, mỗi gốc tự do nhận một electron từ liên kết Cl–Cl.
✔️ (b) Đúng. Khi Cl• tấn công vào phân tử propane (C3H8), nó sẽ chiếm một nguyên tử H từ nhóm CH2 (ở vị trí giữa), tạo thành gốc tự do bậc 2 (CH3-CH•-CH3), vì nguyên tử C này liên kết với 2 nguyên tử C khác.
❌ (c) Sai. Gốc tự do bậc II bền hơn gốc tự do bậc I do hiệu ứng cảm ứng và siêu liên hợp từ các nhóm thế CH3 làm ổn định hóa gốc tự do.
✔️ (d) Đúng. Hai gốc tự do bậc 1 (CH3-CH2-CH2•) có thể kết hợp lại để tạo thành n-hexane (CH3-CH2-CH2-CH2-CH2-CH3).
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
Câu 12 [705423]: “Tơ nylon-6,6 thuộc loại …(1)…, được điều chế từ …(2)… và hexamethylenediamine”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, tơ tự nhiên, acetic acid.
B, polyamide, adipic acid.
C, polymer, adipic acid.
D, polyamide, propionic acid.
Tơ nylon-6,6 thuộc loại polyamide, được điều chế từ adipic acid và hexamethylenediamine.
Giải thích:
Tơ nylon-6,6 là sản phẩm của quá trình trùng ngưng giữa hai hợp chất hữu cơ: acid adipic và hexamethylenediamine. Đây là điển hình của tơ polyamide, vì trong cấu trúc của nó có chứa nhiều nhóm amide (–CO–NH–) lặp lại.
⇒ Chọn đáp án B Đáp án: B
Giải thích:
Tơ nylon-6,6 là sản phẩm của quá trình trùng ngưng giữa hai hợp chất hữu cơ: acid adipic và hexamethylenediamine. Đây là điển hình của tơ polyamide, vì trong cấu trúc của nó có chứa nhiều nhóm amide (–CO–NH–) lặp lại.
⇒ Chọn đáp án B Đáp án: B
Câu 13 [705424]: Phát biểu nào sau đây là đúng?
A, Ở điều kiện thường, đơn chất fluorine, chlorine và bromine đều ở thể khí.
B, So sánh màu sắc của các đơn chất halogen ở điều kiện thường thì fluorine có màu nhạt nhất.
C, Nhiệt độ nóng chảy của các đơn chất halogen tăng dần khi đi từ iodine đến fluorine.
D, Đơn chất iodine được thêm vào muối ăn để phòng bệnh bướu cổ.
Phân tích các phát biểu:
❌ A. Sai. Trạng thái tập hợp của đơn chất ở 20 oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
✔️ B. Đúng. Các đơn chất halogen có màu sắc đậm dần từ fluorine đến iodine:

❌ C. Sai. Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
❌ D. Sai. KI, KIO3 được cho vào muối ăn để bổ sung nguyên tố iodine, cung cấp iodine ngăn ngừa bệnh bướu cổ.
⇒ Chọn đáp án B Đáp án: B
❌ A. Sai. Trạng thái tập hợp của đơn chất ở 20 oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
✔️ B. Đúng. Các đơn chất halogen có màu sắc đậm dần từ fluorine đến iodine:

❌ C. Sai. Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
❌ D. Sai. KI, KIO3 được cho vào muối ăn để bổ sung nguyên tố iodine, cung cấp iodine ngăn ngừa bệnh bướu cổ.
⇒ Chọn đáp án B Đáp án: B
Câu 14 [705425]: Nhóm phân bón nào sau đây chủ yếu được sử dụng để bón lót?
A, Phân bón hữu cơ, phân xanh, phân đạm.
B, Phân xanh, phân kali, phân NPK.
C, Phân rác, phân xanh, phân chuồng.
D, Phân lân, phân xanh, phân bón sinh học.
Bón lót sử dụng các loại phân cần thiết có một thời gian nhất định để chất dinh dưỡng chuyển hoá thành dạng dễ tiêu cây trồng mới sử dụng được như phân chuồng, phân xanh, phân rác, phân lân. Tuy nhiên bón lót vẫn sử dụng một phần phân dễ tan như phân đạm, phân kali.
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 15 [705426]: Hỗn hợp X gồm lysine, glutamic acid và leucine (CH3CH(CH3)CH2CH(NH2)COOH) trong môi trường base mạnh. Thấm dung dịch X lên một tờ giấy, rồi nối tờ giấy với hai điện cực của nguồn điện một chiều thu được kết quả như sau:
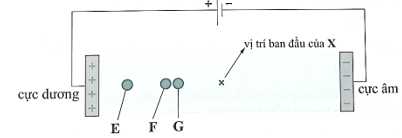
Cho các nhận định sau:
(a) Trong môi trường base mạnh cả 3 amino acid đều tồn tại ở dạng cation.
(b) E là anion của glutamic acid.
(c) E di chuyển nhanh nhất, gần cực dương nhất chủ yếu là do khối lượng phân tử của E lớn nhất.
(d) E, F, G lần lượt là ion của glutamic acid, leucine, lysine.
Các nhận định đúng là

Cho các nhận định sau:
(a) Trong môi trường base mạnh cả 3 amino acid đều tồn tại ở dạng cation.
(b) E là anion của glutamic acid.
(c) E di chuyển nhanh nhất, gần cực dương nhất chủ yếu là do khối lượng phân tử của E lớn nhất.
(d) E, F, G lần lượt là ion của glutamic acid, leucine, lysine.
Các nhận định đúng là
A, (b).
B, (b) và (c).
C, (a), (b), (c).
D, (a), (b), (d).
Ở môi trường có tính base, chứa nhiều ion OH– thì amino acid sẽ phản
ứng với OH– để tạo thành dạng anion mang điện tích âm (–).
Dạng tồn tại của 3 amino acid ở môi trường base mạnh như sau:
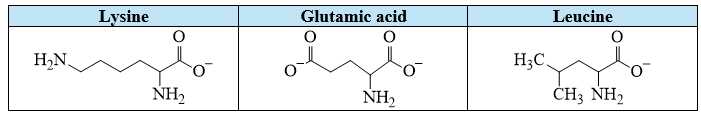
Phân tích các nhận định:
❌ (a) Sai. Trong môi trường base mạnh, cả 3 amino acid đều di chuyển về phía cực dương nên chúng tồn tại ở dạng điện tích âm (anion).
✔️ (b) Đúng. E đến gần cực dương nhất nên có điện tích âm lớn nhất, là anion của glutamic acid với điện tích -2. Còn anion của lysine và leucine cùng điện tích là -1.
❌ (c) Sai. E di chuyển nhanh nhất, gần cực dương nhất chủ yếu là do điện tích của E lớn nhất.
✔️ (d) Đúng. E là Glutamic acid, F là Leucine, G là Lysine. Leu và Lys có cùng điện tích nhưng Leu có phân tử khối nhỏ hơn nên di chuyển nhanh hơn Lys.
⇒ Các nhận định đúng là (b) và (d)
⇒ Chọn đáp án B Đáp án: B
Dạng tồn tại của 3 amino acid ở môi trường base mạnh như sau:

Phân tích các nhận định:
❌ (a) Sai. Trong môi trường base mạnh, cả 3 amino acid đều di chuyển về phía cực dương nên chúng tồn tại ở dạng điện tích âm (anion).
✔️ (b) Đúng. E đến gần cực dương nhất nên có điện tích âm lớn nhất, là anion của glutamic acid với điện tích -2. Còn anion của lysine và leucine cùng điện tích là -1.
❌ (c) Sai. E di chuyển nhanh nhất, gần cực dương nhất chủ yếu là do điện tích của E lớn nhất.
✔️ (d) Đúng. E là Glutamic acid, F là Leucine, G là Lysine. Leu và Lys có cùng điện tích nhưng Leu có phân tử khối nhỏ hơn nên di chuyển nhanh hơn Lys.
⇒ Các nhận định đúng là (b) và (d)
⇒ Chọn đáp án B Đáp án: B
Câu 16 [705427]: Chất nào sau đây có tín hiệu trên phổ hồng ngoại ở khoảng tần số 1750-1680 cm–1?
A, 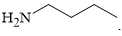

B, 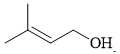

C, 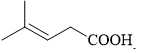

D, 
Tín hiệu phổ hồng ngoại ở khoảng tần số 1750 – 1680 cm-1 là tín hiệu đặc trưng cho C=O của các hợp chất như ester, carboxylic acid, aldehyde và ketone.
→ Chất có cấu tạo phù hợp là CH3C(CH3)=CHCH2COOH là một carboxylic acid.
⇒ Chọn đáp án C Đáp án: C
→ Chất có cấu tạo phù hợp là CH3C(CH3)=CHCH2COOH là một carboxylic acid.
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Hàm lượng Au trong quặng hoặc trong đất thường rất thấp vì vậy rất khó tách Au bằng phương pháp cơ học. Trong công nghiệp, người ta tách vàng từ quặng theo phương trình
Vàng bị hoà tan tạo thành phức chất:
Vàng bị hoà tan tạo thành phức chất:
4Au(s) + 8KCN(aq) + O2(g) + 2H2O(l)→ 4K[Au(CN)2](aq) + 4KOH(aq) (1)
và sau đó kết tủa vàng bằng kẽm (Zn):Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s) (2)
Câu 17 [705428]: Phương pháp điều chế kim loại nào đã được sử dụng trong quá tình sản xuất vàng theo sơ đồ trên?
A, Thủy luyện.
B, Nhiệt luyện.
C, Điện phân.
D, Chiết.
Phản ứng thủy luyện là dùng kim loại mạnh đẩy kim loại yếu hơn ra khỏi dung dịch muối của chúng.
Trong quy trình điều chế Au thì đã dùng Zn mạnh hơn Au để đẩy Au ra khỏi dung dịch muối → Đây là phương pháp thủy luyện.
⇒ Chọn đáp án A Đáp án: A
Trong quy trình điều chế Au thì đã dùng Zn mạnh hơn Au để đẩy Au ra khỏi dung dịch muối → Đây là phương pháp thủy luyện.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [705429]: Nếu dùng 19,5 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
A, 29,55 kg.
B, 9,75 kg.
C, 29,25 kg.
D, 39,0 kg.
4Au + 8KCN + O2 + 2H2O → 4K[Au(CN)2] + 4KOH
Zn + 2K[Au(CN)2] → K2[Zn(CN)4] + 2Au
Số mol của KCN là: nKCN = 19,5 ÷ 65 = 0,3 (kmol)
Từ phương trình hóa học số mol của vàng (Au) là:
nAu = nKCN ÷ 2 = 0,3 ÷ 2 = 0,15 (kmol)
Khối lượng vàng (Au) thu được là: mAu = 197.0,15 = 29,55 (kg)
⇒ Chọn đáp án A Đáp án: A
Zn + 2K[Au(CN)2] → K2[Zn(CN)4] + 2Au
Số mol của KCN là: nKCN = 19,5 ÷ 65 = 0,3 (kmol)
Từ phương trình hóa học số mol của vàng (Au) là:
nAu = nKCN ÷ 2 = 0,3 ÷ 2 = 0,15 (kmol)
Khối lượng vàng (Au) thu được là: mAu = 197.0,15 = 29,55 (kg)
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705430]: Một bạn học sinh tiến hành các thí nghiệm và ghi lại như sau:
∎ Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được dung dịch màu xanh tím.
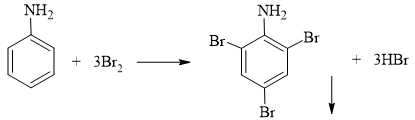
∎ Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
∎ Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên.
∎ Thí nghiệm 4: Nhỏ vài giọt dung dịch aniline vào mẩu giấy quỳ tím, thấy màu quỳ tím chuyển sang màu xanh.
∎ Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được dung dịch màu xanh tím.
∎ Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
∎ Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên.
∎ Thí nghiệm 4: Nhỏ vài giọt dung dịch aniline vào mẩu giấy quỳ tím, thấy màu quỳ tím chuyển sang màu xanh.
Phân tích hiện tượng và phản ứng xảy ra ở các thí nghiệm:
Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được phức tan.
2CH3NH2 + 2H2O + CuSO4 → Cu(OH)2 + (CH3NH3)2SO4
Cu(OH)2 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2
Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.
Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên là nitrogen (N2).
HCl + NaNO2 ⇌ HNO2 + NaCl
C2H5NH2 + HNO2 ⟶ C2H5OH + N2 + H2O
Thí nghiệm 4: Aniline có vòng benzene đính vào nguyên tử N, do hiệu ứng của vòngthơm làm cho mật độ electron trên nguyên tử N giảm, từ đó tính base sẽ yếu hơn ammonia nên aniline không làm đổi màu phenolphthalein và quỳ tím.
Phân tích các phát biểu:
❌ a) Sai. Bạn học sinh ghi đúng hiện tượng của thí nghiệm 2 là thấy có kết tủa màu trắng xuất hiện.
✔️ b) Đúng. Aniline không có khả năng làm đổi màu quỳ tím nên dù quỳ tím khô hay quỳ tím ẩm thì quỳ tím vẫn không đổi màu.
❌ c) Sai. Thí nghiệm 1 là phản ứng tạo phức tan màu xanh của amine [Cu(CH3NH2)4](OH)2.
❌ d) Sai.Ở thí nghiệm 3 nếu thay ethylamine bằng một alkylamine bậc 2 thì thu được N-Nitrosamine (một chất dạng dầu không hoà tan) màu vàng nổi trên mặt nước. Nếu thay bằng amine bậc 3 mới thu được dung dịch trong suốt.
Thí nghiệm 1: Nhỏ từ từ đến dư dung dịch methylamine vào ống nghiệm đựng dung dịch CuSO4 thu được phức tan.
2CH3NH2 + 2H2O + CuSO4 → Cu(OH)2 + (CH3NH3)2SO4
Cu(OH)2 + 4CH3NH2 → [Cu(CH3NH2)4](OH)2
Thí nghiệm 2: Nhỏ nước bromine vào ống nghiệm đựng dung dịch aniline thấy có kết tủa màu trắng xuất hiện.

Thí nghiệm 3: Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch hỗn hợp acid HCl + NaNO2 ở nhiệt độ thường thấy có khí không màu bay lên là nitrogen (N2).
HCl + NaNO2 ⇌ HNO2 + NaCl
C2H5NH2 + HNO2 ⟶ C2H5OH + N2 + H2O
Thí nghiệm 4: Aniline có vòng benzene đính vào nguyên tử N, do hiệu ứng của vòngthơm làm cho mật độ electron trên nguyên tử N giảm, từ đó tính base sẽ yếu hơn ammonia nên aniline không làm đổi màu phenolphthalein và quỳ tím.
Phân tích các phát biểu:
❌ a) Sai. Bạn học sinh ghi đúng hiện tượng của thí nghiệm 2 là thấy có kết tủa màu trắng xuất hiện.
✔️ b) Đúng. Aniline không có khả năng làm đổi màu quỳ tím nên dù quỳ tím khô hay quỳ tím ẩm thì quỳ tím vẫn không đổi màu.
❌ c) Sai. Thí nghiệm 1 là phản ứng tạo phức tan màu xanh của amine [Cu(CH3NH2)4](OH)2.
❌ d) Sai.Ở thí nghiệm 3 nếu thay ethylamine bằng một alkylamine bậc 2 thì thu được N-Nitrosamine (một chất dạng dầu không hoà tan) màu vàng nổi trên mặt nước. Nếu thay bằng amine bậc 3 mới thu được dung dịch trong suốt.
Câu 20 [705431]: Phân tích nguyên tố hợp chất hữu cơ X cho thấy phần trăm khối lượng ba nguyên tố C, H và O lần lượt là 64,86%; 13,51% và 21,63%. Phổ MS của X được cho trên như sau:
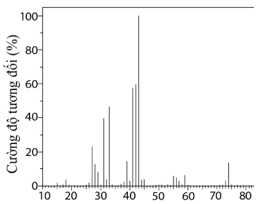
Biết rằng phổ hồng ngoại của X có tín hiệu hấp thụ trong vùng 3650–3200 cm–1. Oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh.

Biết rằng phổ hồng ngoại của X có tín hiệu hấp thụ trong vùng 3650–3200 cm–1. Oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh.
Gọi công thức của X có dạng CxHyOz
Từ phổ MS phân tử khối của X là 74 gam/mol
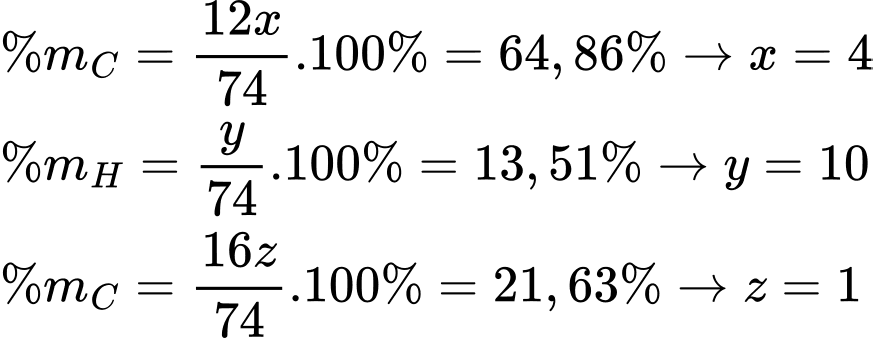
Công thức phân tử của X là C4H10O
Phổ hồng ngoại của X có tín hiệu hấp thụ trong vùng 3650–3200 cm-1 → X có nhóm chức OH của alcohol.
Oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh. → X là alcohol bậc I
Công thức cấu tạo của X là CH3CH(CH3)CH2OH:
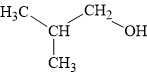
Phân tích các phát biểu:
✔️ a) Đúng. Công thức phân tử của X là C4H10O.
✔️ b) Đúng. X là alcohol bậc 1 nên có chứa nhóm chức gắn với C bậc 1.
✔️ c) Đúng. Khi alcohol bậc 1 bị oxi hóa, chỉ có nhóm CH2OH biến đổi thành CHO, còn mạch carbon giữ nguyên. Vì Y là aldehyde phân nhánh, chứng tỏ X cũng có mạch carbon phân nhánh giống Y.
CH3CH(CH3)CH2OH + CuO –to⟶ CH3CH(CH3)CHO + Cu + H2O
❌ d) Sai. Khi oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh nên X cũng phân nhánh, chỉ có 1 công thức cấu tạo phù hợp với X đã phân tích ở trên.
Từ phổ MS phân tử khối của X là 74 gam/mol
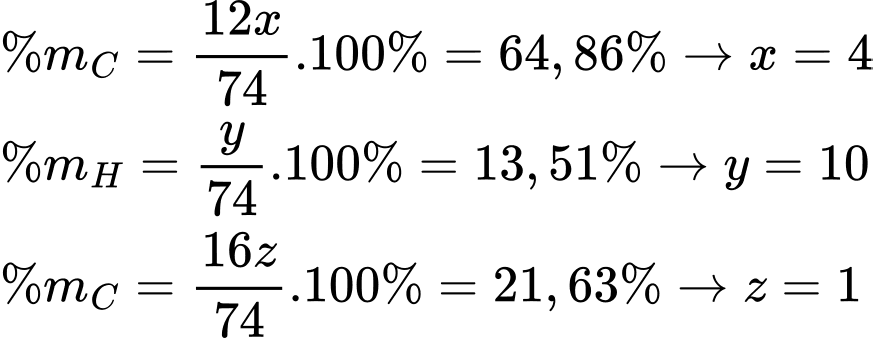
Công thức phân tử của X là C4H10O
Phổ hồng ngoại của X có tín hiệu hấp thụ trong vùng 3650–3200 cm-1 → X có nhóm chức OH của alcohol.
Oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh. → X là alcohol bậc I
Công thức cấu tạo của X là CH3CH(CH3)CH2OH:

Phân tích các phát biểu:
✔️ a) Đúng. Công thức phân tử của X là C4H10O.
✔️ b) Đúng. X là alcohol bậc 1 nên có chứa nhóm chức gắn với C bậc 1.
✔️ c) Đúng. Khi alcohol bậc 1 bị oxi hóa, chỉ có nhóm CH2OH biến đổi thành CHO, còn mạch carbon giữ nguyên. Vì Y là aldehyde phân nhánh, chứng tỏ X cũng có mạch carbon phân nhánh giống Y.
CH3CH(CH3)CH2OH + CuO –to⟶ CH3CH(CH3)CHO + Cu + H2O
❌ d) Sai. Khi oxi hoá X bằng CuO, đun nóng, thu được một aldehyde có mạch carbon phân nhánh nên X cũng phân nhánh, chỉ có 1 công thức cấu tạo phù hợp với X đã phân tích ở trên.
Câu 21 [705432]: Một nhóm học sinh tiến hành lặp các loại pin điện từ hai điện cực khác nhau. Trong quá trình này, các học sinh nhận thấy điện cực được tạo thành từ các cặp oxi hóa khử như: Zn2+/Zn; Mg2+/Mg; Pb2+/Pb; Fe2+/Fe; Cu2+/Cu và Ag+/Ag. Nhóm học sinh đưa ra giả thuyết: “Mỗi một điện cực tạo nên pin điện phải được tạo thành từ kim loại nhúng trong dung dịch chứa ion tương ứng”. Để kiểm chứng giả thuyết trên, nhóm học sinh đã thiết lập sơ đồ như sau:
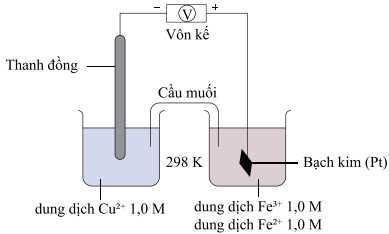
Sau khi thiết lập, trên vôn kế hiển thị giá trị là 0,43 V. Biết thế khử chuẩn của Cu2+/Cu là 0,34 V.

Sau khi thiết lập, trên vôn kế hiển thị giá trị là 0,43 V. Biết thế khử chuẩn của Cu2+/Cu là 0,34 V.
Theo dãy hoạt động của kim loại ta có Fe3+/Fe2+ > Cu2+/Cu
Trong pin điện hóa trên Cu2+/Cu đóng vai trò là anode; thanh Pt trong dung dịch Fe3+/Fe2+ đóng vai trò là cathode
Quá trình xảy ra trong pin:
Cathode (+): Fe3+ + 1e ⟶ Fe2+
Anode (-): Cu ⟶ Cu2+ + 2e
→ Nồng độ của Cu2+ tăng dần, nồng độ của Fe3+ giảm dần.
Phân tích các phát biểu:
✔️ a) Đúng. Anode là nơi xảy ra quá trình oxi hóa, giải phóng electron. Cathode là nơi xảy ra quá trình khử, nhận electron. Electron luôn di chuyển từ anode (Cu) sang cathode (Pt/Fe3+, Fe2+).
✔️ b) Đúng. Kim loại Pt là kim loại trơ, không tham gia phản ứng nhưng đóng vai trò làm điện cực dẫn electron cho phản ứng Fe3+ + 1e ⟶ Fe2+.
✔️ c) Đúng. Giả thuyết ban đầu sai vì ở cực dương (cathode), không có kim loại Fe mà chỉ có điện cực Pt trơ nhúng trong dung dịch Fe3+/Fe2+. Nếu giả thuyết đúng, điện cực dương phải là thanh sắt (Fe), nhưng thực tế lại dùng bạch kim (Pt).
✔️ d) Đúng. Ở anode: Cu bị oxi hóa nên nồng độ Cu2+ tăng.
Ở cathode: Fe3+ bị khử nên nồng độ Fe3+ giảm, Fe2+ tăng.
Phản ứng dừng lại khi thế điện cực bằng nhau (Eanode = Ecathode), lúc này không còn dòng electron nữa.
Trong pin điện hóa trên Cu2+/Cu đóng vai trò là anode; thanh Pt trong dung dịch Fe3+/Fe2+ đóng vai trò là cathode
Quá trình xảy ra trong pin:
Cathode (+): Fe3+ + 1e ⟶ Fe2+
Anode (-): Cu ⟶ Cu2+ + 2e
→ Nồng độ của Cu2+ tăng dần, nồng độ của Fe3+ giảm dần.
Phân tích các phát biểu:
✔️ a) Đúng. Anode là nơi xảy ra quá trình oxi hóa, giải phóng electron. Cathode là nơi xảy ra quá trình khử, nhận electron. Electron luôn di chuyển từ anode (Cu) sang cathode (Pt/Fe3+, Fe2+).
✔️ b) Đúng. Kim loại Pt là kim loại trơ, không tham gia phản ứng nhưng đóng vai trò làm điện cực dẫn electron cho phản ứng Fe3+ + 1e ⟶ Fe2+.
✔️ c) Đúng. Giả thuyết ban đầu sai vì ở cực dương (cathode), không có kim loại Fe mà chỉ có điện cực Pt trơ nhúng trong dung dịch Fe3+/Fe2+. Nếu giả thuyết đúng, điện cực dương phải là thanh sắt (Fe), nhưng thực tế lại dùng bạch kim (Pt).
✔️ d) Đúng. Ở anode: Cu bị oxi hóa nên nồng độ Cu2+ tăng.
Ở cathode: Fe3+ bị khử nên nồng độ Fe3+ giảm, Fe2+ tăng.
Phản ứng dừng lại khi thế điện cực bằng nhau (Eanode = Ecathode), lúc này không còn dòng electron nữa.
Câu 22 [705725]: Tiến hành cho các kim loại kiềm lithium, sodium, potassium phản ứng với chlorine. Quy trình tiến hành như sau:
∎ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
∎ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí chlorine.
∎ Bước 3: Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí chlorine.
∎ Bước 1: Dùng dao cắt các mẩu kim loại to bằng hạt đậu.
∎ Bước 2: Dùng kẹp lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí chlorine.
∎ Bước 3: Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác chứa khí chlorine.
Phân tích các phát biểu:
✔️ a) Đúng. Các kim loại kiềm (Li, Na, K) phản ứng với khí chlorine tạo thành các muối halide tương ứng:
2Li + Cl2 ⟶ 2LiCl
2Na + Cl2 ⟶ 2NaCl
2K + Cl2 ⟶ 2KCl
✔️ b) Đúng. Phản ứng của kim loại kiềm với chlorine là phản ứng tỏa nhiệt mạnh, giải phóng nhiều năng lượng. Do đó, cần dùng bình chịu nhiệt để tránh bị nứt vỡ do nhiệt độ cao.
✔️ c) Đúng. Vai trò của nút cao su không chỉ giúp cố định muỗng đốt mà còn giúp đậy kín bình tam giác, ngăn không cho khí chlorine thoát ra.
✔️ d) Đúng. Trong nhóm IA tính khử của các kim loại kiềm tăng dần nên potassium phản ứng nhanh và mãnh liệt hơn so với lithium và sodium khi tiếp xúc với chlorine.
✔️ a) Đúng. Các kim loại kiềm (Li, Na, K) phản ứng với khí chlorine tạo thành các muối halide tương ứng:
2Li + Cl2 ⟶ 2LiCl
2Na + Cl2 ⟶ 2NaCl
2K + Cl2 ⟶ 2KCl
✔️ b) Đúng. Phản ứng của kim loại kiềm với chlorine là phản ứng tỏa nhiệt mạnh, giải phóng nhiều năng lượng. Do đó, cần dùng bình chịu nhiệt để tránh bị nứt vỡ do nhiệt độ cao.
✔️ c) Đúng. Vai trò của nút cao su không chỉ giúp cố định muỗng đốt mà còn giúp đậy kín bình tam giác, ngăn không cho khí chlorine thoát ra.
✔️ d) Đúng. Trong nhóm IA tính khử của các kim loại kiềm tăng dần nên potassium phản ứng nhanh và mãnh liệt hơn so với lithium và sodium khi tiếp xúc với chlorine.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705433]: Trong phức chất, phân tử NH2CH2CH2NH2 có tên ethylenediamine và thường được viết tắt là en. Trong phức chất [Fe(en)3]Cl3, xung quanh nguyên tử trung tâm có tối đa bao nhiêu liên kết sigma?
Phức chất [Fe(en)3]Cl3 có ion phức là [Fe(en)3]3+, cấu tạo như sau:
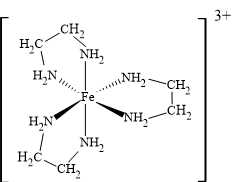
Trong đó:
+) Fe3+ là ion trung tâm.
+) Ethylenediamine (en) là phối tử hai càng, nghĩa là mỗi phân tử en có hai nguyên tử N liên kết với Fe3+.
+) Ba phân tử en liên kết với Fe3+, mỗi phân tử tạo 2 liên kết sigma, tổng cộng có: 3 × 2 = 6 liên kết sigma.
Ngoài ra, vì liên kết phối trí trong phức chất đều là liên kết sigma (không có liên kết pi), nên tổng số liên kết sigma trong ion phức là 6.
⇒ Điền đáp án: 6

Trong đó:
+) Fe3+ là ion trung tâm.
+) Ethylenediamine (en) là phối tử hai càng, nghĩa là mỗi phân tử en có hai nguyên tử N liên kết với Fe3+.
+) Ba phân tử en liên kết với Fe3+, mỗi phân tử tạo 2 liên kết sigma, tổng cộng có: 3 × 2 = 6 liên kết sigma.
Ngoài ra, vì liên kết phối trí trong phức chất đều là liên kết sigma (không có liên kết pi), nên tổng số liên kết sigma trong ion phức là 6.
⇒ Điền đáp án: 6
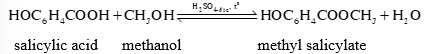
Câu 24 [705434]: Methyl salicylate dùng làm thuốc xoa bóp giảm đau, được điều chế theo phản ứng sau:

Từ 18,63 tấn salicylic acid có thể sản xuất được tối đa x triệu tuýp thuốc xoa bóp giảm đau. Biết mỗi tuýp thuốc chứa 2,7 gam methyl salicylate và hiệu suất phản ứng tính theo salicylic acid là 75%. Giá trị của x là


Từ 18,63 tấn salicylic acid có thể sản xuất được tối đa x triệu tuýp thuốc xoa bóp giảm đau. Biết mỗi tuýp thuốc chứa 2,7 gam methyl salicylate và hiệu suất phản ứng tính theo salicylic acid là 75%. Giá trị của x là
Đổi 1 tấn = 106 gam
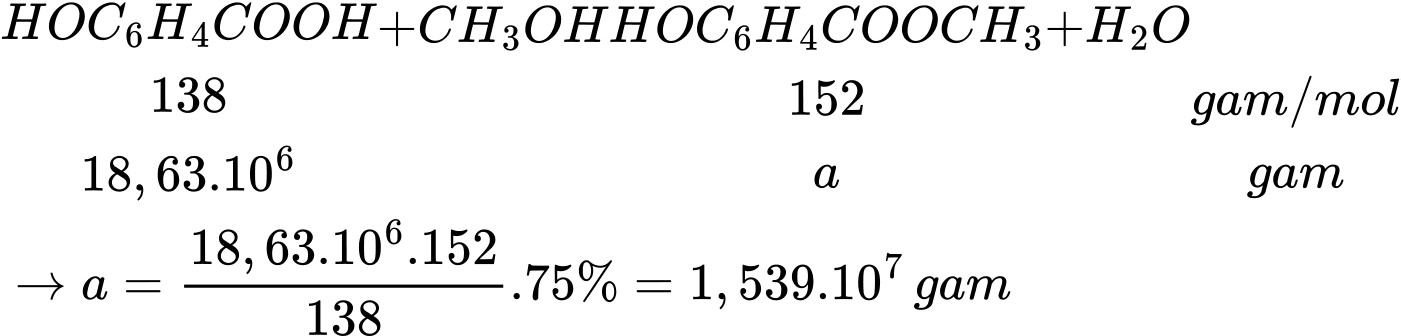
Số tuýp thuốc xoa bóp giảm đau là:
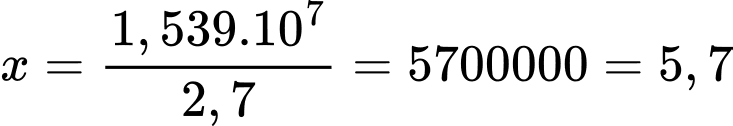 triệu tuýp.
triệu tuýp.
⇒ Điền đáp án: 5,7
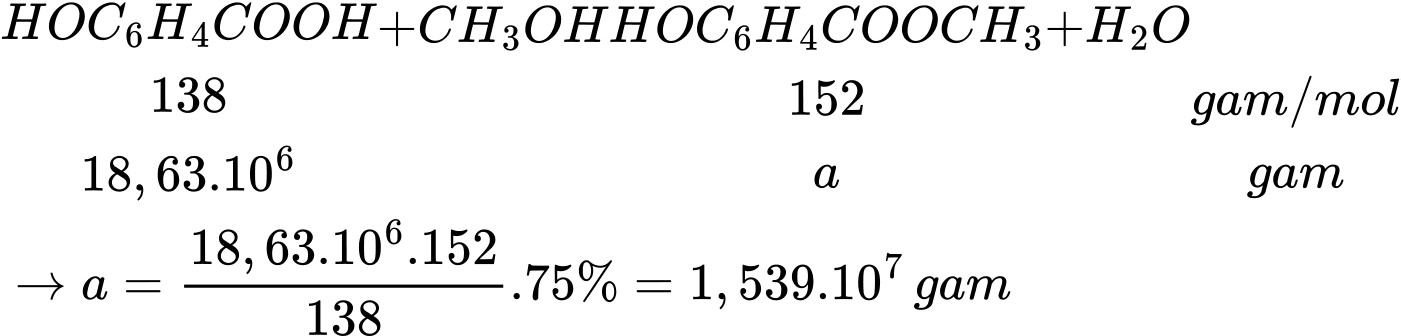
Số tuýp thuốc xoa bóp giảm đau là:
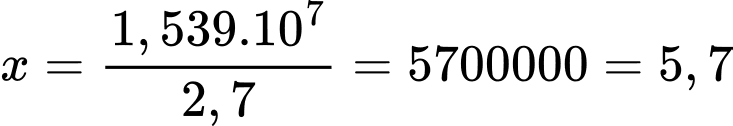 triệu tuýp.
triệu tuýp.⇒ Điền đáp án: 5,7
Câu 25 [705435]: Nitrobenzene với công thức hóa học C6H5NO2, có mùi giống như hạnh nhân. Nó đông lại tạo thành các tinh thể màu vàng lục. Nitrobenzene được sản xuất trên quy mô lớn từ benzene như một tiền chất của aniline. Các bước điều chế nitrobenzene như sau:
(1) Để nguội bình, sau đó rót hỗn hợp phản ứng vào phễu chiết, hỗn hợp tách thành hai lớp.
(2) Tách bỏ phần acid ở bên dưới. Rửa phần chất lỏng còn lại bằng dung dịch sodium carbonate, sau đó rửa bằng nước, thu được chất lỏng nặng hơn nước, có màu vàng nhạt.
(3) Cho từng giọt benzene vào hỗn hợp phản ứng, đồng thời lắc đều và giữ nhiệt độ ở 60 °C trong 1 giờ.
(4) Cho 30 mL dung dịch HNO3 đặc và 25 mL dung dịch H2SO4 đặc vào bình cầu ba cổ có lắp ống sinh hàn, phễu nhỏ giọt và nhiệt kế rồi làm lạnh hỗn hợp đến 30 °C.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình điều chế nitrobenzene (ví dụ: 1234, 4321, ...).
(1) Để nguội bình, sau đó rót hỗn hợp phản ứng vào phễu chiết, hỗn hợp tách thành hai lớp.
(2) Tách bỏ phần acid ở bên dưới. Rửa phần chất lỏng còn lại bằng dung dịch sodium carbonate, sau đó rửa bằng nước, thu được chất lỏng nặng hơn nước, có màu vàng nhạt.
(3) Cho từng giọt benzene vào hỗn hợp phản ứng, đồng thời lắc đều và giữ nhiệt độ ở 60 °C trong 1 giờ.
(4) Cho 30 mL dung dịch HNO3 đặc và 25 mL dung dịch H2SO4 đặc vào bình cầu ba cổ có lắp ống sinh hàn, phễu nhỏ giọt và nhiệt kế rồi làm lạnh hỗn hợp đến 30 °C.
Hãy sắp xếp các bước theo trình tự dãy bốn số để thực hiện được quá trình điều chế nitrobenzene (ví dụ: 1234, 4321, ...).
Nitrobenzene được sản xuất trên quy mô lớn từ benzene như một tiền chất của aniline. Các bước điều chế nitrobenzene như sau:
⭐ Bước 1: Chuẩn bị hỗn hợp phản ứng:
Cho 30 mL dung dịch HNO3 đặc và 25 mL dung dịch H2SO4 đặc vào bình cầu ba cổ có lắp ống sinh hàn, phễu nhỏ giọt và nhiệt kế rồi làm lạnh hỗn hợp đến 30 °C. Ứng với (4)
⭐ Bước 2: Thực hiện phản ứng nitro hóa:
Cho từng giọt benzene vào hỗn hợp phản ứng, đồng thời lắc đều và giữ nhiệt độ ở 60 °C trong 1 giờ ⟶ Ứng với (3)
⭐ Bước 3: Tách sản phẩm khỏi hỗn hợp acid:
Để nguội bình, sau đó rót hỗn hợp phản ứng vào phễu chiết, hỗn hợp tách thành hai lớp ⟶ Ứng với (1)
⭐ Bước 4: Rửa sản phẩm để loại bỏ acid còn sót:
Tách bỏ phần acid ở bên dưới. Rửa phần chất lỏng còn lại bằng dung dịch sodium carbonate, sau đó rửa bằng nước, thu được chất lỏng nặng hơn nước, có màu vàng nhạt ⟶ Ứng với (2)
⇒ Điền đáp án: 4312
⭐ Bước 1: Chuẩn bị hỗn hợp phản ứng:
Cho 30 mL dung dịch HNO3 đặc và 25 mL dung dịch H2SO4 đặc vào bình cầu ba cổ có lắp ống sinh hàn, phễu nhỏ giọt và nhiệt kế rồi làm lạnh hỗn hợp đến 30 °C. Ứng với (4)
⭐ Bước 2: Thực hiện phản ứng nitro hóa:
Cho từng giọt benzene vào hỗn hợp phản ứng, đồng thời lắc đều và giữ nhiệt độ ở 60 °C trong 1 giờ ⟶ Ứng với (3)
⭐ Bước 3: Tách sản phẩm khỏi hỗn hợp acid:
Để nguội bình, sau đó rót hỗn hợp phản ứng vào phễu chiết, hỗn hợp tách thành hai lớp ⟶ Ứng với (1)
⭐ Bước 4: Rửa sản phẩm để loại bỏ acid còn sót:
Tách bỏ phần acid ở bên dưới. Rửa phần chất lỏng còn lại bằng dung dịch sodium carbonate, sau đó rửa bằng nước, thu được chất lỏng nặng hơn nước, có màu vàng nhạt ⟶ Ứng với (2)
⇒ Điền đáp án: 4312
Câu 26 [705436]: Phân tử khối của tetrapeptide mạch hở Gly-Ala-Val-Glu là bao nhiêu?
Khi hình thành liên kết peptide (–CO–NH–), mỗi liên kết mất một phân tử nước (MH2O = 18 g/mol).
Tetrapeptide có 3 liên kết peptide, tức là mất 3 × 18 = 54 g/mol.
Phân tử khối của Gly-Ala-Val-Glu là:
M = 75 + 89 + 117 + 147 – 54 = 374 (gam/mol)
⇒ Điền đáp án: 374
Tetrapeptide có 3 liên kết peptide, tức là mất 3 × 18 = 54 g/mol.
Phân tử khối của Gly-Ala-Val-Glu là:
M = 75 + 89 + 117 + 147 – 54 = 374 (gam/mol)
⇒ Điền đáp án: 374
Câu 27 [705437]: Các nhà khoa học muốn tìm ra loại nhiên liệu mới thay thế cho xăng, ethanol là “một ứng cử viên” cho vị trí này. Giả sử octane (C8H18) làm chất đại diện cho thành phần phức tạp của các hydrocarbon trong xăng. Các dữ liệu được cung cấp như sau:
C8H18(l) + 12,5O2(g) ⟶ 8CO2(g) + 9H2O(l);
C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l);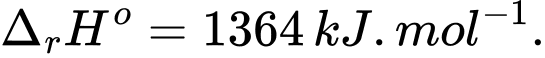
Biết rằng khối lượng riêng của octane và ethanol lần lượt là 0,699 g/mL và 0,785 g/mL. Đốt cháy 1 lít octane tạo ra lượng nhiệt bằng với đốt cháy bao nhiêu L ethanol (Làm tròn đến hàng phần trăm)?
C8H18(l) + 12,5O2(g) ⟶ 8CO2(g) + 9H2O(l);

C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l);
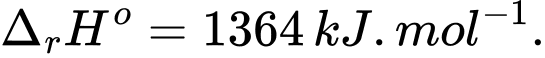
Biết rằng khối lượng riêng của octane và ethanol lần lượt là 0,699 g/mL và 0,785 g/mL. Đốt cháy 1 lít octane tạo ra lượng nhiệt bằng với đốt cháy bao nhiêu L ethanol (Làm tròn đến hàng phần trăm)?
Khối lượng octane là: mC8H18 = V × d = 1 × 0,699 = 0,699 (kg)
Số mol octane là: nC8H18 = m ÷ M = (1 × 0,699) ÷ 114 = 0,0048... (lưu ý ở đây không làm tròn, tránh sai số)
Nhiệt lượng tỏa ra khi đốt cháy 1L C8H18 là:
QC8H18 = [(1 × 0,699) ÷ 114] × 5470 = 26,5522... (không làm tròn)
Nhiệt lượng tỏa ra khi đốt cháy lượng C2H5OH là:
QC2H5OH = [(V × 0,785) ÷ 46] × 1364
Mà nhiệt lượng tạo ra khi đốt cháy 1 L octane bằng với nhiệt lượng tạo ra khi đốt cháy V (L) ethanol nên ta có:
[(V × 0,785) ÷ 46] × 1364 = 26,5522... ⟶ V = 1,4408... ≈ 1,44 (L)
⇒ Điền đáp án: 1,44
Số mol octane là: nC8H18 = m ÷ M = (1 × 0,699) ÷ 114 = 0,0048... (lưu ý ở đây không làm tròn, tránh sai số)
Nhiệt lượng tỏa ra khi đốt cháy 1L C8H18 là:
QC8H18 = [(1 × 0,699) ÷ 114] × 5470 = 26,5522... (không làm tròn)
Nhiệt lượng tỏa ra khi đốt cháy lượng C2H5OH là:
QC2H5OH = [(V × 0,785) ÷ 46] × 1364
Mà nhiệt lượng tạo ra khi đốt cháy 1 L octane bằng với nhiệt lượng tạo ra khi đốt cháy V (L) ethanol nên ta có:
[(V × 0,785) ÷ 46] × 1364 = 26,5522... ⟶ V = 1,4408... ≈ 1,44 (L)
⇒ Điền đáp án: 1,44
Câu 28 [705438]: Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,30 mg/L.Giả thiết sắt trong mẫu nước tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1 : 8. Quá trình tách loại sắt trong 10 m3 mẫu nước trên được thực hiện bằng cách sử dụng 91,575 gam vôi tôi (vừa đủ) để tăng pH , sau đó sục không khí:
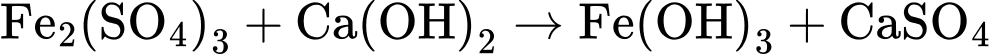
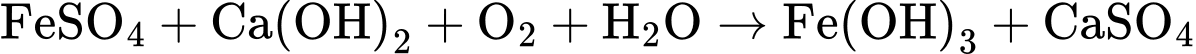
Xác định hàm lượng Fe trong mẫu nước phân tích mg/L.
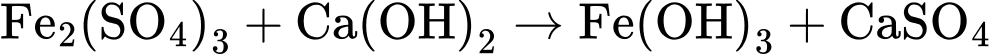
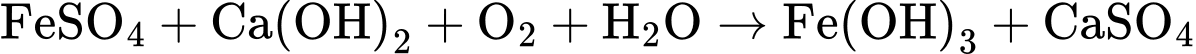
Xác định hàm lượng Fe trong mẫu nước phân tích mg/L.
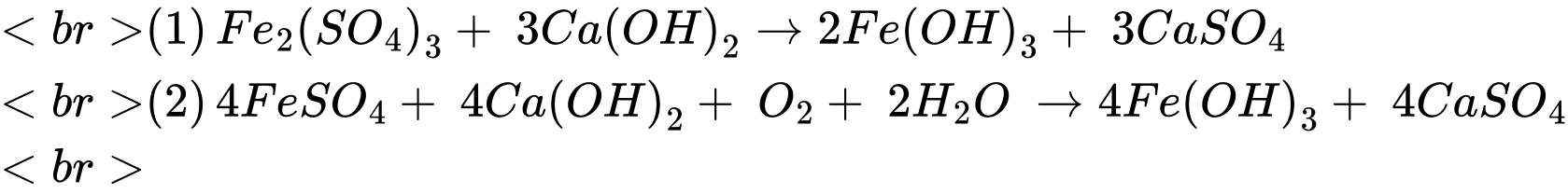
Đổi 10 m3 = 10000 L
Đặt số mol của Fe2(SO4)3 và FeSO4 lần lượt là x và 8x (mol)
Số mol của Ca(OH)2 là: nCa(OH)2 = 91,575 ÷ 74 = 1,2375 (mol)
Từ PTHH số mol của Ca(OH)2 là: nCa(OH)2 = 3x + 8x = 1,2375 (mol) → x = 0,1125 (mol)
Bảo toàn nguyên tố Fe: nFe = 2x + 8x = 1,125 (mol)
Hàm lượng Fe trong mẫu nước phân tích là:
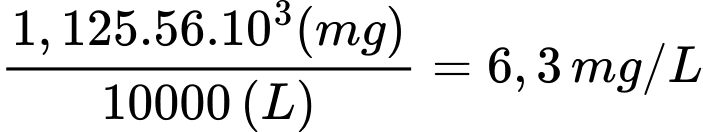
⇒ Điền đáp án: 6,3