PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705439]: Sức điện động chuẩn của ...(1)... được tính bằng ...(2)... của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, pin Galvani, hiệu.
B, pin Galvani, tổng.
C, acquy, hiệu.
D, acquy, tổng.
Sức điện động chuẩn của pin Galvani được tính bằng hiệu của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Công thức:
Eopin = Eocathode − Eoanode
Trong đó:
Eocathode là thế điện cực chuẩn của điện cực dương (nơi xảy ra quá trình khử).
Eoanode là thế điện cực chuẩn của điện cực âm (nơi xảy ra quá trình oxi hóa).
⇒ Chọn đáp án: A Đáp án: A
Công thức:
Eopin = Eocathode − Eoanode
Trong đó:
Eocathode là thế điện cực chuẩn của điện cực dương (nơi xảy ra quá trình khử).
Eoanode là thế điện cực chuẩn của điện cực âm (nơi xảy ra quá trình oxi hóa).
⇒ Chọn đáp án: A Đáp án: A
Câu 2 [705440]: Mg(OH)2 được dùng làm thuốc kháng acid (antacid) dịch vị, thuốc nhuận tràng và thuốc cung cấp magnesium cho cơ thể khi cơ thể thiếu. Tên gọi của Mg(OH)2 là
A, magnesium oxide.
B, manganese hydroxide.
C, manganese oxide.
D, magnesium hydroxide.
Mg là nguyên tố magnesium. OH⁻ là nhóm hydroxide.
→ Mg(OH)2 là magnesium hydroxide, một hợp chất base ít tan trong nước.
Công thức của các hợp chất còn lại:
A. magnesium oxide (MgO) là magnesium oxide, không phải hydroxide.
B. manganese hydroxide (Mn(OH)2) chứa manganese chứ không phải magnesium.
C. manganese oxide (MnO), không liên quan đến Mg(OH)2.
⇒ Chọn đáp án D Đáp án: D
→ Mg(OH)2 là magnesium hydroxide, một hợp chất base ít tan trong nước.
Công thức của các hợp chất còn lại:
A. magnesium oxide (MgO) là magnesium oxide, không phải hydroxide.
B. manganese hydroxide (Mn(OH)2) chứa manganese chứ không phải magnesium.
C. manganese oxide (MnO), không liên quan đến Mg(OH)2.
⇒ Chọn đáp án D Đáp án: D
Câu 3 [310477]: Vật liệu cốt nào sau đây không được sử dụng trong vật liệu composite?
A, sợi carbon.
B, sợi vải.
C, bột nhôm và bột silica.
D, cốt thép.
Vật liệu nền có thể là nhựa nhiệt dẻo hay nhựa nhiệt rắn tuỳ theo mục đích sử dụng.
Vật liệu cốt có thể ở dạng sợi (sợi carbon, sợi vải,..) hoặc dạng bột (bột nhôm, bột silica,...).
⇒ Chọn đáp án D Đáp án: D
Vật liệu cốt có thể ở dạng sợi (sợi carbon, sợi vải,..) hoặc dạng bột (bột nhôm, bột silica,...).
⇒ Chọn đáp án D Đáp án: D
Câu 4 [705441]: Phản ứng giữa ZnO và C để tách kim loại
A, là phản ứng toả nhiệt.
B, là phản ứng không có sự thay đổi số oxi hoá.
C, là phản ứng dựa vào phương pháp thuỷ luyện.
D, có sự tạo thành kẽm ở thể hơi.
Phản ứng giữa ZnO và C để tách kim loại là phản ứng thu nhiệt, dựa vào nguyên tắc phương pháp nhiệt luyện. Kim loại Zn được tạo thành ở dạng hơi.
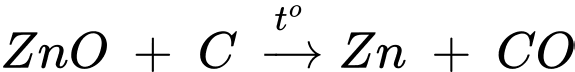
⇒ Chọn đáp án D Đáp án: D
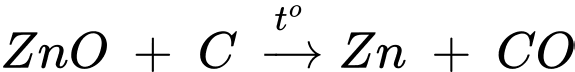
⇒ Chọn đáp án D Đáp án: D
Câu 5 [561021]: Nguyên tử manganese có số oxi hoá +6 trong hợp chất nào sau đây?
A, KMnO4.
B, K2MnO4.
C, MnO2.
D, MnSO4.
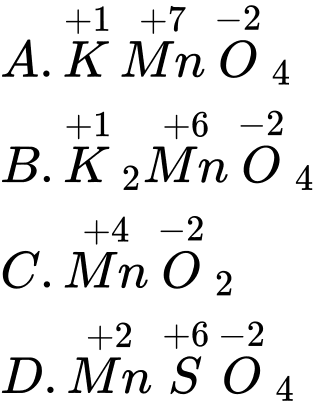
⟹ Chọn đáp án B Đáp án: B
Câu 6 [560912]: Trên bề mặt các hố vôi tôi lâu ngày thường có màng chất rắn do tạo thành hợp chất X không tan màu trắng. Công thức hóa học của X là
A, Ca(NO3)2.
B, CaSO4.
C, CaCO3.
D, CaCrO4.
Trên bề mặt các hố vôi tôi lâu ngày thường có màng chất rắn do tạo thành hợp chất X không tan màu trắng. Phản ứng hóa học xảy ra như sau:
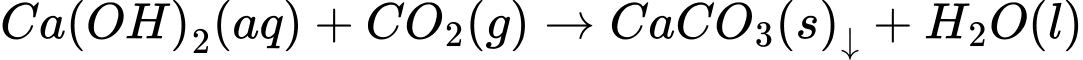
→ Chất X là CaCO3.
⟹ Chọn đáp án C Đáp án: C
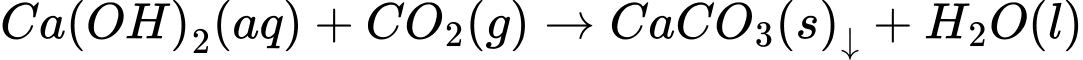
→ Chất X là CaCO3.
⟹ Chọn đáp án C Đáp án: C
Câu 7 [186781]: Phát biểu nào dưới đây không đúng?
A, Hiện tượng phú dưỡng là sự tích tụ lượng lớn chất dinh dưỡng (hợp chất nitrogen và hợp chất phosphorus) trong nguồn nước.
B, Hiện tượng phú dưỡng làm giảm hàm lượng oxygen trong nước, gây ảnh hưởng xấu cho các loài sinh vật khác trong ao, hồ.
C, Hiện tượng phú dưỡng làm rong, rêu, tảo sinh sôi, tạo ra môi trường dinh dưỡng tốt cho sinh vật trong ao, hồ phát triển.
D, Hiện tượng phú dưỡng gây ra nhiều tác động xấu tới hệ sinh thái, môi trường của ao, hồ.
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu, … phát triển nhanh.
*) Nguyên nhân: Do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, … chưa qua xử lí được thải vào ao hồ.
*) Tác hại:
+ Ngăn cản ánh sáng mặt trời, làm giảm sự quang hợp của thực vật thủy sinh.
+ Làm thiếu nguồn oxygen trầm trọng cho tôm, cá, … gây mất cân bằng hệ sinh thái.
+ Gây ô nhiễm môi trường nước, không khí, tạo bùn lắng xuống ao hồ.
*) Biện pháp khắc phục:
+ Xử lí nước thải trước khi cho thải vào môi trường.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm.
+ Khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
→ C sai vì hiện tượng phú dưỡng gây ảnh hưởng đến hệ sinh thái, không tốt cho sự sinh trưởng và phát triển của sinh vật.
⇒ Chọn đáp án C Đáp án: C
*) Nguyên nhân: Do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, … chưa qua xử lí được thải vào ao hồ.
*) Tác hại:
+ Ngăn cản ánh sáng mặt trời, làm giảm sự quang hợp của thực vật thủy sinh.
+ Làm thiếu nguồn oxygen trầm trọng cho tôm, cá, … gây mất cân bằng hệ sinh thái.
+ Gây ô nhiễm môi trường nước, không khí, tạo bùn lắng xuống ao hồ.
*) Biện pháp khắc phục:
+ Xử lí nước thải trước khi cho thải vào môi trường.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm.
+ Khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
→ C sai vì hiện tượng phú dưỡng gây ảnh hưởng đến hệ sinh thái, không tốt cho sự sinh trưởng và phát triển của sinh vật.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [705442]: Hàng năm, có khoảng 50 triệu đến 60 triệu tấn SO2 được thải vào khí quyển! Trong tầng đối lưu, lượng SO2 này hầu hết bị oxy hóa qua một quá trình phức tạp tạo thành H2SO4 gây ra hiện tượng mưa acid. Hiện tại, có hai cách để giảm thiểu lượng khí thải SO2 này. Cách tiếp cận trực tiếp nhất là loại bỏ lưu huỳnh khỏi nhiên liệu hóa thạch trước khi đốt, nhưng về mặt công nghệ, điều này khó thực hiện. Một cách rẻ hơn nhưng lại kém hiệu quả hơn là loại bỏ SO2 khi nó được hình thành. Ví dụ, trong một quy trình, đá vôi dạng bột được phun vào lò hơi hoặc lò nung của nhà máy điện cùng với than. Đá vôi dạng bột phân hủy thành CaO, phản ứng với SO2 tạo thành CaSO3. SO2 còn lại được kết hợp với khói ẩm CaO trong nước tạo thành CaSO3.
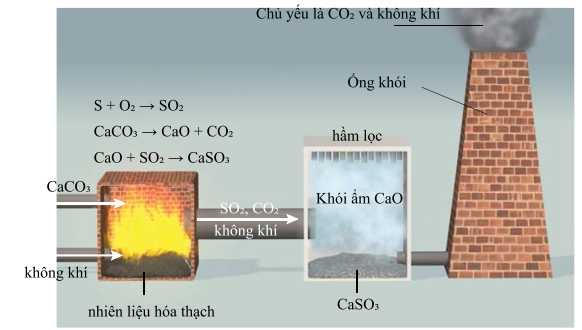
(b) Mục đích chính của việc sử dụng đá vôi dạng bột là để dễ dàng đưa vào lò nung phản ứng.
(c) Phản ứng giữa CaO và SO2 tạo CaSO3 chiếm ưu thế hơn phản ứng giữa CaO và CO2 tạo CaCO3.
(d) Quy trình hạn chế được tối đa lượng SO2 không cho thoát ra ngoài gây ô nhiễm môi trường.
Các phát biểu đúng là

Hình ảnh. Quy trình chung để loại bỏ SO2 khỏi nhiên liệu hóa thạch đang cháy.
(a) SO2 phản ứng trực tiếp với nước mưa tạo thành acid H2SO4 gây ra hiện tượng mưa acid.(b) Mục đích chính của việc sử dụng đá vôi dạng bột là để dễ dàng đưa vào lò nung phản ứng.
(c) Phản ứng giữa CaO và SO2 tạo CaSO3 chiếm ưu thế hơn phản ứng giữa CaO và CO2 tạo CaCO3.
(d) Quy trình hạn chế được tối đa lượng SO2 không cho thoát ra ngoài gây ô nhiễm môi trường.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (d).
C, (c), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
❌ (a) Sai. SO2 sẽ phản ứng với O2 trong không khí tạo SO3, sau đấy SO3 phản ứng với hơi nước tạo H2SO4.
2SO2 + O2 ⟶ 2SO3
SO3 + H2O ⟶ H2SO4
❌ (b) Sai. Mục đích chính của việc sử dụng bột đá vôi, do bột đá vôi có diện tích bề mặt lớn nên sẽ đẩy nhanh tốc độ phản ứng phân hủy đá vôi tạo ra CaO tăng hiệu suất phản ứng.
✔️ (c) Đúng. Từ quy trình phản ứng ta thấy khí thải thoát ra khỏi quy trình chủ yếu là CO2 và không khí.
✔️ (d) Đúng. Phản ứng giữa SO2 và CaO chiếm ưu thế, nên sẽ hạn chế tối đa nhất lượng SO2 không cho thoát ra ngoài gây ô nhiễm môi trường.
Các phát biểu đúng là (c) (d)
⇒ Chọn đáp án C Đáp án: C
❌ (a) Sai. SO2 sẽ phản ứng với O2 trong không khí tạo SO3, sau đấy SO3 phản ứng với hơi nước tạo H2SO4.
2SO2 + O2 ⟶ 2SO3
SO3 + H2O ⟶ H2SO4
❌ (b) Sai. Mục đích chính của việc sử dụng bột đá vôi, do bột đá vôi có diện tích bề mặt lớn nên sẽ đẩy nhanh tốc độ phản ứng phân hủy đá vôi tạo ra CaO tăng hiệu suất phản ứng.
✔️ (c) Đúng. Từ quy trình phản ứng ta thấy khí thải thoát ra khỏi quy trình chủ yếu là CO2 và không khí.
✔️ (d) Đúng. Phản ứng giữa SO2 và CaO chiếm ưu thế, nên sẽ hạn chế tối đa nhất lượng SO2 không cho thoát ra ngoài gây ô nhiễm môi trường.
Các phát biểu đúng là (c) (d)
⇒ Chọn đáp án C Đáp án: C
Câu 9 [585780]: Chất nào dưới đây không là chất hữu cơ?
A, Acetic acid.
B, Urea.
C, Ammonium cyanate.
D, Ethanol.
Hợp chất hữu cơ là hợp chất của carbon trừ: carbon oxide, muối carbonate, hợp chất cyanide, hợp chất cyanate, hợp chất carbide.
→ Ammonium cyanate có công thức hóa học là NH4NCO là hợp chất vô cơ.
⇒ Chọn đáp án C Đáp án: C
→ Ammonium cyanate có công thức hóa học là NH4NCO là hợp chất vô cơ.
⇒ Chọn đáp án C Đáp án: C
Câu 10 [305729]: Chất tham gia phản ứng cộng với hydrogen ở điều kiện thích hợp là
A, Tripalmitin.
B, Tristearin.
C, Ethyl acetate.
D, Ethyl acrylate.
Phân tích các đáp án:
❌ A. Tripalmitin: (C15H31COO)3C3H5: chất béo no nên không cộng hydrogen (H2).
❌ B. Tristearin: (C17H35COO)3C3H5: chất béo no nên không cộng hydrogen (H2).
❌ C. Ethyl acetate: CH3COOCH2CH3: ester no đơn chức ⟶ không cộng H2.
✔️ D. Ethyl acrylate: CH2=CHCOOCH2CH3: ester không no⟶ xảy ra phản ứng:
CH2=CHCOOCH2CH3 + H2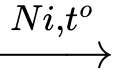 CH3CH2COOCH2CH3.
CH3CH2COOCH2CH3.
⟹ Chọn đáp án D Đáp án: D
❌ A. Tripalmitin: (C15H31COO)3C3H5: chất béo no nên không cộng hydrogen (H2).
❌ B. Tristearin: (C17H35COO)3C3H5: chất béo no nên không cộng hydrogen (H2).
❌ C. Ethyl acetate: CH3COOCH2CH3: ester no đơn chức ⟶ không cộng H2.
✔️ D. Ethyl acrylate: CH2=CHCOOCH2CH3: ester không no⟶ xảy ra phản ứng:
CH2=CHCOOCH2CH3 + H2
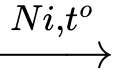 CH3CH2COOCH2CH3.
CH3CH2COOCH2CH3.⟹ Chọn đáp án D Đáp án: D
Câu 11 [308350]: Phân tử saccharose được tạo bởi
A, α-glucose và α-fructose.
B, α-glucose và β-fructose.
C, β-glucose và β-fructose.
D, α-glucose và β-glucose.
HD: Quan sát cấu tạo của saccharose:
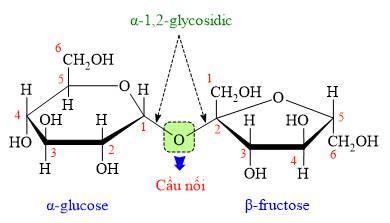
⇒ Trả lời: Phân tử saccharose được tạo bởi hai gốc α-glucose và β-fructose ⇝ Chọn đáp án B. ♦ Đáp án: B

⇒ Trả lời: Phân tử saccharose được tạo bởi hai gốc α-glucose và β-fructose ⇝ Chọn đáp án B. ♦ Đáp án: B
Câu 12 [308514]: Chất nào sau đây thuộc loại amine bậc một ?
A, (CH3)3N.
B, CH3NHCH3.
C, CH3NH2.
D, CH3CH2NHCH3.
Bậc của amine được xác định đơn giản bằng cách dựa vào công thức cấu tạo:
+ Bậc một: có nhóm chức dạng –NH2 đính với một gốc hydrocarbon.
+ Bậc hai: có nhóm chức dạng –NH– đính với hai gốc hydrocarbon.
+ Bậc ba: có nhóm chức dạng ≡N đính với ba gốc hydrocarbon.
Chất thuộc loại amine bậc một là CH3NH2.
CH3NHCH3 và CH3CH2NHCH3 là 2 amine bậc hai.
(CH3)3N là amine bậc ba.
⇒ Chọn đáp án C Đáp án: C
+ Bậc một: có nhóm chức dạng –NH2 đính với một gốc hydrocarbon.
+ Bậc hai: có nhóm chức dạng –NH– đính với hai gốc hydrocarbon.
+ Bậc ba: có nhóm chức dạng ≡N đính với ba gốc hydrocarbon.
Chất thuộc loại amine bậc một là CH3NH2.
CH3NHCH3 và CH3CH2NHCH3 là 2 amine bậc hai.
(CH3)3N là amine bậc ba.
⇒ Chọn đáp án C Đáp án: C
Câu 13 [705443]: Phản ứng của ethylene với bromine diễn ra như sau:
CH2=CH2 + Br2 → CH2Br–CH2Br
Cơ chế của phản ứng xảy ra như sau:
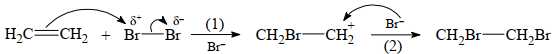
Cho các phát biểu sau:
(a) Hai nguyên tử Br sẽ cộng vào cùng một nguyên tử carbon nối đôi.
(b) Mật độ electron trên nối đôi C=C nhiều hơn trên nối đơn C–C.
(c) Phân tử ethylene có cấu tạo đối xứng nên chỉ tạo một sản phẩm trung gian.
(d) Giai đoạn (1), có sự phân cắt dị li (cặp electron liên kết thuộc về riêng một nguyên tử Br).
Các phát biểu đúng là
CH2=CH2 + Br2 → CH2Br–CH2Br
Cơ chế của phản ứng xảy ra như sau:
Cho các phát biểu sau:
(a) Hai nguyên tử Br sẽ cộng vào cùng một nguyên tử carbon nối đôi.
(b) Mật độ electron trên nối đôi C=C nhiều hơn trên nối đơn C–C.
(c) Phân tử ethylene có cấu tạo đối xứng nên chỉ tạo một sản phẩm trung gian.
(d) Giai đoạn (1), có sự phân cắt dị li (cặp electron liên kết thuộc về riêng một nguyên tử Br).
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
❌ (a) Sai. Từ cơ chế phản ứng 2 nguyên tử Br sẽ cộng và 2 nguyên tử carbon có nối đôi.
✔️ (b) Đúng. Liên kết C=C tạo từ 2 cặp electron dùng chung nên sẽ có mật độ electron cao hơn liên kết C-C tạo tử 1 cặp electron dùng chung.
✔️ (c) Đúng. Khi có cấu tạo đối xứng nên sản phẩm trung gian tạo ra giống nhau.
✔️ (d) Đúng. Từ cơ chế phản ứng khi phân tách 2 nguyên tử Br thì 1 nguyên tử chiếm cả cặp electron dùng chung trở thành anion Br- còn nguyên tử Br còn lại bị mất một electron.
Các phát biểu đúng là (b) (c) (d)
⇒ Chọn đáp án D Đáp án: D
❌ (a) Sai. Từ cơ chế phản ứng 2 nguyên tử Br sẽ cộng và 2 nguyên tử carbon có nối đôi.
✔️ (b) Đúng. Liên kết C=C tạo từ 2 cặp electron dùng chung nên sẽ có mật độ electron cao hơn liên kết C-C tạo tử 1 cặp electron dùng chung.
✔️ (c) Đúng. Khi có cấu tạo đối xứng nên sản phẩm trung gian tạo ra giống nhau.
✔️ (d) Đúng. Từ cơ chế phản ứng khi phân tách 2 nguyên tử Br thì 1 nguyên tử chiếm cả cặp electron dùng chung trở thành anion Br- còn nguyên tử Br còn lại bị mất một electron.
Các phát biểu đúng là (b) (c) (d)
⇒ Chọn đáp án D Đáp án: D
Câu 14 [705444]: Dung dịch X gồm valine, aspartic acid (HOOCCH2CH(NH2)COOH) và lysine trong môi trường pH = 7. Thấm dung dịch X lên một tờ giấy, rồi nối tờ giấy với hai điện cực của nguồn điện một chiều thu được kết quả như sau:
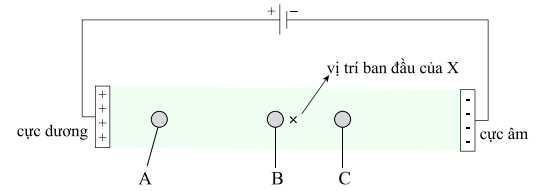
Cho các nhận định sau:
(a) Trong môi trường pH = 7, A tồn tại ở dạng anion, B tồn tại ở dạng trung hòa điện.
(b) Vị trí B là valine (dạng trung hòa điện), C là aspartic acid (dạng cation).
(c) Trong môi trường pH = 2, aspartic acid di chuyển về phía cực âm.
(d) Trong môi trường pH = 7 có thể tách riêng ba amino acid: lysine, aspartic acid, valine.
(e) Tại pH = 11, tổng điện tích trong phân tử lysine là +1.
Các nhận định đúng là

Cho các nhận định sau:
(a) Trong môi trường pH = 7, A tồn tại ở dạng anion, B tồn tại ở dạng trung hòa điện.
(b) Vị trí B là valine (dạng trung hòa điện), C là aspartic acid (dạng cation).
(c) Trong môi trường pH = 2, aspartic acid di chuyển về phía cực âm.
(d) Trong môi trường pH = 7 có thể tách riêng ba amino acid: lysine, aspartic acid, valine.
(e) Tại pH = 11, tổng điện tích trong phân tử lysine là +1.
Các nhận định đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d), (e).
D, (b), (c), (d).
Dạng tồn tại của các amino acid trong dung dịch X tại pH = 7:
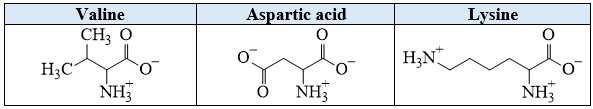
+ Tổng điện tích của valine là 0, tồn tại ở dạng trung hòa nên valine hầu như không di chuyển trong điện trường → B là valine.
+ Tổng điện tích của aspartic acid là -1, tồn tại ở dạng anion nên aspartic acid sẽ di chuyển sang cực dương trong điện trường → A là aspartic acid.
+ Tổng điện tích của lysine là +1 dạng cation, nên lysine sẽ di chuyển sang cực âm trong điện trường → C là lysine.
Phân tích các nhận định:
✔️ (a) Đúng. Trong môi trường pH = 7, A tồn tại ở dạng anion, B tồn tại ở dạng trung hòa điện.
❌ (b) Sai. Vị trí B là valine (dạng trung hòa điện), C là lysine (dạng cation).
✔️ (c) Đúng. Trong môi trường pH = 2, aspartic acid di chuyển về phía cực âm.
✔️ (d) Đúng. Trong môi trường pH = 7 có thể tách riêng ba amino acid: lysine, aspartic acid, valine. Trong đó acid di chuyển về cực dương, lys di chuyển về cực âm và val gần như không di chuyển.
❌ (e) Sai. Tại pH = 11 dạng tồn tại của lysine là anion có tổng điện tích là -1.
Các nhận định đúng là (a) (c) (d)
⇒ Chọn đáp án B Đáp án: B

+ Tổng điện tích của valine là 0, tồn tại ở dạng trung hòa nên valine hầu như không di chuyển trong điện trường → B là valine.
+ Tổng điện tích của aspartic acid là -1, tồn tại ở dạng anion nên aspartic acid sẽ di chuyển sang cực dương trong điện trường → A là aspartic acid.
+ Tổng điện tích của lysine là +1 dạng cation, nên lysine sẽ di chuyển sang cực âm trong điện trường → C là lysine.
Phân tích các nhận định:
✔️ (a) Đúng. Trong môi trường pH = 7, A tồn tại ở dạng anion, B tồn tại ở dạng trung hòa điện.
❌ (b) Sai. Vị trí B là valine (dạng trung hòa điện), C là lysine (dạng cation).
✔️ (c) Đúng. Trong môi trường pH = 2, aspartic acid di chuyển về phía cực âm.
✔️ (d) Đúng. Trong môi trường pH = 7 có thể tách riêng ba amino acid: lysine, aspartic acid, valine. Trong đó acid di chuyển về cực dương, lys di chuyển về cực âm và val gần như không di chuyển.
❌ (e) Sai. Tại pH = 11 dạng tồn tại của lysine là anion có tổng điện tích là -1.
Các nhận định đúng là (a) (c) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 15 [304122]: Ester nào sau đây có công thức phân tử C4H6O2?
A, Phenyl acetate.
B, Vinyl acetate.
C, Propyl acetate.
D, Ethyl acetate.
Phân tích các đáp án:
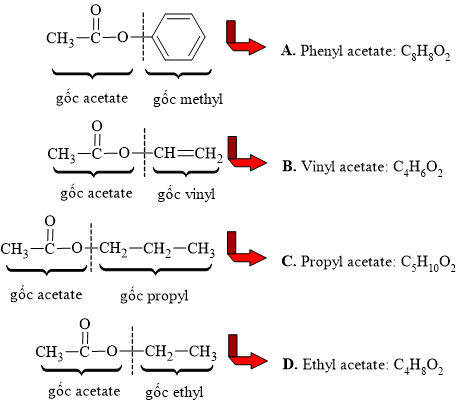
⟹ Ester thỏa mãn yêu cầu là vinyl acetate
⟹ Chọn đáp án B. Đáp án: B

⟹ Ester thỏa mãn yêu cầu là vinyl acetate
⟹ Chọn đáp án B. Đáp án: B
Câu 16 [705445]: “...(1)... là quá trình kết hợp nhiều phân tử nhỏ thành phân tử lớn đồng thời giải phóng những ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, Chuẩn độ, phân tử lớn khác.
B, Trùng hợp, phân tử lớn khác.
C, Trùng ngưng, phân tử nhỏ khác.
D, Trùng ngưng, phân tử lớn khác.
“Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ thành phân tử lớn đồng thời giải phóng những phân tử nhỏ khác”
(Phân biệt với trùng hợp: là quá trình mà các phân tử nhỏ gọi là monomer kết hợp với nhau theo một chuỗi hoặc mạng lưới để tạo thành các phân tử lớn hơn, được gọi là polymer.)
⇒ Chọn đáp án C Đáp án: C
(Phân biệt với trùng hợp: là quá trình mà các phân tử nhỏ gọi là monomer kết hợp với nhau theo một chuỗi hoặc mạng lưới để tạo thành các phân tử lớn hơn, được gọi là polymer.)
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hoá lithium – iodine (gồm hai cặp oxi hoá khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Khi pin hoạt động, lithium bị oxi hoá và iodine bị khử. Biết EoLi+/Li = –3,04 V, EoI2/2I- = +0,54 V, Li = 6,9. Điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s).

Câu 17 [705446]: Cho các nhận định sau, nhận định nào không đúng?
A, Iodine là cathode, lithium là anode.
B, Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-
C, Sức điện động chuẩn của pin là 3,58 V.
D, Cực dương xảy ra quá trình: Li → Li+ + 1e, cực âm xảy ra quá trình: I2 + 2e →2I-.
Ta có: 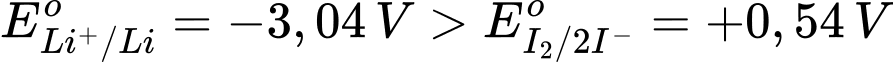 → Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
→ Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
Quá trình xảy ra trong pin:
Cathode (+): I2 + 2e ⟶ 2I–
Anode (–): Li ⟶ Li+ + 1e
Phản ứng trong pin: 2Li + I2 ⟶ 2Li+ + 2I–
⟶ Epin = E(+) – E(–) = 0,54 – (–3,04) = 3,58 V
Phân tích các nhận định:
✔️ A. Đúng. Iodine là cathode, lithium là anode.
✔️ B. Đúng. Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-.
✔️ C. Đúng. Sức điện động chuẩn của pin là 3,58 V.
❌ D. Sai. Cực dương xảy ra quá trình: I2 + 2e →2I-, cực âm xảy ra quá trình: Li → Li+ + 1e.
⇒ Chọn đáp án D Đáp án: D
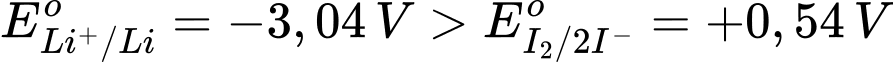 → Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)
→ Li+/Li vai trò điện cực anode (–), I2/2I– vai trò làm điện cực cathode (+)Quá trình xảy ra trong pin:
Cathode (+): I2 + 2e ⟶ 2I–
Anode (–): Li ⟶ Li+ + 1e
Phản ứng trong pin: 2Li + I2 ⟶ 2Li+ + 2I–
⟶ Epin = E(+) – E(–) = 0,54 – (–3,04) = 3,58 V
Phân tích các nhận định:
✔️ A. Đúng. Iodine là cathode, lithium là anode.
✔️ B. Đúng. Phản ứng tổng cộng xảy ra trong pin khi pin hoạt động là 2Li + I2 → 2Li+ + 2I-.
✔️ C. Đúng. Sức điện động chuẩn của pin là 3,58 V.
❌ D. Sai. Cực dương xảy ra quá trình: I2 + 2e →2I-, cực âm xảy ra quá trình: Li → Li+ + 1e.
⇒ Chọn đáp án D Đáp án: D
Câu 18 [705447]: Nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong bao nhiêu ngày?
A, 648 ngày.
B, 1554 ngày.
C, 378 ngày.
D, 965 ngày.
Với t (thời gian, đơn vị: giây). Gọi a là số ngày cần tìm, đổi sang giây ta được: a × 24 × 3600 = t (giây)
Áp dụng định luật Faraday, ta có:
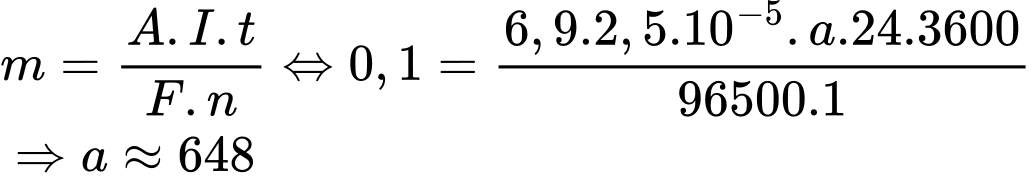
Vậy nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong 648 ngày.
⇒ Chọn đáp án A Đáp án: A
Áp dụng định luật Faraday, ta có:
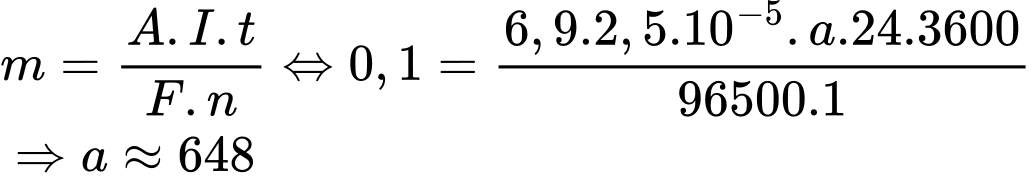
Vậy nếu pin tạo ra một dòng điện ổn định bằng 2,5×10-5 thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động tối đa trong 648 ngày.
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [560572]: Mạ điện là một trong những ứng dụng quan trọng của điện phân, hình dưới đây mô tả quá trình mạ silver lên một chiếc bình bằng thép.
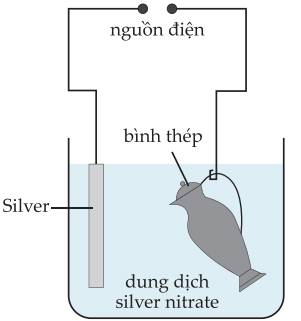

Trong quá trình mạ điện, vật cần mạ được gắn với cực âm cathode, kim loại mạ gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
Mạ điện là một công nghệ điện phân. Quá trình tổng quát là:
– Trên anode xảy ra quá trình hòa tan kim loại:
M – ne ⟶ Mn+
– Trên cathode xảy ra quá trình cation phóng điện trở thành kim loại mạ:
Mn+ + ne → M
Phân tích các phát biểu:
✔️a) Đúng. Trong quá trình mạ điện, vật cần mạ (bình thép) được gắn với cực âm cathode, kim loại mạ (silver) gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
❌b) Sai. Trên anode xảy ra quá trình hòa tan kim loại: Ag(s) – e ⟶ Ag+(aq)
✔️c) Đúng. Trên anode xảy ra quá trình hòa tan kim loại
❌d) Sai. Ion Ag+ di chuyển về cathode (cực âm), bị khử thành kim loại Ag và phủ lên bề mặt của bình thép.
Mạ điện là một công nghệ điện phân. Quá trình tổng quát là:
– Trên anode xảy ra quá trình hòa tan kim loại:
M – ne ⟶ Mn+
– Trên cathode xảy ra quá trình cation phóng điện trở thành kim loại mạ:
Mn+ + ne → M
Phân tích các phát biểu:
✔️a) Đúng. Trong quá trình mạ điện, vật cần mạ (bình thép) được gắn với cực âm cathode, kim loại mạ (silver) gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
❌b) Sai. Trên anode xảy ra quá trình hòa tan kim loại: Ag(s) – e ⟶ Ag+(aq)
✔️c) Đúng. Trên anode xảy ra quá trình hòa tan kim loại
❌d) Sai. Ion Ag+ di chuyển về cathode (cực âm), bị khử thành kim loại Ag và phủ lên bề mặt của bình thép.
Câu 20 [705448]: Một bạn học sinh tiến hành các thí nghiệm như sau:
■ Bước 1: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
■ Bước 2: Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
■ Bước 1: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
■ Bước 2: Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
Hiện tượng: Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride, sodium chloride và potassium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí là cháy với ngọn lửa màu lần lượt là đỏ tía, màu vàng và màu tím.
Phân tích các phát biểu:
✔️ a) Đúng. Que nhúng vào dung dịch lithium chloride sẽ cháy với ngọn lửa màu đỏ tía.
✔️ b) Đúng. Platinum (Pt) ở dạng tinh khiết, không bị oxi hóa ở bất cứ nhiệt độ nào. Kim loại này khó bị ăn mòn, chịu được nhiệt độ cao nên được dùng để làm que đốt.
❌ c) Sai. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên nếu thay NaCl bằng NaNO3 thì que nhúng vào dung dịch vẫn sẽ cháy với ngọn lửa màu vàng chứ không phải màu tím.
✔️ d) Đúng. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên có thể nhận biết riêng từng cation kim loại
Phân tích các phát biểu:
✔️ a) Đúng. Que nhúng vào dung dịch lithium chloride sẽ cháy với ngọn lửa màu đỏ tía.
✔️ b) Đúng. Platinum (Pt) ở dạng tinh khiết, không bị oxi hóa ở bất cứ nhiệt độ nào. Kim loại này khó bị ăn mòn, chịu được nhiệt độ cao nên được dùng để làm que đốt.
❌ c) Sai. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên nếu thay NaCl bằng NaNO3 thì que nhúng vào dung dịch vẫn sẽ cháy với ngọn lửa màu vàng chứ không phải màu tím.
✔️ d) Đúng. Các kim loại kiềm tự do cũng như hợp chất của chúng khi bị đốt sẽ cháy cho ngọn lửa có màu đặc trưng nên có thể nhận biết riêng từng cation kim loại
Câu 21 [705449]: Tiến hành thí nghiệm hòa tan cellulose trong nước Schweizer theo bước sau:
∎ Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
∎ Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20 % vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
∎ Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
∎ Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
∎ Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20 % vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
∎ Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Bước 1: Hoà tan hoàn toàn 2,5 gam CuSO4.5H2O vào 100 mL nước trong cốc thuỷ tinh. Thêm tiếp vào cốc 10 mL dung dịch NaOH 10 %, vừa thêm vừa khuấy.
CuSO4 + 2NaOH ⟶ Cu(OH)2 + Na2SO4
Cu2+ + 2OH– ⟶ Cu(OH)2
Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20% vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
Cu(OH)2 + 4NH3 ⟶ [Cu(NH3)4](OH)2
Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể thay muối CuSO4.5H2O bằng muối Cu(NO3)2.6H2O vì chỉ cần tạo ra Cu(OH)2 nên khi đổi muối thì phương trình ion vẫn không đổi.
Cu2+ + 2OH– ⟶ Cu(OH)2
✔️ b) Đúng. Bước 2 kết tủa tan hình thành phức chất [Cu(NH3)4](OH)2.
❌ c) Sai. Cellulose không bị thủy phân, chỉ bị thủy phân trong môi trường acid hoặc enzyme.
✔️ d) Đúng. Bước 3 chứng minh celllulose có khả năng tan trong nước Schweizer.
CuSO4 + 2NaOH ⟶ Cu(OH)2 + Na2SO4
Cu2+ + 2OH– ⟶ Cu(OH)2
Bước 2: Lọc lấy kết tủa rồi cho kết tủa vào một cốc 100 mL mới, tiếp tục thêm 20 mL dung dịch NH3 20% vào cốc. Khuấy đều cho đến khi kết tủa tan hết, hình thành nước Schweizer.
Cu(OH)2 + 4NH3 ⟶ [Cu(NH3)4](OH)2
Bước 3: Sau đó, cho một nhúm bông vào cốc, khuấy đến khi tạo thành dung dịch đồng nhất.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể thay muối CuSO4.5H2O bằng muối Cu(NO3)2.6H2O vì chỉ cần tạo ra Cu(OH)2 nên khi đổi muối thì phương trình ion vẫn không đổi.
Cu2+ + 2OH– ⟶ Cu(OH)2
✔️ b) Đúng. Bước 2 kết tủa tan hình thành phức chất [Cu(NH3)4](OH)2.
❌ c) Sai. Cellulose không bị thủy phân, chỉ bị thủy phân trong môi trường acid hoặc enzyme.
✔️ d) Đúng. Bước 3 chứng minh celllulose có khả năng tan trong nước Schweizer.
Câu 22 [705450]: Một hợp chất X chứa nhóm chức carbonyl được tiến hành hành nghiên cứu tính chất hóa học như sau:
∎ X không có phản ứng với thuốc thử Tollens.
∎ X không có phản ứng iodoform.
Kết quả phổ hồng ngoại (phổ IR) và phổ khối lượng (phổ MS) của hợp chất X được cho dưới đây:
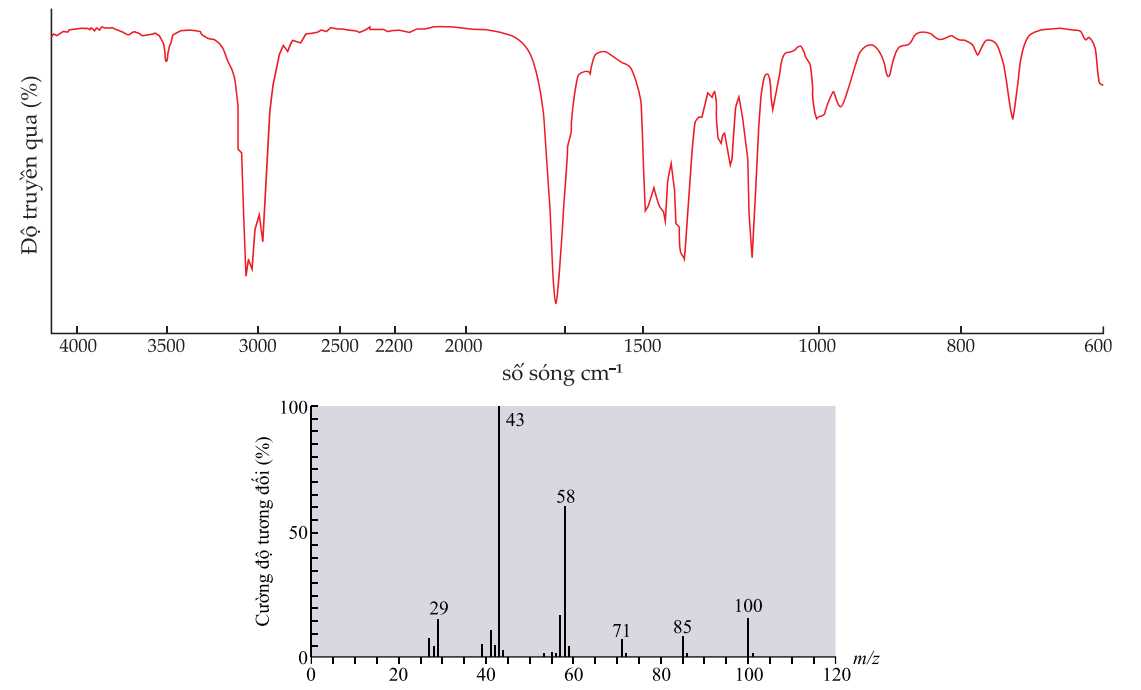
∎ X không có phản ứng với thuốc thử Tollens.
∎ X không có phản ứng iodoform.
Kết quả phổ hồng ngoại (phổ IR) và phổ khối lượng (phổ MS) của hợp chất X được cho dưới đây:

Một hợp chất X chứa nhóm chức carbonyl được tiến hành hành nghiên cứu tính chất hóa học như sau:
X không có phản ứng với thuốc thử Tollens → X không có nhóm chức -CHO
X không có phản ứng iodoform → X không có dạng CH3-CO-R
Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
Từ phổ MS thấy phân tử khối của X là 100 gam/mol
Gọi công thức của X có dạng CxHyOz
MX = 12x + y + 16z = 100 (gam/mol)
Với z = 1 → x = 6; y = 12
Công thức phân tử của X là C6H12O
Với z = 2 → x = 5; y = 8
Công thức phân tử của X là C5H8O2 (loại vì không có CTCT phù hợp)
Với z = 4 → giá trị x = 2; y = 4 là phù hợp
Công thức phân tử của X là C4H4O3 (loại vì không có CTCT phù hợp)
Khi giá trị z càng lớn thì không có công thức cấu tạo của X thỏa mãn yêu cầu bài ra.
→ X có công thức phân tử là C6H12O
Các công thức cấu tạo thỏa mãn của X là:
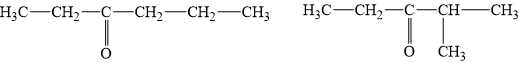
Phân tích các phát biểu:
✔️ a) Đúng. Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
✔️ b) Đúng. X không có phản ứng iodoform → X không có dạng CH3-CO-R
❌ c) Sai. Công thức phân tử của hợp chất X là C6H12O.
❌ d) Sai. X có 2 công thức cấu tạo tỏa mãn điều kiện đề bài.
X không có phản ứng với thuốc thử Tollens → X không có nhóm chức -CHO
X không có phản ứng iodoform → X không có dạng CH3-CO-R
Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
Từ phổ MS thấy phân tử khối của X là 100 gam/mol
Gọi công thức của X có dạng CxHyOz
MX = 12x + y + 16z = 100 (gam/mol)
Với z = 1 → x = 6; y = 12
Công thức phân tử của X là C6H12O
Với z = 2 → x = 5; y = 8
Công thức phân tử của X là C5H8O2 (loại vì không có CTCT phù hợp)
Với z = 4 → giá trị x = 2; y = 4 là phù hợp
Công thức phân tử của X là C4H4O3 (loại vì không có CTCT phù hợp)
Khi giá trị z càng lớn thì không có công thức cấu tạo của X thỏa mãn yêu cầu bài ra.
→ X có công thức phân tử là C6H12O
Các công thức cấu tạo thỏa mãn của X là:
Phân tích các phát biểu:
✔️ a) Đúng. Từ phổ hồng ngoại X có tín hiệu ở khoảng số sóng 1700 cm-1 đặc trưng cho liên kết C=O.
✔️ b) Đúng. X không có phản ứng iodoform → X không có dạng CH3-CO-R
❌ c) Sai. Công thức phân tử của hợp chất X là C6H12O.
❌ d) Sai. X có 2 công thức cấu tạo tỏa mãn điều kiện đề bài.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [308775]: Cho một peptide X được tạo nên bởi n gốc alanine có khối lượng phân tử là
302 g/mol. Giá trị của n là bao nhiêu?
Peptide X được tạo nên bởi n gốc Ala có dạng (Ala)n với n – 1 liên kết peptide
Phân tử khối của peptide X là:
MX = 89n – 18(n – 1) = 302 → n = 4.
⇒ Điền đáp án: 4
Phân tử khối của peptide X là:
MX = 89n – 18(n – 1) = 302 → n = 4.
⇒ Điền đáp án: 4
Câu 24 [705451]: Muối Fe2(SO4)3 khi tan trong nước sẽ phân li thành các ion Fe3+ và SO42–. Môi trường của dung dịch có tính acid do quá trình hình thành H3O+:
Fe3+(aq) + nH2O(l) → [Fe(OH2)6](aq)
[Fe(OH2)6](aq) + nH2O(l) → [Fe(OH)n(OH2)6-n]p+(aq) + nH3O+(aq)
Nếu điện tích của phức chất [Fe(OH)n(OH2)6-n]p+ là 1+ thì giá trị của n là bao nhiêu?
Fe3+(aq) + nH2O(l) → [Fe(OH2)6](aq)
[Fe(OH2)6](aq) + nH2O(l) → [Fe(OH)n(OH2)6-n]p+(aq) + nH3O+(aq)
Nếu điện tích của phức chất [Fe(OH)n(OH2)6-n]p+ là 1+ thì giá trị của n là bao nhiêu?
Phức chất [Fe(OH)n(OH2)6-n]p+ với ion trung tâm là Fe3+ và phối tử là OH- và phối tử trung hòa H2O.
Điện tích của phức chất [Fe(OH)n(OH2)6-n]p+ là 1+
→ +3 + [n × (-1)] + 0 = +1 → n = 2
⇒ Điền đáp án: 2
Điện tích của phức chất [Fe(OH)n(OH2)6-n]p+ là 1+
→ +3 + [n × (-1)] + 0 = +1 → n = 2
⇒ Điền đáp án: 2
Câu 25 [705452]: Một nhóm học sinh tiến hành thí nghiệm thủy phân hoàn toàn tinh bột để điều chế glucose, sau đó thử tính chất của glucose bằng thuốc thử Fehling. Do quá trình không xảy ra các hiện tượng có thể quan sát nên để biết tiến trình của phản ứng thủy phân có thể sử dụng thêm iodine làm chất nhận biết. Các bước trong thí nghiệm này như sau:
(1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
(2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
(3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
(4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
Hãy sắp xếp số thứ tự các bước theo trình tự thành dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4213, ...).
(1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
(2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
(3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
(4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
Hãy sắp xếp số thứ tự các bước theo trình tự thành dãy bốn số để thực hiện thí nghiệm trên (ví dụ: 1234, 4213, ...).
Các bước trong thí nghiệm này như sau:
⭐Bước 1: Chuẩn bị dung dịch hồ tinh bột và H2SO4, sau đó đun nóng để thủy phân tinh bột thành glucose. Đây là bước khởi đầu.
⟶ (2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
⭐Bước 2: Kiểm tra tiến trình thủy phân bằng cách lấy một ít dung dịch và nhỏ vào ống nghiệm chứa iodine. Nếu còn tinh bột, dung dịch sẽ có màu xanh tím; nếu đã thủy phân hoàn toàn, màu sẽ nhạt dần và mất hẳn.
⟶ (1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
⭐Bước 3: Khi dung dịch đã thủy phân hoàn toàn, lấy một phần dung dịch và trung hòa bằng NaOH để tạo môi trường kiềm, cần thiết trước khi thực hiện phản ứng với Fehling.
⟶ (4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
⭐Bước 4: Thử tính chất của glucose bằng thuốc thử Fehling (trộn với CuSO4 và đun nóng để quan sát kết tủa đỏ gạch của Cu2O nếu có glucose).
⟶ (3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
Vậy thứ tự tiến hành các bước là: 2143
⇒ Điền đáp án: 2143
⭐Bước 1: Chuẩn bị dung dịch hồ tinh bột và H2SO4, sau đó đun nóng để thủy phân tinh bột thành glucose. Đây là bước khởi đầu.
⟶ (2) Cho vào ống nghiệm (a) dung dịch hồ tinh bột 2% và dung dịch H2SO4 10%, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (b) dung dịch I2 trong KI.
⭐Bước 2: Kiểm tra tiến trình thủy phân bằng cách lấy một ít dung dịch và nhỏ vào ống nghiệm chứa iodine. Nếu còn tinh bột, dung dịch sẽ có màu xanh tím; nếu đã thủy phân hoàn toàn, màu sẽ nhạt dần và mất hẳn.
⟶ (1) Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (a) nhỏ vào ống nghiệm (b) để kiểm tra tiến trình thủy phân.
⭐Bước 3: Khi dung dịch đã thủy phân hoàn toàn, lấy một phần dung dịch và trung hòa bằng NaOH để tạo môi trường kiềm, cần thiết trước khi thực hiện phản ứng với Fehling.
⟶ (4) Lấy khoảng 1 mL dung dịch đã thuỷ phân hoàn toàn sang ống nghiệm (c), thêm dần từng giọt dung dịch NaOH 10% cho đến môi trường kiềm.
⭐Bước 4: Thử tính chất của glucose bằng thuốc thử Fehling (trộn với CuSO4 và đun nóng để quan sát kết tủa đỏ gạch của Cu2O nếu có glucose).
⟶ (3) Thêm tiếp vào ống nghiệm (c) vài giọt dung dịch CuSO4 5%, lắc đều rồi đun nóng ống nghiệm.
Vậy thứ tự tiến hành các bước là: 2143
⇒ Điền đáp án: 2143
Câu 26 [705453]: Cho salicylic acid (hay 2-hydroxylbenzoic acid) phản ứng với methyl alcohol có mặt sulfuric acid làm xúc tác, thu được methyl salicylate (C8H8O3) dùng làm chất giảm đau. Để sản xuất 15,4 triệu miếng cao dán giảm đau khi vận động thể thao cần tối thiểu m tấn salicylic acid từ phản ứng trên. Biết mỗi miếng cao dán có chứa 105 mg methyl salicylate và hiệu suất phản ứng đạt 70%. Giá trị của m là bao nhiêu? (Kết quả làm tròn đến hàng phần mười)


Khối lượng methyl salicylate từ miếng cao dán là
mC8H8O3 = 15,4.106.105 = 1,617.109 (mg) = 1,617 tấn
Với khối lượng salicylic acid từ phản ứng trên cần để sản xuất 15,4 triệu miếng cao dán giảm đau khi vận động thể thao là m (tấn), ta có:
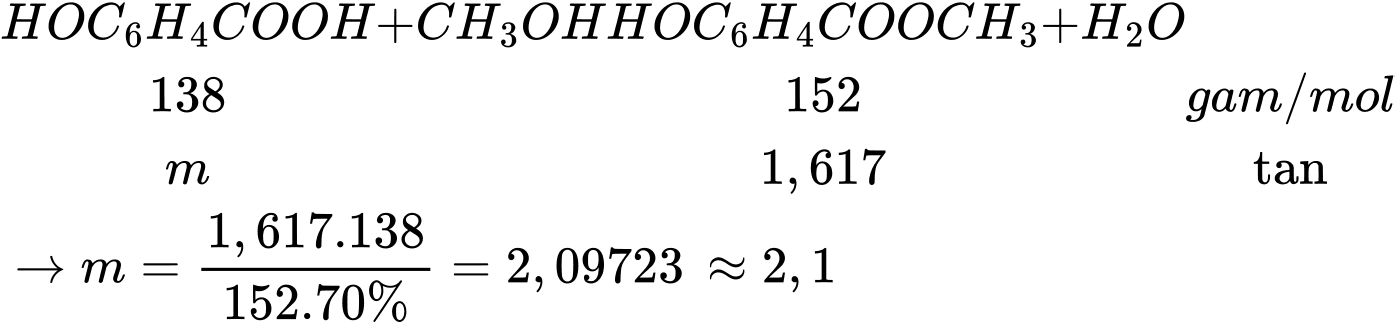
⇒ Điền đáp án: 2,1
mC8H8O3 = 15,4.106.105 = 1,617.109 (mg) = 1,617 tấn
Với khối lượng salicylic acid từ phản ứng trên cần để sản xuất 15,4 triệu miếng cao dán giảm đau khi vận động thể thao là m (tấn), ta có:
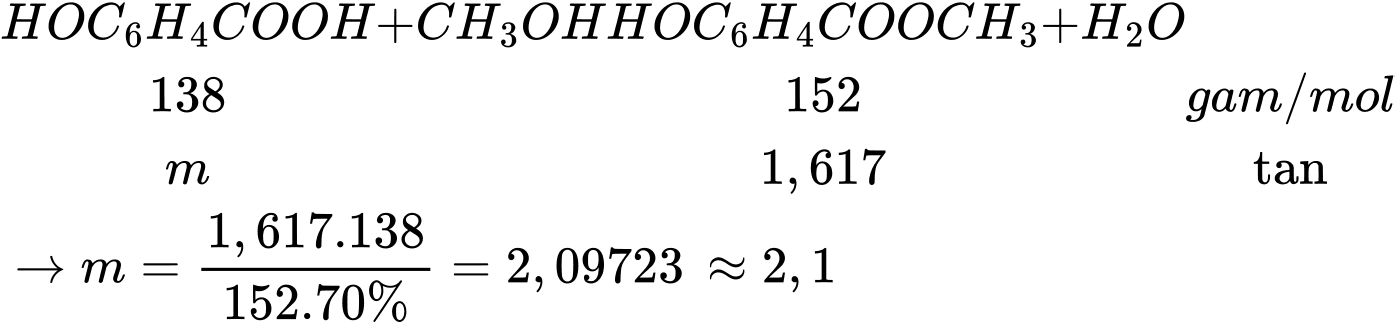
⇒ Điền đáp án: 2,1
Câu 27 [705454]: Khi sử dụng đồ uống có cồn (ethanol), dưới tác dụng của hai loại enzyme dehydrogenase (ADH) và aldehyde dehydrogenase (ALDH) trong gan, có chuyển hóa như sau:
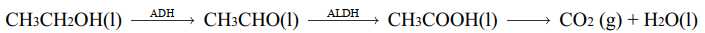
Thông thường, khi một người uống rượu (C2H5OH), có khoảng 10% rượu được thải ra ngoài qua mồ hôi, hơi thở và nước tiểu; 90% được hấp thụ và chuyển hóa hết thành acetaldehyde (CH3CHO) tại gan nhờ hệ thống enzyme. Nếu một người uống hai lon bia, mỗi lon dung tích 330 mL và độ cồn của bia là 5% thì lượng năng lượng mà cơ thể nhận được khi chuyển hóa hết lượng cồn ở trên là bao nhiêu, biết khối lượng riêng của C2H5OH là 0,789 g/mL và enthalpy tiêu chuẩn của các chất được cho trong bảng sau:
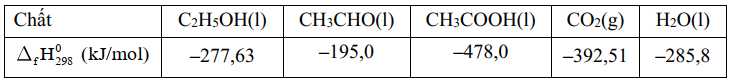
(chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị).
Thông thường, khi một người uống rượu (C2H5OH), có khoảng 10% rượu được thải ra ngoài qua mồ hôi, hơi thở và nước tiểu; 90% được hấp thụ và chuyển hóa hết thành acetaldehyde (CH3CHO) tại gan nhờ hệ thống enzyme. Nếu một người uống hai lon bia, mỗi lon dung tích 330 mL và độ cồn của bia là 5% thì lượng năng lượng mà cơ thể nhận được khi chuyển hóa hết lượng cồn ở trên là bao nhiêu, biết khối lượng riêng của C2H5OH là 0,789 g/mL và enthalpy tiêu chuẩn của các chất được cho trong bảng sau:

(chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị).
Thể tích ethanol trong 2 lon bia là: 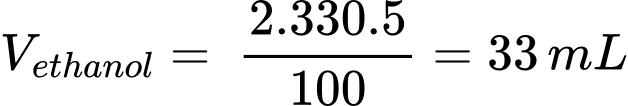
Khối lượng ethanol là: methanol = 33 × 0,789 = 26,037 (g)
Số mol của ethanol là: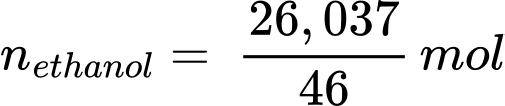
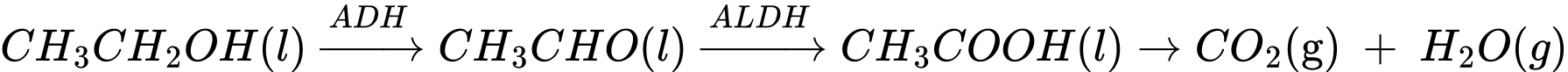
Phản ứng tổng quát:
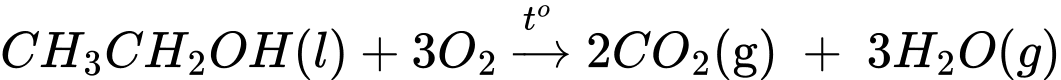
Biến thiên enthalpy của phản ứng trên là
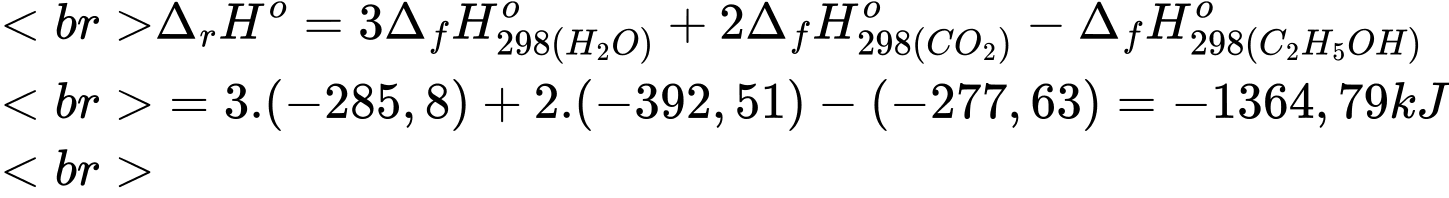
Lượng năng lượng mà cơ thể nhận được khi phân hủy hết lượng cồn ở trên là:

⇒ Điền đáp án: 695
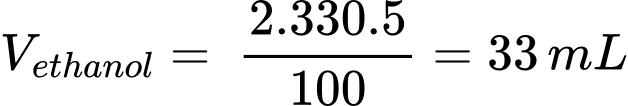
Khối lượng ethanol là: methanol = 33 × 0,789 = 26,037 (g)
Số mol của ethanol là:
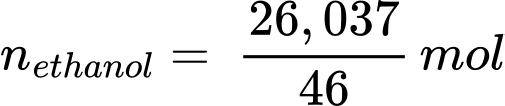
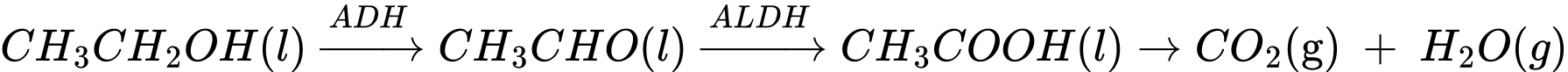
Phản ứng tổng quát:
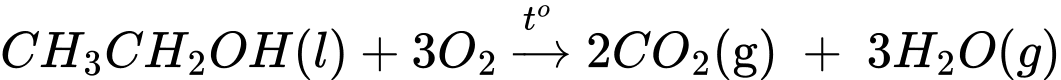
Biến thiên enthalpy của phản ứng trên là
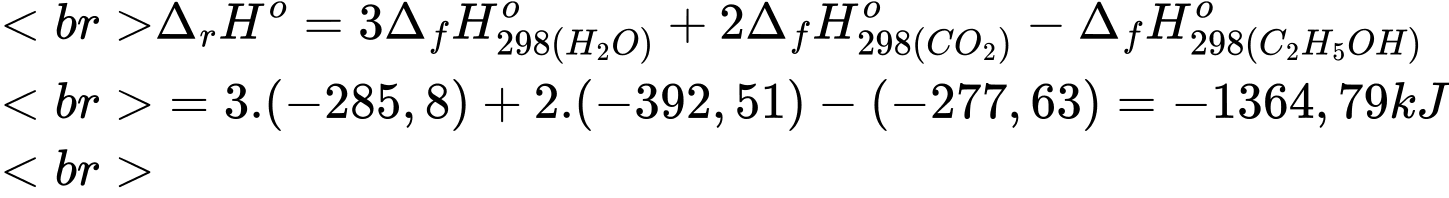
Lượng năng lượng mà cơ thể nhận được khi phân hủy hết lượng cồn ở trên là:

⇒ Điền đáp án: 695
Câu 28 [705455]: Iron (II)sulfate thường được bảo quản ở dạng muối Mohr màu xanh nhạt có công thức FeSO4.(NH4)2SO4.nH2O. Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Cân 3,92 gam muối Mohr rồi hòa tan vào nước, sau đó định mức trong bình 50mL. Chuẩn độ 5mL dung dịch vừa pha cần dùng 10mL dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr.
Thí nghiệm 2: Làm lạnh 100 gam dung dịch muối Mohr bão hòa ở 30oC đến nhiệt độ ổn định ở 0oC thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:

Giá trị của m là bao nhiêu?
Thí nghiệm 1: Cân 3,92 gam muối Mohr rồi hòa tan vào nước, sau đó định mức trong bình 50mL. Chuẩn độ 5mL dung dịch vừa pha cần dùng 10mL dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr.
Thí nghiệm 2: Làm lạnh 100 gam dung dịch muối Mohr bão hòa ở 30oC đến nhiệt độ ổn định ở 0oC thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:

Giá trị của m là bao nhiêu?
Đổi 10 mL = 0,01 L
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là: nKMnO4 = 0,02 × 0,01 = 2×10-4 mol
Từ phương trình số mol của FeSO4 là: nFeSO4 = 5nKMnO4 = 10-3 mol
Số mol của muối Morh trong 50 mL dung dịch là:
nMorrh = (50 ÷ 5) × 10-3 = 0,01 (mol)
Ta có: MMorh = 3,92 ÷ 10-2 = 152 + 132 + 18n ⟶ n = 6
Công thức của muối Morh là FeSO4.(NH4)2SO4.6H2O
Tại 30 oC độ tan của muối Morh là 45 gam trên 100 gam nước
Tại 30 oC khối lượng lượng muối Morh trong 100 gam dung dịch bão hòa là
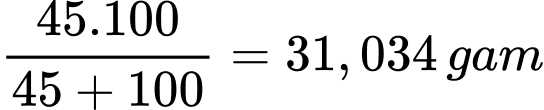
Tại 0 oC giả sử có m gam muối Mohr kết tinh thì khối lượng phần dung dịch bão hòa còn lại là (100 – m) gam.
Cứ 17,2 g muối Morh có thể tan trong 100 g nước tạo thành 117,2 g dung dịch bão hòa.
⟶ Trong (100-m) g dung dịch bão hòa chứa [17,2 × ( 100-m)] ÷ 117,2 g muối Morh.
Bảo toàn khối lượng ta có:
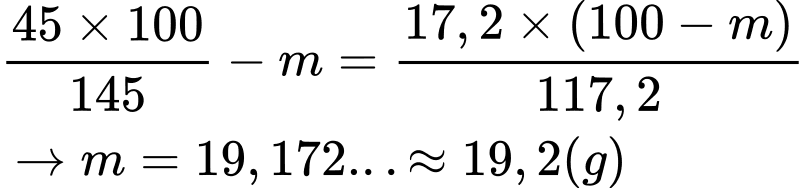
⇒ Điền đáp án: 19,2
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Số mol của KMnO4 là: nKMnO4 = 0,02 × 0,01 = 2×10-4 mol
Từ phương trình số mol của FeSO4 là: nFeSO4 = 5nKMnO4 = 10-3 mol
Số mol của muối Morh trong 50 mL dung dịch là:
nMorrh = (50 ÷ 5) × 10-3 = 0,01 (mol)
Ta có: MMorh = 3,92 ÷ 10-2 = 152 + 132 + 18n ⟶ n = 6
Công thức của muối Morh là FeSO4.(NH4)2SO4.6H2O
Tại 30 oC độ tan của muối Morh là 45 gam trên 100 gam nước
Tại 30 oC khối lượng lượng muối Morh trong 100 gam dung dịch bão hòa là
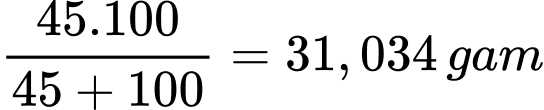
Tại 0 oC giả sử có m gam muối Mohr kết tinh thì khối lượng phần dung dịch bão hòa còn lại là (100 – m) gam.
Cứ 17,2 g muối Morh có thể tan trong 100 g nước tạo thành 117,2 g dung dịch bão hòa.
⟶ Trong (100-m) g dung dịch bão hòa chứa [17,2 × ( 100-m)] ÷ 117,2 g muối Morh.
Bảo toàn khối lượng ta có:
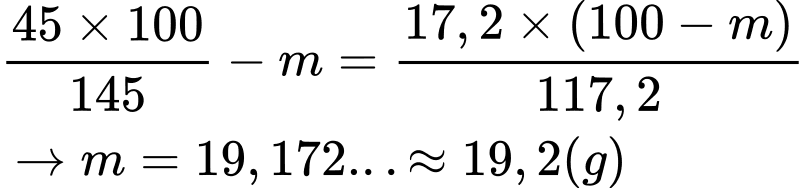
⇒ Điền đáp án: 19,2