PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705687]: Trong vỏ Trái Đất, các kim loại …(1)… tồn tại chủ yếu dưới dạng …(2)... Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, Fe và Na, đơn chất.
B, Ag và Cu, hợp chất.
C, K và Li, hợp chất.
D, Au và Ag, đơn chất.
Trong vỏ Trái Đất, các kim loại Au và Ag tồn tại chủ yếu dưới dạng đơn chất.
Phân tích:
Kim loại trong vỏ Trái Đất thường tồn tại dưới dạng hợp chất, trừ một số loại kim có tính khử yếu như vàng (Au), bạc (Ag), bạch kim (Pt),... có thể tồn tại ở dạng đơn chất.
⭐ Fe và Na: Là các loại kim loại hoạt động mạnh, thường tồn tại trong tự nhiên dưới dạng hợp chất chứ không phải chất đơn.
⭐ Ag và Cu: Đồng tồn tại ở dạng hợp chất, nhưng bạc có thể được tìm thấy ở dạng đơn chất trong tự nhiên.
⭐ K và Li: Là loại kim loại kiềm, có tính khử mạnh nên chỉ tồn tại dưới dạng hợp chất .
⭐ Au và Ag: Là những loại kim loại có tính khử yếu, có thể tồn tại ở dạng đơn chất trong tự nhiên.
⇒ Chọn đáp án D Đáp án: D
Phân tích:
Kim loại trong vỏ Trái Đất thường tồn tại dưới dạng hợp chất, trừ một số loại kim có tính khử yếu như vàng (Au), bạc (Ag), bạch kim (Pt),... có thể tồn tại ở dạng đơn chất.
⭐ Fe và Na: Là các loại kim loại hoạt động mạnh, thường tồn tại trong tự nhiên dưới dạng hợp chất chứ không phải chất đơn.
⭐ Ag và Cu: Đồng tồn tại ở dạng hợp chất, nhưng bạc có thể được tìm thấy ở dạng đơn chất trong tự nhiên.
⭐ K và Li: Là loại kim loại kiềm, có tính khử mạnh nên chỉ tồn tại dưới dạng hợp chất .
⭐ Au và Ag: Là những loại kim loại có tính khử yếu, có thể tồn tại ở dạng đơn chất trong tự nhiên.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [575887]: Tên gọi của hợp chất ion có công thức Ca3N2 là
A, Calcium nitrate.
B, Calcium nitrite.
C, Calcium nitrogen.
D, Calcium nitride.
Hợp chất có công thức Ca3N2 bao gồm calcium (Ca2+) và nitride (N3-). Hợp chất ion này có tên gọi là: Calcium nitride.
Các hợp chất còn lại:
A. Calcium nitrate: Ca(NO3)2
B. Calcium nitrite: Ca(NO2)2
C. Calcium nitrogen: không có hợp chất phù hợp.
⇒ Chọn đáp án D Đáp án: D
Các hợp chất còn lại:
A. Calcium nitrate: Ca(NO3)2
B. Calcium nitrite: Ca(NO2)2
C. Calcium nitrogen: không có hợp chất phù hợp.
⇒ Chọn đáp án D Đáp án: D
Câu 3 [310468]: Teflon là polymer nhiệt dẻo, dùng để tráng, phủ lên chảo, nồi để chống dính, được trùng hợp từ monomer là
A, CF2=CF2.
B, CH2=CH2.
C, CHF=CHF.
D, CH2=CHCl.
– Teflon là một loại polymer nhiệt dẻo, có tính chống dính, chịu nhiệt, kháng hóa chất tốt, thường được dùng để tráng chảo, nồi chống dính.
– Teflon có tên hóa học là polytetrafluoroethylene (PTFE), được tạo thành từ phản ứng trùng hợp tetrafluoroethylene (CF2=CF2).
Phân tích đáp án:
✅ A. CF2=CF2
Đây là tetrafluoroethylene, monomer tạo ra Teflon khi trùng hợp.
❌ B. CH2=CH2
Đây là ethylene, tạo ra polyethylene (PE), không phải Teflon.
❌ C. CHF=CHF
Đây là difluoroethylene, không phải monomer của Teflon.
❌ D. CH2=CHCl
Đây là vinyl chloride, tạo ra polyvinyl chloride (PVC), không liên quan đến Teflon.
⇒ Chọn đáp án A Đáp án: A
– Teflon có tên hóa học là polytetrafluoroethylene (PTFE), được tạo thành từ phản ứng trùng hợp tetrafluoroethylene (CF2=CF2).
Phân tích đáp án:
✅ A. CF2=CF2
Đây là tetrafluoroethylene, monomer tạo ra Teflon khi trùng hợp.
❌ B. CH2=CH2
Đây là ethylene, tạo ra polyethylene (PE), không phải Teflon.
❌ C. CHF=CHF
Đây là difluoroethylene, không phải monomer của Teflon.
❌ D. CH2=CHCl
Đây là vinyl chloride, tạo ra polyvinyl chloride (PVC), không liên quan đến Teflon.
⇒ Chọn đáp án A Đáp án: A
Câu 4 [560622]: Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X là chất lỏng. Kim loại X là
A, W.
B, Cr.
C, Hg.
D, Pb.
Ở điều kiện thường, kim loại duy nhất tồn tại ở thể lỏng là thủy ngân (mercury) kí hiệu là Hg. Thủy ngân được ứng dụng để chế tạo nhiệt kế.
Thủy ngân (mercury) thuộc ô số 80, chu kì 6, nhóm IIB trong bảng tuần hoàn.
⇒ Chọn đáp án C Đáp án: C
Thủy ngân (mercury) thuộc ô số 80, chu kì 6, nhóm IIB trong bảng tuần hoàn.
⇒ Chọn đáp án C Đáp án: C
Câu 5 [575219]: Hạt nào sau đây không phải là hạt cơ bản trong nguyên tử?
A, Neutron.
B, Electron.
C, Proton.
D, Hạt nhân nguyên tử.
Nguyên tử gồm 3 hạt cơ bản là proton, neutron và electron. Các nhà khoa học đã phát hiện chúng thông qua các thí nghiệm:
- Năm 1897, Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm ⇒ Chùm các hạt electron.
- Năm 1918, E. Rutherford và các cộng sự dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton.
- Năm 1932, J. Chadwick và cộng sự của Rutherford đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α.
⟶ Hạt nhân nguyên tử chứa neutron và proton là một thành phần của nguyên tử, không phải hạt cơ bản trong nguyên tử.
⇒ Chọn đáp án D Đáp án: D
- Năm 1897, Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm ⇒ Chùm các hạt electron.
- Năm 1918, E. Rutherford và các cộng sự dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton.
- Năm 1932, J. Chadwick và cộng sự của Rutherford đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α.
⟶ Hạt nhân nguyên tử chứa neutron và proton là một thành phần của nguyên tử, không phải hạt cơ bản trong nguyên tử.
⇒ Chọn đáp án D Đáp án: D
Câu 6 [560895]: Tính chất hoá học đặc trưng của kim loại nhóm IIA là
A, Tính oxi hóa.
B, Tính khử.
C, Tính acid.
D, Tính base.
Các kim loại nhóm IIA như Be, Mg, Ca, Sr, Ba có xu hướng nhường 2 electron ở lớp ngoài cùng để đạt cấu hình bền vững của khí hiếm:
M ⟶ M2+ + 2e
⇒ Đóng vai trò chất khử trong phản ứng.
⇒ Chọn đáp án B Đáp án: B
M ⟶ M2+ + 2e
⇒ Đóng vai trò chất khử trong phản ứng.
⇒ Chọn đáp án B Đáp án: B
Câu 7 [705688]: Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A, Sodium, potassium.
B, Calcium, magnesium.
C, Nitrate, phosphate.
D, Chloride, sulfate.
⭐ Hiện tượng phú dưỡng là tình trạng nước ao, hồ bị ô nhiễm do dư thừa chất dinh dưỡng, dẫn đến sự phát triển quá mức của tảo và thực vật thủy sinh, làm giảm oxi trong nước và gây hại cho hệ sinh thái.
⭐ Nguyên nhân chính của phú dưỡng là sự tích tụ quá mức các ion nitrate (NO3-) và phosphate (PO43-) từ phân bón hóa học, nước thải sinh hoạt, chất thải công nghiệp,...
Phân tích đáp án:
❌ A. Sodium (Na+), potassium (K+)
Đây là các ion có mặt trong nước tự nhiên nhưng không gây phú dưỡng.
❌ B. Calcium (Ca2+), magnesium (Mg2+)
Đây là các ion góp phần vào độ cứng của nước, không gây phú dưỡng.
✅ C. Nitrate (NO3-), phosphate (PO43-)
Đây là hai ion chính gây ra hiện tượng phú dưỡng do kích thích sự phát triển quá mức của tảo.
❌ D. Chloride (Cl-), sulfate (SO42-)
Đây là các ion phổ biến trong nước nhưng không liên quan đến phú dưỡng.
⇒ Chọn đáp án C Đáp án: C
⭐ Nguyên nhân chính của phú dưỡng là sự tích tụ quá mức các ion nitrate (NO3-) và phosphate (PO43-) từ phân bón hóa học, nước thải sinh hoạt, chất thải công nghiệp,...
Phân tích đáp án:
❌ A. Sodium (Na+), potassium (K+)
Đây là các ion có mặt trong nước tự nhiên nhưng không gây phú dưỡng.
❌ B. Calcium (Ca2+), magnesium (Mg2+)
Đây là các ion góp phần vào độ cứng của nước, không gây phú dưỡng.
✅ C. Nitrate (NO3-), phosphate (PO43-)
Đây là hai ion chính gây ra hiện tượng phú dưỡng do kích thích sự phát triển quá mức của tảo.
❌ D. Chloride (Cl-), sulfate (SO42-)
Đây là các ion phổ biến trong nước nhưng không liên quan đến phú dưỡng.
⇒ Chọn đáp án C Đáp án: C
Câu 8 [190524]: Phản ứng thủy phân dẫn xuất halogen trong môi trường kiềm thuộc loại phản ứng gì? 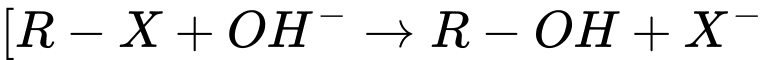
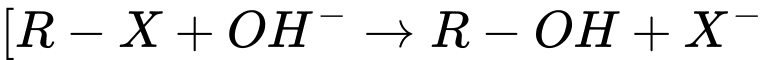
A, Phản ứng thế.
B, Phản ứng cộng.
C, Phản ứng tách.
D, Phản ứng oxi hóa.
Phản ứng thủy phân dẫn xuất halogen trong môi trường kiềm xảy ra theo phương trình tổng quát:
R-X + NaOH → R-OH + NaX
Trong đó:
R-X là dẫn xuất halogen (X = Cl, Br, I,...)
NaOH cung cấp ion OH- để thay thế nguyên tử halogen bằng nhóm OH, tạo thành rượu (alcohol).
⇒ Chọn đáp án A Đáp án: A
R-X + NaOH → R-OH + NaX
Trong đó:
R-X là dẫn xuất halogen (X = Cl, Br, I,...)
NaOH cung cấp ion OH- để thay thế nguyên tử halogen bằng nhóm OH, tạo thành rượu (alcohol).
⇒ Chọn đáp án A Đáp án: A
Câu 9 [308470]: Điều nào sau đây không đúng khi nói về cellulose?
A, Tan trong dung dịch [Cu(NH3)4](OH)2.
B, Có thể dùng để điều chế alcohol ethylic.
C, Dùng để tráng gương.
D, Tạo thành ester với acetic anhydride.
Xét các phát biểu:
✔️ A. Đúng. Cellulose không tan trong nước nhưng tan trong nước Schweizer (dung dịch chứa phức chất của ion Cu2+ với ammonia).
✔️ B. Đúng. Phản ứng thủy phân cellulose xảy ra khi có đun nóng với xúc tác acid vô cơ (hoặc enzyme cellulase). Sản phẩm là glucose, tiếp tục được lên men tạo ra ethanol.
❌ C. Sai. Cellulose không tham gia phản ứng tráng bạc, do trong cấu tạo không có nhóm chức aldehype (-CHO) nên không tham gia phản ứng tráng gương.
✔️ D. Đúng. Cellulose tác dụng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tùy thuộc vào điều kiện phản ứng.
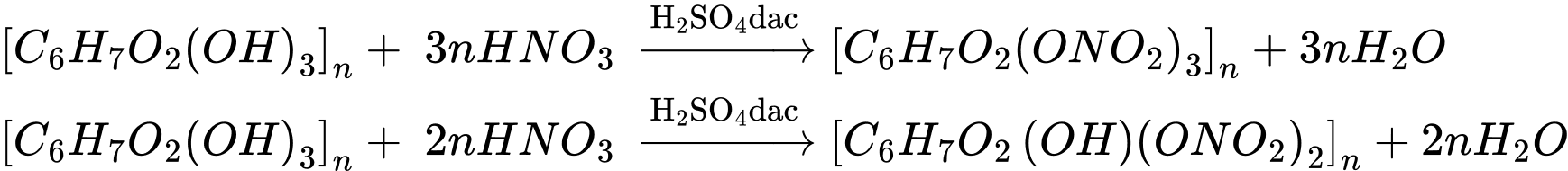
⇒ Chọn đáp án C Đáp án: C
✔️ A. Đúng. Cellulose không tan trong nước nhưng tan trong nước Schweizer (dung dịch chứa phức chất của ion Cu2+ với ammonia).
✔️ B. Đúng. Phản ứng thủy phân cellulose xảy ra khi có đun nóng với xúc tác acid vô cơ (hoặc enzyme cellulase). Sản phẩm là glucose, tiếp tục được lên men tạo ra ethanol.
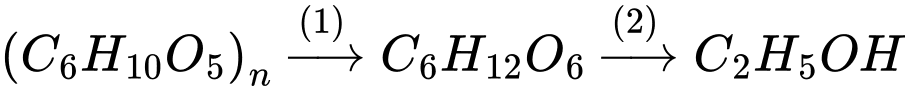
❌ C. Sai. Cellulose không tham gia phản ứng tráng bạc, do trong cấu tạo không có nhóm chức aldehype (-CHO) nên không tham gia phản ứng tráng gương.
✔️ D. Đúng. Cellulose tác dụng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tùy thuộc vào điều kiện phản ứng.
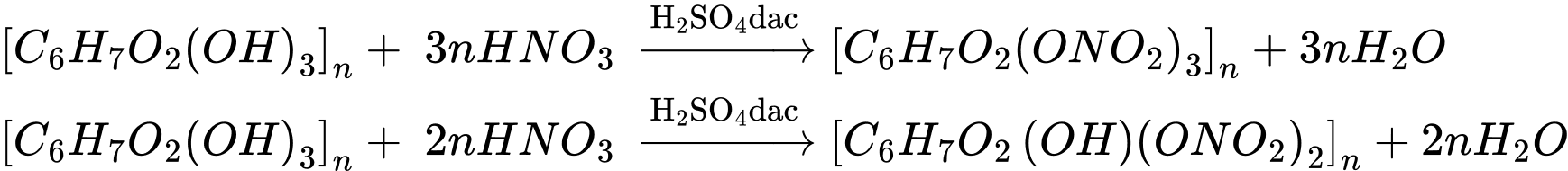
⇒ Chọn đáp án C Đáp án: C
Câu 10 [705689]: Than củi được con người sử dụng từ thời xa xưa, bắt nguồn từ sự phong phú của gỗ ở nhiều vùng khác nhau. Tuy nhiên, việc sử dụng than củi tiềm tàng những nguy hiểm ngoài ý muốn như những vụ cháy nhà ở, cháy kho chứa vật liệu máy móc,... Bên cạnh các thiệt hại gây ra bởi ngọn lửa, các phản ứng cháy còn có thể sinh ra các chất độc hại cho con người và các sinh vật sống như CO. Khi có mặt CO, các phân tử hemoglobin trong máu sẽ không hấp phụ O2 mà hấp phụ CO. Nếu nồng độ CO trong không khí là 1,28 % (theo thể tích) thì con người bất tỉnh sau 2 – 3 nhịp thở, chết sau 2 – 3 phút. Cho các phát biểu sau:
(a) Đốt than củi trong không gian kín tạo thành khí CO nhiều hơn.
(b) Khí CO nặng hơn không khí và có xu hướng lắng đọng ở các tầng không khí thấp.
(c) Phân tử CO tạo liên kết với hemoglobin mạnh hơn phân tử O2.
(d) Nồng độ CO trong không khí là 1,28% (theo thể tích) tương đương 14,46 mg/L tại điều kiện chuẩn.
Các phát biểu đúng là
(a) Đốt than củi trong không gian kín tạo thành khí CO nhiều hơn.
(b) Khí CO nặng hơn không khí và có xu hướng lắng đọng ở các tầng không khí thấp.
(c) Phân tử CO tạo liên kết với hemoglobin mạnh hơn phân tử O2.
(d) Nồng độ CO trong không khí là 1,28% (theo thể tích) tương đương 14,46 mg/L tại điều kiện chuẩn.
Các phát biểu đúng là
A, (a), (c).
B, (a), (b), (c).
C, (a), (b), (d).
D, (a), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Khi than cháy trong điều kiện thiếu oxygen (không gian kín), quá trình cháy không hoàn toàn sẽ tạo nhiều khí CO thay vì CO2.
C + O2 –to⟶ CO2
2C + O2 –to⟶ 2CO
❌ (b) Sai. Phân tử khối trung bình của không khí khoảng 29 g/mol, phân tử khối của CO là 28 g/mol nên khí CO sẽ bay lơ lửng trong không khí.
✔️ (c) Đúng. CO có khả năng kết hợp với hemoglobin trong máu, ngăn cản quá trình vận chuyển oxy đến các tế bào. Người bị ngộ độc khí CO sẽ có các triệu chứng như đau đầu, buồn nôn, chóng mặt, khó thở, hôn mê. Nếu không được cấp cứu kịp thời, bệnh nhân có thể tử vong.
✔️ (d) Đúng.
Số mol của CO trong 1 L không khí là: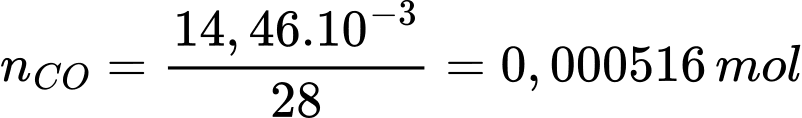
Thể tích khí của CO là: VCO = 0,000516 × 24,79 = 0,0128 L
Phần trăm thể tích khí CO trong 1 L là: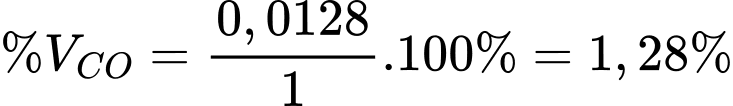
⟶ Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Khi than cháy trong điều kiện thiếu oxygen (không gian kín), quá trình cháy không hoàn toàn sẽ tạo nhiều khí CO thay vì CO2.
C + O2 –to⟶ CO2
2C + O2 –to⟶ 2CO
❌ (b) Sai. Phân tử khối trung bình của không khí khoảng 29 g/mol, phân tử khối của CO là 28 g/mol nên khí CO sẽ bay lơ lửng trong không khí.
✔️ (c) Đúng. CO có khả năng kết hợp với hemoglobin trong máu, ngăn cản quá trình vận chuyển oxy đến các tế bào. Người bị ngộ độc khí CO sẽ có các triệu chứng như đau đầu, buồn nôn, chóng mặt, khó thở, hôn mê. Nếu không được cấp cứu kịp thời, bệnh nhân có thể tử vong.
✔️ (d) Đúng.
Số mol của CO trong 1 L không khí là:
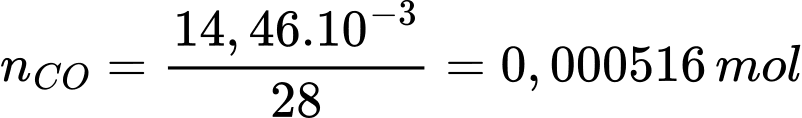
Thể tích khí của CO là: VCO = 0,000516 × 24,79 = 0,0128 L
Phần trăm thể tích khí CO trong 1 L là:
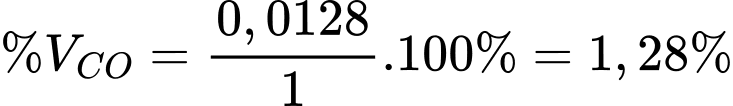
⟶ Các phát biểu đúng là (a) (c) (d)
⇒ Chọn đáp án D Đáp án: D
Câu 11 [308669]: α-amino acid là amino acid có nhóm amino gắn với carbon ở vị trí số
A, 2.
B, 4.
C, 1.
D, 3.
α-Amino acid là amino acid trong đó nhóm amino (-NH2) gắn với carbon α, tức là carbon thứ 2 (C2) của mạch chính.
Công thức tổng quát của α-amino acid:
R-CH(NH2)-COOH
Carbon của nhóm -COOH (carboxylic acid) luôn ở vị trí số 1.
Nhóm -NH2 gắn vào carbon liền kề (carbon số 2 hay còn gọi là carbon α).
Ví dụ: Glycine (H2N-CH2-COOH), Alanine (CH3-CH(NH2)-COOH).
⇒ Chọn đáp án A Đáp án: A
Công thức tổng quát của α-amino acid:
R-CH(NH2)-COOH
Carbon của nhóm -COOH (carboxylic acid) luôn ở vị trí số 1.
Nhóm -NH2 gắn vào carbon liền kề (carbon số 2 hay còn gọi là carbon α).
Ví dụ: Glycine (H2N-CH2-COOH), Alanine (CH3-CH(NH2)-COOH).
⇒ Chọn đáp án A Đáp án: A
Câu 12 [307754]: Chất nào sau đây thuộc loại monosaccharide?
A, Saccharose.
B, Glucose.
C, Tinh bột.
D, Cellulose.
HD: Bài học phân loại hợp chất carbohydrate:
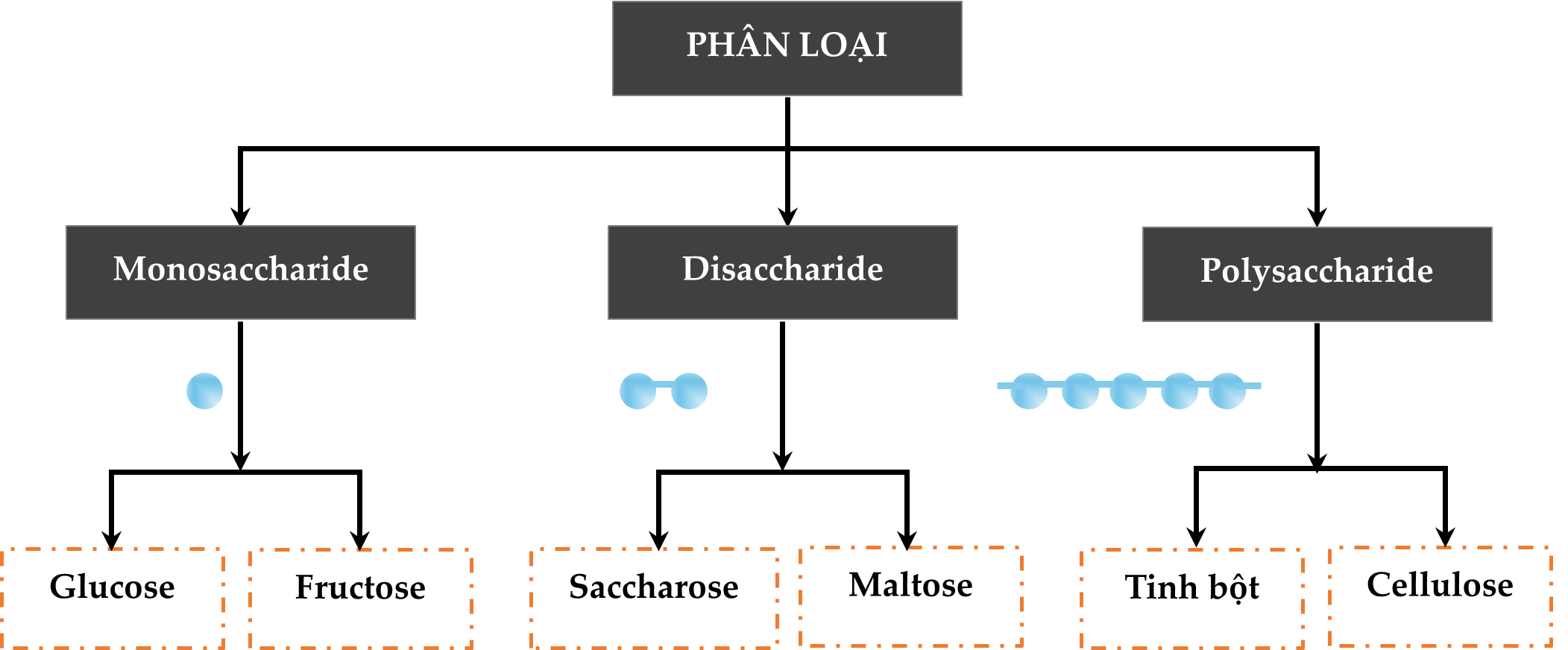
⇒ Trong 4 phương án, glucose là một loại monosaccharide
⇒ Chọn đáp án B Đáp án: B

⇒ Trong 4 phương án, glucose là một loại monosaccharide
⇒ Chọn đáp án B Đáp án: B
Câu 13 [705690]: Acid béo tạo nên chất béo thường là các monocarboxylic acid có mạch carbon …(1)… và có số nguyên tử carbon …(2)… Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, hở, lẻ.
B, kín, chẵn.
C, phân nhánh, lẻ.
D, không phân nhánh, chẵn.
Acid béo tạo nên chất béo thường là các monocarboxylic acid có mạch carbon không phân nhánh và có số nguyên tử carbon chẵn.
Acid béo tạo nên chất béo thường là các monocarboxylic acid có đặc điểm:
⭐ Mạch carbon dài, không phân nhánh → phù hợp với tính chất kỵ nước và khả năng tạo ester với glycerol.
⭐ Có số nguyên tử carbon chẵn (thường từ 12 đến 24 carbon) → do quá trình sinh tổng hợp acid béo trong cơ thể diễn ra theo cơ chế gắn thêm từng cặp nguyên tử carbon (C2) từ acetyl-CoA (acetyl coenzyme A).
⇒ Chọn đáp án D Đáp án: D
Acid béo tạo nên chất béo thường là các monocarboxylic acid có đặc điểm:
⭐ Mạch carbon dài, không phân nhánh → phù hợp với tính chất kỵ nước và khả năng tạo ester với glycerol.
⭐ Có số nguyên tử carbon chẵn (thường từ 12 đến 24 carbon) → do quá trình sinh tổng hợp acid béo trong cơ thể diễn ra theo cơ chế gắn thêm từng cặp nguyên tử carbon (C2) từ acetyl-CoA (acetyl coenzyme A).
⇒ Chọn đáp án D Đáp án: D
Câu 14 [705691]: Phổ hồng ngoại của fructose được cho ở dưới đây.
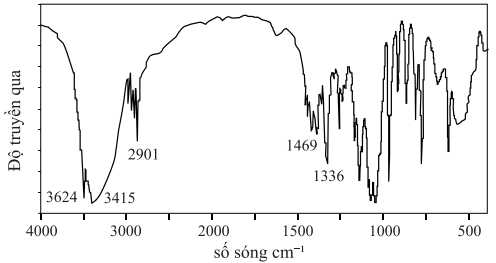
Dựa vào thông tin nào dưới đây có thể kết luận trong điều kiện đo, mẫu fructose tồn tại chủ yếu ở dạng mạch vòng mà không phải ở dạng mạch hở?

Dựa vào thông tin nào dưới đây có thể kết luận trong điều kiện đo, mẫu fructose tồn tại chủ yếu ở dạng mạch vòng mà không phải ở dạng mạch hở?
A, Không có tín hiệu C=O.
B, Không có tín hiệu OH ở C1.
C, Không có tín hiệu OH ở C3.
D, Không có tín hiệu OH ở C4.
Phân tích cấu trúc fructose:
- Dạng mạch hở: Fructose có nhóm C=O (carbonyl) dạng ketone (-CO-) ở C2.
- Dạng mạch vòng: Nhóm C=O sẽ không còn, vì nó đã tham gia vào phản ứng nội phân tử để tạo nên vòng furanose hoặc pyranose.
Phân tích phổ IR (hồng ngoại):
- Nếu fructose tồn tại ở dạng mạch hở, phổ IR phải có đỉnh hấp thụ mạnh ở vùng 1700 cm-1, đặc trưng cho liên kết C=O của ketone.
- Nếu phổ không có tín hiệu C=O, điều đó chứng tỏ fructose chủ yếu tồn tại ở dạng mạch vòng, vì nhóm carbonyl đã tham gia tạo liên kết hemiacetal.
⇒ Chọn đáp án A Đáp án: A
- Dạng mạch hở: Fructose có nhóm C=O (carbonyl) dạng ketone (-CO-) ở C2.
- Dạng mạch vòng: Nhóm C=O sẽ không còn, vì nó đã tham gia vào phản ứng nội phân tử để tạo nên vòng furanose hoặc pyranose.
Phân tích phổ IR (hồng ngoại):
- Nếu fructose tồn tại ở dạng mạch hở, phổ IR phải có đỉnh hấp thụ mạnh ở vùng 1700 cm-1, đặc trưng cho liên kết C=O của ketone.
- Nếu phổ không có tín hiệu C=O, điều đó chứng tỏ fructose chủ yếu tồn tại ở dạng mạch vòng, vì nhóm carbonyl đã tham gia tạo liên kết hemiacetal.
⇒ Chọn đáp án A Đáp án: A
Câu 15 [304786]: Chất có cấu tạo nào sau đây có nhiệt độ sôi cao nhất?
A, 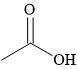

B, 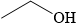
C, 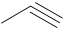
D, 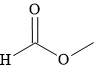

Các chất so sánh có cấu tạo viết gọn như sau:
A. CH3COOH; B. CH3CH2OH; C. CH3C≡CH và D. HCOOCH3.
So sánh các chất có cùng số nguyên tử carbon hoặc phân tử khối tương đương:
hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ CH3C≡CH < C2H5C≡CH (M = 54) < HCOOCH3 (M = 60) < CH3CH2OH < CH3COOH.
⇒ Chất có nhiệt độ sôi cao nhất trong dãy là CH3COOH
⇒ Chọn đáp án A Đáp án: A
A. CH3COOH; B. CH3CH2OH; C. CH3C≡CH và D. HCOOCH3.
So sánh các chất có cùng số nguyên tử carbon hoặc phân tử khối tương đương:
hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ CH3C≡CH < C2H5C≡CH (M = 54) < HCOOCH3 (M = 60) < CH3CH2OH < CH3COOH.
⇒ Chất có nhiệt độ sôi cao nhất trong dãy là CH3COOH
⇒ Chọn đáp án A Đáp án: A
Câu 16 [705692]: Chu sa còn gọi là cinnabar, là một loại khoáng vật có thành phần chính là HgS. Trước đây, trong y học cổ truyền, chu sa được dùng với liều lượng phù hợp kết hợp với một số vị thuốc khác trong điều trị chứng mất ngủ, tim đập loạn, hồi hộp. Tuy nhiên, vị thuốc này chỉ được “dùng sống”, tuyệt đối không nấu (không sắc thuốc) hoặc dùng lửa (nướng, đốt). Tại sao không dùng nhiệt đối với chu sa?
A, Sinh ra Hg dạng hơi, độc tính cao.
B, Sinh ra muối HgSO4, độc tính cao.
C, HgS bị phân hủy, mất tác dụng thuốc.
D, Sinh ra muối HgSO3, cơ thể không hấp thụ.
Chu sa (HgS) là một khoáng vật chứa thủy ngân. Khi bị đun nóng, HgS bị phân hủy sinh ra hơi thủy ngân (Hg), một chất cực độc.
Phân tích đáp án:
✅ A. Sinh ra Hg dạng hơi, độc tính cao.
Phản ứng phân hủy HgS khi đun nóng: HgS –to⟶ Hg + S
Hg dạng hơi rất độc, có thể gây tổn thương hệ thần kinh, thận và các cơ quan khác khi hít phải.
❌ B. Sinh ra muối HgSO4, độc tính cao.
HgSO4 không sinh ra khi nung HgS, vì phản ứng này không có sự tham gia của H2SO4 hay oxygen để tạo muối sulfate.
❌ C. HgS bị phân hủy, mất tác dụng thuốc.
Đúng là HgS bị phân hủy, nhưng vấn đề chính không phải là mất tác dụng thuốc mà là tạo ra Hg dạng hơi rất độc.
❌ D. Sinh ra muối HgSO3, cơ thể không hấp thụ.
HgSO3 cũng không sinh ra từ phản ứng nung HgS.
⇒ Chọn đáp án A Đáp án: A
Phân tích đáp án:
✅ A. Sinh ra Hg dạng hơi, độc tính cao.
Phản ứng phân hủy HgS khi đun nóng: HgS –to⟶ Hg + S
Hg dạng hơi rất độc, có thể gây tổn thương hệ thần kinh, thận và các cơ quan khác khi hít phải.
❌ B. Sinh ra muối HgSO4, độc tính cao.
HgSO4 không sinh ra khi nung HgS, vì phản ứng này không có sự tham gia của H2SO4 hay oxygen để tạo muối sulfate.
❌ C. HgS bị phân hủy, mất tác dụng thuốc.
Đúng là HgS bị phân hủy, nhưng vấn đề chính không phải là mất tác dụng thuốc mà là tạo ra Hg dạng hơi rất độc.
❌ D. Sinh ra muối HgSO3, cơ thể không hấp thụ.
HgSO3 cũng không sinh ra từ phản ứng nung HgS.
⇒ Chọn đáp án A Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Cho bảng giá trị thế điện cực chuẩn $(E_{{{M}^{3+}}/{{M}^{2+}}}^{o})$ của các cặp oxi hóa – khử như sau:
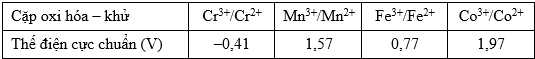

Câu 17 [705693]: Kim loại nào thay đổi trạng thái oxi hoá từ +2 lên +3 dễ nhất?
A, Cr.
B, Mn.
C, Fe.
D, Co.
Nguyên tắc: Thế điện cực chuẩn càng lớn → chất càng có xu hướng nhận e dễ hơn (bị khử), còn quá trình oxi hóa sẽ khó xảy ra hơn.Ngược lại, thế điện cực chuẩn càng nhỏ → chất càng dễ bị oxi hóa (mất e) từ +2 lên +3.
Từ bảng giá trị thế điện cực chuẩn ta thấy được cặp Cr3+/Cr2+ có giá trị thế điện cực nhỏ nhất nên có tính khử mạnh nhất nên sẽ dễ dàng mất electron thay đổi trạng thái số oxi hóa từ +2 lên +3.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [705694]: Giá trị thế điện cực chuẩn của các cặp oxi hóa – khử có được là do điện cực của mỗi cặp oxi hóa – khử được ghép với điện cực hydrogen chuẩn và quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,00 V. Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì thế điện cực chuẩn lớn nhất trong các cặp oxi hóa – khử trên là
A, 2,07 V.
B, 2,47 V.
C, 3,05 V.
D, 4,84 V.
Khi pin được thiết lập, sức điện động của pin luôn dương.
Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì giá trị thế điện cực của các cặp oxi – khử sẽ tăng đi 0,50 V
Ta có bảng giá trị thế điện cực mới:
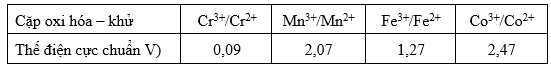
Giá trị thế điện cực chuẩn lớn nhất là 2,47 V của Co3+/Co2+.
⇒ Chọn đáp án B Đáp án: B
Nếu quy ước thế điện cực chuẩn của 2H+/H2 bằng 0,50 V thì giá trị thế điện cực của các cặp oxi – khử sẽ tăng đi 0,50 V
Ta có bảng giá trị thế điện cực mới:

Giá trị thế điện cực chuẩn lớn nhất là 2,47 V của Co3+/Co2+.
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
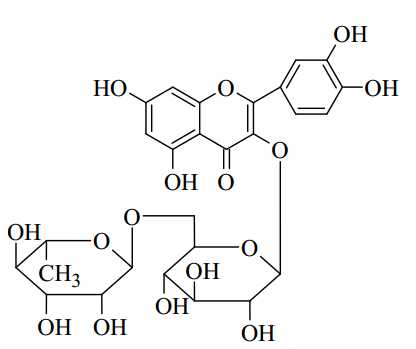
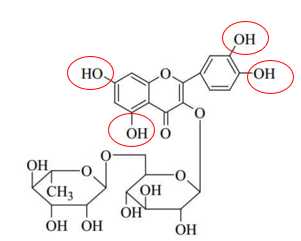
Câu 19 [705696]: Rutin có nhiều trong hoa hoè. Rutin có tác dụng bền vững thành mạch, chống co thắt, chống phóng xạ tia X, chống viêm cầu thận cấp. Rutin có công thức phân tử C27H30O16 với nhiệt độ nóng chảy là 242 oC. Công thức cấu tạo được cho như bên. Có hai phương pháp tách rutin từ hoa hòe như sau:
∎ Phương pháp 1: Hoa hòe xử lí bằng dung dịch sodium hydroxyde. Lọc, acid hóa phần nước lọc thu được rutin.
∎ Phương pháp 2: Chiết rutin từ hoa hòe bằng nước nóng, sau đó để nguội, rutin sẽ tách ra.

∎ Phương pháp 1: Hoa hòe xử lí bằng dung dịch sodium hydroxyde. Lọc, acid hóa phần nước lọc thu được rutin.
∎ Phương pháp 2: Chiết rutin từ hoa hòe bằng nước nóng, sau đó để nguội, rutin sẽ tách ra.
Phân tích các phát biểu:
✔️ a) Đúng. Theo phương pháp 2, rutin được chiết bằng nước nóng, sau đó để nguội thì rutin tách ra. Điều này chứng tỏ rutin tan tốt trong nước nóng, nhưng ít tan trong nước lạnh.
→ Điều này là do phân tử rutin có 2 thành phần gồm một disacharide (đường đôi, tan tốt) kết hợp với thành phần chứa các phenol đa chức, vì vậy rutin tan tương đối ít ở nhiệt độ thường và tan nhiều hơn khi đun nóng.
✔️ b) Đúng. Phân tử Rutin có 4 nhóm -OH phenol (Khoanh tròn) có tính acid yếu nên có khả năng phản ứng với NaOH tạo muối.
✔️ c) Đúng. Muối phenolate (-O-Na+) khi gặp acid mạnh (HCl, H2SO4,...) sẽ bị acid hóa trở lại thành rutin:
R-O-Na+ + HCl → R-OH + NaCl
Điều này cũng phù hợp với phương pháp 1, khi lọc xong rồi acid hóa để thu rutin.
✔️ d) Đúng. Rutin có nhiệt độ nóng chảy cao (242 oC) và ít tan trong nước ở nhiệt độ thường.
Cả hai phương pháp tách đều dựa vào tính chất này:
- Phương pháp 1: Rutin ít tan trong nước, nhưng có thể tan khi tạo muối phenolate với NaOH.
- Phương pháp 2: Rutin tan tốt trong nước nóng nhưng ít tan ở nhiệt độ thường nên có thể tách ra khi làm nguội.
✔️ a) Đúng. Theo phương pháp 2, rutin được chiết bằng nước nóng, sau đó để nguội thì rutin tách ra. Điều này chứng tỏ rutin tan tốt trong nước nóng, nhưng ít tan trong nước lạnh.
→ Điều này là do phân tử rutin có 2 thành phần gồm một disacharide (đường đôi, tan tốt) kết hợp với thành phần chứa các phenol đa chức, vì vậy rutin tan tương đối ít ở nhiệt độ thường và tan nhiều hơn khi đun nóng.
✔️ b) Đúng. Phân tử Rutin có 4 nhóm -OH phenol (Khoanh tròn) có tính acid yếu nên có khả năng phản ứng với NaOH tạo muối.

✔️ c) Đúng. Muối phenolate (-O-Na+) khi gặp acid mạnh (HCl, H2SO4,...) sẽ bị acid hóa trở lại thành rutin:
R-O-Na+ + HCl → R-OH + NaCl
Điều này cũng phù hợp với phương pháp 1, khi lọc xong rồi acid hóa để thu rutin.
✔️ d) Đúng. Rutin có nhiệt độ nóng chảy cao (242 oC) và ít tan trong nước ở nhiệt độ thường.
Cả hai phương pháp tách đều dựa vào tính chất này:
- Phương pháp 1: Rutin ít tan trong nước, nhưng có thể tan khi tạo muối phenolate với NaOH.
- Phương pháp 2: Rutin tan tốt trong nước nóng nhưng ít tan ở nhiệt độ thường nên có thể tách ra khi làm nguội.
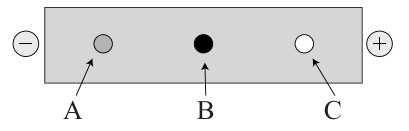
Câu 20 [705697]: Tiến hành nhỏ vài giọt hỗn hợp chứa các amino acid: arginine, alanine và aspatic acid vào giữa một tờ giấy lọc. Đặt tờ giấy lọc vào dung dịch đệm có pH = 6 giữa hai điện cực và có điện trường tác dụng thu được kết quả như hình dưới đây.
Công thức của arginine và aspatic acid được cho trong bảng

Công thức của arginine và aspatic acid được cho trong bảng

Ở pH trung tính, môi trường trung tính, amino acid tồn tại ở dạng ion lưỡng cực như sau:
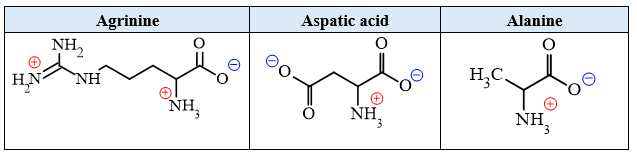
+) Aspartic acid tồn tại chủ yếu dưới dạng anion (-1) → bị kéo về cực dương → C là aspartic acid.
+) Alanine trung hòa, gần như không di chuyển trong điện trường → B là alanine.
+) Arginine tồn tại chủ yếu dưới dạng cation (+1) → bị kéo về cực âm → A là arginine.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể tách riêng arginine, alanine và aspatic acid tại pH = 6 bằng phương pháp điện di vì các amino acid có điện tích khác nhau nên sẽ di chuyển về các hướng khác nhau trong điện trường.
❌ b) Sai. Tại pH = 6, A là arginine (dạng cation), C là aspartic acid (dạng anion).
✔️ c) Đúng. B (Alanine) ở dạng trung hòa nên có điện tích bằng 0 và C (Aspartic acid) mang điện tích -1.
✔️ d) Đúng. Ở pH thấp (pH = 2), môi trường có tính acid, chứa nhiều ion H+ nên arginine và aniline sẽ phản ứng với H+ để tạo thành dạng cation mang điện tích dương (+) → bị kéo về cực âm.

+) Aspartic acid tồn tại chủ yếu dưới dạng anion (-1) → bị kéo về cực dương → C là aspartic acid.
+) Alanine trung hòa, gần như không di chuyển trong điện trường → B là alanine.
+) Arginine tồn tại chủ yếu dưới dạng cation (+1) → bị kéo về cực âm → A là arginine.
Phân tích các phát biểu:
✔️ a) Đúng. Có thể tách riêng arginine, alanine và aspatic acid tại pH = 6 bằng phương pháp điện di vì các amino acid có điện tích khác nhau nên sẽ di chuyển về các hướng khác nhau trong điện trường.
❌ b) Sai. Tại pH = 6, A là arginine (dạng cation), C là aspartic acid (dạng anion).
✔️ c) Đúng. B (Alanine) ở dạng trung hòa nên có điện tích bằng 0 và C (Aspartic acid) mang điện tích -1.
✔️ d) Đúng. Ở pH thấp (pH = 2), môi trường có tính acid, chứa nhiều ion H+ nên arginine và aniline sẽ phản ứng với H+ để tạo thành dạng cation mang điện tích dương (+) → bị kéo về cực âm.
Câu 21 [705698]: Trong công nghiệp, nhôm được sản xuất bằng cách điện phân nóng chảy hỗn hợp aluminium oxide (Al2O3) và cryolite (Na3AlF6) còn gọi là quy trình Hall Héroult:
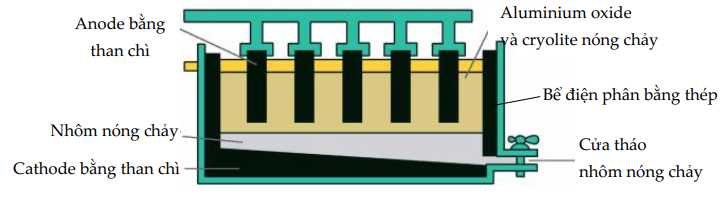
2Al2O3(s)  4Al(l) + 3O2(g)
4Al(l) + 3O2(g)
Nhiệt độ nóng chảy của hỗn hợp aluminium oxide và cryolite khoảng 950 oC, thấp hơn nhiều so với nhiệt độ nóng chảy của aluminium oxide (> 2000 oC); ngoài ra, cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. Trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục được nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới. 4Al(l) + 3O2(g)
4Al(l) + 3O2(g)
Điện phân nóng chảy: 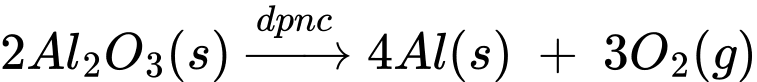
Các quá trình xảy ra tại điện cực:
Tại cathode (–) (cực âm): Al3+ + 3e → Al (Quá trình khử)
Tại anode (+) (cực dương): 2O2- → O2 + 4e (Quá trình oxi hóa)
Graphite (C) bị oxi hóa tạo CO2: C + O2 → CO2 ↑
Vì thế, anode bị ăn mòn theo thời gian.
Phân tích các phát biểu:
✔️ a) Đúng. Vì Al3+ nhận electron tại cathode nên aluminium kim loại được tách ra tại cathode.
✔️ b) Đúng. Cryolite giảm nhiệt độ nóng chảy từ >2000 oC xuống ~950 oC, giúp tiết kiệm nhiên liệu và giảm chi phí sản xuất.
❌ c) Sai. O2 thoát ra ở anode nhưng phản ứng với graphite tạo CO2 nên không thu được O2 tinh khiết.
❌ d) Sai. Cathode (–) cần để tách Al3+ thành Al, còn anode (+) tạo O2. Nếu đổi cực, nhôm sẽ bị oxi hóa thay vì được tạo ra.
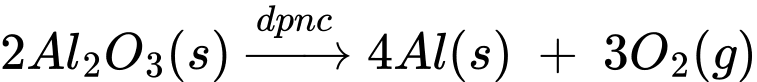
Các quá trình xảy ra tại điện cực:
Tại cathode (–) (cực âm): Al3+ + 3e → Al (Quá trình khử)
Tại anode (+) (cực dương): 2O2- → O2 + 4e (Quá trình oxi hóa)
Graphite (C) bị oxi hóa tạo CO2: C + O2 → CO2 ↑
Vì thế, anode bị ăn mòn theo thời gian.
Phân tích các phát biểu:
✔️ a) Đúng. Vì Al3+ nhận electron tại cathode nên aluminium kim loại được tách ra tại cathode.
✔️ b) Đúng. Cryolite giảm nhiệt độ nóng chảy từ >2000 oC xuống ~950 oC, giúp tiết kiệm nhiên liệu và giảm chi phí sản xuất.
❌ c) Sai. O2 thoát ra ở anode nhưng phản ứng với graphite tạo CO2 nên không thu được O2 tinh khiết.
❌ d) Sai. Cathode (–) cần để tách Al3+ thành Al, còn anode (+) tạo O2. Nếu đổi cực, nhôm sẽ bị oxi hóa thay vì được tạo ra.
Câu 22 [705695]: Tiến hành thí nghiệm so sánh độ tan của CaSO4 và BaSO4 như sau:
∎ Bước 1: Cho 2 mL dung dịch BaCl2 vào ống nghiệm (1), 2 mL dung dịch CaCl2 vào ống nghiệm (2).
∎ Bước 2: Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại.
∎ Bước 1: Cho 2 mL dung dịch BaCl2 vào ống nghiệm (1), 2 mL dung dịch CaCl2 vào ống nghiệm (2).
∎ Bước 2: Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại.
Phản ứng xảy ra trong từng ống nghiệm:
Khi nhỏ từ từ dung dịch CuSO4 vào BaCl2 và CaCl2, ta có:
Ống nghiệm (1): BaCl2 + CuSO4 → BaSO4↓ + CuCl2
BaSO4 có độ tan rất nhỏ, gần như không tan, tạo kết tủa trắng ngay khi có đủ ion SO42-.
Ống nghiệm (2): CaCl2 + CuSO4 → CaSO4↓ + CuCl2
CaSO4 có độ tan lớn hơn BaSO4 nên khi thêm CuSO4 có thể chỉ xuất hiện vẩn đục nhẹ hoặc không tạo kết tủa ngay.
Phân tích các phát biểu:
❌ a) Sai. BaSO4 rất khó tan, tạo kết tủa trắng rõ ràng chứ không chỉ là vẩn đục nhẹ.
❌ b) Sai. Ống nghiệm (2) chứa CaCl2, nên kết tủa là CaSO4, không phải BaSO4.
✔️ c) Đúng. Các ion Cl⁻ và Cu²⁺ không có mặt trong phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4 ↓
Ca2+ + SO42- → CaSO4 ↓
Cl- và Cu2+ không tham gia vào phản ứng kết tủa.
❌ d) Sai. BaSO4 kết tủa nhanh và hoàn toàn, còn CaSO4 chỉ vẩn đục nhẹ, chứng tỏ BaSO4 ít tan hơn CaSO4, không phải ngược lại.
(Kết luận: BaSO4 không tan trong nước còn CaSO4 ít tan trong nước)
Khi nhỏ từ từ dung dịch CuSO4 vào BaCl2 và CaCl2, ta có:
Ống nghiệm (1): BaCl2 + CuSO4 → BaSO4↓ + CuCl2
BaSO4 có độ tan rất nhỏ, gần như không tan, tạo kết tủa trắng ngay khi có đủ ion SO42-.
Ống nghiệm (2): CaCl2 + CuSO4 → CaSO4↓ + CuCl2
CaSO4 có độ tan lớn hơn BaSO4 nên khi thêm CuSO4 có thể chỉ xuất hiện vẩn đục nhẹ hoặc không tạo kết tủa ngay.
Phân tích các phát biểu:
❌ a) Sai. BaSO4 rất khó tan, tạo kết tủa trắng rõ ràng chứ không chỉ là vẩn đục nhẹ.
❌ b) Sai. Ống nghiệm (2) chứa CaCl2, nên kết tủa là CaSO4, không phải BaSO4.
✔️ c) Đúng. Các ion Cl⁻ và Cu²⁺ không có mặt trong phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4 ↓
Ca2+ + SO42- → CaSO4 ↓
Cl- và Cu2+ không tham gia vào phản ứng kết tủa.
❌ d) Sai. BaSO4 kết tủa nhanh và hoàn toàn, còn CaSO4 chỉ vẩn đục nhẹ, chứng tỏ BaSO4 ít tan hơn CaSO4, không phải ngược lại.
(Kết luận: BaSO4 không tan trong nước còn CaSO4 ít tan trong nước)
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705699]: Các phức chất được tạo thành từ sự tương tác giữa cation Co3+ với đồng thời cả anion C2O42– (oxalate kí hiệu là ox) và phân tử H2O, có dạng [Co(OH2)x(ox)y]p+.Biết rằng trong các phức chất này:
∎ Cation Co3+ tạo được 6 liên kết sigma kiểu cho – nhận với các phối tử.
∎ Mỗi anion C2O42– sử dụng 2 cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation kim loại.
Nếu số phối tử H2O trong phức chất [Co(OH2)x(ox)y]p+ là 4 thì giá trị của p bằng bao nhiêu?
∎ Cation Co3+ tạo được 6 liên kết sigma kiểu cho – nhận với các phối tử.
∎ Mỗi anion C2O42– sử dụng 2 cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation kim loại.
Nếu số phối tử H2O trong phức chất [Co(OH2)x(ox)y]p+ là 4 thì giá trị của p bằng bao nhiêu?
Phức chất có dạng [Co(OH2)x(ox)y]p+, trong đó:
★ Co3+ (cation trung tâm) (điện tích +3) có số phối trí = 6, nghĩa là nó tạo 6 liên kết sigma kiểu cho – nhận với các phối tử.
★ Mỗi anion oxalate (C2O42-) (điện tích -2) tạo 2 liên kết cho – nhận, nên một oxalate chiếm 2 vị trí liên kết (phối tử 2 càng).
★ H2O là phối tử đơn càng (trung hòa, không mang điện tích) nên mỗi phân tử H2O chỉ chiếm 1 vị trí liên kết.
Nếu số phối tử H2O trong phức chất [Co(OH2)x(ox)y]p+ là 4, tức x = 4 và tổng số liên kết của Co3+ phải là 6 thì ta có:
x + 2 y= 6 ⇔ 4 + 2y = 6 ⇔ 2y = 2 ⇒ y=1
⟶ Phức chất có dạng [Co(OH2)4(ox)]p+.
⟶ Điện tích của phức là: p = +3 + (−2) = +1.
Vậy giá trị của p là 1.
⇒ Điền đáp án: 1
★ Co3+ (cation trung tâm) (điện tích +3) có số phối trí = 6, nghĩa là nó tạo 6 liên kết sigma kiểu cho – nhận với các phối tử.
★ Mỗi anion oxalate (C2O42-) (điện tích -2) tạo 2 liên kết cho – nhận, nên một oxalate chiếm 2 vị trí liên kết (phối tử 2 càng).
★ H2O là phối tử đơn càng (trung hòa, không mang điện tích) nên mỗi phân tử H2O chỉ chiếm 1 vị trí liên kết.
Nếu số phối tử H2O trong phức chất [Co(OH2)x(ox)y]p+ là 4, tức x = 4 và tổng số liên kết của Co3+ phải là 6 thì ta có:
x + 2 y= 6 ⇔ 4 + 2y = 6 ⇔ 2y = 2 ⇒ y=1
⟶ Phức chất có dạng [Co(OH2)4(ox)]p+.
⟶ Điện tích của phức là: p = +3 + (−2) = +1.
Vậy giá trị của p là 1.
⇒ Điền đáp án: 1
Câu 24 [308625]: Khi cho ethylamine tác dụng với dung dịch acid HCl. Khối lượng dung dịch HCl 7,3% cần dùng để tác dụng vừa đủ với 4,5 gam ethylamine là bao nhiêu?
nC2H5NH2 = 4,5 ÷ 45 = 0,1 (mol)
PTHH:CH3-CH2-NH2 + HCl → CH3-CH2-NH3Cl
0,1 → 0,1
⇒ mddHCl = (mHCl × 100%) ÷ C% = (0,1 × 36,5 × 100%) ÷ 7,3% = 50 (gam)
⇒ Điền đáp án: 50
Câu 25 [705700]: Trong số các chất được cho trong dãy sau: CH3CHO; CH3COCH3; CH3COOC2H5; CH2=CH2; C6H5COOCH3; NH2CH2COOH; C6H5NH2, có bao nhiêu chất phản ứng với thuốc thử Tollens sinh ra kết tủa Ag?
Thuốc thử Tollens ([Ag(NH3)2]+) dùng để nhận biết các chất có nhóm -CHO (aldehyde) hoặc các hợp chất có thể chuyển hóa thành aldehyde trong môi trường base, chẳng hạn như:
- Aldehyde (RCHO)
- Formic acid (HCOOH) và muối của nó
- Một số α-hydroxy ketone có thể chuyển thành aldehyde.
Xét từng chất trong dãy:
✅ CH3CHO (Acetaldehyde - Aldehyde) → Phản ứng với Tollens, tạo Ag.
❌ CH3COCH3 (Acetone - Ketone) → Không phản ứng với Tollens.
❌ CH3COOC2H5 (Ethyl acetate - Ester) → Không phản ứng với Tollens
❌ CH2=CH2 (Ethylene - Alkene) → Không phản ứng với Tollens
❌ C6H5COOCH3 (Methyl benzoate - Ester) → Không phản ứng với Tollens
❌ NH2CH2COOH (Glycine - Amino acid, không có nhóm -CHO) → Không phản ứng với Tollens
❌ C6H5NH2 (Aniline - Amine thơm) → Không phản ứng với Tollens.
→ Chỉ có 1 chất phản ứng với thuốc thử Tollens sinh ra kết tủa Ag là CH3CHO.
⇒ Điền đáp án: 1
- Aldehyde (RCHO)
- Formic acid (HCOOH) và muối của nó
- Một số α-hydroxy ketone có thể chuyển thành aldehyde.
Xét từng chất trong dãy:
✅ CH3CHO (Acetaldehyde - Aldehyde) → Phản ứng với Tollens, tạo Ag.
❌ CH3COCH3 (Acetone - Ketone) → Không phản ứng với Tollens.
❌ CH3COOC2H5 (Ethyl acetate - Ester) → Không phản ứng với Tollens
❌ CH2=CH2 (Ethylene - Alkene) → Không phản ứng với Tollens
❌ C6H5COOCH3 (Methyl benzoate - Ester) → Không phản ứng với Tollens
❌ NH2CH2COOH (Glycine - Amino acid, không có nhóm -CHO) → Không phản ứng với Tollens
❌ C6H5NH2 (Aniline - Amine thơm) → Không phản ứng với Tollens.
→ Chỉ có 1 chất phản ứng với thuốc thử Tollens sinh ra kết tủa Ag là CH3CHO.
⇒ Điền đáp án: 1
Câu 26 [684295]: 1,1-Dibromoethane là một hợp chất hữu cơ trong suốt, có màu hơi nâu, dễ cháy, thường được thấy trong công nghiệp hoá chất, được sử dụng như một chất phụ gia cho nhiên liệu. Phổ khối lượng của 1,1-dibromoethane được cho bởi hình bên dưới. Khối lượng phân tử của 1,1-dibromoethane là bao nhiêu?
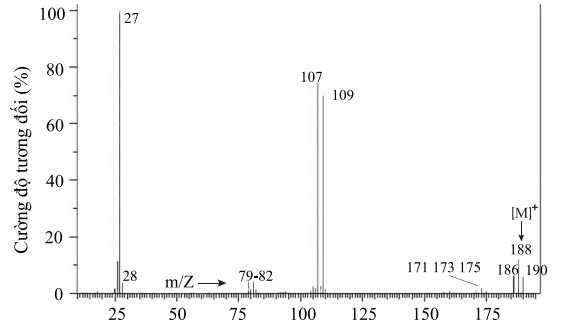

Phổ khối lượng có thể cho biết thông tin về phân tử khối của hợp chất hữu cơ thông qua mảnh ion phân tử [M]+ thường ứng với tín hiệu có giá trị m/z lớn nhất.
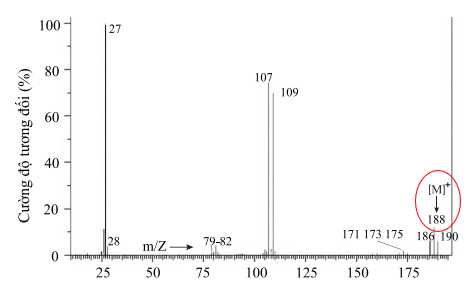
⟶ Phân tử khối của 1,1-dibromoethane là 188 g/mol.
⇒ Điền đáp án: 188

⟶ Phân tử khối của 1,1-dibromoethane là 188 g/mol.
⇒ Điền đáp án: 188
Câu 27 [705701]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monooxide, methanol, ethanol, propane, …) bằng oxygen không khí. Trong pin propane – oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
C3H8(g)+ 5O2(g) + 6OH–(aq) ⟶ 3CO32–(aq) + 7H2O(l)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propane theo phản ứng trên thì sinh ra một lượng năng lượng là 2497,66 kJ. Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane – oxygen. Biết hiệu suất quá trình oxi hóa propane là 70,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 154 gam propane làm nhiên liệu ở điều kiện chuẩn là bao nhiêu?
C3H8(g)+ 5O2(g) + 6OH–(aq) ⟶ 3CO32–(aq) + 7H2O(l)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propane theo phản ứng trên thì sinh ra một lượng năng lượng là 2497,66 kJ. Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane – oxygen. Biết hiệu suất quá trình oxi hóa propane là 70,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 154 gam propane làm nhiên liệu ở điều kiện chuẩn là bao nhiêu?
C3H8(g)+ 5O2(g) + 6OH–(aq) ⟶ 3CO32–(aq) + 7H2O(l)
Số mol của propane là:
npropane = 154 ÷ 44 = 3,5 (mol)
Đốt cháy hoàn toàn 1 mol propane sinh ra lượng năng lượng là 2597,66 kJ
Lượng năng lượng mà bóng đèn nhận được là:
3,5 × 2597,66 × 70% = 6119,267 (kJ)
Cứ 1 giờ bóng đèn LED được tháp sáng liên tục cần tiêu thụ năng lượng bằng 72 kJ.
⟶ Thời gian bóng đèn thắp sáng liên tục là:
t = 6119,267 ÷ 72 = 84,9898… ≈ 85 (giờ)
⇒ Điền đáp án: 85
Số mol của propane là:
npropane = 154 ÷ 44 = 3,5 (mol)
Đốt cháy hoàn toàn 1 mol propane sinh ra lượng năng lượng là 2597,66 kJ
Lượng năng lượng mà bóng đèn nhận được là:
3,5 × 2597,66 × 70% = 6119,267 (kJ)
Cứ 1 giờ bóng đèn LED được tháp sáng liên tục cần tiêu thụ năng lượng bằng 72 kJ.
⟶ Thời gian bóng đèn thắp sáng liên tục là:
t = 6119,267 ÷ 72 = 84,9898… ≈ 85 (giờ)
⇒ Điền đáp án: 85
Câu 28 [705702]: Để xác định hàm lượng hydrogen sulfide (H2S) trong mẫu nước thải công nghiệp, ta tiến hành như sau: Hòa tan 6,50 gam KIO3 trong nước thành 1 lít dung dịch X. Lấy 10 mL dung dịch X, thêm 0,5 gam KI và 5 giọt hồ tinh bột vào, tiếp theo rót 10 mL mẫu nước thải công nghiệp, sau đó acid hóa dung dịch thu được bằng 10 mL dung dịch HCI 3,5M. Sau 5 phút, cho hỗn hợp phản ứng với dung dịch Na2S2O3 0,1M, đến khi màu xanh tím biến mất thì hết 13,5 mL dung dịch Na2S2O3. Biết các phản ứng diễn ra trong quy trình như sau:
IO3– + 5I– + 6H+ ⟶ 3I2 + 3H2O
H2S + I2 ⟶ S + 2HI
S2O32– + I2 ⟶ S4O62– + 2I–
Tính hàm lượng hydrogen sulfide trong mẫu nước theo g/L (chỉ làm tròn ở phép tính cuối cùng và làm tròn kết quả đến hàng phần mười).
IO3– + 5I– + 6H+ ⟶ 3I2 + 3H2O
H2S + I2 ⟶ S + 2HI
S2O32– + I2 ⟶ S4O62– + 2I–
Tính hàm lượng hydrogen sulfide trong mẫu nước theo g/L (chỉ làm tròn ở phép tính cuối cùng và làm tròn kết quả đến hàng phần mười).
(1) IO3− + 5I− + 6H+ → 3I2 + 3H2O
(2) H2S + I2 → S + 2HI
(3) 2S2O32− + I2 → S4O62− + 2I−
Đổi 13,5 mL = 0,0135 L; 1 L = 1000 mL; 10 mL = 0,01 L
Số mol của KIO3 trong 10 mL là: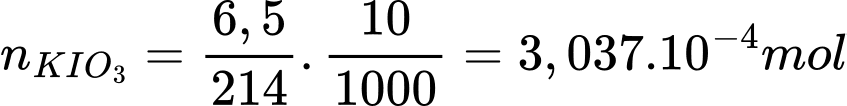
Số mol của I2 trong phương trình (1) là: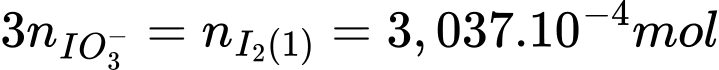
Số mol của Na2S3O3 là: nNa2S2O3 = 0,0135 × 0,1 = 0,00135 (mol)
Từ PTHH (3) số mol của I2 là: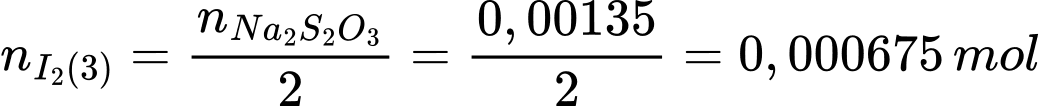
Số mol I2 phản ứng với H2S là: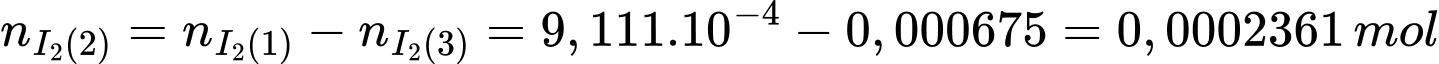
Số mol của H2S là: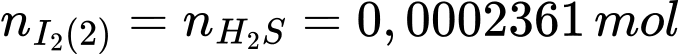
Hàm lượng H2S trong mẫu nước là: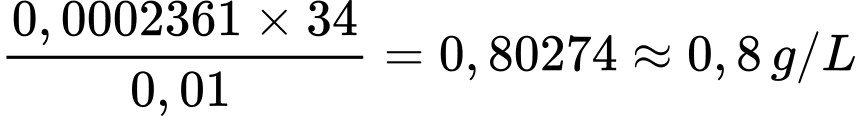 .
.
⇒ Điền đáp án: 0,8
(2) H2S + I2 → S + 2HI
(3) 2S2O32− + I2 → S4O62− + 2I−
Đổi 13,5 mL = 0,0135 L; 1 L = 1000 mL; 10 mL = 0,01 L
Số mol của KIO3 trong 10 mL là:
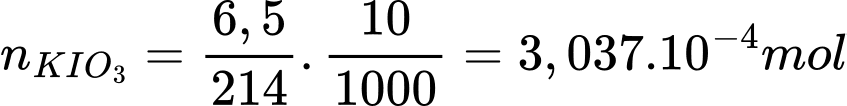
Số mol của I2 trong phương trình (1) là:
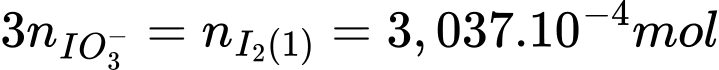
Số mol của Na2S3O3 là: nNa2S2O3 = 0,0135 × 0,1 = 0,00135 (mol)
Từ PTHH (3) số mol của I2 là:
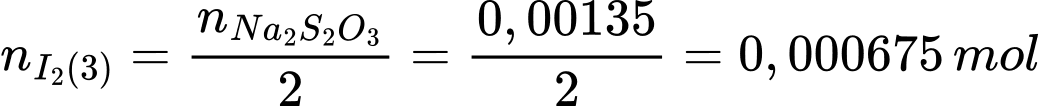
Số mol I2 phản ứng với H2S là:
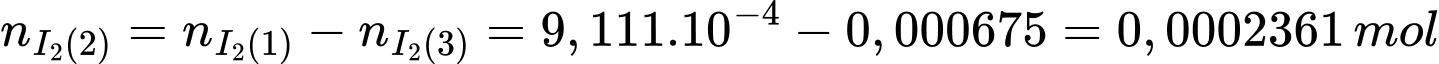
Số mol của H2S là:
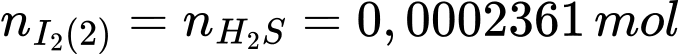
Hàm lượng H2S trong mẫu nước là:
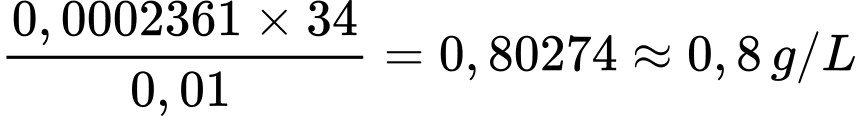 .
.⇒ Điền đáp án: 0,8