PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705703]: Nguồn điện ...(1)... là một loại nguồn điện được tạo ra bằng cách sử dụng các phản ứng hoá học để tạo ra ...(2)... Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, cơ học, dòng điện.
B, pin, nhiệt năng.
C, hoá học, điện năng.
D, acquy, điện năng.
Nguồn điện hoá học là một loại nguồn điện được tạo ra bằng cách sử dụng các phản ứng hoá học để tạo ra điện năng.
Giải thích:
Nguồn điện hóa học là loại nguồn điện được tạo ra nhờ các phản ứng hóa học xảy ra bên trong pin hoặc ắc quy. Khi các chất tham gia phản ứng, chúng chuyển hóa năng lượng hóa học thành năng lượng điện, tạo ra dòng electron dịch chuyển trong mạch ngoài, tức là tạo ra dòng điện.
Ví dụ:
⭐ Pin điện hóa (pin khô, pin kiềm, pin lithium, v.v.): Trong pin, các phản ứng oxi hóa – khử xảy ra giữa hai điện cực (cực dương và cực âm) với dung dịch điện phân giúp tạo ra dòng điện.
⭐ Ắc quy chì - acid: Khi hoạt động, ắc quy sử dụng phản ứng hóa học giữa chì (Pb), lead dioxide (PbO2) và dung dịch sulfuric acid (H2SO4) để tạo ra điện.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
Nguồn điện hóa học là loại nguồn điện được tạo ra nhờ các phản ứng hóa học xảy ra bên trong pin hoặc ắc quy. Khi các chất tham gia phản ứng, chúng chuyển hóa năng lượng hóa học thành năng lượng điện, tạo ra dòng electron dịch chuyển trong mạch ngoài, tức là tạo ra dòng điện.
Ví dụ:
⭐ Pin điện hóa (pin khô, pin kiềm, pin lithium, v.v.): Trong pin, các phản ứng oxi hóa – khử xảy ra giữa hai điện cực (cực dương và cực âm) với dung dịch điện phân giúp tạo ra dòng điện.
⭐ Ắc quy chì - acid: Khi hoạt động, ắc quy sử dụng phản ứng hóa học giữa chì (Pb), lead dioxide (PbO2) và dung dịch sulfuric acid (H2SO4) để tạo ra điện.
⇒ Chọn đáp án C Đáp án: C
Câu 2 [575885]: Tên gọi của hợp chất ion có công thức KCl là
A, Potassium chlorine.
B, Potassium chloride.
C, Potassium chlorate.
D, Potassium chlorite.
K là potassium; Cl là chlorine nhưng khi tạo thành hợp chất ion với kim loại, nó chuyển thành chloride.
⇒ Tên gọi của hợp chất ion có công thức KCl là Potassium chloride.
Phân tích các đáp án khác:
A. potassium chlorine: Sai vì "chlorine" là nguyên tố đơn chất, không phải dạng ion.
C. potassium chlorate (KClO3): Sai vì "chlorate" là gốc ClO3–, không phải Cl–.
D. potassium chlorite (KClO2): Sai vì "chlorite" là gốc ClO2–, không phải Cl–.
⇒ Chọn đáp án B Đáp án: B
⇒ Tên gọi của hợp chất ion có công thức KCl là Potassium chloride.
Phân tích các đáp án khác:
A. potassium chlorine: Sai vì "chlorine" là nguyên tố đơn chất, không phải dạng ion.
C. potassium chlorate (KClO3): Sai vì "chlorate" là gốc ClO3–, không phải Cl–.
D. potassium chlorite (KClO2): Sai vì "chlorite" là gốc ClO2–, không phải Cl–.
⇒ Chọn đáp án B Đáp án: B
Câu 3 [705704]: Adrenaline là hormon tuyến thượng thận có tác dụng làm tăng huyết áp. Adrenaline có công thức cấu tạo như sau:
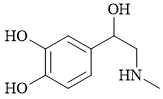
Adrenaline không chứa loại nhóm chức nào sau đây?

Adrenaline không chứa loại nhóm chức nào sau đây?
A, phenol.
B, alcohol.
C, amide.
D, amine.
Adrenaline chứa loại nhóm chức alcohol, phenol và amine:
- Nhóm hydroxyl (-OH) được gắn vào một nguyên tử carbon no được gọi là nhóm chức alcohol.
- Nhóm hydroxyl (-OH) được gắn vào vòng benzene được gọi là nhóm chức phenol.
- Nhóm chức amine (NH) của adrenaline hình thành khi thay thế hai nguyên tử hydrogen của phân tử ammonia (NH3).
Adrenaline không chứa nhóm chức amide do không có nhóm hydroxyl (-OH) được thay thế bằng một nhóm amino (-NH2, -NHR, hoặc -NR2).
⇒ Chọn đáp án C Đáp án: C
- Nhóm hydroxyl (-OH) được gắn vào một nguyên tử carbon no được gọi là nhóm chức alcohol.
- Nhóm hydroxyl (-OH) được gắn vào vòng benzene được gọi là nhóm chức phenol.
- Nhóm chức amine (NH) của adrenaline hình thành khi thay thế hai nguyên tử hydrogen của phân tử ammonia (NH3).
Adrenaline không chứa nhóm chức amide do không có nhóm hydroxyl (-OH) được thay thế bằng một nhóm amino (-NH2, -NHR, hoặc -NR2).
⇒ Chọn đáp án C Đáp án: C
Câu 4 [705705]: Thực hiện các thí nghiệm sau:
(a) Nhiệt phân muối silver nitrate.
(b) Điện phân dung dịch sodium chloride có màng ngăn xốp.
(c) Dẫn khí hydrogen qua bột copper(II) oxide đun nóng.
(d) Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate.
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kim loại là
(a) Nhiệt phân muối silver nitrate.
(b) Điện phân dung dịch sodium chloride có màng ngăn xốp.
(c) Dẫn khí hydrogen qua bột copper(II) oxide đun nóng.
(d) Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate.
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kim loại là
A, (a), (b), (c).
B, (a), (c), (d).
C, (b), (c), (d).
D, (a), (b), (d).
Các phản ứng xảy ra như sau:
(a) Nhiệt phân muối silver nitrate
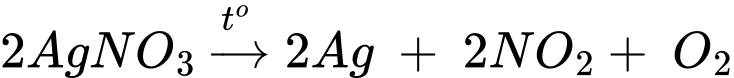
(b) Điện phân dung dịch sodium chloride có màng ngăn xốp
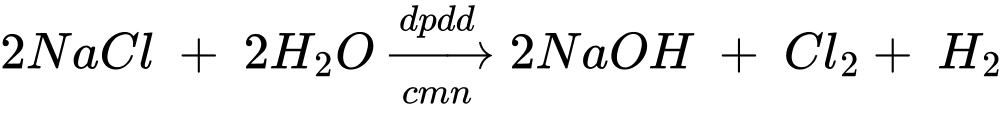
(c) Dẫn khí hydrogen qua bột copper(II) oxide đun nóng
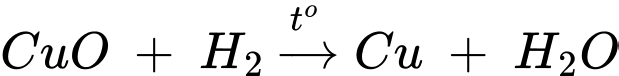
(d) Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate
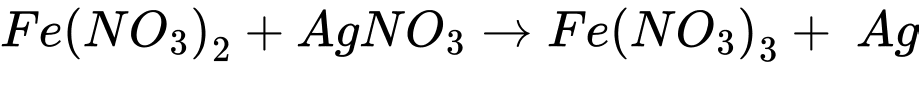
Sau phản ứng, các thí nghiệm thu được kim loại là (a) (c) và (d)
⇒ Chọn đáp án B Đáp án: B
(a) Nhiệt phân muối silver nitrate
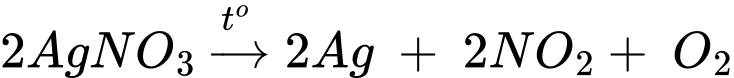
(b) Điện phân dung dịch sodium chloride có màng ngăn xốp
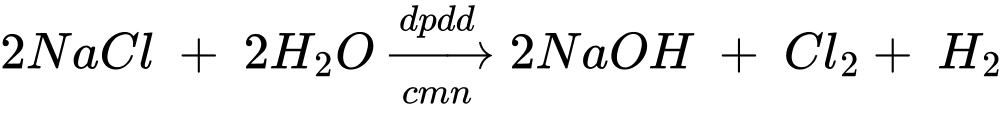
(c) Dẫn khí hydrogen qua bột copper(II) oxide đun nóng
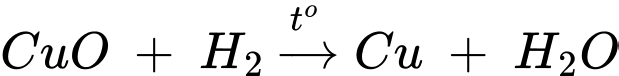
(d) Cho dung dịch iron(II) nitrate vào dung dịch silver nitrate
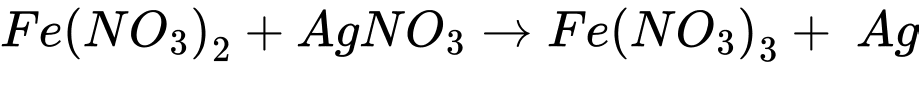
Sau phản ứng, các thí nghiệm thu được kim loại là (a) (c) và (d)
⇒ Chọn đáp án B Đáp án: B
Câu 5 [241772]: Hạt nhân của nguyên tử nào có số hạt neutron là 30?
A, 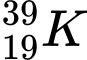 .
.
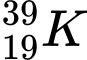 .
.B, 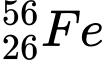 .
.
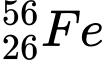 .
.C, 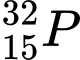 .
.
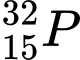 .
.D, 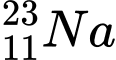 .
.
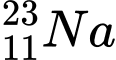 .
.
Số hạt neutron (N) = Số khối (A) – Số hạt proton (P).
Xét hạt nhân của các nguyên tử:
❌ A.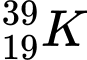 : N = 39 – 19 = 20
: N = 39 – 19 = 20
✔️ B.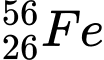 : N = 56 – 26 = 30
: N = 56 – 26 = 30
❌ C.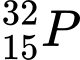 : N = 32 – 15 = 17
: N = 32 – 15 = 17
❌ D.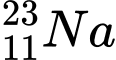 : N = 23 – 11 = 12
: N = 23 – 11 = 12
⇒ Chọn đáp án B Đáp án: B
Xét hạt nhân của các nguyên tử:
❌ A.
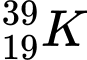 : N = 39 – 19 = 20
: N = 39 – 19 = 20✔️ B.
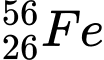 : N = 56 – 26 = 30
: N = 56 – 26 = 30❌ C.
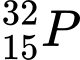 : N = 32 – 15 = 17
: N = 32 – 15 = 17❌ D.
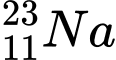 : N = 23 – 11 = 12
: N = 23 – 11 = 12⇒ Chọn đáp án B Đáp án: B
Câu 6 [560604]: Kim loại nào dưới đây là dẻo nhất (thường được dùng để dát lên các công trình kiến trúc cổ)?
A, Ag.
B, Al.
C, Cu.
D, Au.
Vàng (Au) là kim loại dẻo nhất, có thể dát thành các lá cực mỏng (chỉ khoảng 0,0001 mm) và bền với các chất oxi hóa trong không khí. Vì vậy, vàng thường được dùng để mạ hoặc dát lên các công trình kiến trúc cổ, tượng, đồ trang trí,…
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 7 [705706]: Cellulose là một hợp chất carbohydrate thuộc loại
A, monosacharide.
B, disaccharide.
C, lipid.
D, polysaccharide.
Cellulose là một polysaccharide vì nó được cấu tạo từ nhiều đơn vị β-glucose liên kết với nhau qua liên kết β-1,4-glycoside.
Phân loại carbohydrate:

⇒ Chọn đáp án D Đáp án: D
Phân loại carbohydrate:

⇒ Chọn đáp án D Đáp án: D
Câu 8 [705707]: Để phản ứng cháy xảy ra, cần phải có sự tham gia của oxygen. Tốc độ phản ứng hoá học phụ thuộc vào nhiều yếu tố. Một trong những yếu tố đó là nồng độ chất tham gia phản ứng. Nếu nồng độ oxygen giảm thì tốc độ phản ứng cháy cũng bị giảm đi. Khi propane bốc cháy, có biểu thức tốc độ của phản ứng cháy như sau:
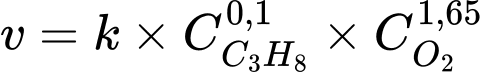
Nếu nồng độ O2 giảm đi 2 lần thì tốc độ của phản ứng propane cháy giảm bao nhiêu lần?
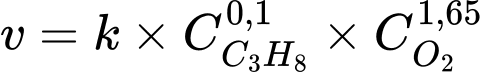
Nếu nồng độ O2 giảm đi 2 lần thì tốc độ của phản ứng propane cháy giảm bao nhiêu lần?
A, 3,14 lần.
B, 6,28 lần.
C, 9,25 lần.
D, 10,74 lần.
Tốc độ phản ứng ban đầu: 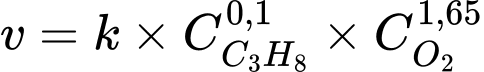
Tốc độ phản ứng khi nồng độ O2 giảm đi 2 lần: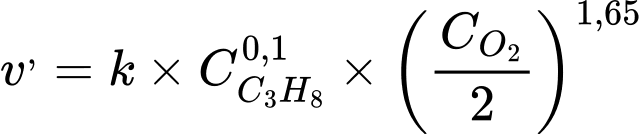
→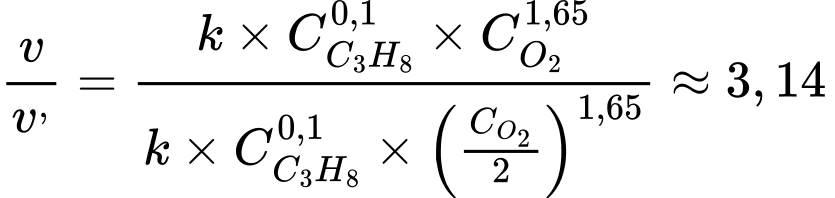
→ Tốc độ phản ứng giảm 3,14 lần.
⇒ Chọn đáp án A Đáp án: A
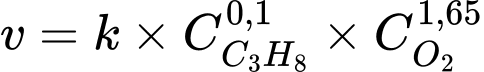
Tốc độ phản ứng khi nồng độ O2 giảm đi 2 lần:
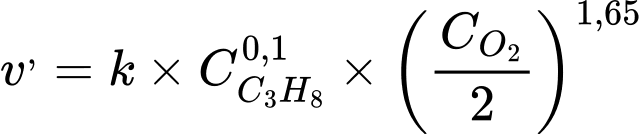
→
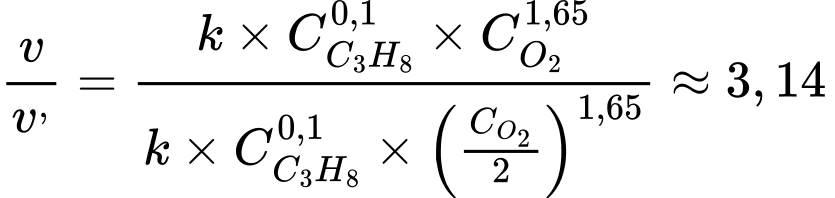
→ Tốc độ phản ứng giảm 3,14 lần.
⇒ Chọn đáp án A Đáp án: A
Câu 9 [705708]: Khi nhỏ vài giọt sulfuric acid đặc vào một xấp giấy ăn khô, giấy ăn sẽ hoá đen ở chỗ tiếp xúc, bốc cháy và tạo nhiều khói; khói này có thể làm đổi màu giấy quỳ tím ẩm. Phátbiểu nào sau đây không đúng?
A, Giấy ăn hoá đen (than hoá) là do cellulose trong giấy bị khử thành carbon.
B, Nếu thay giấy quỳ tím ẩm bằng giấy nhúng dung dịch KMnO4, giấy sẽ bị mất màu.
C, Trong khói sinh ra, có chứa sulfur trioxide là một acidic oxide.
D, Việc rò rỉ sulfuric acid trong quá trình lưu trữ không đúng cách có thể gây hoả hoạn.
Tính háo nước: Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoá). Giấy là hợp chất carbohydrate, do đó khi nhỏ 1 giọt dung dịch acid H2SO4 đặc lên tờ giấy trắng thì tờ giấy bị hoá đen ở chỗ tiếp xúc với acid.
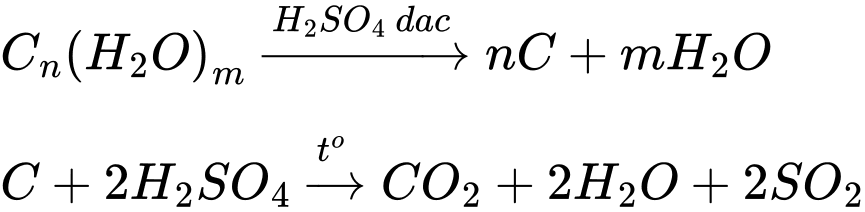
Khí thoát ra là CO2 và SO2
Phân tích các đáp án:
✔️ A. Đúng. Giấy ăn hoá đen (than hoá) là do cellulose trong giấy bị khử thành carbon.
✔️ B. Đúng. SO2 sinh ra phản ứng với KMnO4 trong dung dịch H2SO4.
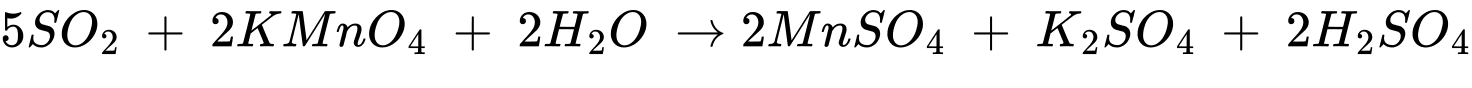
❌ C. Sai. Trong khói sinh ra có chứa sulfur dioxide (SO2) là acidic acid.
✔️ D. Đúng. Khi rò rỉ sulfuric acid trong quá trình lưu trữ sẽ gây ra các phản ứng hóa học, tỏa nhiều nhiệt có thể gây hỏa hoạn.
⇒ Chọn đáp án C Đáp án: C
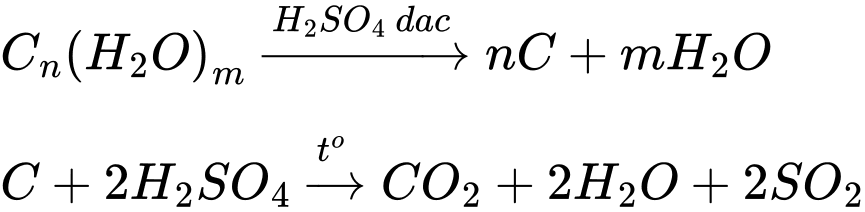
Khí thoát ra là CO2 và SO2
Phân tích các đáp án:
✔️ A. Đúng. Giấy ăn hoá đen (than hoá) là do cellulose trong giấy bị khử thành carbon.
✔️ B. Đúng. SO2 sinh ra phản ứng với KMnO4 trong dung dịch H2SO4.
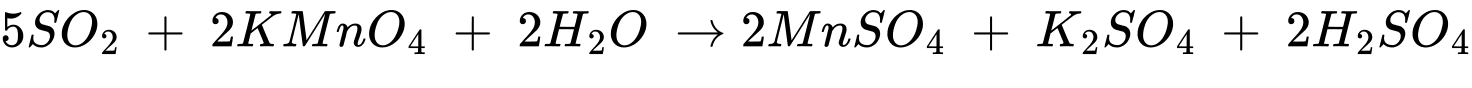
❌ C. Sai. Trong khói sinh ra có chứa sulfur dioxide (SO2) là acidic acid.
✔️ D. Đúng. Khi rò rỉ sulfuric acid trong quá trình lưu trữ sẽ gây ra các phản ứng hóa học, tỏa nhiều nhiệt có thể gây hỏa hoạn.
⇒ Chọn đáp án C Đáp án: C
Câu 10 [190525]: Khi đun sôi hỗn hợp gồm C2H5Br và dung dịch KOH trong C2H5OH thấy thoát ra một chất khí không màu. Dẫn khí này đi qua ống nghiệm đựng nước bromine. Hiện tượng xảy ra là
A, xuất hiện kết tủa trắng.
B, nước bromine có màu đậm hơn.
C, nước bromine bị mất màu.
D, không có hiện tượng gì xảy ra.
CH3CH2Br khi đun với dung dịch kiềm tạo thành alcohol, đun với kiềm trong ethanol tạo thành ethene.
CH3CH2Br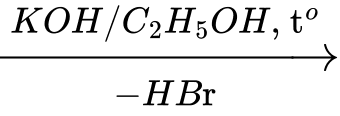 CH2=CH2
CH2=CH2
Ethene
Ethene phản ứng với bromine
CH2=CH2 + Br2 → CH2Br–CH2Br
Hiện tượng, nước bromine mất màu.
⇒ Chọn đáp án C Đáp án: C
CH3CH2Br
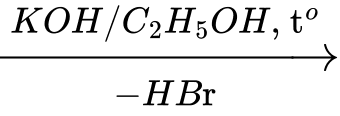 CH2=CH2
CH2=CH2Ethene
Ethene phản ứng với bromine
CH2=CH2 + Br2 → CH2Br–CH2Br
Hiện tượng, nước bromine mất màu.
⇒ Chọn đáp án C Đáp án: C
Câu 11 [309401]: Protein X có 0,16 % lưu huỳnh, biết rằng cứ 1 phân tử X chỉ chứa 1 nguyên tử lưu huỳnh. Khối lượng phân tử gần đúng của X là
A, 100.000 g/mol.
B, 10.000 g/mol.
C, 20.000 g/mol.
D, 2.000 g/mol.
Protein X có 0,16 % lưu huỳnh, biết rằng cử 1 phân tử X chỉ chứa 1 nguyên tử lưu huỳnh.
Khối lượng phân tử của protein X là: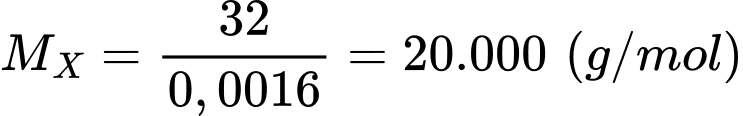
⇒ Chọn đáp án C Đáp án: C
Khối lượng phân tử của protein X là:
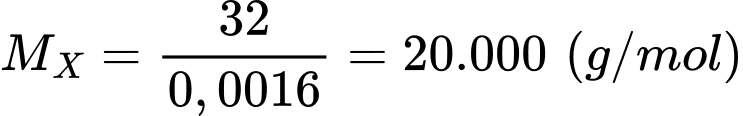
⇒ Chọn đáp án C Đáp án: C
Câu 12 [308475]: Ứng dụng nào sau đây của các carbohydrate là không đúng?
A, Trong Y học, glucose đương dùng làm thuốc tăng lực, saccharose để pha chế thuốc.
B, Cellulose trinitrate là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
C, Trong công nghiệp, tinh bột được dùng để sản xuất bánh kẹo, glucose, hồ dán,..
D, Glucose, saccharose được sử dụng chủ yếu trong công nghiệp tráng gương, tráng ruột phích,…
Phân tích các phát biểu:
✔️ A. Đúng. Glucose, saccharose được sử dụng làm chất dinh dưỡng, cung cấp năng lượng cho cơ thể; làm nguyên liệu và chất phụ gia trong sản xuất các loại bánh, kẹo, thức uống dinh dưỡng, nước giải khát,...
✔️ B. Đúng. Cellulose trinitrate dùng để chế tạo thuốc súng không khói và sản xuất tơ nhân tạo.
✔️ C. Đúng. Tinh bột là nguồn lương thực quan trọng của con người, là nguyên liệu để sản xuất nhiều loại bánh, sản xuất mì sợi. bia, rượu, mạch nha, glucose, ethanol, là phụ gia để hồ vải....
❌ D. Sai. Saccharose không được sử dụng trong công nghiệp tráng gương.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. Glucose, saccharose được sử dụng làm chất dinh dưỡng, cung cấp năng lượng cho cơ thể; làm nguyên liệu và chất phụ gia trong sản xuất các loại bánh, kẹo, thức uống dinh dưỡng, nước giải khát,...
✔️ B. Đúng. Cellulose trinitrate dùng để chế tạo thuốc súng không khói và sản xuất tơ nhân tạo.
✔️ C. Đúng. Tinh bột là nguồn lương thực quan trọng của con người, là nguyên liệu để sản xuất nhiều loại bánh, sản xuất mì sợi. bia, rượu, mạch nha, glucose, ethanol, là phụ gia để hồ vải....
❌ D. Sai. Saccharose không được sử dụng trong công nghiệp tráng gương.
⇒ Chọn đáp án D Đáp án: D
Câu 13 [705709]: Thủy phân etser X trong dung dịch acid, sản phẩm thu được gồm acetic acid và propyl alcohol. Công thức cấu tạo tương ứng của X là
A, CH3COOCH3.
B, HCOOC2H5.
C, CH3CH2COOC2H5.
D, CH3COOCH2CH2CH3.
Acetic acid – CH3COOH
Propyl alcohol – CH3CH2CH2OH
Phản ứng thủy phân ester X xảy ra như sau:
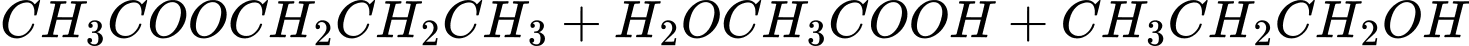
X có công thức cấu tạo là: CH3COOCH2CH2CH3.
⇒ Chọn đáp án D Đáp án: D
Propyl alcohol – CH3CH2CH2OH
Phản ứng thủy phân ester X xảy ra như sau:
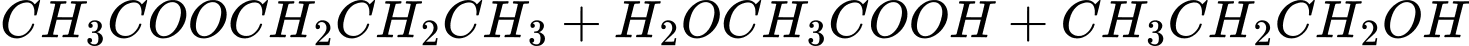
X có công thức cấu tạo là: CH3COOCH2CH2CH3.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [705710]: Khi thay thế nhóm …(1)… ở nhóm -COOH của carboxylic acid bằng nhóm …(2)… thì thu được ester. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, –CO, –NH2.
B, –OH, –NO2.
C, –H, –CH3.
D, –OH, –OR.
Khi thay thế nhóm –OH ở nhóm –COOH của carboxylic acid bằng nhóm –OR (R là gốc hydrocarbon) thì thu được ester.
Giải thích:
Carboxylic acid có công thức tổng quát R–COOH, trong đó nhóm chức –COOH (nhóm carboxyl) gồm:
– Nhóm carbonyl (C=O)
– Nhóm hydroxyl (–OH)
Khi –OH trong nhóm –COOH bị thay thế bởi nhóm –OR (trong đó R là gốc hydrocarbon như CH3, C2H5,...), ta thu được ester với công thức tổng quát R–COOR'.
⇒ Chọn đáp án D Đáp án: D
Giải thích:
Carboxylic acid có công thức tổng quát R–COOH, trong đó nhóm chức –COOH (nhóm carboxyl) gồm:
– Nhóm carbonyl (C=O)
– Nhóm hydroxyl (–OH)
Khi –OH trong nhóm –COOH bị thay thế bởi nhóm –OR (trong đó R là gốc hydrocarbon như CH3, C2H5,...), ta thu được ester với công thức tổng quát R–COOR'.
⇒ Chọn đáp án D Đáp án: D
Câu 15 [705711]: Từ tinh dầu hoa nhài người ta tách được chất hữu cơ X. Kết quả phân tích nguyên tố cho thấy X chứa 72,0% carbon, 6,66% hydrogen còn lại là oxygen. Trên phố khối lượng của X thấy peak ion phân tử M+ = 150. Trên phổ hồng ngoại của X thấy có số sóng hấp thụ ở 1716 cm–1 (mạnh), không thấy số sóng hấp thụ đặc trưng của nhóm OH. Thủy phân X trong dung dịch NaOH thu được một trong các sản phẩm là benzyl alcohol. Công thức cấu tạo phù hợp cho X là
A, 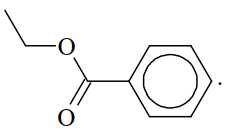

B, 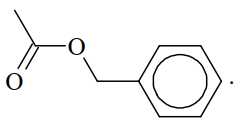

C, 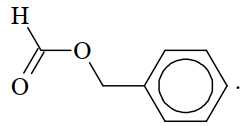

D, 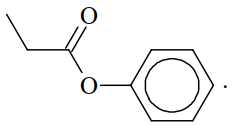

Gọi công thức của X có dạng CaHbOc
Từ phổ MS phân tử khối của X là 150 gam/mol
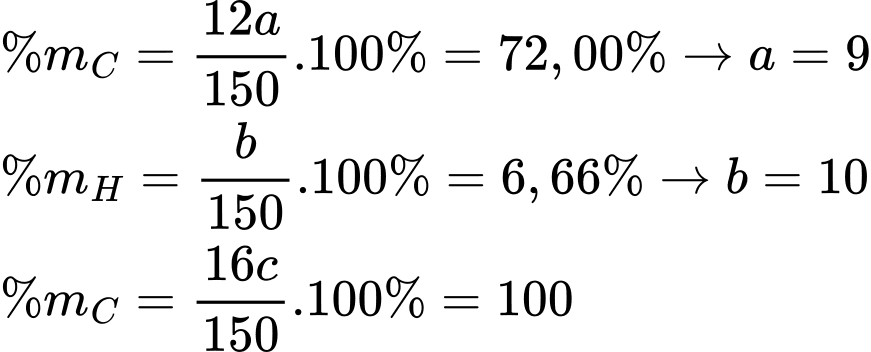
Công thức phân tử của X là C9H10O2
Mà phổ hồng ngoại của X có tín hiệu hấp thụ ở 1716 cm-1 → X có chứa nhóm C=O.
Thủy phân X bằng NaOH thu được benzyl alcohol (C6H5CH2OH) → X là ester đơn chức
Công thức cấu tạo của X là

⇒ Chọn đáp án B Đáp án: B
Từ phổ MS phân tử khối của X là 150 gam/mol
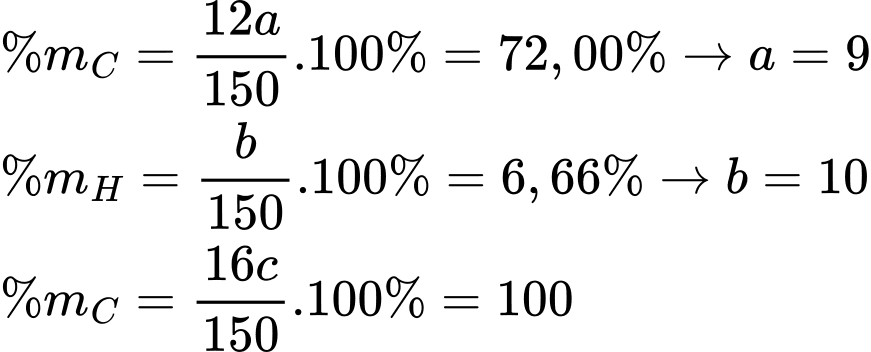
Công thức phân tử của X là C9H10O2
Mà phổ hồng ngoại của X có tín hiệu hấp thụ ở 1716 cm-1 → X có chứa nhóm C=O.
Thủy phân X bằng NaOH thu được benzyl alcohol (C6H5CH2OH) → X là ester đơn chức
Công thức cấu tạo của X là

⇒ Chọn đáp án B Đáp án: B
Câu 16 [705712]: Thuộc da là quá trình mà da động vật được chuyển hoá thành da thuộc với những đặc tính ưu việt hơn như chịu nhiệt độ cao, không thối rữa khi tiếp xúc với nước và các môi trường khác. Quá trình thuộc da xử lí với HCHO là phản ứng tăng mạch carbon của protein dưới tác dụng của HCHO tạo sản phẩm có cấu trúc không gian.
Cho các phát biểu sau:
(a) Polymer khâu mạch khó nóng chảy và khó hoà tan hơn polymer chưa khâu mạch.
(b) Ở phản ứng khâu mạch carbon, các mạch polymer nối lại với nhau tạo mạng không gian nên bền hơn.
(c) Phản ứng xảy ra ở trên thuộc loại phản ứng trùng ngưng.
(d) Khi đun nóng da động vật trong dung dịch NaOH, sẽ xảy ra phản ứng depolymer hoá.
Số phát biểu đúng là
Cho các phát biểu sau:
(a) Polymer khâu mạch khó nóng chảy và khó hoà tan hơn polymer chưa khâu mạch.
(b) Ở phản ứng khâu mạch carbon, các mạch polymer nối lại với nhau tạo mạng không gian nên bền hơn.
(c) Phản ứng xảy ra ở trên thuộc loại phản ứng trùng ngưng.
(d) Khi đun nóng da động vật trong dung dịch NaOH, sẽ xảy ra phản ứng depolymer hoá.
Số phát biểu đúng là
A, 1
B, 2
C, 3
D, 4
Phân tích các phát biểu:
✔️ (a) Đúng. Polymer khâu mạch khó nóng chảy và khó hòa tan hơn polymer chưa khâu mạch nguyên do có sự tăng mạch carbon giúp tăng độ bền của polymer.
✔️ (b) Đúng. Ở phản ứng khâu mạch carbon, các mạch polymer nối lại với nhau tạo mạng không gian nên bền hơn.
❌ (c) Sai. Phản ứng xảy ra ở trên thuộc loại phản ứng tăng mạch carbon.
✔️ (d) Đúng. Khi đun nóng da động vật trong dung dịch NaOH, sẽ xảy ra phản ứng depolymer hóa. Do da động vật có thành phần chính là protein nên sẽ phản ứng depolymer hóa khi phản ứng với NaOH.
Các phát biểu đúng là (a) (b) và (d)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Polymer khâu mạch khó nóng chảy và khó hòa tan hơn polymer chưa khâu mạch nguyên do có sự tăng mạch carbon giúp tăng độ bền của polymer.
✔️ (b) Đúng. Ở phản ứng khâu mạch carbon, các mạch polymer nối lại với nhau tạo mạng không gian nên bền hơn.
❌ (c) Sai. Phản ứng xảy ra ở trên thuộc loại phản ứng tăng mạch carbon.
✔️ (d) Đúng. Khi đun nóng da động vật trong dung dịch NaOH, sẽ xảy ra phản ứng depolymer hóa. Do da động vật có thành phần chính là protein nên sẽ phản ứng depolymer hóa khi phản ứng với NaOH.
Các phát biểu đúng là (a) (b) và (d)
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Tách kẽm từ quặng zinc blende được thực hiện theo quy trình:
Đốt quặng zinc blende: 2ZnS(s) + 3O2(g) –to⟶ 2ZnO(s) + 2SO2(g).
Khử zinc oxide ở nhiệt độ cao bằng than cốc: ZnO(s) + C(s) –to⟶ Zn(g) + CO(g).
Đốt quặng zinc blende: 2ZnS(s) + 3O2(g) –to⟶ 2ZnO(s) + 2SO2(g).
Khử zinc oxide ở nhiệt độ cao bằng than cốc: ZnO(s) + C(s) –to⟶ Zn(g) + CO(g).
Câu 17 [705713]: Phương pháp điều chế kim loại nào đã được sử dụng trong quá tình sản xuất Zn theo sơ đồ trên?
A, Thủy luyện.
B, Nhiệt luyện.
C, Điện phân.
D, Chiết.
Phản ứng 1: Đốt quặng zinc blende (ZnS) để chuyển thành ZnO.
Phản ứng 2: Khử ZnO bằng than cốc (C) ở nhiệt độ cao để thu được Zn kim loại.
👉 Đây là phương pháp nhiệt luyện (dùng nhiệt và chất khử C để khử oxide kim loại thành kim loại).
⇒ Chọn đáp án B Đáp án: B
Phản ứng 2: Khử ZnO bằng than cốc (C) ở nhiệt độ cao để thu được Zn kim loại.
👉 Đây là phương pháp nhiệt luyện (dùng nhiệt và chất khử C để khử oxide kim loại thành kim loại).
⇒ Chọn đáp án B Đáp án: B
Câu 18 [705714]: Phát biểu nào sau đây đúng?
A, ZnO đóng vai trò là chất khử trong phản ứng hoá học trên.
B, Phản ứng xảy ra ở nhiệt độ rất cao, tạo ra kẽm ở dạng hơi.
C, O2 được thêm vào để làm giảm nồng độ CO giúp cân bằng dịch chuyển sang chiều thuận.
D, Phương pháp này còn được dùng để tách kim loại Al khỏi hợp chất Al2O3.
Phân tích các phát biểu:
❌ A. Sai, ZnO bị khử thành Zn, nên nó là chất bị khử, còn C là chất khử (C bị oxi hóa thành CO).
✅ B. Đúng, kẽm có nhiệt độ sôi 907 oC, còn phản ứng khử ZnO bằng C thường xảy ra ở trên 1000 oC, khiến kẽm bay hơi và phải ngưng tụ lại để thu hồi.
❌ C. Sai,O2 không tham gia vào phản ứng khử ZnO bằng C. Thêm O2 có thể gây phản ứng cháy với C tạo CO2, không có lợi cho quá trình điều chế Zn.
❌ D. Sai. Phương pháp trên không thể điều chế kim loại nhôm từ hợp chất Al2O3. Nhôm được điều chế từ aluminium oxide bằng phương pháp điện nóng chảy.
⇒ Chọn đáp án B Đáp án: B
❌ A. Sai, ZnO bị khử thành Zn, nên nó là chất bị khử, còn C là chất khử (C bị oxi hóa thành CO).
✅ B. Đúng, kẽm có nhiệt độ sôi 907 oC, còn phản ứng khử ZnO bằng C thường xảy ra ở trên 1000 oC, khiến kẽm bay hơi và phải ngưng tụ lại để thu hồi.
❌ C. Sai,O2 không tham gia vào phản ứng khử ZnO bằng C. Thêm O2 có thể gây phản ứng cháy với C tạo CO2, không có lợi cho quá trình điều chế Zn.
❌ D. Sai. Phương pháp trên không thể điều chế kim loại nhôm từ hợp chất Al2O3. Nhôm được điều chế từ aluminium oxide bằng phương pháp điện nóng chảy.
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705715]: Quá trình nấu rượu gạo thủ công được thực hiện như sau:
➊ Gạo được nấu chín, để nguội, rắc men, ủ kín 3-5 ngày, thu được một hỗn hợp gồm nước, ethanol và bã rượu.
➋ Đun nóng hỗn hợp trên đến nhiệt độ sôi, hơi bay ra đi vào đường ống dẫn. Hỗn hợp hơi trong đường ống được làm lạnh sẽ hoá lỏng và chảy vào bình hứng.
Quá trình này gọi là chưng cất rượu. Biết nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC.
➊ Gạo được nấu chín, để nguội, rắc men, ủ kín 3-5 ngày, thu được một hỗn hợp gồm nước, ethanol và bã rượu.
➋ Đun nóng hỗn hợp trên đến nhiệt độ sôi, hơi bay ra đi vào đường ống dẫn. Hỗn hợp hơi trong đường ống được làm lạnh sẽ hoá lỏng và chảy vào bình hứng.
Quá trình này gọi là chưng cất rượu. Biết nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC.
Phân tích các phát biểu:
✔️ (a) Đúng. Ở giai đoạn đầu xảy ra sự chuyển hoá tinh bột thành ethanol.
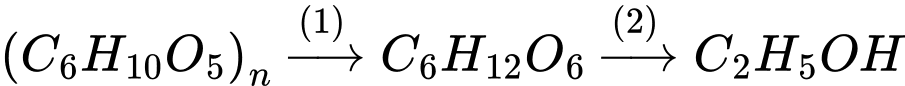
(b) Sai. Nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC nên để chưng cất rượu cần nhiệt độ trong khoảng từ 78 oC đến 100 oC, nếu nhiệt độ lớn hơn 100 oC thì quá trình chưng cất sẽ kèm theo hơi nước không thu được rượu nguyên chất.
✔️ (c) Đúng. Trong quá trình chưng cất, hơi ethanol và hơi nước bay ra theo đường ống. Khi đi qua thùng nước lạnh (bình ngưng tụ), hơi bị làm lạnh và ngưng tụ thành chất lỏng chảy vào bình hứng. Vì vậy, thùng nước lạnh có vai trò chuyển pha từ hơi sang pha lỏng. .
✔️ (d) Đúng. Ban đầu, hỗn hợp chứa nhiều ethanol hơn nước do ethanol bay hơi ở nhiệt độ thấp hơn. Khi chưng cất, ethanol dần thoát ra trước, làm tỉ lệ ethanol/nước trong phần còn lại giảm dần. Sau một thời gian, khi phần ethanol đã gần hết, phần còn lại chủ yếu là nước, và tỉ lệ này không đổi nữa.
✔️ (a) Đúng. Ở giai đoạn đầu xảy ra sự chuyển hoá tinh bột thành ethanol.
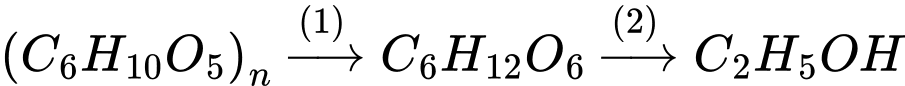
(b) Sai. Nhiệt độ sôi của ethanol và nước lần lượt là 78 oC và 100 oC nên để chưng cất rượu cần nhiệt độ trong khoảng từ 78 oC đến 100 oC, nếu nhiệt độ lớn hơn 100 oC thì quá trình chưng cất sẽ kèm theo hơi nước không thu được rượu nguyên chất.
✔️ (c) Đúng. Trong quá trình chưng cất, hơi ethanol và hơi nước bay ra theo đường ống. Khi đi qua thùng nước lạnh (bình ngưng tụ), hơi bị làm lạnh và ngưng tụ thành chất lỏng chảy vào bình hứng. Vì vậy, thùng nước lạnh có vai trò chuyển pha từ hơi sang pha lỏng. .
✔️ (d) Đúng. Ban đầu, hỗn hợp chứa nhiều ethanol hơn nước do ethanol bay hơi ở nhiệt độ thấp hơn. Khi chưng cất, ethanol dần thoát ra trước, làm tỉ lệ ethanol/nước trong phần còn lại giảm dần. Sau một thời gian, khi phần ethanol đã gần hết, phần còn lại chủ yếu là nước, và tỉ lệ này không đổi nữa.
Câu 20 [705716]: Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pl của các chất sau:
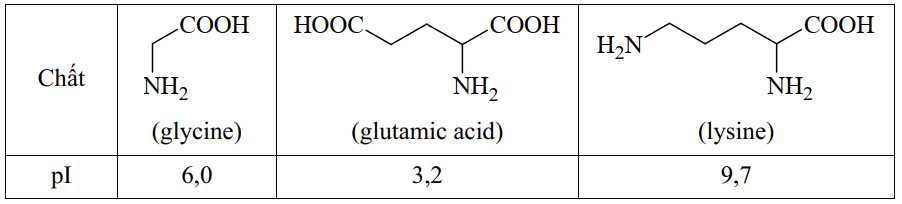

Phân tích các phát biểu:
✔️ (a) Đúng. Ở pH thấp, amino acid tồn tại chủ yếu dưới dạng cation; ngược lại pH cao, hợp chất này tồn tại chủ yếu dưới dạng anion. pH thay đổi làm cho amino acid tích điện khác nhau và có khả năng dịch chuyển về các hướng khác nhau dưới tác dụng của điện trường. Tính chất này được gọi là tính điện di của amino acid.
✔️ (b) Đúng. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion.
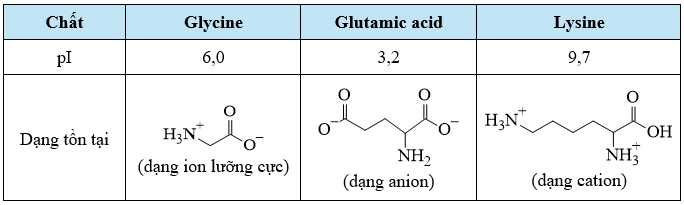
Trong điện trường glycine (dạng ion lưỡng cực) hầu như không di chuyển trong điện trường, glutamic acid (dạng anion) di chuyển sang cực dương, lysine (dạng cation) di chuyển sang cực âm.
❌ (c) Sai. Tại pH = 4 dạng tồn tại của glycine và glutamic acid là:
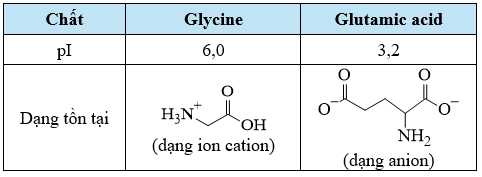
Trong điện trường glycine (dạng cation) di chuyển sang cực âm, glutamic acid (dạng anion) di chuyển sang cực dương.
❌ (d) Sai. Tại pH = 7 > pI = 6 dạng tồn tại của glycine là dạng anion nên sẽ di chuyển sang cực dương trong điện trường.
✔️ (a) Đúng. Ở pH thấp, amino acid tồn tại chủ yếu dưới dạng cation; ngược lại pH cao, hợp chất này tồn tại chủ yếu dưới dạng anion. pH thay đổi làm cho amino acid tích điện khác nhau và có khả năng dịch chuyển về các hướng khác nhau dưới tác dụng của điện trường. Tính chất này được gọi là tính điện di của amino acid.
✔️ (b) Đúng. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion.

Trong điện trường glycine (dạng ion lưỡng cực) hầu như không di chuyển trong điện trường, glutamic acid (dạng anion) di chuyển sang cực dương, lysine (dạng cation) di chuyển sang cực âm.
❌ (c) Sai. Tại pH = 4 dạng tồn tại của glycine và glutamic acid là:

Trong điện trường glycine (dạng cation) di chuyển sang cực âm, glutamic acid (dạng anion) di chuyển sang cực dương.
❌ (d) Sai. Tại pH = 7 > pI = 6 dạng tồn tại của glycine là dạng anion nên sẽ di chuyển sang cực dương trong điện trường.
Câu 21 [705717]: Một bạn học sinh tiến hành thí nghiệm như sau:
∎ Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3, lắc đều.
∎ Bước 2: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều.
∎ Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3, lắc đều.
∎ Bước 2: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều.
Các phản ứng xảy ra như sau:
Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3, lắc đều.
Dung dịch đục dần xuất hiện kết tủa màu trắng.
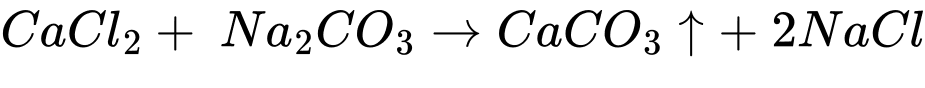
Bước 2: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCI, lắc đều.
Kết tủa tan dần xuất hiện khí không màu thoát ra khỏi dung dịch
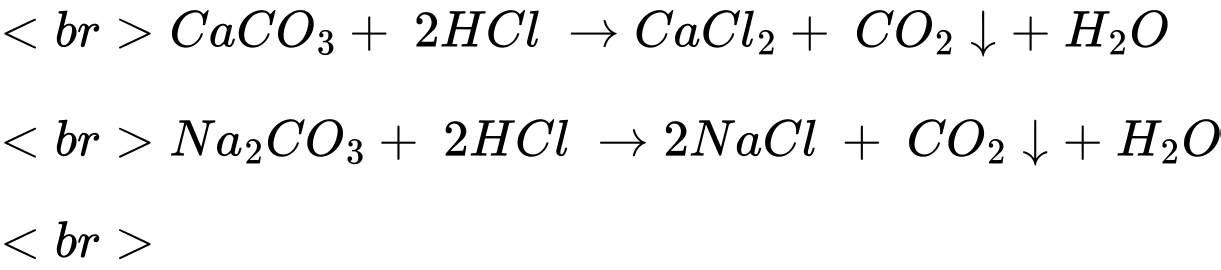
Phân tích các phát biểu:
✔️ (a) Đúng. Sau bước 1 xuất hiện CaCO3 kết tủa trắng.
✔️ (b) Đúng. Kết tủa CaCO3 không bền trong môi trường acid H+, tan tạo CO2 và nước.
✔️ (c) Đúng. Khi cho acid HCl ở bước 2 thì kết tủa tan dần, có xuất hiện bọt khí do phản ứng sinh ra khí CO2.
✔️ (d) Đúng. Sự có mặt của ion Ca2+ trong dung dịch có thể nhận biết bằng dung dịch chứa ion CO32- xuất hiện kết tủa trắng.
Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3, lắc đều.
Dung dịch đục dần xuất hiện kết tủa màu trắng.
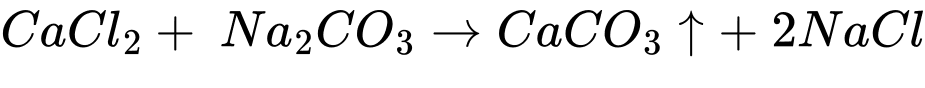
Bước 2: Tiếp tục thêm vào khoảng 10 giọt dung dịch HCI, lắc đều.
Kết tủa tan dần xuất hiện khí không màu thoát ra khỏi dung dịch
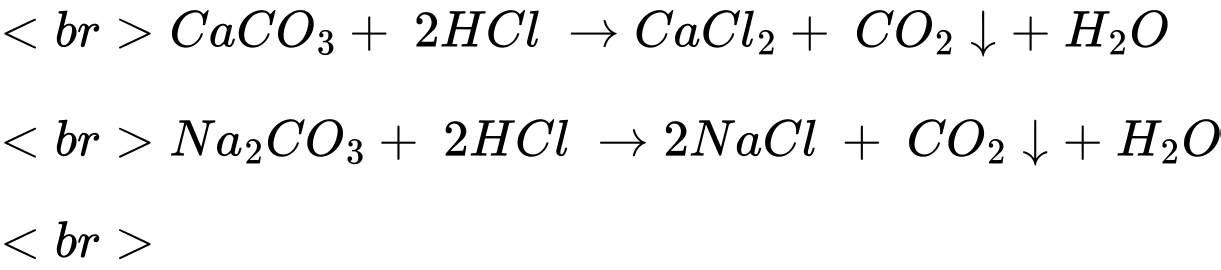
Phân tích các phát biểu:
✔️ (a) Đúng. Sau bước 1 xuất hiện CaCO3 kết tủa trắng.
✔️ (b) Đúng. Kết tủa CaCO3 không bền trong môi trường acid H+, tan tạo CO2 và nước.
✔️ (c) Đúng. Khi cho acid HCl ở bước 2 thì kết tủa tan dần, có xuất hiện bọt khí do phản ứng sinh ra khí CO2.
✔️ (d) Đúng. Sự có mặt của ion Ca2+ trong dung dịch có thể nhận biết bằng dung dịch chứa ion CO32- xuất hiện kết tủa trắng.
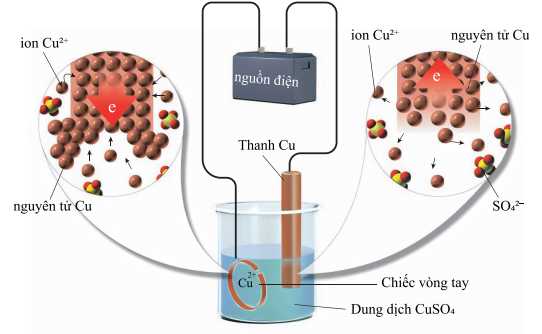
Câu 22 [705718]: Một nhóm học sinh tiến hành mạ một lớp kim loại đồng lên chiếc vòng tay. Giả thuyết được một bạn học sinh đưa ra là: “Nồng độ CuSO4 trong dung dịch trước và sau quá trình mạ đều không thay đổi”. Để kiểm chứng giả thuyết, nhóm học sinh tiến hành quá trình mạ theo sơ đồ được thiết lập như hình bên dưới:
- Cân để xác định khối lượng ban đầu của chiếc vòng là 5,00 gam và thanh đồng là 12,50 gam.
- Nối chiếc vòng với một điện cực và thanh đồng với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch CuSO4 1,00 M.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của chiếc vòng và thanh đồng, thấy khối lượng chiếc vòng là 5,64 gam và khối lượng thanh đồng là 11,86 gam.
- Cân để xác định khối lượng ban đầu của chiếc vòng là 5,00 gam và thanh đồng là 12,50 gam.
- Nối chiếc vòng với một điện cực và thanh đồng với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch CuSO4 1,00 M.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của chiếc vòng và thanh đồng, thấy khối lượng chiếc vòng là 5,64 gam và khối lượng thanh đồng là 11,86 gam.

Phân tích các phát biểu:
✔️ (a) Đúng. Trong quá trình mạ điện, vật cần mạ được gắn với cực âm cathode, kim loại mạ gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
✔️ (b) Đúng. Cực dương của nguồn điện sẽ hút các electron trong quá trình oxi hóa và giải phóng các ion kim loại dương, dưới tác dụng lực tĩnh điện các ion dương này sẽ di chuyển về cực âm, tại đây chúng nhận lại electron trong quá trình oxi hóa khử hình thành lớp kim loại bám trên bề mặt của vật được mạ.
✔️ (c) Đúng. Khối lượng chiếc vòng tăng lên 5,64 – 5 = 0,64 gam; khối lượng thanh đồng giảm 12,5 – 11,86 = 0,64 gam.
✔️ (d) Đúng. CuSO4 đóng vai trò xúc tác, tạo ion Cu2+ nên sau phản ứng sinh ra ion Cu2+ trả lại, khối lượng của chiếc vòng sau quá trình mạ vẫn không đổi.
✔️ (a) Đúng. Trong quá trình mạ điện, vật cần mạ được gắn với cực âm cathode, kim loại mạ gắn với cực dương anode của nguồn điện trong dung dịch điện phân.
✔️ (b) Đúng. Cực dương của nguồn điện sẽ hút các electron trong quá trình oxi hóa và giải phóng các ion kim loại dương, dưới tác dụng lực tĩnh điện các ion dương này sẽ di chuyển về cực âm, tại đây chúng nhận lại electron trong quá trình oxi hóa khử hình thành lớp kim loại bám trên bề mặt của vật được mạ.
✔️ (c) Đúng. Khối lượng chiếc vòng tăng lên 5,64 – 5 = 0,64 gam; khối lượng thanh đồng giảm 12,5 – 11,86 = 0,64 gam.
✔️ (d) Đúng. CuSO4 đóng vai trò xúc tác, tạo ion Cu2+ nên sau phản ứng sinh ra ion Cu2+ trả lại, khối lượng của chiếc vòng sau quá trình mạ vẫn không đổi.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705719]: Phức chất [Co(NH3)5Clx]y– có dạng hình học bát diện, nguyên tử trung tâm là Co3+. Tổng giá trị của x và y là bao nhiêu?
Phức chất [Co(NH3)5Clx]y– có dạng hình học bát diện nên có dạng tổng quát là [ML6]
→ 5 + x = 6 → x = 1
Phức chất [Co(NH3)5Clx]y– có ion trung tâm Co3+ với NH3 là phối tử trung hòa và 1 ion Cl– là phối tử
→ y = 2
Tổng giá trị của x + y = 1 + 2 = 3
⇒ Điền đáp án: 3
→ 5 + x = 6 → x = 1
Phức chất [Co(NH3)5Clx]y– có ion trung tâm Co3+ với NH3 là phối tử trung hòa và 1 ion Cl– là phối tử
→ y = 2
Tổng giá trị của x + y = 1 + 2 = 3
⇒ Điền đáp án: 3
Câu 24 [308749]: Cho sơ đồ chuyển hóa sau:
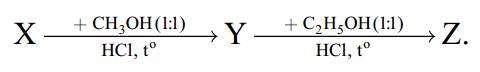
Biết X là glutamic acid, Y, Z, T là các chất hữu cơ chứa nitrogen. Số nguyên tử hydrogen trong phân tử Z là bao nhiêu?
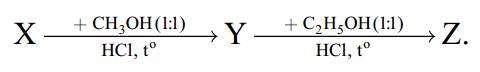
Biết X là glutamic acid, Y, Z, T là các chất hữu cơ chứa nitrogen. Số nguyên tử hydrogen trong phân tử Z là bao nhiêu?
Các phản ứng xảy ra:
H2NC3H5(COOH)2 (X) + CH3OH + HCl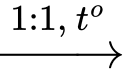 ClH3NC3H5(COOCH3)(COOH) (Y) + H2O
ClH3NC3H5(COOCH3)(COOH) (Y) + H2O
ClH3NC3H5(COOCH3)(COOH) (Y) + C2H5OH + HCl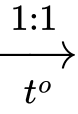 ClH3NC3H5(COOCH3)(COOC2H5) (Z) + H2O
ClH3NC3H5(COOCH3)(COOC2H5) (Z) + H2O
→ Số nguyên tử hydrogen trong phân tử Z là 16.
⇒ Điền đáp án: 16
H2NC3H5(COOH)2 (X) + CH3OH + HCl
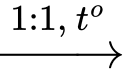 ClH3NC3H5(COOCH3)(COOH) (Y) + H2O
ClH3NC3H5(COOCH3)(COOH) (Y) + H2OClH3NC3H5(COOCH3)(COOH) (Y) + C2H5OH + HCl
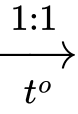 ClH3NC3H5(COOCH3)(COOC2H5) (Z) + H2O
ClH3NC3H5(COOCH3)(COOC2H5) (Z) + H2O→ Số nguyên tử hydrogen trong phân tử Z là 16.
⇒ Điền đáp án: 16
Câu 25 [705721]: Methyl amine là một amine có mùi tanh, được ứng dụng nhiều trong dược phẩm, thuốc trừ sâu,…. Quan sát phổ IR của methyl amine, cho biết tín hiệu đặc trưng của methyl amine có thể thấy ở số sóng bao nhiêu cm-1?
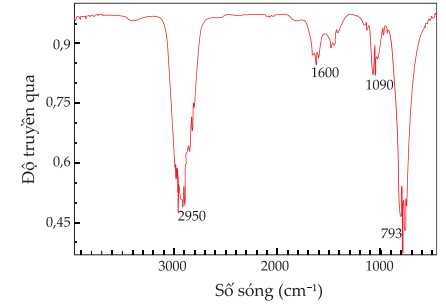

CH3NH2 là amine có nên liên kết hấp thụ N–H có số sóng hấp thụ đặc trưng là 2950 cm–1.
⇒ Điền đáp án: 2950
⇒ Điền đáp án: 2950
Câu 26 [705722]: Khái niệm chlorine hoạt động được hiểu ngoài Cl2 phân tử còn bao gồm chlorine oxide, chloramine, hypochlorite, chlorite. Người ta tiến hành phân tích mẫu đất gần nhà máy.
∎ Bước 1: 20 gam đất khô lắc đều 5 phút trong nước cất với tốc độc 160 vòng/phút tạo thành 100 mL dung dịch. Để yên 30 phút rồi lọc, thêm 1 gam tinh thể KNO3 vào dung dịch để chống đục (giả sử thể tích dung dịch không thay đổi).
∎ Bước 2: Lấy 25 ml dung dịch + 1 ml dung dịch K2CrO4 10% rồi tiến hành chuẩn độ bằng AgNO3 0,01 M. Lúc đầu thấy xuất hiện kết tủa trắng. Sau đó chuẩn độ đến xuất hiện kết tủa đỏ gạch thì dừng chuẩn độ, thấy hết 4,6 mL dung dịch AgNO3. Hàm lượng phần trăm của ion Cl– trong mẫu đất là a×10–2 %. Xác định giá trị của a (Làm tròn đến hàng phần trăm).
∎ Bước 1: 20 gam đất khô lắc đều 5 phút trong nước cất với tốc độc 160 vòng/phút tạo thành 100 mL dung dịch. Để yên 30 phút rồi lọc, thêm 1 gam tinh thể KNO3 vào dung dịch để chống đục (giả sử thể tích dung dịch không thay đổi).
∎ Bước 2: Lấy 25 ml dung dịch + 1 ml dung dịch K2CrO4 10% rồi tiến hành chuẩn độ bằng AgNO3 0,01 M. Lúc đầu thấy xuất hiện kết tủa trắng. Sau đó chuẩn độ đến xuất hiện kết tủa đỏ gạch thì dừng chuẩn độ, thấy hết 4,6 mL dung dịch AgNO3. Hàm lượng phần trăm của ion Cl– trong mẫu đất là a×10–2 %. Xác định giá trị của a (Làm tròn đến hàng phần trăm).
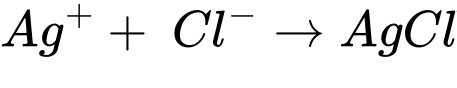
Đổi 4,6 mL = 0,0046 L
Số mol của AgNO3 là nAgNO3 = 0,0046.0,01 = 4,6.10-5 mol
Số mol của Cl- trong mẫu đất là
Hàm lượng của ion Cl- trong mẫu đất là:
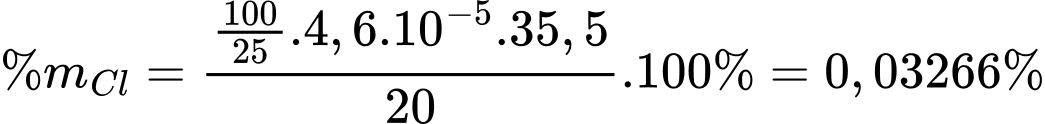
Ta có:
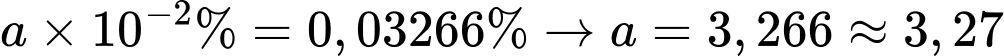
⇒ Điền đáp án: 3,27
Câu 27 [705723]: Cho dãy các chất sau: acetic acid, ethyl acetate, isopropylamine, glucose, acetone. Trong số các chất trên, có bao nhiêu tác dụng với Cu(OH)2 ở điều kiện thường?
Các chất tác dụng với Cu(OH)2 ở điều kiện thường là acetic acid, isopropylamine, glucose.
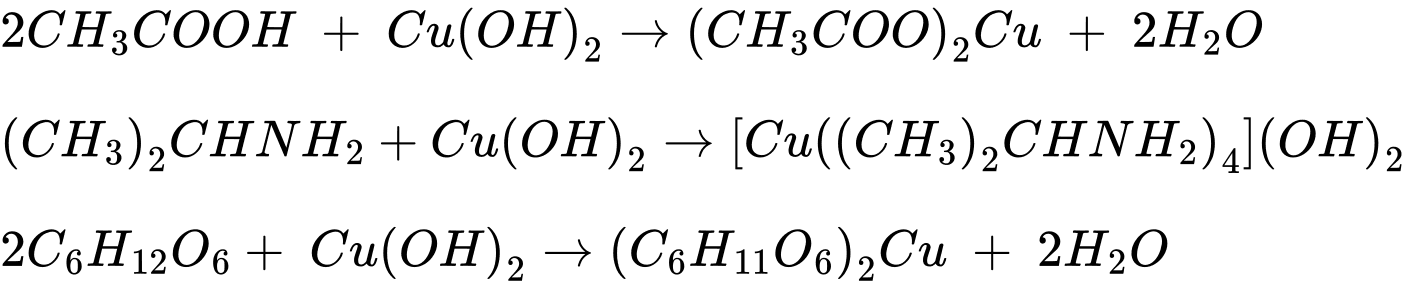
⇒ Điền đáp án: 3
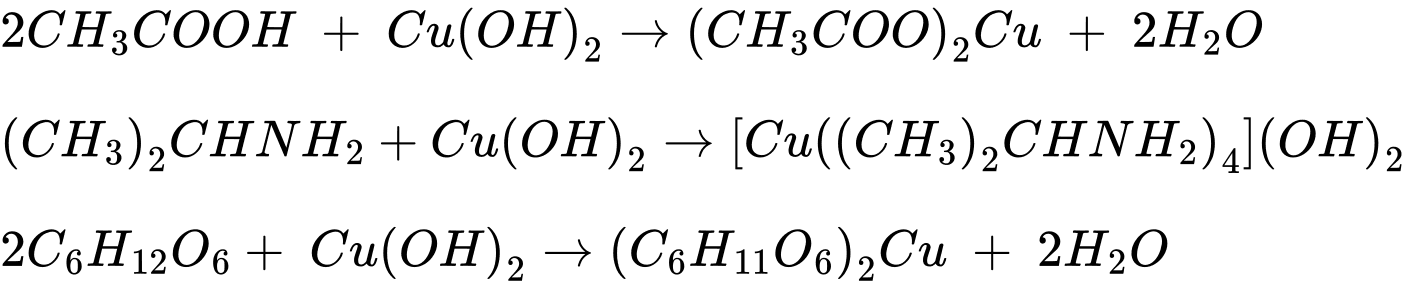
⇒ Điền đáp án: 3
Câu 28 [705724]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Pin nhiên liệu sử dụng tế bào nhiên liệu với nguyên liệu là khí hydrogen để chuyển hoá năng lượng thành điện năng:
Anode (+): 2H2 + 4OH– → 4H2O + 4e
Cathode (–): O2 + 4e + 2H2O → 4OH–
Một máy điện sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng).
Lượng khí hydrogen được điều chế từ khí thiên nhiên theo các quy trình sau: CH4 + H2O → CO + 3H2
CO + H2O → CO2 + H2
Mỗi ngày nhà máy sản xuất được 500 kWh. Tính khối lượng (theo kg) khí thiên nhiên tiêu thụ mỗi ngày? Cho biết: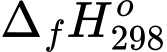 H2O(l) = –285,84 kJ/mol, 1kWh = 3,6.106 J. Khí thiên nhiên đã sử dụng chứa 100% CH4 và hiệu suất điều chế hydrogen là 90%.
H2O(l) = –285,84 kJ/mol, 1kWh = 3,6.106 J. Khí thiên nhiên đã sử dụng chứa 100% CH4 và hiệu suất điều chế hydrogen là 90%.
Anode (+): 2H2 + 4OH– → 4H2O + 4e
Cathode (–): O2 + 4e + 2H2O → 4OH–
Một máy điện sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng).
Lượng khí hydrogen được điều chế từ khí thiên nhiên theo các quy trình sau: CH4 + H2O → CO + 3H2
CO + H2O → CO2 + H2
Mỗi ngày nhà máy sản xuất được 500 kWh. Tính khối lượng (theo kg) khí thiên nhiên tiêu thụ mỗi ngày? Cho biết:
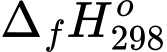 H2O(l) = –285,84 kJ/mol, 1kWh = 3,6.106 J. Khí thiên nhiên đã sử dụng chứa 100% CH4 và hiệu suất điều chế hydrogen là 90%.
H2O(l) = –285,84 kJ/mol, 1kWh = 3,6.106 J. Khí thiên nhiên đã sử dụng chứa 100% CH4 và hiệu suất điều chế hydrogen là 90%.
Nhà máy sản xuất 500 kWh điện mỗi ngày:
1 kWh = 3,6 × 106 J nên tổng năng lượng cần thiết là: 500 × 3,6 × 106 = 1,8 × 109 J
Vì hiệu suất chuyển hóa là 60%, năng lượng do phản ứng cung cấp thực tế là: (1,8 × 109) ÷ 0,6 = 3,0 × 109 J
Phương trình phản ứng ở pin nhiên liệu:
2H2 + 4OH− → 4H2O + 4e
O2 + 4e + 2H2O → 4OH−
Tổng phản ứng: H2 + 1/2O2 → H2O
Mỗi mol H2 sinh ra năng lượng: ∆H = −285,84 kJ/mol H2 = −285,84 × 103 J/mol H2
Số mol H2 cần thiết là: (3,0 × 109) ÷ (285,84 × 103) ≈ 10495,6 mol
Quá trình điều chế H2 từ CH4:
CH4 + H2O → CO + 3H2
CO + H2O → CO2 + H2
1 mol CH4 tạo ra 4 mol H2 nên số mol CH4 lý thuyết cần thiết để tạo 10495,6 mol H2 là: [10495,6 × 4a × 90% × 60% × 1000 ] : 3,6×106 = 500
→ a = 2915,4 mol
→ Khối lượng CH4 tiêu thụ mỗi ngày là: 2915,4 × 16 = 46646,4 g = 46,6 kg.
⇒ Điền đáp án: 46,6
1 kWh = 3,6 × 106 J nên tổng năng lượng cần thiết là: 500 × 3,6 × 106 = 1,8 × 109 J
Vì hiệu suất chuyển hóa là 60%, năng lượng do phản ứng cung cấp thực tế là: (1,8 × 109) ÷ 0,6 = 3,0 × 109 J
Phương trình phản ứng ở pin nhiên liệu:
2H2 + 4OH− → 4H2O + 4e
O2 + 4e + 2H2O → 4OH−
Tổng phản ứng: H2 + 1/2O2 → H2O
Mỗi mol H2 sinh ra năng lượng: ∆H = −285,84 kJ/mol H2 = −285,84 × 103 J/mol H2
Số mol H2 cần thiết là: (3,0 × 109) ÷ (285,84 × 103) ≈ 10495,6 mol
Quá trình điều chế H2 từ CH4:
CH4 + H2O → CO + 3H2
CO + H2O → CO2 + H2
1 mol CH4 tạo ra 4 mol H2 nên số mol CH4 lý thuyết cần thiết để tạo 10495,6 mol H2 là: [10495,6 × 4a × 90% × 60% × 1000 ] : 3,6×106 = 500
→ a = 2915,4 mol
→ Khối lượng CH4 tiêu thụ mỗi ngày là: 2915,4 × 16 = 46646,4 g = 46,6 kg.
⇒ Điền đáp án: 46,6