PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Giải thích:
- Kim loại kiềm có bán kính nguyên tử lớn so với nhiều kim loại khác, dẫn đến mật độ nguyên tử trong một đơn vị thể tích nhỏ hơn.
- Kim loại kiềm có cấu trúc mạng tinh thể lập phương tâm khối, không đặc khít bằng các mạng lập phương tâm diện hay lục phương của nhiều kim loại khác như Fe, Cu, Al. Do đó, khoảng cách giữa các nguyên tử trong tinh thể lớn, khiến khối lượng riêng của chúng thấp hơn.
⇒ Chọn đáp án A
Đáp án: A
⇒ Chọn đáp án A Đáp án: A
- Chromium có độ cứng rất cao, chỉ đứng sau kim cương.
- Chromium được dùng trong thép không gỉ: Khi thêm vào thép, Cr tạo lớp oxide bảo vệ giúp chống ăn mòn, làm cho hợp kim không gỉ.
- Chromium tăng độ bền cơ học của hợp kim: Được dùng trong các hợp kim như thép không gỉ, hợp kim chịu nhiệt, dụng cụ cắt gọt.
⇒ Chọn đáp án A Đáp án: A
(a) Đun sôi nước cứng tạm thời.
(b) Cho phèn chua vào lượng dư dung dịch barium hydroxide.
(c) Sục khí ammonia dư vào dung dịch silver nitrate.
(d) Cho sodium hydroxide vào dung dịch copper(II) sulfate.
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kết tủa là
✔️ (a) Đun sôi nước cứng tạm thời.
Nước cứng tạm thời chứa Ca(HCO3)2 và Mg(HCO3)2
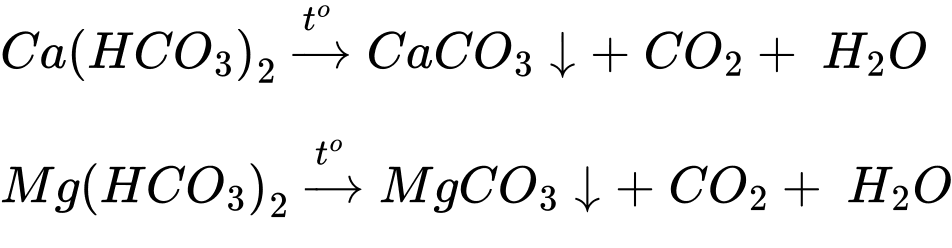
✔️ (b) Cho phèn chua vào lượng dư dung dịch barium hydroxide.
Phèn chua có công thức K2SO4.Al2(SO4)3.24H2O
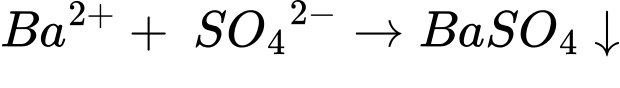
❌ (c) Sục khí ammonia dư vào dung dịch silver nitrate.
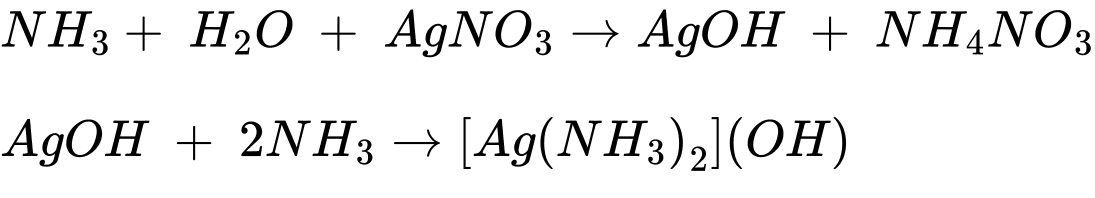
✔️ (d) Cho sodium hydroxide vào dung dịch copper(II) sulfate.
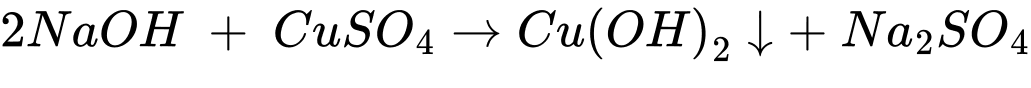
Các phản ứng thu được kết tủa là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
⟶ Oxygen có 6 electron lớp ngoài cùng cần nhận 2 electron đạt octet tạo thành ion O2–:
O + 2e ⟶ O2–
⇒ Chọn đáp án B Đáp án: B
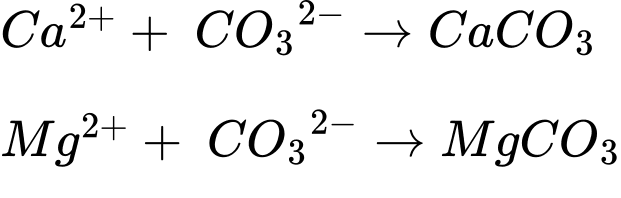
⇒ Chọn đáp án D Đáp án: D
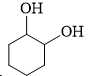
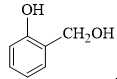
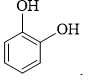
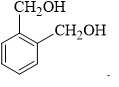
❌ Nhóm –OH alcohol (liên kết với mạch nhánh hoặc vòng không thơm) không phản ứng với NaOH ở điều kiện thường.
Xét điều kiện phản ứng với NaOH của các chất:
❌ A. Chứa 2 nhóm –OH nhưng không phải phenol → Không phản ứng với NaOH.
❌ B. Chứa 1 nhóm –OH phenol và 1 nhóm –CH2OH → Chỉ có 1 nhóm phản ứng với NaOH → Tỉ lệ 1:1.
✔️ C. Chứa 2 nhóm –OH phenol → Cả hai nhóm phản ứng với NaOH theo tỉ lệ 1:2.
❌ D. Chứa 2 nhóm –CH2OH (không phải phenol) → Không phản ứng với NaOH.
⇒ Chọn đáp án C Đáp án: C
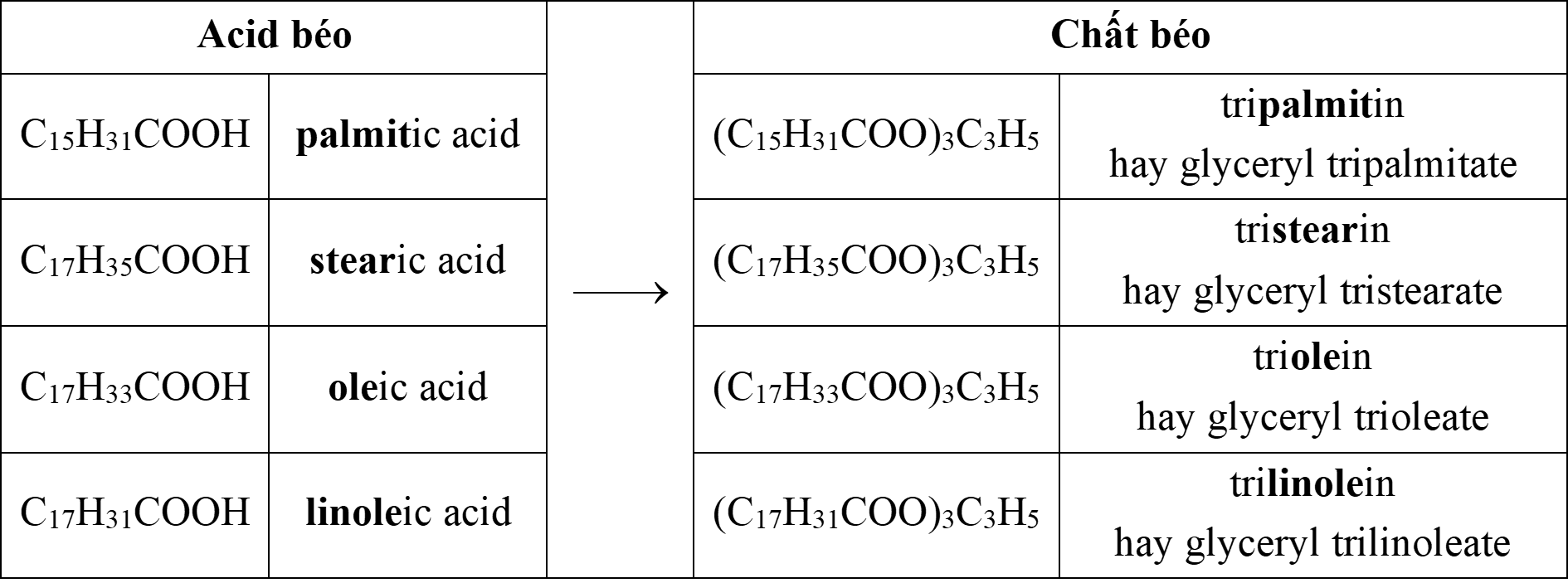
⇒ Xuất hiện trong 4 phương án là palmitic acid.
⇒ Chọn đáp án A Đáp án: A

Chất lỏng có điểm chớp cháy nhỏ hơn 37,8 oC được gọi là chất lỏng dễ cháy. Trong khi các chất lỏng có điểm chớp cháy trên nhiệt độ đó gọi là chất lỏng có thể gây cháy.
Cho các phát biểu sau:
(a) Xăng và ethanol được gọi là chất lỏng dễ cháy.
(b) Dầu hỏa được gọi là chất lỏng có thể gây cháy.
(c) Nguy cơ gây cháy của ethanol cao hơn xăng.
(d) Dưới 160 oC thì dầu diesel sinh học không thể cháy.
Các phát biểu đúng là
✔️ (a) Đúng. Xăng và ethanol có điểm chớp cháy lần lượt là –43 oC và 13 oC đều nhỏ hơn 37,8 oC nên đều là chất dễ cháy.
✔️ (b) Đúng. Dầu hỏa có điểm chớp cháy là 38–72 oC lớn hơn 37,8 oC là chất có thể gây cháy.
❌ (c) Sai. Xăng có điểm chớp cháy là –43 oC nhỏ hơn ethanol có điểm chớp cháy 13 oC nên xăng dễ cháy hơn ethanol
✔️(d) Đúng. Điểm chớp cháy của dầu diesel sinh học là 160 oC nghĩa là dưới 160oC dầu diesel sinh học không tạo đủ hơi để bốc cháy.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án C Đáp án: C
Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa được biểu diễn theo sơ đồ:
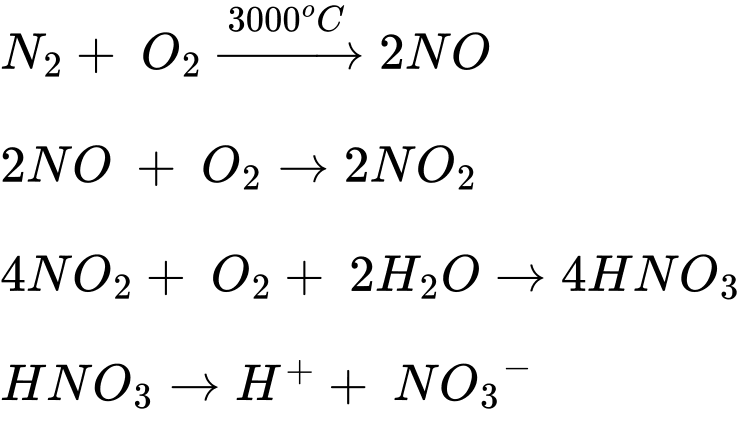
⇒ Chọn đáp án D Đáp án: D
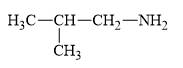
:
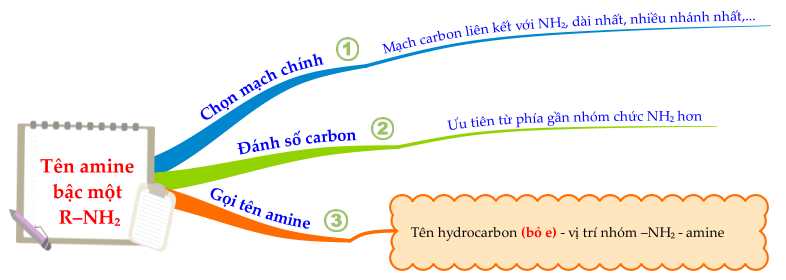
Tên gọi của amine có công thức CH3CH(CH3)CH2NH2 được xác định như sau:
- Nhánh CH3 được gắn ở vị trí carbon số 2 → 2-methyl
- Mạch carbon chính có 3C nên tên mạch chính là propan
- Nhóm NH2 được gắn ở vị trí carbon số 1 → 1-amine
⇒ Tên thay thế của amine trên là: 2-methylpropan-1-amine.
⇒ Chọn đáp án D Đáp án: D
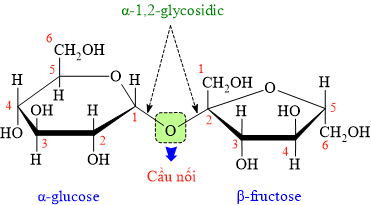
Trên mỗi mắt xích glucose và fructose đều chứa đúng 4 nhóm OH ⇒ tổng có 8 nhóm
⇒ Chọn đáp án B Đáp án: B
∎ Dung dịch chất điện li là dung dịch CuSO4.
∎ Cực dương làm bằng tấm đồng có độ tinh khiết thấp.
∎ Cực âm làm bằng tấm đồng có độ tinh khiết cao.
Nhận định nào sau đây không đúng?
✔️ A. Đúng. Ở cực dương (anode): Đồng có độ tinh khiết thấp bị oxi hóa thành Cu2+, đi vào dung dịch:
Cu → Cu2+ + 2e
✔️ B. Đúng. Ở cực âm (cathode): Cu2+ trong dung dịch nhận electron và kết tủa thành đồng tinh khiết:
Cu2+ +2e → Cu
Vì chỉ có Cu2+ bị khử nên đồng thu được có độ tinh khiết cao.
✔️ C. Đúng. Số ion Cu2+ bị khử ở cathode đúng bằng số ion Cu2+ sinh ra từ anode. Do đó, nồng độ ion Cu2+ trong dung dịch không đổi.
❌ D. Sai. Nếu thay dung dịch CuSO4 bằng AgNO3 thì:
Anode (đồng) sẽ bị oxi hóa thành Cu2+, không phải Ag+.
Cathode sẽ thu được bạc (Ag), không phải đồng tinh khiết).
⟶ Quá trình này không còn là tinh luyện đồng nữa.
⇒ Chọn đáp án D Đáp án: D
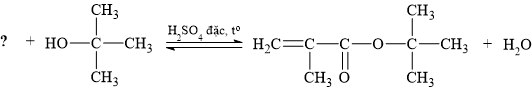
Carboxylic acid cần thiết để hoàn thành phản ứng điều chế ester trên có tên gọi là
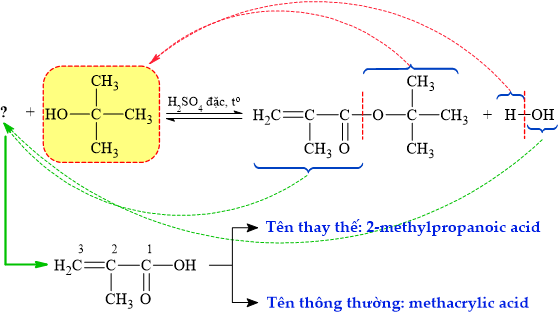
⇒ Carboxylic acid cần thiết để hoàn thành phản ứng điều chế ester là methacrylic acid
⇒ Chọn đáp án C
► Chú ý: CH2=CHCOOH là acrylic acid; có nhóm metyl CH3 đính vào tạo CH2=C(CH3)COOH
⇝ tên gọi thông thường được giản lược là methacrylic acid. Đáp án: C
Giải thích:
– Amino acid có tính lưỡng tính vì trong phân tử chứa cả nhóm –NH2 (base yếu) và –COOH (acid yếu), nên có thể phản ứng với cả acid và base.
– Amino acid chứa nhóm -COOH (carboxylic acid) có thể phản ứng với alcohol (ROH) trong môi trường acid mạnh (H2SO4 đặc) để tạo ester theo phản ứng ester hóa.
⇒ Chọn đáp án C Đáp án: C
I2 + 2Na2S2O3
 2NaI + Na2S4O6
2NaI + Na2S4O6Dung dịch X được sử dụng trong thí nghiệm trên nhằm mục đích chính là
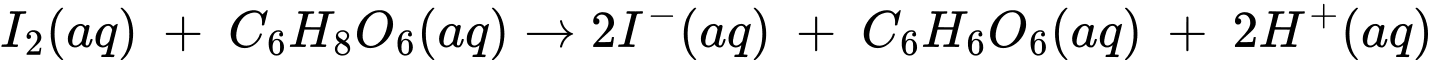
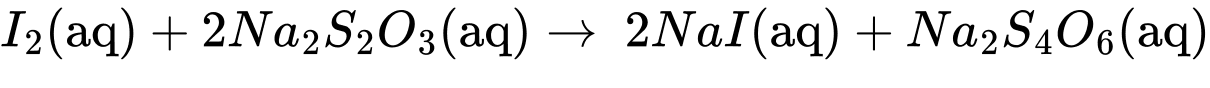
Dung dịch X là hồ tinh bột mục đích nhận biết hàm lượng Iodine dư trong dung dịch sau phản ứng.
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
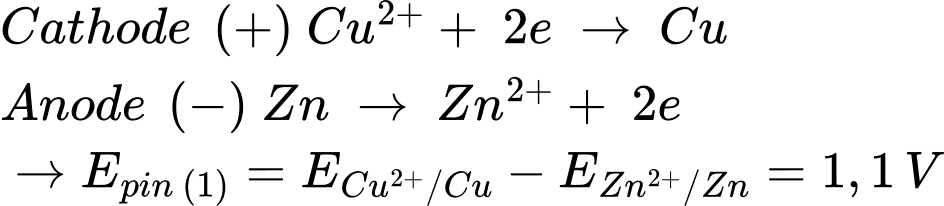
Pin 2: Zn đóng vai trò là cực âm (quá trình oxi hóa) và Ni đóng vai trò là cực dương (quá trình khử)
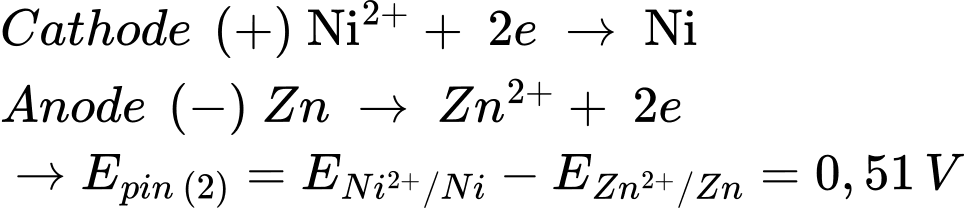
Từ pin 1 và pin 2 → Tính khử của các kim loại giảm dần Zn > Ni > Cu.
Từ pin 1 và pin 2 → Pin 3: Ni đóng vai trò là cực âm và Cu đóng vai trò là cực dương
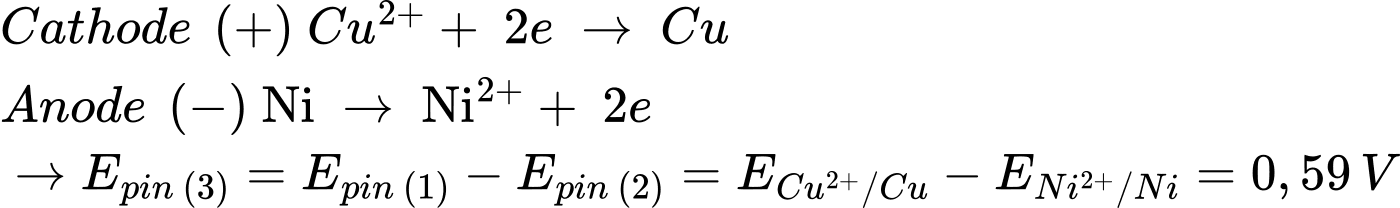
⇒ Chọn đáp án C Đáp án: C
❌ A. Sai. Pin 3: Ni đóng vai trò là cực âm và Cu đóng vai trò là cực dương
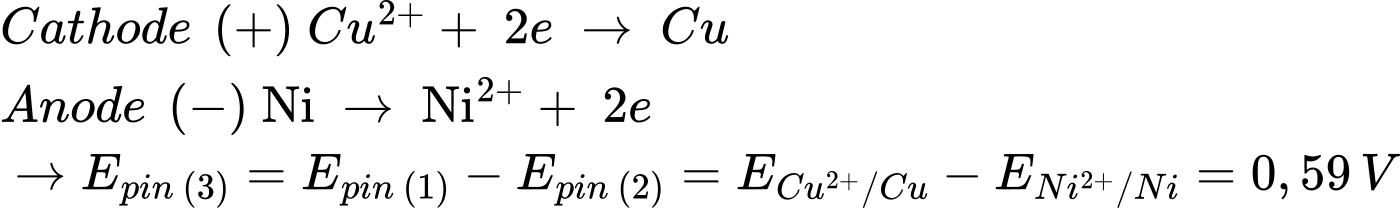
❌ B. Sai. Từ pin 1 và pin 2 → Tính khử của các kim loại giảm dần Zn > Ni > Cu.
❌ C. Sai.
Pin 1: Zn đóng vai trò là cực âm (quá trình oxi hóa) và Cu đóng vai trò là cực dương (quá trình khử)
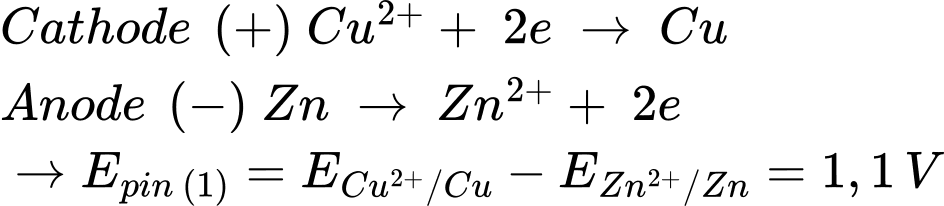
Pin 2: Zn đóng vai trò là cực âm (quá trình oxi hóa) và Ni đóng vai trò là cực dương (quá trình khử)
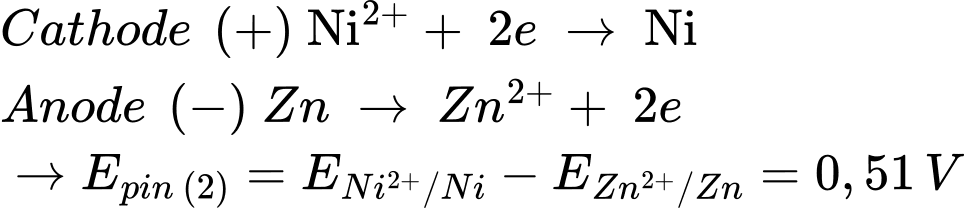
✔️ D. Đúng. Pin 3: Ni đóng vai trò là cực âm và Cu đóng vai trò là cực dương
⇒ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
✤ Hoá chất: Dung dịch BaCl2 0,1 M; H2SO4 1,0 М.
✤ Tiến hành thí nghiệm: Cho vào ống nghiệm khoảng 2 mL dung dịch BaCl2, thêm từ từ cho đến hết khoảng 6 – 8 giọt dung dịch H2SO4, lắc đều.
✔️ A. Đúng. Phản ứng giữa BaCl2 và H2SO4 tạo BaSO4 kết tủa màu trắng: BaCl2 + H2SO4 → BaSO4↓ + 2HCl. BaSO4 là một kết tủa trắng, không tan trong nước.
✔️ B. Đúng. Trong thực tế Barium sulfate là một muối bền vững, không tan trong nước, trong cồn hay các dung dịch acid.
✔️ C. Đúng. Đề bài cho BaCl2 ở dạng rắn, cần hòa tan trước khi phản ứng để phản ứng có thể xảy ra:
BaCl2 + H2SO4 → BaSO4 + 2HCl
✔️ D. Đúng. Sự có mặt của ion Ba2+ trong dung dịch có thể nhận biết bằng dung dịch chứa ion SO42- hoặc CO32- xuất hiện kết tủa trắng.
Ba2+ + SO42- → BaSO4 (kết tủa trắng, không tan trong acid)
Ba2+ + CO32- → BaCO3 (kết tủa trắng, tan trong acid loãng)
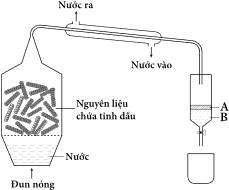
❌ a. Sai. Chưng cất hơi nước là phương pháp chiết xuất tinh dầu phổ biến nhất từ thực vật. Phương pháp này dựa vào hơi nước để giúp các hợp chất dễ bay hơi thoát ra khỏi nguyên liệu, rồi ngưng tụ lại thành dạng lỏng để tách tinh dầu.
❌ b. Sai. Lớp A là tinh dầu, lớp B là nước vì tinh dầu có khối lượng riêng nhỏ hơn khối lượng riêng của nước 1 g/mL nên nằm ở trên.
✔️ c. Đúng. Chiết là phương pháp tách biệt và tinh chế hỗn hợp dựa vào sự hòa tan khác nhau của chúng trong hai môi trường. Chiết lỏng – lỏng: dùng để tách các chất hữu cơ hòa tan trong nước.
❌ d. Sai. Nước được dùng để làm lạnh sẽ dẫn vào bên trong ống sinh hàn từ vòi phía dưới và chảy ra ở vòi phía trên. Do đó, chiều của dòng nước trong ống bao phía ngoài ống sinh hàn sẽ chảy ngược hướng với hơi của chất lỏng bốc lên.
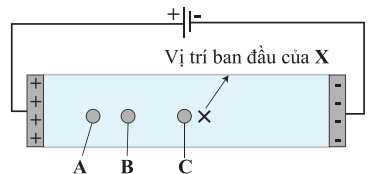
Tại pH = 6,06 dạng tồn tại của glycine, glutamic acid và Glu-Gly như sau: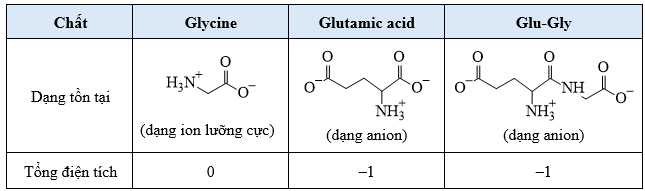
– Tại pH = 6,06 dạng tồn tại của glycine tồn tại dạng ion lưỡng cực nên hầu như không di chuyển trong điện trường → C là Glycine.
– Tại pH = 6,06 dạng tồn tại của Glutamic acid và Glu–Gly tồn tại dạng ion anion và có tổng điện tích là – 1 nên di chuyển về cực dương trong điện trường, nhưng Glutamic acid có kích thước nhỏ hơn nên sẽ đi nhanh hơn về phía cực dương → A là Glutamic acid và B là Glu–Gly.
Phân tích các phát biểu:
❌ (a) Sai. Chất A tiến gần cực dương hơn nên chất A không thể có điện tích nhỏ hơn chất B.
✔️ (b) Đúng. Chất A, B, C lượt là Glu (dạng anion), Glu-Gly (dạng anion) và Ala(dạng trung hòa về điện).
❌ (c) Sai. Tại pH = 6,06 dạng tồn tại của Glutamic acid và Glu-Gly tồn tại dạng ion anion và có tổng điện tích là –1 nên di chuyển về cực dương trong điện trường, nhưng Glutamic acid có kích thước nhỏ hơn nên sẽ đi nhanh hơn về phía cực dương.
❌ (d) Sai. Tại pH = 2, glutamic acid và glycine đều tồn tại dạng cation nên di chuyển về cực âm: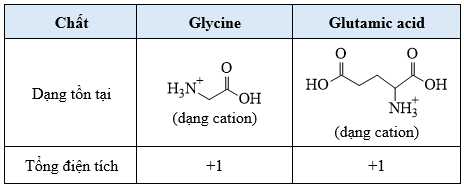
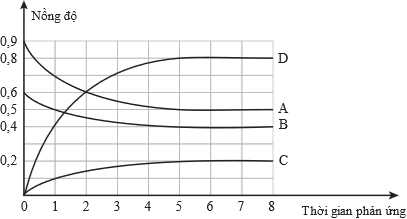
Sau khi phản ứng đạt trạng thái cân bằng, tiến hành tăng nhiệt độ của bình phản ứng thì thấy số mol khí trong bình tăng lên.
❌ (a) Sai. Trước thời điểm cân bằng, tốc độ phản ứng nghịch tăng dần theo thời gian do nồng độ sản phẩm tăng lên; tốc độ phản ứng thuận giảm dần theo thời gian do nồng độ sản phẩm giảm xuống.
✔️ (b) Đúng. Hoàn toàn có thể dựa vào sự thay đổi nồng độ của chất phản ứng (hoặc chất sản phẩm) trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng và xác định chất tham gia, chất sản phẩm.
✔️ (c) Đúng.
Nồng độ của các chất A và B tại thời điểm ban đầu lần lượt là 0,9 M và 0,6 M.
Nồng độ của các chất A, B, C, D tại thời điểm cân bằng lần lượt là 0,5 M; 0,4 M; 0,2 M; 0,8 M.
Lượng chất A, B tham gian phản ứng lần lượt là 0,9 – 0,5 = 0,4 M; 0,6 – 0,4 = 0,2 M.
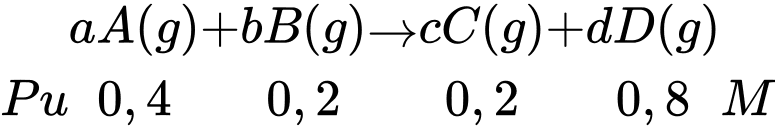
Tỉ lệ nồng độ các chất A, B, C, D là a:b:c:d = 0,4:0,2:0,2:0,8 = 2:1:1:4
→ Phương trình hóa học có dạng
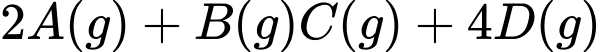
Hằng số cân bằng của phản ứng là
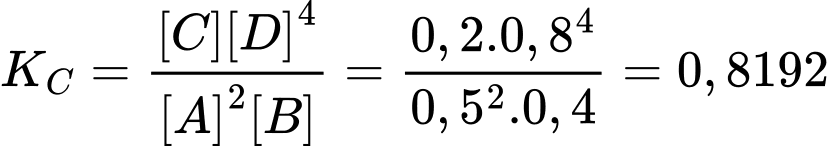
❌ (d) Sai.
Tổng nồng độ khí trước phản ứng là 0,9 + 0,6 = 1,5 M
Tổng nồng độ khi sau phản ứng là 0,5 + 0,4 + 0,2 + 0,8 = 1,9 M
Nồng độ khí sau phản ứng tăng lên chứng tỏ khi tăng nhiệt độ tại thời điểm cân bằng thì cân bằng chuẩn dịch theo chiều thuận → phản ứng trên là phản ứng thu nhiệt.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
→ Phức chất có 6 phối tử H2O → x = 6.
⇒ Điền đáp án: 6
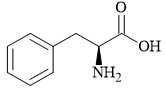
Cho 33 gam phenylalanine phản ứng với dung dịch H2SO4 dư thu được m gam muối. Xác định giá trị của m.
PTHH:
2HOOCC8H8NH2 + H2SO4 ⟶ (HOOCC8H8NH3)2SO4
⟶ Số mol của muối là: n(HOOCC8H8NH3)2SO4 = nHOOCC8H8NH2 ÷ 2 = 0,2 ÷ 2 = 0,1 (mol)
⟶ Khối lượng của muối là: m(HOOCC8H8NH3)2SO4 = 0,1 × 428 = 42,8 (g)
⇒ Điền đáp án: 42,8
Cathode: C2H5OH(l) + 3H2O(l) → 2CO2(g) + 12H+(aq) + 12e
Anode: 3O2(g) + 12H+(aq) + 12e → 6H2O(l)
Một bóng đèn LED công suất 30 W được thắp sáng bằng pin ethanol. Biết hiệu suất quá trình là 90,0%; hiệu suất sử dụng năng lượng là 90% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì điện năng tiêu thụ 0,03 kWh. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 92 gam ethanol làm nhiên liệu ở điều kiện chuẩn (Làm tròn đến số nguyên)? Biết 1 J/s = 1 W và enthalpy tiêu chuẩn của các chất được cho trong bảng sau:
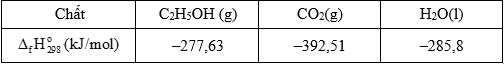
Anode: 3O2(g) + 12H+(aq) + 12e → 6H2O(l)
––––––––––––––––––––––––––––––––––––––––––
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Biến thiên enthalpy của phản ứng trên là:
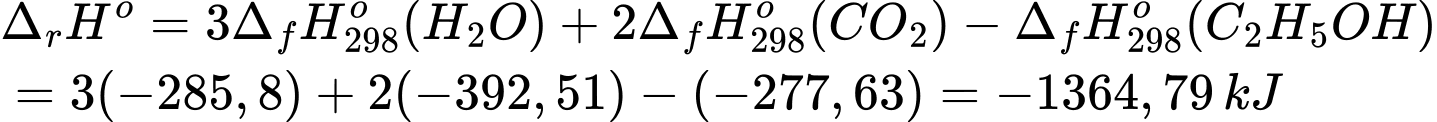
1 mol ethanol sẽ tỏa ra lượng năng lượng 1364,79 kJ
Trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì điện năng tiêu thụ 0,03 kWh.
→ Trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì điện năng tiêu thụ 108 kJ.
Hiệu suất quá trình là 90,0% và hiệu suất sử dụng năng lượng là 90%
→ Hiệu suất chung của cả quá trình là H = 90% × 90% = 81%
Số mol ethanol là: nethanol = 92 ÷ 46 = 2 (mol)
Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 92 gam methanol làm nhiên liệu là:
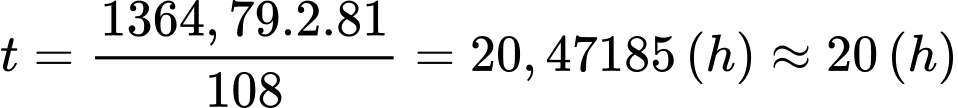
⇒ Điền đáp án: 20
❌ 1. Glucose: Là monosaccharide (C6H12O6), không có liên kết glycoside nên không bị thủy phân.
✔️ 2. Saccharose (C12H22O11): Là disaccharide được tạo nên bởi glucose và fructose nên bị thủy phân trong môi trường acid thành glucose và fructose.
✔️ 3.Tinh bột: Là polysaccharide gồm nhiều đơn vị glucose liên kết bằng liên kết α-1,4 và α-1,6-glycoside nên bị thủy phân trong môi trường acid tạo maltose → glucose.
✔️ 4. Maltose (C12H22O11):Là disaccharide gồm hai phân tử glucose liên kết bằng liên kết α-1,4-glycoside nên bị thủy phân trong môi trường acid thành glucose.
✔️ 5. Cellulose: Là polysaccharide gồm nhiều đơn vị glucose liên kết bằng liên kết β-1,4-glycoside nên bị thủy phân trong môi trường acid tạo glucose.
Vậy có 4 chất tham gia phản ứng thủy phân trong môi trường acid.
⇒ Điền đáp án: 4
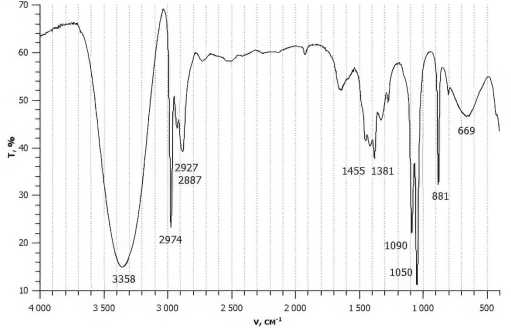
Số sóng đặc trưng của liên kết O–H trong phân tử ethyl alcohol có số sóng là bao nhiêu cm–1?
→ Từ phổ hồng ngoại tín hiệu đặc trưng cho liên kết O–H của ethyl alcohol có số sóng là 3358 cm–1.
⇒ Điền đáp án: 3358
Bước 1: Điện phân dung dịch KI trong 2 phút với dòng điện 2 mA.
Bước 2: Sau đó dẫn 2 lít không khí trên lội từ từ qua bình điện phân cho đến khi iot mất màu hoàn toàn.
Bước 3: Thêm hồ tinh bột vào bình và tiếp tục điện phân trong 35 giây nữa, khi thấy dung dịch bắt đầu xuất hiện màu xanh thì ngưng điện phân.
Hàm lượng của H2S trong khí thải của nhà máy trên là a×10–2 (mg/L). Xác định giá trị của a (Làm tròn đến hàng phần trăm).
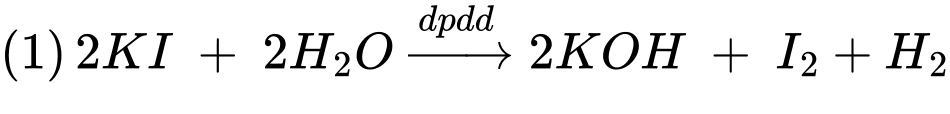
Bước 2: Sau đó dẫn 2 L không khí trên lội từ từ qua bình điện phân cho đến khi iodine mất màu hoàn toàn.
Bước 3: Thêm hồ tinh bột vào bình và tiếp tục điện phân trong 35 giây nữa, khi thấy dung dịch bắt đầu xuất hiện màu xanh thì ngưng điện phân.
(2) H2S + I2 ⟶ S + 2HI
Từ các bước ta thấy sau 2 phút 35 giây (155 giây) thì lượng I2 sinh ra phản ứng hết với H2S.
Số mol electron trao đổi là:
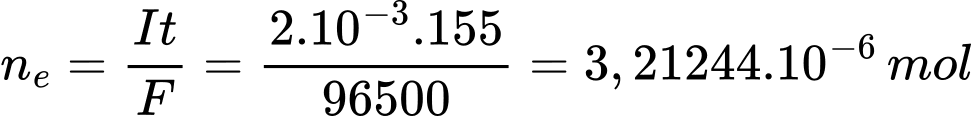
Quá trình khử: 2I- ⟶ I2 + 2e
Số mol của I2 là:
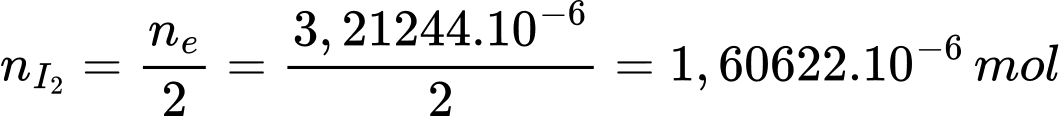
Từ phương trình (2) số mol của H2S là: nH2S = nI2 = 1,60622 × 10-6 mol
Hàm lượng của H2S (mg/L) trong khí thải của nhà máy trên là:
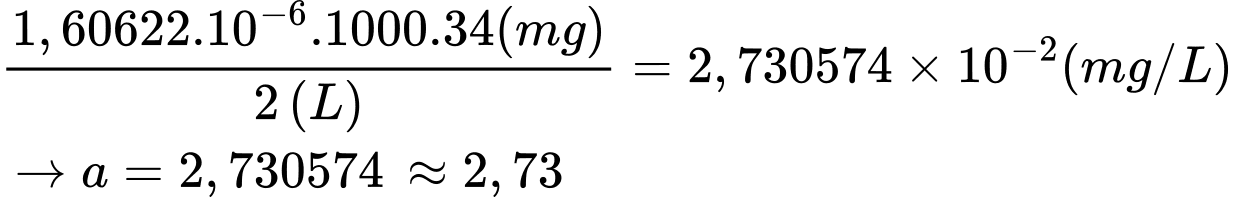
⇒ Điền đáp án: 2,73