PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705456]: Trong tự nhiên, các nguyên tố ...(1)... chỉ tồn tại ở dạng hợp chất do đều là những kim loại hoạt động hóa học ...(2)... nên không tồn tại dạng đơn chất. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, nhóm IIA, yếu.
B, nhóm IA, yếu.
C, Nhóm VIIA, mạnh.
D, nhóm IA, mạnh.
Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất do đều là những kim loại hoạt động hóa học mạnh nên không tồn tại dạng đơn chất.
Giải thích:
– Kim loại kiềm (Nhóm IA) gồm Li, Na, K, Rb, Cs, Fr và kim loại kiềm thổ (Nhóm IIA): Gồm Be, Mg, Ca, Sr, Ba, Ra có 1 hoặc 2 electron hóa trị, rất dễ mất electron để tạo ion dương (M+ hay M2+), nên có tính khử rất mạnh.
– Do phản ứng quá mạnh với các chất trong môi trường tự nhiên (oxygen, nước, CO2...), các kim loại này không thể tồn tại lâu dưới dạng đơn chất mà luôn tồn tại dưới dạng hợp chất (oxide, muối, silicate...).
⇒ Chọn đáp án D Đáp án: D
Giải thích:
– Kim loại kiềm (Nhóm IA) gồm Li, Na, K, Rb, Cs, Fr và kim loại kiềm thổ (Nhóm IIA): Gồm Be, Mg, Ca, Sr, Ba, Ra có 1 hoặc 2 electron hóa trị, rất dễ mất electron để tạo ion dương (M+ hay M2+), nên có tính khử rất mạnh.
– Do phản ứng quá mạnh với các chất trong môi trường tự nhiên (oxygen, nước, CO2...), các kim loại này không thể tồn tại lâu dưới dạng đơn chất mà luôn tồn tại dưới dạng hợp chất (oxide, muối, silicate...).
⇒ Chọn đáp án D Đáp án: D
Câu 2 [575889]: Tên gọi đúng của hợp chất Hg2CrO4 là gì?
A, Mercury(I) chromate.
B, Dimercury chromate.
C, Mercury(II) chromate.
D, Mercury dichromate.
✅ A. Đúng. Hg22+ thực chất là 2 ion Hg+ liên kết với nhau, nên số oxi hóa của mỗi nguyên tử Hg là +1, đúng với cách gọi Mercury(I). CrO42- là chromate. Tên đầy đủ: Mercury(I) chromate.
❌ B. Sai. "Dimercury" không phải cách gọi đúng trong danh pháp hóa học chuẩn của phần kim loại (không dùng tiền tố như "mono, di, tri,..." cho kim loại).
❌ C. Sai. Nếu là Mercury(II) chromate, công thức phải là HgCrO4, chứ không phải Hg2CrO4.
❌ D. Sai. Dichromate (Cr2O72−) không phải là ion trong hợp chất này.
⇒ Chọn đáp án A Đáp án: A
❌ B. Sai. "Dimercury" không phải cách gọi đúng trong danh pháp hóa học chuẩn của phần kim loại (không dùng tiền tố như "mono, di, tri,..." cho kim loại).
❌ C. Sai. Nếu là Mercury(II) chromate, công thức phải là HgCrO4, chứ không phải Hg2CrO4.
❌ D. Sai. Dichromate (Cr2O72−) không phải là ion trong hợp chất này.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [705457]: Chất nào sau đây thuộc loại hợp chất carbohydrate?
A, Maltose.
B, Acetaldehyde.
C, Glycine.
D, Ethyl acetate.
Carbohydratelà một phân tử hữu cơ cấu tạo từ 3 nguyên tố C, H và O. Hợp chất này có công thức cấu tạo chung là Cm(H2O)n, trong đó m và n là các số tự nhiên khác 0, có thể giống hoặc khác nhau.
✔️ A. Maltose có công thức phân tử C12H22O11 → thuộc loại hợp chất carbohydrate.
❌ B. Acetaldehyde có công thức phân tử CH3CHO → thuộc loại hợp chất aldehyde (có nhóm chức -CHO).
❌ C. Glycine có công thức phân tử H2NCH2COOH → thuộc loại hợp chất amino acid (Có nhóm -NH2 và -COOH).
❌ D. Ethyl acetate có công thức phân tử CH3COOC2H5 → thuộc loại hợp chất ester (có nhóm -COO-).
⇒ Chọn đáp án A Đáp án: A
✔️ A. Maltose có công thức phân tử C12H22O11 → thuộc loại hợp chất carbohydrate.
❌ B. Acetaldehyde có công thức phân tử CH3CHO → thuộc loại hợp chất aldehyde (có nhóm chức -CHO).
❌ C. Glycine có công thức phân tử H2NCH2COOH → thuộc loại hợp chất amino acid (Có nhóm -NH2 và -COOH).
❌ D. Ethyl acetate có công thức phân tử CH3COOC2H5 → thuộc loại hợp chất ester (có nhóm -COO-).
⇒ Chọn đáp án A Đáp án: A
Câu 4 [705458]: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
(b) Cho dung dịch NaHCO3 vào dung dịch MgCl2.
(c) Cho dung dịch Na3PO4 vào dung dịch Ca(NO3)2.
(d) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kết tủa là
(a) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
(b) Cho dung dịch NaHCO3 vào dung dịch MgCl2.
(c) Cho dung dịch Na3PO4 vào dung dịch Ca(NO3)2.
(d) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kết tủa là
A, (a), (b), (c).
B, (b), (c), (d).
C, (a), (c), (d).
D, (a), (b), (d).
Phản ứng ở các thí nghiệm xảy ra như sau:
✔️ (a) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
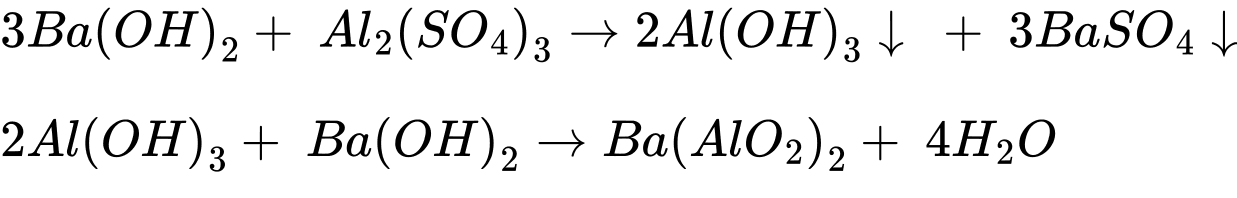
❌ (b) Cho dung dịch NaHCO3 vào dung dịch MgCl2 không có phản ứng.
✔️ (c) Cho dung dịch Na3PO4 vào dung dịch Ca(NO3)2.
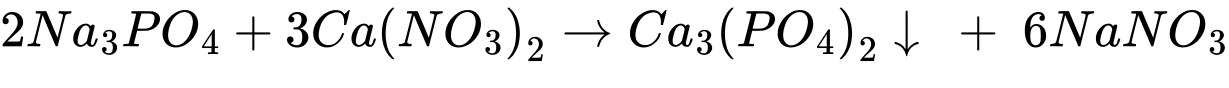
✔️ (d) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
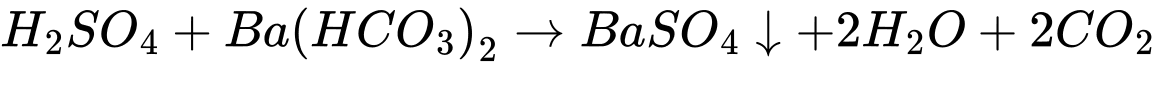
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kết tủa là (a), (c), (d).
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Cho dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
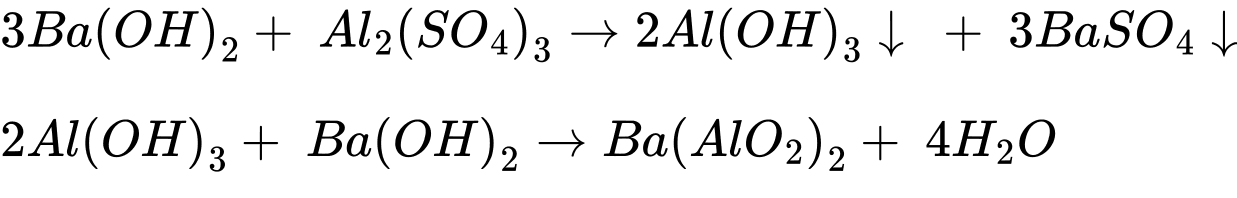
❌ (b) Cho dung dịch NaHCO3 vào dung dịch MgCl2 không có phản ứng.
✔️ (c) Cho dung dịch Na3PO4 vào dung dịch Ca(NO3)2.
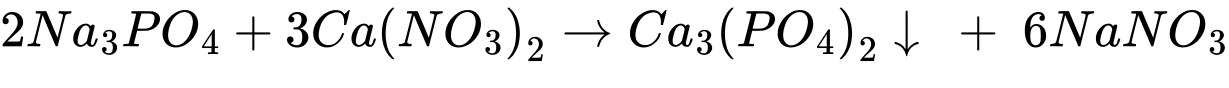
✔️ (d) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
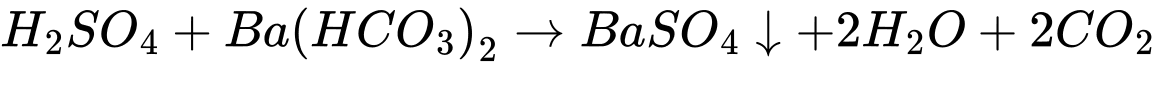
Sau khi các phản ứng xảy ra hoàn toàn, những thí nghiệm thu được kết tủa là (a), (c), (d).
⇒ Chọn đáp án C Đáp án: C
Câu 5 [575621]: Anion X2– có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ của X2– là
A, 18.
B, 16.
C, 9.
D, 20.
Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6
Cấu hình electron của anion X2- là: 1s22s22p63s23p6
→ Tổng số electron lớp vỏ của X2- là 18.
⇒ Chọn đáp án A Đáp án: A
Cấu hình electron của anion X2- là: 1s22s22p63s23p6
→ Tổng số electron lớp vỏ của X2- là 18.
⇒ Chọn đáp án A Đáp án: A
Câu 6 [560607]: Kim loại nào sau đây dẫn điện tốt nhất?
A, Ag.
B, Al.
C, Cu.
D, Hg.
Ag dẫn điện tốt nhất, sau đó đến Cu, Au, Al, Fe,...
Bạc có độ dẫn điện cao nhất trong tất cả các kim loại, nhưng vì giá thành cao nên ít được sử dụng trong dây điện.
⇒ Chọn đáp án A Đáp án: A
Bạc có độ dẫn điện cao nhất trong tất cả các kim loại, nhưng vì giá thành cao nên ít được sử dụng trong dây điện.
⇒ Chọn đáp án A Đáp án: A
Câu 7 [705459]: Điểm chớp cháy của một chất là nhiệt độ thấp nhất ở áp suất khí quyển mà hơi của chất đó sẽ bốc cháy trong không khí khi tiếp xúc với nguồn lửa. Giả sử bạn đang giữ hai dung môi trong phòng thí nghiệm của mình, một dung môi A có điểm chớp cháy là 15 oC và dung môi B còn lại có điểm chớp cháy là 75 oC. Nhận định nào sau đây không đúng?
A, Khi được cô lập với môi trường ngoài, hai dung môi A và B có độ an toàn như nhau.
B, Dung môi B dễ cháy và tạo ra ngọn lửa có nhiệt độ cao hơn dung môi A.
C, Tại nhiệt độ phòng, hơi dung môi A bốc cháy khi tiếp xúc với ngọn lửa.
D, Dung môi có điểm chớp cháy thấp hơn đòi hỏi phải xử lý cẩn thận hơn.
Phân tích các nhận định:
✔️ A – Đúng. Khi được cô lập với môi trường ngoài, hai dung môi A và B không có khả năng bốc cháy nên có độ an toàn như nhau.
❌ B – Sai. Dung môi B khó cháy hơn dung môi dung môi A nguyên do dung môi B có điểm chớp cháy là 75 oC cao hơn dung môi A là 15 oC.
✔️ C – Đúng. Tại nhiệt độ phòng (25 oC), hơi dung môi A bốc cháy khi tiếp xúc với ngọn lửa. Nguyên do điểm chớp cháy của dung môi A là 15 oC thấp hơn nhiệt độ phòng.
✔️ D – Đúng. Dung môi có điểm chớp cháy thấp hơn đòi hỏi phải xử lý cẩn thận hơn nguyên do chất có điểm chớp cháy nhỏ hơn sẽ dễ cháy hơn nên cần xử lí cẩn thận.
⇒ Chọn đáp án B Đáp án: B
✔️ A – Đúng. Khi được cô lập với môi trường ngoài, hai dung môi A và B không có khả năng bốc cháy nên có độ an toàn như nhau.
❌ B – Sai. Dung môi B khó cháy hơn dung môi dung môi A nguyên do dung môi B có điểm chớp cháy là 75 oC cao hơn dung môi A là 15 oC.
✔️ C – Đúng. Tại nhiệt độ phòng (25 oC), hơi dung môi A bốc cháy khi tiếp xúc với ngọn lửa. Nguyên do điểm chớp cháy của dung môi A là 15 oC thấp hơn nhiệt độ phòng.
✔️ D – Đúng. Dung môi có điểm chớp cháy thấp hơn đòi hỏi phải xử lý cẩn thận hơn nguyên do chất có điểm chớp cháy nhỏ hơn sẽ dễ cháy hơn nên cần xử lí cẩn thận.
⇒ Chọn đáp án B Đáp án: B
Câu 8 [705460]: Sulfuric acid đặc gây bỏng nặng khi tiếp xúc với da nếu không được sơ cứu kịp thời. Cách sơ cứu nào sau đây phù hợp khi bị sulfuric acid đặc rơi vào tay?
A, Rửa chỗ tiếp xúc với acid bằng dung dịch NaHCO3 để trung hoà lượng acid.
B, Rửa chỗ tiếp xúc bằng dung dịch NaOH loãng để nhanh chóng loại bỏ lượng acid trên da.
C, Rửa chỗ tiếp xúc dưới vòi nước sạch khoảng 20 phút và đến cơ sở y tế.
D, Rửa chỗ tiếp xúc dưới vòi nước sạch khoảng 20 phút và bôi kem chống bỏng.
Tính chất nguy hiểm của H2SO4 đặc:
- H2SO4 đặc có tính hút nước mạnh, khi tiếp xúc với da có thể gây mất nước mô, cháy da, và hoại tử sâu.
- Khi phản ứng với nước hoặc dung dịch kiềm (NaOH, KOH), nó tỏa nhiều nhiệt, có thể làm bỏng nặng hơn nếu trung hòa trực tiếp trên da.
Phân tích các cách sơ cứu:
❌ A. Sai. KOH là base mạnh, khi trung hòa với H2SO4 sẽ tỏa nhiệt, có thể làm vết bỏng nghiêm trọng hơn.
❌ B. Sai. NaOH cũng là base mạnh, có thể gây bỏng kiềm và tạo phản ứng tỏa nhiệt, làm tổn thương da nghiêm trọng hơn.
✔️ C. Đúng. Cách sơ cứu tiêu chuẩn khi bị bỏng acid là rửa ngay dưới vòi nước sạch trong ít nhất 20 phút để loại bỏ acid, sau đó đến cơ sở y tế để xử lý tiếp theo.
❌ D. Sai. Không nên bôi kem, dầu mỡ hoặc thuốc mỡ ngay sau khi bị bỏng acid, vì có thể giữ acid lại trên da và làm vết thương trầm trọng hơn.
⇒ Chọn đáp án C Đáp án: C
- H2SO4 đặc có tính hút nước mạnh, khi tiếp xúc với da có thể gây mất nước mô, cháy da, và hoại tử sâu.
- Khi phản ứng với nước hoặc dung dịch kiềm (NaOH, KOH), nó tỏa nhiều nhiệt, có thể làm bỏng nặng hơn nếu trung hòa trực tiếp trên da.
Phân tích các cách sơ cứu:
❌ A. Sai. KOH là base mạnh, khi trung hòa với H2SO4 sẽ tỏa nhiệt, có thể làm vết bỏng nghiêm trọng hơn.
❌ B. Sai. NaOH cũng là base mạnh, có thể gây bỏng kiềm và tạo phản ứng tỏa nhiệt, làm tổn thương da nghiêm trọng hơn.
✔️ C. Đúng. Cách sơ cứu tiêu chuẩn khi bị bỏng acid là rửa ngay dưới vòi nước sạch trong ít nhất 20 phút để loại bỏ acid, sau đó đến cơ sở y tế để xử lý tiếp theo.
❌ D. Sai. Không nên bôi kem, dầu mỡ hoặc thuốc mỡ ngay sau khi bị bỏng acid, vì có thể giữ acid lại trên da và làm vết thương trầm trọng hơn.
⇒ Chọn đáp án C Đáp án: C
Câu 9 [190590]: X là alcohol no, đơn chức. X không tham gia phản ứng tách nước tạo alkene. Phân tử khối của X là
A, 32.
B, 46.
C, 60.
D, 74.
X không tham gia tách nước tạo alkene ⇒ X chỉ có 1 nguyên tử carbon, vậy X là CH3OH = 32.
Xét các đáp án còn lại:
❌ B. Ta có MX = 46 → 14n + 18 = 46 → n = 2
→ Công thức phân tử của X là C2H5OH → Có thể tham gia phản ứng tách nước tạo C2H4.
❌ C. Ta có MX = 60 → 14n + 18 = 32 → n = 3
→ Công thức phân tử của X là C3H7OH → Có thể tham gia phản ứng tách nước tạo C3H6.
❌ D. Ta có MX = 74 → 14n + 18 = 74 → n = 4
→ Công thức phân tử của X là C4H9OH → Có thể tham gia phản ứng tách nước tạo C4H8.
⇒ Chọn đáp án A Đáp án: A
Xét các đáp án còn lại:
❌ B. Ta có MX = 46 → 14n + 18 = 46 → n = 2
→ Công thức phân tử của X là C2H5OH → Có thể tham gia phản ứng tách nước tạo C2H4.
❌ C. Ta có MX = 60 → 14n + 18 = 32 → n = 3
→ Công thức phân tử của X là C3H7OH → Có thể tham gia phản ứng tách nước tạo C3H6.
❌ D. Ta có MX = 74 → 14n + 18 = 74 → n = 4
→ Công thức phân tử của X là C4H9OH → Có thể tham gia phản ứng tách nước tạo C4H8.
⇒ Chọn đáp án A Đáp án: A
Câu 10 [705461]: Chất nào trong các chất sau đây có nhiệt độ sôi thấp nhất?
A, CH3COOH.
B, CH3CHO.
C, C2H5OH.
D, HCOOCH3.
Thứ tự giảm dần nhiệt độ sôi các hợp chất hữu cơ::
Carboxylic acid > alcohol > amine > ester > ketone > aldehyde > dẫn xuất halogen > ether > CxHy.
Chất có nhiệt độ sôi thấp nhất trong các đáp án trên là CH3CHO (aldehyde) trong khi A là carboxylic acid có nhiệt độ sôi cao nhất, C là alcohol và D là ester.
⇒ Chọn đáp án B Đáp án: B
Carboxylic acid > alcohol > amine > ester > ketone > aldehyde > dẫn xuất halogen > ether > CxHy.
Chất có nhiệt độ sôi thấp nhất trong các đáp án trên là CH3CHO (aldehyde) trong khi A là carboxylic acid có nhiệt độ sôi cao nhất, C là alcohol và D là ester.
⇒ Chọn đáp án B Đáp án: B
Câu 11 [305040]: Số nhóm chức ester có trong mỗi phân tử chất béo là
A, 1.
B, 4.
C, 2.
D, 3.
HD: ► Chất béo là các triester (ester ba chức) của glycerol với các acid béo, gọi chung là các triglyceride.

Triester ⇄ Ester 3 chức (tri = 3)
⇒ Chọn đáp án D Đáp án: D

Triester ⇄ Ester 3 chức (tri = 3)
⇒ Chọn đáp án D Đáp án: D
Câu 12 [308476]: Nhận xét nào sau đây sai?
A, Glucose được dùng làm thuốc tăng lực cho người già, trẻ em, người ốm.
B, Gỗ được dùng để chế biến thành giấy.
C, Cellulose có phản ứng màu với iodine.
D, Tinh bột là một trong số nguồn cung cấp năng lượng cho cơ thể.
Phân tích các nhận xét:
✔️ A. Đúng. Glucose được sử dụng làm chất dinh dưỡng, cung cấp năng lượng cho cơ thể; làm nguyên liệu và chất phụ gia trong sản xuất các loại bánh, kẹo, thức uống dinh dưỡng, nước giải khát,...
✔️ B. Đúng. Các vật liệu chứa nhiều cellulose như tre, nứa, gỗ, thường được dùng làm vật liệu xây dựng, đồ dùng gia đình. Cellulose nguyên liệu và gần nguyên chất được chế tạo thành sợi, tơ, giấy viết, giấy bao bì, màng mỏng,...
❌ C. Sai. Phản ứng màu với iondine là phản ứng đặc trưng của tinh bột. Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine. Cellulose không có phản ứng này.
✔️ D. Đúng. Tinh bột là nguồn lương thực quan trọng của con người, là nguyên liệu để sản xuất nhiều loại bánh, sản xuất mì sợi. bia, rượu, mạch nha, glucose, ethanol.
⇒ Chọn đáp án C Đáp án: C
✔️ A. Đúng. Glucose được sử dụng làm chất dinh dưỡng, cung cấp năng lượng cho cơ thể; làm nguyên liệu và chất phụ gia trong sản xuất các loại bánh, kẹo, thức uống dinh dưỡng, nước giải khát,...
✔️ B. Đúng. Các vật liệu chứa nhiều cellulose như tre, nứa, gỗ, thường được dùng làm vật liệu xây dựng, đồ dùng gia đình. Cellulose nguyên liệu và gần nguyên chất được chế tạo thành sợi, tơ, giấy viết, giấy bao bì, màng mỏng,...
❌ C. Sai. Phản ứng màu với iondine là phản ứng đặc trưng của tinh bột. Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine. Cellulose không có phản ứng này.
✔️ D. Đúng. Tinh bột là nguồn lương thực quan trọng của con người, là nguyên liệu để sản xuất nhiều loại bánh, sản xuất mì sợi. bia, rượu, mạch nha, glucose, ethanol.
⇒ Chọn đáp án C Đáp án: C
Câu 13 [705462]: Nhôm được sản xuất trong công nghiệp bằng phương pháp điện phân nóng chảy quặng bauxite chứa thành phần chính là Al2O3.
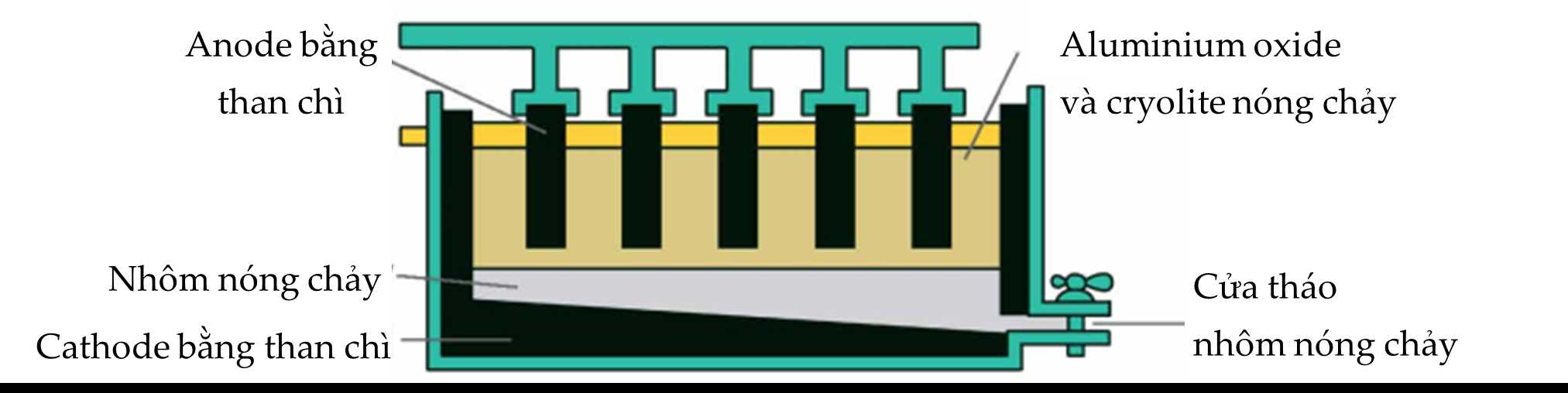
Cho các phát biểu sau:
(a) Cathode xảy ra quá trình khử Al3+ thành kim loại Al nóng chảy.
(b) Ở anode xuất hiện hỗn hợp khí O2, CO và CO2.
(c) Na3AlF6 được thêm vào sẽ nổi lên trên, bảo vệ nhôm nóng chảy khỏi bị oxi hóa bởi O2 không khí.
(d) Trong quá trình điện phân, cực âm luôn phải được thay mới do điện cực làm bằng than chì.Số phát biểu đúng là

Cho các phát biểu sau:
(a) Cathode xảy ra quá trình khử Al3+ thành kim loại Al nóng chảy.
(b) Ở anode xuất hiện hỗn hợp khí O2, CO và CO2.
(c) Na3AlF6 được thêm vào sẽ nổi lên trên, bảo vệ nhôm nóng chảy khỏi bị oxi hóa bởi O2 không khí.
(d) Trong quá trình điện phân, cực âm luôn phải được thay mới do điện cực làm bằng than chì.Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
✔️ (a) – Đúng. Cathode xảy ra quá trình khử Al3+ thành kim loại Al nóng chảy.
Điện phân nóng chảy:
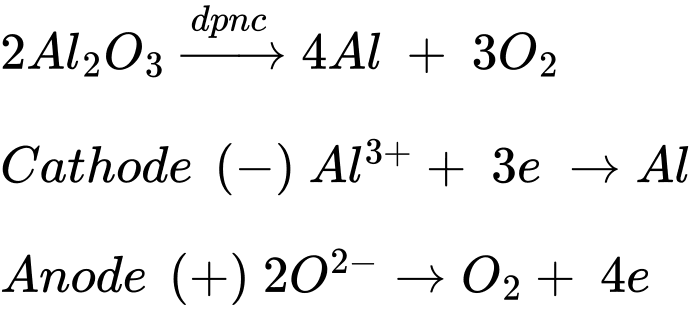
✔️ (b) – Đúng. Ở anode xuất hiện hỗn hợp khí O2, CO và CO2 nguyên do điện cực làm bằng than chì nên sẽ phản ứng với O2 sinh ra.
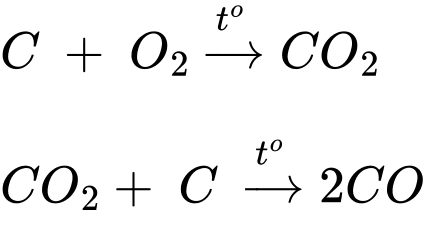
✔️ (c) – Đúng.
Cryolite (Na3AlF6) là nguyên liệu được dùng để sản xuất nhôm với mục đích:
- Làm giảm nhiệt độ nóng chảy của Al2O3.
- Tiết kiệm được năng lượng, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
- Tạo chất lỏng có tỉ khối nhỏ hơn nhôm, nổi lên bề mặt ngăn nhôm nóng chảy bị oxi hoá.
❌ (d) – Sai. Trong quá trình điện phân, cực dương (anode) luôn phải được thay mới do điện cực làm bằng than chì sẽ phản ứng với O2 sinh ra trong quá trình sản xuất nhôm.
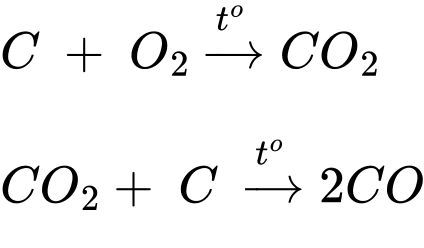
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) – Đúng. Cathode xảy ra quá trình khử Al3+ thành kim loại Al nóng chảy.
Điện phân nóng chảy:
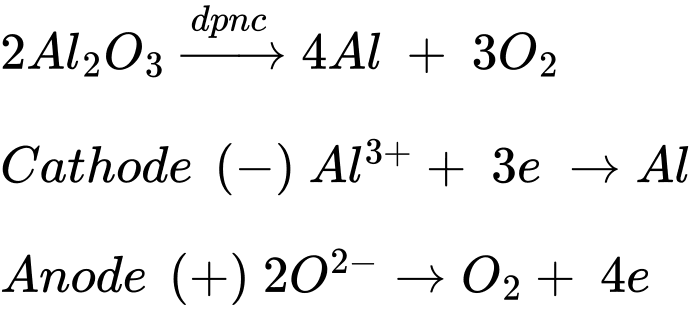
✔️ (b) – Đúng. Ở anode xuất hiện hỗn hợp khí O2, CO và CO2 nguyên do điện cực làm bằng than chì nên sẽ phản ứng với O2 sinh ra.
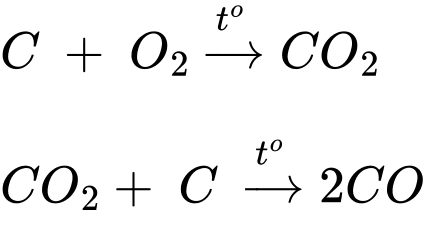
✔️ (c) – Đúng.
Cryolite (Na3AlF6) là nguyên liệu được dùng để sản xuất nhôm với mục đích:
- Làm giảm nhiệt độ nóng chảy của Al2O3.
- Tiết kiệm được năng lượng, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
- Tạo chất lỏng có tỉ khối nhỏ hơn nhôm, nổi lên bề mặt ngăn nhôm nóng chảy bị oxi hoá.
❌ (d) – Sai. Trong quá trình điện phân, cực dương (anode) luôn phải được thay mới do điện cực làm bằng than chì sẽ phản ứng với O2 sinh ra trong quá trình sản xuất nhôm.
Các phát biểu đúng là (a) (b) (c)
⇒ Chọn đáp án C Đáp án: C
Câu 14 [304846]: Etser X có công thức phân tử là C4H8O2. Thủy phân X trong dung dịch H2SO4 loãng, đun nóng, thu được sản phẩm gồm acetic acid và chất hữu cơ Y. Công thức Y là
A, HCOOH.
B, CH3OH.
C, C2H5COOH.
D, C2H5OH.
Phân tích phản ứng thủy phân ester trong môi trường acid:
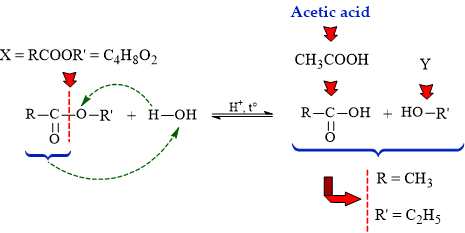
Đơn giản bảo toàn số C, H, O ⇒ gốc R' là C2H5 ⇒ Y là C2H5OH: ethyl alcohol
⇒ Chọn đáp án D Đáp án: D

Đơn giản bảo toàn số C, H, O ⇒ gốc R' là C2H5 ⇒ Y là C2H5OH: ethyl alcohol
⇒ Chọn đáp án D Đáp án: D
Câu 15 [705463]: “…(1)… là quá trình kết hợp nhiều phân tử …(2)… giống nhau hay tương tự nhau tạo thành phân tử có phân tử khối lớn”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, Xà phòng hoá, nhỏ.
B, Trùng hợp, nhỏ.
C, Trùng ngưng, lớn.
D, Lên men, lớn.
Trùng hợp là quá trình kết hợp nhiều phân tử nhỏ giống nhau hay tương tự nhau tạo thành phân tử có phân tử khối lớn.
Ví dụ:
Trùng hợp ethylene (C2H4) tạo polyethylene (PE):
nCH2=CH2 −xt, to⟶ (−CH2−CH2−)n
− Monomer: ethylene (CH2=CH2)
− Polymer: polyethylene ((−CH2−CH2−)n)
− Ứng dụng: Sản xuất túi nhựa, màng bọc thực phẩm, ống nhựa.
⇒ Chọn đáp án B Đáp án: B
Ví dụ:
Trùng hợp ethylene (C2H4) tạo polyethylene (PE):
nCH2=CH2 −xt, to⟶ (−CH2−CH2−)n
− Monomer: ethylene (CH2=CH2)
− Polymer: polyethylene ((−CH2−CH2−)n)
− Ứng dụng: Sản xuất túi nhựa, màng bọc thực phẩm, ống nhựa.
⇒ Chọn đáp án B Đáp án: B
Câu 16 [705464]: Các enzyme đóng vai trò quan trọng đối với cơ thể sinh vật, như xúc tác cho các quá trình sinh hoá và hoá học. Ví dụ, lipase là enzyme xúc tác cho quá trình thuỷ phân các chất béo chuỗi dài; protease là enzyme xúc tác cho quá trình thuỷ phân các liên kết peptide có trong protein và polypeptide;... Các enzyme chỉ tồn tại và phát triển ở môi trường gần trung tính và nhiệt độ tương đối thấp (gần với nhiệt độ của cơ thể sinh vật). Khi đóng vai trò là chất xúc tác trong các quá trình sinh hoá, các enzyme không có đặc điểm nào sau đây?
A, Có tính chọn lọc cao.
B, Làm tăng tốc độ của các quá trình sinh hoá.
C, Có tác dụng tốt ở nhiệt độ cao hoặc môi trường acid mạnh.
D, Chỉ hoạt động trong điều kiện nhiệt độ phù hợp.
Phân tích các đặc điểm:
✔️ A. Đúng. Enzyme có tính chọn lọc cao, chỉ xúc tác cho một phản ứng cụ thể hoặc nhóm phản ứng có cấu trúc tương tự. Điều này giúp chúng thực hiện các quá trình sinh hóa chính xác và hiệu quả.
✔️ B. Đúng. Enzyme giúp tăng tốc độ phản ứng mà không bị tiêu tốn trong phản ứng đó, thông qua việc giảm năng lượng kích hoạt cần thiết cho phản ứng.
❌ C. Sai. Enzyme thường có dải nhiệt độ và pH thích hợp để hoạt động, thường là ở nhiệt độ thấp (gần nhiệt độ cơ thể sinh vật) và môi trường gần trung tính (pH khoảng 7). Ở nhiệt độ quá cao hoặc môi trường acid mạnh, enzyme có thể bị biến tính (mất cấu trúc và chức năng).
✔️ D. Đúng. Enzyme chỉ hoạt động hiệu quả trong điều kiện nhiệt độ và pH thích hợp. Nhiệt độ quá cao hoặc pH quá cao hoặc thấp có thể làm enzyme bị mất chức năng.
⇒ Chọn đáp án C Đáp án: C
✔️ A. Đúng. Enzyme có tính chọn lọc cao, chỉ xúc tác cho một phản ứng cụ thể hoặc nhóm phản ứng có cấu trúc tương tự. Điều này giúp chúng thực hiện các quá trình sinh hóa chính xác và hiệu quả.
✔️ B. Đúng. Enzyme giúp tăng tốc độ phản ứng mà không bị tiêu tốn trong phản ứng đó, thông qua việc giảm năng lượng kích hoạt cần thiết cho phản ứng.
❌ C. Sai. Enzyme thường có dải nhiệt độ và pH thích hợp để hoạt động, thường là ở nhiệt độ thấp (gần nhiệt độ cơ thể sinh vật) và môi trường gần trung tính (pH khoảng 7). Ở nhiệt độ quá cao hoặc môi trường acid mạnh, enzyme có thể bị biến tính (mất cấu trúc và chức năng).
✔️ D. Đúng. Enzyme chỉ hoạt động hiệu quả trong điều kiện nhiệt độ và pH thích hợp. Nhiệt độ quá cao hoặc pH quá cao hoặc thấp có thể làm enzyme bị mất chức năng.
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:

Một pin đồng – kẽm được thiết lập bởi hai điện cực chuẩn (với thể tích các dung dịch CuSO4 1,0 M và ZnSO4 1,0 M bằng nhau). Nối thanh đồng với thanh kẽm bằng một dây dẫn.
Cho $E_{C{u^{2 + }}/Cu}^o = + 0,34V;E_{Z{n^{2 + }}/Zn}^o = - 0,76V$.
Câu 17 [705465]: Sau một thời gian hoạt động, nồng độ CuSO4 thay đổi 0,5 M. Nồng độ của các dung dịch tại thời điểm này là
A, CuSO4, 0,5M; ZnSO4 0,5 M.
B, CuSO4, 0,5 M; ZnSO4, 1,5 M.
C, CuSO4 1,5 M; ZnSO4 0,5 M.
D, CuSO4, 1,5 M; ZnSO4, 1,5 M.
Ta có: 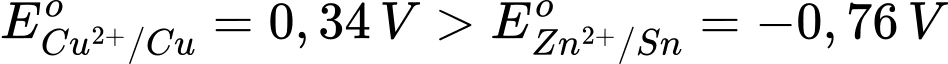
Trong pin điện hóa trên Cu đóng vai trò là cathode và Zn đóng vai trò là anode
Phản ứng trong pin: Cu2+ + Zn ⟶ Cu + Zn2+
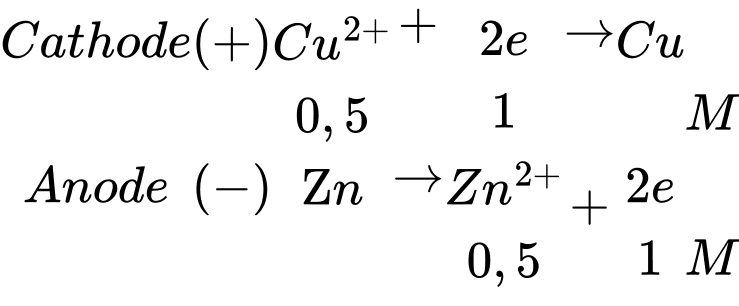
→ Nồng độ các chất trong dung dịch là:
CCuSO4 = 1 – 0,5 = 0,5 M;
CZnSO4 = 1 + 0,5 = 1,5 M.
⇒ Chọn đáp án B Đáp án: B
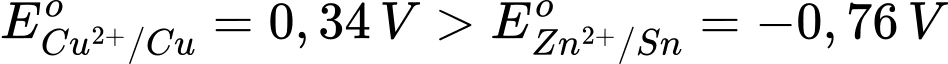
Trong pin điện hóa trên Cu đóng vai trò là cathode và Zn đóng vai trò là anode
Phản ứng trong pin: Cu2+ + Zn ⟶ Cu + Zn2+
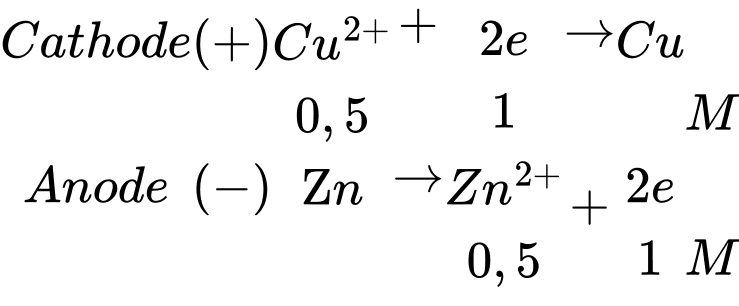
→ Nồng độ các chất trong dung dịch là:
CCuSO4 = 1 – 0,5 = 0,5 M;
CZnSO4 = 1 + 0,5 = 1,5 M.
⇒ Chọn đáp án B Đáp án: B
Câu 18 [705466]: Đồ thị nào thể hiện sự thay đổi sức điện động của pin đồng - kẽm theo thời gian?
A, 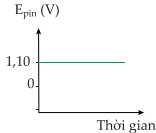

B, 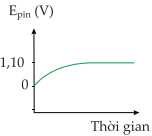

C, 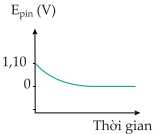

D, 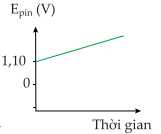

Khi thời gian phản ứng tăng, tức lượng Cu2+ trong pin Đồng – kẽm giảm dần
→ Sức điện động của pin sẽ giảm dần từ 1,10 V đến 0.
⇒ Chọn đáp án C Đáp án: C
→ Sức điện động của pin sẽ giảm dần từ 1,10 V đến 0.
⇒ Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [585217]: Thực hiện thí nghiệm tách β-carotene từ nước ép cà rốt:
Chuẩn bị: nước ép cà rốt, hexane; cốc thuỷ tinh 100 mL, bình tam giác 100 mL, phễu chiết 60 mL, giá thí nghiệm.
Tiến hành:
- Cho khoảng 20 mL nước ép cà rốt vào phễu chiết. Thêm tiếp khoảng 20 mL hexane, lắc đều khoảng 2 phút.
- Để yên phễu chiết trên giá thí nghiệm khoảng 5 phút để chất lỏng tách thành hai lớp.
- Mở khoá phễu chiết cho phần nước ở dưới chảy xuống, còn lại phần dung dịch β-carotene hoà tan trong hexane.
Chuẩn bị: nước ép cà rốt, hexane; cốc thuỷ tinh 100 mL, bình tam giác 100 mL, phễu chiết 60 mL, giá thí nghiệm.
Tiến hành:
- Cho khoảng 20 mL nước ép cà rốt vào phễu chiết. Thêm tiếp khoảng 20 mL hexane, lắc đều khoảng 2 phút.
- Để yên phễu chiết trên giá thí nghiệm khoảng 5 phút để chất lỏng tách thành hai lớp.
- Mở khoá phễu chiết cho phần nước ở dưới chảy xuống, còn lại phần dung dịch β-carotene hoà tan trong hexane.
Phân tích các phát biểu:
✔️a. Đúng. Trước khi chiết lớp hexane trong phễu không có màu; sau khi chiết lớp hexane trong phễu có màu vàng cam.
❌ b. Sai. Thí nghiệm tách β-carotene từ nước cà rốt dựa theo nguyên tắc chiết lỏng – lỏng.
✔️ c. Đúng. Dùng dung môi là hexane có khả năng hoà tan β-carotene nhưng không tan trong nước và có nhiệt độ sôi thấp để chiết.
✔️ d. Đúng. Phễu chiết tách thành hai lớp, lớp bên trên là β-carotene hoà tan trong hexane, lớp dưới là nước.
✔️a. Đúng. Trước khi chiết lớp hexane trong phễu không có màu; sau khi chiết lớp hexane trong phễu có màu vàng cam.
❌ b. Sai. Thí nghiệm tách β-carotene từ nước cà rốt dựa theo nguyên tắc chiết lỏng – lỏng.
✔️ c. Đúng. Dùng dung môi là hexane có khả năng hoà tan β-carotene nhưng không tan trong nước và có nhiệt độ sôi thấp để chiết.
✔️ d. Đúng. Phễu chiết tách thành hai lớp, lớp bên trên là β-carotene hoà tan trong hexane, lớp dưới là nước.
Câu 20 [705467]: Một mẫu magnesium nitrate được nung nóng trong thiết bị được thiết kế sau:
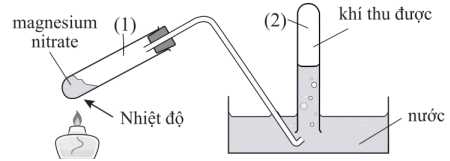
Thu lấy ống nghiệm (2) chứa sản phẩm khí, đưa một que diêm đang cháy lên miệng ống nghiệm và quan sát. Đồng thời tiến hành đo giá trị pH của dung dịch trong máng.

Thu lấy ống nghiệm (2) chứa sản phẩm khí, đưa một que diêm đang cháy lên miệng ống nghiệm và quan sát. Đồng thời tiến hành đo giá trị pH của dung dịch trong máng.
Phản ứng phân hủy 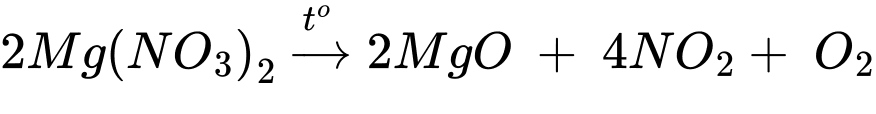
Phân tích các phát biểu:
❌ (a) Sai. Sau phản ứng nhiệt phân hoàn toàn chất rắn còn lại trong ống nghiệm (1) là oxide kim loại MgO.
❌ (b) Sai. Khí thu được trong ống nghiệm (2) là hỗn hợp NO2 và O2. O2 duy trì sự cháy, do đó que diêm có thể bùng cháy mạnh hơn nếu có đủ lượng O2.
✔️ (c) Đúng. Giá trị pH của dung dịch trong máng sau khi nung nóng sẽ nhỏ hơn 7 nguyên nhân có phản ứng hình thành nitric acid.
2H2O + O2 + 4NO2 ⟶ 4HNO3
✔️ (d) Đúng. Tỉ lệ của các chất khí sinh ra ở ống nghiệm (1) 1:4 ứng với O2 và NO2 khác với ở ống nghiệm (2) sau phản ứng của NO2 và O2 với nước tạo ra HNO3 còn lại khí NO và O2.
2H2O + O2 + 4NO2 ⟶ 4HNO3
NO2 + H2O ⟶ HNO3 + NO
Phân tích các phát biểu:
❌ (a) Sai. Sau phản ứng nhiệt phân hoàn toàn chất rắn còn lại trong ống nghiệm (1) là oxide kim loại MgO.
❌ (b) Sai. Khí thu được trong ống nghiệm (2) là hỗn hợp NO2 và O2. O2 duy trì sự cháy, do đó que diêm có thể bùng cháy mạnh hơn nếu có đủ lượng O2.
✔️ (c) Đúng. Giá trị pH của dung dịch trong máng sau khi nung nóng sẽ nhỏ hơn 7 nguyên nhân có phản ứng hình thành nitric acid.
2H2O + O2 + 4NO2 ⟶ 4HNO3
✔️ (d) Đúng. Tỉ lệ của các chất khí sinh ra ở ống nghiệm (1) 1:4 ứng với O2 và NO2 khác với ở ống nghiệm (2) sau phản ứng của NO2 và O2 với nước tạo ra HNO3 còn lại khí NO và O2.
2H2O + O2 + 4NO2 ⟶ 4HNO3
NO2 + H2O ⟶ HNO3 + NO
Câu 21 [705468]: Tiến hành thí nghiệm:
▪ Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch ZnSO4, thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc ống nghiệm.
▪ Bước 2: Tiếp tục thêm vào khoảng 2 - 3 giọt dung dịch HCl, lắc đều.
▪ Bước 1: Cho vào ống nghiệm khoảng 2 mL dung dịch ZnSO4, thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc ống nghiệm.
▪ Bước 2: Tiếp tục thêm vào khoảng 2 - 3 giọt dung dịch HCl, lắc đều.
Phân tích các phát biểu:
✔️ (a) Đúng. Ở bước 1, có kết tủa trắng BaSO4 xuất hiện.
ZnSO4 + BaCl2 ⟶ BaSO4 + ZnCl2
❌ (b) Sai. BaSO4 là kết tủa trắng, bền không tan trong nước và các dung dịch acid.
✔️ (c) Đúng. Nếu thay dung dịch ZnSO4 bằng dung dịch Na2SO4, hiện tượng xảy ra tương tự.
Na2SO4 + BaCl2 ⟶ BaSO4 + 2NaCl
✔️ (d) Đúng. Sự có mặt của ion Ba2+ trong dung dịch có thể nhận biết bằng dung dịch chứa ion SO42–.
Ba2+ + SO42– ⟶ BaSO4 (kết tủa trắng).
✔️ (a) Đúng. Ở bước 1, có kết tủa trắng BaSO4 xuất hiện.
ZnSO4 + BaCl2 ⟶ BaSO4 + ZnCl2
❌ (b) Sai. BaSO4 là kết tủa trắng, bền không tan trong nước và các dung dịch acid.
✔️ (c) Đúng. Nếu thay dung dịch ZnSO4 bằng dung dịch Na2SO4, hiện tượng xảy ra tương tự.
Na2SO4 + BaCl2 ⟶ BaSO4 + 2NaCl
✔️ (d) Đúng. Sự có mặt của ion Ba2+ trong dung dịch có thể nhận biết bằng dung dịch chứa ion SO42–.
Ba2+ + SO42– ⟶ BaSO4 (kết tủa trắng).
Câu 22 [705469]: Thí nghiệm được mô tả như hình vẽ:
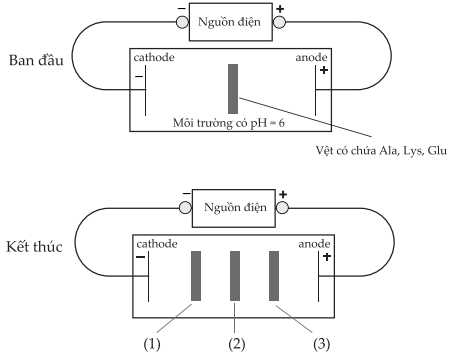

Tại pH = 6:
− Alanine (Ala): tồn tại chủ yếu ở dạng lưỡng cực ion và gần như không di chuyển.
− Lysine (Lys): tồn tại dưới dạng cation (NH3+), nên bị hút về cực âm (cathode).
− Glutamic acid (Glu): tồn tại dưới dạng anion (COO−), nên bị hút về cực dương (anode).
Phân tích các phát biểu:
✔️ (a) Đúng. Thí nghiệm này khảo sát tính chất lưỡng tính của amino acid và sự di chuyển của chúng trong điện trường dựa vào .
✔️ (b) Đúng. Tại pH = 6 alanine tồn tại dạng ion lưỡng cực, tổng điện tích bằng không nên hầu như không di chuyển trong điện trường ứng với vị trí số (2).
✔️ (c) Đúng. Tại pH = 6, Lysine có tổng điện tích bằng 1+ nên di chuyển sang cực âm trong điện trường ứng với vị trí số (1).
❌ (d) Sai. Tại pH = 6 glutamic acid tồn tại dạng anion, tổng điện tích bằng 1− nên di chuyển về cực dương trong điện trường ứng với vị trí số (3).
− Alanine (Ala): tồn tại chủ yếu ở dạng lưỡng cực ion và gần như không di chuyển.
− Lysine (Lys): tồn tại dưới dạng cation (NH3+), nên bị hút về cực âm (cathode).
− Glutamic acid (Glu): tồn tại dưới dạng anion (COO−), nên bị hút về cực dương (anode).
Phân tích các phát biểu:
✔️ (a) Đúng. Thí nghiệm này khảo sát tính chất lưỡng tính của amino acid và sự di chuyển của chúng trong điện trường dựa vào .
✔️ (b) Đúng. Tại pH = 6 alanine tồn tại dạng ion lưỡng cực, tổng điện tích bằng không nên hầu như không di chuyển trong điện trường ứng với vị trí số (2).
✔️ (c) Đúng. Tại pH = 6, Lysine có tổng điện tích bằng 1+ nên di chuyển sang cực âm trong điện trường ứng với vị trí số (1).
❌ (d) Sai. Tại pH = 6 glutamic acid tồn tại dạng anion, tổng điện tích bằng 1− nên di chuyển về cực dương trong điện trường ứng với vị trí số (3).
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705470]: Trong phức chất [Ni(NH3)6]2+.
Số phối tử xung quanh một nguyên tử trung tâm là bao nhiêu?
[Ni(NH3)6]2+ có ion nguyên tử trung tâm là Ni2+ và có 6 phối tử trung hòa NH3
→ Xung quanh ion nguyên tử trung tâm có 6 phối tử.
⇒ Điền đáp án: 6
→ Xung quanh ion nguyên tử trung tâm có 6 phối tử.
⇒ Điền đáp án: 6
Câu 24 [684454]: Ứng với công thức phân tử C4H8O có bao nhiêu hợp chất mạch hở bền khi tác dụng với NaBH4 tạo ra alcohol bậc một?
Alcohol bậc 1: Nhóm -OH được gắn vào nguyên tử carbon bậc 1
Ứng với công thức phân tử C4H8O các hợp chất mạch hở tác dụng với NaBH4 tạo ra alcohol bậc 1:
(1). CH3 – CH2 – CH2 – CHO
(2). (CH3)2 – CH – CHO
⇒ Điền đáp án: 2
Ứng với công thức phân tử C4H8O các hợp chất mạch hở tác dụng với NaBH4 tạo ra alcohol bậc 1:
(1). CH3 – CH2 – CH2 – CHO
(2). (CH3)2 – CH – CHO
⇒ Điền đáp án: 2
Câu 25 [705471]: C6H5CHO là một aldehyde có nhân thơm, phổ hồng ngoại của aldehyde này là hình ảnh bên dưới. Ngoài tín hiệu 1702 cm–1 của nhóm C=O thì dùng thêm tín hiệu (cm–1) nào để kết luận đây là một aldehyde?
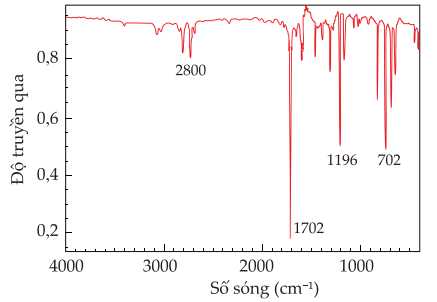

Hợp chất aldehyde có 2 liên kết hấp thụ đặc trung trong phổ hồng ngoại với số sóng hấp thụ là 2850–2700 cm–1 thuộc liên kết C–H và 1740–1670 cm–1 thuộc liên kết C=O.
Ngoài tín hiệu 1702 cm–1 của nhóm C=O thì dùng thêm tín hiệu 2800 cm–1 để kết luận đây là một aldehyde.
⇒ Điền đáp án: 2800
Ngoài tín hiệu 1702 cm–1 của nhóm C=O thì dùng thêm tín hiệu 2800 cm–1 để kết luận đây là một aldehyde.
⇒ Điền đáp án: 2800
Câu 26 [705472]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Pin carbonate nóng chảy (MCFC) kết hợp nhiệt và điện cho các trạm điện phân cấp và cho các phương tiện giao thông chuyển hoá năng lượng thành điện năng:
Anode (+): H2(g)+ CO32–(aq) ⟶ H2O(l) + CO2(g) + 2e
Cathode (–): 1/2O2(g) + CO2(g) + 2e ⟶ CO32–(aq)
Một động cơ “DEUZT MODEL TCD 2012” sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi giờ động cơ tiêu hao 88 kWh. Tính khối lượng theo đơn vị kg của khí hydrogen đã tiêu thụ (Làm tròn đến hàng phần trăm) trong 1 giờ? Cho biết: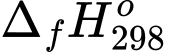 (H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
(H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
Anode (+): H2(g)+ CO32–(aq) ⟶ H2O(l) + CO2(g) + 2e
Cathode (–): 1/2O2(g) + CO2(g) + 2e ⟶ CO32–(aq)
Một động cơ “DEUZT MODEL TCD 2012” sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi giờ động cơ tiêu hao 88 kWh. Tính khối lượng theo đơn vị kg của khí hydrogen đã tiêu thụ (Làm tròn đến hàng phần trăm) trong 1 giờ? Cho biết:
 (H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s.
(H2O(l) = –285,84 kJ/mol, 1 kWh = 3,6.106 J/s. 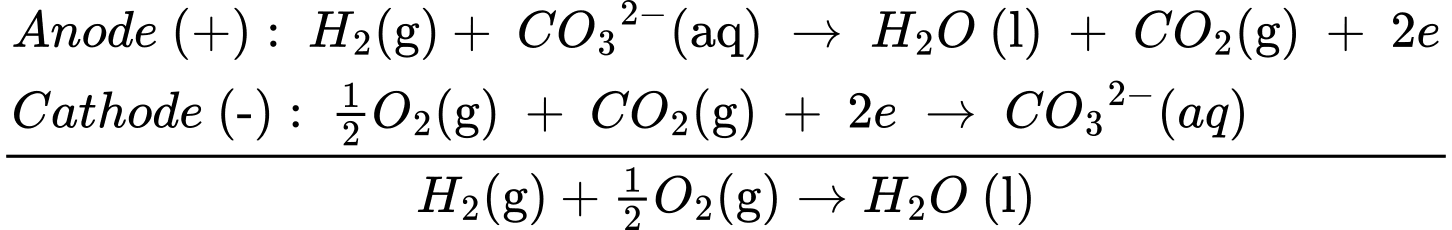
Năng lượng động cơ thật sự tiêu hao trong 1 giờ là: 88 × 3,6 × 106 ÷ 0,6 = 582000 kJ
1 mol H2 chuyển hóa thành lượng năng lượng là 285,84 (kJ)
x mol H2 chuyển hóa thành lượng năng lượng là 582000 (kJ)
→ x = 528000 ÷ 285,84 = 1874,187 (mol)
Khối lượng H2 cần dung là: mH2 = 1874,187 × 2 = 3694,374 (g) ≈ 3,69 (kg)
⇒ Điền đáp án: 3,69
Câu 27 [705473]: Cho các ester sau: CH3COOC2H5, HCOOC(CH3)=CH2, C2H5COOC6H4CH3 (có vòng benzene), C6H5COOCH3. Ở điều kiện thích hợp, có bao nhiêu ester thủy phân không hoàn toàn trong môi trường acid?
Có 4 ester bị thuỷ phân không hòa toàn trong môi trường acid là CH3COOC2H5, C6H5COOCH3.
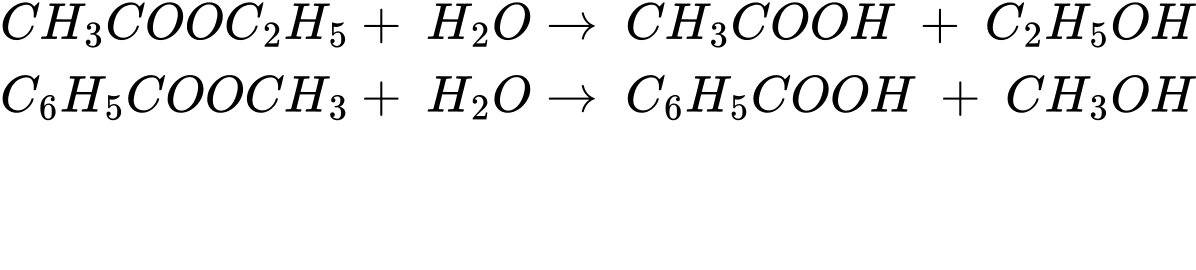
⟹ Điền đáp án: 2
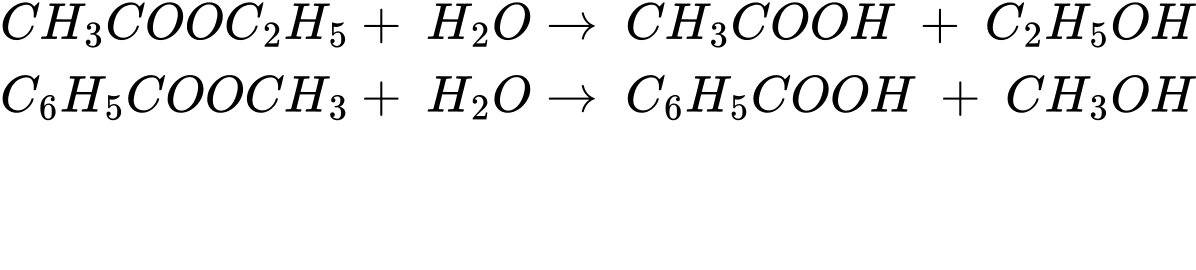
⟹ Điền đáp án: 2
Câu 28 [705474]: Theo Tiêu chuẩn Việt Nam, nồng độ cho phép của ion Cu2+ trong nước uống không được phép vượt quá 3 mg/L. Để xác định hàm lượng Cu2+ trong nước người ta thường chuẩn độ bằng Na2S2O3 (chuẩn độ gián tiếp):
Tiến hành chuẩn độ lượng I3– bằng Na2S2O3 với chất chỉ thị được sử dụng là hồ tinh bột, tại điểm tương đương màu xanh của dung dịch nhạt dần chuyển sang màu trắng đục.
2Cu2+ + 5I– ⟶ 2CuI↓ + I3–
Tiến hành chuẩn độ lượng I3– bằng Na2S2O3 với chất chỉ thị được sử dụng là hồ tinh bột, tại điểm tương đương màu xanh của dung dịch nhạt dần chuyển sang màu trắng đục.
I3– + 2S2O32– ⟶ 3I– + S4O62–
Tiến hành xác định nồng độ Cu2+ trong 500 mL một mẫu nước như sau: Lấy 25 ml từ 500 mL một mẫu nước để tiến hành xác định nồng độ Cu2+. Sau khi thực hiện các quá trình thì dùng hết 15,4 mL dung dịch Na2S2O3 0,01 M. Xác định nồng độ của Cu2+ theo mg/L (Làm tròn đến số nguyên). 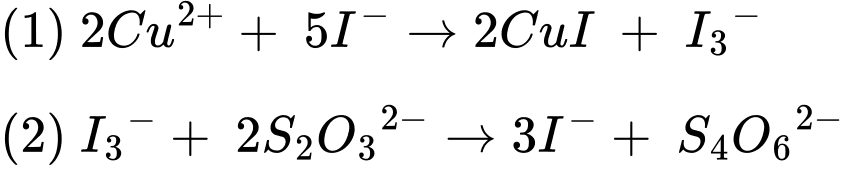
Đổi 15,4 mL = 0,0154 L
Số mol của Na2S2O3 là: nNa2S2O3 = 0,01 × 0,0154 = 1,54 × 10-4 mol
Từ PTHH số mol của Cu2+ là:
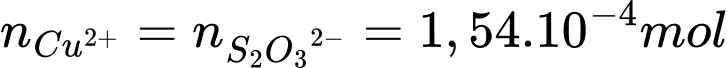
Nồng độ của Cu2+ là:
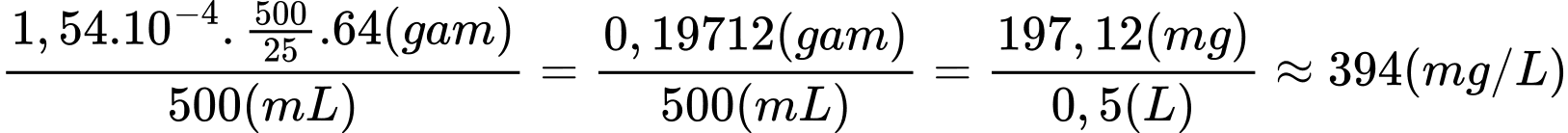
⇒ Điền đáp án: 394