PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705475]: Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác do tinh thể có kiểu mạng …(1)… và có lực liên kết …(2)… Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, lập phương tâm khối, yếu.
B, lập phương tâm diện, yếu.
C, lục giác, mạnh.
D, lập phương tâm khối, mạnh.
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác do tinh thể có kiểu mạng lập phương tâm khối và có lực liên kết yếu.
Giải thích:
– Các kim loại kiềm (Li, Na, K, Rb, Cs, Fr) có mạng tinh thể thuộc loại lập phương tâm khối, trong đó mỗi nguyên tử kim loại chỉ liên kết với 8 nguyên tử lân cận, ít hơn so với mạng lập phương tâm diện (12 liên kết) hoặc lục giác (12 liên kết). Do số liên kết ít hơn nên các kim loại kiềm có cấu trúc lỏng lẻo hơn, khối lượng riêng nhỏ và độ cứng thấp.
– Kim loại kiềm có chỉ 1 electron hóa trị ở lớp ngoài cùng (ns1), nên khả năng tạo liên kết kim loại yếu dẫn đến kim loại kiềm mềm, dễ bị cắt bằng dao và có độ cứng rất thấp so với các kim loại khác như sắt, đồng.
⇒ Chọn đáp án A Đáp án: A
Giải thích:
– Các kim loại kiềm (Li, Na, K, Rb, Cs, Fr) có mạng tinh thể thuộc loại lập phương tâm khối, trong đó mỗi nguyên tử kim loại chỉ liên kết với 8 nguyên tử lân cận, ít hơn so với mạng lập phương tâm diện (12 liên kết) hoặc lục giác (12 liên kết). Do số liên kết ít hơn nên các kim loại kiềm có cấu trúc lỏng lẻo hơn, khối lượng riêng nhỏ và độ cứng thấp.
– Kim loại kiềm có chỉ 1 electron hóa trị ở lớp ngoài cùng (ns1), nên khả năng tạo liên kết kim loại yếu dẫn đến kim loại kiềm mềm, dễ bị cắt bằng dao và có độ cứng rất thấp so với các kim loại khác như sắt, đồng.
⇒ Chọn đáp án A Đáp án: A
Câu 2 [575888]: Dung dịch hydrochloric acid tác dụng với sắt tạo thành:
A, Iron(II) chloride và khí hydrogen.
B, Iron(III) chloride và khí hydrogen.
C, Iron(II) sulfide và khí hydrogen.
D, Iron(II) chlorate và nước.
Dung dịch hydrochloric acid (HCl) tác dụng với sắt (Fe) tạo ra iron(II) chloride (FeCl2) và khí hydrogen (H2) theo phương trình phản ứng:
⇒ Chọn đáp án A Đáp án: A
Fe + 2HCl → FeCl2 + H2↑
(Lưu ý: FeCl3 (iron(III) chloride) chỉ được tạo ra nếu có tác nhân oxi hóa mạnh như Cl2 hoặc HNO3.⇒ Chọn đáp án A Đáp án: A
Câu 3 [560740]: Hợp kim nào sau đây siêu nhẹ, được dùng trong vật liệu hàng không?


A, Fe – C.
B, Fe – Cr.
C, Cu – Zn.
D, Li – Al.
Hợp kim aluminium–lithium (Li–Al) là một trong những vật liệu siêu nhẹ, có độ bền cao và chịu nhiệt tốt, rất phù hợp để sử dụng trong ngành hàng không và vũ trụ. Các hợp kim khác trong các lựa chọn không đáp ứng các yêu cầu tương tự về trọng lượng và tính năng cần thiết trong lĩnh vực này.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 4 [679452]: Tiến hành các thí nghiệm sau:
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
(a) Nhúng thanh đồng nguyên chất vào dung dịch FeCl3.
(b) Cắt miếng sắt tây (sắt tráng thiếc), để trong không khí ẩm.
(c) Nhúng thanh kẽm vào dung dịch H2SO4 loãng có nhỏ vài giọt dung dịch CuSO4.
(d) Quấn sợi dây đồng vào đinh sắt rồi nhúng vào cốc nước muối.
Trong các thí nghiệm trên, số thí nghiệm chỉ xảy ra ăn mòn hóa học là
A, 2.
B, 3.
C, 4.
D, 1.
HD: ► Điều kiện xảy ra ăn mòn điện hoá:
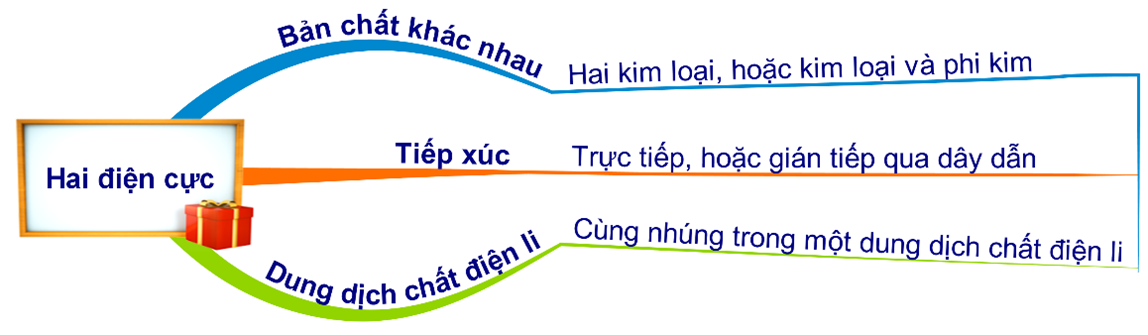
⇝ Phân tích các thí nghiệm tiến hành:
✔️ (a) Cu + FeCl3 → 2FeCl2 + CuCl2: chỉ xảy ra ăn mòn hoá học.
❌ (b) Cặp cực Fe-Sn tiếp xúc nhau, không khí ẩm là điều kiện dung dịch điện ly ⇒ xảy ra ăn mòn điện hoá học.
❌ (c) đầu tiên: Zn + CuSO4 → ZnSO4 + Cu; Cu sinh ra bám vào Zn tạo thành cặp cực trong dung dịch H2SO4 ⇒ xảy ra ăn mòn điện hoá.
❌ (d) Fe-Cu là cặp cực tiếp xúc nhau trong dung dịch điện ly là muối ⇒ xảy ra ăn mòn điện hoá.
⇝ chỉ có 1/4 thí nghiệm thoả mãn yêu cầu
⇒ Chọn đáp án D Đáp án: D

⇝ Phân tích các thí nghiệm tiến hành:
✔️ (a) Cu + FeCl3 → 2FeCl2 + CuCl2: chỉ xảy ra ăn mòn hoá học.
❌ (b) Cặp cực Fe-Sn tiếp xúc nhau, không khí ẩm là điều kiện dung dịch điện ly ⇒ xảy ra ăn mòn điện hoá học.
❌ (c) đầu tiên: Zn + CuSO4 → ZnSO4 + Cu; Cu sinh ra bám vào Zn tạo thành cặp cực trong dung dịch H2SO4 ⇒ xảy ra ăn mòn điện hoá.
❌ (d) Fe-Cu là cặp cực tiếp xúc nhau trong dung dịch điện ly là muối ⇒ xảy ra ăn mòn điện hoá.
⇝ chỉ có 1/4 thí nghiệm thoả mãn yêu cầu
⇒ Chọn đáp án D Đáp án: D
Câu 5 [575619]: Số proton, neutron và electron của ion 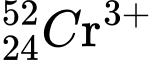 lần lượt là
lần lượt là
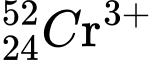 lần lượt là
lần lượt là A, 24, 28, 24.
B, 24, 28, 21.
C, 24, 30, 21.
D, 24, 28, 27.
Ion 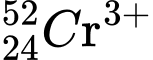 có:
có:
Số proton: p = 24.
Số neutron: n = 52 - 24 = 28.
Số electron: e = 24 - 3 = 21 (Do nguyên tử Cr có p = e = 24, nhưng ion Cr3+ đã mất đi 3e so với nguyên tử Cr).
⇒ Chọn đáp án B Đáp án: B
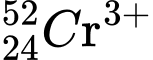 có:
có: Số proton: p = 24.
Số neutron: n = 52 - 24 = 28.
Số electron: e = 24 - 3 = 21 (Do nguyên tử Cr có p = e = 24, nhưng ion Cr3+ đã mất đi 3e so với nguyên tử Cr).
⇒ Chọn đáp án B Đáp án: B
Câu 6 [560624]: X là kim loại cứng nhất, có thể cắt được thủy tinh. X là
A, Fe.
B, W.
C, Cu.
D, Cr.
Chromium (Cr) có độ cứng cao nhất trong các kim loại. Nó có thể cắt được thủy tinh, vì thủy tinh có độ cứng kém hơn.
Tính chất đặc biệt: Cr có độ bền cơ học cao, chống ăn mòn, thường được dùng để mạ cứng lên các dụng cụ.
Ứng dụng: Chế tạo thép không gỉ, dụng cụ cắt gọt, lớp phủ bảo vệ.
⇒ Chọn đáp án D Đáp án: D
Tính chất đặc biệt: Cr có độ bền cơ học cao, chống ăn mòn, thường được dùng để mạ cứng lên các dụng cụ.
Ứng dụng: Chế tạo thép không gỉ, dụng cụ cắt gọt, lớp phủ bảo vệ.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [190529]: Bromomethane (CH3Br) được sử dụng làm chất để tiêu diệt côn trùng gây hại trong hạt. Bromomethane có thể được tạo ra bằng cách cho methanol phản ứng với hydrogen bromide theo phương trình sau:
CH3OH + HBr ⟶ CH3Br + H2O.
Phản ứng trên thuộc loại phản ứng nào?
CH3OH + HBr ⟶ CH3Br + H2O.
Phản ứng trên thuộc loại phản ứng nào?
A, Phản ứng cộng.
B, Phản ứng thế.
C, Phản ứng tách.
D, Phản ứng oxi hóa.
CH3OH + HBr ⟶ CH3Br + H2O.
Nguyên tử Br đã thay thế nhóm OH trong alcohol ⇒ Phản ứng trên là phản ứng thế.
⇒ Đáp án B Đáp án: B
Nguyên tử Br đã thay thế nhóm OH trong alcohol ⇒ Phản ứng trên là phản ứng thế.
⇒ Đáp án B Đáp án: B
Câu 8 [304780]: Chất nào sau đây tồn tại ở thể lỏng trong điều kiện thường?
A, CH3CH3.
B, CH≡CH.
C, CH2=CH2.
D, HCOOCH3.
HD: Chú ý các hydrocarbon có số carbon ≤ 4 thường là chất khí ở điều kiện thường. Còn với HCOOCH3 là một ester, như phần tính chất vật lí ta biết: "Ở điều kiện thường, các ester đều ở thể lỏng hoặc rắn." HCOOCH3 là chất lỏng ở điều kiện thường.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 9 [705476]: Các nhiên liệu khi cháy cần có sự tham gia của oxygen. Nồng độ của oxygen ảnh hưởng đến tốc độ của phản ứng cháy. Biểu thức tốc độ phản ứng cháy của các nhiên liệu như sau: 
Với hệ số a và b tương ứng như sau:
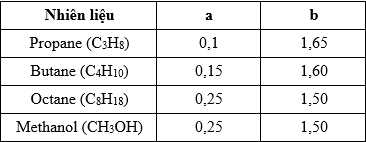
Sự gia tăng nồng độ O2 làm cho phản ứng cháy của loại nhiên liệu nào trở nên mãnh liệt nhất?

Với hệ số a và b tương ứng như sau:

Sự gia tăng nồng độ O2 làm cho phản ứng cháy của loại nhiên liệu nào trở nên mãnh liệt nhất?
A, Propane.
B, Butane.
C, Octane.
D, Methanol và octane.
Biểu thức tốc độ phản ứng ứng với các nhiên liệu là:
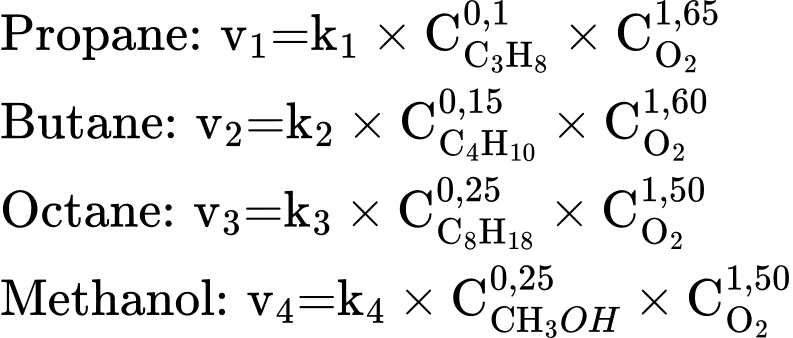
Ta nhận thấy ra khi đốt propane với hệ số b = 1,65 lớn nhất thì khi gia tăng nồng độ của O2 làm cho phản ứng cháy của propane trở nên mãnh liệt nhất.
⇒ Chọn đáp án A Đáp án: A
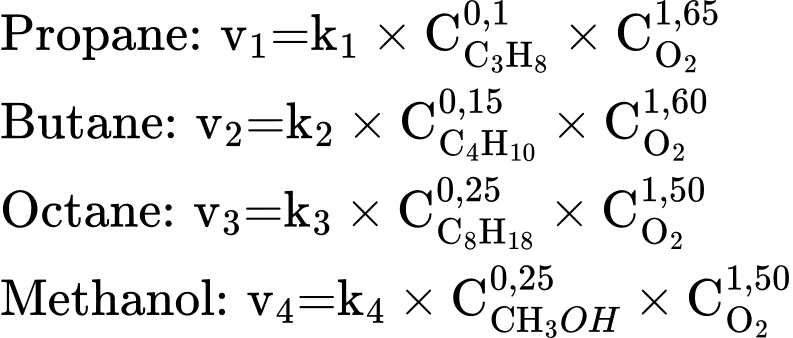
Ta nhận thấy ra khi đốt propane với hệ số b = 1,65 lớn nhất thì khi gia tăng nồng độ của O2 làm cho phản ứng cháy của propane trở nên mãnh liệt nhất.
⇒ Chọn đáp án A Đáp án: A
Câu 10 [705477]: Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Đề khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít hoá chất có sẵn trong nhà. Hãy chọn hoá chất thích hợp:
A, Phèn chua.
B, Giấm ăn.
C, Muối ăn.
D, Nước gừng tươi.
Mùi khai còn lại trên tã lót là do ammonia (NH3), một hợp chất có tính base yếu.
Giấm ăn chứa acetic acid (CH3COOH), có thể phản ứng với ammonia theo phương trình:
NH3 + CH3COOH → CH3COO−NH4+
Sản phẩm tạo thành là muối ammonium acetate, tan tốt trong nước và không có mùi khai. Vì vậy, giấm ăn giúp khử mùi ammonia hiệu quả.
⇒ Chọn đáp án B Đáp án: B
Giấm ăn chứa acetic acid (CH3COOH), có thể phản ứng với ammonia theo phương trình:
NH3 + CH3COOH → CH3COO−NH4+
Sản phẩm tạo thành là muối ammonium acetate, tan tốt trong nước và không có mùi khai. Vì vậy, giấm ăn giúp khử mùi ammonia hiệu quả.
⇒ Chọn đáp án B Đáp án: B
Câu 11 [308569]: Cho vài giọt phenolphthalein vào dung dịch ethylamine thì dung dịch chuyển thành
A, màu hồng.
B, màu đỏ.
C, màu tím.
D, màu xanh.
Ethylamine có tính base yếu nên sẽ làm phenolphtalein chuyển thành màu hồng.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 12 [308237]: Chất nào sau đây thuộc loại polysaccharide?
A, Glucose.
B, Fructose.
C, Saccharose.
D, Cellulose.
HD: Bài học phân loại hợp chất carbohydrate:
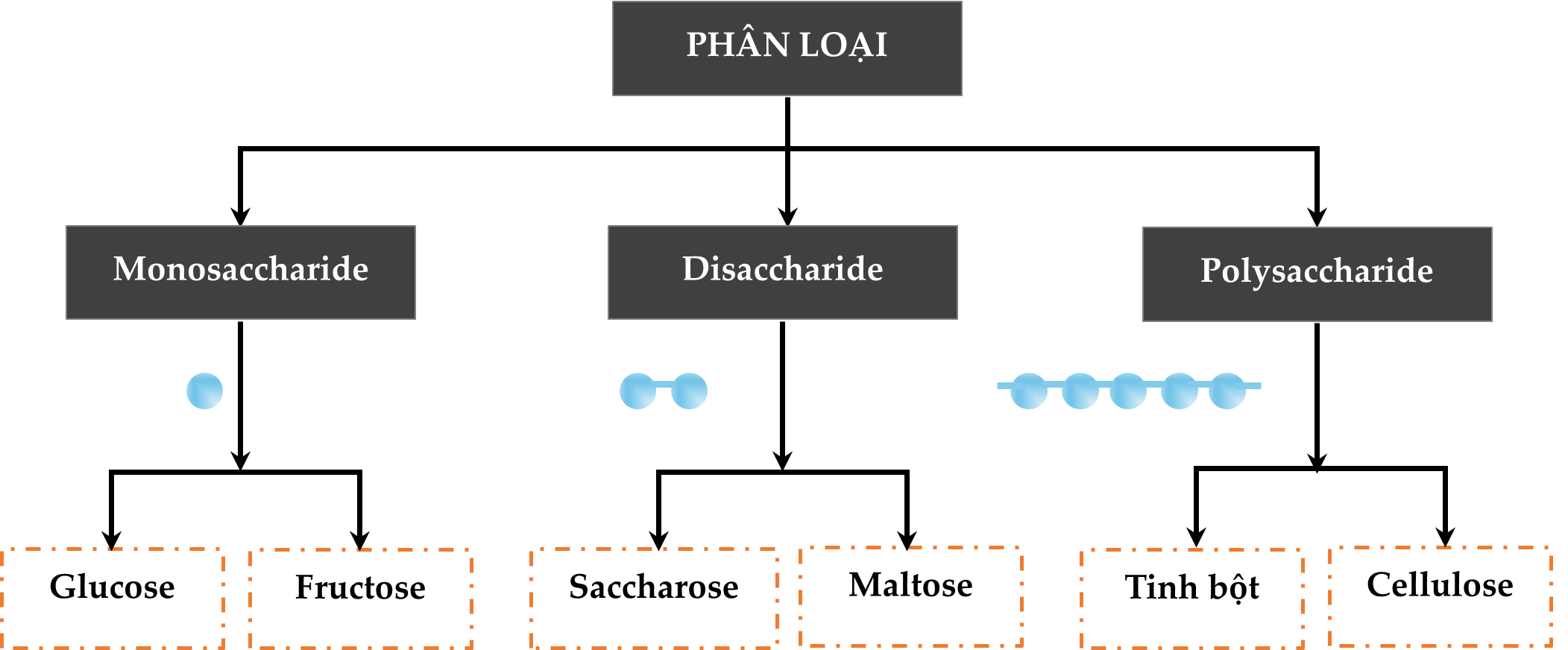
⇒ Cellulose là một loại polysaccharide
⇒ Chọn đáp án D Đáp án: D

⇒ Cellulose là một loại polysaccharide
⇒ Chọn đáp án D Đáp án: D
Câu 13 [705478]: Acid trong dịch dạ dày có thành phần chủ yếu là HCl. Khi nồng độ acid trong dịch dạ dày quá cao sẽ dẫn đến tình trạng dư thừa acid, gây ra nhiều bệnh lí. Sữa magiê có dạng huyền phù, chứa thành phần chính là Mg(OH)2 được sử dụng như một loại thuốc kháng acid trong dạ dày. Nếu dạ dày chứa 200 mL dung dịch HCl có pH = 1,5 thì khối lượng tối thiểu Mg(OH)2 trong sữa magiê cần dùng để trung hòa toàn bộ lượng HCl này là bao nhiêu (làm tròn kết quả đến chữ số hàng phần mười)?
A, 91,7 mg.
B, 183,4 mg.
C, 348,0 mg.
D, 3,5 gam.
Đổi 200 mL = 0,2 L
Ta có pH = 1,5 → Nồng độ H+ trong dạ dày là [H+] = 10-1,5 M
Số mol H+ là: nH+ = 10-1,5 × 0,2 = 0,006325 mol
PTHH: Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O
Từ phương trình số mol của Mg(OH)2 là: nMg(OH)2 = nH+ ÷ 2 = 0,006325 ÷ 2 = 0,0031625 (mol)
Khối lượng của Mg(OH)2 trong “sữa magiê” cần dùng là:
mMg(OH)2 = 0,0031625 × 58 = 0,183425 (g) ≈ 183,4 (mg)
⇒ Chọn đáp án B Đáp án: B
Ta có pH = 1,5 → Nồng độ H+ trong dạ dày là [H+] = 10-1,5 M
Số mol H+ là: nH+ = 10-1,5 × 0,2 = 0,006325 mol
PTHH: Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O
Từ phương trình số mol của Mg(OH)2 là: nMg(OH)2 = nH+ ÷ 2 = 0,006325 ÷ 2 = 0,0031625 (mol)
Khối lượng của Mg(OH)2 trong “sữa magiê” cần dùng là:
mMg(OH)2 = 0,0031625 × 58 = 0,183425 (g) ≈ 183,4 (mg)
⇒ Chọn đáp án B Đáp án: B
Câu 14 [305731]: Muốn chuyển chất béo từ thể lỏng sang thể rắn, người ta tiến hành
A, Đun chất béo với H2 (xúc tác Ni).
B, Đun chất béo với dung dịch HNO3.
C, Đun chất béo với dung dịch NaOH.
D, Đun chất béo với dung dịch H2SO4 loãng.
HD: Chất béo lỏng chứa các gốc hyrocarbon không no (chưa bão hòa) ⇝ tiến hành phản ứng hydrogen hóa chuyển chúng thành các gốc no ⇝ chất béo mới sẽ trở nên cứng hơn:
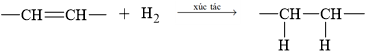
► Chú ý, trong thực tế: Dầu thực vật hydrogen hóa một phần được phát triển một phần để giúp thay thế chất béo động vật có độ bão hòa cao được sử dụng trong chiên, nướng và phết. Điều quan trọng của quá trình hydrogen hoá là không để phản ứng xảy ra hoàn toàn, không làm bão hòa hoàn toàn tất cả các liên kết đôi (tức không phá vỡ tất cả các liên kết đôi). Bởi nếu bão hòa hoàn toàn thì sản phẩm sẽ bị cứng giống như sáp - không phải là loại sản phẩm mềm, mịn như kem mà người tiêu dùng mong muốn.
⇒ Chọn đáp án A Đáp án: A
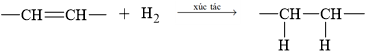
► Chú ý, trong thực tế: Dầu thực vật hydrogen hóa một phần được phát triển một phần để giúp thay thế chất béo động vật có độ bão hòa cao được sử dụng trong chiên, nướng và phết. Điều quan trọng của quá trình hydrogen hoá là không để phản ứng xảy ra hoàn toàn, không làm bão hòa hoàn toàn tất cả các liên kết đôi (tức không phá vỡ tất cả các liên kết đôi). Bởi nếu bão hòa hoàn toàn thì sản phẩm sẽ bị cứng giống như sáp - không phải là loại sản phẩm mềm, mịn như kem mà người tiêu dùng mong muốn.
⇒ Chọn đáp án A Đáp án: A
Câu 15 [705479]: “Keo dán là loại vật liệu có khả năng ...(1)... bề mặt của hai vật liệu rắn với nhau mà ...(2)... bản chất của các vật liệu được kết dính”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, tách rời, thay đổi.
B, nối liền, không làm thay đổi.
C, kết dính, không làm thay đổi.
D, tách rời, không làm thay đổi.
Keo dán là loại vật liệu có khả năng kết dính bề mặt của hai vật liệu rắn với nhau mà không làm thay đổi bản chất của các vật liệu được kết dính.
Giải thích:
- Keo dán chỉ bám lên bề mặt của hai vật liệu và tạo liên kết giữa chúng. Hai vật liệu vẫn là hai phần riêng biệt, chỉ được gắn kết lại nhờ keo. Khi nói "nối liền", ta thường nghĩ đến các phương pháp như hàn, nung chảy, hay ghép cơ khí, trong đó các vật liệu có thể hòa trộn hoặc thay đổi cấu trúc để tạo thành một thể thống nhất.
- Khi sử dụng keo, vật liệu không bị biến đổi về tính chất hóa học hay vật lí. Khác với hàn hay nung chảy (có thể làm thay đổi cấu trúc kim loại), keo chỉ bám dính lên bề mặt mà không làm biến đổi cấu trúc bên trong của vật liệu. Điều này giúp các vật liệu giữ nguyên đặc tính ban đầu sau khi được dán.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
- Keo dán chỉ bám lên bề mặt của hai vật liệu và tạo liên kết giữa chúng. Hai vật liệu vẫn là hai phần riêng biệt, chỉ được gắn kết lại nhờ keo. Khi nói "nối liền", ta thường nghĩ đến các phương pháp như hàn, nung chảy, hay ghép cơ khí, trong đó các vật liệu có thể hòa trộn hoặc thay đổi cấu trúc để tạo thành một thể thống nhất.
- Khi sử dụng keo, vật liệu không bị biến đổi về tính chất hóa học hay vật lí. Khác với hàn hay nung chảy (có thể làm thay đổi cấu trúc kim loại), keo chỉ bám dính lên bề mặt mà không làm biến đổi cấu trúc bên trong của vật liệu. Điều này giúp các vật liệu giữ nguyên đặc tính ban đầu sau khi được dán.
⇒ Chọn đáp án C Đáp án: C
Câu 16 [705480]: Aspirin được sử dụng làm thuốc giảm đau, hạ sốt. Aspirin được tổng hợp bằng cách đun hỗn hợp salicylic acid và anhydride acetic khi có mặt xúc tác sulfuric acid đặc theo phương trình hóa học sau:
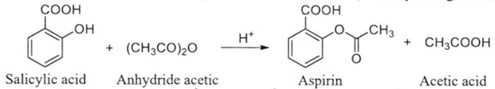
Hỗn hợp sau phản ứng được làm lạnh để tạo tinh thể aspirin. Sau đó tiến hành lọc, rửa, làm khô sản phẩm và đem cân để tính hiệu suất phản ứng. Trong các phát biểu sau:
(a) Phản ứng tổng hợp aspirin là phản ứng oxi hóa – khử trong đó acid đóng vai trò xúc tác.
(b) Nếu không làm khô sản phẩm thì hiệu suất phản ứng tính được sẽ cao hơn thực tế.
(c) Quá trình rửa sản phẩm giúp tăng độ tinh khiết của aspirin tổng hợp được.
(d) 1 mol aspirin tác dụng tối đa với 1 mol NaOH trong dung dịch.
Số phát biểu đúng là

Hỗn hợp sau phản ứng được làm lạnh để tạo tinh thể aspirin. Sau đó tiến hành lọc, rửa, làm khô sản phẩm và đem cân để tính hiệu suất phản ứng. Trong các phát biểu sau:
(a) Phản ứng tổng hợp aspirin là phản ứng oxi hóa – khử trong đó acid đóng vai trò xúc tác.
(b) Nếu không làm khô sản phẩm thì hiệu suất phản ứng tính được sẽ cao hơn thực tế.
(c) Quá trình rửa sản phẩm giúp tăng độ tinh khiết của aspirin tổng hợp được.
(d) 1 mol aspirin tác dụng tối đa với 1 mol NaOH trong dung dịch.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
❌ (a) – Sai. Phản ứng tổng hợp aspirin không có sự thay đổi số oxi hóa của các nguyên tử trong phản ứng nên không phải là phản ứng oxi hóa – khử.
✔️ (b) – Đúng Nếu không làm khô sản phẩm thì sản phẩm thu được có cả nước nên làm cho khối lượng không đúng với thực tế.
✔️ (c) – Đúng. Việc rửa sản phẩm giúp làm loại bỏ các tạp chất có trong sản phẩm.
❌ (d) – Sai. Trong phân tử aspirin có 1 nhóm chức ester (trong đó gốc CH3COO- gắn vào vòng thơm) và 1 nhóm chức carboxylic acid nên có thể tác dụng với NaOH theo tỉ lệ: 1 mol aspirin: 3 mol NaOH.
Các phát biểu đúng là (b) (c)
⇒ Chọn đáp án B Đáp án: B
❌ (a) – Sai. Phản ứng tổng hợp aspirin không có sự thay đổi số oxi hóa của các nguyên tử trong phản ứng nên không phải là phản ứng oxi hóa – khử.
✔️ (b) – Đúng Nếu không làm khô sản phẩm thì sản phẩm thu được có cả nước nên làm cho khối lượng không đúng với thực tế.
✔️ (c) – Đúng. Việc rửa sản phẩm giúp làm loại bỏ các tạp chất có trong sản phẩm.
❌ (d) – Sai. Trong phân tử aspirin có 1 nhóm chức ester (trong đó gốc CH3COO- gắn vào vòng thơm) và 1 nhóm chức carboxylic acid nên có thể tác dụng với NaOH theo tỉ lệ: 1 mol aspirin: 3 mol NaOH.
Các phát biểu đúng là (b) (c)
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Hemoglobin là thành phần cấu tạo nên hồng cầu trong các mạch máu. Mỗi phân tử hemoglobin chứa 4 heme B. Heme B kết hợp thêm một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mô. Heme B cũng kết hợp được với phân tử carbon monoxide (CO). Khi con người hít thở không khí có nồng độ CO cao (như không khí ở các đám cháy, không khí trong nhà kín có đốt than để sưởi ấm có thể bị hôn mê, thậm chí tử vong.
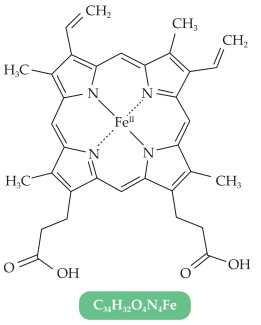

Câu 17 [705481]: Trong heme B có bao nhiêu phối tử liên kết với nguyên tử trung tâm.
A, 1.
B, 2.
C, 3.
D, 4.
Phối tử đa càng là loại phối tử có nhiều vị trí liên kết với ion trung tâm, nhưng vẫn được xem là một phối tử duy nhất.
Trong heme B, vòng porphyrin đóng vai trò như một phối tử, liên kết với nguyên tử trung tâm Fe(II) bằng 4 nguyên tử nitrogen.
Mặc dù có 4 liên kết, nhưng vì chúng đều thuộc một vòng porphyrin, nên chỉ được tính là một phối tử.
⇒ Chọn đáp án A Đáp án: A
Trong heme B, vòng porphyrin đóng vai trò như một phối tử, liên kết với nguyên tử trung tâm Fe(II) bằng 4 nguyên tử nitrogen.
Mặc dù có 4 liên kết, nhưng vì chúng đều thuộc một vòng porphyrin, nên chỉ được tính là một phối tử.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [705482]: Phát biểu nào dưới đây không đúng?
A, Nguyên tử trung tâm trong heme B là Fe.
B, Mỗi phân tử hemoglobin có khả năng kết hợp tối đa với 4 phân tử O2.
C, Liên kết giữa heme B với CO bền hơn liên kết giữa heme B với O2.
D, Dạng hình học của heme B là bát diện.
Phân tích các phát biểu:
✔️ A. Đúng. Trong heme B, nguyên tử trung tâm là sắt (Fe(II)), liên kết với vòng porphyrin.
✔️B. Đúng. Mỗi phân tử hemoglobin (Hb) có 4 tiểu đơn vị, mỗi tiểu đơn vị chứa 1 nhóm heme B.Mỗi heme B có thể liên kết với 1 phân tử O2, nên tối đa 1 hemoglobin có thể gắn 4 O2.
✔️ C. Đúng. Liên kết giữa Fe và CO trong heme B bền hơn liên kết giữa Fe và O2 gấp ~200-250 lần.Điều này giải thích tại sao CO rất độc, vì nó chiếm chỗ của O2 trong hemoglobin, khiến máu không vận chuyển được oxygen.
❌ D. Sai. Chỉ có 4 liên kết N-Fe nên không tạo hình bát diện.
⇒ Chọn đáp án D Đáp án: D
✔️ A. Đúng. Trong heme B, nguyên tử trung tâm là sắt (Fe(II)), liên kết với vòng porphyrin.
✔️B. Đúng. Mỗi phân tử hemoglobin (Hb) có 4 tiểu đơn vị, mỗi tiểu đơn vị chứa 1 nhóm heme B.Mỗi heme B có thể liên kết với 1 phân tử O2, nên tối đa 1 hemoglobin có thể gắn 4 O2.
✔️ C. Đúng. Liên kết giữa Fe và CO trong heme B bền hơn liên kết giữa Fe và O2 gấp ~200-250 lần.Điều này giải thích tại sao CO rất độc, vì nó chiếm chỗ của O2 trong hemoglobin, khiến máu không vận chuyển được oxygen.
❌ D. Sai. Chỉ có 4 liên kết N-Fe nên không tạo hình bát diện.
⇒ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705483]: Tiến hành các thí nghiệm:
▪ Bước 1: Cho vào ống nghiệm khoảng 1 mL dung dịch Na2CO3. Dùng giấy chỉ thị pH để kiểm tra môi trường dung dịch.
▪ Bước 2: Thêm tiếp 2 mL dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
▪ Bước 1: Cho vào ống nghiệm khoảng 1 mL dung dịch Na2CO3. Dùng giấy chỉ thị pH để kiểm tra môi trường dung dịch.
▪ Bước 2: Thêm tiếp 2 mL dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
Bước 1:
- Dung dịch Na2CO3 là muối của acid yếu (H2CO3) và base mạnh (NaOH), nên có tính base yếu.
- Khi dùng giấy chỉ thị pH, nó sẽ chuyển sang màu đặc trưng cho môi trường base (thường là xanh hoặc xanh lục tùy loại giấy).
Bước 2:
- Khi thêm HCl vào dung dịch Na2CO3, xảy ra phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
→ Có khí CO2 thoát ra, không tạo kết tủa.
- Khi đưa que diêm đang cháy đến miệng ống nghiệm, khí CO2 sinh ra không duy trì sự cháy, nên que diêm tắt.
Phân tích các phát biểu:
❌ (a) Sai. Dung dịch Na2CO3 có tính base yếu, giấy chỉ thị pH sẽ chuyển sang màu xanh đặc trưng cho môi trường base.
❌ (b) Sai. Phản ứng tạo ra khí CO2 và nước, không có kết tủa:
2HCl + Na2CO3 → 2NaCl + H2O + CO2
✔️ (c) Đúng. Khí sinh ra sau phản ứng là CO2 không duy trì sự sống và sự cháy.
✔️ (d) Đúng. Khi cho acid (chứa ion H+) vào dung dịch có ion CO32-, sẽ xảy ra phản ứng tạo khí CO2 bay lên.
- Dung dịch Na2CO3 là muối của acid yếu (H2CO3) và base mạnh (NaOH), nên có tính base yếu.
- Khi dùng giấy chỉ thị pH, nó sẽ chuyển sang màu đặc trưng cho môi trường base (thường là xanh hoặc xanh lục tùy loại giấy).
Bước 2:
- Khi thêm HCl vào dung dịch Na2CO3, xảy ra phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
→ Có khí CO2 thoát ra, không tạo kết tủa.
- Khi đưa que diêm đang cháy đến miệng ống nghiệm, khí CO2 sinh ra không duy trì sự cháy, nên que diêm tắt.
Phân tích các phát biểu:
❌ (a) Sai. Dung dịch Na2CO3 có tính base yếu, giấy chỉ thị pH sẽ chuyển sang màu xanh đặc trưng cho môi trường base.
❌ (b) Sai. Phản ứng tạo ra khí CO2 và nước, không có kết tủa:
2HCl + Na2CO3 → 2NaCl + H2O + CO2
✔️ (c) Đúng. Khí sinh ra sau phản ứng là CO2 không duy trì sự sống và sự cháy.
✔️ (d) Đúng. Khi cho acid (chứa ion H+) vào dung dịch có ion CO32-, sẽ xảy ra phản ứng tạo khí CO2 bay lên.
Câu 20 [705484]: Một vài giọt dung dịch hỗn hợp amino acid được nhỏ vào giữa một tờ giấy lọc (hoặc gel). Khi tờ giấy (hoặc gel) được đặt trong dung dịch đệm (giữ ổn định pH = 5) giữa hai điện cực và một điện trường được áp dụng, kết quả sau khi điện di được thể hiện như dưới đây:
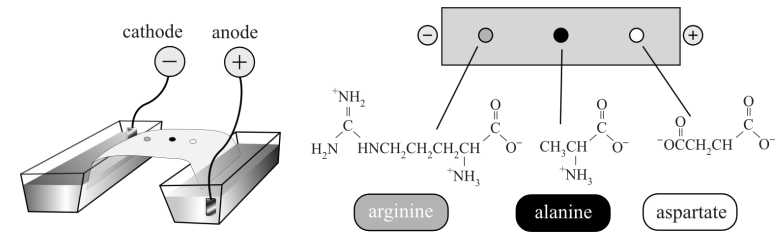

Phân tích các phát biểu:
✔️ (a) Đúng. Tại pH = 5, alanine tồn tại chủ yếu ở dạng trung hòa về điện với tổng điện tích bằng 0.
CH3–CH(NH3+)–COO–
✔️ (b) Đúng. Tại pH = 5, aspartate tồn tại chủ yếu ở dạng anion bị phân li tất cả ion H+ trong gốc COOH.
✔️ (c) Đúng. Tại pH = 5, dạng tồn tại của arginine là dạng cation với tổng điện tích là +1 di chuyển về cực âm trong điện trường.
✔️ (d) Đúng. pH càng thấp thì dạng tồn tại chủ yếu của amino acid là dạng cation càng nhiều nguyên tử H, do dễ nhận thêm proton (H+)
✔️ (a) Đúng. Tại pH = 5, alanine tồn tại chủ yếu ở dạng trung hòa về điện với tổng điện tích bằng 0.
CH3–CH(NH3+)–COO–
✔️ (b) Đúng. Tại pH = 5, aspartate tồn tại chủ yếu ở dạng anion bị phân li tất cả ion H+ trong gốc COOH.
✔️ (c) Đúng. Tại pH = 5, dạng tồn tại của arginine là dạng cation với tổng điện tích là +1 di chuyển về cực âm trong điện trường.
✔️ (d) Đúng. pH càng thấp thì dạng tồn tại chủ yếu của amino acid là dạng cation càng nhiều nguyên tử H, do dễ nhận thêm proton (H+)
Câu 21 [705485]: Tiến hành thí nghiệm của hexane với dung dịch potassium permanganate (thuốc tím, KMnO4) như sau:
▪ Bước 1: Cho khoảng 1 mL hexane vào ống nghiệm.
▪ Bước 2: Thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút.
Biết rằng hexane có khối lượng riêng nhỏ hơn dung dịch potassium permanganate.
▪ Bước 1: Cho khoảng 1 mL hexane vào ống nghiệm.
▪ Bước 2: Thêm vài giọt dung dịch KMnO4 1%, lắc đều ống nghiệm trong khoảng 5 phút, sau đó đặt ống nghiệm vào giá rồi để yên khoảng 10 phút.
Biết rằng hexane có khối lượng riêng nhỏ hơn dung dịch potassium permanganate.
Bước 1:
- Hexane (C6H14) là một hydrocarbon thuộc nhóm alkane (paraffin), không tan trong nước, nhẹ hơn nước.
- KMnO4 tan tốt trong nước, tạo dung dịch màu tím.
Bước 2:
- Khi thêm dung dịch KMnO₄ vào hexane, do hexane không tan trong nước, hỗn hợp sẽ tạo hai lớp chất lỏng:
+ Lớp trên: Hexane (nhẹ hơn).
+ Lớp dưới: Dung dịch KMnO4 trong nước (nặng hơn).
- Vì hexane là alkane (chỉ có liên kết đơn σ, không có liên kết đôi C=C như alkene hay alkyn), nên nó không phản ứng với KMnO4 ở điều kiện thường.
- KMnO4 tan chủ yếu trong nước, không tan tốt trong hexane.
Phân tích các phát biểu:
✔️ (a) Đúng. KMnO4 là hợp chất ion, tan tốt trong dung môi phân cực như nước, nhưng không tan trong hexane (một dung môi không phân cực).
✔️ (b) Đúng. Hexane không tan trong nước và có khối lượng riêng nhỏ hơn nước nên nổi ở trên. Lớp dưới là KMnO4.
❌ (c) Sai. KMnO4 tan trong nước (lớp dưới), còn lớp trên là hexane không chứa KMnO4, nên không có màu tím.
✔️ (d) Đúng. Hexane là alkane, chỉ có liên kết đơn C-C và C-H rất bền, không dễ bị oxi hóa bởi KMnO4 ở điều kiện thường.
- Hexane (C6H14) là một hydrocarbon thuộc nhóm alkane (paraffin), không tan trong nước, nhẹ hơn nước.
- KMnO4 tan tốt trong nước, tạo dung dịch màu tím.
Bước 2:
- Khi thêm dung dịch KMnO₄ vào hexane, do hexane không tan trong nước, hỗn hợp sẽ tạo hai lớp chất lỏng:
+ Lớp trên: Hexane (nhẹ hơn).
+ Lớp dưới: Dung dịch KMnO4 trong nước (nặng hơn).
- Vì hexane là alkane (chỉ có liên kết đơn σ, không có liên kết đôi C=C như alkene hay alkyn), nên nó không phản ứng với KMnO4 ở điều kiện thường.
- KMnO4 tan chủ yếu trong nước, không tan tốt trong hexane.
Phân tích các phát biểu:
✔️ (a) Đúng. KMnO4 là hợp chất ion, tan tốt trong dung môi phân cực như nước, nhưng không tan trong hexane (một dung môi không phân cực).
✔️ (b) Đúng. Hexane không tan trong nước và có khối lượng riêng nhỏ hơn nước nên nổi ở trên. Lớp dưới là KMnO4.
❌ (c) Sai. KMnO4 tan trong nước (lớp dưới), còn lớp trên là hexane không chứa KMnO4, nên không có màu tím.
✔️ (d) Đúng. Hexane là alkane, chỉ có liên kết đơn C-C và C-H rất bền, không dễ bị oxi hóa bởi KMnO4 ở điều kiện thường.
Câu 22 [705486]: Một bạn học sinh muốn xác nhận xem chiếc vòng tay của mình đang đeo có được làm bằng silver (bạc) nguyên chất hay không. Một thí nghiệm đơn giản đã được thiết lập như hình dưới đây:
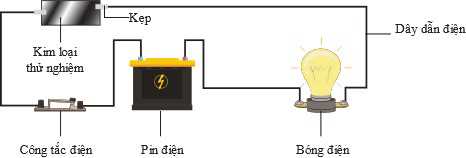
Thay lần lượt chiếc vòng tay và miếng bạc nguyên chất vào vị trí của kim loại thử nghiệm, so sánh độ sáng của bóng đèn giữa các lần thử. Kết quả thí nghiệm được cho trong bảng:
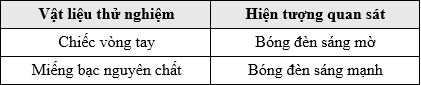

Thay lần lượt chiếc vòng tay và miếng bạc nguyên chất vào vị trí của kim loại thử nghiệm, so sánh độ sáng của bóng đèn giữa các lần thử. Kết quả thí nghiệm được cho trong bảng:

Chiếc vòng tay làm bóng đèn sáng mờ, trong khi miếng bạc nguyên chất làm bóng đèn sáng mạnh.
Điều này chứng tỏ cả hai vật liệu đều dẫn điện, nhưng bạc nguyên chất dẫn điện tốt hơn chiếc vòng tay.
Phân tích các phát biểu:
✔️ (a) Đúng. Cả hai đều làm bóng đèn sáng, chứng tỏ có dòng điện chạy qua.
✔️ (b) Đúng. Bạc nguyên chất có độ dẫn điện cao hơn nên làm bóng đèn sáng mạnh hơn.
✔️ (c) Đúng. Kim loại có khả năng dẫn điện vì trong tinh thể kim loại, các electron liên kết yếu với hạt nhân, chuyển động tự do trong toàn bộ mạng tinh thể.
✔️ (d) Đúng. Nếu chiếc vòng là bạc nguyên chất thì bóng đèn phải sáng mạnh như khi thử với miếng bạc nguyên chất. Nhưng thực tế, bóng đèn chỉ sáng mờ, chứng tỏ chiếc vòng có lẫn tạp chất hoặc không phải bạc nguyên chất.
Phân tích các phát biểu:
✔️ (a) Đúng. Cả hai đều làm bóng đèn sáng, chứng tỏ có dòng điện chạy qua.
✔️ (b) Đúng. Bạc nguyên chất có độ dẫn điện cao hơn nên làm bóng đèn sáng mạnh hơn.
✔️ (c) Đúng. Kim loại có khả năng dẫn điện vì trong tinh thể kim loại, các electron liên kết yếu với hạt nhân, chuyển động tự do trong toàn bộ mạng tinh thể.
✔️ (d) Đúng. Nếu chiếc vòng là bạc nguyên chất thì bóng đèn phải sáng mạnh như khi thử với miếng bạc nguyên chất. Nhưng thực tế, bóng đèn chỉ sáng mờ, chứng tỏ chiếc vòng có lẫn tạp chất hoặc không phải bạc nguyên chất.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705487]: Cần bao nhiêu tấn quặng manhetit chứa 75% Fe3O4 để có thể sản xuất được 450 tấn gang có hàm lượng sắt là 96%. Biết rằng trong quá trình sản xuất, lượng sắt bị hao hụt là 1%. (làm tròn đáp án đến chứ số hàng đơn vị).
Khối lượng sắt trong 450 tấn gang là: mFe = 450 × 96% = 432 tấn
Trong quá trình sản xuất lượng sắt bị hao hụt 1% → Hiệu suất của quá trình là 99%
Gọi x (tấn) là khối lượng Fe3O4 ban đầu, ta có sơ đồ phản ứng:
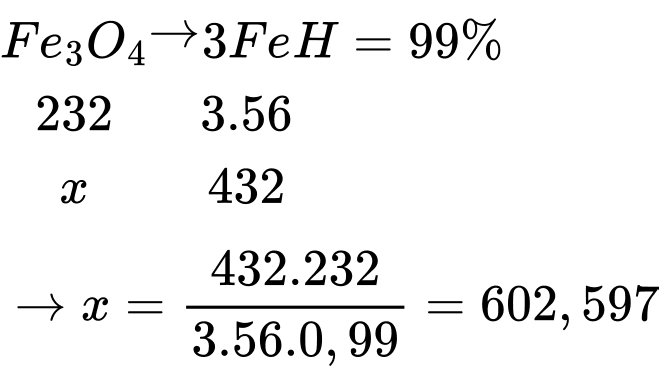
Khối lượng quặng magnetite là: mquặng = 602,597 ÷ 0,75 = 803,463 tấn ≈ 803 tấn
⇒ Điền đáp án: 803
Trong quá trình sản xuất lượng sắt bị hao hụt 1% → Hiệu suất của quá trình là 99%
Gọi x (tấn) là khối lượng Fe3O4 ban đầu, ta có sơ đồ phản ứng:
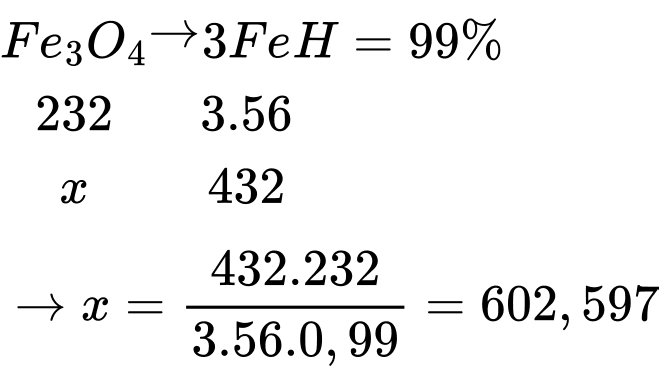
Khối lượng quặng magnetite là: mquặng = 602,597 ÷ 0,75 = 803,463 tấn ≈ 803 tấn
⇒ Điền đáp án: 803
Câu 24 [684450]: Cho các tác nhân phản ứng:
(a) H2/Pd, to
(b) LiAlH4
(c) NaBH4
(d) nước bromine.
Có bao nhiêu tác nhân ở trên có thể chuyển hóa RCHO thành RCH2OH?
Điền đáp án: __________
(a) H2/Pd, to
(b) LiAlH4
(c) NaBH4
(d) nước bromine.
Có bao nhiêu tác nhân ở trên có thể chuyển hóa RCHO thành RCH2OH?
Điền đáp án: __________
Ta có các phản ứng:
a.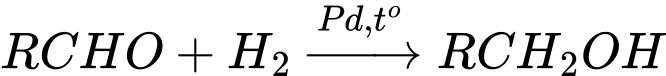
b. RCHO + LiAlH4 → RCH2OH
c. RCHO + NaBH4 + 3H2O → RCH2OH + NaB(OH)4
d. RCHO + Br2 → RCHBr2
Các tác nhân có thể chuyển RCHO thành RCH2OH là : (a), (b), (c)
⇒ Điền đáp án: 3
a.
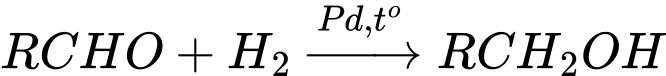
b. RCHO + LiAlH4 → RCH2OH
c. RCHO + NaBH4 + 3H2O → RCH2OH + NaB(OH)4
d. RCHO + Br2 → RCHBr2
Các tác nhân có thể chuyển RCHO thành RCH2OH là : (a), (b), (c)
⇒ Điền đáp án: 3
Câu 25 [705488]: Vitamin C (ascorbic acid) chứa 40,92% C, 4,58% H và 54,50% O về khối lượng. Hình sau đây là phổ khối lượng của ascorbic acid:
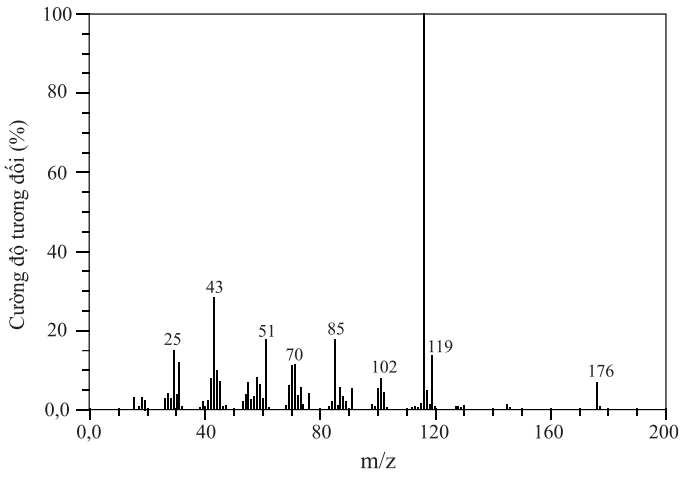
Trong phân tử của ascorbic acid có bao nhiêu nguyên tử oxygen?

Trong phân tử của ascorbic acid có bao nhiêu nguyên tử oxygen?
Từ phổ khối lượng phân tử khối của vitamin C là 176.
Gọi số nguyên tử O trong vitamin C là a, ta có:
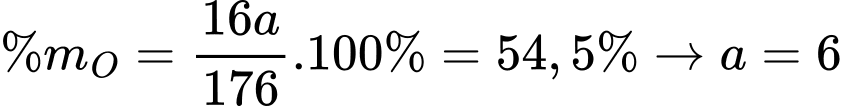
⇒ Điền đáp án: 6
Gọi số nguyên tử O trong vitamin C là a, ta có:
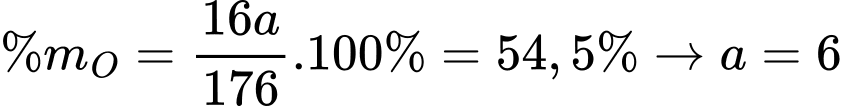
⇒ Điền đáp án: 6
Câu 26 [705489]: Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I–). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định.
Cho biết: MLi = 7 g/mol; hằng số Faraday là 96500 C/mol; I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
Nếu pin hoạt động ở cường độ dòng điện ổn định là 2,5.10-5 A thì một pin được chế tạo bởi 0,6 gam lithium có thể hoạt động tối đa trong thời gian bao nhiêu năm (Làm tròn đến hàng phần mười)?
Cho biết: MLi = 7 g/mol; hằng số Faraday là 96500 C/mol; I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
Nếu pin hoạt động ở cường độ dòng điện ổn định là 2,5.10-5 A thì một pin được chế tạo bởi 0,6 gam lithium có thể hoạt động tối đa trong thời gian bao nhiêu năm (Làm tròn đến hàng phần mười)?
Số mol của Li là: nLi = 0,6 ÷ 7 (mol)
Quá trình xảy ra trong pin:
Anode (-):
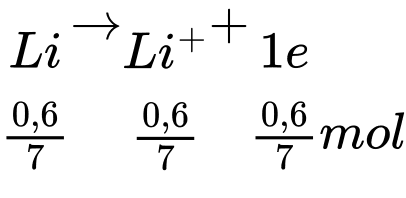
Số năm pin lithium có thể hoạt động tối đa là:
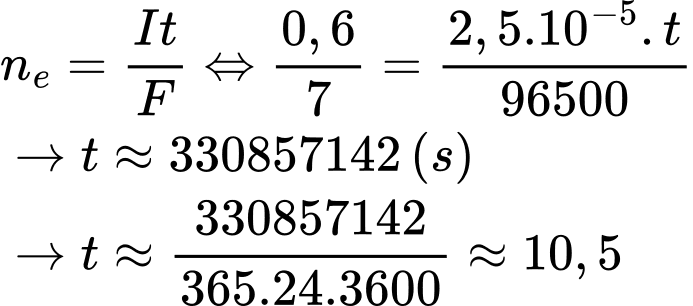
⇒ Điền đáp án: 10,5
Quá trình xảy ra trong pin:
Anode (-):
Số năm pin lithium có thể hoạt động tối đa là:
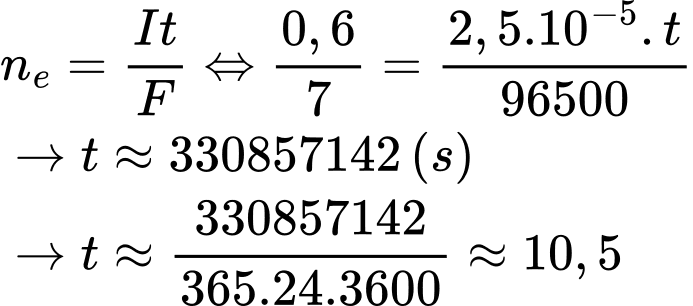
⇒ Điền đáp án: 10,5
Câu 27 [705490]: Cho dãy các chất sau: acetylene, methylamine, ethylene, benzene, lysine. Có bao nhiêu chất trong dãy có khả năng làm mất màu của dung dịch KMnO4 ở nhiệt độ thường hoặc đun nóng?
Các chất làm mất màu của dung dịch KMnO4 ở nhiệt độ thường hoặc đun nóng phải có liên kết đôi hoặc liên kết ba.
Tuy nhiên, benzene có liên kết đôi nhưng không làm mất màu dung dịch KMnO4 trong điều kiện thường do cấu trúc vòng benzen rất ổn định và không có các nhóm chức dễ bị oxi hóa.
CTCT của các chất còn lại là:
+) Acetylene: CH≡CH
+) Methylamine: CH3–NH2
+) Ethylene: CH2=CH2
+) Lysine: H2N–[CH2]4CH(NH2)–COOH
⟶ Các chất làm mất màu của dung dịch KMnO4 ở nhiệt độ thường hoặc đung nóng trong dãy chất trên là acetylene và ethylene:
3CH≡CH + 8KMnO4 ⟶ 3(COOK)2 + 8MnO2↓ + 2KOH + 2H2O.
3CH2=CH2 + 2KMnO4 + 4H2O ⟶ 3C2H4(OH)2 + 2MnO2 + 2KOH.
⇒ Điền đáp án: 2
Tuy nhiên, benzene có liên kết đôi nhưng không làm mất màu dung dịch KMnO4 trong điều kiện thường do cấu trúc vòng benzen rất ổn định và không có các nhóm chức dễ bị oxi hóa.
CTCT của các chất còn lại là:
+) Acetylene: CH≡CH
+) Methylamine: CH3–NH2
+) Ethylene: CH2=CH2
+) Lysine: H2N–[CH2]4CH(NH2)–COOH
⟶ Các chất làm mất màu của dung dịch KMnO4 ở nhiệt độ thường hoặc đung nóng trong dãy chất trên là acetylene và ethylene:
3CH≡CH + 8KMnO4 ⟶ 3(COOK)2 + 8MnO2↓ + 2KOH + 2H2O.
3CH2=CH2 + 2KMnO4 + 4H2O ⟶ 3C2H4(OH)2 + 2MnO2 + 2KOH.
⇒ Điền đáp án: 2
Câu 28 [705491]: Tổng hàm lượng lưu huỳnh trong các cây trồng khác nhau, khoảng 0,2 đến 0,5% tổng lượng chất khô, lưu huỳnh trong đất khô tồn tại dưới dạng SO42–. Phương pháp xác định hàm lượng SO42– bằng barium chromate (BaCrO4), trình tự phân tích như sau:
Bước 1: Lấy 20 gam đất lắc 5 phút với nước cất, để yên 30 phút rồi lọc, thu lấy 100 mL dịch.
Bước 2: Lấy 50 mL dịch lọc + 10 mL BaCrO4 0,3 M(*) lắc đều 5 phút. Thêm 10 mL NH4OH(**) 5%, lắc đều vài phút rồi lên định mức đến vạch 100 mL, dung dịch lúc này có màu vàng.
Bước 1: Lấy 20 gam đất lắc 5 phút với nước cất, để yên 30 phút rồi lọc, thu lấy 100 mL dịch.
Bước 2: Lấy 50 mL dịch lọc + 10 mL BaCrO4 0,3 M(*) lắc đều 5 phút. Thêm 10 mL NH4OH(**) 5%, lắc đều vài phút rồi lên định mức đến vạch 100 mL, dung dịch lúc này có màu vàng.
SO42-(aq) + BaCrO4(aq) ⇌ BaSO4(s) + CrO42-(aq)
(*) BaCrO4 sử dụng ở dạng hòa tan trong dung dịch acid HCl, không sử dụng ở dạng kết tủa.
(**) Dung dịch NH4OH trung hòa acid HCl để BaCrO4 chuyển thành dạng kết tủa và tách ra khỏi dung dịch.
Bước 3: Lấy 50 mL dịch lọc này + 3 mL dung dịch H2SO4 đặc + 10 mL dung dịch muối Mohr 0,02 M (công thức muối Mohr là FeSO4.(NH4)2SO4.6H2O) chuẩn độ bằng dung dịch KMnO4 0,02 M thì dùng hết V1 = 10 mL.2CrO42–(aq) ⇌ Cr2O72–(aq)
6Fe2+(aq) + Cr2O72–(aq) + 14H+(aq) ⟶ 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(aq)
5Fe2+(aq) + MnO42–(aq) + 8H+(aq) ⟶ Mn2+(aq) + 5Fe3+(aq) + 4H2O(aq)
Lấy 10 mL dung dịch muối Mohr chuẩn độ bằng dung dịch KMnO4 0,02 M thì dùng hết V2 = 20 mL. Xác định phần trăm SO42– trong 20 gam mẫu đất trên (Làm tròn đến hàng phần trăm)? 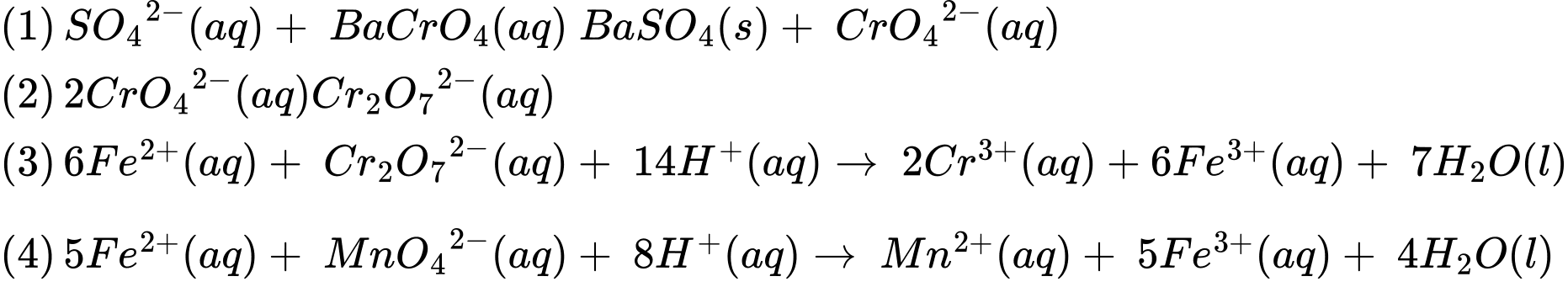
Đổi 10 mL = 0,01 L; 20 mL = 0,02 L
Tại bước 3 sử dụng dư muối mohr với mục đích phản ứng hết Cr2O72- sau đó chuẩn độ phần muối morh dư bằng KMnO4.
Bước 3: Lấy 50 mL dịch lọc này + 3 mL dung dịch H2SO4 đặc + 10 mL dung dịch muối Mohr 0,02 M (công thức muối Mohr là FeSO4.(NH4)2SO4.6H2O) chuẩn độ bằng dung dịch KMnO4 0,02 M thì dùng hết V1 = 10mL.
Lấy 10 mL dung dịch muối Mohr chuẩn độ bằng dung dịch KMnO4 0,02 M thì dùng hết V2 = 20 mL.
Nếu chỉ xét KMnO4 phản ứng với lượng Fe2+ trong phương trình (3)
→ Số mol KMnO4 tác dụng với Fe2+ trong phương trình (3) là:
nKMnO4 = (0,02 – 0,01) × 0,02 = 0,0002 mol
Số mol của Fe2+ là:
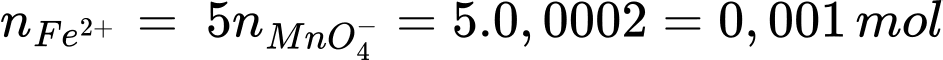
Từ phương trình (1), (2), (3) số mol của SO42- là: nSO42- = 0,001 ÷ 3 mol
Số mol SO42- trong mẫu đất ban đầu là:
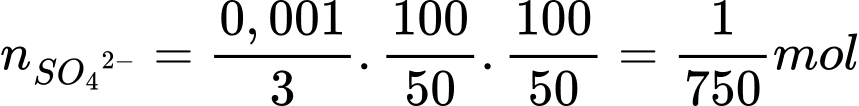
Phần trăm SO42- trong mẫu đất là:
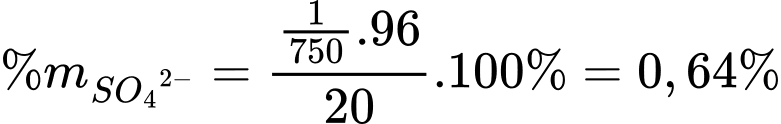
⇒ Điền đáp án: 0,64