PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705492]: “Các kim loại kiềm có thế điện cực chuẩn …(1)…, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ …(2)… từ Li đến Cs”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, rất âm, giảm dần.
B, rất dương, giảm dần.
C, rất dương, tăng dần.
D, rất âm, tăng dần.
Các kim loại kiềm có thế điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
Giải thích:
- Thế điện cực chuẩn (Eo) của kim loại kiềm so với cặp M+/M đều có giá trị rất âm, chứng tỏ chúng dễ bị oxi hóa để tạo ion dương, tức kim loại kiềm có tính khử rất mạnh, dễ dàng nhường electron để phản ứng với các chất như nước.
- Bán kính nguyên tử của các kim loại kiềm lớn nên lực liên kết giữa hạt nhân và electron hóa trị nhỏ ⟶ khả năng nhường electron dễ dàng hơn. Vì thế, tính khử mạnh, dẫn đến phản ứng với nước diễn ra mạnh.
⇒ Chọn đáp án D Đáp án: D
Giải thích:
- Thế điện cực chuẩn (Eo) của kim loại kiềm so với cặp M+/M đều có giá trị rất âm, chứng tỏ chúng dễ bị oxi hóa để tạo ion dương, tức kim loại kiềm có tính khử rất mạnh, dễ dàng nhường electron để phản ứng với các chất như nước.
- Bán kính nguyên tử của các kim loại kiềm lớn nên lực liên kết giữa hạt nhân và electron hóa trị nhỏ ⟶ khả năng nhường electron dễ dàng hơn. Vì thế, tính khử mạnh, dẫn đến phản ứng với nước diễn ra mạnh.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [705493]: Chromium(III) oxide được dùng làm chất tạo màu trong vật liệu gốm. Nó luôn cho màu xanh lục đặc trưng dù nung chậm hay nhanh, môi trường lò oxi hóa hay khử. Công thức cấu tạo của chromium(III) oxide là
A, Cr(OH)3.
B, CrO3.
C, Cr2O3.
D, CrO.
Chromium(III) oxide là một oxide base có công thức Cr2O3 được dùng là chất tạo màu trong vật liệu gốm nhóm tạo màu. Nó luôn cho màu xanh lục đặc trưng dù nung chậm hay nhanh, môi trường lò oxi hóa hay khử. Tuy nhiên nó cho men màu xanh mờ và nhạt.
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 3 [308667]: Chất nào sau đây thuộc loại hợp chất hữu cơ tạp chức?
A, CH3CH(NH2)COOH.
B, HOCH2CH2OH.
C, HCOOCH3.
D, (CHO)2.
- Hợp chất hữu cơ tạp chức là hợp chất hữu cơ có nhiều hơn 1 loại nhóm chức. Điều này có nghĩa là trong cấu trúc của hợp chất này, có ít nhất 2 nhóm chức khác nhau.
- CH3CH(NH2)COOH là loại hữu cơ tạp chức vì có đến 2 nhóm chức là amine (NH2) và carboxylic acid (COOH).
⇒ Chọn đáp án A Đáp án: A
- CH3CH(NH2)COOH là loại hữu cơ tạp chức vì có đến 2 nhóm chức là amine (NH2) và carboxylic acid (COOH).
⇒ Chọn đáp án A Đáp án: A
Câu 4 [575617]: Để hình thành ion K+ thì mỗi nguyên tử potassium đã
A, nhường 1 electron.
B, nhường 3 electron.
C, nhận 1 electron.
D, nhận 2 electron.
K (Z = 19): 1s22s22p63s23p64s1
- Để đạt được cấu hình electron bền vững giống khí hiếm, K có xu hướng mất đi 1 electron ở lớp ngoài cùng, thay vì nhận thêm 7 electron.Khi K mất 1 electron, nó trở thành ion dương (cation) K+, mang điện tích +1.
⇒ Chọn đáp án A
Đáp án: A
- Để đạt được cấu hình electron bền vững giống khí hiếm, K có xu hướng mất đi 1 electron ở lớp ngoài cùng, thay vì nhận thêm 7 electron.Khi K mất 1 electron, nó trở thành ion dương (cation) K+, mang điện tích +1.
⇒ Chọn đáp án A
Câu 5 [15112]: Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta gắn vào mặt ngoài của ống thép những tấm kim loại
A, chì.
B, đồng.
C, kẽm.
D, bạc.
Bảo vệ kim loại bằng phương pháp điện hóa: Gắn kim loại cần bảo vệ (Fe) với một kim loại mạnh hơn (Zn) để kim loại đó bị ăn mòn thay (do kẽm hoạt động hoá học mạnh hơn sắt nên đóng vai trò là anode và bị ăn mòn trước).
⇒ Chọn đáp án C Đáp án: C
⇒ Chọn đáp án C Đáp án: C
Câu 6 [705494]: Tốc độ phản ứng cháy phụ thuộc vào nồng độ của các chất tham gia. Octane là một trong những thành phần có trong xăng, khi bốc cháy, octane tỏa nhiều nhiệt với phương trình hóa học
C8H18 + 12,5O2 8CO2 + 9H2O
8CO2 + 9H2O
Biểu thức tốc độ của phản ứng cháy như sau:
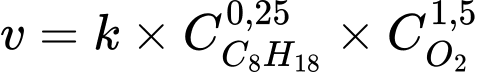
Nhận định nào sau đây đúng?
C8H18 + 12,5O2
 8CO2 + 9H2O
8CO2 + 9H2OBiểu thức tốc độ của phản ứng cháy như sau:
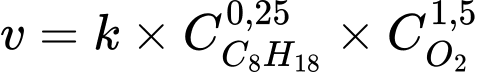
Nhận định nào sau đây đúng?
A, Tốc độ của phản ứng cháy phụ thuộc vào nồng độ CO2 và H2O.
B, Khi nồng độ octane tăng, tốc độ phản ứng cháy giảm.
C, Khi nồng độ oxygen tăng, tốc độ phản ứng cháy tăng.
D, Khi nồng độ các chất ban đầu đều tăng 2 lần thì tốc độ phản ứng tăng 4 lần.
Phân tích các nhận định:
❌ A. Sai. Tốc độ của phản ứng cháy phụ thuộc vào nồng độ O2 và C8H18, khi tăng nồng độ của O2 và C8H18 thì tốc độ phản ứng tăng và ngược lại.
❌ B. Sai. Khi nồng độ octane tăng, tốc độ phản ứng cháy tăng.
✔️ C. Đúng. Khi nồng độ oxygen tăng, tốc độ phản ứng cháy tăng.
❌ D. Sai. Khi nồng độ các chất ban đầu đều tăng 2 lần thì tốc độ phản ứng tăng 3,36 lần.
Ban đầu: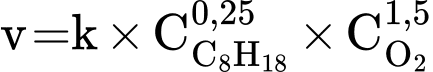
Khi nồng độ các chất tăng lên 2 lần:
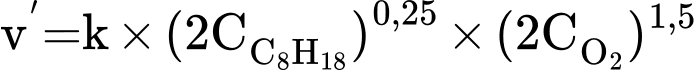
→ tốc độ phản ứng sau khi tăng gấp đôi nồng độ các chất là:
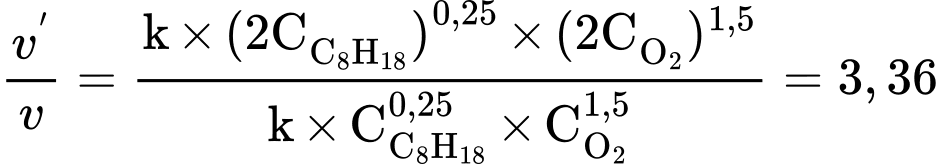 lần.
lần.
⇒ Chọn đáp án C Đáp án: C
❌ A. Sai. Tốc độ của phản ứng cháy phụ thuộc vào nồng độ O2 và C8H18, khi tăng nồng độ của O2 và C8H18 thì tốc độ phản ứng tăng và ngược lại.
❌ B. Sai. Khi nồng độ octane tăng, tốc độ phản ứng cháy tăng.
✔️ C. Đúng. Khi nồng độ oxygen tăng, tốc độ phản ứng cháy tăng.
❌ D. Sai. Khi nồng độ các chất ban đầu đều tăng 2 lần thì tốc độ phản ứng tăng 3,36 lần.
Ban đầu:
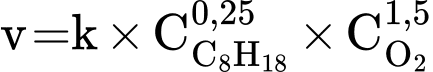
Khi nồng độ các chất tăng lên 2 lần:
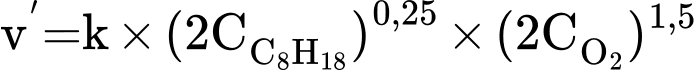
→ tốc độ phản ứng sau khi tăng gấp đôi nồng độ các chất là:
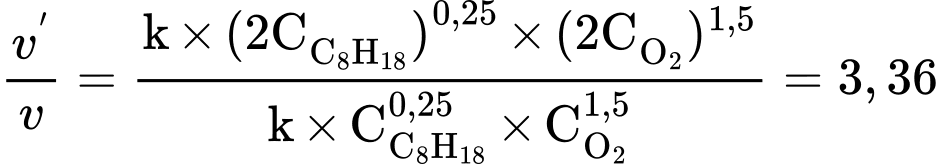 lần.
lần.⇒ Chọn đáp án C Đáp án: C
Câu 7 [60608]: Cho dãy chuyển hóa sau: 
Bộ ba các chất theo thứ tự X, Y, Z nào sau đây không thỏa mãn?

Bộ ba các chất theo thứ tự X, Y, Z nào sau đây không thỏa mãn?
A, Cl2, Fe, HNO3.
B, Cl2, Cu, HNO3.
C, Cl2, Fe, AgNO3.
D, HCl, Cl2, AgNO3.
Bộ ba các chất theo thứ tự X, Y, Z không thỏa mãn là HCl, Cl2, AgNO3.
Nguyên nhân khi cho Fe tác dụng với HCl (X) thì chỉ thu được FeCl2 không phải FeCl3 như yêu cầu của đề bài.
⇒ Chọn đáp án D Đáp án: D
Nguyên nhân khi cho Fe tác dụng với HCl (X) thì chỉ thu được FeCl2 không phải FeCl3 như yêu cầu của đề bài.
⇒ Chọn đáp án D Đáp án: D
Câu 8 [705495]: Nitrogen trong không khí có vai trò nào sau đây?
A, Hình thành sấm sét.
B, Tham gia quá trình quang hợp của cây.
C, Tham gia hình thành mây.
D, Cung cấp đạm tự nhiên cho cây trồng.
❌ A. Sấm sét là hiện tượng do sự phóng điện trong khí quyển, không phải do nitrogen gây ra. Tuy nhiên, sấm sét giúp chuyển hóa nitrogen thành hợp chất có ích cho cây, chứ nitrogen không phải là nguyên nhân hình thành sấm sét.
❌ B. Quang hợp chủ yếu sử dụng CO2, nước và ánh sáng để tổng hợp chất hữu cơ, không liên quan trực tiếp đến nitrogen trong không khí.
❌ C. Mây được hình thành do sự ngưng tụ của hơi nước trong không khí, không liên quan đến nitrogen.
✔️ D. Trong không khí nitrogen chiếm khoảng 78% thể tích, nhờ các quá trình tự nhiên như sấm sét mà nitrogen chuyển hóa thành các hợp chất mà cây có thể hấp thu được , đó là đạm tự nhiên cho cây.
⇒ Chọn đáp án D Đáp án: D
❌ B. Quang hợp chủ yếu sử dụng CO2, nước và ánh sáng để tổng hợp chất hữu cơ, không liên quan trực tiếp đến nitrogen trong không khí.
❌ C. Mây được hình thành do sự ngưng tụ của hơi nước trong không khí, không liên quan đến nitrogen.
✔️ D. Trong không khí nitrogen chiếm khoảng 78% thể tích, nhờ các quá trình tự nhiên như sấm sét mà nitrogen chuyển hóa thành các hợp chất mà cây có thể hấp thu được , đó là đạm tự nhiên cho cây.
⇒ Chọn đáp án D Đáp án: D
Câu 9 [190620]: Chất nào dưới đây có thể dùng để phân biệt propan-2-ol và glycerol đựng trong hai ống nghiệm không dán nhãn.
A, Cu(OH)2.
B, NaOH.
C, Na.
D, H2SO4 loãng.
Glycerol hoà tan Cu(OH)2 tạo thành dung dịch màu xanh lam đậm => Cho lần lượt hai mẫu thử vào kết tủa Cu(OH)2, mẫu thử hoà tan Cu(OH)2 là glycerol, mẫu còn lại là propan-2-ol.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 10 [305032]: Acid béo nào sau đây là acid béo không bão hòa?
A, CH3(CH2)14COOH.
B, CH3(CH2)12COOH.
C, CH3(C14H24)COOH.
D, CH3(C10H20)COOH.
HD: Học cách quan sát nhanh hơn để tìm ra đáp án: tất cả đều có đầu CH3 và đuôi chức carboxylic acid: COOH.
► Nếu mạch no, bão hòa thì sẽ là bội của nhóm CH2 ⇒ tổng quát là (CH2)n. Quan sát 4 đáp án:
❌ A. n = 14 ⇒ CH3(CH2)14COOH ⇝ là một acid béo bão hòa.
❌ B. n = 12 ⇒ CH3(CH2)12COOH. ⇝ là một acid béo bão hòa.
❌ D. n = 10 ⇝ (CH2)10 = C10H20 ⇒ CH3(C10H20)COOH. ⇝ là một acid bão hòa.
⇒ Chọn đáp án C.
Bởi đáng nhẽ C14 thì cần H228 để bão hòa, nhưng đây: CH3(C14H24)COOH chỉ có 24H ⇒ mất 4H ⇄ tương ứng có 2 nối đôi C=C ⇝ là một acid béo không bão hòa. Đáp án: C
► Nếu mạch no, bão hòa thì sẽ là bội của nhóm CH2 ⇒ tổng quát là (CH2)n. Quan sát 4 đáp án:
❌ A. n = 14 ⇒ CH3(CH2)14COOH ⇝ là một acid béo bão hòa.
❌ B. n = 12 ⇒ CH3(CH2)12COOH. ⇝ là một acid béo bão hòa.
❌ D. n = 10 ⇝ (CH2)10 = C10H20 ⇒ CH3(C10H20)COOH. ⇝ là một acid bão hòa.
⇒ Chọn đáp án C.
Bởi đáng nhẽ C14 thì cần H228 để bão hòa, nhưng đây: CH3(C14H24)COOH chỉ có 24H ⇒ mất 4H ⇄ tương ứng có 2 nối đôi C=C ⇝ là một acid béo không bão hòa. Đáp án: C
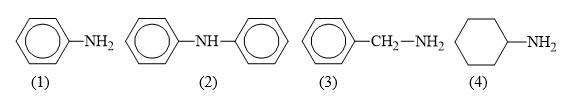
Câu 11 [308573]: Cho dãy các amine có cấu tạo sau:
Amine có tính base yếu nhất trong dãy là

Amine có tính base yếu nhất trong dãy là
A, (3).
B, (4).
C, (1).
D, (2).
- Các amine (1) (2) (4) có N đính trực tiếp với vòng thơm nên có tính base yếu hơn amine (3)
- Cyclohexylamine (C6H11NH2) là một base yếu nhưng mạnh hơn so với amine có vòng thơm tương tự nó là aniline (C6H5NH2).
- Gốc C6H5NH2 là gốc đẩy electron yếu → Tính base yếu
- Gốc (C6H5)2NH có 2 gốc C6H5- hút electron nên tính base của (C6H5)2NH yếu hơn C6H5NH2
→ Thứ tự tăng dần tính base: (2) < (1) < (4) < (3)
→ Chất có tính base yếu nhất là (2)
⇒ Chọn đáp án D Đáp án: D
- Cyclohexylamine (C6H11NH2) là một base yếu nhưng mạnh hơn so với amine có vòng thơm tương tự nó là aniline (C6H5NH2).
- Gốc C6H5NH2 là gốc đẩy electron yếu → Tính base yếu
- Gốc (C6H5)2NH có 2 gốc C6H5- hút electron nên tính base của (C6H5)2NH yếu hơn C6H5NH2
→ Thứ tự tăng dần tính base: (2) < (1) < (4) < (3)
→ Chất có tính base yếu nhất là (2)
⇒ Chọn đáp án D Đáp án: D
Câu 12 [705496]: Số nhóm hydroxy trong phân tử glucose ở dạng mạch hở là
A, 4.
B, 3.
C, 5.
D, 6.
- Dạng mạch hở:
+ Glucose: CH2OH-[CHOH]4-CHO có 5 nhóm hydroxy (OH) và 1 nhóm aldehyde (CHO).
⇒ Chọn đáp án C Đáp án: C
+ Glucose: CH2OH-[CHOH]4-CHO có 5 nhóm hydroxy (OH) và 1 nhóm aldehyde (CHO).
⇒ Chọn đáp án C Đáp án: C
Câu 13 [705497]: Sự phụ thuộc của tốc độ thủy phân tinh bột (r) vào nhiệt độ (T) của phản ứng được xúc tác bởi một loại enzyme amylase (có cấu tạo từ protein) được mô tả như hình bên. Phát biểu nào sau đây là đúng?
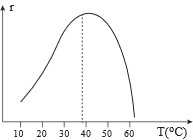

A, Ở nhiệt độ cao (khoảng 60 °C - 70°C), tốc độ phản ứng giảm do phản ứng tỏa nhiệt nên cân bằng bị chuyển dịch.
B, Trong khoảng nhiệt độ nghiên cứu, tốc độ phản ứng tăng khi nhiệt độ tăng do phản ứng được xúc tác bởi enzyme.
C, Ở nhiệt độ cao (khoảng 60 °C - 70°C), tốc độ phản ứng giảm do cấu trúc của protein trong enzyme bị biến đổi làm giảm khả năng xúc tác.
D, Tốc độ phản ứng thủy phân không phụ thuộc vào nhiệt độ do nhiệt độ không ảnh hưởng tới cấu trúc enzyme cấu tạo từ protein chứa các liên kết peptide bền vững.
❌ A. Sai. Ở nhiệt độ cao (khoảng 60 oC - 70 oC), tốc độ phản ứng giảm do emzyme bị giảm khả năng hoạt động.
❌ B. Sai. Từ đồ thị trong khoảng nhiệt độ nghiên cứu, tốc độ phản ứng chỉ tăng khi nhiệt độ tăng đến 50 oC khi tăng nhiệt độ cao hơn tốc độ phản ứng giảm.
✔️ C. Đúng. Ở nhiệt độ cao (khoảng 60 oC - 70 oC), tốc độ phản ứng giảm do cấu trúc của protein trong enzyme bị biến đổi làm giảm khả năng xúc tác.
❌ D. Sai. Tốc độ phản ứng thủy phân phụ thuộc vào nhiệt độ do tại nhiệt độ cao sẽ ảnh hưởng đến tới cấu trúc enzyme cấu tạo từ protein, các enzyme sẽ bị biến tính.
⇒ Chọn đáp án C Đáp án: C
❌ B. Sai. Từ đồ thị trong khoảng nhiệt độ nghiên cứu, tốc độ phản ứng chỉ tăng khi nhiệt độ tăng đến 50 oC khi tăng nhiệt độ cao hơn tốc độ phản ứng giảm.
✔️ C. Đúng. Ở nhiệt độ cao (khoảng 60 oC - 70 oC), tốc độ phản ứng giảm do cấu trúc của protein trong enzyme bị biến đổi làm giảm khả năng xúc tác.
❌ D. Sai. Tốc độ phản ứng thủy phân phụ thuộc vào nhiệt độ do tại nhiệt độ cao sẽ ảnh hưởng đến tới cấu trúc enzyme cấu tạo từ protein, các enzyme sẽ bị biến tính.
⇒ Chọn đáp án C Đáp án: C
Câu 14 [705498]: “Chất béo là nguyên liệu cho ngành công nghiệp ...(1)..., sản xuất xà phòng và ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, dệt may, alcohol.
B, luyện kim, alcohol.
C, khai khoáng, glycerol.
D, thực phẩm, glycerol.
Chất béo là nguyên liệu cho ngành công nghiệp thực phẩm, sản xuất xà phòng và glycerol.
Các ứng dụng của chất béo:
- Cung cấp một lượng đáng kể năng lượng cho cơ thể và được xem là nguồn dinh dưỡng quan trọng.
- Được dùng để tổng hợp các chất cần thiết khác cho cơ thể, đồng thời có tác dụng đảm bảo sự vận chuyển và hấp thụ các chất tan được trong chất béo.
- Dùng để điều chế xà phòng và glycerol.
- Dùng nhiều trong chế biến thực phẩm. Ngày nay một số loại dầu thực vật còn được dùng để sản xuất nhiên liệu sinh học (biodiesel).
- Là nguồn cũng cấp acid béo omega-3 và omega-6 cho cơ thể.
⇒ Chọn đáp án D Đáp án: D
Các ứng dụng của chất béo:
- Cung cấp một lượng đáng kể năng lượng cho cơ thể và được xem là nguồn dinh dưỡng quan trọng.
- Được dùng để tổng hợp các chất cần thiết khác cho cơ thể, đồng thời có tác dụng đảm bảo sự vận chuyển và hấp thụ các chất tan được trong chất béo.
- Dùng để điều chế xà phòng và glycerol.
- Dùng nhiều trong chế biến thực phẩm. Ngày nay một số loại dầu thực vật còn được dùng để sản xuất nhiên liệu sinh học (biodiesel).
- Là nguồn cũng cấp acid béo omega-3 và omega-6 cho cơ thể.
⇒ Chọn đáp án D Đáp án: D
Câu 15 [304801]: Có thể tạo ra mùi thơm của quả mơ từ ester có tên pentyl butanoate. Công thức cấu tạo của hợp chất này được cho dưới đây:
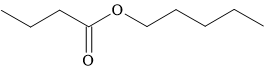
Alcohol nào đã cấu tạo nên pentyl butanoate?

Alcohol nào đã cấu tạo nên pentyl butanoate?
A, C5H11OH.
B, C4H9OH.
C, C3H7OH.
D, C2H5OH.
HD: Phân tích cấu tạo ester:
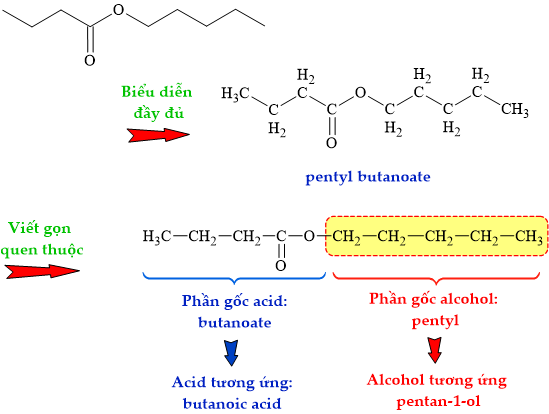
⇒ Alcohol cấu tạo nên ester pentyl butanoate là pentan-1-ol: CH3CH2CH2CH2CH2OH ⇄ công thức rút gọn: C5H11OH
⇒ Chọn đáp án A Đáp án: A

⇒ Alcohol cấu tạo nên ester pentyl butanoate là pentan-1-ol: CH3CH2CH2CH2CH2OH ⇄ công thức rút gọn: C5H11OH
⇒ Chọn đáp án A Đáp án: A
Câu 16 [705499]: Poly(phenol-formaldehyde) (PPF) là polymer có tính cứng, chịu nhiệt, chống mài mòn và chống ẩm cao. Vì vậy, PPF được ứng dụng rộng rãi trong nhiều ngành công nghiệp như sử dụng làm chất kết dính trong sản xuất ván ép, ván MDF, giúp tăng độ bền và khả năng chống ẩm của vật liệu. PPF được điều chế từ phản ứng giữa phenol và formaldehyde ở pH và nhiệt độ thích hợp.
Cho các phát biểu sau:
(a) PPF được điều chế từ phản ứng trùng hợp.
(b) Các mạch polymer của PPF có thể tham gia phản ứng nối mạch polymer lại với nhau tạo thành mạng không gian.
(c) Rác thải nhựa làm từ vật liệu PPF có thể xử lí bằng cách đốt.
(d) PPF là vật liệu polymer thuộc loại chất dẻo.
Số phát biểu đúng là
Cho các phát biểu sau:
(a) PPF được điều chế từ phản ứng trùng hợp.
(b) Các mạch polymer của PPF có thể tham gia phản ứng nối mạch polymer lại với nhau tạo thành mạng không gian.
(c) Rác thải nhựa làm từ vật liệu PPF có thể xử lí bằng cách đốt.
(d) PPF là vật liệu polymer thuộc loại chất dẻo.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích từng phát biểu:
❌ (a) Sai. PPF (poly(phenol-formaldehyde)) được điều chế từ phản ứng trùng ngưng, không phải trùng hợp. Cụ thể, phenol và formaldehyde phản ứng với nhau tạo thành mạch polymer, đồng thời giải phóng nước.
✅ (b) Đúng. PPF là polymer nhiệt rắn, trong quá trình gia nhiệt, các mạch polymer có thể liên kết với nhau tạo thành mạng không gian 3D, làm tăng độ cứng và khả năng chịu nhiệt.
❌ (c) Sai. Nhựa PPF khi đốt cháy sinh ra CO2 và H2O, là chất độc hại gây ô nhiễm môi trường.
✅ (d) Đúng. PPF có tính dẻo nên nó là nhựa nhiệt dẻo hay còn gọi là nhựa bakelite.
Vậy có 2 phát biểu đúng là (b) và (d)
⇒ Chọn đáp án B Đáp án: B
❌ (a) Sai. PPF (poly(phenol-formaldehyde)) được điều chế từ phản ứng trùng ngưng, không phải trùng hợp. Cụ thể, phenol và formaldehyde phản ứng với nhau tạo thành mạch polymer, đồng thời giải phóng nước.
✅ (b) Đúng. PPF là polymer nhiệt rắn, trong quá trình gia nhiệt, các mạch polymer có thể liên kết với nhau tạo thành mạng không gian 3D, làm tăng độ cứng và khả năng chịu nhiệt.
❌ (c) Sai. Nhựa PPF khi đốt cháy sinh ra CO2 và H2O, là chất độc hại gây ô nhiễm môi trường.
✅ (d) Đúng. PPF có tính dẻo nên nó là nhựa nhiệt dẻo hay còn gọi là nhựa bakelite.
Vậy có 2 phát biểu đúng là (b) và (d)
⇒ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Trong công nghiệp, đồng kim loại được tinh chế bằng phương pháp điện phân như hình minh hoạ sau đây:
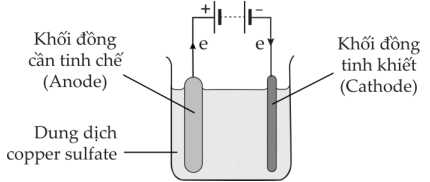

Câu 17 [705500]: Nhận định nào sau đây đúng về quá trình điện phân trên?
A, Phản ứng khử xảy ra ở điện cực dương.
B, Màu xanh của dung dịch đậm dần.
C, Khối lượng điện cực âm tăng dần.
D, Nồng độ ion Cu2+ trong dung dịch giảm dần.
Quá trình điện phân:
Cathode (–): Cu2+ + 2e ⟶ Cu
Anode (+): Cu ⟶ Cu2+ + 2e
Phân tích các nhận định:
❌ A. Sai. Phản ứng khử xảy ra ở điện cực âm, cực dương xảy ra phản ứng oxi hóa.
❌ B. Sai. Màu xanh của dung dịch không đổi do có sự tạo thành Cu2+ trên cực dương bù cho sự mất đi của Cu2+ trên cực âm.
✔️ C. Đúng. Khối lượng điện cực âm tăng dần do Cu tạo thành bám trên cực âm.
❌ D. Sai. Nồng độ ion Cu2+ trong dung dịch không đổi do có sự tạo thành Cu2+ trên cực dương bù cho sự mất đi của Cu2+ trên cực âm.
⇒ Chọn đáp án C Đáp án: C
Cathode (–): Cu2+ + 2e ⟶ Cu
Anode (+): Cu ⟶ Cu2+ + 2e
Phân tích các nhận định:
❌ A. Sai. Phản ứng khử xảy ra ở điện cực âm, cực dương xảy ra phản ứng oxi hóa.
❌ B. Sai. Màu xanh của dung dịch không đổi do có sự tạo thành Cu2+ trên cực dương bù cho sự mất đi của Cu2+ trên cực âm.
✔️ C. Đúng. Khối lượng điện cực âm tăng dần do Cu tạo thành bám trên cực âm.
❌ D. Sai. Nồng độ ion Cu2+ trong dung dịch không đổi do có sự tạo thành Cu2+ trên cực dương bù cho sự mất đi của Cu2+ trên cực âm.
⇒ Chọn đáp án C Đáp án: C
Câu 18 [705501]: Khối đồng cần tinh chế được sử dụng làm anode trong bộ điện phân trên. Sau một thời gian, khối lượng anode giảm 50,0 gam, khối lượng cathode tăng 45,0 gam. Giả sử các quá trình đều xảy ra hoàn toàn và thanh đồng cần tinh chế là đồng nhất. Độ tinh khiết của khối đồng là
A, 10,0%.
B, 11,1%.
C, 90,0%.
D, 95,0%.
Quá trình điện phân:
Cathode (–): Cu2+ + 2e ⟶ Cu
Anode (+): Cu ⟶ Cu2+ + 2e
Theo định luật bảo toàn lượng Cu mất đi bên anode sẽ bằng đúng lượng Cu tạo thành trên cathode.
Hiệu suất của phản ứng là: H = 45 ÷ 50 × 100% = 90 %.
⇒ Chọn đáp án C Đáp án: C
Cathode (–): Cu2+ + 2e ⟶ Cu
Anode (+): Cu ⟶ Cu2+ + 2e
Theo định luật bảo toàn lượng Cu mất đi bên anode sẽ bằng đúng lượng Cu tạo thành trên cathode.
Hiệu suất của phản ứng là: H = 45 ÷ 50 × 100% = 90 %.
⇒ Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705502]: Để nhận biết sự có mặt của một số ion kim loại có thể tiến hành các thí nghiệm theo quy trình dưới đây:
▪ Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (1) chứa khoảng 1 mL dung dịch CuSO4.
▪ Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (2) chứa khoảng 1 mL dung dịch FeCl3.
▪ Ống nghiệm (1): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (1) chứa khoảng 1 mL dung dịch CuSO4.
▪ Ống nghiệm (2): Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm (2) chứa khoảng 1 mL dung dịch FeCl3.
Hiện tượng và PTHH xảy ra ở 2 ống nghiệm như sau:
Ống nghiệm (1): Xuất hiện kết tủa xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ (xanh) + Na2SO4
Ống nghiệm (2): Xuất hiện kết tủa đỏ nâu:
FeCl3 + 3NaOH → Fe(OH)3↓ (đỏ nâu) + 3NaCl
Phân tích các phát biểu:
✔️ (a) Đúng. Ống nghiệm (1) xuất hiện kết tủa xanh trong ống nghiệm là Cu(OH)2.
❌ (b) Sai. Ống nghiệm (2) xuất hiện kết tủa nâu đỏ Fe(OH)3 không bị oxi hóa không khí ẩm nên không chuyển sang màu vàng nâu.
✔️ (c) Đúng. Nếu NaOH bằng dung dịch NH3 thì hiện tượng trong cả hai ống nghiệm vẫn xảy ra tương tự do NH3 và NaOH mang tính base như nhau, đều chứa ion OH-, phản ứng xảy ra:
Ống nghiệm (1): Xuất hiện kết tủa xanh:
CuSO4 + 2NaOH → Cu(OH)2↓ (xanh) + Na2SO4
Ống nghiệm (2): Xuất hiện kết tủa đỏ nâu:
FeCl3 + 3NaOH → Fe(OH)3↓ (đỏ nâu) + 3NaCl
Phân tích các phát biểu:
✔️ (a) Đúng. Ống nghiệm (1) xuất hiện kết tủa xanh trong ống nghiệm là Cu(OH)2.
❌ (b) Sai. Ống nghiệm (2) xuất hiện kết tủa nâu đỏ Fe(OH)3 không bị oxi hóa không khí ẩm nên không chuyển sang màu vàng nâu.
✔️ (c) Đúng. Nếu NaOH bằng dung dịch NH3 thì hiện tượng trong cả hai ống nghiệm vẫn xảy ra tương tự do NH3 và NaOH mang tính base như nhau, đều chứa ion OH-, phản ứng xảy ra:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ (xanh) + (NH4)2SO4
FeCl3 + 3NH3 + 3H2O → Fe(OH)3↓ (đỏ nâu) + 3NH4Cl
✔️ (d) Đúng. Dựa vào màu sắc của kết tủa có thể phân biệt được sự có mặt của ion Cu2+ và Fe3+ trong dung dịch. Kết tủa của Fe3+ có màu nâu đỏ là Fe(OH)3 và kết tủa của Cu2+ có màu xanh là Cu(OH)2.
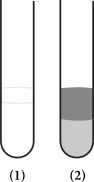
Câu 20 [705503]: Tiến hành chuẩn bị hai ống nghiệm:
▪ Bước 1: Một ống đựng hexane, ống còn lại đựng hex-1-ene.
▪ Bước 2: Tiến hành nhỏ vài giọt nước bromine vào từng ống nghiệm, lắc đều.
Sau thí nghiệm thu được kết quả như sau:
▪ Bước 1: Một ống đựng hexane, ống còn lại đựng hex-1-ene.
▪ Bước 2: Tiến hành nhỏ vài giọt nước bromine vào từng ống nghiệm, lắc đều.
Sau thí nghiệm thu được kết quả như sau:

Phân tích các phát biểu:
✔️ (a) Đúng. Ống nghiệm (1) có chứa hex-1-ene có khả năng làm mất màu Bromine để thành dung dịch không màu.
✔️ (b) Đúng. Có phản ứng tạo thành dẫn xuất halogen của hex-1-ene với Br2
✔️ (c) Đúng. Hexane nhẹ hơn nước nên nó sẽ nổi trên mặt nước, dung dịch nước bromine có khả năng hòa tan hexane nên các phân tử Br2 sẽ di chuyển từ lớp chất lỏng bên dưới lên lớp chất lỏng bên trên làm cho lớp hexane trở lên đậm hơn.
✔️ (d) Đúng. Nước nằm ở phần chất lỏng phía trên ống 1 và bên dưới ống 2.
✔️ (a) Đúng. Ống nghiệm (1) có chứa hex-1-ene có khả năng làm mất màu Bromine để thành dung dịch không màu.
✔️ (b) Đúng. Có phản ứng tạo thành dẫn xuất halogen của hex-1-ene với Br2
CH2=CH[CH2]3CH3 + Br2 ⟶ CH2BrCHBr[CH2]3CH3
Phần lớn các dẫn xuất halogen đều nặng hơn nước và hầu như đều không tan được trong nước. ✔️ (c) Đúng. Hexane nhẹ hơn nước nên nó sẽ nổi trên mặt nước, dung dịch nước bromine có khả năng hòa tan hexane nên các phân tử Br2 sẽ di chuyển từ lớp chất lỏng bên dưới lên lớp chất lỏng bên trên làm cho lớp hexane trở lên đậm hơn.
✔️ (d) Đúng. Nước nằm ở phần chất lỏng phía trên ống 1 và bên dưới ống 2.
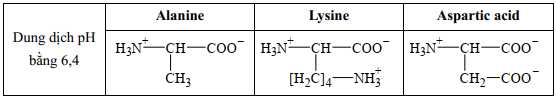
Câu 21 [705504]: Cho biết, trong dung dịch có pH = 6,4, dạng tồn tại của một số amino acid như sau:

Phân tích các phát biểu:
❌ (b) Sai. Tại pH = 6,4. Alanine có tổng điện tích bằng không nên hầu như không di chuyển trong điện trường. Lysine có tổng điện tích bằng +1 nên sẽ di chuyển sang cực âm trong trong điện trường. Aspartic acid có tổng điện tích bằng -1 nên sẽ di chuyển sang cực dương trong trong điện trường.
✔️ (c) Đúng. Tại pH = 6,4. Alanine tồn tại dạng ion lưỡng cực trung hòa về điện. Lysine có tổng điện tích bằng +1. Aspartic acid có tổng điện tích bằng -1.
✔️ (d) Đúng. Tại pH = 6,4. Alanine có tổng điện tích bằng không nên hầu như không di chuyển trong điện trường. Lysine có tổng điện tích bằng +1 nên sẽ di chuyển sang cực âm trong trong điện trường. Aspartic acid có tổng điện tích bằng -1 nên sẽ di chuyển sang cực dương trong trong điện trường.
❌ (a) Sai. Ở pH = 6,4, lysine có tổng điện tích là +1 với 2 nhóm NH3+ và 1 nhóm COO- nên có khả năng nhận tối đa 1 H+.

❌ (b) Sai. Tại pH = 6,4. Alanine có tổng điện tích bằng không nên hầu như không di chuyển trong điện trường. Lysine có tổng điện tích bằng +1 nên sẽ di chuyển sang cực âm trong trong điện trường. Aspartic acid có tổng điện tích bằng -1 nên sẽ di chuyển sang cực dương trong trong điện trường.
✔️ (c) Đúng. Tại pH = 6,4. Alanine tồn tại dạng ion lưỡng cực trung hòa về điện. Lysine có tổng điện tích bằng +1. Aspartic acid có tổng điện tích bằng -1.
✔️ (d) Đúng. Tại pH = 6,4. Alanine có tổng điện tích bằng không nên hầu như không di chuyển trong điện trường. Lysine có tổng điện tích bằng +1 nên sẽ di chuyển sang cực âm trong trong điện trường. Aspartic acid có tổng điện tích bằng -1 nên sẽ di chuyển sang cực dương trong trong điện trường.
Câu 22 [705505]: Giá trị biến thiên enthalpyl chuẩn của phản ứng phân hủy muối carbonate của một số nguyên tố nhóm IIA được cho trong bảng dưới đây:

Biến thiên enthalpyl chuẩn của phản ứng phân hủy muối carbonate cũng sẽ cho biết độ bền nhiệt các muối carbonate.

Biến thiên enthalpyl chuẩn của phản ứng phân hủy muối carbonate cũng sẽ cho biết độ bền nhiệt các muối carbonate.
Phân tích các phát biểu:
✔️ (a) Đúng. Nhiệt phân muối carbonate của các chất trên đều thu được basic oxide và khí CO2.
Phương trình tổng quát: MCO3 –to⟶ MO + CO2 (M là kim loại kiềm thổ)
❌ (b) Sai. Giá trị biến thiên enthalpy chuẩn của phản ứng lớn hơn 0 thì phản ứng sẽ thu nhiệt.
✔️ (c) Đúng. Độ bền nhiệt của muối có xu hướng tăng từ MgCO3 đến BaCO3 do có biến thiên enthalpy tăng dần càng về sau càng khó phân hủy.
✔️ (d) Đúng. Biến thiên enthalpyl chuẩn của phản ứng thì cần nhận vào càng nhiều năng lượng thì phản ứng phân hủy mới xảy ra.
✔️ (a) Đúng. Nhiệt phân muối carbonate của các chất trên đều thu được basic oxide và khí CO2.
Phương trình tổng quát: MCO3 –to⟶ MO + CO2 (M là kim loại kiềm thổ)
❌ (b) Sai. Giá trị biến thiên enthalpy chuẩn của phản ứng lớn hơn 0 thì phản ứng sẽ thu nhiệt.
✔️ (c) Đúng. Độ bền nhiệt của muối có xu hướng tăng từ MgCO3 đến BaCO3 do có biến thiên enthalpy tăng dần càng về sau càng khó phân hủy.
✔️ (d) Đúng. Biến thiên enthalpyl chuẩn của phản ứng thì cần nhận vào càng nhiều năng lượng thì phản ứng phân hủy mới xảy ra.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705506]: Xét ion phức chất aqua [Cu(H2O)6]2+. Hãy cho biết dung lượng phối trí của phối tử H2O trong phức chất?
- Dung lượng phối trí của một phối tử bằng số liên kết ở giữa phối tử đó với nguyên tử trung tâm khi hình thành phức chất.
- Phối tử liên kết với nguyên tử trung tâm chỉ qua một nguyên tử có dung lượng phối trí là 1.
- Phối tử liên kết với nguyên tử trung tâm qua 2, 3, 4,... nguyên tử có dung lượng phối trí là 2, 3, 4,... tương ứng. Các phối tử này thường tạo ra phức chất vòng bền.
Phức chất aqua [Cu(H2O)6]2+ có 6 phối tử H2O, dung lượng phối trí của phối tử H2O là 1 vì chỉ tạo 1 liên kết giữa phối tử trung hòa H2O với ion nguyên tử trung tâm là 1.
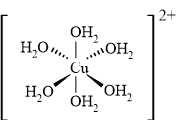
⇒ Điền đáp án: 1
- Phối tử liên kết với nguyên tử trung tâm chỉ qua một nguyên tử có dung lượng phối trí là 1.
- Phối tử liên kết với nguyên tử trung tâm qua 2, 3, 4,... nguyên tử có dung lượng phối trí là 2, 3, 4,... tương ứng. Các phối tử này thường tạo ra phức chất vòng bền.
Phức chất aqua [Cu(H2O)6]2+ có 6 phối tử H2O, dung lượng phối trí của phối tử H2O là 1 vì chỉ tạo 1 liên kết giữa phối tử trung hòa H2O với ion nguyên tử trung tâm là 1.

⇒ Điền đáp án: 1
Câu 24 [684464]: Cho dãy chuyển hóa sau:

Trong đó, X, Y và Z đều là các hợp chất hữu cơ. Xác định khối lượng phân tử của Z.

Trong đó, X, Y và Z đều là các hợp chất hữu cơ. Xác định khối lượng phân tử của Z.
Ta có các phản ứng:
(1)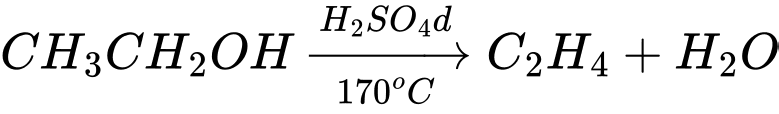
(2)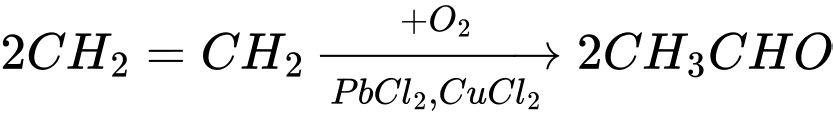
(3)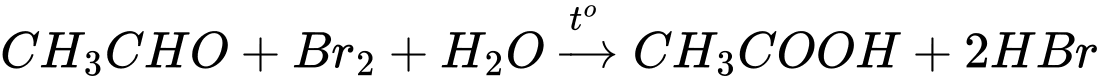
Công thức cấu tạo của Z là: CH3COOH
Khối lượng phân tử của Z là : 12 × 2 + 1 × 4 + 16 × 2 = 60
⇒ Điền đáp án: 60
(1)
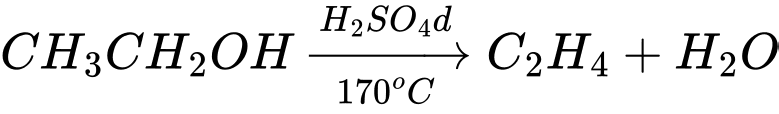
(2)
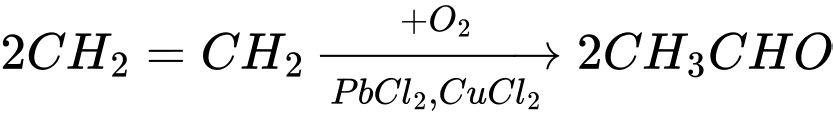
(3)
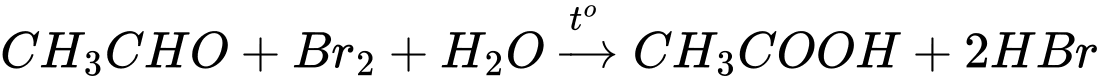
Công thức cấu tạo của Z là: CH3COOH
Khối lượng phân tử của Z là : 12 × 2 + 1 × 4 + 16 × 2 = 60
⇒ Điền đáp án: 60
Câu 25 [705507]: Có bao nhiêu chất trong dãy sau phản ứng với dung dịch NaOH: acetaldehyde, methyl formate, acetic acid, phenyl acrylate, phenol, ethanol?
Các chất phản ứng vơi NaOH là methyl formate, acetic acid, phenyl acrylate, phenol.
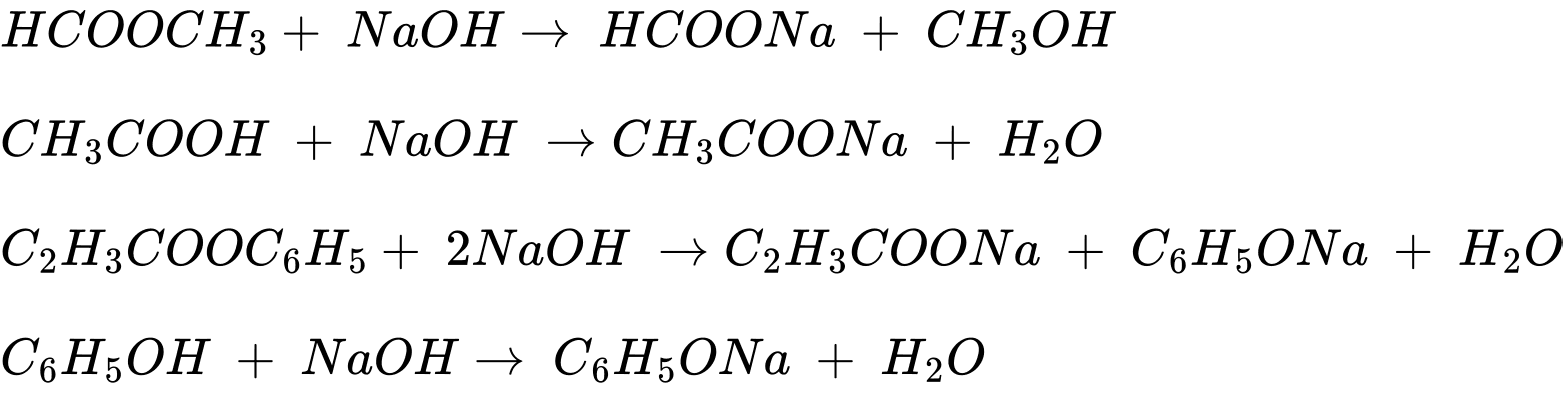
⇒ Điền đáp án: 4
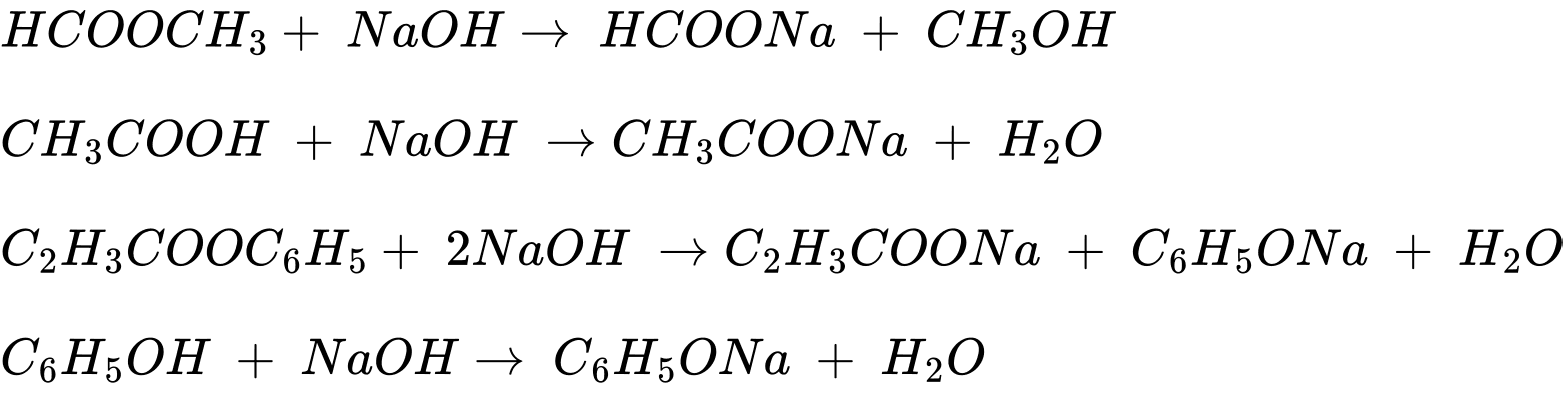
⇒ Điền đáp án: 4
Câu 26 [705508]: Hình phổ dưới đây là của một hợp chất có công thức tổng quát CnH2n+2. Phân tích và cho biết giá trị của n bằng bao nhiêu?
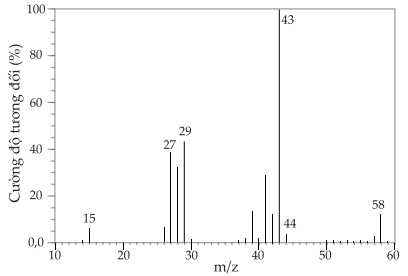

Từ phổ MS ta nhận thấy khối lượng phân tử của hợp chất hữu cơ là 58.
Ta có:
⇒ Điền đáp án: 4
Ta có:

⇒ Điền đáp án: 4
Câu 27 [705509]: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, ...) bằng oxygen không khí. Pin nhiên liệu sử dụng tế bào nhiên liệu với nguyên liệu là khí hydrogen để chuyển hoá năng lượng thành điện năng:
Anode (+): 2H2 + 4OH– 4H2O + 4e
4H2O + 4e
Cathode (–): O2 + 4e + 2H2O 4OH–
4OH–
Một máy điện sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi ngày nhà máy sản xuất được 480 kWh. Tính khối lượng (theo kg) khí hydrogen tiêu thụ trong một ngày (Làm tròn đến hàng phần mười)? Cho biết: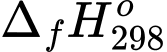 (H2O(l)) = –285,84 kJ/mol, 1 kWh = 3,6.106 J.
(H2O(l)) = –285,84 kJ/mol, 1 kWh = 3,6.106 J.
Anode (+): 2H2 + 4OH–
 4H2O + 4e
4H2O + 4eCathode (–): O2 + 4e + 2H2O
 4OH–
4OH–Một máy điện sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất là 60% (nghĩa là có 60% năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi ngày nhà máy sản xuất được 480 kWh. Tính khối lượng (theo kg) khí hydrogen tiêu thụ trong một ngày (Làm tròn đến hàng phần mười)? Cho biết:
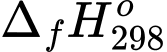 (H2O(l)) = –285,84 kJ/mol, 1 kWh = 3,6.106 J.
(H2O(l)) = –285,84 kJ/mol, 1 kWh = 3,6.106 J. 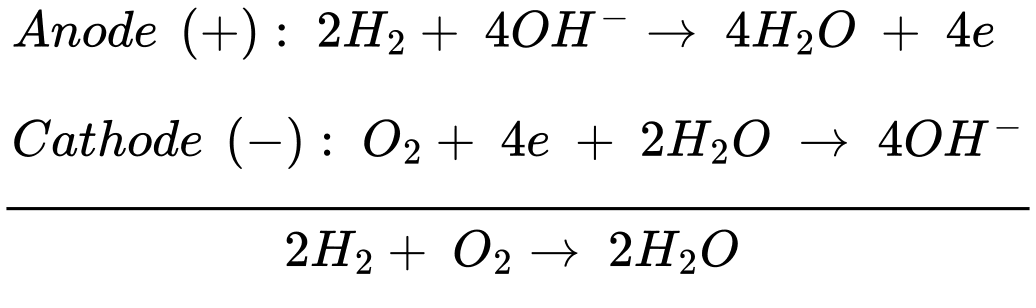
Biến thiên enthalpy của phản ứng là:
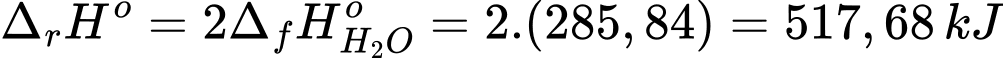
Hiệu suất chuyển hóa điện năng là 60%
2 mol H2 sẽ tạo ra năng lượng thực tế là 517,68 × 60% = 343,008 kJ
4 gam H2 sẽ tạo ra năng lượng thực tế là 343,008 kJ
x gam H2 sẽ tạo ra năng lượng thực tế là 480 × 3,6 × 103 kJ
→
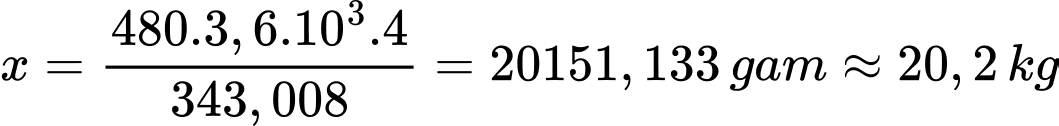
⇒ Điền đáp án: 20,2
Câu 28 [705510]: Ngộ độc carbon monoxide (CO) gây ra các triệu chứng cấp tính như nhức đầu, buồn nôn, yếu, đau thắt ngực, khó thở, mất ý thức, co giật và hôn mê. Các triệu chứng tâm thần thần kinh có thể phát triển vài tuần sau đó. Để xác định hàm lượng khí độc CO trong không khí người ta làm như sau: Lấy 25,0 L không khí (có khối lượng riêng d = 1,2 g/L). Dẫn toàn bộ mẫu khí đó đi từ từ qua thiết bị có ống đựng với lượng dư I2O5 được đốt nóng để oxi hóa toàn bộ lượng CO có trong mẫu thành CO2 và I2, lượng I2 thành hơi và được hấp thụ hết vào bình đựng lượng dư KI tạo ra phức chất KI3. Sau đó chuẩn độ KI3 bằng Na2S2O3 thì cần vừa đủ 9,6 mL dung dịch Na2S2O3 0,002M. Theo các phương trình hóa học sau:
5CO +I2O5 I2 + 5CO2
I2 + 5CO2
KI+I2 KІ3
KІ3
I3– + 2S2O32– 3I– + S4O62–
3I– + S4O62–
Biết rằng ppm là số microgam (μg) chất trong 1 gam mẫu (1 μg = 10-6 gam). Hàm lượng CO (ppm) trong mẫu không khí là bao nhiêu?
5CO +I2O5
 I2 + 5CO2
I2 + 5CO2KI+I2
 KІ3
KІ3I3– + 2S2O32–
 3I– + S4O62–
3I– + S4O62–Biết rằng ppm là số microgam (μg) chất trong 1 gam mẫu (1 μg = 10-6 gam). Hàm lượng CO (ppm) trong mẫu không khí là bao nhiêu?
Đổi 9,6 mL = 0,0096 L
Khối lượng của không khí là: mkk = 25 × 1,2 = 30 (g)
Số mol của Na2S2O3 phản ứng là: nNa2S2O3 = 0,0096 × 0,002 = 0,0000192 (mol)
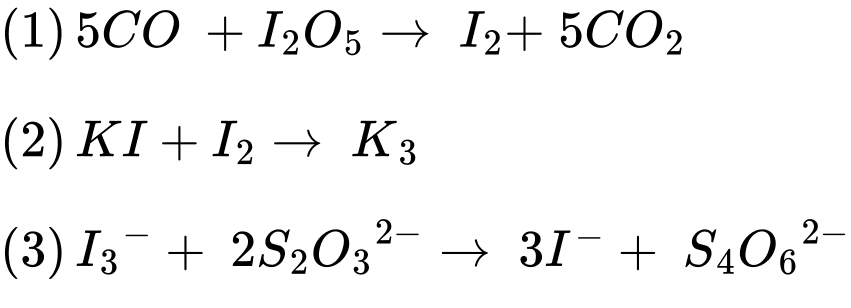
Từ phương trình hóa học số mol của CO là: nCO = 0,000048 (mol)
Hàm lượng CO trong mẫu không khí là: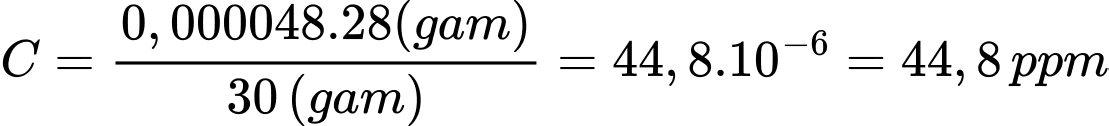
⇒ Điền đáp án: 44,8
Khối lượng của không khí là: mkk = 25 × 1,2 = 30 (g)
Số mol của Na2S2O3 phản ứng là: nNa2S2O3 = 0,0096 × 0,002 = 0,0000192 (mol)
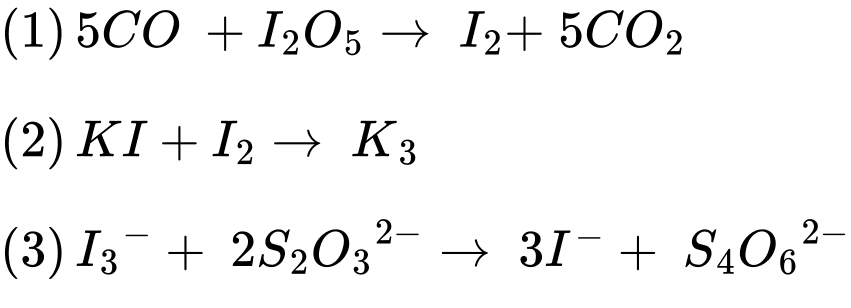
Từ phương trình hóa học số mol của CO là: nCO = 0,000048 (mol)
Hàm lượng CO trong mẫu không khí là:
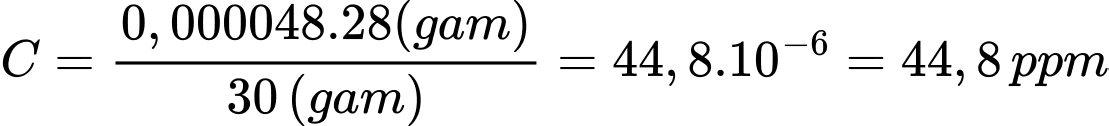
⇒ Điền đáp án: 44,8