PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705760]: Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là khử ...(1)... trong hợp chất thành ...(2)... Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, ion kim loại, ion dương.
B, nguyên tử, ion kim loại.
C, ion kim loại, nguyên tử.
D, nguyên tử, nguyên tố.
Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là khử ion kim loại trong hợp chất thành nguyên tử.
Giải thích:
- Trong hợp chất, kim loại thường tồn tại dưới dạng ion dương (Mn+). Để tách kim loại ra, ta cần khử ion Mn+ thành kim loại M bằng cách cung cấp electron. Phương trình tổng quát:
Giải thích:
- Trong hợp chất, kim loại thường tồn tại dưới dạng ion dương (Mn+). Để tách kim loại ra, ta cần khử ion Mn+ thành kim loại M bằng cách cung cấp electron. Phương trình tổng quát:
Mn+ + ne → M
Đáp án: C - Phương pháp thực hiện:
+ Dùng chất khử mạnh (C, CO, Al, H2,...): thường áp dụng cho các kim loại trung bình và yếu.
+ Điện phân (đối với kim loại hoạt động mạnh như Na, K, Al).
⇒ Chọn đáp án C
+ Dùng chất khử mạnh (C, CO, Al, H2,...): thường áp dụng cho các kim loại trung bình và yếu.
+ Điện phân (đối với kim loại hoạt động mạnh như Na, K, Al).
⇒ Chọn đáp án C
Câu 2 [309488]: Polymer nào sau đây không chứa nitrogen trong phân tử?
A, Poly(vinyl chloride).
B, Polyacrylonitrile.
C, Nylon-6,6.
D, Nylon-6.
Phân tích các mắt xích của các polymer xem thành phần nguyên tố:
✔️A. Poly(vinyl chloride): –CH2–CHCl–: chứa C, H, Cl.
❌B. Polyacrylonitrile: –CH2–CH(CN)–: chứa C, H, N.
❌C. Nylon-6,6: –HN–[CH2]6–NH–CO–[CH2]4–CO–: chứa C, H, O, N.
❌D. Nylon-6: –HN–[CH2]5CO–: chứa C, H, N, O.
⟹ Poly(vinyl chloride) là polymer không chứa nitrogen trong phân tử.
⇒ Chọn đáp án A Đáp án: A
✔️A. Poly(vinyl chloride): –CH2–CHCl–: chứa C, H, Cl.
❌B. Polyacrylonitrile: –CH2–CH(CN)–: chứa C, H, N.
❌C. Nylon-6,6: –HN–[CH2]6–NH–CO–[CH2]4–CO–: chứa C, H, O, N.
❌D. Nylon-6: –HN–[CH2]5CO–: chứa C, H, N, O.
⟹ Poly(vinyl chloride) là polymer không chứa nitrogen trong phân tử.
⇒ Chọn đáp án A Đáp án: A
Câu 3 [705761]: Potassium dichromate tinh thể có màu da cam, được sử dụng là tác nhân oxi hóa mạnh trong hóa học. Công thức hóa học của potassium dichromate là
A, K2CrO4.
B, K2Cr2O7.
C, KCrO2.
D, KCr(SO4)2.12H2O.
Potasium dichromate có công thức K2Cr2O7, là một hợp chất phản ứng hóa học vô cơ phổ biến, thường được sử dụng như là một chất oxi hóa trong các ứng dụng phòng thí nghiệm và công nghiệp khác nhau.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 4 [705762]: Cho các thí nghiệm sau
(a) Sục khí sulfur dioxide vào dung dịch barium chloride dư.
(b) Cho dung dịch potassium hydroxide vào dung dịch calcium hydrogencarbonate.
(c) Cho dung dịch hydrogen sulfide vào dung dịch copper(II) chloride.
(d) Cho khí ammonia dư vào dung dịch aluminium chlodirde.
Số thí nghiệm thu được kết tủa là
(a) Sục khí sulfur dioxide vào dung dịch barium chloride dư.
(b) Cho dung dịch potassium hydroxide vào dung dịch calcium hydrogencarbonate.
(c) Cho dung dịch hydrogen sulfide vào dung dịch copper(II) chloride.
(d) Cho khí ammonia dư vào dung dịch aluminium chlodirde.
Số thí nghiệm thu được kết tủa là
A, (a), (b), (c).
B, (b), (c), (d).
C, (a), (b), (d).
D, (a), (c), (d).
(a) Sai. Sục khí sulfur dioxide vào dung dịch barium chloride dư không có phản ứng
(b) Đúng. Cho dung dịch potassium hydroxide vào dung dịch calcium hydrogencarbonate tạo kết tủa trắng.
2KOH + Ca(HCO3)2 ⟶ CaCO3↓ + 2H2O + K2CO3.
(c) Đúng. Cho dung dịch hydrogen sulfide vào dung dịch copper(II) chloride tạo kết tủa đen. CuCl2 + H2S → CuS ↓ + 2HCl
(d) Đúng. Cho khí ammonia dư vào dung dịch aluminium chlodirde tạo kết tủa keo trắng 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Các thí nghiệm thu được kết tủa là (b) (c) (d)
⇒ Chọn đáp án B Đáp án: B
(b) Đúng. Cho dung dịch potassium hydroxide vào dung dịch calcium hydrogencarbonate tạo kết tủa trắng.
2KOH + Ca(HCO3)2 ⟶ CaCO3↓ + 2H2O + K2CO3.
(c) Đúng. Cho dung dịch hydrogen sulfide vào dung dịch copper(II) chloride tạo kết tủa đen. CuCl2 + H2S → CuS ↓ + 2HCl
(d) Đúng. Cho khí ammonia dư vào dung dịch aluminium chlodirde tạo kết tủa keo trắng 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Các thí nghiệm thu được kết tủa là (b) (c) (d)
⇒ Chọn đáp án B Đáp án: B
Câu 5 [575628]: Ion nào sau đây không có cấu hình electron giống khí hiếm?
A, Na+.
B, Al3+.
C, Cl–.
D, Fe2+.
Cấu hình electron nguyên tử Na (Z = 11): 1s2 2s2 2p6 3s1 → ion Na+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Al (Z = 13): 1s2 2s2 2p6 3s2 3p1 → ion Al3+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5 → ion Cl-: 1s2 2s2 2p6 3s2 3p6
Cấu hình electron nguyên tử Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2 → ion Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
→ ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
⇒ Chọn đáp án D Đáp án: D
Cấu hình electron nguyên tử Al (Z = 13): 1s2 2s2 2p6 3s2 3p1 → ion Al3+: 1s2 2s2 2p6
Cấu hình electron nguyên tử Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5 → ion Cl-: 1s2 2s2 2p6 3s2 3p6
Cấu hình electron nguyên tử Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2 → ion Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6
→ ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
⇒ Chọn đáp án D Đáp án: D
Câu 6 [560608]: Kim loại nào dẫn điện kém nhất trong số các kim loại dưới đây?
A, Al.
B, Ag.
C, Au.
D, Fe.
Ag dẫn điện tốt nhất, sau đó đến Cu, Au, Al, Fe,...
⇒ Trong 4 đáp án, kim loại dẫn nhiệt kém nhất là Fe.
⇒ Chọn đáp án D Đáp án: D
⇒ Trong 4 đáp án, kim loại dẫn nhiệt kém nhất là Fe.
⇒ Chọn đáp án D Đáp án: D
Câu 7 [705763]: Sản phẩm tạo thành chất kết tủa khi cho phenol tác dụng với chất nào sau đây?
A, Dung dịch NaOH.
B, Nước bromine.
C, Quỳ tím.
D, Phenolphthalein.
Khi cho phenol (C6H5OH) tác dụng với nước bromine (Br2), phản ứng thế xảy ra ở vị trí ortho và para của vòng benzene, tạo thành 2,4,6-tribromophenol (C6H2Br3OH), một chất rắn màu trắng không tan trong nước, xuất hiện dưới dạng kết tủa.
Phương trình phản ứng:
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
Phân tích các đáp án khác:
A. Phenol phản ứng với NaOH tạo dung dịch natri phenolate (C6H5ONa) tan trong nước, không tạo kết tủa.
C. Phenol làm quỳ tím hóa đỏ nhẹ, nhưng không tạo kết tủa.
D. Phenol là acid yếu, không làm phenolphthalein đổi màu, cũng không tạo kết tủa.
⇒ Chọn đáp án B Đáp án: B
Phương trình phản ứng:
C6H5OH + 3Br2 → C6H2Br3OH↓ + 3HBr
Phân tích các đáp án khác:
A. Phenol phản ứng với NaOH tạo dung dịch natri phenolate (C6H5ONa) tan trong nước, không tạo kết tủa.
C. Phenol làm quỳ tím hóa đỏ nhẹ, nhưng không tạo kết tủa.
D. Phenol là acid yếu, không làm phenolphthalein đổi màu, cũng không tạo kết tủa.
⇒ Chọn đáp án B Đáp án: B
Câu 8 [308722]: Chất nào dưới đây không có tính lưỡng tính?
A, Alanine.
B, Glutamic acid.
C, Valine.
D, Ethylamine.
- Các chất :
Alanine (CH3-CH(NH2)-COOH)
Glutamic acid (HOOC-CH2CH2CH(NH2)COOH)
Valine (CH3CH(CH3)CH(NH2)COOH)
Là các chất lưỡng do trong phân tử vừa có nhóm amino thể hiện tính base, vừa có nhóm carboxyl thể hiện tính acid.
- Ethylamine (C2H5NH2) là amine chỉ mang tính base yếu nên không phải chất lưỡng tính.
⇒ Chọn đáp án D Đáp án: D
Alanine (CH3-CH(NH2)-COOH)
Glutamic acid (HOOC-CH2CH2CH(NH2)COOH)
Valine (CH3CH(CH3)CH(NH2)COOH)
Là các chất lưỡng do trong phân tử vừa có nhóm amino thể hiện tính base, vừa có nhóm carboxyl thể hiện tính acid.
- Ethylamine (C2H5NH2) là amine chỉ mang tính base yếu nên không phải chất lưỡng tính.
⇒ Chọn đáp án D Đáp án: D
Câu 9 [308556]: Amine tồn tại ở trạng thái lỏng trong điều kiện thường là
A, aniline.
B, dimethylamine.
C, ethylamine.
D, methylamine.
Có 4 alkylamine tồn tại ở trạng thái khí nên nhớ:
+) Methylamine: CH3–NH2
+) Dimethylamine: NH(CH3)2
+) Trimethylamine: N(CH3)3
+) Ethylamine: CH3–CH2–NH2
Aniline (C6H5NH2)là một amine thơm (có nhóm –NH2 gắn vào vòng benzene), tồn tại ở trạng thái lỏng trong điều kiện thường.
⇒ Chọn đáp án A Đáp án: A
+) Methylamine: CH3–NH2
+) Dimethylamine: NH(CH3)2
+) Trimethylamine: N(CH3)3
+) Ethylamine: CH3–CH2–NH2
Aniline (C6H5NH2)là một amine thơm (có nhóm –NH2 gắn vào vòng benzene), tồn tại ở trạng thái lỏng trong điều kiện thường.
⇒ Chọn đáp án A Đáp án: A
Câu 10 [705764]: Các phân tử hemoglobin (Hb) trong tế bào máu làm nhiệm vụ vận chuyển oxygen từ phổi tới các cơ quan và vận chuyển carbon dioxide từ các cơ quan về phổi. Một trong những phản ứng quan trọng nhất của quá trình hô hấp là phản ứng giữa Hb với O2 ở phổi:
(*) Hb + O2 HbO2
HbO2
Biểu thức tốc độ của phản ứng (*) như sau:

Hàm lượng oxygen trong không khí là 21%. Nếu nồng độ oxygen giảm, tốc độ phản ứng (*) giảm đi 1,31 lần thì nhịp thở và nhịp tim tăng lên, xuất hiện cảm giác đau đầu và buồn nôn. Hàm lượng oxygen trong không khí tại thời điểm này là bao nhiêu %?
(*) Hb + O2
 HbO2
HbO2Biểu thức tốc độ của phản ứng (*) như sau:

Hàm lượng oxygen trong không khí là 21%. Nếu nồng độ oxygen giảm, tốc độ phản ứng (*) giảm đi 1,31 lần thì nhịp thở và nhịp tim tăng lên, xuất hiện cảm giác đau đầu và buồn nôn. Hàm lượng oxygen trong không khí tại thời điểm này là bao nhiêu %?
A, 10%.
B, 12%.
C, 14%.
D, 16%.
Ban đầu: 
Khi nồng độ khí oxygen giảm:
→ tốc độ phản ứng giảm 1,31 lần
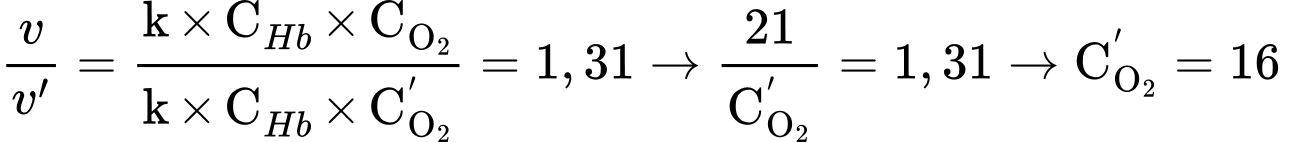
⇒ Chọn đáp án D Đáp án: D

Khi nồng độ khí oxygen giảm:

→ tốc độ phản ứng giảm 1,31 lần
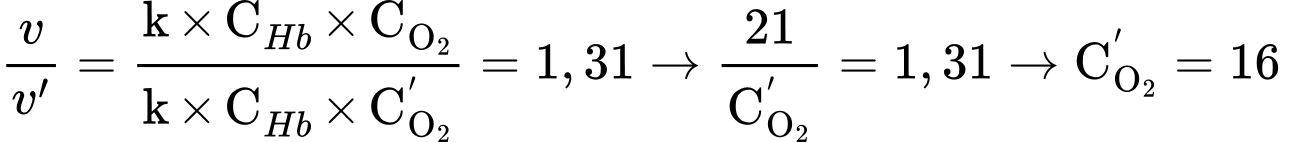
⇒ Chọn đáp án D Đáp án: D
Câu 11 [705765]: Oxide X là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, X được dùng làm chất tẩy trắng bột gỗ, sản xuất sulfuric acid. Công thức của X là
A, CO2.
B, H2S.
C, SO2.
D, P2O5.
- SO2 (sulfur dioxide) là chất khí, có mùi hắc, độc, gây ho, viêm đường hô hấp, có thể tạo mưa acid khi phản ứng với nước.
- Ứng dụng của SO2 trong đời sống: Sử dụng SO2 tẩy trắng giấy; Chất khử trùng trong sản xuất rượu vang và bia; Chất trung gian trong sản xuất acid sulfuric; Chất bảo quản thực phẩm; Chất chống oxi hóa trong sản xuất trái cây khô; Chất làm sạch trong ngành công nghiệp hóa chất; Chất phản ứng trong ngành dệt may.
Các oxide khác:
❌ A. CO2 (Carbon dioxide): Không có mùi hắc, không gây viêm đường hô hấp, không dùng để sản xuất H2SO4.
❌ B. H2S (Hydrogen sulfide): Mùi trứng thối, rất độc nhưng không được dùng để tẩy trắng bột gỗ hay sản xuất H2SO4.
❌ D. P2O5 (Diphosphorus pentoxide): Là chất rắn dạng bột trắng, không phải chất khí, không gây ho và không có mùi hắc.
⇒ Chọn đáp án C Đáp án: C
- Ứng dụng của SO2 trong đời sống: Sử dụng SO2 tẩy trắng giấy; Chất khử trùng trong sản xuất rượu vang và bia; Chất trung gian trong sản xuất acid sulfuric; Chất bảo quản thực phẩm; Chất chống oxi hóa trong sản xuất trái cây khô; Chất làm sạch trong ngành công nghiệp hóa chất; Chất phản ứng trong ngành dệt may.
Các oxide khác:
❌ A. CO2 (Carbon dioxide): Không có mùi hắc, không gây viêm đường hô hấp, không dùng để sản xuất H2SO4.
❌ B. H2S (Hydrogen sulfide): Mùi trứng thối, rất độc nhưng không được dùng để tẩy trắng bột gỗ hay sản xuất H2SO4.
❌ D. P2O5 (Diphosphorus pentoxide): Là chất rắn dạng bột trắng, không phải chất khí, không gây ho và không có mùi hắc.
⇒ Chọn đáp án C Đáp án: C
Câu 12 [308242]: Carbohydrate có cấu tạo như hình bên thuộc loại nào sau đây?
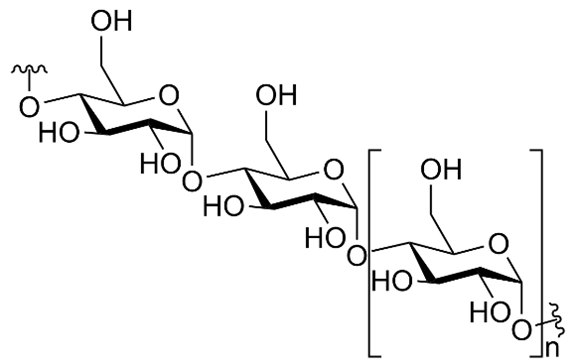

A, Monosaccharide.
B, Disaccharide.
C, Polysaccharide.
D, Lipid.
HD: Cấu tạo hợp chất đã cho có nhiều vòng thể hiện ở hệ số n; một cách trực quan: 1 vòng ⇄ monosaccharide; 2 vòng ⇄ disaccharide và nhiều vòng ⇄ polysaccharide ⇒ Hợp chất trong hình thuộc loại polysaccharide.
Cụ thể, cấu tạo được cho tương ứng là tinh bột dạng amylose (tạo bởi nhiều đơn vị (mắt xích) α-glucose qua liên kết α-1,4-glycosidic):

⇒ Chọn đáp án C Đáp án: C
Cụ thể, cấu tạo được cho tương ứng là tinh bột dạng amylose (tạo bởi nhiều đơn vị (mắt xích) α-glucose qua liên kết α-1,4-glycosidic):

⇒ Chọn đáp án C Đáp án: C
Câu 13 [705766]: Chuẩn bị các khuôn gỗ có kích thước 58 cm × 80 cm × 5 cm, ở giữa có đặt tấm thuỷ tinh được quét mỡ lợn cả hai mặt, mỗi lớp dày 3 mm. Đặt lên trên bề mặt chất béo một lớp lụa mỏng rồi rải lên trên 30 – 80 g hoa tươi khô ráo, không bị dập nát. Khoảng 30 – 40 khuôn gỗ được xếp chồng lên nhau rồi để trong phòng kín. Sau khoảng 24 – 72 giờ (tuỳ từng loại hoa), người ta thay lớp hoa mới cho đến khi lớp chất béo bão hoà tinh dầu.Phát biểu nào sau đây không đúng?
A, Quy trình trên sử dụng phương pháp chiết để lấy tinh dầu từ hoa.
B, Vai trò của chất béo (mỡ lợn) trong quy trình là làm dung môi hòa tan tinh dầu.
C, Có thể thay chất béo bằng các dung môi nước để hòa tan tinh dầu.
D, Khi đun nóng, chất béo có thể hòa tan lượng tinh dầu lớn hơn.
Phân tích các phát biểu:
✅ A. Đúng. Đây là phương pháp hấp phụ bằng chất béo lạnh, một dạng của phương pháp chiết xuất tinh dầu.
✅ B. Đúng. Chất béo có tính kỵ nước cao nên có thể hòa tan tinh dầu từ hoa một cách hiệu quả.
❌ C. Sai. Tinh dầu là hợp chất không phân cực, không tan trong nước mà tan tốt trong dung môi hữu cơ hoặc chất béo. Do đó, nước không thể thay thế chất béo trong quy trình này.
✅ D. Đúng. Khi đun nóng, chất béo giảm độ nhớt, tăng khả năng hòa tan tinh dầu. Tuy nhiên, phương pháp enfleurage thường không đun nóng để bảo vệ hương thơm tinh tế của tinh dầu.
⇒ Chọn đáp án C Đáp án: C
✅ A. Đúng. Đây là phương pháp hấp phụ bằng chất béo lạnh, một dạng của phương pháp chiết xuất tinh dầu.
✅ B. Đúng. Chất béo có tính kỵ nước cao nên có thể hòa tan tinh dầu từ hoa một cách hiệu quả.
❌ C. Sai. Tinh dầu là hợp chất không phân cực, không tan trong nước mà tan tốt trong dung môi hữu cơ hoặc chất béo. Do đó, nước không thể thay thế chất béo trong quy trình này.
✅ D. Đúng. Khi đun nóng, chất béo giảm độ nhớt, tăng khả năng hòa tan tinh dầu. Tuy nhiên, phương pháp enfleurage thường không đun nóng để bảo vệ hương thơm tinh tế của tinh dầu.
⇒ Chọn đáp án C Đáp án: C
Câu 14 [304146]: Ester CH2=C(CH3)COOCH2CH3 có tên gọi là
A, Vinyl propionate.
B, Methyl acrylate.
C, Ethyl formate.
D, Ethyl methacrylate.
Phân tích cấu tạo ester:

⇒ Chọn đáp án D Đáp án: D

⇒ Chọn đáp án D Đáp án: D
Câu 15 [705767]: “Saccharose có thể bị thuỷ phân (dưới tác dụng của enzyme hoặc acid) tạo thành ...(1)... và ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, α-glucose, β-glucose.
B, α-fructose, β-fructose.
C, glucose, fructose.
D, fructose, maltose.
Saccharose có thể bị thuỷ phân (dưới tác dụng của enzyme hoặc acid) tạo thành glucose và fructose.
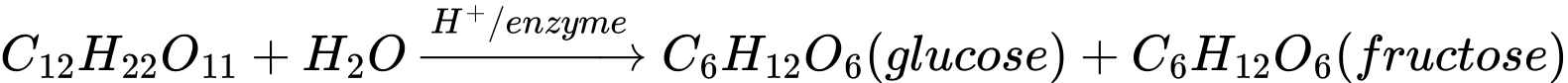
Giải thích:
- Saccharose (C12H22O11) là một disaccharide gồm glucose và fructose liên kết bằng liên kết glycosidic.
- Khi gặp acid hoặc enzyme, liên kết này bị cắt, tạo ra glucose và fructose theo tỉ lệ 1:1.
⇒ Chọn đáp án C Đáp án: C
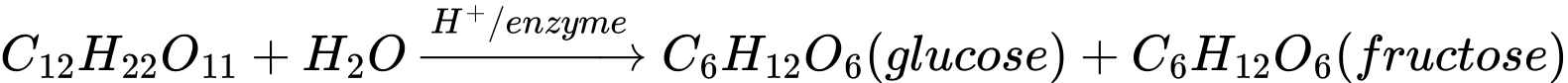
Giải thích:
- Saccharose (C12H22O11) là một disaccharide gồm glucose và fructose liên kết bằng liên kết glycosidic.
- Khi gặp acid hoặc enzyme, liên kết này bị cắt, tạo ra glucose và fructose theo tỉ lệ 1:1.
⇒ Chọn đáp án C Đáp án: C
Câu 16 [705768]: Trong thành phần của một loại phèn sắt có muối Fe2(SO4)3 và một loại phèn nhôm có muối Al2(SO4)3. Kí hiệu chung của hai muối sulfate trên là M2(SO4)3. Khi hoà tan hoàn toàn phèn sắt hoặc phèn nhôm vào nước có một số quá trình quan trọng sau:
M2(SO4)3(aq) 2M3+(aq) + 3SO42–(aq) (1)
2M3+(aq) + 3SO42–(aq) (1)
M3+(aq) + 6H2O(l) [M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) + mH2O(l)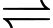 [M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
[M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
Cho các phát biểu sau:
(a) Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3).
(b) Trong nước, [M(OH2)6]3+ là một acid theo Brønsted – Lowry.
(c) Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 2.
(d) Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu.
Các phát biểu đúng là
M2(SO4)3(aq)
 2M3+(aq) + 3SO42–(aq) (1)
2M3+(aq) + 3SO42–(aq) (1)M3+(aq) + 6H2O(l)
 [M(OH2)6]3+(aq) (2)
[M(OH2)6]3+(aq) (2)[M(OH2)6]3+(aq) + mH2O(l)
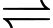 [M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)
[M(OH)m(OH2)6–m](3–m)+(aq hoặc s) + mH3O+(aq) (3)Cho các phát biểu sau:
(a) Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3).
(b) Trong nước, [M(OH2)6]3+ là một acid theo Brønsted – Lowry.
(c) Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 2.
(d) Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu.
Các phát biểu đúng là
A, (a), (b).
B, (a), (c).
C, (a), (b), (c).
D, (a), (b), (d).
Phân tích các phát biểu:
(a) Đúng. Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3). Giải thích ion M3+ là một acid theo Brønsted – Lowry.
(b) Đúng. Trong nước, [M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted - Lowry.
(c) Sai. Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 3 thì phức chất trung hòa về điện tạo dạng kết tủa không tan [M(OH)3(OH2)3] có khả năng làm trong nước
(d) Đúng. Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu do[M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted – Lowry.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án D Đáp án: D
(a) Đúng. Sự thuỷ phân của M2(SO4)3 được giải thích nhờ kết hợp các quá trình (1), (2) và (3). Giải thích ion M3+ là một acid theo Brønsted – Lowry.
(b) Đúng. Trong nước, [M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted - Lowry.
(c) Sai. Phức chất không tan, sinh ra ở quá trình (3), ứng với m = 3 thì phức chất trung hòa về điện tạo dạng kết tủa không tan [M(OH)3(OH2)3] có khả năng làm trong nước
(d) Đúng. Sau khi dùng phèn để làm trong nước thì pH của nước sẽ giảm so với ban đầu do[M(OH2)6]3+ nhường H+ nên là một acid theo Brønsted – Lowry.
Các phát biểu đúng là (a) (b) (d)
⇒ Chọn đáp án D Đáp án: D
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Bộ dụng cụ dưới đây được sử dụng để điện phân nước. Chất điện li sử dụng là H2SO4 hoặc Na2SO4
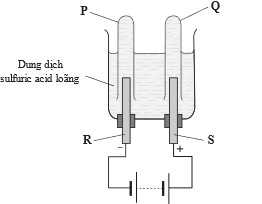

Câu 17 [705769]: Cho các nhận định sau:
(a) Na2SO4, H2SO4 giúp tăng độ dẫn điện của dung dịch.
(b) Điện cực R, S có thể là platinum hoặc carbon.
(c) Khí thu được ở P là O2, khí thu được ở Q là H2.
(d) Trong quá trình điện phân nồng độ acid giảm dần.
(e) Có thể thay dung dịch H2SO4 bằng dung dịch HCl.
Các nhận định đúng là
(a) Na2SO4, H2SO4 giúp tăng độ dẫn điện của dung dịch.
(b) Điện cực R, S có thể là platinum hoặc carbon.
(c) Khí thu được ở P là O2, khí thu được ở Q là H2.
(d) Trong quá trình điện phân nồng độ acid giảm dần.
(e) Có thể thay dung dịch H2SO4 bằng dung dịch HCl.
Các nhận định đúng là
A, (a), (b), (c).
B, (b), (c), (d).
C, (a), (b).
D, (a), (b), (e).
Phân tích các nhận định:
✔️ (a) Đúng. Na2SO4, H2SO4 giúp tăng độ dẫn điện của dung dịch nguyên do có sự phân li ra các ion H+, Na+ và SO42- giúp tăng độ dẫn điện.
✔️ (b) Đúng. Điện cực R, S có thể là platinum hoặc carbon không phản ứng với acid trong dung dịch điện phân
❌ (c) Sai. Khí thu được ở P là H2, khí thu được ở Q là O2.
Quá trình điện phân:
Cathode: (-): 2H+ + 2e ⟶ H2
2H2O + 2e ⟶ 2OH- + H2
Anode (+): 2H2O ⟶ 4H+ + O2 + 4e
❌ (d) Sai. Tại anode lượng H+ sinh ra luôn nhiều H+ mất đi tại cathode nên nồng độ H+ tăng dần.
✔️ (e) Đúng. Có thể thay dung dịch H2SO4 bằng dung dịch HCI, chủ yếu là tăng sự dẫn điện.
Các nhận định đúng là (a) (b) (e)
⇒ Chọn đáp án D Đáp án: D
✔️ (a) Đúng. Na2SO4, H2SO4 giúp tăng độ dẫn điện của dung dịch nguyên do có sự phân li ra các ion H+, Na+ và SO42- giúp tăng độ dẫn điện.
✔️ (b) Đúng. Điện cực R, S có thể là platinum hoặc carbon không phản ứng với acid trong dung dịch điện phân
❌ (c) Sai. Khí thu được ở P là H2, khí thu được ở Q là O2.
Quá trình điện phân:
Cathode: (-): 2H+ + 2e ⟶ H2
2H2O + 2e ⟶ 2OH- + H2
Anode (+): 2H2O ⟶ 4H+ + O2 + 4e
❌ (d) Sai. Tại anode lượng H+ sinh ra luôn nhiều H+ mất đi tại cathode nên nồng độ H+ tăng dần.
✔️ (e) Đúng. Có thể thay dung dịch H2SO4 bằng dung dịch HCI, chủ yếu là tăng sự dẫn điện.
Các nhận định đúng là (a) (b) (e)
⇒ Chọn đáp án D Đáp án: D
Câu 18 [705770]: Ở Q sẽ thu được bao nhiêu mL khí nếu ở P thu được 100 mL khí (cùng điều kiện áp suất).
A, 100 mL.
B, 200 mL.
C, 150 mL.
D, 50 mL.
Coi 100 mL khí như số mol.
Quá trình điện phân:
Cathode: (-): 2H+ + 2e ⟶ H2
2H2O + 2e ⟶ 2OH- + H2
Anode (+): 2H2O ⟶ 4H+ + O2 + 4e
Tại cathode số mol electron trao đổi là 200 mL
→ Thể tích khí O2 tạo thành tại anode là 50 mL.
⇒ Chọn đáp án D Đáp án: D
Quá trình điện phân:
Cathode: (-): 2H+ + 2e ⟶ H2
2H2O + 2e ⟶ 2OH- + H2
Anode (+): 2H2O ⟶ 4H+ + O2 + 4e
Tại cathode số mol electron trao đổi là 200 mL
→ Thể tích khí O2 tạo thành tại anode là 50 mL.
⇒ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705771]: Tiến hành thí nghiệm sau:
▪ Bước 1: Cho vào ống nghiệm dung dịch KMnO4 loãng có màu tím nhạt.
▪ Bước 2: Sau đó tiến hành sục khí ethylene C2H4 vào ống nghiệm.
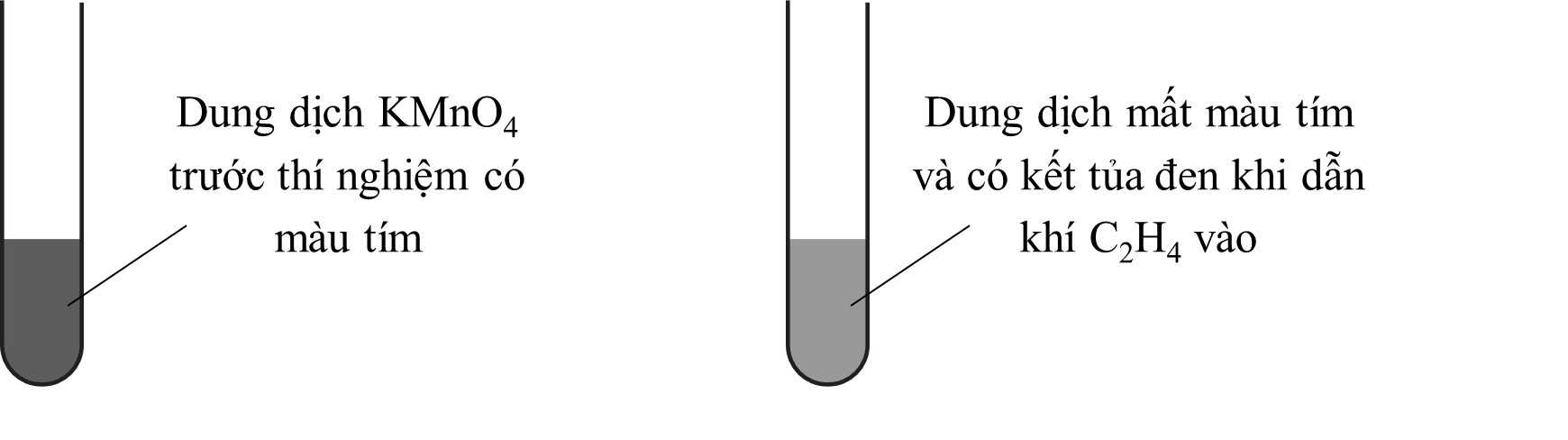
▪ Bước 1: Cho vào ống nghiệm dung dịch KMnO4 loãng có màu tím nhạt.
▪ Bước 2: Sau đó tiến hành sục khí ethylene C2H4 vào ống nghiệm.

Phân tích các phát biểu:
❌ (a) Sai. Xuất hiện kết tủa màu đen do KMnO4 bị khử thành MnO2 (Mn4+).
CH2=CH2 + 2KMnO4 + 4H2O → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
❌ (b) Sai. Sản phẩm tạo thành có ethylene glycol tan trong nước do có 2 nhóm -OH tạo liên kết hydrogen mạnh với nước.
✔️ (c) Đúng. Trong phản ứng cộng hoặc oxi hóa alkene, liên kết π (kém bền) trong C=C bị phá vỡ, chỉ còn lại liên kết σ bền hơn.
Ở đây, liên kết π trong C=C của C2H4 bị phá vỡ khi phản ứng với KMnO4 để tạo C2H4(OH)2.
✔️ (d) Đúng. Acetylene (C2H2) có liên kết ba (C≡C), có thể phản ứng với KMnO4 tạo sản phẩm oxi hóa.
Nếu dùng KMnO4 loãng, acetylene bị oxi hóa nhẹ tạo ethanediol (C2H2(OH)2) giống ethylene.
Nếu dùng KMnO4 đặc, phản ứng tiếp tục tạo ra CO2 và H2O.
Hiện tượng quan sát được: KMnO4 mất màu và có kết tủa MnO2 (giống ethylene).
❌ (a) Sai. Xuất hiện kết tủa màu đen do KMnO4 bị khử thành MnO2 (Mn4+).
CH2=CH2 + 2KMnO4 + 4H2O → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
❌ (b) Sai. Sản phẩm tạo thành có ethylene glycol tan trong nước do có 2 nhóm -OH tạo liên kết hydrogen mạnh với nước.
✔️ (c) Đúng. Trong phản ứng cộng hoặc oxi hóa alkene, liên kết π (kém bền) trong C=C bị phá vỡ, chỉ còn lại liên kết σ bền hơn.
Ở đây, liên kết π trong C=C của C2H4 bị phá vỡ khi phản ứng với KMnO4 để tạo C2H4(OH)2.
✔️ (d) Đúng. Acetylene (C2H2) có liên kết ba (C≡C), có thể phản ứng với KMnO4 tạo sản phẩm oxi hóa.
Nếu dùng KMnO4 loãng, acetylene bị oxi hóa nhẹ tạo ethanediol (C2H2(OH)2) giống ethylene.
Nếu dùng KMnO4 đặc, phản ứng tiếp tục tạo ra CO2 và H2O.
Hiện tượng quan sát được: KMnO4 mất màu và có kết tủa MnO2 (giống ethylene).
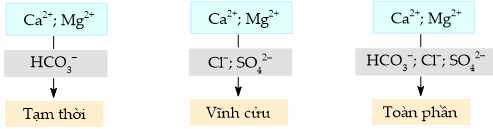
Câu 20 [705772]: Nước cứng được phân làm ba loại: nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần.

Phân tích các phát biểu:
✔️ (a) Đúng. Căn cứ để phân loại nước cứng là dựa vào thành phần của anion gốc acid tạo muối với ion Ca2+ và Mg2+:
- Nước cứng tạm thời là nguồn nước cứng mà trong thành phần của nó có chứa nhiều các ion Ca2+, Mg2+ và gốc bicarbonate (HCO3-). Do đó thành phần chính của nước cứng tạm thời sẽ là 2 muối Ca(HCO3)2 và Mg(HCO3)2.
- Nước cứng vĩnh cửu là nước cứng chứa nồng độ cao của các anion, như anion sunfate (SO42-), chloride (Cl-) với thành phần là các muối như MgCl2, CaCl2, MgSO4, CaSO4.
- Nước cứng thành phần hiểu đơn giản là loại nước cứng bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu. Do đó thành phần của nó sẽ là các muối Ca(HCO3)2, Mg(HCO3)2, MgCl2, CaCl2, MgSO4, CaSO4.
❌ (b) Sai. Các loại nước cứng đều gây hại như nhau đối với đời sống và sức khỏe con người. Nước cứng sẽ làm mất vị ngon ngọt tự nhiên của thực phẩm khi chế biến, làm giảm thời gian đun nấu chin và giảm chất dinh dưỡng. Đặc biệt, nước uống sẽ có vị tanh nồng, vì thế sẽ làm thay đổi rõ rệt màu sắc, mùi vị của sữa, cà phê, trà… làm các loại này có màu đậm hơn, ít ngọt và ít thơm, tạo ra vị chát. Không chỉ thế, ấm đun nước, cốc chén sẽ có cặn bám thành mảng rất khó vệ sinh.
❌ (c) Sai. Một dung dịch có chứa hàm lượng lớn các muối CaCl2, Ca(HCO3)2, MgSO4. Dung dịch này là nước có tính cứng toàn phần.
❌ (d) Sai. Một dung dịch nước cứng tạm thời có tổng số mol Ca2+, Mg2+ là 0,2 mol, theo định luật bảo toàn điện tích số mol của anion trong dung dịch là 0,2 × 2 = 0,4 mol.
✔️ (a) Đúng. Căn cứ để phân loại nước cứng là dựa vào thành phần của anion gốc acid tạo muối với ion Ca2+ và Mg2+:
- Nước cứng tạm thời là nguồn nước cứng mà trong thành phần của nó có chứa nhiều các ion Ca2+, Mg2+ và gốc bicarbonate (HCO3-). Do đó thành phần chính của nước cứng tạm thời sẽ là 2 muối Ca(HCO3)2 và Mg(HCO3)2.
- Nước cứng vĩnh cửu là nước cứng chứa nồng độ cao của các anion, như anion sunfate (SO42-), chloride (Cl-) với thành phần là các muối như MgCl2, CaCl2, MgSO4, CaSO4.
- Nước cứng thành phần hiểu đơn giản là loại nước cứng bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu. Do đó thành phần của nó sẽ là các muối Ca(HCO3)2, Mg(HCO3)2, MgCl2, CaCl2, MgSO4, CaSO4.
❌ (b) Sai. Các loại nước cứng đều gây hại như nhau đối với đời sống và sức khỏe con người. Nước cứng sẽ làm mất vị ngon ngọt tự nhiên của thực phẩm khi chế biến, làm giảm thời gian đun nấu chin và giảm chất dinh dưỡng. Đặc biệt, nước uống sẽ có vị tanh nồng, vì thế sẽ làm thay đổi rõ rệt màu sắc, mùi vị của sữa, cà phê, trà… làm các loại này có màu đậm hơn, ít ngọt và ít thơm, tạo ra vị chát. Không chỉ thế, ấm đun nước, cốc chén sẽ có cặn bám thành mảng rất khó vệ sinh.
❌ (c) Sai. Một dung dịch có chứa hàm lượng lớn các muối CaCl2, Ca(HCO3)2, MgSO4. Dung dịch này là nước có tính cứng toàn phần.
❌ (d) Sai. Một dung dịch nước cứng tạm thời có tổng số mol Ca2+, Mg2+ là 0,2 mol, theo định luật bảo toàn điện tích số mol của anion trong dung dịch là 0,2 × 2 = 0,4 mol.
Câu 21 [705773]: Tiến hành các thí nghiệm:
▪ Bước 1: Cho từ từ từng giọt dung dịch NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4 thì có kết tủa xuất hiện. Lắc ống nghiệm trong quá trình thêm dung dịch NH3.
▪ Bước 2: Tiếp tục cho NH3 đến khi kết tủa tan hết, dung dịch trong ống nghiệm chuyển sang màu xanh lam thì dừng.
▪ Bước 1: Cho từ từ từng giọt dung dịch NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4 thì có kết tủa xuất hiện. Lắc ống nghiệm trong quá trình thêm dung dịch NH3.
▪ Bước 2: Tiếp tục cho NH3 đến khi kết tủa tan hết, dung dịch trong ống nghiệm chuyển sang màu xanh lam thì dừng.
Thí nghiệm diễn ra như sau:
Bước 1: Thêm NH3 vào CuSO4 → Kết tủa xuất hiện
Phản ứng xảy ra:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ + (NH4)2SO4
Kết tủa Cu(OH)2 có màu xanh lam nhạt.
Bước 2: Thêm dư NH3 → Kết tủa tan, dung dịch xanh đậm. Lúc này Cu(OH)2 tan tạo phức:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Dung dịch chuyển thành màu xanh đậm do ion phức [Cu(NH3)4](OH)2.
Phân tích các phát biểu:
❌ (a) Sai. Kết tủa Cu(OH)2 xuất hiện ở bước 1 có màu xanh.
✔️ (b) Đúng. Ở bước 2 có hình thành phức chất [Cu(NH3)4](OH)2.
✔️ (c) Đúng. NH3 khi tan trong nước có sự phân li ra ion OH- tạo môi trường base nên giá trị pH của dung dịch tăng dần.
Bước 1: Thêm NH3 vào CuSO4 → Kết tủa xuất hiện
Phản ứng xảy ra:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2↓ + (NH4)2SO4
Kết tủa Cu(OH)2 có màu xanh lam nhạt.
Bước 2: Thêm dư NH3 → Kết tủa tan, dung dịch xanh đậm. Lúc này Cu(OH)2 tan tạo phức:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Dung dịch chuyển thành màu xanh đậm do ion phức [Cu(NH3)4](OH)2.
Phân tích các phát biểu:
❌ (a) Sai. Kết tủa Cu(OH)2 xuất hiện ở bước 1 có màu xanh.
✔️ (b) Đúng. Ở bước 2 có hình thành phức chất [Cu(NH3)4](OH)2.
✔️ (c) Đúng. NH3 khi tan trong nước có sự phân li ra ion OH- tạo môi trường base nên giá trị pH của dung dịch tăng dần.
NH3 + H2O ⇌ NH4+ + OH-
✔️ (d) Đúng. Ngoài NH3, các amine CH3NH2, C2H5NH2 cũng có tính chất tương tự (còn cặp electron chưa liên kết) nên có thể tạo phức với ion Cu2+.
Câu 22 [705774]: Đặt hỗn hợp các amino acid gồm lysine, glycine và glutamic acid ở pH = 6,0 vào trong một điện trường.
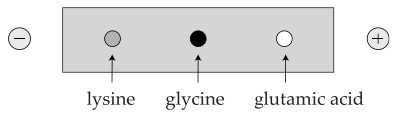
Sự di chuyển của một số amino acid dưới tác dụng của điện trường ở pH = 6.

Sự di chuyển của một số amino acid dưới tác dụng của điện trường ở pH = 6.
Phân tích các phát biểu:
✔️ (a) Đúng. pH của dung dịch bằng điểm đẳng điện (pH = pI ≈ 6,0), glycine tồn tại chủ yếu ở dạng lưỡng cực ion trung hòa nên không chịu tác dụng của điện trường.
❌ (b) Sai. Lysine có hai nhóm amine (–NH2) và một nhóm carboxyl (–COOH). Ở pH = 6, lysine có dạng H3N+–CH(CH2)4–NH3+–COO– ⟶ Điện tích của lysine là +1.
❌ (c) Sai. Glutamic acid có hai nhóm –COOH và một nhóm –NH2. Ở pH = 6, nó tồn tại chủ yếu ở dạng H2N–CH(CH2–COO–)–COO–, mang điện tích âm (anion) nên di chuyển về cực dương.
✔️ (d) Đúng. Glycine gần như không di chuyển, lysine di chuyển về cực âm và glutamic acid di chuyển về cực dương nên ta có thể tách chúng ra bằng phương pháp điện di.
✔️ (a) Đúng. pH của dung dịch bằng điểm đẳng điện (pH = pI ≈ 6,0), glycine tồn tại chủ yếu ở dạng lưỡng cực ion trung hòa nên không chịu tác dụng của điện trường.
❌ (b) Sai. Lysine có hai nhóm amine (–NH2) và một nhóm carboxyl (–COOH). Ở pH = 6, lysine có dạng H3N+–CH(CH2)4–NH3+–COO– ⟶ Điện tích của lysine là +1.
❌ (c) Sai. Glutamic acid có hai nhóm –COOH và một nhóm –NH2. Ở pH = 6, nó tồn tại chủ yếu ở dạng H2N–CH(CH2–COO–)–COO–, mang điện tích âm (anion) nên di chuyển về cực dương.
✔️ (d) Đúng. Glycine gần như không di chuyển, lysine di chuyển về cực âm và glutamic acid di chuyển về cực dương nên ta có thể tách chúng ra bằng phương pháp điện di.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705775]: Trong phức chất [Fe(H2O)6]Cl3. Xung quanh một nguyên tử trung tâm có bao nhiêu phối tử?
Trong phức chất [Fe(H2O)6]Cl3, nguyên tử Fe3+ là ion trung tâm, và có 6 phân tử H2O liên kết với nó dưới dạng phối tử.
⇒ Số phối tử trong phức [Fe(H2O)6]Cl3 là 6.
⇒ Điền đáp án: 6
⇒ Số phối tử trong phức [Fe(H2O)6]Cl3 là 6.
⇒ Điền đáp án: 6
Câu 24 [684510]: Rosmarinic acid thường có trong các loại thảo mộc như hương thảo, xô thơm, cỏ xạ hương....có công thức cấu tạo như sau:
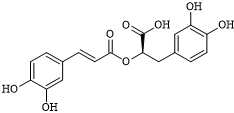
Khi đun nóng 1 mol rosmarinic acid phản ứng được bao nhiêu mol NaOH?

Khi đun nóng 1 mol rosmarinic acid phản ứng được bao nhiêu mol NaOH?
Rosmarinic acid là một hợp chất tạp chức có chứa các nhóm chức phenol, ester, carboxylic acid.
Khi cho Rosmarinic acid tác dụng với NaOH các nhóm chức phenol và carboxylic acid sẽ phản ứng.
Trong đó, phân tử Rosmarinic acid chứa 4 nhóm chức -OH (phenol) gắn trực tiếp vào vòng benzene, 1 nhóm chức (-COO-) ester và 1 nhóm chức -COOH (carboxylic acid) nên khi đun nóng 1 mol Rosmarinic acid phản ứng với 6 mol NaOH.
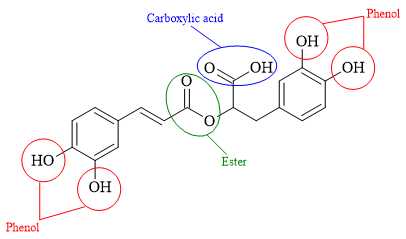
⇒ Điền đáp án: 6
Khi cho Rosmarinic acid tác dụng với NaOH các nhóm chức phenol và carboxylic acid sẽ phản ứng.
Trong đó, phân tử Rosmarinic acid chứa 4 nhóm chức -OH (phenol) gắn trực tiếp vào vòng benzene, 1 nhóm chức (-COO-) ester và 1 nhóm chức -COOH (carboxylic acid) nên khi đun nóng 1 mol Rosmarinic acid phản ứng với 6 mol NaOH.

⇒ Điền đáp án: 6
Câu 25 [705776]: Cho dãy các polymer sau: nylon-6,6; polyacrylonitril, polybutadiene, poly(methyl methacrylate), poly(vinyl chloride). Có bao nhiêu polimer được điều chế bằng phản ứng trùng hợp?
✩ Phản ứng trùng hợp: Các monomer không mất nguyên tử hay phân tử nhỏ, chỉ liên kết với nhau để tạo polymer.
✩ Phản ứng trùng ngưng: Các monomer loại bỏ một phân tử nhỏ (H2O, NH3, HCl,...) trong quá trình tạo liên kết.
Xét từng polymer trong dãy:
❌ Nylon-6,6: Được điều chế từ hexamethylenediamine và adipic acid. Phản ứng tạo liên kết amide (-CO-NH-), có sự tách H2O.
⟶ Điều chế bằng phản ứng trùng ngưng.
✅ Polyacrylonitril: Monomer CH2=CH-CN. Quá trình trùng hợp liên kết đôi C=C để tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Polybutadiene: Monomer: CH2=CH-CH=CH2. Trùng hợp liên kết đôi C=C tạo chuỗi polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Poly(methyl methacrylate): Monomer CH2=C(CH3)-COOCH3. Trùng hợp liên kết đôi C=C tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Poly(vinyl chloride): Monomer CH2=CHCl. Trùng hợp liên kết đôi C=C tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
⇒ Có 4 polymer được điều chế bằng phản ứng trùng hợp.
⇒ Điền đáp án: 4
✩ Phản ứng trùng ngưng: Các monomer loại bỏ một phân tử nhỏ (H2O, NH3, HCl,...) trong quá trình tạo liên kết.
Xét từng polymer trong dãy:
❌ Nylon-6,6: Được điều chế từ hexamethylenediamine và adipic acid. Phản ứng tạo liên kết amide (-CO-NH-), có sự tách H2O.
⟶ Điều chế bằng phản ứng trùng ngưng.
✅ Polyacrylonitril: Monomer CH2=CH-CN. Quá trình trùng hợp liên kết đôi C=C để tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Polybutadiene: Monomer: CH2=CH-CH=CH2. Trùng hợp liên kết đôi C=C tạo chuỗi polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Poly(methyl methacrylate): Monomer CH2=C(CH3)-COOCH3. Trùng hợp liên kết đôi C=C tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
✅ Poly(vinyl chloride): Monomer CH2=CHCl. Trùng hợp liên kết đôi C=C tạo polymer.
⟶ Điều chế bằng phản ứng trùng hợp.
⇒ Có 4 polymer được điều chế bằng phản ứng trùng hợp.
⇒ Điền đáp án: 4
Câu 26 [705777]: Quan sát phổ khối bên dưới. Một hợp chất C2H5Br có hai đỉnh ion phân tử tại m/z = 108 và m/z = a. Giá trị của a bằng bao nhiêu?
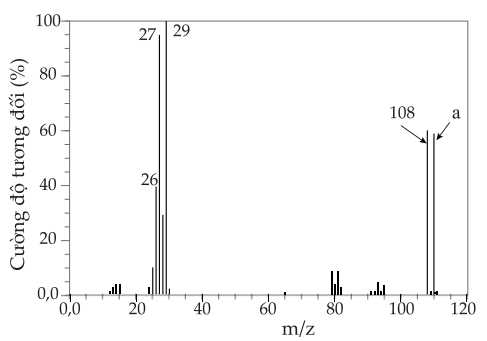

Từ phổ MS ta nhận thấy rằng peak m/z = 108 nhỏ hơn a → peak 108 có thể ứng với mảnh ion là

Từ phổ MS ta nhận thấy rằng peak m/z = a là lớn nhất ứng với khối lượng phân tử của C2H5Br:
MC2H5Br = 12 × 2 + 5 + 80 = 109.
→ Giá trị a là 109.
⇒ Điền đáp án: 109

Từ phổ MS ta nhận thấy rằng peak m/z = a là lớn nhất ứng với khối lượng phân tử của C2H5Br:
MC2H5Br = 12 × 2 + 5 + 80 = 109.
→ Giá trị a là 109.
⇒ Điền đáp án: 109
Câu 27 [705778]: Khí Biogas còn gọi là khí sinh học. Thành phần chính của khí sinh học Biogas có khí methane chiếm 60% thể tích còn lại là carbon dioxide và các khí khác. Một bình gas (khí hóa lỏng) chứa hỗn hợp propane và butane với tỉ lệ mol 1 : 2. Khi được đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ, 1 mol butane tỏa ra lượng nhiệt là 2874 kJ và 1 mol methane tỏa ra lượng nhiệt là 890,5 kJ. Trung bình 60 ngày một hộ gia đình cần dùng hết một bình “ga” loại 12 kg. Thể tích khí Biogas tối thiểu cần dùng để tạo ra lượng nhiệt tương đương khi đốt cháy 1 bình “ga” loại 12 kg là bao nhiêu m3 (đkc)? (Làm tròn đến hàng phần mười)
Gọi nC3H8 = a mol, nC4H10 = b mol
Đổi 12 kg = 12000 gam
Ta có: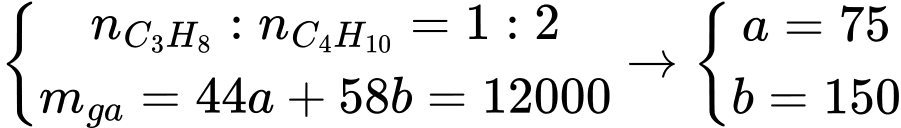
Lượng nhiệt bình ga tỏa ra là: 75 × 2220 + 150 × 2874 = 597600 kJ
Số mol khí biogas cần là: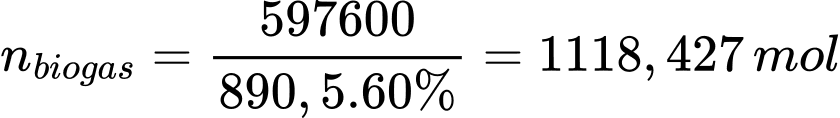
Thể tích khí biogas cần là: Vbiogas = 1118,427 × 24,79 = 27726,92 L ≈ 27,7 m3
⇒ Điền đáp án: 27,7
Đổi 12 kg = 12000 gam
Ta có:
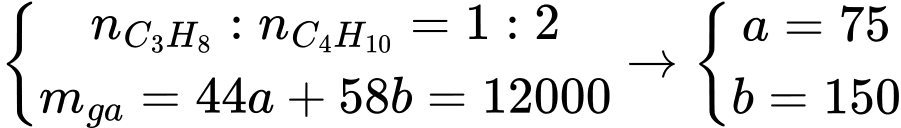
Lượng nhiệt bình ga tỏa ra là: 75 × 2220 + 150 × 2874 = 597600 kJ
Số mol khí biogas cần là:
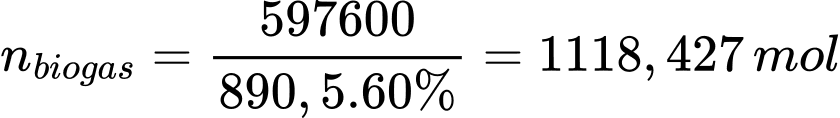
Thể tích khí biogas cần là: Vbiogas = 1118,427 × 24,79 = 27726,92 L ≈ 27,7 m3
⇒ Điền đáp án: 27,7
Câu 28 [705779]: Hydro peroxide, hoặc hydrogen peroxide (có công thức là H2O2) thường gọi là nước oxi già, là một chất oxy hóa dạng lỏng trong suốt, đặc tính nhớt, có các thuộc tính oxi hóa mạnh, là chất tẩy trắng mạnh được sử dụng như là chất tẩy uế, cũng như làm chất oxi hóa. Để kiểm chứng nồng độ dung dịch H2O2 trong một lọ oxi già nồng độ khoảng 3% thể tích 60 mL. Lấy 10 mL dung dịch H2O2 từ lọ trên, tiến hành chuẩn độ 3 lần bằng dung dịch KMnO4 0,1 M đã được acid hóa H2SO4 thì kết quả thu được theo bảng sau:
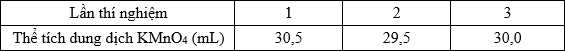
Biết phản ứng chuẩn độ:
5H2O2 + 2KMnO4 + 3H2SO4 K2SO4 + 2MnSO4 + 5O2 + 8H2O.
Xác định hàm lượng H2O2 (%) trong lọ oxi già. Giả sử khối lượng riêng của dung dịch H2O2 trong lọ là 1 g/cm3.
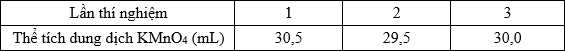
Biết phản ứng chuẩn độ:
5H2O2 + 2KMnO4 + 3H2SO4 K2SO4 + 2MnSO4 + 5O2 + 8H2O.
Xác định hàm lượng H2O2 (%) trong lọ oxi già. Giả sử khối lượng riêng của dung dịch H2O2 trong lọ là 1 g/cm3.
Thể tích trung bình của dich dịch KMnO4 là: 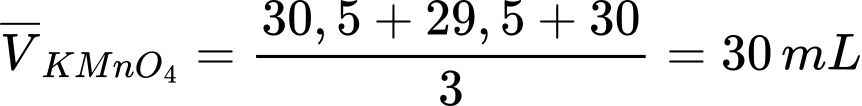
Đổi 30 mL = 0,03 L
Khối lượng của 10 mL H2O2 là 10 gam (dH2O2 = 1 gam/cm3)
Số mol của KMnO4 là: nKMnO4 = 0,03 × 0,1 = 0,003 mol
Từ phương trình hóa học số mol của H2O2 là: nH2O2 = 0,0075 mol
Hàm lượng H2O2 trong lọ oxi già là: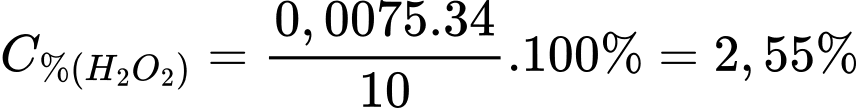
⇒ Điền đáp án: 2,55
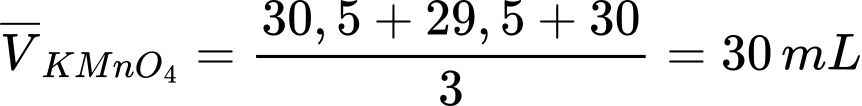
Đổi 30 mL = 0,03 L
Khối lượng của 10 mL H2O2 là 10 gam (dH2O2 = 1 gam/cm3)
Số mol của KMnO4 là: nKMnO4 = 0,03 × 0,1 = 0,003 mol
Từ phương trình hóa học số mol của H2O2 là: nH2O2 = 0,0075 mol
Hàm lượng H2O2 trong lọ oxi già là:
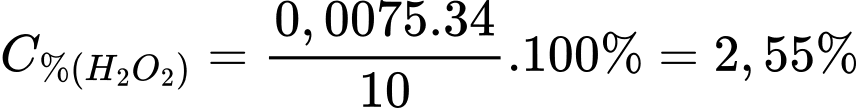
⇒ Điền đáp án: 2,55