PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705359]: Khi tan trong nước, muối của các kim loại chuyển tiếp …(1)… thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kêt cho - nhận, tạo ra phức chất aqua có dạng tổng quát là ...(2)... Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, điện li, [M(OH2)m]n+.
B, điện li, [M(OH2)n]+.
C, phân li, [M(OH2)n]+.
D, phân li, [M(OH2)m]n+.
Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kêt cho - nhận, tạo ra phức chất aqua có dạng tổng quát là [M(OH2)m]n+.
- Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Mn+(aq) + mH2O(l) →[M(OH2)m]n+(aq)
- Trong đó:
+ n là giá trị điện tích của cation kim loại M
+ m là số phối tử H2O
+ [M(OH2)m]n+ là công thức tổng quát của phức chất aqua của Mn+.
⇒ Chọn đáp án D Đáp án: D
- Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Mn+(aq) + mH2O(l) →[M(OH2)m]n+(aq)
- Trong đó:
+ n là giá trị điện tích của cation kim loại M
+ m là số phối tử H2O
+ [M(OH2)m]n+ là công thức tổng quát của phức chất aqua của Mn+.
⇒ Chọn đáp án D Đáp án: D
Câu 2 [619770]: Trong tự nhiên, calcium sulfate tồn tại dưới dạng muối ngậm nước (CaSO4, 2H2O) được gọi là
A, bauxite.
B, đá vôi.
C, thạch cao nung.
D, thạch cao sống.
Phân tích các đáp án:
❌A. Bauxite là Al2O3.2H2O.
❌B. Đá vôi là CaCO3.
❌C. Thạch cao nung là CaSO4.H2O.
✔️D. Thạch cao sống là CaSO4.2H2O.
⇒ Chọn đáp án D.
Đáp án: D
❌A. Bauxite là Al2O3.2H2O.
❌B. Đá vôi là CaCO3.
❌C. Thạch cao nung là CaSO4.H2O.
✔️D. Thạch cao sống là CaSO4.2H2O.
⇒ Chọn đáp án D.
Đáp án: D
Câu 3 [705360]: Chất nào sau đây có khả năng tham gia phản ứng trùng hợp?
A, Butane.
B, Isoprene.
C, Hexamethylenediamine.
D, Toluene.
Phản ứng trùng hợp là phản ứng kết hợp nhiều phân tử nhỏ (monomer) giống nhau hay tương tự nhau tạo thành phân tử lớn (polymer).
Điều kiện về cấu tạo của monomer có thể tham gia phản ứng trùng hợp: trong phân tử phải có các liên kết bội như CH2=CH2, CH2=CHCl,… hoặc vòng kém bền.
Phân tích các chất:
❌ A. Butane (C4H10): Là hydrocarbon no, không có liên kết đôi C=C → Không trùng hợp.
✔️ B. Isoprene (CH2=C(CH3)-CH=CH2): Có hai liên kết đôi C=C trong phân tử, có thể tham gia phản ứng trùng hợp để tạo cao su → Có thể trùng hợp.
❌ C. Hexamethylenediamine (H2N-(CH2)6-NH2): Thường tham gia trùng ngưng với dicacboxylic acid để tạo nylon, không phải phản ứng trùng hợp thông thường → Không phù hợp.
❌ D. Toluene (C6H5CH3): Là hợp chất thơm, không có liên kết đôi C=C ngoài vòng benzen, không tham gia phản ứng trùng hợp → Không trùng hợp.
⇒ Chọn đáp án B Đáp án: B
Điều kiện về cấu tạo của monomer có thể tham gia phản ứng trùng hợp: trong phân tử phải có các liên kết bội như CH2=CH2, CH2=CHCl,… hoặc vòng kém bền.
Phân tích các chất:
❌ A. Butane (C4H10): Là hydrocarbon no, không có liên kết đôi C=C → Không trùng hợp.
✔️ B. Isoprene (CH2=C(CH3)-CH=CH2): Có hai liên kết đôi C=C trong phân tử, có thể tham gia phản ứng trùng hợp để tạo cao su → Có thể trùng hợp.
❌ C. Hexamethylenediamine (H2N-(CH2)6-NH2): Thường tham gia trùng ngưng với dicacboxylic acid để tạo nylon, không phải phản ứng trùng hợp thông thường → Không phù hợp.
❌ D. Toluene (C6H5CH3): Là hợp chất thơm, không có liên kết đôi C=C ngoài vòng benzen, không tham gia phản ứng trùng hợp → Không trùng hợp.
⇒ Chọn đáp án B Đáp án: B
Câu 4 [705361]: Tiến hành các thí nghiệm sau:
(a) Cho kim loại đồng (copper) vào dung dịch iron(II) nitrate.
(b) Sục khí carbonic vào dung dịch sodium hydroxide.
(c) Cho sodium hidrogencarbonate vào dung dịch calcium chloride rồi đun nóng.
(d) Cho Fe(NO3)2 vào dung dịch NaHSO4.
Những thí nghiệm có phản ứng hóa học xảy ra là
(a) Cho kim loại đồng (copper) vào dung dịch iron(II) nitrate.
(b) Sục khí carbonic vào dung dịch sodium hydroxide.
(c) Cho sodium hidrogencarbonate vào dung dịch calcium chloride rồi đun nóng.
(d) Cho Fe(NO3)2 vào dung dịch NaHSO4.
Những thí nghiệm có phản ứng hóa học xảy ra là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các thí nghiệm:
❌ Thí nghiệm (a) Cho kim loại đồng (copper) vào dung dịch iron(II) nitrate → Không có phản ứng
✔️ Thí nghiệm (b) Sục khí carbonic vào dung dịch sodium hydroxide.
CO2 + NaOH → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
✔️ Thí nghiệm (c) Cho sodium hidrogencarbonate vào dung dịch calcium chloride rồi đun nóng.
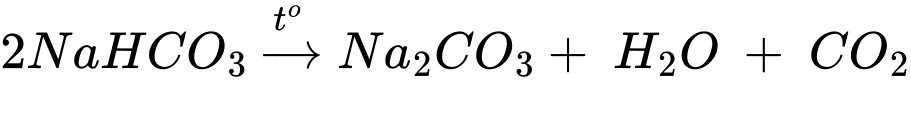
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
✔️ Thí nghiệm (d) Cho Fe(NO3)2 vào dung dịch NaHSO4.
9Fe(NO3)2 + 12NaHSO4 → 2Fe2(SO4)3 + 5Fe(NO3)3 + 6Na2SO4 + 3NO + 6H2O
⇒ Chọn đáp án D
❌ Thí nghiệm (a) Cho kim loại đồng (copper) vào dung dịch iron(II) nitrate → Không có phản ứng
✔️ Thí nghiệm (b) Sục khí carbonic vào dung dịch sodium hydroxide.
CO2 + NaOH → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
✔️ Thí nghiệm (c) Cho sodium hidrogencarbonate vào dung dịch calcium chloride rồi đun nóng.
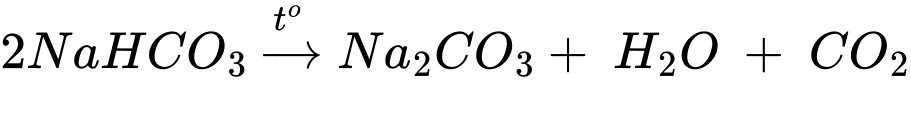
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
✔️ Thí nghiệm (d) Cho Fe(NO3)2 vào dung dịch NaHSO4.
9Fe(NO3)2 + 12NaHSO4 → 2Fe2(SO4)3 + 5Fe(NO3)3 + 6Na2SO4 + 3NO + 6H2O
⇒ Chọn đáp án D
Câu 5 [243436]: Nguyên tử magnesium có cấu hình electron là: 1s22s22p63s2. Sau khi tạo liên kết ion, điện tích của ion magnesium là
A, 2+.
B, 2.
C, 2–.
D, 3+.
Nguyên tử magnesium có 12 electron nên khi tham gia liên kết có xu hướng nhường đi 2 electron để đạt cấu hình của nguyên tử nguyên tố khí hiếm gần nhất là neon (Z = 10), tạo thành cation Mg2+.
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 6 [560805]: Trong các kim loại sau, kim loại nào thường được dùng làm tế bào quang điện?
A, Na.
B, K.
C, Rb.
D, Cs.
- Cs có khả năng dễ dàng nhả electron khi bị chiếu sáng, có tính năng quang điện tốt.
- Na (Natri), K (Kali) và Rb (Rubidi) không được sử dụng trong các tế bào quang điện chủ yếu vì khó cho electron hơn khi bị chiếu sáng, có tính ổn định kém và hiệu suất kém.
⟹ Chọn đáp án D Đáp án: D
- Na (Natri), K (Kali) và Rb (Rubidi) không được sử dụng trong các tế bào quang điện chủ yếu vì khó cho electron hơn khi bị chiếu sáng, có tính ổn định kém và hiệu suất kém.
⟹ Chọn đáp án D Đáp án: D
Câu 7 [705362]: Quá trình đốt cháy hỗn hợp nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là
A, ammonia.
B, Nitrogen dioxide.
C, nitrogen monoxide.
D, nitrogen.
Phân tử NO chỉ có 1 nguyên tử O nên có tên gọi là nitrogen monoxide, khác với NO2 có 2 nguyên tử O nên có tên gọi nitrogen dioxide.
- Ammonia có công thức NH3
- Nitrogen: N2
⇒ Chọn đáp án C Đáp án: C
- Ammonia có công thức NH3
- Nitrogen: N2
⇒ Chọn đáp án C Đáp án: C
Câu 8 [304784]: Chất nào sau đây có nhiệt độ sôi cao nhất?
A, C2H5OH.
B, CH3COOH.
C, HCOOCH3.
D, C2H6.
HD: ► Các chất so sánh có cùng số nguyên tử carbon:
⇒ Thứ tự tổng quát: hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ C2H6 < HCOOCH3 < C2H5OH < CH3COOH.
⇒ Chất có nhiệt độ sôi lớn nhất trong dãy là CH3COOH
⇒ Chọn đáp án B Đáp án: B
⇒ Thứ tự tổng quát: hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ C2H6 < HCOOCH3 < C2H5OH < CH3COOH.
⇒ Chất có nhiệt độ sôi lớn nhất trong dãy là CH3COOH
⇒ Chọn đáp án B Đáp án: B
Câu 9 [705363]: Hàm lượng oxygen trong không khí là 21%. Nếu hàm lượng oxygen trong không khí giảm xuống đến 16%, để có đủ oxygen cho cơ thể con người, nhịp thở và nhịp tim tăng lên, xuất hiện cảm giác đau đầu và buồn nôn. Nếu hàm lượng oxygen trong không khí giảm xuống còn 12% sẽ gây chóng mặt, không đứng vững. Nếu hàm lượng oxygen trong không khí còn 8% sẽ gây bất tỉnh, thiệt mạng trong 7 – 8 phút. Một trong những phản ứng quan trọng nhất của quá trình hô hấp là phản ứng giữa Hb với O2 ở phổi:
(*) Hb + O2 HbO2
HbO2
Biểu thức tốc độ của phản ứng (*) như sau:

Nếu tốc độ phản ứng (*) giảm 2 lần thì nồng độ oxygen trong không khí tại thời điểm này là
(*) Hb + O2
 HbO2
HbO2Biểu thức tốc độ của phản ứng (*) như sau:

Nếu tốc độ phản ứng (*) giảm 2 lần thì nồng độ oxygen trong không khí tại thời điểm này là
A, 8,0%.
B, 10,5%.
C, 14,8%.
D, 20,5%.
Ban đầu: 
Khi nồng độ khí oxygen giảm thì tốc độ phản ứng:
→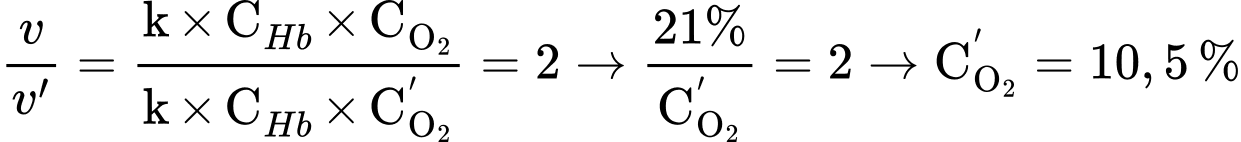
⇒ Chọn đáp án B Đáp án: B

Khi nồng độ khí oxygen giảm thì tốc độ phản ứng:

→
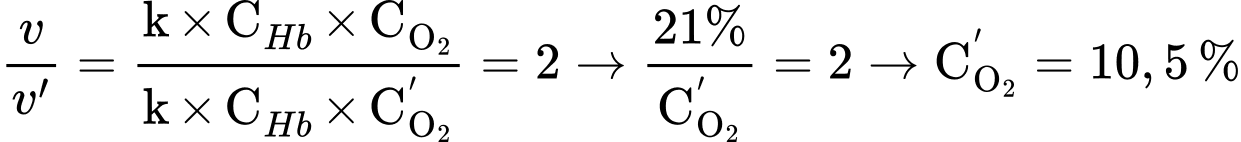
⇒ Chọn đáp án B Đáp án: B
Câu 10 [705364]: Chất, dung dịch tác dụng với phenol sinh ra chất khí là
A, dung dịch KOH.
B, dung dịch K2CO3.
C, kim loại Na.
D, kim loại Ag.
Phenol có thể tác dụng được với Na như rượu nhưng khác với rượu, muối phenolate không bị nước phân hủy.
2C6H5OH + 2Na → 2C6H5ONa + H2
⇒ Chọn đáp án C Đáp án: C
2C6H5OH + 2Na → 2C6H5ONa + H2
⇒ Chọn đáp án C Đáp án: C
Câu 11 [309408]: Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do
A, Phản ứng thủy phân của protein.
B, Phản ứng màu của protein.
C, Sự đông tụ của lipid.
D, Sự đông tụ của protein do nhiệt độ.
Protein sẽ bị đông tụ dưới tác dụng của nhiệt, acid, base hoặc ion kim loại nặng. Sự đông tụ này xảy ra do cấu tạo ban đầu của protein bị biến đổi.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 12 [308243]: Cho công thức chiếu Haworth của hợp chất carbohydrate như hình bên. Phân tử carbohydrate đang ở dạng
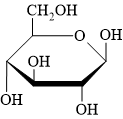

A, alpha (α).
B, beta (β).
C, gamma (γ).
D, sigma (δ).
HD: Mẹo nhỏ: quan sát nhóm CH2OH (khác biệt nhất là nhóm OH không đính vào vòng).
• β = bê (bờ) = bần cùng ⇒ nhóm OH đính vào C1 cùng phía với CH2OH.
• ⇒ α có nhóm OH đính vào C1 khác phía với nhóm CH2OH.
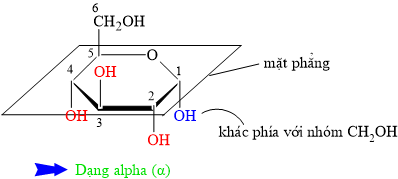
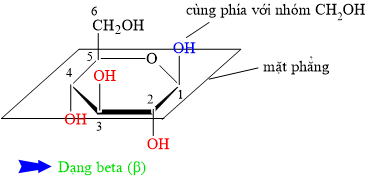
⇒ Quan sát lại cấu tạo chất đã cho ⇒ Phân tử carbohydate đang ở dạng beta (β)
⇒ Chọn đáp án B Đáp án: B
• β = bê (bờ) = bần cùng ⇒ nhóm OH đính vào C1 cùng phía với CH2OH.
• ⇒ α có nhóm OH đính vào C1 khác phía với nhóm CH2OH.


⇒ Quan sát lại cấu tạo chất đã cho ⇒ Phân tử carbohydate đang ở dạng beta (β)
⇒ Chọn đáp án B Đáp án: B
Câu 13 [705365]: Để nghiên cứu thành phần hoá học của một loại cây thuốc người ta làm như sau: Ngâm mẫu cây trong dung môi thích hợp (thường là ethanol) một thời gian, sau đó gạn lấy chất lỏng. Đun sôi hỗn hợp để thu hồi bớt dung môi, được hỗn hợp sền sệt gọi là cao tổng. Cho cao tổng vào cột sắc kí, sau đó đổ dung môi thích hợp vào trên lớp cao tổng. Dùng các lọ nhỏ hứng lấy các phân đoạn chất lỏng chảy ra khỏi cột sắc kí, sau đó đem xác định chất có trong mỗi phân đoạn. Trong các phương pháp tách và tinh chế chất sau:
(1) Kết tinh.
(2) Chiết lỏng – rắn.
(3) Chiết lỏng – lỏng.
(4) Chưng cất.
(5) Sắc kí.
Trong quá trình trên đã áp dụng mấy phương pháp để tách và tinh chế chất?
(1) Kết tinh.
(2) Chiết lỏng – rắn.
(3) Chiết lỏng – lỏng.
(4) Chưng cất.
(5) Sắc kí.
Trong quá trình trên đã áp dụng mấy phương pháp để tách và tinh chế chất?
A, 1.
B, 2.
C, 3.
D, 4.
Trong quá trình nghiên cứu thành phần hóa học của cây thuốc, người ta đã sử dụng các phương pháp tách và tinh chế chất sau:
- Chiết lỏng – rắn (2): Ngâm mẫu cây trong dung môi (ethanol) để chiết xuất các hợp chất có trong cây.
- Chưng cất (4): Đun sôi hỗn hợp để thu hồi bớt dung môi, được hỗn hợp sền sệt gọi là cao tổng
- Sắc kí (5): Dùng các lọ nhỏ hứng lấy các phân đoạn chất lỏng chảy ra khỏi cột sắc kí, sau đó đem xác định chất có trong mỗi phân đoạn.
⇒ Chọn đáp án C
Đáp án: C
- Chiết lỏng – rắn (2): Ngâm mẫu cây trong dung môi (ethanol) để chiết xuất các hợp chất có trong cây.
- Chưng cất (4): Đun sôi hỗn hợp để thu hồi bớt dung môi, được hỗn hợp sền sệt gọi là cao tổng
- Sắc kí (5): Dùng các lọ nhỏ hứng lấy các phân đoạn chất lỏng chảy ra khỏi cột sắc kí, sau đó đem xác định chất có trong mỗi phân đoạn.
⇒ Chọn đáp án C
Đáp án: C
Câu 14 [308681]: Alanine là tên gọi của α-amino acid có phân tử khối bằng
A, 103.
B, 117.
C, 75.
D, 89.
CTCT của Alanine: CH3-CH(NH2)COOH → Phân tử khối bằng 89 g/mol.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 15 [705366]: “Chất béo là triester (ester ba chức) của ...(1)... với acid béo, gọi chung là ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, glycerol, glyceride.
B, steroid, triglyceride.
C, glycerol, triglyceride.
D, steroid, glyceride.
"Chất béo là triester (ester ba chức) của glycerol với acid béo, gọi chung là triglyceride”
Giải thích:
- Chất béo là các ester của glycerol (C3H8O3) với acid béo.
- Glycerol có công thức: C3H5(OH)3, chứa ba nhóm -OH có thể tạo liên kết ester với ba phân tử acid béo.
- Phản ứng tạo chất béo là phản ứng ester hóa giữa glycerol và acid béo:
C3H5(OH)3 + 3RCOOH → C3H5(OOR)3 + 3H2O
- Vì ba nhóm -OH của glycerol đều tham gia tạo liên kết este, nên chất béo là trieste của glycerol. Tên gọi chung của các chất béo này là triglyceride.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
- Chất béo là các ester của glycerol (C3H8O3) với acid béo.
- Glycerol có công thức: C3H5(OH)3, chứa ba nhóm -OH có thể tạo liên kết ester với ba phân tử acid béo.
- Phản ứng tạo chất béo là phản ứng ester hóa giữa glycerol và acid béo:
C3H5(OH)3 + 3RCOOH → C3H5(OOR)3 + 3H2O
- Vì ba nhóm -OH của glycerol đều tham gia tạo liên kết este, nên chất béo là trieste của glycerol. Tên gọi chung của các chất béo này là triglyceride.
⇒ Chọn đáp án C Đáp án: C
Câu 16 [705367]: Tiến hành cho từ từ dung dịch sodium choride bão hoà đến dư vào dung dịch copper(II) sulfate loãng, chỉ thấy dấu hiệu nhạt màu, không thấy dấu hiệu dung dịch chuyển sang màu khác. Nếu tiến hành thí nghiệm thay bằng dung dịch hydrochloric acid đặc và dung dịch copper(II) sulfate thì dung dịch chuyển sang màu vàng.
Cho các phát biểu sau:
(a) Trong dung dịch CuSO4, ion Cu2+ tồn tại ở dạng phức chất aqua [Cu(OH2)6]2+.
(b) Dung dịch chuyển sang màu vàng là dấu hiệu của sự hình thành phức chất.
(c) Khả năng thay thế phối tử trong phức chất không phụ thuộc vào nồng độ của anion Cl trong dung dịch.
(d) Nồng độ Cl– trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl– trong dung dịch hydrochloric acid đặc.
Các phát biểu đúng là
Cho các phát biểu sau:
(a) Trong dung dịch CuSO4, ion Cu2+ tồn tại ở dạng phức chất aqua [Cu(OH2)6]2+.
(b) Dung dịch chuyển sang màu vàng là dấu hiệu của sự hình thành phức chất.
(c) Khả năng thay thế phối tử trong phức chất không phụ thuộc vào nồng độ của anion Cl trong dung dịch.
(d) Nồng độ Cl– trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl– trong dung dịch hydrochloric acid đặc.
Các phát biểu đúng là
A, (a), (b), (c).
B, (a), (c), (d).
C, (a), (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️ (a) Đúng. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Cu2+(aq) + 6H2O(l) →[Cu(OH2)6]2+(aq)
✔️ (b) Đúng. Nhỏ vài giọt dung dịch HCI đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
[Cu(OH2)6]2 +(aq) + Cl-(aq) → [CuCl4]2+ (aq) + 6H2O(l)
❌ (c) Sai. Khả năng thay thế phối tử trong phức chất không phụ thuộc vào khả năng tương tác giữa phối tử và ion nguyên tử trung tâm, phối tử anion Cl- tương tác mạnh hơn phối tử trung hòa aqua trong dung dịch.
✔️ (d) Đúng. Nồng độ Cl- trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl- trong dung dịch hydrochloric acid đặc nguyên do độ tan trong nước của HCl (725g/L) ở 20 độ C) cao hơn nhiều so với NaCl (35,9 g/100 mL)
⇒ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hóa trị riêng từ các phân tử H2O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:
Cu2+(aq) + 6H2O(l) →[Cu(OH2)6]2+(aq)
✔️ (b) Đúng. Nhỏ vài giọt dung dịch HCI đặc vào ống nghiệm chứa dung dịch CuSO4 loãng thấy dung dịch từ màu xanh chuyển sang màu vàng, chứng tỏ phức chất [CuCl4]2- đã được tạo thành.
[Cu(OH2)6]2 +(aq) + Cl-(aq) → [CuCl4]2+ (aq) + 6H2O(l)
❌ (c) Sai. Khả năng thay thế phối tử trong phức chất không phụ thuộc vào khả năng tương tác giữa phối tử và ion nguyên tử trung tâm, phối tử anion Cl- tương tác mạnh hơn phối tử trung hòa aqua trong dung dịch.
✔️ (d) Đúng. Nồng độ Cl- trong dung dịch sodium choride bão hoà thấp hơn nồng độ Cl- trong dung dịch hydrochloric acid đặc nguyên do độ tan trong nước của HCl (725g/L) ở 20 độ C) cao hơn nhiều so với NaCl (35,9 g/100 mL)
⇒ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Tiến hành thí nghiệm của ba kim loại khác nhau với dung dịch hydrochloric acid loãng theo hình vẽ sau:
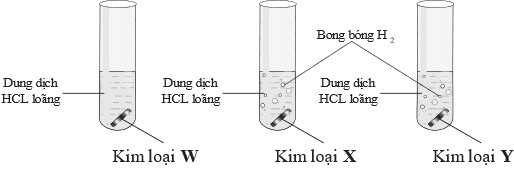

Câu 17 [705558]: Các kim loại W, X, Y nào sau đây tương ứng thỏa mãn hiện tượng trong thí nghiệm trên?
A, Cu, Mg, Zn.
B, Zn, Mg, Cu.
C, Mg, Zn, Cu.
D, Cu, Zn, Mg.
Kim loại W không tác dụng với dung dịch HCl
Kim loại X, Y tác dụng với dung dịch HCl, nhưng kim loại X tác dụng với dung dịch X tạo nhiều khí hơn so với kim loại X → tính khử của X mạnh hơn Y
→ Đáp án phù hợp là Cu, Mg, Zn.
⇒ Chọn đáp án A Đáp án: A
Kim loại X, Y tác dụng với dung dịch HCl, nhưng kim loại X tác dụng với dung dịch X tạo nhiều khí hơn so với kim loại X → tính khử của X mạnh hơn Y
→ Đáp án phù hợp là Cu, Mg, Zn.
⇒ Chọn đáp án A Đáp án: A
Câu 18 [705559]: Nhận định nào dưới đây không đúng?
A, Thế điện cực chuẩn cặp oxi hóa khử của kim loại W > 0.
B, Trong ba kim loại, kim loại có tính khử mạnh nhất là W.
C, Khi thay dung dịch HCl bằng dung dịch H2SO4 loãng hiện tượng quan sát được trong ba ống nghiệm không đổi.
D, Kim loại X, kim loại Y đều đứng trước hydrogen trong dãy hoạt động hóa học của kim loại.
Phân tích các nhận định:
✔️ A – Đúng. Thế điện cực chuẩn cặp oxi hóa khử của kim loại W > 0, do W không có tác dụng với HCl, nên thế điện cựa của W sẽ lớn hơn của
❌ B – Sai. Trong ba kim loại, kim loại có tính khử yếu nhất là W, do W không có tác dụng với HCl.
✔️ C – Đúng. Khi thay dung dịch HCI bằng dung dịch H2SO4 loãng hiện tượng quan sát được trong ba ống nghiệm không đổi nguyên do cả 2 đều có tính acid tương tự nhau.
✔️ D – Đúng. Kim loại X, kim loại Y đều đứng trước hydrogen trong dãy hoạt động hóa học của kim loại thì sẽ phản ứng được với dung dịch acid.
⇒ Chọn đáp án B Đáp án: B
✔️ A – Đúng. Thế điện cực chuẩn cặp oxi hóa khử của kim loại W > 0, do W không có tác dụng với HCl, nên thế điện cựa của W sẽ lớn hơn của
❌ B – Sai. Trong ba kim loại, kim loại có tính khử yếu nhất là W, do W không có tác dụng với HCl.
✔️ C – Đúng. Khi thay dung dịch HCI bằng dung dịch H2SO4 loãng hiện tượng quan sát được trong ba ống nghiệm không đổi nguyên do cả 2 đều có tính acid tương tự nhau.
✔️ D – Đúng. Kim loại X, kim loại Y đều đứng trước hydrogen trong dãy hoạt động hóa học của kim loại thì sẽ phản ứng được với dung dịch acid.
⇒ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705560]: Thử nghiệm một số thí nghiệm với chất rắn tinh thể màu trắng X, kết quả được đưa ra trong bảng sau:
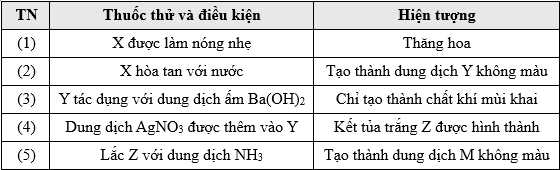

X hòa tan trong nước tạo dung dịch Y không màu, Y tác dụng với Ba(OH)2 tạo khí có mùi khai là NH3.
→ X là muối ammonium.
Dung dịch Y tác dụng với dung dịch AgNO3 tạo thành kết tủa trắng
→ Muối X có gốc Cl-
→ Công thức của muối muối X là NH4Cl
Phân tích các phát biểu:
❌ (a) Sai. X bị thăng hoa và phân hủy tạo thành NH3 và HCl.

✔️ (b) Đúng. Kết tủa trắng Z là AgCl
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
✔️ (c) Đúng. Dung dịch M chứa phức chất [Ag(NH3)2]Cl.
AgCl + NH3 + H2O → [Ag(NH3)2](OH) + HCl
❌ (d) Sai. Từ thí nghiệm (3) chưa thể kết luận dung dịch Y không chứa anion SO42- hoặc NO3-. Vì với anion SO42- tạo kết tủa trắng với Ag+.
→ X là muối ammonium.
Dung dịch Y tác dụng với dung dịch AgNO3 tạo thành kết tủa trắng
→ Muối X có gốc Cl-
→ Công thức của muối muối X là NH4Cl
Phân tích các phát biểu:
❌ (a) Sai. X bị thăng hoa và phân hủy tạo thành NH3 và HCl.

✔️ (b) Đúng. Kết tủa trắng Z là AgCl
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
✔️ (c) Đúng. Dung dịch M chứa phức chất [Ag(NH3)2]Cl.
AgCl + NH3 + H2O → [Ag(NH3)2](OH) + HCl
❌ (d) Sai. Từ thí nghiệm (3) chưa thể kết luận dung dịch Y không chứa anion SO42- hoặc NO3-. Vì với anion SO42- tạo kết tủa trắng với Ag+.
Câu 20 [705780]: Lắp đặt và tiến hành thí nghiệm điều chế và thử tính chất của ethylene như sau:
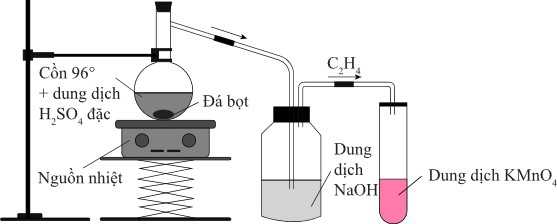

Phân tích các phát biểu:
✔️ (a) Đúng. Đá bọt có vai trò làm cho chất lỏng không trào lên khi đun nóng, để dung dịch sôi đều, tránh sôi một cách cục bộ;
Đá bọt là loại đá thu được từ dung nham núi lửa, nhẹ, cấu trúc xốp, nhiều lỗ rỗng. Nếu dùng đá bọt để điều hòa quá trình đun sôi ta không nên cho đá bọt vào chất lỏng đang sôi hay đang đun nóng vì sẽ làm cho chất lỏng sôi bùng lên trào ra ngoài rất nguy hiểm và đồng thời đá bọt cũng mất tác dụng điều hoà sự sôi.
❌ (b) Sai. Nếu thu khí ethylene đi ra từ ống dẫn khí của ống số 2 thì dùng phương pháp dời nước, nhưng không sử phương pháp đẩy không khí ngửa bình do ethylene nhẹ hơn không khí.
✔️ (c) Đúng. Dung dịch NaOH đặc có tác dụng loại bớt tạp chất trong khí sinh ra như SO2, CO2.
✔️ (d) Đúng. Sau khi phản ứng xảy ra thấy dung dịch KMnO4 bị mất màu xuất hiện kết tủa đen.
3CH2=CH2 + 2KMnO4 + 4H2O → 3OH-CH2-CH2 – OH + 2MnO2 + 2KOH
✔️ (a) Đúng. Đá bọt có vai trò làm cho chất lỏng không trào lên khi đun nóng, để dung dịch sôi đều, tránh sôi một cách cục bộ;
Đá bọt là loại đá thu được từ dung nham núi lửa, nhẹ, cấu trúc xốp, nhiều lỗ rỗng. Nếu dùng đá bọt để điều hòa quá trình đun sôi ta không nên cho đá bọt vào chất lỏng đang sôi hay đang đun nóng vì sẽ làm cho chất lỏng sôi bùng lên trào ra ngoài rất nguy hiểm và đồng thời đá bọt cũng mất tác dụng điều hoà sự sôi.
❌ (b) Sai. Nếu thu khí ethylene đi ra từ ống dẫn khí của ống số 2 thì dùng phương pháp dời nước, nhưng không sử phương pháp đẩy không khí ngửa bình do ethylene nhẹ hơn không khí.
✔️ (c) Đúng. Dung dịch NaOH đặc có tác dụng loại bớt tạp chất trong khí sinh ra như SO2, CO2.
✔️ (d) Đúng. Sau khi phản ứng xảy ra thấy dung dịch KMnO4 bị mất màu xuất hiện kết tủa đen.
3CH2=CH2 + 2KMnO4 + 4H2O → 3OH-CH2-CH2 – OH + 2MnO2 + 2KOH
Câu 21 [705561]: Lysine là một amino acid thiết yếu cấu tạo nên protein cho cơ thể. Lysine đóng vai trò quan trọng đối với trẻ, giúp cơ thể hấp thụ calcium, sắt và kẽm, thúc đẩy tạo collagen, giúp sản xuất các enzyme, kháng thể và kích thích các yếu tố hỗ trợ hệ miễn dịch. Lysine có cấu trúc như hình bên. Lysine có điểm đẳng điện pI = 9,8 (pI là giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion).
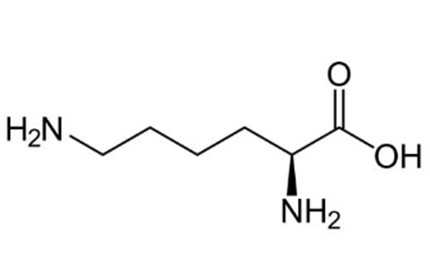

Phân tích các phát biểu:
✔️ (a) Đúng. Tên thay thế của lysine là 2,6-diaminohexanoic acid.
✔️ (b) Đúng. Lysine thuộc loại hợp chất hữu cơ tạp chức.Lysine là một α-amino acid có hai nhóm amine (-NH₂) và một nhóm carboxyl (-COOH)
✔️ (c) Đúng. Tại pH = 9,8 bằng với giá trị pI thì dạng tồn tại chủ yếu có tổng điện tích bằng 0.
❌ (d) Sai. Trong dung dịch có pH = 2 (nhỏ hơn pI) thì lysine tồn tại chủ yếu dạng cation và pH = 9, 8 (bằng pI) thì dạng tồn tại chủ yếu có tổng điện tích bằng 0. Hai dạng tồn tại là khác nhau.
✔️ (a) Đúng. Tên thay thế của lysine là 2,6-diaminohexanoic acid.
✔️ (b) Đúng. Lysine thuộc loại hợp chất hữu cơ tạp chức.Lysine là một α-amino acid có hai nhóm amine (-NH₂) và một nhóm carboxyl (-COOH)
✔️ (c) Đúng. Tại pH = 9,8 bằng với giá trị pI thì dạng tồn tại chủ yếu có tổng điện tích bằng 0.
❌ (d) Sai. Trong dung dịch có pH = 2 (nhỏ hơn pI) thì lysine tồn tại chủ yếu dạng cation và pH = 9, 8 (bằng pI) thì dạng tồn tại chủ yếu có tổng điện tích bằng 0. Hai dạng tồn tại là khác nhau.
Câu 22 [705562]: Khí chlorine và các ion Fe(II) phản ứng với nhau trong dung dịch nước thì xảy ra phản ứng: Cl2 + 2Fe2+  2Cl− + 2Fe3+
2Cl− + 2Fe3+
Sơ đồ bên dưới cho thấy thiết bị cần thiết để đo Eo cho phản ứng trên.
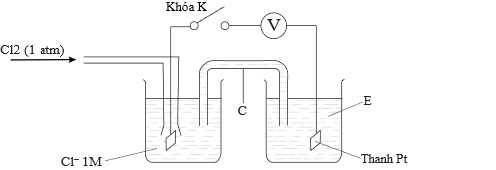
Thay A bằng Cl2 (1 atm); B bằng dung dịch Cl– 1 M; D bằng thanh Pt. S bằng cầu giao.
Cho thế khử chuẩn của các cặp oxi hóa khử:
Fe3+ + 1e Fe2+;
Fe2+; 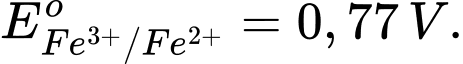
Cl2 + 2e 2Cl–;
2Cl–; 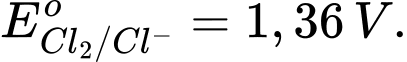
 2Cl− + 2Fe3+
2Cl− + 2Fe3+Sơ đồ bên dưới cho thấy thiết bị cần thiết để đo Eo cho phản ứng trên.

Thay A bằng Cl2 (1 atm); B bằng dung dịch Cl– 1 M; D bằng thanh Pt. S bằng cầu giao.
Cho thế khử chuẩn của các cặp oxi hóa khử:
Fe3+ + 1e
 Fe2+;
Fe2+; 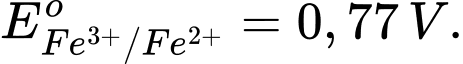
Cl2 + 2e
 2Cl–;
2Cl–; 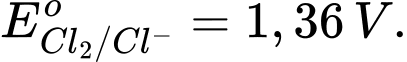
Ta có:
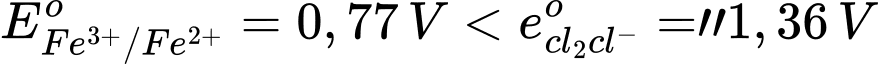 "
" 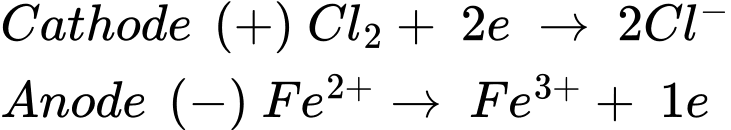 Phản ứng xảy ra là
Phản ứng xảy ra là 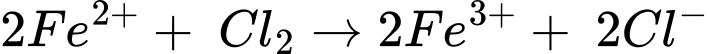
→ Epin = E(+) – E(-) = 1,36 – 0,77 = 0,59 V
Phân tích các phát biểu:
❌ (a) Sai . Dung dịch ban đầu E chỉ chứa cation Fe2+ với nồng độ 1 M, sau khi pin hoạt động chứa các cation Fe2+, Fe3+.
✔️ (b) Đúng. Cầu muối C có thể sử dụng NaCl làm chất điện li.Cầu muối là một bộ phận quan trọng trong pin điện hóa (pin Galvani), giúp cân bằng điện tích giữa hai nửa pin bằng cách cho phép ion di chuyển mà không làm cho hai dung dịch tiếp xúc trực tiếp. Duy trì tính trung hòa điện tích:Anion (ion âm) di chuyển về cực dương và Cation (ion dương) di chuyển về cực âm. Ngăn cản sự tiếp xúc trực tiếp giữa hai dung dịch, tránh phản ứng kết tủa làm giảm hiệu suất pin.
✔️ (c) Đúng. Đây là phản ứng oxi hóa khử, theo định luật bảo toàn electron thì số electron nhường bằng nhận.
✔️ (d) Đúng. Khi thiết bị hoạt động ở điều kiện chuẩn, giá trị hiển thị trên vôn kế là 0,59 V.
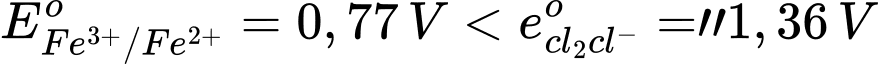 "
" 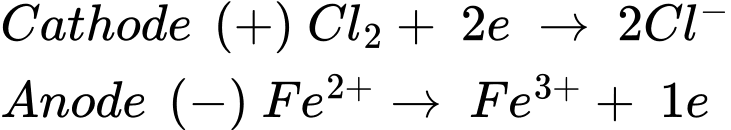 Phản ứng xảy ra là
Phản ứng xảy ra là 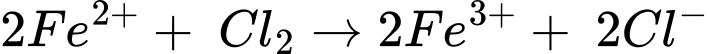
→ Epin = E(+) – E(-) = 1,36 – 0,77 = 0,59 V
Phân tích các phát biểu:
❌ (a) Sai . Dung dịch ban đầu E chỉ chứa cation Fe2+ với nồng độ 1 M, sau khi pin hoạt động chứa các cation Fe2+, Fe3+.
✔️ (b) Đúng. Cầu muối C có thể sử dụng NaCl làm chất điện li.Cầu muối là một bộ phận quan trọng trong pin điện hóa (pin Galvani), giúp cân bằng điện tích giữa hai nửa pin bằng cách cho phép ion di chuyển mà không làm cho hai dung dịch tiếp xúc trực tiếp. Duy trì tính trung hòa điện tích:Anion (ion âm) di chuyển về cực dương và Cation (ion dương) di chuyển về cực âm. Ngăn cản sự tiếp xúc trực tiếp giữa hai dung dịch, tránh phản ứng kết tủa làm giảm hiệu suất pin.
✔️ (c) Đúng. Đây là phản ứng oxi hóa khử, theo định luật bảo toàn electron thì số electron nhường bằng nhận.
✔️ (d) Đúng. Khi thiết bị hoạt động ở điều kiện chuẩn, giá trị hiển thị trên vôn kế là 0,59 V.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705563]: Phức chất [X(NH3)6]3+ có 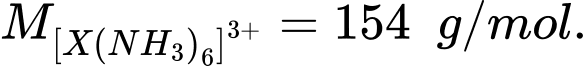 Nguyên tử khối của nguyên tử X là bao nhiêu?
Nguyên tử khối của nguyên tử X là bao nhiêu?
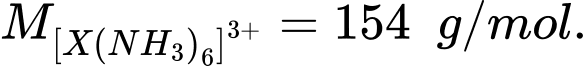 Nguyên tử khối của nguyên tử X là bao nhiêu?
Nguyên tử khối của nguyên tử X là bao nhiêu?
Phức chất [X(NH3)6]3+ có khối lượng phân tử là 154
→ MX + 17 × 6 = 154
→ MX = 52
⇒ Điền đáp án: 52
→ MX + 17 × 6 = 154
→ MX = 52
⇒ Điền đáp án: 52
Câu 24 [705564]: Hình dưới biểu diễn cấu trúc một đoạn mạch polymer A, được tạo thành từ phản ứng trùng hợp một alkene.
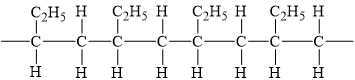
Monomer tạo thành A có chứa mấy nguyên tử carbon?

Monomer tạo thành A có chứa mấy nguyên tử carbon?
→ Momomer tương ứng có dạng:
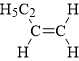 với 4 nguyên tử carbon.
với 4 nguyên tử carbon.⇒ Điền đáp án: 4
Câu 25 [705566]: Xăng sinh học E5 chứa 5% ethanol về thể tích (Khối lượng riêng của ethanol là 0,8 g/mL), còn lại là xăng truyền thống, giả thiết xăng truyền thống chỉ chứa hai alkane là C8H18 và C9H20 có tỉ lệ mol tương ứng là 4 : 3 (Khối lượng riêng của xăng truyền thống là 0,7 g/mL). Khi được đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5072 kJ và 1 mol C9H20 tỏa ra nhiệt lượng là 6119 kJ. Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 212 kJ. Nếu xe máy tay ga đó đã sử dụng hết 6,5 lít xăng E5 ở trên thì quãng đường xe di chuyển được là bao nhiêu km? (biết hiệu suất sử dụng nhiên liệu của động cơ là 40%) (làm tròn đến hàng đơn vị).
Đổi 6,5 L = 6500 mL
Thể tích của ethanol trong xăng E5 là: Vethanol = 6500 × 5% = 325 mL
Thể tích của xăng truyền thống trong xăng E5 là: Vxăng = 6500 – 325 = 6175 mL
Khối lượng của xăng truyền thống là: mxăng = 6175 × 0,7 = 4322,5 gam
Khối lượng của ethanol là: methanol = 325 × 0,8 = 260 gam
Số mol của ethanol là: nethanol = 260 ÷ 46 = 130/23 mol
Đặt số mol của C8H18 là 4a mol; số mol của C9H20 là 2a mol;
Khối lượng của xăng truyền thống là: mxăng = 4a × 114a + 3a × 128 = 4322,5 gam
→ a = 247/48 mol
Nhiệt lượng xe máy sử dụng khi dùng hết 6,5 L xăng E5 là:
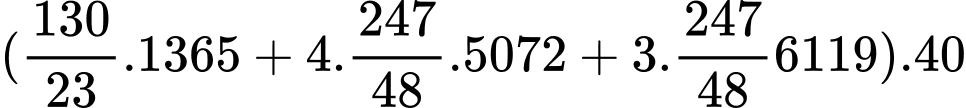
Quãng đường xe máy đi được là: 82630,397 ÷ 212 = 389,766 ≈ 390 km
⇒ Điền đáp án: 390
Thể tích của ethanol trong xăng E5 là: Vethanol = 6500 × 5% = 325 mL
Thể tích của xăng truyền thống trong xăng E5 là: Vxăng = 6500 – 325 = 6175 mL
Khối lượng của xăng truyền thống là: mxăng = 6175 × 0,7 = 4322,5 gam
Khối lượng của ethanol là: methanol = 325 × 0,8 = 260 gam
Số mol của ethanol là: nethanol = 260 ÷ 46 = 130/23 mol
Đặt số mol của C8H18 là 4a mol; số mol của C9H20 là 2a mol;
Khối lượng của xăng truyền thống là: mxăng = 4a × 114a + 3a × 128 = 4322,5 gam
→ a = 247/48 mol
Nhiệt lượng xe máy sử dụng khi dùng hết 6,5 L xăng E5 là:
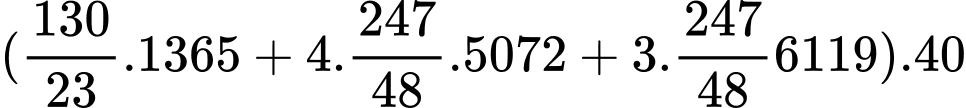
Quãng đường xe máy đi được là: 82630,397 ÷ 212 = 389,766 ≈ 390 km
⇒ Điền đáp án: 390
Câu 26 [705567]: Quan sát dưới và xác định giá trị phân tử khối của naphtalene. Biết phân tử khối tương ứng với peak có cường độ tương đối lớn nhất hiển thị trên phổ khối lượng.
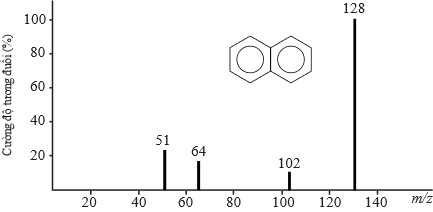

Trong phổ khối lương MS mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và có giá trị bằng phân tử khối của chất nghiên cứu.
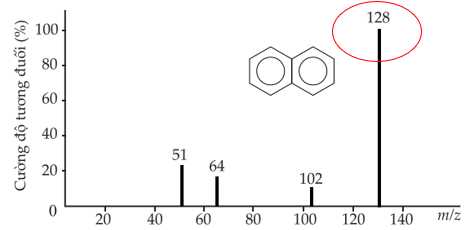
Từ phổ MS phân tử khối của napthtalene là 128.
⇒ Điền đáp án: 128

Từ phổ MS phân tử khối của napthtalene là 128.
⇒ Điền đáp án: 128
Câu 27 [705565]: Trong số các chất sau đây: fructose; formaldehyde; formic acid; saccharose; oxalic acid. Có bao nhiêu chất có phản ứng tráng bạc?
Các chất phản ứng với thuốc thử Tollens là fructose, formaldehyde, formic acid.
Fructose ⇌ Glucose
2Ag(NH3)2OH + C6H12O6 → 2Ag + C6H12O7 + 4NH3 + H2O
HCOOH + 2(Ag(NH3)2)OH → 2Ag + 2NH3 + H2O + (NH4)2CO3
4(Ag(NH3)2)OH + HCHO → 4Ag + 6NH3 + (NH4)2CO3 + 2H2O
⇒ Điền đáp án: 3
Fructose ⇌ Glucose
2Ag(NH3)2OH + C6H12O6 → 2Ag + C6H12O7 + 4NH3 + H2O
HCOOH + 2(Ag(NH3)2)OH → 2Ag + 2NH3 + H2O + (NH4)2CO3
4(Ag(NH3)2)OH + HCHO → 4Ag + 6NH3 + (NH4)2CO3 + 2H2O
⇒ Điền đáp án: 3
Câu 28 [705568]: Để xác định hàm lượng nitrogen trong phân người ta sử dụng phương pháp formaline (HCHO): Phương pháp dùng để xác định nitrogen trong phân chứa ammonium như: (NH4)2SO4, NH4Cl, NH4NO3, ammophos, ....
Phương pháp phân tích dựa trên cơ sở phân ammonium tác dụng với formaline (HCHO) tạo thành hợp chất hữu cơ hexamethylentetramine C6H12N4.
2(NH4)2SO4 + 6HCHO C6H12N4 + 2H2SO4 + 6H2O
C6H12N4 + 2H2SO4 + 6H2O
Hoặc: NH4NO3 + 6HCHO C6H12N4 + 4HNO3 + 6H2O
C6H12N4 + 4HNO3 + 6H2O
Đồng thời acid vô cơ tạo thành tương ứng được chuẩn độ acid – base:
H2SO4 + 2NaOH Na2SO4 + H2O
Na2SO4 + H2O
Hoặc: HNO3 + NaOH NaNO3 + H2O
NaNO3 + H2O
Người ta tiến hành phân tích lượng nitrogen có trong một loại phân bón được tiến hành như sau: Cân 10 gam phân (chứa chủ yếu (NH4)2SO4) nghiền nhỏ hòa tan tan trong 100 ml nước, lọc qua giấy lọc. Phần dịch lọc được đưa vào bình định mức 200 mL, định mức đến vạch. Lấy 25 mL dung dịch trên rót vào 10 mL dung dịch formaline 40%, thêm chỉ thị phenolphtalein lắc đều sau đó tiến hành chuẩn độ bằng NaOH 0,5 M. Sau chuẩn độ thấy hết 22 mL dung dịch NaOH 0,5M. Xác định hàm lượng nitrogen (%) trong mẫu phân bón trên (Làm tròn đến phần mười).
Phương pháp phân tích dựa trên cơ sở phân ammonium tác dụng với formaline (HCHO) tạo thành hợp chất hữu cơ hexamethylentetramine C6H12N4.
2(NH4)2SO4 + 6HCHO
 C6H12N4 + 2H2SO4 + 6H2O
C6H12N4 + 2H2SO4 + 6H2OHoặc: NH4NO3 + 6HCHO
 C6H12N4 + 4HNO3 + 6H2O
C6H12N4 + 4HNO3 + 6H2OĐồng thời acid vô cơ tạo thành tương ứng được chuẩn độ acid – base:
H2SO4 + 2NaOH
 Na2SO4 + H2O
Na2SO4 + H2OHoặc: HNO3 + NaOH
 NaNO3 + H2O
NaNO3 + H2ONgười ta tiến hành phân tích lượng nitrogen có trong một loại phân bón được tiến hành như sau: Cân 10 gam phân (chứa chủ yếu (NH4)2SO4) nghiền nhỏ hòa tan tan trong 100 ml nước, lọc qua giấy lọc. Phần dịch lọc được đưa vào bình định mức 200 mL, định mức đến vạch. Lấy 25 mL dung dịch trên rót vào 10 mL dung dịch formaline 40%, thêm chỉ thị phenolphtalein lắc đều sau đó tiến hành chuẩn độ bằng NaOH 0,5 M. Sau chuẩn độ thấy hết 22 mL dung dịch NaOH 0,5M. Xác định hàm lượng nitrogen (%) trong mẫu phân bón trên (Làm tròn đến phần mười).
2(NH4)2SO4 + 6HCHO → C6H12N4 + 2H2SO4 + 6H2O
H2SO4 + 2NaOH → Na2SO4 + H2O
Đổi 22 mL = 0,022 L
Số mol của NaOH là: nNaOH = 0,022 × 0,5 = 0,011 mol
Từ phương trình hóa học số mol của (NH4)2SO4 là 5,5×10-3 mol
Hàm lượng Nitrogen trong phân bón trên là: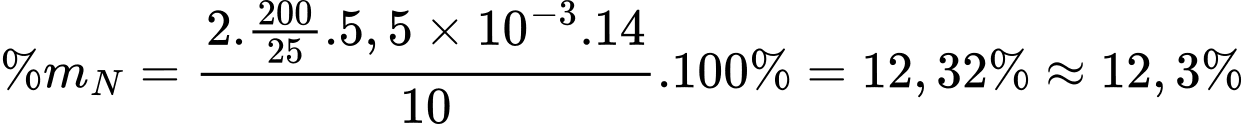
⇒ Điền đáp án: 12,3
H2SO4 + 2NaOH → Na2SO4 + H2O
Đổi 22 mL = 0,022 L
Số mol của NaOH là: nNaOH = 0,022 × 0,5 = 0,011 mol
Từ phương trình hóa học số mol của (NH4)2SO4 là 5,5×10-3 mol
Hàm lượng Nitrogen trong phân bón trên là:
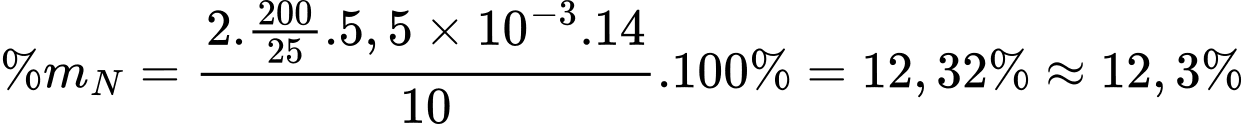
⇒ Điền đáp án: 12,3