PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705781]: "Phương pháp Solvay dùng để sản xuất soda và baking soda sử dụng nguồn nguyên liệu dễ tìm trong tự nhiên là ..(1)..., đá vôi và ...(2)...”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, muối ăn, ammonia.
B, muối ăn, carbon dioxide.
C, cát, ammonia.
D, cát, carbon dioxide.
"Phương pháp Solvay dùng để sản xuất soda và baking soda sử dụng nguồn nguyên liệu dễ tìm trong tự nhiên là muối ăn, đá vôi và ammonia”
Giải thích:
Phương pháp Solvay là một quy trình công nghiệp quan trọng để sản xuất soda (Na2CO3) và baking soda (NaHCO3). Phương pháp này sử dụng nguyên liệu rẻ, dễ tìm trong tự nhiên gồm:
- Nước muối (NaCl) – nguồn cung cấp ion Na+.
- Đá vôi (CaCO3) – dùng để tạo CO2 và CaO.
- Ammonia (NH3) – giúp kết tủa NaHCO3 từ dung dịch.
⇒ Chọn đáp án A Đáp án: A
Giải thích:
Phương pháp Solvay là một quy trình công nghiệp quan trọng để sản xuất soda (Na2CO3) và baking soda (NaHCO3). Phương pháp này sử dụng nguyên liệu rẻ, dễ tìm trong tự nhiên gồm:
- Nước muối (NaCl) – nguồn cung cấp ion Na+.
- Đá vôi (CaCO3) – dùng để tạo CO2 và CaO.
- Ammonia (NH3) – giúp kết tủa NaHCO3 từ dung dịch.
⇒ Chọn đáp án A Đáp án: A
Câu 2 [58974]: Trường hợp nào sau đây thép (Fe – C) bị ăn mòn nhanh nhất?
A, Ngâm trong nước cất.
B, Để ngoài không khí ẩm.
C, Để ngoài không khí khô.
D, Ngâm trong nước biển.
HD:
Thép để ngoài không khí ẩm hay ngâm trong nước biển đều xảy ra ăn mòn điện hóa, tuy nhiên tốc độ ăn mòn khi ngâm trong nước biển chắc chắn nhanh hơn việc để ngoài không khí ẩm do nước biển chứa nhiều ion muối (Na+, Cl–, SO42–,...) giúp tăng tốc độ phản ứng điện hóa giữa sắt và oxygen.
⇒ Chọn đáp án D
Đáp án: D
⇒ Chọn đáp án D
Đáp án: D
Câu 3 [309511]: Trùng hợp propylene thu được polymer có tên gọi là
A, Polyethylene.
B, Polystyrene.
C, Polypropylene.
D, Poly(vinyl chloride).
Phản ứng trùng hợp propylene:
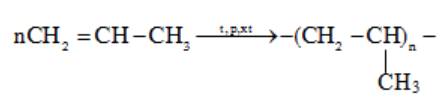
⇒ Trùng hợp propylene thu được polymer có tên gọi là polypropylene.
⇒ Chọn đáp án C Đáp án: C
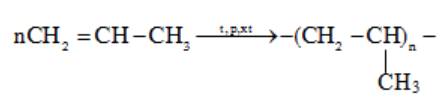
⇒ Trùng hợp propylene thu được polymer có tên gọi là polypropylene.
⇒ Chọn đáp án C Đáp án: C
Câu 4 [52145]: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch FeCl2 vào dung dịch silver nitrate dư.
(b) Dẫn khí H2 qua bột FeO đun nóng.
(c) Cho FeSO4 vào dung dịch gồm KMnO4 và H2SO4 loãng.
(d) Cho Fe(NO3)2 vào dung dịch H2SO4 loãng.
Sau khi kết thúc phản ứng, những thí nghiệm chứng minh iron(II) có tính khử là
(a) Cho dung dịch FeCl2 vào dung dịch silver nitrate dư.
(b) Dẫn khí H2 qua bột FeO đun nóng.
(c) Cho FeSO4 vào dung dịch gồm KMnO4 và H2SO4 loãng.
(d) Cho Fe(NO3)2 vào dung dịch H2SO4 loãng.
Sau khi kết thúc phản ứng, những thí nghiệm chứng minh iron(II) có tính khử là
A, (a), (b), (c).
B, (b), (c), (d).
C, (a), (c), (d).
D, (a), (b), (d).
HD: Phân tích các thí nghiệm:
✔️ (a) FeCl2 + 3AgNO3 → Fe(NO3)3 + 2AgCl↓ + Ag↓.
❌ (b) H2 + FeO → Fe + H2O.
✔️ (c) 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
✔️ (d) xảy ra: 3Fe2+ + NO3– + 4H+ → 3Fe3+ + NO↑ + 2H2O.
⇝ Có 3 thí nghiệm (a) (c) (d) mà số oxi hoá của Fe tăng (từ +2 lên +3) thể hiện tính khử
⇒ Chọn đáp án C. Đáp án: C
✔️ (a) FeCl2 + 3AgNO3 → Fe(NO3)3 + 2AgCl↓ + Ag↓.
❌ (b) H2 + FeO → Fe + H2O.
✔️ (c) 10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
✔️ (d) xảy ra: 3Fe2+ + NO3– + 4H+ → 3Fe3+ + NO↑ + 2H2O.
⇝ Có 3 thí nghiệm (a) (c) (d) mà số oxi hoá của Fe tăng (từ +2 lên +3) thể hiện tính khử
⇒ Chọn đáp án C. Đáp án: C
Câu 5 [575622]: Anion X3– có cấu hình electron lớp ngoài cùng là 2s22p6. Tổng số electron ở lớp vỏ của X3– là
A, 10.
B, 11.
C, 7.
D, 12.
Cấu hình electron của X3- là: 1s2 2s2 2p6.
→ Tổng số electron ở lớp vỏ của X3- là 10.
⇒ Chọn đáp án A Đáp án: A
→ Tổng số electron ở lớp vỏ của X3- là 10.
⇒ Chọn đáp án A Đáp án: A
Câu 6 [560612]: Các kim loại có khả năng phản xạ hầu hết những tia sáng khả kiến, tạo nên vẻ sáng lấp lánh dưới ánh sáng Mặt Trời và được gọi là
A, tính dẫn điện.
B, ánh kim.
C, tính dẫn nhiệt.
D, tính dẻo.
Tính ánh kim là đặc điểm quan trọng giúp kim loại được sử dụng rộng rãi trong các lĩnh vực trang trí, sản xuất gương, chiếu sáng, và các ứng dụng cần phản xạ ánh sáng. Ví dụ, bạc và vàng là hai kim loại có ánh kim rất rõ rệt, trong khi nhôm cũng có khả năng phản xạ ánh sáng tốt, mặc dù không mạnh bằng bạc.
⇒ Chọn đáp án B Đáp án: B
⇒ Chọn đáp án B Đáp án: B
Câu 7 [309405]: Chất nào sau đây là chất rắn ở điều kiện thường?
A, Anbumin.
B, Aniline.
C, Methylamine.
D, Glycine.
❌ A. Albumin: Là một loại protein có trong lòng trắng trứng, thường tồn tại ở dạng keo trong dung dịch nước, không phải chất rắn kết tinh.
❌ B. Aniline (C6H5NH2): Là một amine thơm, có liên kết hydrogen nhưng khối lượng phân tử không quá lớn. Ở điều kiện thường, aniline là chất lỏng.
❌ C. Methylamine (CH3NH2): Là amine bậc 1 có khối lượng phân tử nhỏ. Ở điều kiện thường, methylamine là khí.
✅ D. Glycine (NH2CH2COOH): Là một amino acid, có liên kết ion và liên kết hydrogen mạnh. Các amino acid thường tồn tại ở trạng thái rắn kết tinh không màu.
⇒ Chọn đáp án D Đáp án: D
❌ B. Aniline (C6H5NH2): Là một amine thơm, có liên kết hydrogen nhưng khối lượng phân tử không quá lớn. Ở điều kiện thường, aniline là chất lỏng.
❌ C. Methylamine (CH3NH2): Là amine bậc 1 có khối lượng phân tử nhỏ. Ở điều kiện thường, methylamine là khí.
✅ D. Glycine (NH2CH2COOH): Là một amino acid, có liên kết ion và liên kết hydrogen mạnh. Các amino acid thường tồn tại ở trạng thái rắn kết tinh không màu.
⇒ Chọn đáp án D Đáp án: D
Câu 8 [308283]: Số nguyên tử carbon trong phân tử glucose là
A, 2.
B, 4.
C, 6.
D, 8.
HD: Thông tin về glucose:
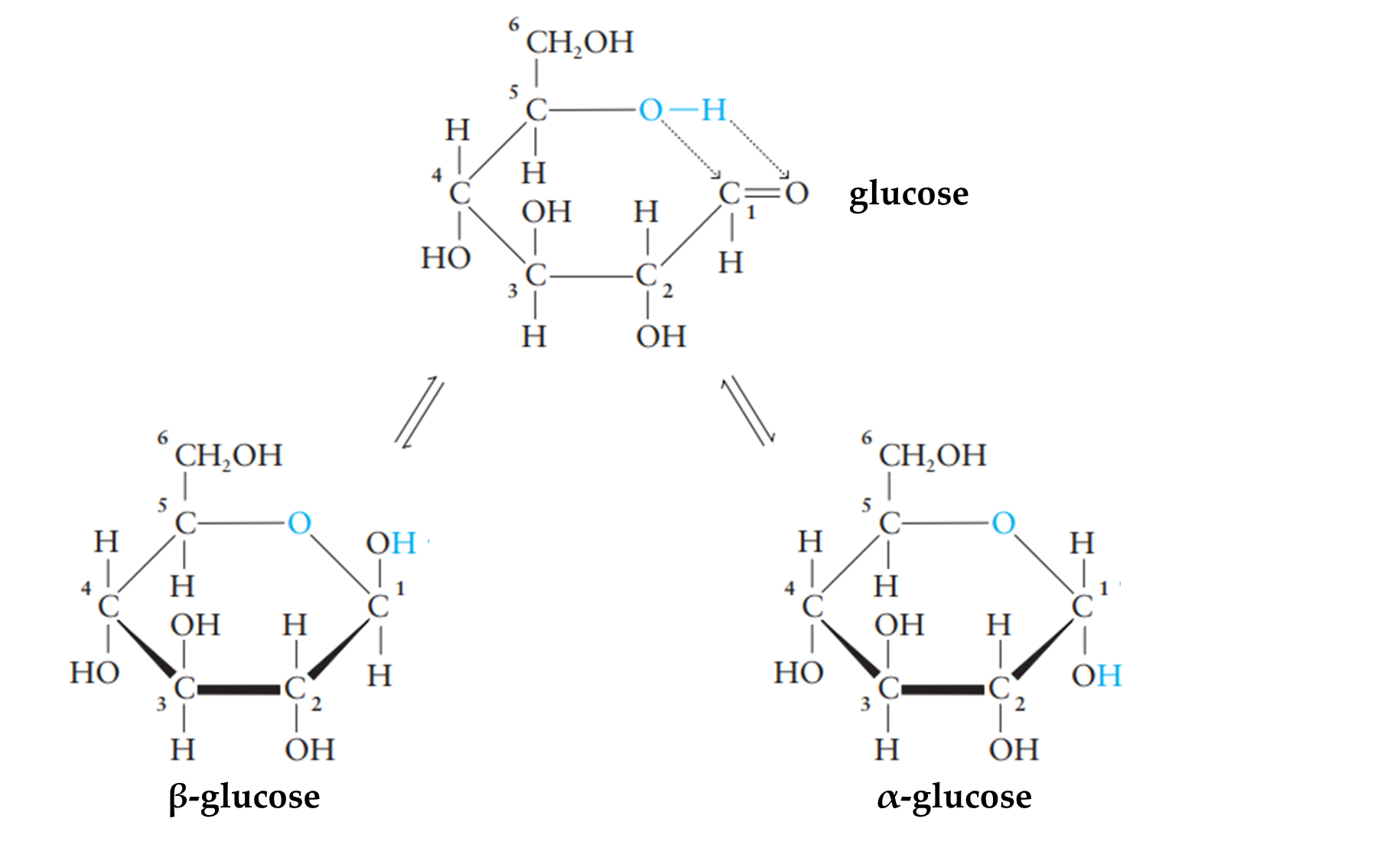
Công thức phân tử: C6H12O6 (M = 180) ⇝ số nguyên tử carbon là 6
⇒ Chọn đáp án C Đáp án: C

Công thức phân tử: C6H12O6 (M = 180) ⇝ số nguyên tử carbon là 6
⇒ Chọn đáp án C Đáp án: C
Câu 9 [705782]: Cho phản ứng giữa Hb với O2 ở phổi:
Hb + O2 ⟶ HbO2
Giả sử lượng oxygen cung cấp cho cơ thể chỉ phụ thuộc vào tốc độ phản ứng; tần số nhịp thở trung bình của một người là 16 nhịp/phút. Hỏi nếu hàm lượng oxygen trong không khí giảm từ 21% xuống 18% (theo thể tích) thì tần số nhịp thở trung bình là bao nhiêu để đảm bảo lượng oxygen cung cấp cho cơ thể không thay đổi? A, 18,6 nhịp/phút.
B, 13,7 nhịp/phút.
C, 21,0 nhịp/phút.
D, 24,3 nhịp/phút.
Giả sử lượng oxygen cung cấp cho cơ thể chỉ phụ thuộc vào tốc độ phản ứng và tần số nhịp thở. Lượng oxygen hấp thụ tỉ lệ thuận với hàm lượng oxygen trong không khí và tần số nhịp thở.
Gọi:
• Nhịp thở ban đầu: f1 = 16 nhịp/phút.
• Nồng độ oxygen ban đầu: C1 = 21% = 0,21.
• Nồng độ oxy giảm xuống: C2 = 18% = 0,18.
• Tần số nhịp thở cần tìm: f2.
Vì lượng oxygen hít vào không đổi nên:
f1 × C1 = f2 × C2 ⇔ 16 × 0,21 = f2 × 0,18
⇒ f2 = (16 × 0,21) / 0,18 = 18,67 ≈ 18,6 nhịp/phút
⇒ Chọn đáp án A Đáp án: A
Gọi:
• Nhịp thở ban đầu: f1 = 16 nhịp/phút.
• Nồng độ oxygen ban đầu: C1 = 21% = 0,21.
• Nồng độ oxy giảm xuống: C2 = 18% = 0,18.
• Tần số nhịp thở cần tìm: f2.
Vì lượng oxygen hít vào không đổi nên:
f1 × C1 = f2 × C2 ⇔ 16 × 0,21 = f2 × 0,18
⇒ f2 = (16 × 0,21) / 0,18 = 18,67 ≈ 18,6 nhịp/phút
⇒ Chọn đáp án A Đáp án: A
Câu 10 [705783]: Cho các phát biểu sau:
(a) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(b) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc.
(c) Khi cho quỳ tím ẩm vào lọ đựng khí NH3 quỳ tím chuyển thành màu đỏ.
(d) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Trong các phát biểu trên, có bao nhiêu phát biểu đúng?
(a) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(b) Để làm khô khí NH3 có lẫn hơi nước, có thể dẫn khí NH3 đi qua bình đựng dung dịch H2SO4 đặc.
(c) Khi cho quỳ tím ẩm vào lọ đựng khí NH3 quỳ tím chuyển thành màu đỏ.
(d) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Trong các phát biểu trên, có bao nhiêu phát biểu đúng?
A, 2.
B, 3.
C, 1.
D, 4.
✔️ (a) Đúng. NH3 lỏng có nhiệt độ bay hơi thấp (-33,4 oC), hấp thụ nhiệt mạnh khi hóa hơi, được sử dụng làm môi chất lạnh trong hệ thống làm lạnh công nghiệp.
❌ (b) Sai. H2SO4 đặc hút nước tốt, nhưng nó phản ứng với NH3 tạo muối (NH4)2SO4:
2NH3 + H2SO4 → (NH4)2SO4
Dung dịch H2SO4 không được dùng để làm khô NH3 vì xảy ra phản ứng.
Chất thích hợp để làm khô NH3 là: CaO, NaOH, KOH (vì chúng hút ẩm nhưng không phản ứng với NH3).
❌ (c) Sai. NH3 là chất khí có tính base, khi gặp quỳ tím sẽ chuyển sang màu xanh, không phải đỏ.
✔️ (d) Đúng. Nitrogen lỏng (N2 lỏng) có nhiệt độ rất thấp (-196 oC), giúp bảo quản máu, tế bào, mô sinh học mà không làm tổn hại chúng.
Vậy các phát biểu đúng là (a) (d)
⇒ Chọn đáp án A Đáp án: A
❌ (b) Sai. H2SO4 đặc hút nước tốt, nhưng nó phản ứng với NH3 tạo muối (NH4)2SO4:
2NH3 + H2SO4 → (NH4)2SO4
Dung dịch H2SO4 không được dùng để làm khô NH3 vì xảy ra phản ứng.
Chất thích hợp để làm khô NH3 là: CaO, NaOH, KOH (vì chúng hút ẩm nhưng không phản ứng với NH3).
❌ (c) Sai. NH3 là chất khí có tính base, khi gặp quỳ tím sẽ chuyển sang màu xanh, không phải đỏ.
✔️ (d) Đúng. Nitrogen lỏng (N2 lỏng) có nhiệt độ rất thấp (-196 oC), giúp bảo quản máu, tế bào, mô sinh học mà không làm tổn hại chúng.
Vậy các phát biểu đúng là (a) (d)
⇒ Chọn đáp án A Đáp án: A
Câu 11 [808723]: Hiện tượng quan sát được khi cho dung dịch HNO3 vào dung dịch phenol là
A, có kết tủa trắng và có bọt khí.
B, có bọt khí bay ra.
C, xuất hiện kết tủa trắng.
D, xuất hiện kết tủa vàng.
HD: Ở nhiệt độ thường, khi cho dung dịch HNO3 vào dung dịch phenol,
xuất hiện kết tủa vàng 2,4,6-trinitrophenol (axit picric):
![540625[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/BAI%2016/540625[LG].png)
⇒ Chọn đáp án D
Đáp án: D
xuất hiện kết tủa vàng 2,4,6-trinitrophenol (axit picric):
![540625[LG].png](https://asset.moon.vn/img/ai/Teachers/rongden_167/ProS2018/BAI%2016/540625[LG].png)
⇒ Chọn đáp án D
Đáp án: D
Câu 12 [304140]: Ester tạo ra mùi thơm của chuối chín có cấu tạo như hình vẽ sau:
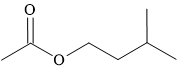
Tên gọi nào sau đây là không đúng với cấu tạo ester trên?

Tên gọi nào sau đây là không đúng với cấu tạo ester trên?
A, Isopentyl acetate.
B, Isoamyl acetate.
C, 3-methylbutyl ethanoate.
D, Methyl pentanoate.
HD: Phân tích tên gọi ester theo tên thông thường và tên thay thế:
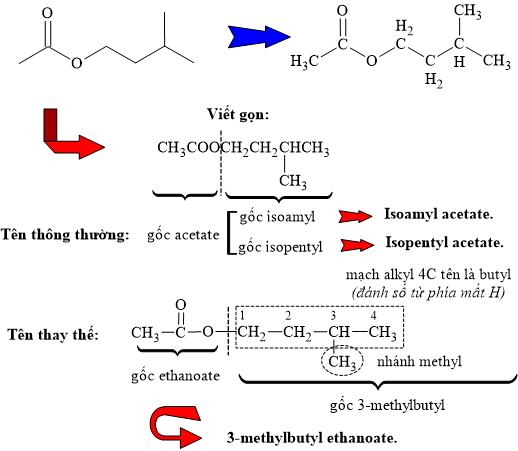
⇒ Methyl pentanoate chỉ ester có cấu tạo CH3CH2CH2CH2COOCH3 ≠ cấu tạo ester có mùi chuối trên
⇒ Chọn đáp án D Đáp án: D

⇒ Methyl pentanoate chỉ ester có cấu tạo CH3CH2CH2CH2COOCH3 ≠ cấu tạo ester có mùi chuối trên
⇒ Chọn đáp án D Đáp án: D
Câu 13 [705784]: Sự cố tràn dầu trên sông, biển gây thiệt hại rất lớn về kinh tế và môi trường. Để thu hồi dầu tràn, người ta dùng hệ thống phao để gom dầu tràn vào một khu vực, sau đó hút vào các bồn lớn trên tàu. Để thu được dầu, người ta li tâm để tách hỗn hợp lỏng thành lớp nước (ở dưới) và lớp dầu (ở trên). Mở van xả để loại bỏ nước phía dưới, thu được lớp dầu. Phát biểu nào sau đây là không đúng?
A, Dầu nhẹ hơn nước và không tan trong nước.
B, Li tâm dựa vào sự không tan và khối lượng riêng khác nhau của dầu và nước.
C, Trong quá trình trên đã sử dụng kĩ thuật chiết lỏng – lỏng.
D, Có thể chưng cất hỗn hợp dầu và nước để thu lấy dầu.
✔️ A. Đúng. Dầu có khối lượng riêng nhỏ hơn nước (~0,8 g/cm3 so với 1,0 g/cm3 của nước), nên nổi trên mặt nước. Dầu là hợp chất hữu cơ không tan trong nước do tính kị nước.
✔️ B. Đúng. Phương pháp li tâm hoạt động dựa trên sự khác biệt về khối lượng riêng, làm dầu và nước tách thành hai lớp rõ rệt. Ngoài ra, dầu và nước không trộn lẫn (không tan vào nhau) nên có thể tách được.
✔️ C. Đúng. Chiết lỏng - lỏng là phương pháp tách hai chất lỏng không tan vào nhau, dựa vào sự khác biệt về khối lượng riêng. Ở đây, dầu nổi lên trên, nước ở dưới và khi mở van xả nước phía dưới thì thu được dầu.
❌ D. Sai. Chưng cất là phương pháp tách dựa vào sự khác biệt nhiệt độ sôi.
- Nhiệt độ sôi của nước (~100 oC) và dầu mỏ (cao hơn 200 oC) rất chênh lệch.
- Khi đun nóng, nước sẽ bay hơi trước, nhưng dầu có thể bị biến chất hoặc cháy khi đun nóng đến nhiệt độ quá cao.
⇒ Không dùng chưng cất để tách dầu ra khỏi nước trong trường hợp này.
⇒ Chọn đáp án D Đáp án: D
✔️ B. Đúng. Phương pháp li tâm hoạt động dựa trên sự khác biệt về khối lượng riêng, làm dầu và nước tách thành hai lớp rõ rệt. Ngoài ra, dầu và nước không trộn lẫn (không tan vào nhau) nên có thể tách được.
✔️ C. Đúng. Chiết lỏng - lỏng là phương pháp tách hai chất lỏng không tan vào nhau, dựa vào sự khác biệt về khối lượng riêng. Ở đây, dầu nổi lên trên, nước ở dưới và khi mở van xả nước phía dưới thì thu được dầu.
❌ D. Sai. Chưng cất là phương pháp tách dựa vào sự khác biệt nhiệt độ sôi.
- Nhiệt độ sôi của nước (~100 oC) và dầu mỏ (cao hơn 200 oC) rất chênh lệch.
- Khi đun nóng, nước sẽ bay hơi trước, nhưng dầu có thể bị biến chất hoặc cháy khi đun nóng đến nhiệt độ quá cao.
⇒ Không dùng chưng cất để tách dầu ra khỏi nước trong trường hợp này.
⇒ Chọn đáp án D Đáp án: D
Câu 14 [304832]: Thuỷ phân ester C2H5COOCH3 trong môi trường acid HCl thì thu được sản phẩm gồm các chất là
A, HCOOH và CH3OH.
B, CH3COOH và C2H5OH.
C, C2H5COOH và CH3OH.
D, CH3COONa và CH3OH.
Phân tích phản ứng thủy phân ester trong môi trường acid:

⟹ sản phẩm thu được tương ứng là methanol CH3OH và propionate acid CH3CH2COOH
⟹ Chọn đáp án C Đáp án: C

⟹ sản phẩm thu được tương ứng là methanol CH3OH và propionate acid CH3CH2COOH
⟹ Chọn đáp án C Đáp án: C
Câu 15 [705785]: “Vật liệu ...(1)... là loại vật liệu được tổ hợp từ hai hay nhiều vật liệu khác nhau tạo nên vật liệu mới có tính chất ...(2)... so với các vật liệu ban đầu”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, polymer, bền hơn.
B, silicate, cứng hơn.
C, kim loại, dẻo hơn.
D, composite, vượt trội.
Vật liệu composite là loại vật liệu được tổ hợp từ hai hay nhiều vật liệu khác nhau tạo nên vật liệu mới có tính chất vượt trội so với các vật liệu ban đầu.
Giải thích:
Vật liệu composite được tổ hợp với mục đích tạo nên loại vật liệu mới có nhiều ưu điểm hơn so với vật liệu truyền thống như:
• Nhẹ hơn nhưng bền hơn (ví dụ: sợi carbon nhẹ hơn thép nhưng cứng hơn nhiều).
• Chịu ăn mòn tốt (ví dụ: nhựa composite không bị rỉ sét như kim loại).
• Chịu nhiệt tốt, cách điện, cách nhiệt tốt.
• Dễ gia công thành nhiều hình dạng phức tạp.
⇒ Chọn đáp án D Đáp án: D
Giải thích:
Vật liệu composite được tổ hợp với mục đích tạo nên loại vật liệu mới có nhiều ưu điểm hơn so với vật liệu truyền thống như:
• Nhẹ hơn nhưng bền hơn (ví dụ: sợi carbon nhẹ hơn thép nhưng cứng hơn nhiều).
• Chịu ăn mòn tốt (ví dụ: nhựa composite không bị rỉ sét như kim loại).
• Chịu nhiệt tốt, cách điện, cách nhiệt tốt.
• Dễ gia công thành nhiều hình dạng phức tạp.
⇒ Chọn đáp án D Đáp án: D
Câu 16 [705786]: Muối CoCl2 khan có màu xanh. Hòa tan một lượng muối này vào nước, thu được dung dịch màu hồng (có chứa phức chất X). Nhúng mảnh giấy lọc vào dung dịch này, sấy khô, thu được mảnh giấy có màu xanh (giấy Y). Giấy Y được sử dụng làm giấy chỉ thị để phát hiện nước. Cho các phát biểu sau:
(a) CoCl2 là hợp chất của kim loại chuyển tiếp.
(b) Phức chất X không chứa phối tử aqua (phối tử H2O).
(c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
(d) Khi nhỏ giọt nước lên giấy Y, giấy Y chuyển màu.
Trong các phát biểu trên, những phát biểu đúng là
(a) CoCl2 là hợp chất của kim loại chuyển tiếp.
(b) Phức chất X không chứa phối tử aqua (phối tử H2O).
(c) Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion.
(d) Khi nhỏ giọt nước lên giấy Y, giấy Y chuyển màu.
Trong các phát biểu trên, những phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (d).
D, (c), (d).
Phân tích các đáp án:
✔️ (a) Đúng. Cobalt (Co) là kim loại chuyển tiếp thuộc nhóm VIIIB (nhóm 9) trong bảng tuần hoàn.CoCl2 là muối của kim loại chuyển tiếp.
❌ (b) Sai. Khi hòa tan CoCl2 khan (màu xanh) vào nước, thu được dung dịch màu hồng do tạo thành phức chất [Co(H2O)6]2+.
CoCl2 + 6H2O → [Co(H2O)6]2+ + 2Cl−
Phức chất có chứa phối tử aqua (H2O).
❌ (c) Sai. Trong phức chất [Co(H2O)6]2+, nguyên tử trung tâm Co2+ liên kết với phối tử H2O bằng liên kết cho nhận, không phải liên kết ion. Liên kết ion chỉ xuất hiện giữa ion phức với các ion đối (ví dụ Cl−).
✔️ (d) Đúng. Giấy Y (đã tẩm CoCl2 khan, màu xanh) hấp thụ nước tạo thành [Co(H2O)6]2+, có màu hồng. Ứng dụng: Giấy này được dùng làm chỉ thị phát hiện hơi nước.
⟹ Chọn đáp án C Đáp án: C
✔️ (a) Đúng. Cobalt (Co) là kim loại chuyển tiếp thuộc nhóm VIIIB (nhóm 9) trong bảng tuần hoàn.CoCl2 là muối của kim loại chuyển tiếp.
❌ (b) Sai. Khi hòa tan CoCl2 khan (màu xanh) vào nước, thu được dung dịch màu hồng do tạo thành phức chất [Co(H2O)6]2+.
CoCl2 + 6H2O → [Co(H2O)6]2+ + 2Cl−
Phức chất có chứa phối tử aqua (H2O).
❌ (c) Sai. Trong phức chất [Co(H2O)6]2+, nguyên tử trung tâm Co2+ liên kết với phối tử H2O bằng liên kết cho nhận, không phải liên kết ion. Liên kết ion chỉ xuất hiện giữa ion phức với các ion đối (ví dụ Cl−).
✔️ (d) Đúng. Giấy Y (đã tẩm CoCl2 khan, màu xanh) hấp thụ nước tạo thành [Co(H2O)6]2+, có màu hồng. Ứng dụng: Giấy này được dùng làm chỉ thị phát hiện hơi nước.
⟹ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Lưu huỳnh (sulfur) là phi kim đa hóa trị phổ biến, hiện diện trong một số amino acid và là tiền chất của nhiều hóa chất công nghiệp quan trọng, bao gồm H2SO4. H2SO4 là acid khoáng phổ biến với nhiều ứng dụng, một trong số đó là làm chất điện li trong pin.
Trong pin chì-acid của xe hơi, các phản ứng sau xảy ra:
▪ anode: Pb(s) ⟶ Pb2+(aq) + 2e;
▪ cathode: PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l).
Trong pin chì-acid của xe hơi, các phản ứng sau xảy ra:
▪ anode: Pb(s) ⟶ Pb2+(aq) + 2e;
▪ cathode: PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l).
Câu 17 [705787]: Khi pin hoạt động giải phóng năng lượng,
A, nồng độ H+ giảm dần.
B, nồng độ Pb2+ giảm dần.
C, khối lượng Pb rắn giảm.
D, khối lượng PbO2 rắn giảm.
Phản ứng tại mỗi điện cực:
Anode (cực âm - nơi oxi hóa xảy ra): Pb(s) ⟶ Pb2+(aq) + 2e
→ Chì kim loại bị oxi hóa thành ion Pb2+, làm nồng độ Pb²⁺ tăng.
Cathode (cực dương - nơi khử xảy ra): PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l)
→ PbO2 rắn bị tiêu hao để tạo ra Pb2+.
→ H+ bị tiêu hao, làm nồng độ H+ giảm.
Phân tích các đáp án:
❌ A. Sai. Ở cathode, ion H+ bị tiêu hao trong phản ứng với PbO2 nên nồng độ H+ giảm chứ không tăng.
✔️ B. Đúng. Cả hai điện cực đều tạo ra Pb2+ trong dung dịch, làm nồng độ Pb2+ tăng.
❌ C. Đúng. Pb ở anode bị oxi hóa thành Pb2+, tức là Pb bị ăn mòn, khối lượng giảm chứ không tăng.
❌ D. Sai. PbO2 rắn ở cathode bị tiêu hao để tạo Pb2+, nên khối lượng giảm.
⇒ Chọn đáp án B Đáp án: B
Anode (cực âm - nơi oxi hóa xảy ra): Pb(s) ⟶ Pb2+(aq) + 2e
→ Chì kim loại bị oxi hóa thành ion Pb2+, làm nồng độ Pb²⁺ tăng.
Cathode (cực dương - nơi khử xảy ra): PbO2(s) + 4H+(aq) + 2e ⟶ Pb2+(aq) + 2H2O(l)
→ PbO2 rắn bị tiêu hao để tạo ra Pb2+.
→ H+ bị tiêu hao, làm nồng độ H+ giảm.
Phân tích các đáp án:
❌ A. Sai. Ở cathode, ion H+ bị tiêu hao trong phản ứng với PbO2 nên nồng độ H+ giảm chứ không tăng.
✔️ B. Đúng. Cả hai điện cực đều tạo ra Pb2+ trong dung dịch, làm nồng độ Pb2+ tăng.
❌ C. Đúng. Pb ở anode bị oxi hóa thành Pb2+, tức là Pb bị ăn mòn, khối lượng giảm chứ không tăng.
❌ D. Sai. PbO2 rắn ở cathode bị tiêu hao để tạo Pb2+, nên khối lượng giảm.
⇒ Chọn đáp án B Đáp án: B
Câu 18 [705788]: Cho 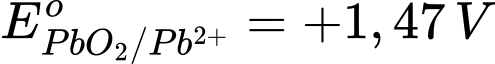 và
và 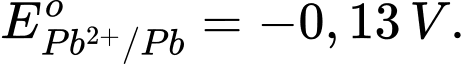 Tính giá trị Eo của pin.
Tính giá trị Eo của pin.
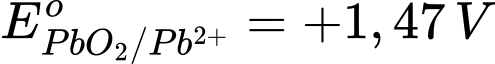 và
và 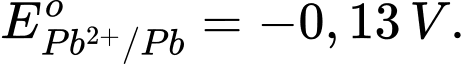 Tính giá trị Eo của pin.
Tính giá trị Eo của pin. A, 0,48 V.
B, 0,85 V.
C, 1,34 V.
D, 1,60 V.
Eopin = Eocathode – Eoanode = 1,47 – (–0,13) = 1,60 V
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705789]: Trong nước thải của một nhà máy, hàm lượng ion amonium là 192 mg/L. Để xử lí ion amonium về nồng độ cho phép là không quá 5 mg/L (theo quy chuẩn Việt Nam), người ta tiến hành xử lí nước thải theo phương pháp Anammox (Anaerobic Ammonium Oxidation). Phương pháp này gồm 2 giai đoạn:
▪ Giai đoạn 1: Oxi hóa một phần ion amonium thành ion nitrite theo phản ứng sau:
2NH4+(aq) + 3O2(g) +4HCO3–(aq) 2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
Trong đó, sử dụng muối NaHCO3 để cung cấp ion HCO3–, sục không khí liên tục để cung cấp O2.
▪ Giai đoạn 2: Diễn ra trong điều kiện yếm khí, lượng amonium còn lại sẽ được oxi hoá trực tiếp bằng ion nitrite từ giai đoạn 1, sản phẩm tạo thành là khí nitrogen theo phản ứng:
NH4+(aq) + NO2–(aq) N2(g) + 2H2O
N2(g) + 2H2O
Biết các phản ứng xảy ra hoàn toàn.
▪ Giai đoạn 1: Oxi hóa một phần ion amonium thành ion nitrite theo phản ứng sau:
2NH4+(aq) + 3O2(g) +4HCO3–(aq)
 2NO2–(aq) + 4CO2(aq) + 6H2O(aq)
2NO2–(aq) + 4CO2(aq) + 6H2O(aq)Trong đó, sử dụng muối NaHCO3 để cung cấp ion HCO3–, sục không khí liên tục để cung cấp O2.
▪ Giai đoạn 2: Diễn ra trong điều kiện yếm khí, lượng amonium còn lại sẽ được oxi hoá trực tiếp bằng ion nitrite từ giai đoạn 1, sản phẩm tạo thành là khí nitrogen theo phản ứng:
NH4+(aq) + NO2–(aq)
 N2(g) + 2H2O
N2(g) + 2H2OBiết các phản ứng xảy ra hoàn toàn.
Phân tích các phát biểu:
✔️A. Đúng. CM (NH4+) = n : V = 192.10-3 : 18 : 1 = 1,07.10-2 M.
❌B. Sai. Số oxi hóa theo PT:
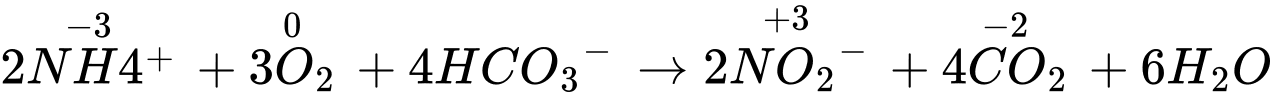
⟹ Chất khử là NH4+, chất oxi hóa là O2.
❌C. Sai. Nếu số oxi hóa thay đổi trong cùng 1 phân tử ⟹ oxi hóa nội phân tử. Nhưng ở giai đoạn 2 có 2 phân tử thay đổi số oxi hóa là NH4+ và NO2-.
✔️D. Đúng. 1mol NH4+ ⟹ 1mol HCO3-
✔️A. Đúng. CM (NH4+) = n : V = 192.10-3 : 18 : 1 = 1,07.10-2 M.
❌B. Sai. Số oxi hóa theo PT:
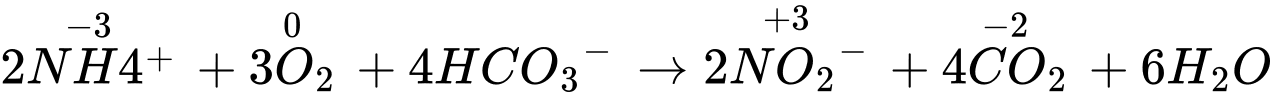
⟹ Chất khử là NH4+, chất oxi hóa là O2.
❌C. Sai. Nếu số oxi hóa thay đổi trong cùng 1 phân tử ⟹ oxi hóa nội phân tử. Nhưng ở giai đoạn 2 có 2 phân tử thay đổi số oxi hóa là NH4+ và NO2-.
✔️D. Đúng. 1mol NH4+ ⟹ 1mol HCO3-
Câu 20 [705790]: Tiến hành theo sơ đồ và các thí nghiệm sau đây:
Điều chế X: Mở khóa phễu cho H2O chảy từ từ xuống bình cầu đựng CaC2 thì có khí X xuất hiện.
Thử tính chất của X:
Thí nghiệm 1: Dẫn X vào bình đựng dung dịch Br2 thì dung dịch Br2 mất màu.
Thí nghiệm 2: Dẫn X vào bình đựng dung dịch AgNO3 trong NH3 xuất hiện kết tủa vàng.
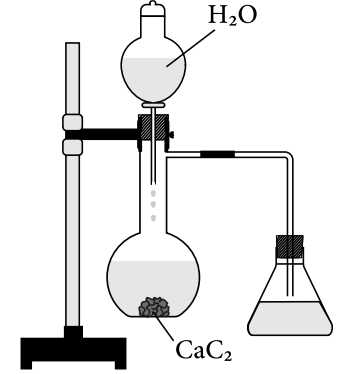
Điều chế X: Mở khóa phễu cho H2O chảy từ từ xuống bình cầu đựng CaC2 thì có khí X xuất hiện.
Thử tính chất của X:
Thí nghiệm 1: Dẫn X vào bình đựng dung dịch Br2 thì dung dịch Br2 mất màu.
Thí nghiệm 2: Dẫn X vào bình đựng dung dịch AgNO3 trong NH3 xuất hiện kết tủa vàng.

CaC2 + 2H2O ⟶ Ca(OH)2 + C2H2
Phân tích các phát biểu:
✔️A. Đúng. Khí thu được là acetylene ( C2H2 ).
✔️B. Đúng. Dẫn C2H2 vào thấy mất màu nước Bromine => Có phản ứng xảy ra. Do C2H2 có liên kết pi.
✔️C. Chỉ có alk - 1yne mới có phản ứng với AgNO3.
C2H2 + 2AgNO3 + 2NH3 = Ag2C2 + 2NH4NO3.
✔️D. Đúng. Phản ứng điều chế C2H2 tỏa 1 lượng nhiệt mạnh, nên cần cho từ từ nước vào.
Phân tích các phát biểu:
✔️A. Đúng. Khí thu được là acetylene ( C2H2 ).
✔️B. Đúng. Dẫn C2H2 vào thấy mất màu nước Bromine => Có phản ứng xảy ra. Do C2H2 có liên kết pi.
✔️C. Chỉ có alk - 1yne mới có phản ứng với AgNO3.
C2H2 + 2AgNO3 + 2NH3 = Ag2C2 + 2NH4NO3.
✔️D. Đúng. Phản ứng điều chế C2H2 tỏa 1 lượng nhiệt mạnh, nên cần cho từ từ nước vào.
Câu 21 [705791]: Thủy phân tripeptide X bằng xúc tác enzyme thu được hỗn hợp gồm alanine, lysine và glutamic acid. Đặt hỗn hợp sản phẩm trong điện trường ở pH = 6,0, phát biểu nào sau đây về sự di chuyển về các amino acid dưới tác dụng của điện trường đúng/sai?
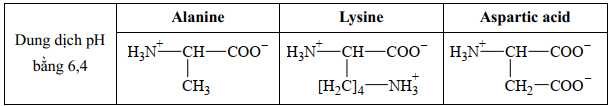
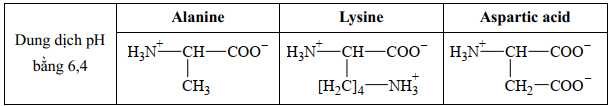
Dung dịch có pH = 6,4
⟹ Tổng điện tích của alanine = 0, của lysine = +1 và aspartic acid = -1
Phân tích các phát biểu:
❌ A. Sai. Có lysine và aspartic aci di chuyển, còn alanine không di chuyển do điện tích = 0
✔️ B. Đúng. Tại pH = 6 alanine không di chuyển trong điện trường do điện tích = 0.
✔️ C. Đúng. Tổng điện tích của lysine = +1.
✔️ D. Đúng. Alanine không di chuyển, Lysine di chuyển về cực âm và aspartic acid di chuyển về cực dương.
⟹ Tổng điện tích của alanine = 0, của lysine = +1 và aspartic acid = -1
Phân tích các phát biểu:
❌ A. Sai. Có lysine và aspartic aci di chuyển, còn alanine không di chuyển do điện tích = 0
✔️ B. Đúng. Tại pH = 6 alanine không di chuyển trong điện trường do điện tích = 0.
✔️ C. Đúng. Tổng điện tích của lysine = +1.
✔️ D. Đúng. Alanine không di chuyển, Lysine di chuyển về cực âm và aspartic acid di chuyển về cực dương.
Câu 22 [705792]: Hòa tan hoàn toàn 2,40 g beryllium chloride vào 50,00 mL nước bên trong cốc thủy tinh. Sau đó chuẩn độ bằng dung dịch lead nitrate 0,80 M vào cốc thủy tinh, tạo thành kết tủa lead(II) chloride. Học sinh thực hiện thí nghiệm này đã đề xuất hai kỹ thuật sau để tách chất kết tủa ra khỏi nước:
(i) Đun sôi để nước bốc hơi.
(ii) Rót nước từ cốc thủy tinh ra bên ngoài.
(i) Đun sôi để nước bốc hơi.
(ii) Rót nước từ cốc thủy tinh ra bên ngoài.
BeCl2 + Pb(NO3)2 ⟹ PbCl2 + Be(NO3)2
n BeCl2 = m : M = 0,03 mol
C BeCl2 = n : CM = 0,03 : 0,05 = 0,6M
BeCl2 ⟹ Be2+ + 2Cl-
n BeCl2 = 0,6M ⟹ nCl- = 1,2M
Lượng kết tủa lớn nhất khi BeCl2 phản ứng hoàn toàn.
V Pb(NO3)2 = n : CM = 0,03 : 0,8M = 37,5 mL
Phân tích các phát biểu:
✔️A. Đúng. BeCl2 là chất điện li mạnh.
❌B. Sai. Nồng độ Be2+ = 0,6M, của Cl- = 1,2M.
✔️C. Đúng. Cần tối thiểu 37,5mL để lượng kết tủa là lớn nhất.
✔️D. Đúng. Cả hai kỹ thuật (i) và (ii) đều không được sử dụng để tách kết tủa ra khỏi nước. Sử dụng phương pháp lọc để tách kết tủa, không sử dụng phương pháp đun sôi và rót nước để tách kết tủa.
- Đun sôi: Có thể loại bỏ nước, để lại chất rắn.
- Rót nước: Có thể giữ lại lượng lớn nước, để lại chất rắn.
Khi sử dụng phương pháp lọc, chất rắn thu được trên giấy lọc có thể được rửa bằng dung môi thích hợp (thường là nước cất) để loại bỏ các ion hoặc tạp chất hòa tan còn bám lại trên bề mặt kết tủa. Quá trình này giúp tăng độ tinh khiết của sản phẩm.
n BeCl2 = m : M = 0,03 mol
C BeCl2 = n : CM = 0,03 : 0,05 = 0,6M
BeCl2 ⟹ Be2+ + 2Cl-
n BeCl2 = 0,6M ⟹ nCl- = 1,2M
Lượng kết tủa lớn nhất khi BeCl2 phản ứng hoàn toàn.
V Pb(NO3)2 = n : CM = 0,03 : 0,8M = 37,5 mL
Phân tích các phát biểu:
✔️A. Đúng. BeCl2 là chất điện li mạnh.
❌B. Sai. Nồng độ Be2+ = 0,6M, của Cl- = 1,2M.
✔️C. Đúng. Cần tối thiểu 37,5mL để lượng kết tủa là lớn nhất.
✔️D. Đúng. Cả hai kỹ thuật (i) và (ii) đều không được sử dụng để tách kết tủa ra khỏi nước. Sử dụng phương pháp lọc để tách kết tủa, không sử dụng phương pháp đun sôi và rót nước để tách kết tủa.
- Đun sôi: Có thể loại bỏ nước, để lại chất rắn.
- Rót nước: Có thể giữ lại lượng lớn nước, để lại chất rắn.
Khi sử dụng phương pháp lọc, chất rắn thu được trên giấy lọc có thể được rửa bằng dung môi thích hợp (thường là nước cất) để loại bỏ các ion hoặc tạp chất hòa tan còn bám lại trên bề mặt kết tủa. Quá trình này giúp tăng độ tinh khiết của sản phẩm.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705793]: Trong công nghiệp, kim loại sắt (Iron, Fe) được sản xuất bằng phương pháp nhiệt luyện quặng hemantite. Với hiệu suất chuyển hóa từ Fe2O3 thành Fe là 75%. Để sản xuất được 5,6 tấn Fe cần dùng bao nhiêu tấn nguyên liệu quặng hematite biết quặng có chưa 70% Fe2O3. (Làm tròn đến hàng phần mười)
Trong Fe2O3 có 2 nguyên tử Fe
Số mol Fe = m ÷ M = 5,6.106 ÷ 56 = 0,1.106 mol
⇒ Số mol Fe2O3 = nFe ÷ 2 ÷ Hiệu suất = 0,1 ÷ 2 ÷ 75%
Do trong quặng chứa 70% Fe2O3
⇒ mquặng = mFe2O3 ÷ 70% = 0,1.106 ÷ 2 ÷ 75% × 160 ÷ 70%
= 15238095 gam ≈ 15,2 tấn
⇒ Điền đáp án : 15,2
Số mol Fe = m ÷ M = 5,6.106 ÷ 56 = 0,1.106 mol
⇒ Số mol Fe2O3 = nFe ÷ 2 ÷ Hiệu suất = 0,1 ÷ 2 ÷ 75%
Do trong quặng chứa 70% Fe2O3
⇒ mquặng = mFe2O3 ÷ 70% = 0,1.106 ÷ 2 ÷ 75% × 160 ÷ 70%
= 15238095 gam ≈ 15,2 tấn
⇒ Điền đáp án : 15,2
Câu 24 [683551]: Dẫn 10,8 gam but-1-yne qua dung dịch AgNO3 trong NH3 dư, sau phản ứng thu a gam kết tủa. Giá trị của a là bao nhiêu?
Điền đáp án: __________
Điền đáp án: __________
Ta có: Số mol của but-1-yne: nC4H6 = 10,8 ÷ 54 = 0,2mol
Phương trình phản ứng:
CH≡C-CH2-CH3 + AgNO3 + NH3 ⟶ CAg≡C-CH2-CH3 ↓ + NH4NO3
Theo phương trình: nkết tủa = nC4H6 = 0,2 mol
Khối lượng kết tủa thu được là: m↓ = 0,2 × 161 = 32,2 gam
⇒ Điền đáp án: 32,2
Phương trình phản ứng:
CH≡C-CH2-CH3 + AgNO3 + NH3 ⟶ CAg≡C-CH2-CH3 ↓ + NH4NO3
Theo phương trình: nkết tủa = nC4H6 = 0,2 mol
Khối lượng kết tủa thu được là: m↓ = 0,2 × 161 = 32,2 gam
⇒ Điền đáp án: 32,2
Câu 25 [705794]: Trong số các chất được cho trong dãy sau: CH3CHO; CH3COCH3; CH3COOC2H5; CH2=CH2; NH2CH2COOH, có bao nhiêu chất không tạo bạc với thuốc thử Tollens?
Các chất phản ứng với thuốc thử Tollens chứa nhóm -CHO hoặc HCOO-
Có CH3CHO tham gia phản ứng trong các chất trên.
⇒ Còn 4 chất không phản ứng.
⇒ Điền đáp án: 4
Có CH3CHO tham gia phản ứng trong các chất trên.
⇒ Còn 4 chất không phản ứng.
⇒ Điền đáp án: 4
Câu 26 [705795]: Biểu đồ phổ khối lượng bên dưới thể hiện cho một hợp chất chỉ có hai nguyên tố là C và H trong đó có 12 nguyên tố C. Cho biết số nguyên tố H trong phân tử hợp chất là bao nhiêu?
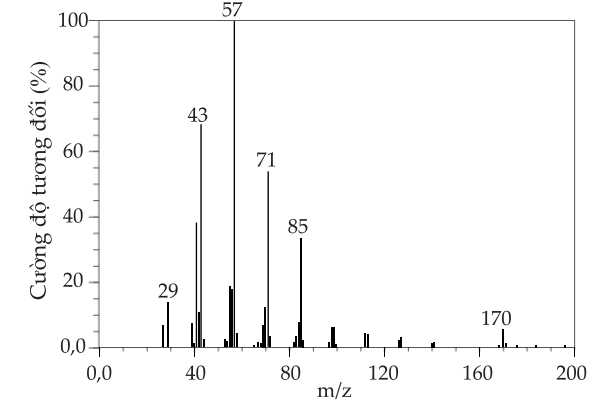

Gọi công thức của hợp chất là CxHy
Mảnh m/z lớn nhất = 170 = Khối lượng của CxHy
Hợp chất có 12C nên có dạng C12Hy.
⇒ 12 × 12 + y = 170
⇒ y = 26
⇒ Điền đáp án: 26
Mảnh m/z lớn nhất = 170 = Khối lượng của CxHy
Hợp chất có 12C nên có dạng C12Hy.
⇒ 12 × 12 + y = 170
⇒ y = 26
⇒ Điền đáp án: 26
Câu 27 [705796]: Lactic acid hay acid sữa là hợp trong nhiều quá trình sinh hoá, lần đầu tiên được phân tách vào năm 1780 bởi nhà hoá học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân tử C3H6O3, công thức cấu tạo CH3–CH(OH)–COOH.
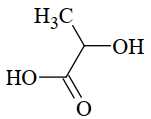
Khi vận động mạnh cơ thể không cung cấp đủ oxygen, thì cơ thể sẽ chuyển hoá glucose thành lactic acid (lactic acid tạo thành từ quá trình này sẽ gây mỏi cơ) theo phương trình sau:C6H12O6(aq) 2C3H6O3(aq);
2C3H6O3(aq); 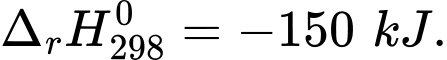 Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng (g) lactic acid tạo ra từ quá trình này (Làm tròn đến hàng phần mười). Biết rằng 1 cal = 4,184 J.
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng (g) lactic acid tạo ra từ quá trình này (Làm tròn đến hàng phần mười). Biết rằng 1 cal = 4,184 J.

Khi vận động mạnh cơ thể không cung cấp đủ oxygen, thì cơ thể sẽ chuyển hoá glucose thành lactic acid (lactic acid tạo thành từ quá trình này sẽ gây mỏi cơ) theo phương trình sau:C6H12O6(aq)
 2C3H6O3(aq);
2C3H6O3(aq); 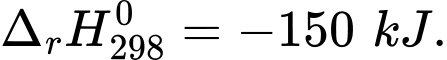 Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng (g) lactic acid tạo ra từ quá trình này (Làm tròn đến hàng phần mười). Biết rằng 1 cal = 4,184 J.
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng (g) lactic acid tạo ra từ quá trình này (Làm tròn đến hàng phần mười). Biết rằng 1 cal = 4,184 J.
Năng lượng chạy Q = 300 kcal
Q (chuyển hóa G ⇒ Lac) = 2 ÷ 100 × 300 = 6 kcal
6 kcal = 6000 cal = 6000 × 4,184 = 25104 J = 25,104 kJ
Cứ 2 mol C3H6O3 ⇒ -150 kJ
x mol ⇒ 25,104 kJ
⇒ x = 0,33472 mol
⇒ m C3H6O3 = 30,12 (g)
⇒ Điền đáp án: 30,1
Q (chuyển hóa G ⇒ Lac) = 2 ÷ 100 × 300 = 6 kcal
6 kcal = 6000 cal = 6000 × 4,184 = 25104 J = 25,104 kJ
Cứ 2 mol C3H6O3 ⇒ -150 kJ
x mol ⇒ 25,104 kJ
⇒ x = 0,33472 mol
⇒ m C3H6O3 = 30,12 (g)
⇒ Điền đáp án: 30,1
Câu 28 [705797]: Một nhà máy muốn xác định tổng độ cứng và nồng độ ion Ca2+ của mẫu nước khoáng. Kỹ sư cho 50 mL nước khoáng cho vào bình định mức 100 mL, thêm nước cất đến vạch định mức thì thu được 100 mL dung dịch X.
Phần 1: Lấy 20 mL dung dịch X chuẩn độ với dung dịch EDTA 0,01 M, thì dùng hết 1,85 mL dung dịch EDTA.
Phần 2: Lấy 20 mL dung dịch X, điểu chỉnh pH của dung dịch lên 12 bằng cách thêm NaOH 0,2 M để loại ion Mg2+ dưới dạng kết tủa Mg(OH)2. Sau khi tách kết tủa, cũng tiến hành chuẩn độ với dung dịch EDTA 0,01 M thì thấy dùng hết 1,24 mL dung dịch EDTA.
Hãy tính nồng độ Mg2+ (ppm) trong nước (Làm tròn đến hàng phần mười). Biết 1 ppm là 1 mg chất tan trong 1 L dung dịch và phương trình chuẩn độ như sau:
Mg2+(aq) + EDTA2–(aq) ⟶ Mg(EDTA)(aq)
Ca2+(aq) + EDTA2–(aq) ⟶ Ca(EDTA)(aq)
Phần 1: Lấy 20 mL dung dịch X chuẩn độ với dung dịch EDTA 0,01 M, thì dùng hết 1,85 mL dung dịch EDTA.
Phần 2: Lấy 20 mL dung dịch X, điểu chỉnh pH của dung dịch lên 12 bằng cách thêm NaOH 0,2 M để loại ion Mg2+ dưới dạng kết tủa Mg(OH)2. Sau khi tách kết tủa, cũng tiến hành chuẩn độ với dung dịch EDTA 0,01 M thì thấy dùng hết 1,24 mL dung dịch EDTA.
Hãy tính nồng độ Mg2+ (ppm) trong nước (Làm tròn đến hàng phần mười). Biết 1 ppm là 1 mg chất tan trong 1 L dung dịch và phương trình chuẩn độ như sau:
Mg2+(aq) + EDTA2–(aq) ⟶ Mg(EDTA)(aq)
Ca2+(aq) + EDTA2–(aq) ⟶ Ca(EDTA)(aq)
Phần 1: Cả Mg2+ và Ca2+ đều phản ứng với EDTA2- theo phương trình:
Mg2+ + EDTA2- ⟶ Mg(EDTA)
Ca2+ + EDTA2- ⟶ Ca(EDTA)
Tổng số mol EDTA tham gia phản ứng là:
1,85 ÷ 1000 × 0,01 = 1,85×10 -5 mol
Phần 2: Chỉ có Ca2+ phản ứng.
Số mol EDTA = 1,24 ÷ 1000 × 0,01 = 1,24×10-5 mol
Số mol Ca2+ = 1,24 × 10-5 mol
⇒ Số mol Mg2+ = 1,85×10 -5 – 1,24×10-5 = 6,1 × 10-6 mol ( trong 20mL)
⇒ Trong 100mL ⇒ 6,1 × 10-6 × 24 × 100/20 = 7,32 × 10-4
Ppm = m ÷ L
= 7,32 ×10-4× 103 : 0,05 = 14,6 ppm
⇒ Điền đáp án: 14,6
Mg2+ + EDTA2- ⟶ Mg(EDTA)
Ca2+ + EDTA2- ⟶ Ca(EDTA)
Tổng số mol EDTA tham gia phản ứng là:
1,85 ÷ 1000 × 0,01 = 1,85×10 -5 mol
Phần 2: Chỉ có Ca2+ phản ứng.
Số mol EDTA = 1,24 ÷ 1000 × 0,01 = 1,24×10-5 mol
Số mol Ca2+ = 1,24 × 10-5 mol
⇒ Số mol Mg2+ = 1,85×10 -5 – 1,24×10-5 = 6,1 × 10-6 mol ( trong 20mL)
⇒ Trong 100mL ⇒ 6,1 × 10-6 × 24 × 100/20 = 7,32 × 10-4
Ppm = m ÷ L
= 7,32 ×10-4× 103 : 0,05 = 14,6 ppm
⇒ Điền đáp án: 14,6