PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [702828]: Tinh thể kim loại chứa các …(1)… sắp xếp theo trật tự nhất định cùng với các …(2)… chuyển động tự do. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, hạt kim loại, hạt nhân nguyên tử.
B, hạt nhân nguyên tử, hạt kim loại.
C, electron tự do, cation kim loại.
D, cation kim loại, electron tự do.
- Trong kim loại, khi các nguyên tử mất đi electron ở lớp vỏ ngoài cùng sẽ trở thành các ion dương (cation). Những ion này chiếm các vị trí cố định trong mạng tinh thể kim loại, tạo nên cấu trúc trật tự.
- Các electron bị mất không bị giữ cố định bởi bất kỳ ion dương nào mà chuyển động tự do trong tinh thể kim loại.
⇒ Tinh thể kim loại chứa các cation kim loại sắp xếp theo trật tự nhất định cùng với các electron tự do chuyển động tự do.
Chọn đáp án D Đáp án: D
- Các electron bị mất không bị giữ cố định bởi bất kỳ ion dương nào mà chuyển động tự do trong tinh thể kim loại.
⇒ Tinh thể kim loại chứa các cation kim loại sắp xếp theo trật tự nhất định cùng với các electron tự do chuyển động tự do.
Chọn đáp án D Đáp án: D
Câu 2 [560808]: Sodium hydroxide (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của sodium hydroxide là
A, Ca(OH)2.
B, NaOH.
C, NaHCO3.
D, Na2CO3.
Hydroxide là một nhóm chức hóa học, công thức hóa học là OH−, gồm một nguyên tử oxygen liên kết với một nguyên tử hydrogen
⤑ Sodium là Na; hydroxide là OH nên sodium hydroxide có công thức là NaOH.
⇒ Chọn đáp án B Đáp án: B
⤑ Sodium là Na; hydroxide là OH nên sodium hydroxide có công thức là NaOH.
⇒ Chọn đáp án B Đáp án: B
Câu 3 [309447]: Tên gọi của polymer có công thức: 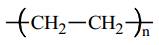 là
là
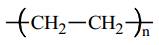 là
là A, Poly(methyl metacrylate).
B, Poly(vinyl chloride).
C, Polyethylene.
D, Polystyrene.
Polymer được tạo bởi các đơn phân (monomer) liên kết với nhau thông qua các liên kết hóa học để tạo thành chuỗi dài.
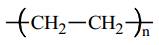 là một polymer được tạo thành từ monomer CH2=CH2 (ethylene) qua phản ứng trùng hợp.
là một polymer được tạo thành từ monomer CH2=CH2 (ethylene) qua phản ứng trùng hợp.
⇒ Chọn đáp án C Đáp án: C
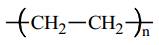 là một polymer được tạo thành từ monomer CH2=CH2 (ethylene) qua phản ứng trùng hợp.
là một polymer được tạo thành từ monomer CH2=CH2 (ethylene) qua phản ứng trùng hợp.⇒ Chọn đáp án C Đáp án: C
Câu 4 [560410]: Khi nhúng thanh kim loại Cu vào trong dung dịch muối CuSO4 sẽ tạo thành điện cực của cặp oxi hóa – khử nào sau đây?
A, Cu3+/Cu.
B, Cu2+/Cu.
C, Cu2+/Cu3+.
D, Cu2+/SO42–.
Trong kí hiệu cặp oxi hoá – khử, dạng oxi hoá (dạng có số oxi hoá cao hơn) luôn ở bên trên còn dạng khử (dạng có số oxi hoá thấp hơn) luôn ở bên dưới.
→ Cặp oxi hoá - khử của quá trình là Cu2+/Cu.
⇒ Chọn đáp án B Đáp án: B
→ Cặp oxi hoá - khử của quá trình là Cu2+/Cu.
⇒ Chọn đáp án B Đáp án: B
Câu 5 [702829]: Hạt cơ bản nào sau đây không bị lệch trong điện trường?
A, Electron.
B, Proton.
C, Neutron.
D, Hydrogen.
Nguyên tử chứa 3 loại hạt cơ bản:
+ Electron mang điện tích âm nên lệch về phía cực dương trong điện trường
+ Proton mang điện tích dương nên lệch về phía cực âm trong điện trường
+ Neutron không mang điện tích nên không bị lệch trong điện trường.
⇒ Chọn đáp án C Đáp án: C
+ Electron mang điện tích âm nên lệch về phía cực dương trong điện trường
+ Proton mang điện tích dương nên lệch về phía cực âm trong điện trường
+ Neutron không mang điện tích nên không bị lệch trong điện trường.
⇒ Chọn đáp án C Đáp án: C
Câu 6 [560483]: Cho bán phản ứng và giá trị thế điện cực chuẩn như sau:
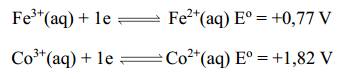
Giá trị suất điện động của pin Fe – Co là
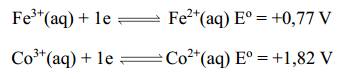
Giá trị suất điện động của pin Fe – Co là
A, 2,59 V.
B, +1,05 V.
C, –1,05 V.
D, –2,59 V.
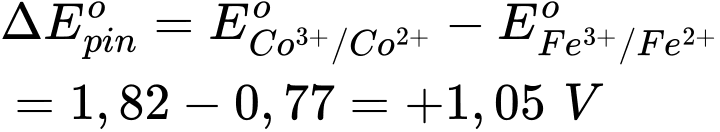
⇒ Chọn đáp án B Đáp án: B
Câu 7 [702830]: Vấn đề nào sau đây có thể xảy ra nếu nông dân bón quá nhiều NH4NO3 cho cây trồng?
A, Lượng NH4NO3 dư thừa (do thực vật không sử dụng hết) làm cho đất bị kiềm hóa.
B, Mưa rửa trôi một số NH4NO3 vào nước sông và tạo thành kết tủa.
C, NH4NO3 hòa tan trong nước ngầm và có thể đi vào cơ thể qua đường uống.
D, Ammonia (NH3) được tạo thành, dẫn đến độ pH của đất giảm đáng kể.
Phân tích các vấn đề:
❌ A. Sai. Lượng NH4NO3 dư thừa (do thực vật không sử dụng hết) làm cho đất bị acid hóa do quá trình phân li của NH4NO3 như sau:
NH4NO3 → NH4+ + NO3-. Lúc này, NH4 tiếp tục phân li cho ra NH3 và H+. H+ là môi trường acid nên đất sẽ bị acid hoá.
❌ B. Sai. Mưa rửa trôi một số NH4NO3 vào nước sông nhưng không tạo kết tủa do ion NH4+ và NO3- không có khả năng tạo kết tủa.
❌ C. Sai. NH4NO3 hòa tan tốt trong nước nên chỉ tổn tại trên tầng nước bề mặt nên để trải qua nhiều lớp đá, nhiều tầng khác để xuống nguồn nước ngầm là không thể.
✔️ D. Đúng. Ammonia (NH3) được tạo thành, dẫn đến độ pH của đất giảm đáng kể do phân li ra ion H+, làm cho đất có môi trường acid như ý a đã nhắc đến. Đáp án: D
❌ A. Sai. Lượng NH4NO3 dư thừa (do thực vật không sử dụng hết) làm cho đất bị acid hóa do quá trình phân li của NH4NO3 như sau:
NH4NO3 → NH4+ + NO3-. Lúc này, NH4 tiếp tục phân li cho ra NH3 và H+. H+ là môi trường acid nên đất sẽ bị acid hoá.
❌ B. Sai. Mưa rửa trôi một số NH4NO3 vào nước sông nhưng không tạo kết tủa do ion NH4+ và NO3- không có khả năng tạo kết tủa.
❌ C. Sai. NH4NO3 hòa tan tốt trong nước nên chỉ tổn tại trên tầng nước bề mặt nên để trải qua nhiều lớp đá, nhiều tầng khác để xuống nguồn nước ngầm là không thể.
✔️ D. Đúng. Ammonia (NH3) được tạo thành, dẫn đến độ pH của đất giảm đáng kể do phân li ra ion H+, làm cho đất có môi trường acid như ý a đã nhắc đến. Đáp án: D
Câu 8 [702831]: Để làm giảm mùi tanh của cá đồng (gây ra do một số amine) khi kho cá ta có thể sử dụng loại củ, quả nào sau đây?
A, Cà rốt.
B, Củ cải.
C, Dưa chuột.
D, Khế chua.
Để làm giảm mùi tanh của cá đồng (do một số amine gây ra) khi kho cá ta có thể sử dụng các loại củ, quả có tính acid nhẹ như dứa, khế chua.
⇒ Chọn đáp án D Đáp án: D
⇒ Chọn đáp án D Đáp án: D
Câu 9 [702832]: Bọt cách nhiệt urea-formaldehyde được sử dụng để lấp đầy các hốc tường. Bọt có khả năng phân hủy chậm để giải phóng formaldehyde, đặc biệt là trong điều kiện acid và ẩm ướt. Nồng độ formaldehyde thấp trong không khí có thể gây buồn ngủ, buồn nôn, đau đầu và các bệnh về đường hô hấp khác. Tiêu chuẩn an toàn formaldehyde của không khí trong nhà đã được đặt ở mức 0,1 ppm (ppm: parts-per-million: 1/1000000) theo thể tích. Vì formaldehyde là chất khử, nên các thiết bị đã được chế tạo để loại bỏ nó bằng phản ứng oxy hóa khử. Không khí trong nhà được lưu thông qua máy lọc không khí có chứa chất oxi hóa như Al2O3/KMnO4, chất này chuyển đổi formaldehyde thành acid hữu cơ có cùng số carbon tương ứng. Cho các phát biểu:
(a) Urea-formaldehyde được tổng hợp bằng cách đồng trùng hợp urea và formaldehyde.
(b) Nồng độ formaldehyde trong môi trường không khí ẩm thấp hơn trong không khí khô.
(c) Tiêu chuẩn an toàn formaldehyde của không khí trong nhà là 1 lít formaldehyde trong 10 triệu lít không khí.
(d) Chất oxi hóa như Al2O3/KMnO4 sẽ chuyển đổi formaldehyde thành formic acid.
Số phát biểu đúng là
(a) Urea-formaldehyde được tổng hợp bằng cách đồng trùng hợp urea và formaldehyde.
(b) Nồng độ formaldehyde trong môi trường không khí ẩm thấp hơn trong không khí khô.
(c) Tiêu chuẩn an toàn formaldehyde của không khí trong nhà là 1 lít formaldehyde trong 10 triệu lít không khí.
(d) Chất oxi hóa như Al2O3/KMnO4 sẽ chuyển đổi formaldehyde thành formic acid.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu:
❌ (a) Sai. Urea-formaldehyde được tổng hợp bằng cách đồng trùng ngưng urea và formaldehyde.
❌ (b) Sai. Nồng độ formaldehyde trong môi trường không khí ẩm cao hơn trong không khí khô.
✔️ (c) Đúng. Tiêu chuẩn an toàn formaldehyde của không khí trong nhà là 0,1 ppm tức 1 lít formaldehyde trong 10 triệu lít không khí.
✔️ (d) Đúng. Chất oxi hóa như Al2O3/KMnO4 sẽ chuyển đổi formaldehyde thành formic acid.
⇒ Có 2 phát biểu đúng là (c) và (d)
⇒ Chọn đáp án B Đáp án: B
❌ (a) Sai. Urea-formaldehyde được tổng hợp bằng cách đồng trùng ngưng urea và formaldehyde.
❌ (b) Sai. Nồng độ formaldehyde trong môi trường không khí ẩm cao hơn trong không khí khô.
✔️ (c) Đúng. Tiêu chuẩn an toàn formaldehyde của không khí trong nhà là 0,1 ppm tức 1 lít formaldehyde trong 10 triệu lít không khí.
✔️ (d) Đúng. Chất oxi hóa như Al2O3/KMnO4 sẽ chuyển đổi formaldehyde thành formic acid.
⇒ Có 2 phát biểu đúng là (c) và (d)
⇒ Chọn đáp án B Đáp án: B
Câu 10 [702833]: Sau khi biết công thức thực nghiệm, có thể xác định công thức phân tử của hợp chất hữu cơ dựa trên đặc điểm nào sau đây?
A, Phân tử khối của chất.
B, Thành phần phần trăm về khối lượng các nguyên tố có trong phân tử chất.
C, Khối lượng các sản phẩm thu được khi đốt cháy hoàn toàn một lượng chất xác định.
D, Các hấp thụ đặc trưng trên phổ IR của chất.
Công thức thực nghiệm chỉ cho biết tỷ lệ tối giản giữa các nguyên tố, không phản ánh đầy đủ số lượng thực tế của các nguyên tử trong phân tử nên phân tử khối là yếu tố cần thiết để chuyển từ công thức thực nghiệm (chỉ tỷ lệ nguyên tố) sang công thức phân tử (phản ánh đúng số lượng nguyên tử trong phân tử).
⇒ Chọn đáp án A Đáp án: A
⇒ Chọn đáp án A Đáp án: A
Câu 11 [702834]: Thuỷ phân ester ethyl butanoate trong dung dịch sodium hydroxide loãng, dư. Hợp chất nào sau đây là một trong các sản phẩm của phản ứng này?
A, CH3CH2CH2COONa.
B, CH3COONa.
C, CH3CH2ONa
D, H2O.
Ester ethyl butanoate có công thức là CH3-CH2-CH2-COO-CH2-CH3 nên khi thuỷ phân trong môi trường kiềm (NaOH) phản ứng sẽ xảy ra như sau:
CH3-CH2-CH2-COO-CH2-CH3 + NaOH → CH3-CH2-CH2-COONa + CH3-CH2OH
⇒ Chọn đáp án A Đáp án: A
CH3-CH2-CH2-COO-CH2-CH3 + NaOH → CH3-CH2-CH2-COONa + CH3-CH2OH
⇒ Chọn đáp án A Đáp án: A
Câu 12 [702835]: Khi thay thế một hay nhiều nguyên tử …(1)… trong phân tử ammonia bằng một hay nhiều gốc …(2)… thu được amine. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, hydrogen, amino.
B, nitrogen, amino.
C, hydrogen, hydrocarbon.
D, nitrogen, hydrocarbon.
Ammonia (NH3) là hợp chất cơ bản có cấu trúc gồm một nguyên tử nitrogen (N) liên kết với ba nguyên tử hydrogen (H).
Amine: Được hình thành khi các nguyên tử H trong NH3 được thay thế bởi các gốc hydrocarbon (như CH3, C2H5,...) hoặc các nhóm alkyl/aryl.
⇒ Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử ammonia bằng một hay nhiều gốc hydrocarbon thu được amine.
⇒ Chọn đáp án C Đáp án: C
Amine: Được hình thành khi các nguyên tử H trong NH3 được thay thế bởi các gốc hydrocarbon (như CH3, C2H5,...) hoặc các nhóm alkyl/aryl.
⇒ Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử ammonia bằng một hay nhiều gốc hydrocarbon thu được amine.
⇒ Chọn đáp án C Đáp án: C
Câu 13 [702836]: Chất nào sau đây biểu diễn cấu tạo của một ester?
A, 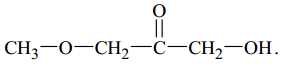
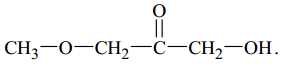
B, 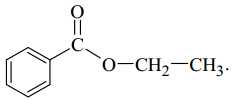

C, 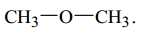
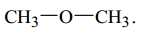
D, 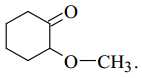

Ester là một loại hợp chất hữu cơ có công thức chung RCOOR' (trong phân tử có nhóm COO)
❌ A. Phân tử chỉ chứa nhóm C=O (ketone)
✔️ B. Phân tử chứa nhóm O-C=O (ester)
❌ C. Phân tử chứa chức -O- (ether)
❌ D. Phân tử chứa nhóm C=O và C-O.
⇒ Chọn đáp án B Đáp án: B
❌ A. Phân tử chỉ chứa nhóm C=O (ketone)
✔️ B. Phân tử chứa nhóm O-C=O (ester)
❌ C. Phân tử chứa chức -O- (ether)
❌ D. Phân tử chứa nhóm C=O và C-O.
⇒ Chọn đáp án B Đáp án: B
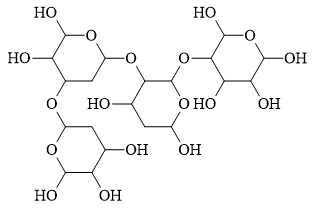
Câu 14 [702837]: Trong cấu tạo của polysaccharide sau đây có bao nhiêu liên kết glycoside?

A, 2.
B, 3.
C, 4.
D, 5.
Liên kết glycoside là liên kết giữa một phân tử đường (carbohydrate) và một phân tử khác (có thể là đường khác hoặc một phân tử không phải đường) thông qua nguyên tử oxygen. Liên kết này hình thành khi một phân tử nước bị loại bỏ trong quá trình kết hợp.
Trong cấu tạo của polysaccharide trên có 3 liên kết glycoside được xác định dưới đây:
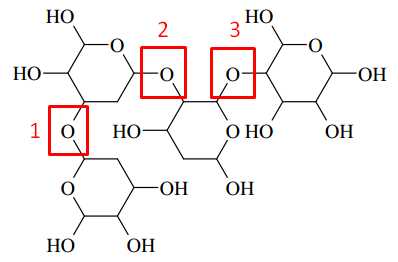
⇒ Chọn đáp án B Đáp án: B
Trong cấu tạo của polysaccharide trên có 3 liên kết glycoside được xác định dưới đây:

⇒ Chọn đáp án B Đáp án: B
Câu 15 [702838]: 1-bromoethane, CH3CH2Br, là một halogenoalkane bậc một. Phản ứng thủy phân trong môi trường kiềm là:
C2H5Br + OH– C2H5OH + Br–
C2H5OH + Br–
Cơ chế của phản ứng được mô tả như sau:
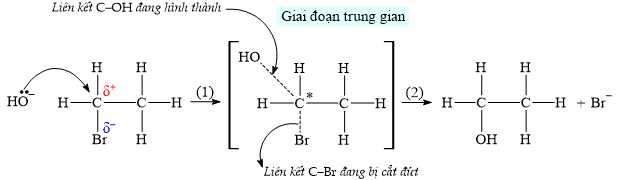
Nhận định nào sau đây là đúng?
C2H5Br + OH–
 C2H5OH + Br–
C2H5OH + Br–Cơ chế của phản ứng được mô tả như sau:

Nhận định nào sau đây là đúng?
A, Ở giai đoạn trung gian, C* tạo thành 5 liên kết σ.
B, Tổng số nguyên tử H trong phân tử hữu cơ trước và sau phản ứng không đổi.
C, Ion OH– hình thành liên kết với C mang một phần điện tích dương (δ+).
D, Nguyên tử Br sẽ tách đi cùng với H của carbon bên cạnh hình thành liên kết σ.
Phân tích các đáp án:
❌ A. Sai. Ở giai đoạn trung gian, C* vẫn có 4 liên kết σ.
❌ B. Sai. Trước phản ứng ta có 5H, sau khi thế -OH vào Br thì ta có 6H.
✔️ C. Đúng. ion OH⁻ tấn công vào carbon mang nhóm rời (Br). Carbon này mang điện tích dương (δ+) trong suốt quá trình phản ứng do sự rút electron từ nhóm halogen (Br). Do đó, OH⁻ tấn công vào carbon mang điện tích dương (δ+).
❌ D. Sai. Nguyên tử Br tách đi một mình và không đi kèm với H. Tách Br⁻ là một quá trình độc lập, không có sự tham gia của H.
⇒ Chọn đáp án C Đáp án: C
❌ A. Sai. Ở giai đoạn trung gian, C* vẫn có 4 liên kết σ.
❌ B. Sai. Trước phản ứng ta có 5H, sau khi thế -OH vào Br thì ta có 6H.
✔️ C. Đúng. ion OH⁻ tấn công vào carbon mang nhóm rời (Br). Carbon này mang điện tích dương (δ+) trong suốt quá trình phản ứng do sự rút electron từ nhóm halogen (Br). Do đó, OH⁻ tấn công vào carbon mang điện tích dương (δ+).
❌ D. Sai. Nguyên tử Br tách đi một mình và không đi kèm với H. Tách Br⁻ là một quá trình độc lập, không có sự tham gia của H.
⇒ Chọn đáp án C Đáp án: C
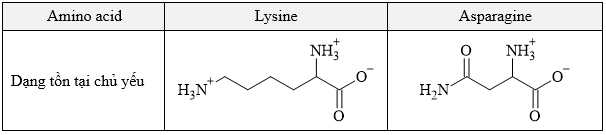
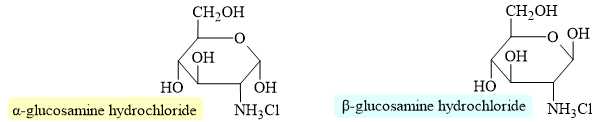
Câu 16 [702839]: Hỗn hợp dipeptide Lys-Asn và hai amino acid thành phần của nó, asparagine và lysine, được phân tách bằng phương pháp điện di sử dụng đệm ở pH 5,0. Biết rằng tại pH = 5 thì lysine và asparagine tồn tại chủ yếu ở các dạng dưới đây:
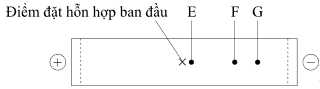
Kết quả khi tiến hành điện di được thể hiện trong hình dưới đây:
Cho các nhận định sau về quá trình điện di:
(a) Tại môi trường pH = 5 thì dạng tồn tại chủ yếu của lysine có tổng điện tích là +1.
(b) Chất E có thể là dipeptide Lys-Asn do có phân tử khối lớn.
(c) Điện tích dương càng lớn thì càng dễ dàng di chuyển về phía cực âm.
(d) Lysine có phân tử khối lớn hơn asparagine nên di chuyển chậm hơn và cách xa cực âm hơn.
Các nhận định đúng là

Kết quả khi tiến hành điện di được thể hiện trong hình dưới đây:

Cho các nhận định sau về quá trình điện di:
(a) Tại môi trường pH = 5 thì dạng tồn tại chủ yếu của lysine có tổng điện tích là +1.
(b) Chất E có thể là dipeptide Lys-Asn do có phân tử khối lớn.
(c) Điện tích dương càng lớn thì càng dễ dàng di chuyển về phía cực âm.
(d) Lysine có phân tử khối lớn hơn asparagine nên di chuyển chậm hơn và cách xa cực âm hơn.
Các nhận định đúng là
A, (a), (c).
B, (a), (d).
C, (a), (c), (d).
D, (b), (c), (d).
Tại pH = 5:
Chất G (lysine, mang điện tích dương mạnh nhất).
Chất F (dipeptide Lys-Asn, mang điện tích dương nhưng yếu hơn lysine).
Chất E (asparagine, mang điện tích bằng 0, di chuyển chậm hoặc không di chuyển).
Phân tích các nhận định:
✔️ (a) Đúng. Tại môi trường pH = 5 thì dạng tồn tại chủ yếu của lysine có tổng điện tích là +1.
❌ (b) Sai. Chất E là asparagine mang điện tích bằng 0, di chuyển chậm hoặc không di chuyển.
✔️ (c) Đúng. Điện tích dương càng lớn thì càng dễ dàng di chuyển về phía cực âm.
❌ (d) Sai. Lysine có phân tử khối lớn hơn asparagine nhưng có điện tích dương hơn nên di chuyển nhanh hơn và gần cực âm hơn.
Các nhận định đúng là (a) và (c)
⇒ Chọn đáp án A Đáp án: A
Chất G (lysine, mang điện tích dương mạnh nhất).
Chất F (dipeptide Lys-Asn, mang điện tích dương nhưng yếu hơn lysine).
Chất E (asparagine, mang điện tích bằng 0, di chuyển chậm hoặc không di chuyển).
Phân tích các nhận định:
✔️ (a) Đúng. Tại môi trường pH = 5 thì dạng tồn tại chủ yếu của lysine có tổng điện tích là +1.
❌ (b) Sai. Chất E là asparagine mang điện tích bằng 0, di chuyển chậm hoặc không di chuyển.
✔️ (c) Đúng. Điện tích dương càng lớn thì càng dễ dàng di chuyển về phía cực âm.
❌ (d) Sai. Lysine có phân tử khối lớn hơn asparagine nhưng có điện tích dương hơn nên di chuyển nhanh hơn và gần cực âm hơn.
Các nhận định đúng là (a) và (c)
⇒ Chọn đáp án A Đáp án: A
Sử dụng đoạn thông tin dưới đây để trả lời câu 17 và câu 18:
Bước đầu tiên trong sản xuất phân lân là xử lý fluor – apatite, một loại đá phosphate được xử lí bằng sulfuric acid để tạo ra calcium dihydrogen phosphate, calcium sulfate và khí hydrogen fluoride. Trong một thí nghiệm, một nhà hóa học kết hợp 1,00 kg mỗi chất phản ứng.
Câu 17 [702840]: Chọn phương trình cân bằng đúng để biểu diễn cho phản ứng:
A, 2CaPO4F(s) + 2H2SO4(aq)  CaH2PO4(aq) + CaSO4(aq) + HF(g);
CaH2PO4(aq) + CaSO4(aq) + HF(g);
 CaH2PO4(aq) + CaSO4(aq) + HF(g);
CaH2PO4(aq) + CaSO4(aq) + HF(g);B, 2CaPO4F(s) + H2SO4(aq)  CaH2PO4(aq) + CaSO4(aq) + HF(g);
CaH2PO4(aq) + CaSO4(aq) + HF(g);
 CaH2PO4(aq) + CaSO4(aq) + HF(g);
CaH2PO4(aq) + CaSO4(aq) + HF(g);C, 2Ca5(PO4)3F(s) + 7H2SO4(aq)  3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g);
3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g);
 3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g);
3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g);D, Ca5(PO4)3F(s) + 3H2SO4(aq)  3Ca(H2PO4)2(aq) + 2CaSO4(aq) + HF(g).
3Ca(H2PO4)2(aq) + 2CaSO4(aq) + HF(g).
 3Ca(H2PO4)2(aq) + 2CaSO4(aq) + HF(g).
3Ca(H2PO4)2(aq) + 2CaSO4(aq) + HF(g).
Fluor – apatite là một khoáng chất phosphate có công thức Ca5(PO4)3F ở dạng chất rắn kết tinh cứng.
Phương trình khi xử lý fluor – apatite bằng sulfuric acid để tạo ra calcium dihydrogen phosphate, calcium sulfate và khí hydrogen fluoride xảy ra như sau:
2Ca5(PO4)3F(s) + 7H2SO4(aq) 3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g)
3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g)
⇒ Chọn đáp án C Đáp án: C
Phương trình khi xử lý fluor – apatite bằng sulfuric acid để tạo ra calcium dihydrogen phosphate, calcium sulfate và khí hydrogen fluoride xảy ra như sau:
2Ca5(PO4)3F(s) + 7H2SO4(aq)
 3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g)
3Ca(H2PO4)2(aq) + 7CaSO4(aq) + 2HF(g)⇒ Chọn đáp án C Đáp án: C
Câu 18 [702841]: Khối lượng chất phản ứng dư còn lại chưa phản ứng là bao nhiêu?
A, 319 gam.
B, 681 gam.
C, 406 gam.
D, 490 gam.
Đổi 1kg = 1000 gam
Số mol của Ca5(PO4)3F là: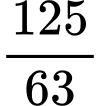 (mol)
(mol)
Số mol của H2SO4 là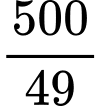 (mol)
(mol)
2Ca5(PO4)3F(s) + 7H2SO4(aq) ⟶ 3Ca(H2PO4)2 + 7CaSO4(aq) + 2HF(aq)
Từ tỉ lệ phương trình → Ca5(PO4)3F hết, H2SO4 dư
Khối lượng lượng của chất dư là:
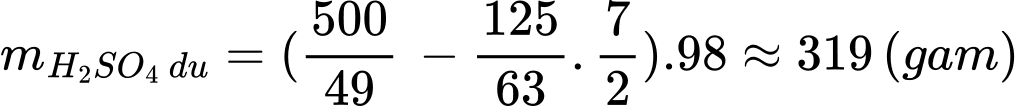
⇒ Chọn đáp án A Đáp án: A
Số mol của Ca5(PO4)3F là:
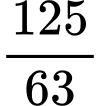 (mol)
(mol)Số mol của H2SO4 là
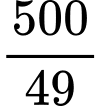 (mol)
(mol)2Ca5(PO4)3F(s) + 7H2SO4(aq) ⟶ 3Ca(H2PO4)2 + 7CaSO4(aq) + 2HF(aq)
Từ tỉ lệ phương trình → Ca5(PO4)3F hết, H2SO4 dư
Khối lượng lượng của chất dư là:
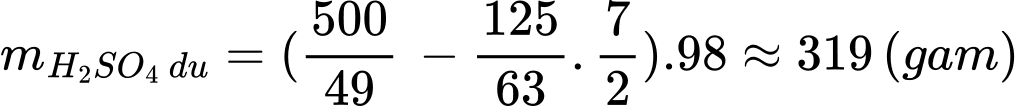
⇒ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [702842]: Một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5 % màu xanh nhạt. Trong dung dịch, ion Cu2+ tạo phức chất với phối tử aqua ở dạng bát diện. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh của phức chất mới (là phức chất tứ diện của Cu2+ với phối tử Cl– có dạng [Cu(Cl)n]2–n).
Phân tích các phát biểu:
❌ a) Sai. Phức chất của Cu2+ với aqua [Cu(H2O)6]2+ có điện tích +2, do phối tử aqua không mang điện.
✔️ b) Đúng. Trong phức chất của [Cu(Cl)n]2–n, giá trị của n là 4.
✔️ c) Đúng. Trong quá trình chuyển đổi giữa các phức, không có sự thay đổi số oxi hoá của các nguyên tố.
✔️ d) Đúng. Trong điều kiện của thí nghiệm, phức chất của Cu2+ với aqua kém bền hơn phức chất của Cu2+ với Cl– do Cl– là một phối tử có khả năng tạo liên kết phối trí mạnh hơn aqua và phức [CuCl4]2− có năng lượng bền hoá cao hơn do sự tương tác mạnh giữa Cu2+ và Cl−.
❌ a) Sai. Phức chất của Cu2+ với aqua [Cu(H2O)6]2+ có điện tích +2, do phối tử aqua không mang điện.
✔️ b) Đúng. Trong phức chất của [Cu(Cl)n]2–n, giá trị của n là 4.
[Cu(H2O)6]2+(aq) + 4Cl-(aq) → [CuCl4]2-(aq) + 6H2O(l)
✔️ c) Đúng. Trong quá trình chuyển đổi giữa các phức, không có sự thay đổi số oxi hoá của các nguyên tố.
✔️ d) Đúng. Trong điều kiện của thí nghiệm, phức chất của Cu2+ với aqua kém bền hơn phức chất của Cu2+ với Cl– do Cl– là một phối tử có khả năng tạo liên kết phối trí mạnh hơn aqua và phức [CuCl4]2− có năng lượng bền hoá cao hơn do sự tương tác mạnh giữa Cu2+ và Cl−.
Câu 20 [702843]: Chitin là một loại polymer thiên nhiên với trữ lượng rất lớn, đứng thứ hai sau cellulose. Trong động vật, chitin là một thành phần cấu trúc quan trọng trong vỏ của tôm, cua,...
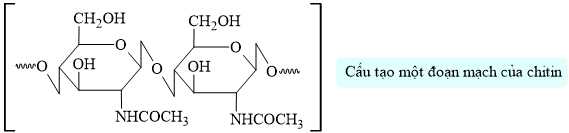
Chitin là nguyên liệu để điều chế glucosamine hydrochloride. Glucosamine giúp hỗ trợ khớp khoẻ mạnh nhờ tái tạo các sụn quanh khớp, đồng thời cũng giúp bảo vệ sụn tránh khỏi phân huỷ bởi các enzyme có trong cơ thể.
Quá trình điều chế glucosamine hydrochloride từ chitin được thực hiện theo các bước sau:
▪ Bước 1: Lấy 10 gam vỏ tôm khô cho vào bình cầu 250 mL. Cho nước ngập vỏ tôm và đun cách thuỷ trong 2 giờ. Rửa sạch để loại bỏ thịt tôm còn bám trên vỏ.
▪ Bước 2: Cho vỏ tôm vừa rửa sạch ở trên vào bình cầu 250 mL, rồi cho thêm 60 mL dung dịch HCl 5%. Đun cách thuỷ trong 2 giờ để loại khoáng (nếu không đun có thể để qua đêm), sau đó rửa bằng nước đến khi pH = 7.
▪ Bước 3: Cho vỏ tôm thu được ở Bước 2 vào bình cầu 250 mL, đổ ngập vỏ tôm bằng dung dịch NaOH 5%, rồi đun cách thuỷ (duy trì ở nhiệt độ 90 – 95 °C) trong 4 giờ. Rửa bằng nước đến pH = 7 và đem sấy khô. Chitin thu được có màu trắng phớt hồng, mềm, không còn vị tanh.
▪ Bước 4: Lấy chitin thu được ở Bước 3 vào bình cầu, rồi thêm khoảng 80 mL dung dịch HCl 35 – 36%. Đun cách thuỷ trong 4 giờ (duy trì ở nhiệt độ 95 – 100 °C). Lắp sinh hàn hồi lưu vào bình cầu. Sau khi đun, nếu thấy sản phẩm có màu thì tẩy màu bằng than hoạt tính. Sau đó, lọc loại bỏ than hoạt tính, để nguội, tinh thể glucosamine hydrochloride sẽ tách ra. Sấy khô ở nhiệt độ khoảng 60 °C, thu được glucosamine hydrochloride màu trắng.

Chitin là nguyên liệu để điều chế glucosamine hydrochloride. Glucosamine giúp hỗ trợ khớp khoẻ mạnh nhờ tái tạo các sụn quanh khớp, đồng thời cũng giúp bảo vệ sụn tránh khỏi phân huỷ bởi các enzyme có trong cơ thể.

Quá trình điều chế glucosamine hydrochloride từ chitin được thực hiện theo các bước sau:
▪ Bước 1: Lấy 10 gam vỏ tôm khô cho vào bình cầu 250 mL. Cho nước ngập vỏ tôm và đun cách thuỷ trong 2 giờ. Rửa sạch để loại bỏ thịt tôm còn bám trên vỏ.
▪ Bước 2: Cho vỏ tôm vừa rửa sạch ở trên vào bình cầu 250 mL, rồi cho thêm 60 mL dung dịch HCl 5%. Đun cách thuỷ trong 2 giờ để loại khoáng (nếu không đun có thể để qua đêm), sau đó rửa bằng nước đến khi pH = 7.
▪ Bước 3: Cho vỏ tôm thu được ở Bước 2 vào bình cầu 250 mL, đổ ngập vỏ tôm bằng dung dịch NaOH 5%, rồi đun cách thuỷ (duy trì ở nhiệt độ 90 – 95 °C) trong 4 giờ. Rửa bằng nước đến pH = 7 và đem sấy khô. Chitin thu được có màu trắng phớt hồng, mềm, không còn vị tanh.
▪ Bước 4: Lấy chitin thu được ở Bước 3 vào bình cầu, rồi thêm khoảng 80 mL dung dịch HCl 35 – 36%. Đun cách thuỷ trong 4 giờ (duy trì ở nhiệt độ 95 – 100 °C). Lắp sinh hàn hồi lưu vào bình cầu. Sau khi đun, nếu thấy sản phẩm có màu thì tẩy màu bằng than hoạt tính. Sau đó, lọc loại bỏ than hoạt tính, để nguội, tinh thể glucosamine hydrochloride sẽ tách ra. Sấy khô ở nhiệt độ khoảng 60 °C, thu được glucosamine hydrochloride màu trắng.
Phân tích các phát biểu:
✔️ a) Đúng. Hợp chất chứa liên kết amide CO-NH trong chitin bị thủy phân trong môi trường acid nên kém bền.
❌ b) Sai. Ở bước 4 xảy ra quá trình thủy phân chitin thành glucosamine hydrochloride khi cho phản ứng với dung dịch HCl và đun cách thuỷ.
✔️ c) Đúng. Ở bước 4, cần lắp sinh hàn hồi lưu vào bình cầu để hạn chế sự bay hơi của hydrochloride do sinh hàn có tác dụng làm lạnh hydrochloride (ở trạng thái lỏng trong điều kiện thường) đang hóa hơi, đi ngang qua ống sẽ ngưng tụ và quay trở lại bình cầu thay vì thoát ra ngoài.
✔️ d) Đúng. Glucosamine hydrochloride tồn tại ở dạng muối rắn ion nên có độ tan cao trong nước, nhưng khi điều kiện thay đổi (giảm nhiệt độ, giảm dung môi), nó dễ kết tinh và tách ra hơn so với glucosamine tự do.
✔️ a) Đúng. Hợp chất chứa liên kết amide CO-NH trong chitin bị thủy phân trong môi trường acid nên kém bền.
❌ b) Sai. Ở bước 4 xảy ra quá trình thủy phân chitin thành glucosamine hydrochloride khi cho phản ứng với dung dịch HCl và đun cách thuỷ.
✔️ c) Đúng. Ở bước 4, cần lắp sinh hàn hồi lưu vào bình cầu để hạn chế sự bay hơi của hydrochloride do sinh hàn có tác dụng làm lạnh hydrochloride (ở trạng thái lỏng trong điều kiện thường) đang hóa hơi, đi ngang qua ống sẽ ngưng tụ và quay trở lại bình cầu thay vì thoát ra ngoài.
✔️ d) Đúng. Glucosamine hydrochloride tồn tại ở dạng muối rắn ion nên có độ tan cao trong nước, nhưng khi điều kiện thay đổi (giảm nhiệt độ, giảm dung môi), nó dễ kết tinh và tách ra hơn so với glucosamine tự do.
Câu 21 [702844]: Trong công nghiệp, một trong những nguồn chính để sản xuất iodine là rong biển. Quy trình được thực hiện như sau:
Bước 1: Người ta phơi khô rong biển, đốt thành tro, ngâm tro trong nước để hòa tan hết các muối.
Bước 2: Gạn lấy dung dịch, đem cô cạn cho đến khi các muối kết tinh, làm lạnh dung dịch xuống 20 °C, phần lớn muối sodium chloride và muối sodium sulfate lắng xuống, còn muối iodide ở lại trong dung dịch.
Bước 3: Cho dung dịch này tác dụng với một lượng khí chlorine (không lấy dư) theo phương trình hóa học: 2NaI(aq) + Cl2(g) 2NaCl(aq) + I2(aq)
2NaCl(aq) + I2(aq)
Bước 4: Sau đó chưng cất để được iodine.
Bước 1: Người ta phơi khô rong biển, đốt thành tro, ngâm tro trong nước để hòa tan hết các muối.
Bước 2: Gạn lấy dung dịch, đem cô cạn cho đến khi các muối kết tinh, làm lạnh dung dịch xuống 20 °C, phần lớn muối sodium chloride và muối sodium sulfate lắng xuống, còn muối iodide ở lại trong dung dịch.
Bước 3: Cho dung dịch này tác dụng với một lượng khí chlorine (không lấy dư) theo phương trình hóa học: 2NaI(aq) + Cl2(g)
 2NaCl(aq) + I2(aq)
2NaCl(aq) + I2(aq)Bước 4: Sau đó chưng cất để được iodine.
Phân tích các phát biểu:
✔️ a) Đúng. Tính oxi hóa của các halogen giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2 nên phản ứng trên chứng tỏ tính oxi hóa của chlorine mạnh hơn iodine.
✔️ b) Đúng. Ở 20 °C, độ tan trong nước của sodium iodide lớn hơn độ tan của sodium chloride do sau phản ứng phần lớn muối NaCl và muối Na2SO4 lắng xuống, còn muối iodide ở lại trong dung dịch.
❌ c) Sai. Không thể thay khí chlorine bằng khí florine vì fluorine sẽ phản ứng trước với nước trong dung dịch, sẽ không phản ứng với NaI:
✔️ a) Đúng. Tính oxi hóa của các halogen giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2 nên phản ứng trên chứng tỏ tính oxi hóa của chlorine mạnh hơn iodine.
✔️ b) Đúng. Ở 20 °C, độ tan trong nước của sodium iodide lớn hơn độ tan của sodium chloride do sau phản ứng phần lớn muối NaCl và muối Na2SO4 lắng xuống, còn muối iodide ở lại trong dung dịch.
❌ c) Sai. Không thể thay khí chlorine bằng khí florine vì fluorine sẽ phản ứng trước với nước trong dung dịch, sẽ không phản ứng với NaI:
2F2 + 2H2O ⟶ 4HF + O2↑
✔️ d) Đúng. Khi dùng dư Cl2 thì Cl2 sẽ phản ứng với I2 gây thất thoát:
I2 + 5Cl2 + 6H2O ⟶ 2HIO3 + 10HCl
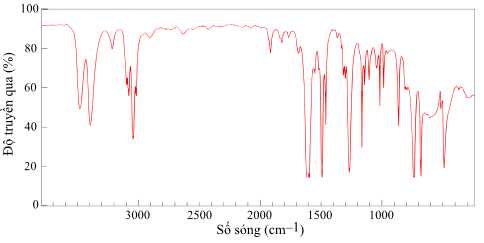
Câu 22 [702845]: M là chất đầu quan trọng trong công nghiệp hóa chất, đặc biệt là trong sản xuất thuốc nhuộm azo - loại thuốc nhuộm phổ biến dùng trong ngành dệt may. Ngoài ra, M còn là nguyên liệu cơ bản để sản xuất các loại nhựa và cao su tổng hợp. Cho biết số sóng hấp thụ đặc trưng của M trên phổ hồng ngoại như sau:
Cho bảng số sóng đặc trưng của các liên kết ở bảng sau:
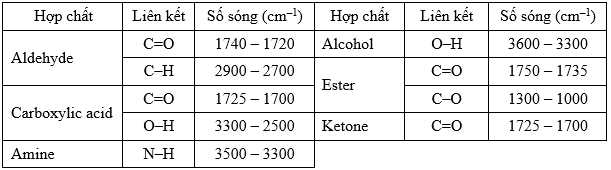

Cho bảng số sóng đặc trưng của các liên kết ở bảng sau:

Phân tích các phát biểu:
❌ a) Sai. Chất đầu trong sản xuất thuốc nhuộm azo là aniline (C6H5NH2) nên M là hợp chất hữu cơ được hình thành khi thay thế một nguyên tử H trong phân tử NH3 bằng một gốc hydrocarbon.
✔️ b) Đúng. Aniline có khả năng phản ứng với nước bromine tạo kết tủa trắng:
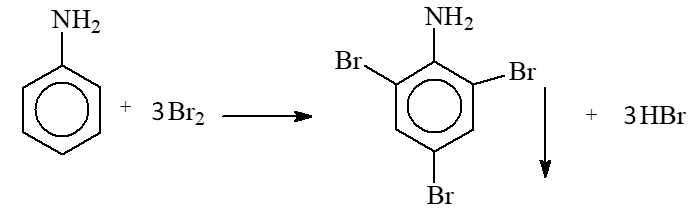
✔️ c) Đúng. Phổ hồng ngoại của M có tín hiệu trong dải hấp thụ 3500-3300 cm-1, là sóng hấp thu đặc trưng của liên kết N–H trong nhóm chức amine.
✔️ d) Dựa vào phổ hồng ngoại có thể phân biệt M với các hợp chất có nhóm chức carbonyl. Do các hợp chất carbonyl chứa C=O nằm trong dải hấp phụ 1740-1720 cm-1 (aldehyde); 1725-1700 cm-1 (ketone) mà M không có.
❌ a) Sai. Chất đầu trong sản xuất thuốc nhuộm azo là aniline (C6H5NH2) nên M là hợp chất hữu cơ được hình thành khi thay thế một nguyên tử H trong phân tử NH3 bằng một gốc hydrocarbon.
✔️ b) Đúng. Aniline có khả năng phản ứng với nước bromine tạo kết tủa trắng:

✔️ c) Đúng. Phổ hồng ngoại của M có tín hiệu trong dải hấp thụ 3500-3300 cm-1, là sóng hấp thu đặc trưng của liên kết N–H trong nhóm chức amine.
✔️ d) Dựa vào phổ hồng ngoại có thể phân biệt M với các hợp chất có nhóm chức carbonyl. Do các hợp chất carbonyl chứa C=O nằm trong dải hấp phụ 1740-1720 cm-1 (aldehyde); 1725-1700 cm-1 (ketone) mà M không có.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [702846]: Trong công nghiệp sản xuất nhôm từ quặng bauxite theo quy trình Hall- Heroult được thực hiện theo sơ đồ: quặng bauxite  Al2O3
Al2O3  Al. Theo tính toán, từ 4 tấn quặng tinh chế được 2 tấn Al2O3 và thu được 1 tấn Al, đồng thời thải ra môi trường 1,574 tấn CO2. Nếu sử dụng 10000 tấn quặng thì lượng khí CO2 thải ra môi trường là bao nhiêu tấn?
Al. Theo tính toán, từ 4 tấn quặng tinh chế được 2 tấn Al2O3 và thu được 1 tấn Al, đồng thời thải ra môi trường 1,574 tấn CO2. Nếu sử dụng 10000 tấn quặng thì lượng khí CO2 thải ra môi trường là bao nhiêu tấn?
 Al2O3
Al2O3  Al. Theo tính toán, từ 4 tấn quặng tinh chế được 2 tấn Al2O3 và thu được 1 tấn Al, đồng thời thải ra môi trường 1,574 tấn CO2. Nếu sử dụng 10000 tấn quặng thì lượng khí CO2 thải ra môi trường là bao nhiêu tấn?
Al. Theo tính toán, từ 4 tấn quặng tinh chế được 2 tấn Al2O3 và thu được 1 tấn Al, đồng thời thải ra môi trường 1,574 tấn CO2. Nếu sử dụng 10000 tấn quặng thì lượng khí CO2 thải ra môi trường là bao nhiêu tấn?
Lượng CO2 thải ra từ 1 tấn quặng là:
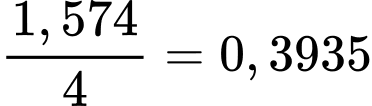 (tấn)
(tấn)
Lượng CO2 thải ra từ 10 000 tấn quặng là:
0,3935 . 10 000 = 3935 (tấn)
⇒ Điền đáp án: 3935
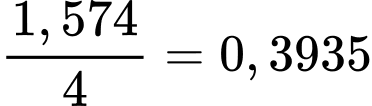 (tấn)
(tấn)Lượng CO2 thải ra từ 10 000 tấn quặng là:
0,3935 . 10 000 = 3935 (tấn)
⇒ Điền đáp án: 3935
Câu 24 [702847]: Triglyceride đóng vai trò là nguồn cung cấp năng lượng và chuyên chở các chất béo trong quá trình trao đổi chất. Cho triglyceride X có công thức cấu tạo như hình sau.
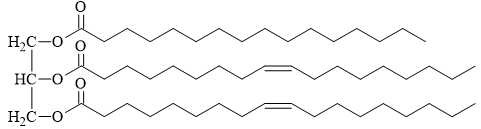
Trong cấu tạo của phân tử chất X trên có chứa bao nhiêu liên kết π?

Trong cấu tạo của phân tử chất X trên có chứa bao nhiêu liên kết π?
Liên kết π là các liên kết đôi trong phân tử. Quan sát cấu tạo của Triglyceride thấy có liên kết π ở các vị trí như sau:
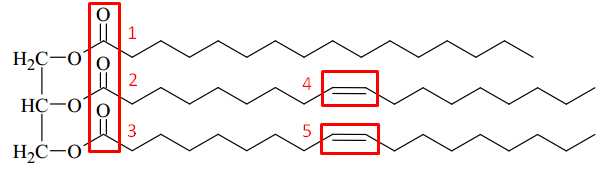
⇒ Điền đáp án: 5

⇒ Điền đáp án: 5
Câu 25 [702848]: Một ester đơn giản có mùi chuối chín là pentyl ethanoate có thể được điều chế từ alcohol và carboxylic acid tương ứng theo các bước như sau:
(1) Nối đường nước với ống sinh hàn và bật nước để đạt được dòng chảy đồng đều bên trong ống sinh hàn.
(2) Cho pentan-1-ol, ethanoic acid, sulfuric acid đặc và một đá tạo bọt vào bình đáy tròn rồi kẹp chặt vào giá.
(3) Đun nóng hỗn hợp bằng bếp ủ nhiệt với nhiệt độ ổn định không đổi trong khoảng 30 phút. Đảm bảo hỗn hợp không bị đun nóng quá nhiều nếu không hơi sẽ thoát ra khỏi đỉnh của bình.
(4) Lắp thiết bị hồi lưu. Đảm bảo các dụng cụ được kẹp chắc chắn và khớp chặt với nhau.
Hãy sắp xếp các bước theo trình tự dãy bốn số để có quá trình đúng điều chế ester pentyl ethanoate (ví dụ: 1234, 4213, ...).
(1) Nối đường nước với ống sinh hàn và bật nước để đạt được dòng chảy đồng đều bên trong ống sinh hàn.
(2) Cho pentan-1-ol, ethanoic acid, sulfuric acid đặc và một đá tạo bọt vào bình đáy tròn rồi kẹp chặt vào giá.
(3) Đun nóng hỗn hợp bằng bếp ủ nhiệt với nhiệt độ ổn định không đổi trong khoảng 30 phút. Đảm bảo hỗn hợp không bị đun nóng quá nhiều nếu không hơi sẽ thoát ra khỏi đỉnh của bình.
(4) Lắp thiết bị hồi lưu. Đảm bảo các dụng cụ được kẹp chắc chắn và khớp chặt với nhau.
Hãy sắp xếp các bước theo trình tự dãy bốn số để có quá trình đúng điều chế ester pentyl ethanoate (ví dụ: 1234, 4213, ...).
Quy trình điều chế ester có mùi chuối chín là pentyl ethanoate:
Bước 1: Cho pentan-1-ol, ethanoic acid, sulfuric acid đặc và một đá tạo bọt vào bình đáy tròn rồi kẹp chặt vào giá. → Ứng với (2)
Bước 2: Lắp thiết bị hồi lưu. Đảm bảo các dụng cụ được kẹp chắc chắn và khớp chặt với nhau. → Ứng với (4)
Bước 3: Nối đường ống nước với đường ống sinh hàn và bật nước để đạt được dòng chảy đồng đều bên trong ống sinh hàn. → Ứng với (1)
Bước 4: Đun nóng hỗn hợp bằng bếp ủ nhiệt với nhiệt độ ổn định không đổi trong 30 phút. Đảm bảo hỗn hợp không bị đun nóng quá nhiều nếu không hơi sẽ thoát ra khỏi bình. → Ứng với (3)
⇒ Điền đáp án: 2413
Bước 1: Cho pentan-1-ol, ethanoic acid, sulfuric acid đặc và một đá tạo bọt vào bình đáy tròn rồi kẹp chặt vào giá. → Ứng với (2)
Bước 2: Lắp thiết bị hồi lưu. Đảm bảo các dụng cụ được kẹp chắc chắn và khớp chặt với nhau. → Ứng với (4)
Bước 3: Nối đường ống nước với đường ống sinh hàn và bật nước để đạt được dòng chảy đồng đều bên trong ống sinh hàn. → Ứng với (1)
Bước 4: Đun nóng hỗn hợp bằng bếp ủ nhiệt với nhiệt độ ổn định không đổi trong 30 phút. Đảm bảo hỗn hợp không bị đun nóng quá nhiều nếu không hơi sẽ thoát ra khỏi bình. → Ứng với (3)
⇒ Điền đáp án: 2413
Câu 26 [702849]: Có bao nhiêu tripeptide khác nhau có thể được tạo thành từ hai gốc phenylalanine và một gốc alanine?
Có 3 tripeptide khác nhau có thể được tạo thành từ hai gốc phenylalanine và một gốc alanine như sau:
1, Phe-Phe-Ala
2, Phe-Ala-Phe
3, Ala-Phe-Phe
⟹ Điền đáp án : 3
1, Phe-Phe-Ala
2, Phe-Ala-Phe
3, Ala-Phe-Phe
⟹ Điền đáp án : 3
Câu 27 [702850]: Xăng sinh học (Biogasonline) là hỗn hợp của xăng truyền thống và cồn sinh học C2H5OH được sử dụng cho các động cơ đốt trong như ô tô, xe máy. Một loại xăng sinh học có thành phần và khối lượng riêng các chất như bảng dưới đây:
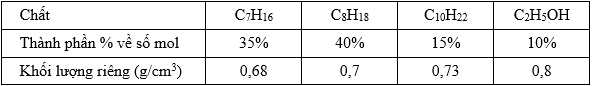
Cho các phương trình nhiệt hóa sau:
(1) C7H16(g) +11O2(g) 7CO2(g) + 8H2O(l)
7CO2(g) + 8H2O(l) 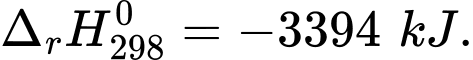
(2) C8H18(l) + 12,5O2(g) 8CO2(g) + 9H2O(l)
8CO2(g) + 9H2O(l) 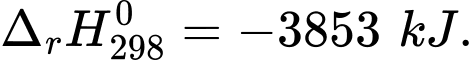
(3) C10H22(l) + 15,5O2(g) 10CO2(g) + 11H2O(l)
10CO2(g) + 11H2O(l) 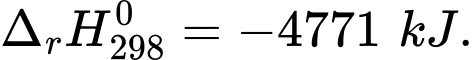
(4) C2H5OH(l) + 3,5O2(g) 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) 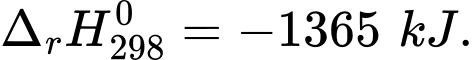
Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 250 kJ. Nếu dùng xăng sinh học trên làm nhiên liệu, hãy tính quãng đường xe đi được theo đơn vị km với 1 lít xăng, biết hiệu suất sử dụng nhiệt của xe là 60% (làm tròn đến hàng phần mười).

Cho các phương trình nhiệt hóa sau:
(1) C7H16(g) +11O2(g)
 7CO2(g) + 8H2O(l)
7CO2(g) + 8H2O(l) 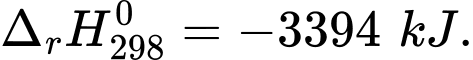
(2) C8H18(l) + 12,5O2(g)
 8CO2(g) + 9H2O(l)
8CO2(g) + 9H2O(l) 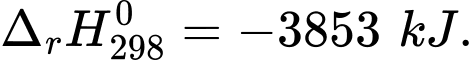
(3) C10H22(l) + 15,5O2(g)
 10CO2(g) + 11H2O(l)
10CO2(g) + 11H2O(l) 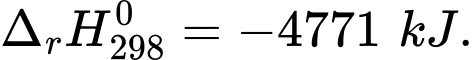
(4) C2H5OH(l) + 3,5O2(g)
 2CO2(g) + 3H2O(l)
2CO2(g) + 3H2O(l) 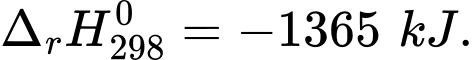
Trung bình, một chiếc xe máy tay ga di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 250 kJ. Nếu dùng xăng sinh học trên làm nhiên liệu, hãy tính quãng đường xe đi được theo đơn vị km với 1 lít xăng, biết hiệu suất sử dụng nhiệt của xe là 60% (làm tròn đến hàng phần mười).
Đổi 1 L = 1000 mL
Gọi số mol của xăng là a mol
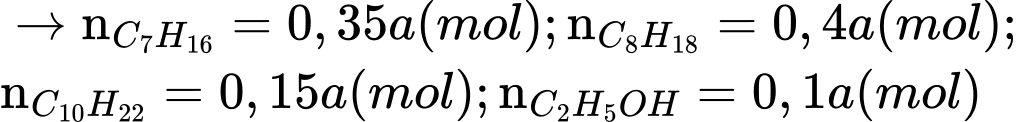
Ta có:
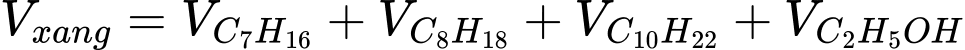
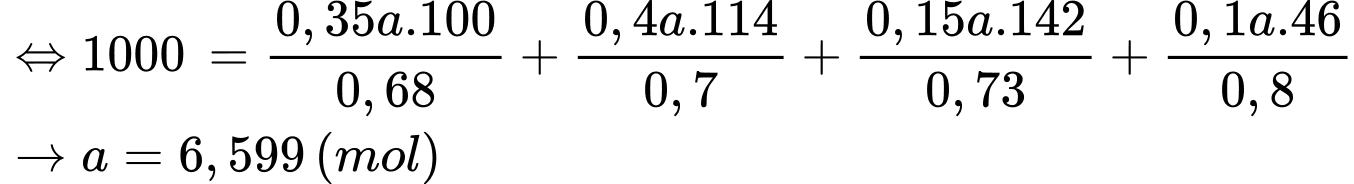
Nhiệt lượng mà 1 L xăng toả ra là:
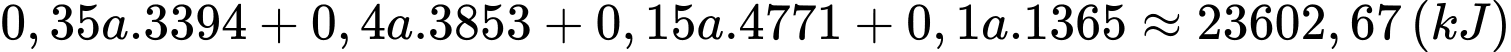
Quãng đường xe đi được khi tiêu thụ hết 1 L xăng là:
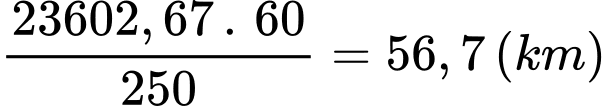
⇒ Điền đáp án: 56,7
Gọi số mol của xăng là a mol
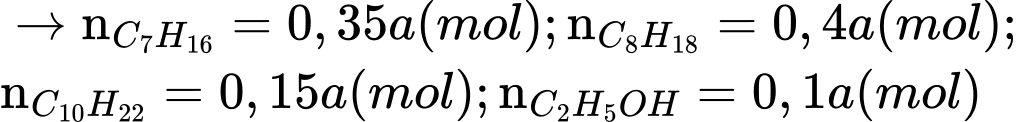
Ta có:
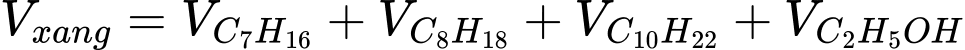
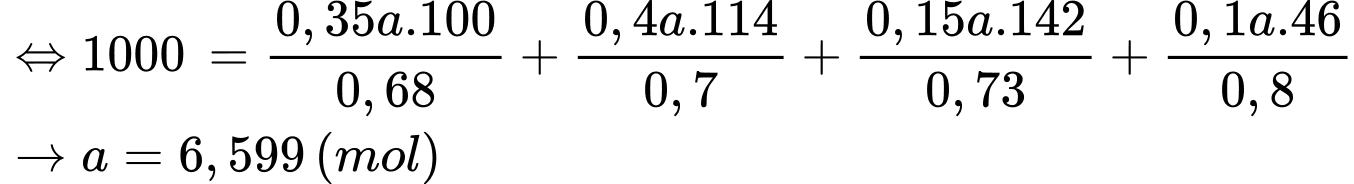
Nhiệt lượng mà 1 L xăng toả ra là:
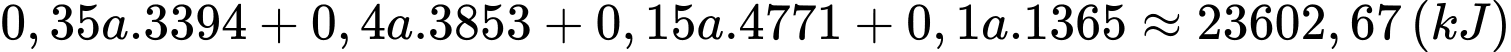
Quãng đường xe đi được khi tiêu thụ hết 1 L xăng là:
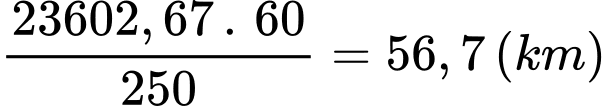
⇒ Điền đáp án: 56,7
Câu 28 [702851]: Để xác định hàm lượng Fe2+ trong một lọ muối Mohr (có công thức (NH4)2SO4. FeSO4.6H2O) người ta tiến hành thí nghiệm như sau: Cân 5,00 gam muối rồi hoà tan vào nước, thêm tiếp 5 mL dung dịch H2SO4 20% rồi cho nước cất vào để được 100 mL dung dịch (kí hiệu là dung dịch X). Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn KMnO4 0,02 M thì thấy hết 10 mL. Hàm lượng Fe2+ trong mẫu muối Mohr đem phân tích ở trên là bao nhiêu?
Đổi 10 mL = 0,01 L
Số mol của KMnO4 phản ứng là 0,01.0,02 = 0,0002 (mol)
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Từ PTHH số mol FeSO4 phản ứng là: 0,0002.5 = 0,001 (mol)
Hàm lượng Fe2+ trong mẫu muối Mohr trên là:
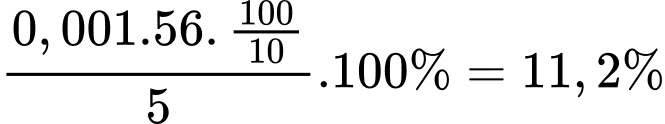
⇒ Điền đáp án: 11,2
Số mol của KMnO4 phản ứng là 0,01.0,02 = 0,0002 (mol)
10FeSO4 + 2KMnO4 + 8H2SO4 ⟶ 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Từ PTHH số mol FeSO4 phản ứng là: 0,0002.5 = 0,001 (mol)
Hàm lượng Fe2+ trong mẫu muối Mohr trên là:
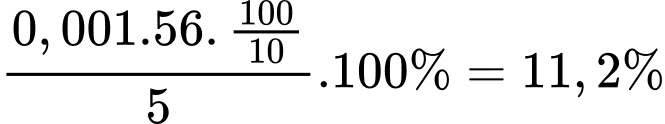
⇒ Điền đáp án: 11,2