PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705824]: “Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, tạo thành khí ..(1).. và ..(2)..”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, carbon dioxide, sulfur dioxide.
B, carbon monoxide, carbon dioxide.
C, carbon dioxide, nước.
D, carbon monoxide, muội than.
Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, tạo thành khí carbon dioxide và nước.
Giải thích:
Các kim loại nhóm kiềm thổ (Mg, Ca, Sr, Ba) tạo muối carbonate có công thức chung MCO3.
Muối này có tính base yếu, dễ bị phân hủy trong môi trường acid mạnh.
Khi cho muối carbonate vào dung dịch acid mạnh (HCl, H2SO4, HNO3...), phản ứng xảy ra:
MCO3 + 2H+ → M2+ + CO2↑ + H2O
Sản phẩm khí sinh ra là CO2 (carbon dioxide) và nước.
⇒ Chọn đáp án C Đáp án: C
Giải thích:
Các kim loại nhóm kiềm thổ (Mg, Ca, Sr, Ba) tạo muối carbonate có công thức chung MCO3.
Muối này có tính base yếu, dễ bị phân hủy trong môi trường acid mạnh.
Khi cho muối carbonate vào dung dịch acid mạnh (HCl, H2SO4, HNO3...), phản ứng xảy ra:
MCO3 + 2H+ → M2+ + CO2↑ + H2O
Sản phẩm khí sinh ra là CO2 (carbon dioxide) và nước.
⇒ Chọn đáp án C Đáp án: C
Câu 2 [705825]: Khoáng chất trona được dùng để điều chế sodium carbonate. Theo cách này sẽ thu được sodium carbonate dưới dạng muối ngậm nước theo tỉ lệ 1 : 10. Công thức của muối ngậm nước là
A, Na2CO3.10H2O.
B, Na2SO3.10H2O.
C, NaHCO3.10H2O.
D, K2CO3.10H2O.
Sodium carbonate dưới dạng muối ngậm nước theo tỉ lệ 1 : 10. Công thức của muối ngậm nước là Na2CO3. 10H2O.
Chọn đáp án A Đáp án: A
Chọn đáp án A Đáp án: A
Câu 3 [705826]: Cây xanh là lá phổi của Trái Đất, giữ vai trò điều hòa khí hậu, làm sạch bầu khí quyển. Trong quá trình quang hợp, cây xanh hấp thụ khí CO2, giải phóng khí O2, đồng thời tạo ra một loại hợp chất hữu cơ thiết yếu cho con người, đó là
A, ester.
B, carbohydrate.
C, chất béo.
D, amine.
- Trong cây xanh tạo tinh bột qua quá trình quang hợp
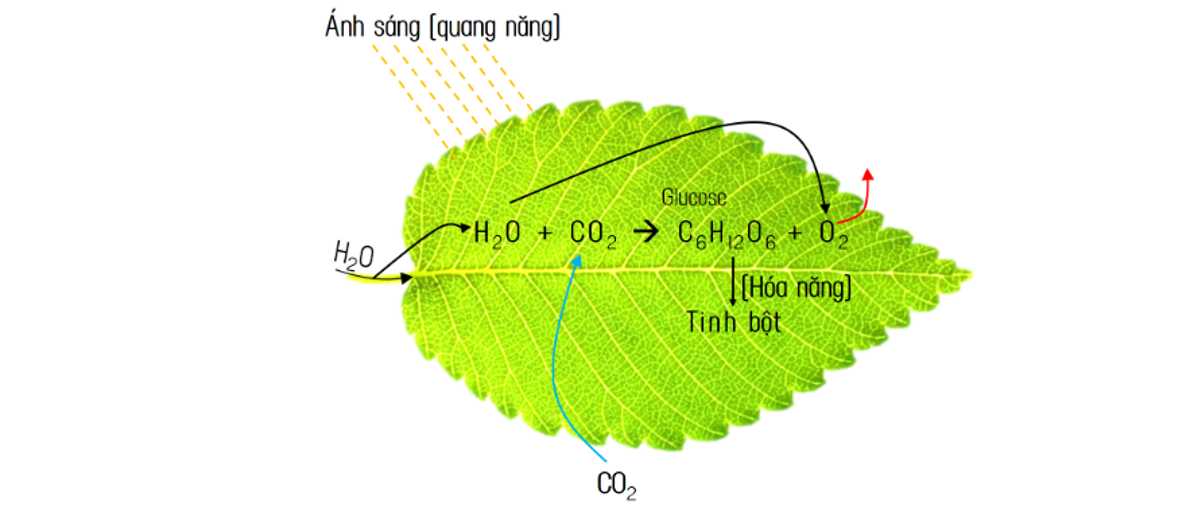
Quang hợp tạo ra Glucose - là carbohydrate.
Chọn đáp án B Đáp án: B

Quang hợp tạo ra Glucose - là carbohydrate.
Chọn đáp án B Đáp án: B
Câu 4 [705827]: Polymer polyvinyl acetate thuộc loại chất dẻo, trong suốt được dùng để sản xuất kính ô tô, cửa ra vào. Polyvinyl acetate được tạo ra bằng phản ứng trùng hợp chất nào sau đây?
A, CH2=CHCOOCH3.
B, CH2=C(CH3)COOCH3.
C, CH3COOCH=CH2.
D, CH3COOC(CH3)=CH2.
Phương trình phản ứng trùng hợp polyvinyl acetate như sau:
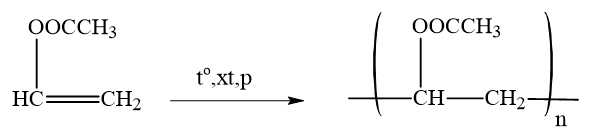
Chọn đáp án C Đáp án: C

Chọn đáp án C Đáp án: C
Câu 5 [705828]: Cửa sắt bị gỉ là tình trạng trên bề mặt cửa sắt xuất hiện những mảng gỉ sét với các mức độ khác nhau. Sắt bị gỉ nguyên nhân chủ yếu là do
A, phản ứng trực tiếp với oxygen trong không khí.
B, ăn mòn điện hóa giữa các phần tử sắt trong môi trường ẩm.
C, phản ứng với khí CO2 trong không khí.
D, tác dụng với dung dịch acid mạnh.
Quá trình gỉ sắt là quá trình ăn mòn điện hoá trong đó nước đóng vai trò là môi trường dẫn điện di chuyển các ion sắt và tạo ra phản ứng giữa sắt và oxygen.
Sắt phản ứng trực tiếp với oxygen trong không khí sẽ diễn ra rất chậm, phản ứng không mãnh liệt.
Ăn mòn điện hoá giữa các phần tử sắt trong môi trường ẩm. Trong môi trường ẩm sẽ tạo môi trường điện hoá giúp sắt bị ăn mòn nhanh hơn và tạo gỉ sắt (Fe2O3.xH2O - oxide ngậm nước có màu nâu đỏ).
Chọn đáp án B
Đáp án: B
Sắt phản ứng trực tiếp với oxygen trong không khí sẽ diễn ra rất chậm, phản ứng không mãnh liệt.
Ăn mòn điện hoá giữa các phần tử sắt trong môi trường ẩm. Trong môi trường ẩm sẽ tạo môi trường điện hoá giúp sắt bị ăn mòn nhanh hơn và tạo gỉ sắt (Fe2O3.xH2O - oxide ngậm nước có màu nâu đỏ).
Chọn đáp án B
Đáp án: B
Câu 6 [705829]: Calcium là nguyên tổ kim loại đóng vai trò thiết yếu cho việc phát triển cơ thể động vật, đồng thời góp phần duy trì hoạt động của cơ bắp, truyền dẫn thần kinh, tăng cường khả năng miễn dịch,... Trong cơ thể người, phần lớn lượng calcium tập trung ở
A, xương, răng.
B, máu.
C, cơ bắp.
D, tóc, móng.
Khoảng 99% lượng calcium trong cơ thể người tập trung ở xương và răng, đóng vai trò chính trong việc duy trì cấu trúc và độ cứng. Chỉ 1% còn lại tồn tại trong máu, cơ và dịch ngoại bào, tham gia vào các quá trình sinh lý quan trọng
Chọn đáp án A Đáp án: A
Chọn đáp án A Đáp án: A
Câu 7 [705830]: Các alkane hầu như không tan trong dung môi nào dưới đây?
A, Nước.
B, Tetracloromethan.
C, Hexane.
D, Benzene.
Các alkane không có tính dẫn điện và về cơ bản chúng cũng không bị phân cực bởi điện trường. Vì lý do này chúng không tạo ra các liên kết hydrogen và vì vậy không hòa tan trong các dung môi phân cực như nước.
Chọn đáp án A Đáp án: A
Chọn đáp án A Đáp án: A
Câu 8 [705831]: Một loại bình chữa cháy chứa khí CO2 ở áp suất cao. Khi mở van, do áp suất giảm đột ngột nên khí CO2 sẽ chuyển sang thể lỏng.
Cho các phát biểu sau:
(a) CO2 làm giảm nhiệt độ của đám cháy do CO2 lỏng bay hơi sẽ hấp thu nhiệt.
(b) Luồng khí CO2 làm hạn chế sự tiếp xúc của đồ vật với oxygen.
(c) Luồng khí CO2 làm loãng nồng độ hơi chất cháy trong đám cháy.
(d) Hơi chất cháy phản ứng với CO2 tạo hợp chất mới thay vì phản ứng với oxygen.
Số phát biểu đúng là
Cho các phát biểu sau:
(a) CO2 làm giảm nhiệt độ của đám cháy do CO2 lỏng bay hơi sẽ hấp thu nhiệt.
(b) Luồng khí CO2 làm hạn chế sự tiếp xúc của đồ vật với oxygen.
(c) Luồng khí CO2 làm loãng nồng độ hơi chất cháy trong đám cháy.
(d) Hơi chất cháy phản ứng với CO2 tạo hợp chất mới thay vì phản ứng với oxygen.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Nguyên lý chữa cháy của bình CO2
Cơ chế chữa cháy (tác dụng) của CO2 là làm loãng nồng độ hơi chất cháy trong vùng cháy và bên cạnh đó nó còn có tác dụng làm lạnh do CO2 ở dạng lỏng khi bay hơi sẽ thu nhiệt.
✔️(a) – Đúng. CO2 làm giảm nhiệt độ của đám cháy do CO2 lỏng bay hơi sẽ hấp thu nhiệt.
✔️ (b) – Đúng. Luồng khí CO2làm hạn chế sự tiếp xúc của đồ vật với oxygen giảm khả năng lan rông của đám cháy.
❌(c) – Sai. CO2 không làm loãng nồng độ hơi chất cháy.
❌(d) – Sai. Hơi chất cháy không phản ứng với CO2 tạo hợp chất mới thì sẽ làm quá trình cháy trở lên mãnh liệt.
Có 2 nhận định đúng.
Chọn đáp án B Đáp án: B
Cơ chế chữa cháy (tác dụng) của CO2 là làm loãng nồng độ hơi chất cháy trong vùng cháy và bên cạnh đó nó còn có tác dụng làm lạnh do CO2 ở dạng lỏng khi bay hơi sẽ thu nhiệt.
✔️(a) – Đúng. CO2 làm giảm nhiệt độ của đám cháy do CO2 lỏng bay hơi sẽ hấp thu nhiệt.
✔️ (b) – Đúng. Luồng khí CO2làm hạn chế sự tiếp xúc của đồ vật với oxygen giảm khả năng lan rông của đám cháy.
❌(c) – Sai. CO2 không làm loãng nồng độ hơi chất cháy.
❌(d) – Sai. Hơi chất cháy không phản ứng với CO2 tạo hợp chất mới thì sẽ làm quá trình cháy trở lên mãnh liệt.
Có 2 nhận định đúng.
Chọn đáp án B Đáp án: B
Câu 9 [705832]: Cho phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g). Nồng độ tại thời điểm cân bằng của I2 và H2 chỉ bằng nhau khi
A, Nồng độ ban đầu của I2 và H2 bằng nhau.
B, Khối lượng ban đầu của I2 và H2 bằng nhau.
C, Số mol I2 và H2 phản ứng bằng nhau.
D, Tốc độ phản ứng thuận gấp hai lần phản ứng nghịch.
Tỉ lệ phản ứng giữa I2 và H2 là 1:1 nên nồng độ chất mất đi của H2 và I2 là như nhau nên nồng độ ban đầu của H2 và I2 phải bằng nhau thì nồng độ tại cân bằng của I2 và H2 tại cân bằng sẽ bằng nhau.
Chọn đáp án A Đáp án: A
Chọn đáp án A Đáp án: A
Câu 10 [705833]: Beryllium carbonate (BeCO3 với M = 69 g/mol) khan là chất bột màu trắng, dễ phân huỷ ngay trong điều kiện thường, tạo thành BeO. Do đó, BeCO3 thường được bảo quản trong khí quyển tạo bởi chất X. BeCO3 ít tan trong nước giống như các muối carbonate của các kim loại nhóm IIA khác; tuy nhiên điểm khác biệt là chất này dễ bị thuỷ phân. Điều này chủ yếu là do cation Be2+ có bán kính nhỏ hơn nhiều so với các cation kim loại cùng nhóm IIA. Việc thường xuyên hít phải BeCO3 hay BeO đều có thể dẫn tới ung thư phổi. Nếu đi vào cơ thể, các cation Be2+ có thể vô hiệu hoá chức năng của các enzyme, đặc biệt là các enzyme chứa phức chất có nguyên tử trung tâm được hình thành từ cation Mg2+.
Mật độ điện tích của ion bằng điện tích của ion chia cho thể tích của ion đó. Ion được coi có dạng cầu nên thể tích của ion liên hệ với bán kính ion bởi công thức:
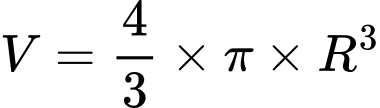 với R là bán kính ion.
với R là bán kính ion.
Trong các phát biểu sau:
(a) Phần trăm khối lượng của beryllium trong beryllium carbonate tinh khiết khan là 6,25%.
(b) BeCO3 thường được bảo quản trong khí quyển tạo bởi chất X là carbon dioxide.
(c) Cation Be2+ dễ bị thuỷ phân hơn so với cation Ca2+ là do mật độ điện tích trên cation Be2+ nhỏ hơn so với cation Ca2+.
(d) Cation Be2+ có khả năng thay thế nguyên tử trung tâm magnesium của phức chất trong một số enzyme, tạo phức chất bền hơn.
Các phát biểu đúng là
Mật độ điện tích của ion bằng điện tích của ion chia cho thể tích của ion đó. Ion được coi có dạng cầu nên thể tích của ion liên hệ với bán kính ion bởi công thức:
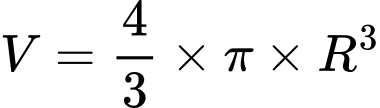 với R là bán kính ion.
với R là bán kính ion. Trong các phát biểu sau:
(a) Phần trăm khối lượng của beryllium trong beryllium carbonate tinh khiết khan là 6,25%.
(b) BeCO3 thường được bảo quản trong khí quyển tạo bởi chất X là carbon dioxide.
(c) Cation Be2+ dễ bị thuỷ phân hơn so với cation Ca2+ là do mật độ điện tích trên cation Be2+ nhỏ hơn so với cation Ca2+.
(d) Cation Be2+ có khả năng thay thế nguyên tử trung tâm magnesium của phức chất trong một số enzyme, tạo phức chất bền hơn.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (b), (d).
D, (b), (c), (d).
Phân tích các phát biểu:
❌A.Sai. Phần trăm khối lượng của beryllium trong beryllium carbonate tinh khiết khan là 13,04%.
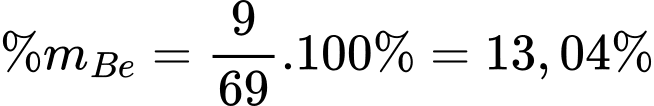
✔️B. Đúng. Beryllium carbonate (BeCO3 với M = 69 g/mol) khan là chất bột màu trắng, dễ phân huỷ ngay trong điều kiện thường, tạo thành BeO nên cần bảo quản trong CO2 để cân bằng chuyển dịch để tạo BaCO3.
❌C. Sai. Cation Be2+ dễ bị thuỷ phân hơn so với cation Ca2+ là do mật độ điện tích trên cation Be2+ lớn hơn so với cation Ca2+. Nguyên do Be2+ và Ca2+ có cùng tổng điện tích 2+ nhưng Be2+ có bán kính nhỏ hơn Ca2+ nên có mật độ điện tích lớn hơn Ca2+.
✔️D. Đúng. Cation Be2+ có khả năng thay thế nguyên tử trung tâm magnesium của phức chất trong một số enzyme, tạo phức chất bền hơn. cation Be2+ có thể vô hiệu hoá chức năng của các enzyme, đặc biệt là các enzyme chứa phức chất có nguyên tử trung tâm được hình thành từ cation Mg2+.
Chọn đáp án C Đáp án: C
❌A.Sai. Phần trăm khối lượng của beryllium trong beryllium carbonate tinh khiết khan là 13,04%.
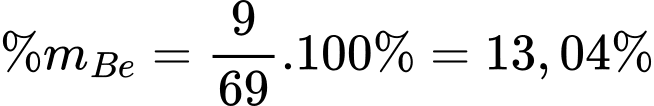
✔️B. Đúng. Beryllium carbonate (BeCO3 với M = 69 g/mol) khan là chất bột màu trắng, dễ phân huỷ ngay trong điều kiện thường, tạo thành BeO nên cần bảo quản trong CO2 để cân bằng chuyển dịch để tạo BaCO3.
❌C. Sai. Cation Be2+ dễ bị thuỷ phân hơn so với cation Ca2+ là do mật độ điện tích trên cation Be2+ lớn hơn so với cation Ca2+. Nguyên do Be2+ và Ca2+ có cùng tổng điện tích 2+ nhưng Be2+ có bán kính nhỏ hơn Ca2+ nên có mật độ điện tích lớn hơn Ca2+.
✔️D. Đúng. Cation Be2+ có khả năng thay thế nguyên tử trung tâm magnesium của phức chất trong một số enzyme, tạo phức chất bền hơn. cation Be2+ có thể vô hiệu hoá chức năng của các enzyme, đặc biệt là các enzyme chứa phức chất có nguyên tử trung tâm được hình thành từ cation Mg2+.
Chọn đáp án C Đáp án: C
Câu 11 [705834]: Cho các nguyên tử sau: 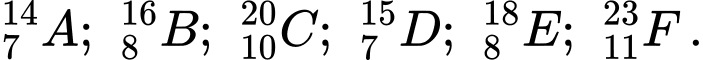 Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
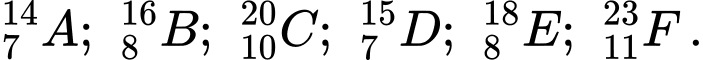 Các nguyên tử nào thuộc cùng một nguyên tố hóa học?
Các nguyên tử nào thuộc cùng một nguyên tố hóa học? A, A và B, C và D.
B, A và C, B và D.
C, B và E, C và F.
D, A và D, B và E.
Các nguyên tử của cùng một nguyên tố có cùng số proton, hay còn gọi là số nguyên tử.
Các nguyên tố cùng một nguyên tố hóa học là
A và D có cùng số proton là 7
B và E có cùng số proton là 8
Chọn đáp án D Đáp án: D
Các nguyên tố cùng một nguyên tố hóa học là
A và D có cùng số proton là 7
B và E có cùng số proton là 8
Chọn đáp án D Đáp án: D
Câu 12 [705835]: Phản ứng X + Y2+ → X2+ + Y sẽ tự xảy ra nếu X và Y lần lượt là các chất nào sau đây?
A, Ag và Fe.
B, Cu và Zn.
C, Ca và Zn.
D, Zn và Cu.
- Phản ứng: 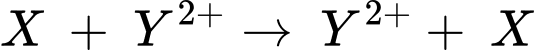
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cặp chất phù hợp là Zn và Cu. Zn có tính khử mạnh hơn Cu, Cu2+ có tính oxi hóa mạnh hơn Zn2+
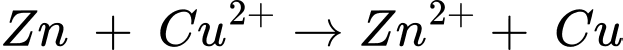
Chọn đáp án D Đáp án: D
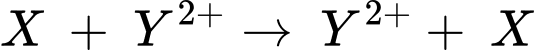
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cặp chất phù hợp là Zn và Cu. Zn có tính khử mạnh hơn Cu, Cu2+ có tính oxi hóa mạnh hơn Zn2+
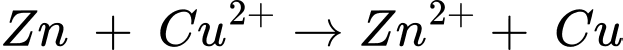
Chọn đáp án D Đáp án: D
Câu 13 [705836]: CS2 là nguyên liệu phổ biến dùng trong tổng hợp hóa hữu cơ của các ngành công nghiệp.
CS2 dễ dàng bốc cháy trong oxygen theo phương trình:
CS2 + 3O2 → CO2 + 2SO2.
Nếu 6,30 mol khí được tạo thành từ phản ứng trên thì cần bao nhiêu mol O2 tham gia phản ứng?
CS2 dễ dàng bốc cháy trong oxygen theo phương trình:
CS2 + 3O2 → CO2 + 2SO2.
Nếu 6,30 mol khí được tạo thành từ phản ứng trên thì cần bao nhiêu mol O2 tham gia phản ứng?
A, 1,05 mol.
B, 2,1 mol.
C, 4,2 mol.
D, 6,3 mol.
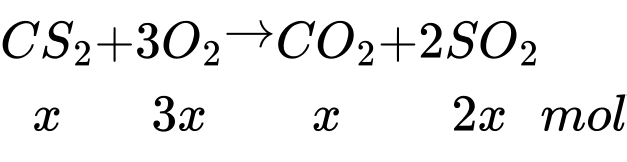
nSO2 + nCO2 = x + 2x = 6,3 mol → x = 2,1 mol
⟹nO2 = 3 × 2,1 = 6,3 mol
Chọn đáp án D Đáp án: D
Câu 14 [705837]: Phản ứng nào sau đây là đặc trưng của ester?
A, Thế halogen vào mạch carbon.
B, Thủy phân trong môi trường acid hoặc kiềm.
C, Phản ứng cộng H2 vào liên kết đôi.
D, Phản ứng oxi hóa tạo CO2 và H2O.
a. Phản ứng thuỷ phân ester trong môi trường acid
Ester bị thuỷ phân trong môi trường acid thường tạo thành carboxylic acid và alcohol (hoặc phenol) tương ứng.
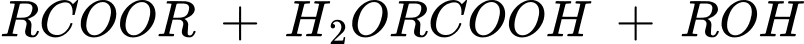
b. Phản ứng thuỷ phân ester trong môi trường base
Ester bị thuỷ phân trong môi trường base (như NaOH, KOH) thường thu được muối carboxylate và alcohol:
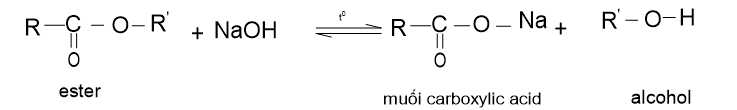
Phản ứng thuỷ phân ester trong môi trường base là phản ứng một chiều. Phản ứng này được ứng dụng làm xà phòng nên được gọi là phản ứng xà phòng hoá.
Chọn đáp án B Đáp án: B
Ester bị thuỷ phân trong môi trường acid thường tạo thành carboxylic acid và alcohol (hoặc phenol) tương ứng.
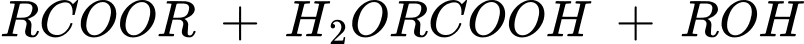
b. Phản ứng thuỷ phân ester trong môi trường base
Ester bị thuỷ phân trong môi trường base (như NaOH, KOH) thường thu được muối carboxylate và alcohol:

Phản ứng thuỷ phân ester trong môi trường base là phản ứng một chiều. Phản ứng này được ứng dụng làm xà phòng nên được gọi là phản ứng xà phòng hoá.
Chọn đáp án B Đáp án: B
Câu 15 [705838]: “Chất …(1)… là những polymer khi …(2)…. tạo thành chất lỏng nhớt, khi nguội sẽ rắn lại”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, nhiệt dẻo, bị hòa tan.
B, nhiệt dẻo, nóng chảy.
C, nhiệt rắn, bị hòa tan
D, nhiệt rắn, nóng chảy.
Chất nhiệt dẻo là những polymer khi nóng chảy tạo thành chất lỏng nhớt, khi nguội sẽ rắn lại.
⟹Chọn đáp án B Đáp án: B
⟹Chọn đáp án B Đáp án: B
Câu 16 [705839]: Dichloro(ethylenediamine)platinum(II) có công thức PtCl2(en) là một loại bột màu vàng, được sử dụng làm chất xúc tác tiền chất trong công nghiệp và cũng là chất phản ứng bắt đầu cho quá trình mạ điện, một số hợp chất platinum có khả năng chống ung thư.
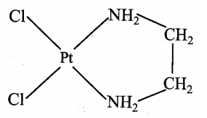
Cho các phát biểu sau:
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho – nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Số phát biểu đúng là

Cho các phát biểu sau:
(a) Điện tích của phức chất bằng 0.
(b) Số liên kết cho – nhận giữa mỗi phối tử với nguyên tử trung tâm là như nhau.
(c) Số oxi hoá của nguyên tử trung tâm trong phức chất là +4.
(d) Tất cả các liên kết trong phức chất đều là liên kết cộng hoá trị.
(e) Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Số phát biểu đúng là
A, 2.
B, 3.
C, 4.
D, 5.
Phân tích các đáp án:
✔️(a) – Đúng. Điện tích của phức chất bằng 0. Nguyên tử trung tâm Pt có điện tích là 2+ và có 2 phối tử Cl- và phối tử trung hòa H2NCH2CH2NH2.
❌(b) – Sai. Mỗi phối tử có số dung lượng phối trí khác nhau Cl- có dung lượng phối trí là 1 nên có 1 liên kết với ion nguyên tử trung tâm và H2NCH2CH2NH2 có dung lượng phối trí là 2 nên có 2 liên kết với ion nguyên tử trung tâm
❌(c) – Sai. Số oxi hoá của nguyên tử trung tâm trong phức chất là +2.
✔️(d) – Đúng. Liên kết trong phức chất là liên kết cho – nhận (trường hợp của liên kết cộng hóa trị) nên phân tử hoặc anion cần có cặp electron hóa trị riêng.
✔️(e) – Đúng. Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Có 3 nhận định đúng.
⟹ Chọn đáp án B Đáp án: B
✔️(a) – Đúng. Điện tích của phức chất bằng 0. Nguyên tử trung tâm Pt có điện tích là 2+ và có 2 phối tử Cl- và phối tử trung hòa H2NCH2CH2NH2.
❌(b) – Sai. Mỗi phối tử có số dung lượng phối trí khác nhau Cl- có dung lượng phối trí là 1 nên có 1 liên kết với ion nguyên tử trung tâm và H2NCH2CH2NH2 có dung lượng phối trí là 2 nên có 2 liên kết với ion nguyên tử trung tâm
❌(c) – Sai. Số oxi hoá của nguyên tử trung tâm trong phức chất là +2.
✔️(d) – Đúng. Liên kết trong phức chất là liên kết cho – nhận (trường hợp của liên kết cộng hóa trị) nên phân tử hoặc anion cần có cặp electron hóa trị riêng.
✔️(e) – Đúng. Theo thuyết liên kết hoá trị, các liên kết quanh nguyên tử trung tâm là liên kết cộng hoá trị theo kiểu cho – nhận.
Có 3 nhận định đúng.
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin dưới đây, trả lời câu hỏi số 17, 18
Leucine là một trong những amino acid thiết yếu, cơ thể không thể tự tổng hợp được mà phải lấy từ thức ăn. Leucine được tìm thấy có trong thịt, cá, gia cầm. Leucine có khả năng kích thích sự tổng hợp protein, giúp cơ thể để xây dựng cơ bắp. Công thức cấu tạo của leucine được cho trong hình vẽ bên.
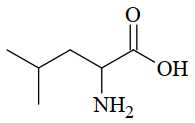

Câu 17 [705840]: Leucine không tham gia phản ứng với dung dịch nào dưới đây?
A, dung dịch NaOH.
B, Dung dịch HCl.
C, Ethanol (xúc tác H2SO4 đặc).
D, Dung dịch NaCl.
- Tính acid – base: Amino acid vừa tác dụng với acid mạnh tạo muối ammonium, vừa tác dụng được với base mạnh tạo muối carboxylate. Vì thế, amino acid là những hợp chất lưỡng tính.
- Phản ứng tạo ester của nhóm – COOH: Tương tự như carboxylic acid, amino acid có thể tác dụng với alcohol khi có mặt xúc tác acid mạnh để tạo thành ester.
Phân tích các đáp án:
✔️A. NaOH là base
✔️B. HCl là acid
✔️C. Ethanol là alcohol
❌D. NaCl là muối
⟹ Chọn đáp án D Đáp án: D
- Phản ứng tạo ester của nhóm – COOH: Tương tự như carboxylic acid, amino acid có thể tác dụng với alcohol khi có mặt xúc tác acid mạnh để tạo thành ester.
Phân tích các đáp án:
✔️A. NaOH là base
✔️B. HCl là acid
✔️C. Ethanol là alcohol
❌D. NaCl là muối
⟹ Chọn đáp án D Đáp án: D
Câu 18 [705841]: Cho 0,2 mol leucine tham gia phản ứng với dung dịch KOH vừa đủ, dung dịch thu được đem cô cạn thu được bao nhiêu gam muối?
A, 34,0.
B, 30,8.
C, 30,8.
D, 33,8.
Phương trình phản ứng:
CH3CH(CH3)CH2CH(NH2)COOH + KOH → CH3CH(CH3)CH2CH(NH2)COOK + H2O
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 169 = 33,8 gam
⟹ Chọn đáp án D Đáp án: D
CH3CH(CH3)CH2CH(NH2)COOH + KOH → CH3CH(CH3)CH2CH(NH2)COOK + H2O
Từ phương trình hóa học số mol của muối là 0,2 mol
Khối lượng của muối là mmuối = 0,2 × 169 = 33,8 gam
⟹ Chọn đáp án D Đáp án: D
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705842]: Tiến hành đun nóng 0,10 mol gallium rắn ban đầu ở nhiệt độ phòng với tốc độ không đổi trong một hệ kín và nhiệt độ của nó được theo dõi theo đồ thị sau:
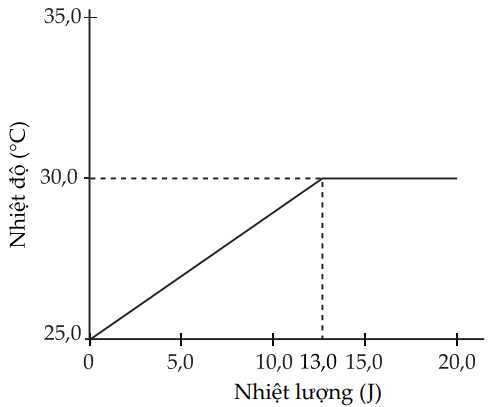
∎ Gallium nhận nhiệt và tăng nhiệt độ từ 25 oC lên 30 oC.
∎ Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái:
Ga(s) → Ga(l)

∎ Gallium nhận nhiệt và tăng nhiệt độ từ 25 oC lên 30 oC.
∎ Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái:
Ga(s) → Ga(l)
Phân tích các đáp án:
✔️A. Đúng. Nhiệt độ nóng chảy của Ga là 30 oC.
Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái: Ga(s) → Ga(l)
✔️B. Đúng. Nhiệt dung riêng của Ga là 0,37 (J/g.K).
Q = m. c. ∆t
→ 13,0 J = 0,1.69,7.(303 – 298).c → c = 0,37 (J/g.K)
❌C. Sai. Tại khoảng nhiệt độ 30 oC, hệ nhận nhiệt và áp suất của hệ tăng. Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái: Ga(s) → Ga(l)
❌D. Sai.
Q = m. c. ∆t → 10,0 J = 0,1.69,7.(t – 298). 0,37 → t = 301,87 (K) = 28,8 oC
✔️A. Đúng. Nhiệt độ nóng chảy của Ga là 30 oC.
Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái: Ga(s) → Ga(l)
✔️B. Đúng. Nhiệt dung riêng của Ga là 0,37 (J/g.K).
Q = m. c. ∆t
→ 13,0 J = 0,1.69,7.(303 – 298).c → c = 0,37 (J/g.K)
❌C. Sai. Tại khoảng nhiệt độ 30 oC, hệ nhận nhiệt và áp suất của hệ tăng. Tại 30 oC, gallium bắt đầu có quá trình chuyển trạng thái: Ga(s) → Ga(l)
❌D. Sai.
Q = m. c. ∆t → 10,0 J = 0,1.69,7.(t – 298). 0,37 → t = 301,87 (K) = 28,8 oC
Câu 20 [705843]: Trong công nghiệp sản xuất sulfuric acid, người ta dùng dung dịch H2SO4 98 % để hấp thụ hoàn toàn SO3 tạo ra sản phẩm là oleum. Lấy 5,0 gam oleum sinh ra ở trên pha loãng với nước cất thu được 1 000 mL dung dịch H2SO4 loãng (dung dịch X). Để xác định nồng độ H2SO4 trong X người ta tiến hành chuẩn độ như sau:
∎ Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1 М rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1 M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
∎ Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3 – 4 giọt phenolphthalein, lắc đều.
∎ Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, luôn lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Lặp lại thêm hai lần, kết quả được ghi lại trong bảng sau:
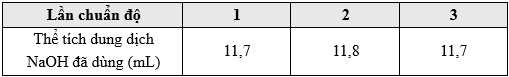
Lấy thể tích dung dịch NaOH trung bình của 3 lần.
∎ Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1 М rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1 M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
∎ Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3 – 4 giọt phenolphthalein, lắc đều.
∎ Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, luôn lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Lặp lại thêm hai lần, kết quả được ghi lại trong bảng sau:

Lấy thể tích dung dịch NaOH trung bình của 3 lần.
Phân tích các phát biểu:
✔️A. Đúng. Khi rửa sạch burette bằng nước cất lại phải tráng lại bằng dung dịch NaOH chuẩn để tránh sai số khi đo, vì khi rửa bằng nước cất thì sẽ còn dính nước trên thành ống nếu không tráng bằng NaOH mà đổ trực tiếp dẫn đến sai kết quả nồng độ.
✔️B. Đúng. Khi cho vào burrtte thì dung dịch trong ống chuyển hồng, vẫn cần phải thêm tiếp chất chỉ thị vào dung dịch cần chuẩn độ để xác định điểm tương đương.
✔️C. Đúng. NaOH được nhỏ từ từ xuống bình tam giác, luôn lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng.
❌D. Sai.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Thể tích trung bình NaOH là
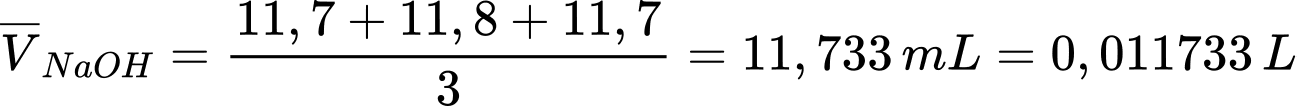
Số mol của NaOH là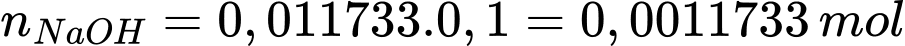
Từ PTHH số mol của H2SO4 là nH2SO4 = 5,8665.10-4 mol
Nồng độ dung dịch H2SO4 là
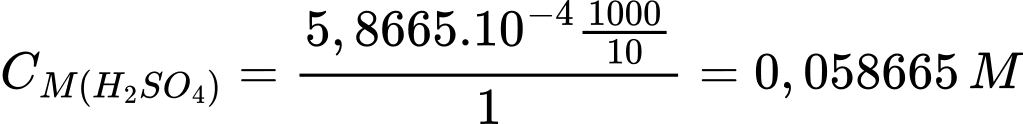
✔️A. Đúng. Khi rửa sạch burette bằng nước cất lại phải tráng lại bằng dung dịch NaOH chuẩn để tránh sai số khi đo, vì khi rửa bằng nước cất thì sẽ còn dính nước trên thành ống nếu không tráng bằng NaOH mà đổ trực tiếp dẫn đến sai kết quả nồng độ.
✔️B. Đúng. Khi cho vào burrtte thì dung dịch trong ống chuyển hồng, vẫn cần phải thêm tiếp chất chỉ thị vào dung dịch cần chuẩn độ để xác định điểm tương đương.
✔️C. Đúng. NaOH được nhỏ từ từ xuống bình tam giác, luôn lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng.
❌D. Sai.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Thể tích trung bình NaOH là
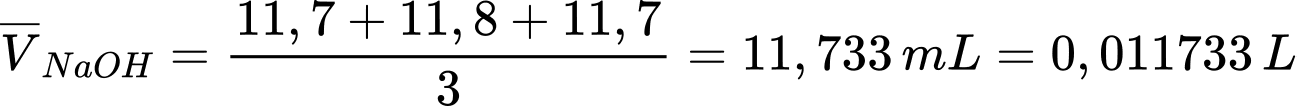
Số mol của NaOH là
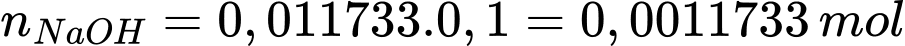
Từ PTHH số mol của H2SO4 là nH2SO4 = 5,8665.10-4 mol
Nồng độ dung dịch H2SO4 là
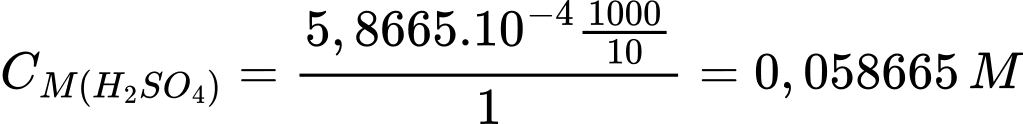
Câu 21 [705844]: Tiến hành thí nghiệm điều chế isoamyl acetate (chất có mùi chuối chín) theo thứ tự các bước sau đây:
∎ Bước 1: Cho khoảng 3 mL CH3CH(CH3)CH2CH2OH, 3 mL CH3COOH và vài giọt H2SO4 đặc vào ống nghiệm.
∎ Bước 2: Lắc đều ống nghiệm rồi đun cách thuỷ (trong nồi nước nóng) khoảng 5 – 7 phút ở 65 – 70 °C.
∎ Bước 3: Làm lạnh, sau đó thêm khoảng 5 mL dung dịch NaCl bão hoà vào ống nghiệm.
∎ Bước 1: Cho khoảng 3 mL CH3CH(CH3)CH2CH2OH, 3 mL CH3COOH và vài giọt H2SO4 đặc vào ống nghiệm.
∎ Bước 2: Lắc đều ống nghiệm rồi đun cách thuỷ (trong nồi nước nóng) khoảng 5 – 7 phút ở 65 – 70 °C.
∎ Bước 3: Làm lạnh, sau đó thêm khoảng 5 mL dung dịch NaCl bão hoà vào ống nghiệm.
Phân tích các phát biểu:
✔️A. Đúng. H2SO4 đặc có vai trò xúc tác cho phản ứng tạo isoamyl acetate.
❌B. Sai. Mục đích chính của việc thêm dung dịch NaCl bão hòa để giảm độ tan của ester trong nước và làm cho ester tách ra dễ hơn.
✔️C. Đúng. vì phản ứng ester trong môi trường acid là phản ứng thuận nghịch nên luôn còn 1 lượng acid và alcohol chưa phản ứng.
❌D. Sai. Sau bước 3, trong ống nghiệm thu được 1 lớp ester không tan trong nước.
✔️A. Đúng. H2SO4 đặc có vai trò xúc tác cho phản ứng tạo isoamyl acetate.
❌B. Sai. Mục đích chính của việc thêm dung dịch NaCl bão hòa để giảm độ tan của ester trong nước và làm cho ester tách ra dễ hơn.
✔️C. Đúng. vì phản ứng ester trong môi trường acid là phản ứng thuận nghịch nên luôn còn 1 lượng acid và alcohol chưa phản ứng.
❌D. Sai. Sau bước 3, trong ống nghiệm thu được 1 lớp ester không tan trong nước.
Câu 22 [705845]: Các loại ngũ cốc lên men có thể tạo ra hàm lượng cồn tối đa khoảng 16 %, đây là giới hạn của hầu hết các loại bia và rượu vang, vì sinh vật nấm men được sử dụng không thể tồn tại trong các dung dịch rượu đặc hơn. Tuy nhiên, các loại rượu mạnh thường có hàm lượng cồn khoảng 40 % theo thể tích. Chưng cất là phương pháp được sử dụng để cô đặc dung dịch lên men và sản xuất rượu mạnh.
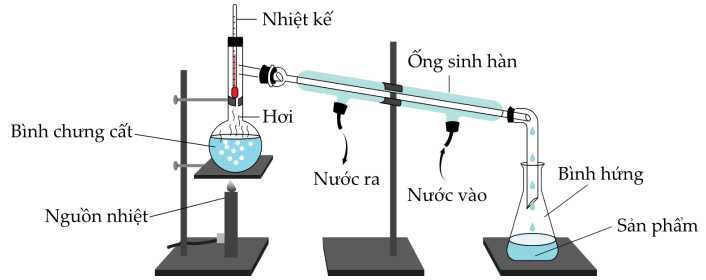
Quá trình chưng cất rượu vang đỏ có thể được chứng minh là đã cô đặc hơn so với được rượu ban đầu thông qua thử nghiệm ngọn lửa. Vào thế kỉ 16 khi rượu là một mặt hàng trao đổi, nó thường xuyên được thử nghiệm để đảm bảo rằng không bị pha loãng. Một mẫu rượu 57 % theo thể tích có khả năng bắt lửa, trong khi các dung dịch loãng hơn thì không.

Quá trình chưng cất rượu vang đỏ có thể được chứng minh là đã cô đặc hơn so với được rượu ban đầu thông qua thử nghiệm ngọn lửa. Vào thế kỉ 16 khi rượu là một mặt hàng trao đổi, nó thường xuyên được thử nghiệm để đảm bảo rằng không bị pha loãng. Một mẫu rượu 57 % theo thể tích có khả năng bắt lửa, trong khi các dung dịch loãng hơn thì không.
Phân tích các đáp án:
❌A. Sai. Nhiệt độ của quá trình chưng cất được duy trì ở 80 oC. Nếu đun đến 100 oC thì sẽ kéo thêm hơi nước chất thu được theo chưng cất không tinh khiết.
✔️B. Đúng. Nhiệt độ sôi của rượu là 78,37 oC thấp hơn của nước 100 oC
❌C. Sai. Quá trình chưng cất có thể làm giảm hàm lượng rượu trong bình chưng cất nguyên do rượu bị bay hơi và ngưng tụ trong bình hứng.
✔️D. Đúng.Các kho chứa rượu mạnh có nguy cơ xảy ra hoả hoạn do hàm lượng rượu cao có khả năng bắt lửa. Một mẫu rượu 57% theo thể tích có khả năng bắt lửa, trong khi các dung dịch loãng hơn thì không.
❌A. Sai. Nhiệt độ của quá trình chưng cất được duy trì ở 80 oC. Nếu đun đến 100 oC thì sẽ kéo thêm hơi nước chất thu được theo chưng cất không tinh khiết.
✔️B. Đúng. Nhiệt độ sôi của rượu là 78,37 oC thấp hơn của nước 100 oC
❌C. Sai. Quá trình chưng cất có thể làm giảm hàm lượng rượu trong bình chưng cất nguyên do rượu bị bay hơi và ngưng tụ trong bình hứng.
✔️D. Đúng.Các kho chứa rượu mạnh có nguy cơ xảy ra hoả hoạn do hàm lượng rượu cao có khả năng bắt lửa. Một mẫu rượu 57% theo thể tích có khả năng bắt lửa, trong khi các dung dịch loãng hơn thì không.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705846]: Độ tan của Na2SO4 ở 80 oC là 28,3 gam. Có bao nhiêu gam chất tan trong 256,6 gam dung dịch Na2SO4 ở 80 oC?
Độ tan của Na2SO4 ở 80oC là 28,3 gam/100 gam nước
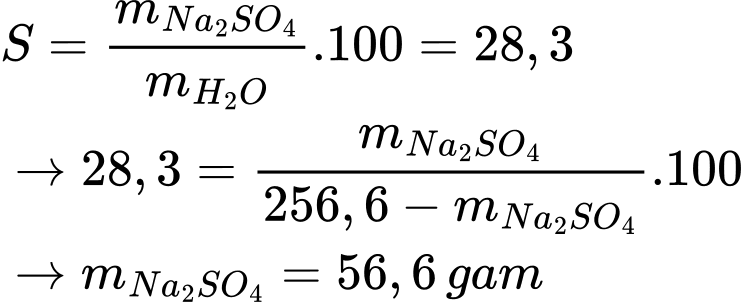
Điền đáp án : 56,6
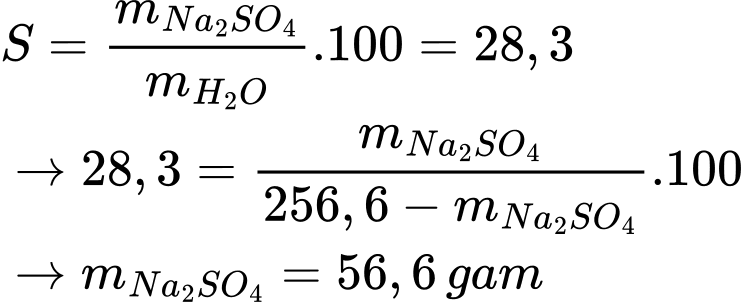
Điền đáp án : 56,6
Câu 24 [973669]: [TN THPT 2020 – Đ2]: Hòa tan Fe3O4 bằng lượng vừa đủ dung dịch HCl, thu được dung dịch X. Có bao nhiêu chất khi cho vào X thì xảy ra phản ứng hóa học trong các chất: Ca(OH)2, Cu, AgNO3, Na2SO4?
HD: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O.
Vừa đủ nên dung dịch X thu được gồm FeCl2 và FeCl3.
Phân tích các chất trong dãy:
✔️ Ca(OH)2 cung cấp OH– để tạo kết tủa Fe(OH)2↓ và Fe(OH)3.
✔️ Cu + 2FeCl3 → CuCl2 + 2FeCl3.
✔️ AgNO3 cung cấp Ag+ tạo kết tủa với Cl– → AgCl↓; ngoài ra Ag+ + Fe2+ → Fe3+ + Ag↓.
❌ Na2SO4 không có phản ứng với cả FeCl2 và FeCl3.
⟶ có 3/4 chất thỏa mãn yêu cầu
Vừa đủ nên dung dịch X thu được gồm FeCl2 và FeCl3.
Phân tích các chất trong dãy:
✔️ Ca(OH)2 cung cấp OH– để tạo kết tủa Fe(OH)2↓ và Fe(OH)3.
✔️ Cu + 2FeCl3 → CuCl2 + 2FeCl3.
✔️ AgNO3 cung cấp Ag+ tạo kết tủa với Cl– → AgCl↓; ngoài ra Ag+ + Fe2+ → Fe3+ + Ag↓.
❌ Na2SO4 không có phản ứng với cả FeCl2 và FeCl3.
⟶ có 3/4 chất thỏa mãn yêu cầu
Câu 25 [705847]: Lên men 162 gam bột nếp (chứa 80% tinh bột). Hiệu suất quá trình lên men là 60%. Lượng alcohol thu được đem chưng cất sau đó pha loãng với nước sạch thành V mL alcohol 35o. Biết khối lượng riêng của alcohol nguyên chất là 0,8 g/mL. Giá trị của V là bao nhiêu (Làm tròn đến số nguyên)?
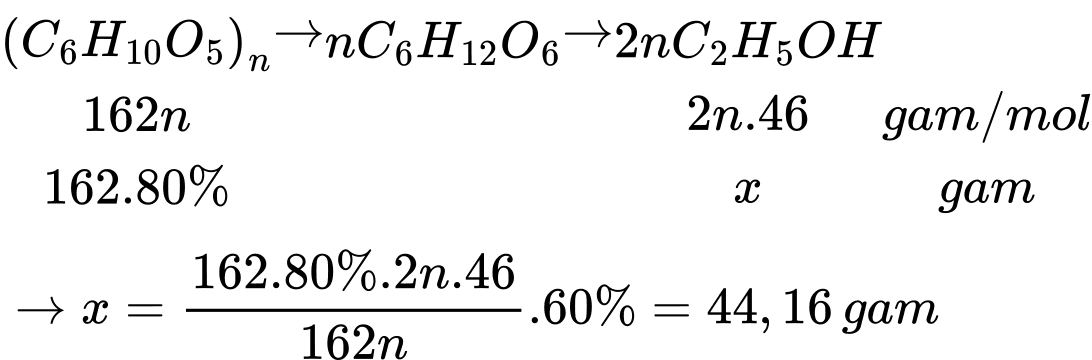
Thể tích ethanol tạo thành là VC2H5OH = 44,16 : 0,8 = 55,2 mL
Thể tích dung dịch rượu 35o là
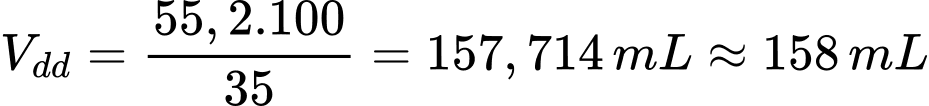
⟹Điền đáp án: 158
Câu 26 [705848]: Geraniol là một alcohol có trong tinh dầu hoa hồng. Nó được điều chế từ phản ứng khử geranial (một chất có trong tinh dầu sả) theo phản ứng:
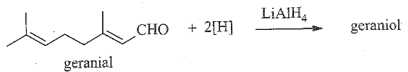
Khi phản ứng khử xảy ra, geranial bị phá vỡ bao nhiêu liên kết π?
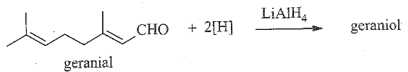
Khi phản ứng khử xảy ra, geranial bị phá vỡ bao nhiêu liên kết π?
Tác nhân LiAlH4 chỉ phá vỡ liên kết trong liên kết C=O, không thể phá vỡ liên kết trong C=C nguyên do C=C có mật độ điện tích âm cao và tác nhân LiAlH4 là tác nhân khử.
→ geranial chỉ có 1 liên kết trong nhóm CHO bị phá vỡ.
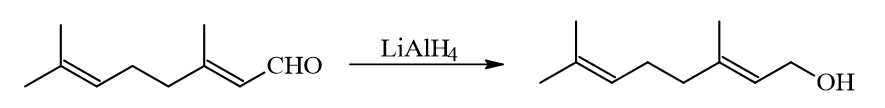
Điền đáp án : 1
→ geranial chỉ có 1 liên kết trong nhóm CHO bị phá vỡ.

Điền đáp án : 1
Câu 27 [705849]: L-leucine hydrochloride, [(CH3)2CHCH2CH(NH3)COOH]+Cl‒, được sử dụng làm chất bổ sung amino acid thiết yếu trong chế độ ăn uống. Thêm từ từ 50 mL dung dịch leucine hydrochloride 0,1 M vào dung dịch NaOH 0,2 M. Thể tích tối thiểu dung dịch NaOH cần dùng để L-leucine hydrochloride phân li toàn bộ H+ là bao nhiêu mL?
Đổi 50 mL = 0,05 L
[(CH3)2CHCH2CH(NH3)COOH] + Cl- + 2NaOH → (CH3)2CHCH2CH(NH3)COONa + NaCl + H2O
Số mol của L-leucine hydrochloride là nL-leucine hydrochloride = 0,05.0,1 = 0,005 mol
Từ phương trình hóa học số mol của NaOH là 0,01 mol
Thể tích tối thiểu của dung dịch NaOH cần dùng là VNaOH = 0,01:0,2 = 0,05 L = 50 mL
Điền đáp án : 50
[(CH3)2CHCH2CH(NH3)COOH] + Cl- + 2NaOH → (CH3)2CHCH2CH(NH3)COONa + NaCl + H2O
Số mol của L-leucine hydrochloride là nL-leucine hydrochloride = 0,05.0,1 = 0,005 mol
Từ phương trình hóa học số mol của NaOH là 0,01 mol
Thể tích tối thiểu của dung dịch NaOH cần dùng là VNaOH = 0,01:0,2 = 0,05 L = 50 mL
Điền đáp án : 50
Câu 28 [705850]: Chlorine được dùng làm chất chống tạo rong rêu trong vệ sinh bể bơi theo phản ứng sau:
Ca(OCl)2 + 2H2O → 2HClO + Ca(OH)2
Calcium hypochlorite phản ứng với nước tạo hypochlorous acid là một tác nhân hoạt động. Ở pH bằng 7,0 có 27,5% acid ion hoá thành ion hypochlorite không hoạt động. Phần hypochlorous acid còn lại (72,5%) chuyển thành chlorine dùng làm sạch hồ bơi.Trong hồ bơi, mức chlorine được duy trì ở 3 ppm. Cần bao nhiêu gam calcium hypochlorite để thêm vào hồ chứa 80 m3 nước để mức chlorine đạt tiêu chuẩn vệ sinh là 3 ppm ở pH bằng 7,0? Biết 1 ppm = 1 g chlorine trên 1 m3 nước (Làm tròn đến số nguyên).
Ca(OCl)2 + 2H2O → 2HClO + Ca(OH)2
Calcium hypochlorite phản ứng với nước tạo hypochlorous acid là một tác nhân hoạt động. Ở pH bằng 7,0 có 27,5% acid ion hoá thành ion hypochlorite không hoạt động. Phần hypochlorous acid còn lại (72,5%) chuyển thành chlorine dùng làm sạch hồ bơi.Trong hồ bơi, mức chlorine được duy trì ở 3 ppm. Cần bao nhiêu gam calcium hypochlorite để thêm vào hồ chứa 80 m3 nước để mức chlorine đạt tiêu chuẩn vệ sinh là 3 ppm ở pH bằng 7,0? Biết 1 ppm = 1 g chlorine trên 1 m3 nước (Làm tròn đến số nguyên).
Ca(OCl)2 + 2H2O → 2HClO + Ca(OH)2
Khối lượng chlorine trong hồ bơi là 80.3 = 240 gam
Bảo toàn nguyên tố Cl: nCl = nHClO = 240 : 35,5 = 480/71 mol
số mol của HClO ban đầu là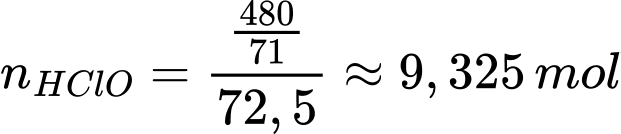
Từ phương trình số mol của Ca(OCl)2 là 4,6625 mol
Khối lượng của Ca(OCl)2 cần dùng là mCa(OCl)2 = 4,6625.143 = 666,7375 gam = 667 gam
Điền đáp án: 667
Khối lượng chlorine trong hồ bơi là 80.3 = 240 gam
Bảo toàn nguyên tố Cl: nCl = nHClO = 240 : 35,5 = 480/71 mol
số mol của HClO ban đầu là
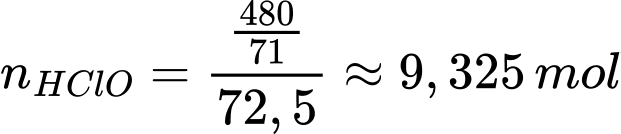
Từ phương trình số mol của Ca(OCl)2 là 4,6625 mol
Khối lượng của Ca(OCl)2 cần dùng là mCa(OCl)2 = 4,6625.143 = 666,7375 gam = 667 gam
Điền đáp án: 667