PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705726]: Hợp kim là vật liệu kim loại có chứa một ..(1).. cơ bản và một số ..(1).. khác hoặc ..(2)..”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, kim loại, hợp chất.
B, kim loại, phi kim.
C, sắt, chromium.
D, carbon, phi kim.
Hợp kim là một hỗn hợp của kim loại với các nguyên tố khác.
Trong hợp kim, luôn có một kim loại chính (kim loại cơ bản) và có thể chứa thêm các kim loại khác.
⟹ (1) là "kim loại".
Trong hợp kim, ngoài các kim loại khác, còn có thể có phi kim như: Carbon (C) trong thép; Silicon (Si) trong gang
Phi kim đóng vai trò quan trọng trong việc thay đổi tính chất của hợp kim.
⟹ (2) là "phi kim".
⟹Chọn đáp án B Đáp án: B
Trong hợp kim, luôn có một kim loại chính (kim loại cơ bản) và có thể chứa thêm các kim loại khác.
⟹ (1) là "kim loại".
Trong hợp kim, ngoài các kim loại khác, còn có thể có phi kim như: Carbon (C) trong thép; Silicon (Si) trong gang
Phi kim đóng vai trò quan trọng trong việc thay đổi tính chất của hợp kim.
⟹ (2) là "phi kim".
⟹Chọn đáp án B Đáp án: B
Câu 2 [705727]: Sodium peroxide được sử dụng trong bình lặn để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người. Công thức hóa học của sodium peroxide là
A, Na2O.
B, Na2O2.
C, NaO2.
D, NaO.
Phân tích các đáp án:
❌A. Na2O : Sodium oxide
✔️B. Na2O2 : Sodium peroxide
❌C. NaO2 : Sodium superoxide
❌D. NaO : vi phạm quy tắc hóa trị.
⟹ Chọn đáp án B Đáp án: B
❌A. Na2O : Sodium oxide
✔️B. Na2O2 : Sodium peroxide
❌C. NaO2 : Sodium superoxide
❌D. NaO : vi phạm quy tắc hóa trị.
⟹ Chọn đáp án B Đáp án: B
Câu 3 [705728]: Trên thế giới, mía là loại cây được trồng với diện tích rất lớn. Mía chiếm hơn 80% nguyên liệu đầu vào cho sản xuất đường (còn lại từ củ cải đường). Carbohydrate trong đường mía có tên gọi là
A, Saccharose.
B, Glucose.
C, Fructose.
D, Cellulose.
Phân tích các phát biểu:
✔️A. Đường mía chủ yếu chứa saccharose (sucrose) – một loại disaccharide (đường đôi).
✔️A. Đường mía chủ yếu chứa saccharose (sucrose) – một loại disaccharide (đường đôi).
Đây là loại đường phổ biến trong thực phẩm, được chiết xuất từ cây mía và củ cải đường.
❌B. Glucose là một loại monosaccharide (đường đơn), cung cấp năng lượng chính cho cơ thể có nhiều trong tinh bột từ gạo, khoai tây, bột mì (khi tiêu hóa sẽ chuyển thành glucose)❌C. Fructose cũng là một monosaccharide, có vị ngọt hơn glucose, có nhiều trong mật ong.
❌D.Cellulose là một polysaccharide, không tiêu hóa được bởi cơ thể con người, nhưng rất quan trọng trong chế độ ăn uống vì là chất xơ. Có nhiều trong rau xanh, trái cây, ngũ cốc nguyên hạt.
⟹Chọn đáp án A
Đáp án: A ❌D.Cellulose là một polysaccharide, không tiêu hóa được bởi cơ thể con người, nhưng rất quan trọng trong chế độ ăn uống vì là chất xơ. Có nhiều trong rau xanh, trái cây, ngũ cốc nguyên hạt.
⟹Chọn đáp án A
Câu 4 [705729]: Tại sao người ta thường dùng các loại xà phòng trung tính để giặt quần áo bằng len lông cừu, nylon hoặc tơ tằm?
A, Các chất liệu này có cấu trúc là các tơ poliamide kém bền với nhiệt, với acid và kiềm.
B, Các chất liệu này dễ tan trong nước nếu sử dụng xà phòng có tính kiềm.
C, Các chất liệu này có cấu trúc đặc biệt, không chịu tác động của xà phòng có tính kiềm.
D, Xà phòng trung tính giúp len, nylon và tơ tằm tăng khả năng hút nước, làm mềm sợi.
Len (lông cừu) và tơ tằm đều có thành phần chính là protein (keratin ở len, fibroin ở tơ tằm).Protein dễ bị phân hủy trong môi trường kiềm mạnh.Nếu giặt bằng xà phòng có tính kiềm cao, len và tơ tằm sẽ mất độ bền, trở nên thô ráp hoặc hư hỏng.
- Nylon là một loại polyamide (giống như protein), cũng không bền với acid mạnh và kiềm mạnh.
Phân tích các phát biểu:
✔️A. Len, nylon và tơ tằm đều có cấu trúc là polyamide, dễ bị hư hỏng bởi nhiệt, acid và kiềm mạnh.
❌B. Các chất liệu này không tan trong nước khi gặp xà phòng kiềm, mà chỉ bị hư hỏng.
❌C. Các chất liệu này chịu tác động mạnh của xà phòng có tính kiềm, không phải là "không chịu tác động".
❌D. Xà phòng trung tính không làm tăng khả năng hút nước mà chủ yếu giúp bảo vệ sợi vải
⟹Chọn đáp án A Đáp án: A
- Nylon là một loại polyamide (giống như protein), cũng không bền với acid mạnh và kiềm mạnh.
Phân tích các phát biểu:
✔️A. Len, nylon và tơ tằm đều có cấu trúc là polyamide, dễ bị hư hỏng bởi nhiệt, acid và kiềm mạnh.
❌B. Các chất liệu này không tan trong nước khi gặp xà phòng kiềm, mà chỉ bị hư hỏng.
❌C. Các chất liệu này chịu tác động mạnh của xà phòng có tính kiềm, không phải là "không chịu tác động".
❌D. Xà phòng trung tính không làm tăng khả năng hút nước mà chủ yếu giúp bảo vệ sợi vải
⟹Chọn đáp án A Đáp án: A
Câu 5 [705730]: Vì sao pin và vỏ hộp kim loại không nên để chung trong môi trường ẩm ướt?
A, Pin và kim loại phản ứng hóa học mạnh, gây cháy nổ.
B, Ăn mòn điện hóa xảy ra làm hỏng pin và vỏ hộp.
C, Môi trường ẩm làm pin nhanh hết điện.
D, pin và vỏ hộp tiếp xúc làm tăng khả năng dẫn nhiệt.
Pin chứa các kim loại và dung dịch điện phân.
- Kim loại trong môi trường ẩm ướt dễ bị ăn mòn điện hóa do có nước làm chất điện ly, tạo điều kiện cho phản ứng oxi hóa-khử xảy ra.
- Ăn mòn điện hóa có thể làm hỏng vỏ pin, gây rò rỉ dung dịch, ảnh hưởng đến thiết bị và môi trường xung quanh
Phân tích các đáp án :
❌A. Sai vì phản ứng hóa học giữa pin và kim loại không phải là nguyên nhân chính gây cháy nổ. Pin chỉ phát nổ khi bị đoản mạch, quá nhiệt hoặc chập điện chứ không phải do tiếp xúc với kim loại trong môi trường ẩm.
✔️B. Đúng vì trong môi trường ẩm, có sự xuất hiện của nước làm chất điện ly, pin và vỏ hộp kim loại tạo thành một cặp điện hóa, dẫn đến quá trình ăn mòn điện hóa. Hậu quả là pin bị rò rỉ hóa chất và vỏ hộp bị hỏng.
❌C. Sai vì môi trường ẩm không trực tiếp làm pin nhanh hết điện. Tuy nhiên, ăn mòn điện hóa có thể làm hỏng pin, gián tiếp khiến pin bị rò rỉ và mất khả năng hoạt động
❌D. Sai vì dẫn nhiệt không phải vấn đề chính trong trường hợp này. Môi trường ẩm chủ yếu gây ăn mòn điện hóa chứ không ảnh hưởng nhiều đến tính dẫn nhiệt của kim loại.
⟹Chọn đáp án B
Đáp án: B
- Kim loại trong môi trường ẩm ướt dễ bị ăn mòn điện hóa do có nước làm chất điện ly, tạo điều kiện cho phản ứng oxi hóa-khử xảy ra.
- Ăn mòn điện hóa có thể làm hỏng vỏ pin, gây rò rỉ dung dịch, ảnh hưởng đến thiết bị và môi trường xung quanh
Phân tích các đáp án :
❌A. Sai vì phản ứng hóa học giữa pin và kim loại không phải là nguyên nhân chính gây cháy nổ. Pin chỉ phát nổ khi bị đoản mạch, quá nhiệt hoặc chập điện chứ không phải do tiếp xúc với kim loại trong môi trường ẩm.
✔️B. Đúng vì trong môi trường ẩm, có sự xuất hiện của nước làm chất điện ly, pin và vỏ hộp kim loại tạo thành một cặp điện hóa, dẫn đến quá trình ăn mòn điện hóa. Hậu quả là pin bị rò rỉ hóa chất và vỏ hộp bị hỏng.
❌C. Sai vì môi trường ẩm không trực tiếp làm pin nhanh hết điện. Tuy nhiên, ăn mòn điện hóa có thể làm hỏng pin, gián tiếp khiến pin bị rò rỉ và mất khả năng hoạt động
❌D. Sai vì dẫn nhiệt không phải vấn đề chính trong trường hợp này. Môi trường ẩm chủ yếu gây ăn mòn điện hóa chứ không ảnh hưởng nhiều đến tính dẫn nhiệt của kim loại.
⟹Chọn đáp án B
Đáp án: B
Câu 6 [705731]: Việc khử trùng chuồng rất quan trọng, nó giúp tiêu diệt vi khuẩn và virus. Tuy nhiên hóa chất dùng khử trùng cũng cần phải dễ sử dụng và giá rẻ. Loại hóa chất nào được sử dụng để khử trùng chuồng trại?
A, Vôi sống (CaO).
B, Vôi tôi (Ca(OH)2).
C, Đá vôi (CaCO3).
D, Thạch cao (CaSO4).
Phân tích các đáp án :
✔️A. Vôi sống khi gặp nước sẽ tạo phản ứng tỏa nhiệt mạnh (CaO + H2O → Ca(OH)2),
- Khi hòa vào nước, nó tạo dung dịch có tính kiềm mạnh, giúp tiêu diệt vi khuẩn, virus và nấm mốc.
❌C. Đá vôi không có tính khử trùng vì nó là một muối trung tính, không có khả năng tiêu diệt vi khuẩn, chủ yếu được dùng để cải tạo đất, xử lý ao nuôi.
❌D. Thạch cao không có tính khử trùng, chỉ là một dạng muối dùng trong xây dựng hoặc sản xuất vật liệu.
⟹Chọn đáp án A Đáp án: A
✔️A. Vôi sống khi gặp nước sẽ tạo phản ứng tỏa nhiệt mạnh (CaO + H2O → Ca(OH)2),
- Khi hòa vào nước, nó tạo dung dịch có tính kiềm mạnh, giúp tiêu diệt vi khuẩn, virus và nấm mốc.
- Dễ sử dụng: Có thể rải bột hoặc pha nước để quét, phun.
❌B. Vôi tôi (Ca(OH)2) cũng được sử dụng nhưng chi phí cao.❌C. Đá vôi không có tính khử trùng vì nó là một muối trung tính, không có khả năng tiêu diệt vi khuẩn, chủ yếu được dùng để cải tạo đất, xử lý ao nuôi.
❌D. Thạch cao không có tính khử trùng, chỉ là một dạng muối dùng trong xây dựng hoặc sản xuất vật liệu.
⟹Chọn đáp án A Đáp án: A
Câu 7 [252416]: Cho 15,8 gam KMnO4 tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được ở đkc là
A, 2,749 L.
B, 6,1975 L.
C, 4,958 L.
D, 9,916 L.
2KMnO4(r) + 16HCl(đặc) 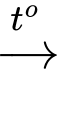 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
2KCl + 2MnCl2 + 5Cl2 + 8H2O.
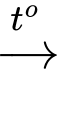 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
2KCl + 2MnCl2 + 5Cl2 + 8H2O. Số mol KMnO4 = 0,1 mol ⟹ mol Cl2 = 0,25
⟹ Thể tích khí thu được ở đkc là = 0,25 × 24,79 = 6,1975 L
⟹Chọn đáp án B
Đáp án: B ⟹ Thể tích khí thu được ở đkc là = 0,25 × 24,79 = 6,1975 L
⟹Chọn đáp án B
Câu 8 [705732]: Phân tử hemoglobin (Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2, lại chuyển thành Hb và O2 (để cung cấp O2 cho các hoạt động sinh hoá cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide (CO), cơ thể nhanh chóng bị ngộ độc. Cho các số liệu thực nghiệm sau:
Hb + O2 → HbO2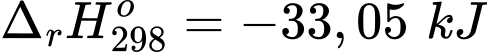 (1)
(1)
Hb + CO HbCO
HbCO 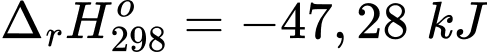 (2)
(2)
HbO2 + CO HbCO + O2
HbCO + O2 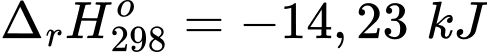 (3)
(3)
HbCO + O2 HbO2 + CO
HbO2 + CO 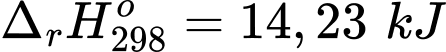 (4)
(4)
Cho các phát biểu sau: Trong các điều kiện đã cho bên trên
(a) Hb kết hợp với O2 là quá trình tỏa nhiệt.
(b) Hb kết hợp với CO dễ dàng hơn kết hợp với O2.
(c) Nếu trong không khí có lẫn CO, lượng O2 cơ thể được nhận giảm.
(d) HbCO muốn kết hợp với O2 không cần tiêu tốn năng lượng.
Các phát biểu đúng là
Hb + O2 → HbO2
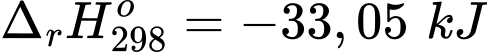 (1)
(1)Hb + CO
 HbCO
HbCO 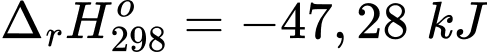 (2)
(2)HbO2 + CO
 HbCO + O2
HbCO + O2 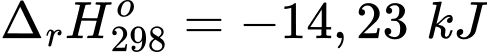 (3)
(3)HbCO + O2
 HbO2 + CO
HbO2 + CO 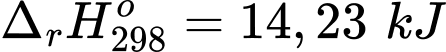 (4)
(4)Cho các phát biểu sau: Trong các điều kiện đã cho bên trên
(a) Hb kết hợp với O2 là quá trình tỏa nhiệt.
(b) Hb kết hợp với CO dễ dàng hơn kết hợp với O2.
(c) Nếu trong không khí có lẫn CO, lượng O2 cơ thể được nhận giảm.
(d) HbCO muốn kết hợp với O2 không cần tiêu tốn năng lượng.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu:
✔️(a) – Đúng. Hb kết hợp với O2 tỏa ra 33,05 kJ
✔️(b) – Đúng. Nhiệt lượng của phản ứng Hb kết hợp với O2 là 33,05 kJ thấp hơn Hb kết hợp với CO là 47,28 kJ nên Hb kết hợp với CO dễ hơn so với O2.
✔️ (c) – Đúng. Hb ưu tiên kết hợp với CO, do phản ứng kết hợp của Hb và CO tỏa nhiệt mạnh hơn so với Hb phản ứng với O2.
❌(d) – Sai. HbCO kết hợp với O2 là phản ứng thu nhiệt nên cần cung cấp năng lượng thì phản ứng mới xảy ra.
Các phát biểu đúng là (a), (b), (c).
⟹Chọn đáp án C Đáp án: C
✔️(a) – Đúng. Hb kết hợp với O2 tỏa ra 33,05 kJ
✔️(b) – Đúng. Nhiệt lượng của phản ứng Hb kết hợp với O2 là 33,05 kJ thấp hơn Hb kết hợp với CO là 47,28 kJ nên Hb kết hợp với CO dễ hơn so với O2.
✔️ (c) – Đúng. Hb ưu tiên kết hợp với CO, do phản ứng kết hợp của Hb và CO tỏa nhiệt mạnh hơn so với Hb phản ứng với O2.
❌(d) – Sai. HbCO kết hợp với O2 là phản ứng thu nhiệt nên cần cung cấp năng lượng thì phản ứng mới xảy ra.
Các phát biểu đúng là (a), (b), (c).
⟹Chọn đáp án C Đáp án: C
Câu 9 [186325]: Trong dung dịch nước của 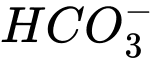 tồn tại cân bằng như sau:
tồn tại cân bằng như sau:
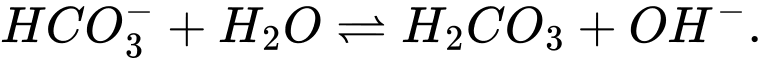
Cặp acid/ base liên hợp trong cân bằng trên là
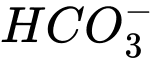 tồn tại cân bằng như sau:
tồn tại cân bằng như sau: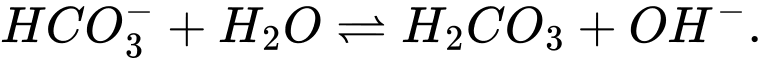
Cặp acid/ base liên hợp trong cân bằng trên là
A, 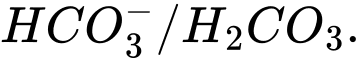
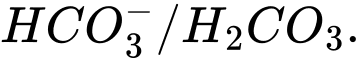
B, 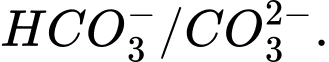
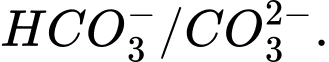
C, 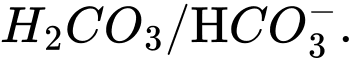
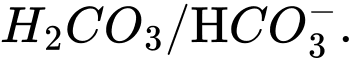
D, 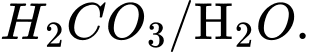
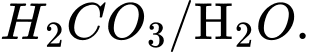
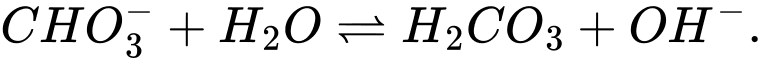
Base acid acid base
Cặp acid/ base liên hợp trong cân bằng trên là
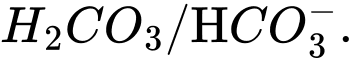
⟹Chọn đáp án C Đáp án: C
Câu 10 [247297]: Cho các cấu hình lớp ngoài cùng của Sulfur (Z=16) như sau, cấu hình ở trạng thái cơ bản là
A, 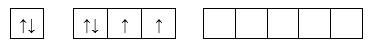

B, 

C, 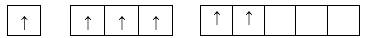

D, 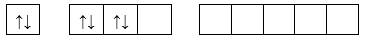

Cấu hình electron của S: 1s22s22p63s23p4
Cấu hình e lớp ngoài cùng: 3s23p4
⟹Chọn đáp án A Đáp án: A
Cấu hình e lớp ngoài cùng: 3s23p4
⟹Chọn đáp án A Đáp án: A
Câu 11 [705733]: Thế điện cực chuẩn của các cặp Cu2+/Cu, Zn2+/Zn, Sn2+/Sn và Ag+/Ag lần lượt là 0,340 V; –0,763 V; –0,138 V và 0,799 V. Phát biểu nào sau đây là đúng?
A, Thùng bằng kẽm có thể dùng để chứa dung dịch CuSO4.
B, Thùng bằng kẽm có thể dùng để chứa dung dịch AgNO3.
C, Thùng bằng thiếc (Sn) có thể dùng để chứa dung dịch AgNO3.
D, Thùng bằng bạc có thể dùng để chứa dung dịch CuSO4.
Phân tích các đáp án:
❌A – Sai. Thùng bằng kẽm không thể dùng để chứa dung dịch CuSO4. Do Zn có tính khử mạnh hơn Cu nên sẽ có phản ứng hóa học làm thùng kẽm bị ăn mòn dần.
Zn + CuSO4 → ZnSO4 + Cu
❌B – Sai. Thùng bằng kẽm không thể dùng để chứa dung dịch AgNO3. Do Zn có tính khử mạnh hơn Ag nên sẽ có phản ứng hóa học làm thùng kẽm bị ăn mòn dần.
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
❌C – Sai. Thùng bằng thiếc (Sn) không thể dùng để chứa dung dịch AgNO3. Do Sn có tính khử mạnh hơn Ag nên sẽ có phản ứng hóa học làm thùng thiếc bị ăn mòn dần.
Sn + 2AgNO3 → Sn(NO3)2 + 2Ag
✔️D – Đúng. Thùng bằng bạc (Ag) có thể dùng để chứa dung dịch CuSO4. Do Ag có tính khử yếu hơn Cu nên không có phản ứng hóa học với dung dịch CuSO4
⟹Chọn đáp án D Đáp án: D
❌A – Sai. Thùng bằng kẽm không thể dùng để chứa dung dịch CuSO4. Do Zn có tính khử mạnh hơn Cu nên sẽ có phản ứng hóa học làm thùng kẽm bị ăn mòn dần.
Zn + CuSO4 → ZnSO4 + Cu
❌B – Sai. Thùng bằng kẽm không thể dùng để chứa dung dịch AgNO3. Do Zn có tính khử mạnh hơn Ag nên sẽ có phản ứng hóa học làm thùng kẽm bị ăn mòn dần.
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
❌C – Sai. Thùng bằng thiếc (Sn) không thể dùng để chứa dung dịch AgNO3. Do Sn có tính khử mạnh hơn Ag nên sẽ có phản ứng hóa học làm thùng thiếc bị ăn mòn dần.
Sn + 2AgNO3 → Sn(NO3)2 + 2Ag
✔️D – Đúng. Thùng bằng bạc (Ag) có thể dùng để chứa dung dịch CuSO4. Do Ag có tính khử yếu hơn Cu nên không có phản ứng hóa học với dung dịch CuSO4
⟹Chọn đáp án D Đáp án: D
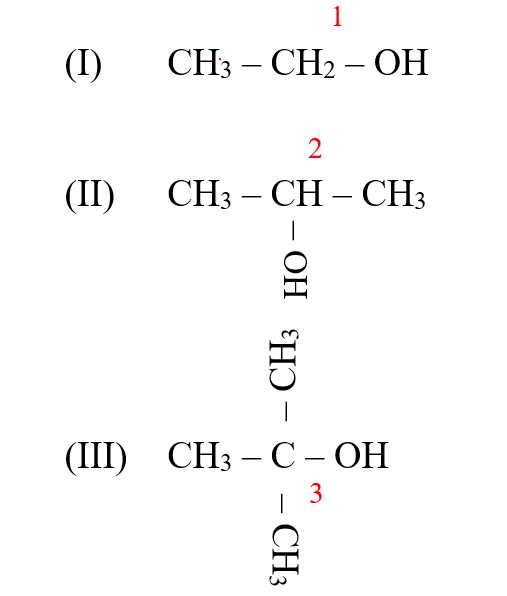
Câu 12 [14958]: Cho dãy gồm các alcohol sau: (I) CH3CH2OH; (II) CH3CH(OH)CH3; (III) (CH3)3C(OH); (IV) CH3CH(OH)CH2CH3; (V) CH3CH(CH3)CH2OH.
Số alcohol bậc hai là
Số alcohol bậc hai là
A, 5.
B, 3.
C, 4.
D, 2.
Alcohol bậc hai = OH liên kết với carbon bậc 2 => (II), (IV)
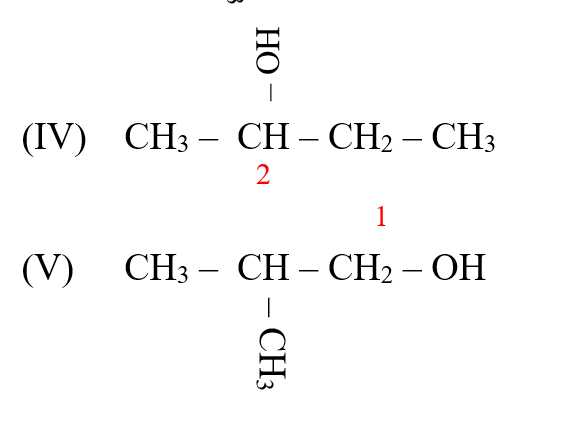 ⟹Chọn đáp án D Đáp án: D
⟹Chọn đáp án D Đáp án: D

 ⟹Chọn đáp án D Đáp án: D
⟹Chọn đáp án D Đáp án: D
Câu 13 [705734]: Menthol là một hoạt chất được tìm thấy nhiều trong cây bạc hà. Menthol tạo ra cảm giác mát lạnh, nhờ đó nó giảm sự chú ý của ta khỏi cơn đau và những kích thích khác. Menthol còn có tác dụng kháng khuẩn, chống co thắt và làm giãn cơ. Công thức cấu tạo của menthol như hình bên.
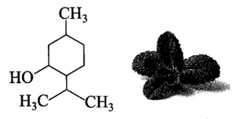
Cho các phát biểu sau:
(1) Menthol là alcohol đơn chức.
(2) Công thức phân tử của menthol có dạng CnH2n–1OH.
(3) Tên thay thế của menthol là 2-isopropyl-5-methylcyclohexandiol.
(4) Menthol là alcohol thơm.
(5) Oxi hoá menthol bằng CuO, đun nóng, thu được một aldehyde.
Những phát biểu nào đúng trong các phát biểu sau?

Cho các phát biểu sau:
(1) Menthol là alcohol đơn chức.
(2) Công thức phân tử của menthol có dạng CnH2n–1OH.
(3) Tên thay thế của menthol là 2-isopropyl-5-methylcyclohexandiol.
(4) Menthol là alcohol thơm.
(5) Oxi hoá menthol bằng CuO, đun nóng, thu được một aldehyde.
Những phát biểu nào đúng trong các phát biểu sau?
A, (1) và (2).
B, (1), (2) và (4).
C, (1) và (5).
D, (3), (4) và (5).
Phân tích các phát biểu:
✔️(1) – Đúng. Menthol là alcohol có 1 nhóm OH, nên là alcohol đơn chức.
✔️(2) – Đúng. Menthol có 1 vòng nên có độ bất bão hòa bằng 1, công thức tổng quát của menthol là CnH2n-1OH
❌(3) – Sai. Menthol có tên thay thế là 5-methyl-2-isopropyl cylclohexane-1-ol.
❌(4) – Sai. Menthol là alcohol no, đơn chức
❌(5) – Sai. Menthol là alcohol bậc II nên khi bị oxi hóa bằng CuO tạo ra ketone.
⟹Chọn đáp án A Đáp án: A
✔️(1) – Đúng. Menthol là alcohol có 1 nhóm OH, nên là alcohol đơn chức.
✔️(2) – Đúng. Menthol có 1 vòng nên có độ bất bão hòa bằng 1, công thức tổng quát của menthol là CnH2n-1OH
❌(3) – Sai. Menthol có tên thay thế là 5-methyl-2-isopropyl cylclohexane-1-ol.
❌(4) – Sai. Menthol là alcohol no, đơn chức
❌(5) – Sai. Menthol là alcohol bậc II nên khi bị oxi hóa bằng CuO tạo ra ketone.
⟹Chọn đáp án A Đáp án: A
Câu 14 [705735]: Có hai thí nghiệm dưới đây:
∎ Thí nghiệm 1 ở 0 °C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
[Cu(OH2)6]2+(aq) + 4Cl–(aq)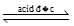 [CuCl4]2–(aq) + 6H2O(l); KC = 4,18×105
[CuCl4]2–(aq) + 6H2O(l); KC = 4,18×105
∎ Thí nghiệm 2 ở 20 °C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
Trong các phát biểu sau:
(a) Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
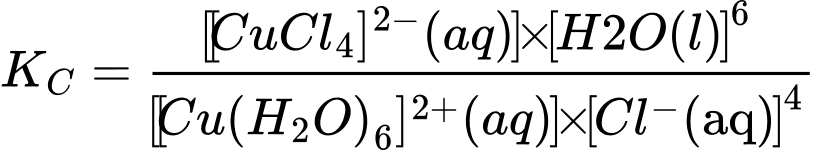
(b) Trong thí nghiệm 1, phản ứng nghịch diễn ra thuận lợi hơn so với phản ứng thuận.
(c) Trong thí nghiệm 1, nồng độ anion Cl– càng cao thì phản ứng thuận càng dễ diễn ra.
(d) Trong thí nghiệm 2 không có dấu hiệu của phản ứng hình thành phức chất.
Các phát biểu đúng là
∎ Thí nghiệm 1 ở 0 °C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
[Cu(OH2)6]2+(aq) + 4Cl–(aq)
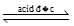 [CuCl4]2–(aq) + 6H2O(l); KC = 4,18×105
[CuCl4]2–(aq) + 6H2O(l); KC = 4,18×105∎ Thí nghiệm 2 ở 20 °C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
Trong các phát biểu sau:
(a) Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
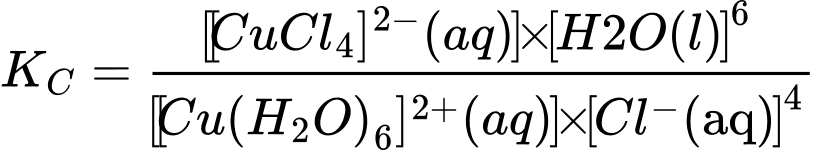
(b) Trong thí nghiệm 1, phản ứng nghịch diễn ra thuận lợi hơn so với phản ứng thuận.
(c) Trong thí nghiệm 1, nồng độ anion Cl– càng cao thì phản ứng thuận càng dễ diễn ra.
(d) Trong thí nghiệm 2 không có dấu hiệu của phản ứng hình thành phức chất.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (c), (d).
D, (a), (c), (d).
Đối với hệ phản ứng thuận nghịch đồng thể (hệ chỉ gồm chất khí hoăc chất tan trong dung dịch ) tổng quát dạng :
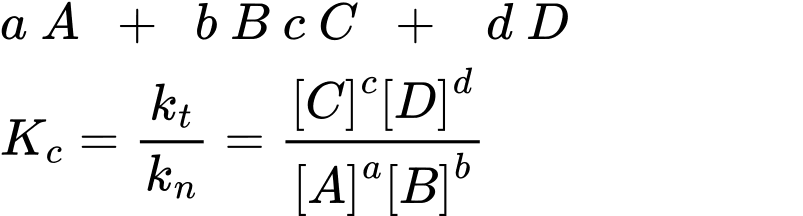
(Trong đó là nồng độ mol/l của các chất A , B , C , D ở trạng thái cân bằng )
là nồng độ mol/l của các chất A , B , C , D ở trạng thái cân bằng )
Phân tích các phát biểu:
✔️(a) – Đúng. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
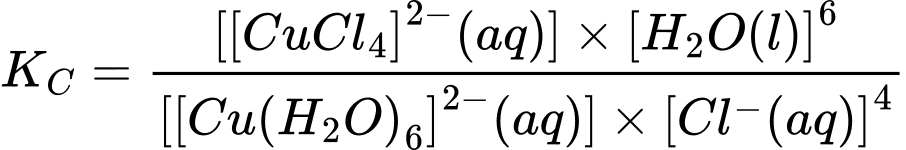
❌(b) – Sai. Phản ứng thuận diễn ra thuận lợi hơn với hằng số cân bằng 4,18.105
✔️(c) – Đúng. Khi nồng độ Cl- càng cao, theo nguyên lí chuyển dịch cân bằng làm cân bằng chuyển dịch theo chiều thuận.
✔️(d) – Đúng. Nếu hình thành phức [CuCl4]2-(aq) phải có màu vàng chanh nhưng thí nghiệm 2 không thấy hiện tượng này.
⟹Có 3 phát biểu đúng là (a), (c), (d).
⟹Chọn đáp án D Đáp án: D
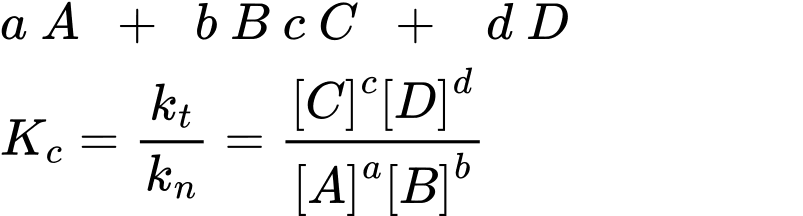
(Trong đó
 là nồng độ mol/l của các chất A , B , C , D ở trạng thái cân bằng )
là nồng độ mol/l của các chất A , B , C , D ở trạng thái cân bằng )Phân tích các phát biểu:
✔️(a) – Đúng. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
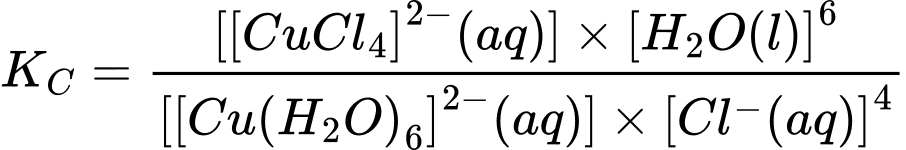
❌(b) – Sai. Phản ứng thuận diễn ra thuận lợi hơn với hằng số cân bằng 4,18.105
✔️(c) – Đúng. Khi nồng độ Cl- càng cao, theo nguyên lí chuyển dịch cân bằng làm cân bằng chuyển dịch theo chiều thuận.
✔️(d) – Đúng. Nếu hình thành phức [CuCl4]2-(aq) phải có màu vàng chanh nhưng thí nghiệm 2 không thấy hiện tượng này.
⟹Có 3 phát biểu đúng là (a), (c), (d).
⟹Chọn đáp án D Đáp án: D
Câu 15 [705736]: Số liên kết π trong phân tử CH3COOCH3 là:
A, 1.
B, 2.
C, 3.
D, 4.
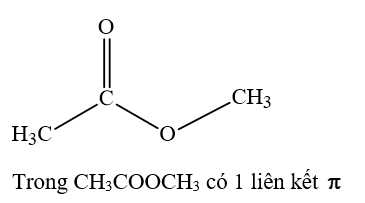
⟹Chọn đáp án A
Câu 16 [705737]: “Các alkyl amine, ..(1).. có khả năng tham gia phản ứng với ..(2).. trong điều kiện thích hợp tạo sản phẩm là alcohol, khí nitrogen và nước”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, bậc 1, nitric acid.
B, bậc 2, nitrous acid.
C, bậc 1, nitrous acid.
D, bậc 2, nitric acid.
- Chỉ amin bậc 1 có thể phản ứng với acid để tạo ra alcohol, khí nitrogen và nước.
- Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng khí nitrogen (phản ứng này thường được dùng để nhận biết alkylamine bậc một).
Ví dụ:CH3NH2 + HONO → CH3OH + N2 + H2O
⟹Chọn đáp án C Đáp án: C
- Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng khí nitrogen (phản ứng này thường được dùng để nhận biết alkylamine bậc một).
Ví dụ:CH3NH2 + HONO → CH3OH + N2 + H2O
⟹Chọn đáp án C Đáp án: C
Sử dụng thông tin dưới đây trả lời câu hỏi số 17, 18
Thủy phân hoàn toàn 1 mol pentapeptide X, thu được 2 mol glycine (Gly), 1 mol alanine
(Ala), 1 mol valine (Val) và 1 mol glutamic acid (Glu). Thủy phân không hoàn toàn X thu được
dipeptide Val-Glu và tripeptide Gly-Ala-Val nhưng không thu được dipeptide Gly-Gly.
Câu 17 [705738]: Chất X có công thức là
A, Gly-Glu-Gly-Ala-Val.
B, Gly-Ala-Val-Val-Glu.
C, Gly-Ala-Val-Glu-Gly.
D, Val-Glu-Gly-Ala-Gly.
Thủy phân hoàn toàn 1 mol pentapeptide X, thu được 2 mol glycine (Gly), 1 mol alanine (Ala), 1 mol Valine (Val), và 1 mol glutamic acid (Glu)
→ Nhận thấy pentapeptide X gồm 2 Gly, 1 ala, 1 val và 1 Glu.
Thủy phân không hoàn toàn X thu được dipeptide Val-Glu và tripeptit Gly-Ala-Val nhưng không thu được dipeptide Gly-Gly.
→ Đáp án phù hợp là Gly-Ala-Val-Glu-Gly.
⟹Chọn đáp án C Đáp án: C
→ Nhận thấy pentapeptide X gồm 2 Gly, 1 ala, 1 val và 1 Glu.
Thủy phân không hoàn toàn X thu được dipeptide Val-Glu và tripeptit Gly-Ala-Val nhưng không thu được dipeptide Gly-Gly.
→ Đáp án phù hợp là Gly-Ala-Val-Glu-Gly.
⟹Chọn đáp án C Đáp án: C
Câu 18 [705739]: Thủy phân hoàn toàn 0,3 mol peptide trên trong dung dịch NaOH, sau phản ứng thu được bao nhiêu gam muối?
A, 173,4.
B, 190,5.
C, 177,3.
D, 228.
Sơ đồ phản ứng:
(peptide)n + (n - 1 + b)NaOH → n muối của - amino acid + bH2O
Trong đó: b là tổng số nhóm -COOH còn tự do trong peptide (các nhóm COOH không tạo liên kết peptide), n là số amino acid cấu tạo nên peptide.
Pentapeptide X có dạng Gly-Ala-Val-Glu-Gly với glu và gly (cuối mạch) đều còn 1 nhóm COOH trong không tạo liên kết peptide.
Sơ đồ phản ứng:
(peptide)5 + 6NaOH → 5muối của - amino acid + 2H2O
Từ PTHH số mol của NaOH và H2O là nNaOH = 1,8 mol; nH2O = 0,6 mol
Áp dụng định luật bảo toàn khối lượng :
mX + mNaOH = mMuối + m H2O
0,3.(75.2 + 89 + 117 + 147 - 18.4 ) + 1,8.40 = mmuối + 0,6.18
mmuối = 190,5 gam.
⟹Chọn đáp án B Đáp án: B
(peptide)n + (n - 1 + b)NaOH → n muối của - amino acid + bH2O
Trong đó: b là tổng số nhóm -COOH còn tự do trong peptide (các nhóm COOH không tạo liên kết peptide), n là số amino acid cấu tạo nên peptide.
Pentapeptide X có dạng Gly-Ala-Val-Glu-Gly với glu và gly (cuối mạch) đều còn 1 nhóm COOH trong không tạo liên kết peptide.
Sơ đồ phản ứng:
(peptide)5 + 6NaOH → 5muối của - amino acid + 2H2O
Từ PTHH số mol của NaOH và H2O là nNaOH = 1,8 mol; nH2O = 0,6 mol
Áp dụng định luật bảo toàn khối lượng :
mX + mNaOH = mMuối + m H2O
0,3.(75.2 + 89 + 117 + 147 - 18.4 ) + 1,8.40 = mmuối + 0,6.18
mmuối = 190,5 gam.
⟹Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705740]: Sắc kí cột có thể được sử dụng để tách các chất ra khỏi nhau. Hỗn hợp sản phẩm được đặt ở trên pha tĩnh (chứa chất rắn alumina hoặc silica) và thêm từ từ dung môi (pha động) từ trên xuống. Khi mở van, dung môi chảy xuống và các thành phần của hỗn hợp bắt đầu di chuyển xuống ống và tách ra khỏi nhau.
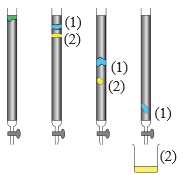

Phân tích các đáp án:
❌A. Sai. Pha động là dung môi, là chất lỏng hoặc khí mang các chất cần tách qua pha tĩnh. Alumina và silica là pha tĩnh, là chất rắn được sử dụng để hấp phụ các chất.
✔️B. Đúng. Chất nào tương tác tốt hơn với pha động (dung môi) sẽ di chuyển nhanh hơn và do đó đi ra khỏi cột trước.
✔️C. Đúng. Trong sắc ký cột, chất phân cực sẽ tương tác tốt hơn với dung môi phân cực và di chuyển nhanh hơn. Trong hình, chất (2) đi ra khỏi cột trước, chứng tỏ nó di chuyển nhanh hơn, do đó nó phân cực hơn chất (1).
❌D. Sai. Thứ tự đi ra khỏi cột trong sắc ký cột phụ thuộc vào tương tác giữa các chất với pha tĩnh và pha động, không phụ thuộc vào khối lượng riêng.
❌A. Sai. Pha động là dung môi, là chất lỏng hoặc khí mang các chất cần tách qua pha tĩnh. Alumina và silica là pha tĩnh, là chất rắn được sử dụng để hấp phụ các chất.
✔️B. Đúng. Chất nào tương tác tốt hơn với pha động (dung môi) sẽ di chuyển nhanh hơn và do đó đi ra khỏi cột trước.
✔️C. Đúng. Trong sắc ký cột, chất phân cực sẽ tương tác tốt hơn với dung môi phân cực và di chuyển nhanh hơn. Trong hình, chất (2) đi ra khỏi cột trước, chứng tỏ nó di chuyển nhanh hơn, do đó nó phân cực hơn chất (1).
❌D. Sai. Thứ tự đi ra khỏi cột trong sắc ký cột phụ thuộc vào tương tác giữa các chất với pha tĩnh và pha động, không phụ thuộc vào khối lượng riêng.
Câu 20 [705948]: Tiến hành thí nghiệm theo bước sau:
∎ Bước 1: Cho vào ống nghiệm 1 mL dung dịch AgNO3 1 %.
∎ Bước 2: Thêm tiếp từ từ từng giọt dung dịch NH3 5 % và lắc đều đến khi kết tủa vừa tan hết.
∎ Bước 3: Tiếp tục thêm vào ống nghiệm 1 mL dung dịch glucose 2 %, lắc đều rồi để ống nghiệm cố định trong cốc nước nóng.
∎ Bước 1: Cho vào ống nghiệm 1 mL dung dịch AgNO3 1 %.
∎ Bước 2: Thêm tiếp từ từ từng giọt dung dịch NH3 5 % và lắc đều đến khi kết tủa vừa tan hết.
∎ Bước 3: Tiếp tục thêm vào ống nghiệm 1 mL dung dịch glucose 2 %, lắc đều rồi để ống nghiệm cố định trong cốc nước nóng.
Phân tích các đáp án:
✔️A. Đúng. Nồng độ dung dịch AgNO3 không ảnh hưởng đến bản chất phản ứng, chỉ ảnh hưởng đến lượng kết tủa tạo thành. Dung dịch 2% vẫn hoạt động tốt trong phản ứng tráng bạc.
✔️B. Đúng. Khi thêm NH3 vào dung dịch AgNO3, kết tủa AgOH được hình thành:
AgNO3 + NH3 + H2O → AgOH + NH4NO3
Sau đó, AgOH tan ra do tạo phức chất tan [Ag(NH3)2]OH: AgOH + 2NH3 → [Ag(NH3)2]OH
✔️C. Đúng. Nhiệt độ tăng làm tăng tốc độ phản ứng hóa học, bao gồm cả phản ứng oxi hóa khử giữa glucose và ion Ag+.
✔️D. Đúng. Glucose có thể tồn tại ở cả dạng mạch hở và mạch vòng. Tuy nhiên, chỉ dạng mạch hở có nhóm chức aldehyde (-CHO) mới có khả năng tham gia phản ứng tráng bạc. Phản ứng tráng bạc chứng minh sự tồn tại của nhóm aldehyde, do đó chứng minh glucose có tồn tại ở dạng mạch hở.
✔️A. Đúng. Nồng độ dung dịch AgNO3 không ảnh hưởng đến bản chất phản ứng, chỉ ảnh hưởng đến lượng kết tủa tạo thành. Dung dịch 2% vẫn hoạt động tốt trong phản ứng tráng bạc.
✔️B. Đúng. Khi thêm NH3 vào dung dịch AgNO3, kết tủa AgOH được hình thành:
AgNO3 + NH3 + H2O → AgOH + NH4NO3
Sau đó, AgOH tan ra do tạo phức chất tan [Ag(NH3)2]OH: AgOH + 2NH3 → [Ag(NH3)2]OH
✔️C. Đúng. Nhiệt độ tăng làm tăng tốc độ phản ứng hóa học, bao gồm cả phản ứng oxi hóa khử giữa glucose và ion Ag+.
✔️D. Đúng. Glucose có thể tồn tại ở cả dạng mạch hở và mạch vòng. Tuy nhiên, chỉ dạng mạch hở có nhóm chức aldehyde (-CHO) mới có khả năng tham gia phản ứng tráng bạc. Phản ứng tráng bạc chứng minh sự tồn tại của nhóm aldehyde, do đó chứng minh glucose có tồn tại ở dạng mạch hở.
Câu 21 [705949]: Hợp chất nhôm chloride, AlCl3, được tạo thành từ một kim loại và một phi kim nên có thể thấy liên kết của nó là liên kết ion. Tuy nhiên, ở trong pha khí, nó tồn tại dưới dạng dimer hóa là Al2Cl6. Khi này, liên kết tồn tại trong phân tử lại là liên kết cộng hóa trị.
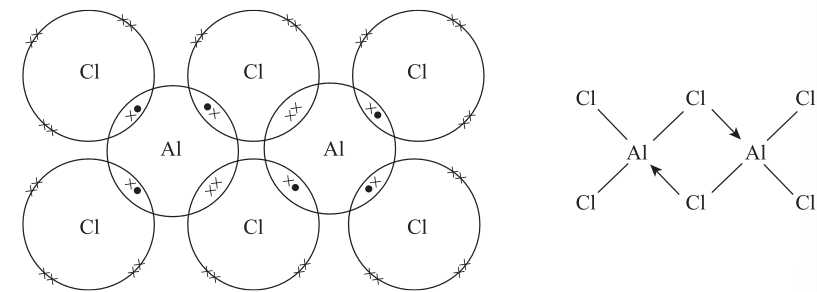

Phân tích các phát biểu:
✔️A. Đúng. Ở trạng thái rắn, AlCl3 tồn tại dưới dạng mạng tinh thể ion. Nhôm (Al) nhường 3 electron tạo cation Al3+, clo (Cl) nhận 1 electron tạo anion Cl-. Lực hút tĩnh điện giữa các ion trái dấu tạo thành liên kết ion.
✔️B. Đúng. Trong Al2Cl6, có hai nguyên tử clo đóng vai trò "cầu nối" giữa hai nguyên tử nhôm. Mỗi nguyên tử Chlorine này cung cấp một cặp electron cho cả hai nguyên tử nhôm, tạo thành liên kết cộng hóa trị phối hợp. Nhôm nhận cặp electron này từ clo.
✔️C. Đúng. Trong Al2Cl6, có 6 liên kết Al-Cl thông thường và 2 liên kết Al-Cl cầu nối. Mỗi liên kết cộng hóa trị có 2 electron. Vậy tổng số electron tham gia tạo liên kết là (6 + 2) × 2 = 16 electron.
❌D. Sai. Trong Al2Cl6, có 2 nguyên tử Cl đóng vai trò cầu nối. Mỗi nguyên tử Cl này tham gia vào 2 liên kết với 2 nguyên tử Al. Do đó, chúng chỉ còn 2 cặp electron riêng chưa tham gia liên kết. 4 nguyên tử Cl còn lại chỉ tham gia vào 1 liên kết với Al, nên chúng còn 3 cặp electron riêng.
✔️A. Đúng. Ở trạng thái rắn, AlCl3 tồn tại dưới dạng mạng tinh thể ion. Nhôm (Al) nhường 3 electron tạo cation Al3+, clo (Cl) nhận 1 electron tạo anion Cl-. Lực hút tĩnh điện giữa các ion trái dấu tạo thành liên kết ion.
✔️B. Đúng. Trong Al2Cl6, có hai nguyên tử clo đóng vai trò "cầu nối" giữa hai nguyên tử nhôm. Mỗi nguyên tử Chlorine này cung cấp một cặp electron cho cả hai nguyên tử nhôm, tạo thành liên kết cộng hóa trị phối hợp. Nhôm nhận cặp electron này từ clo.
✔️C. Đúng. Trong Al2Cl6, có 6 liên kết Al-Cl thông thường và 2 liên kết Al-Cl cầu nối. Mỗi liên kết cộng hóa trị có 2 electron. Vậy tổng số electron tham gia tạo liên kết là (6 + 2) × 2 = 16 electron.
❌D. Sai. Trong Al2Cl6, có 2 nguyên tử Cl đóng vai trò cầu nối. Mỗi nguyên tử Cl này tham gia vào 2 liên kết với 2 nguyên tử Al. Do đó, chúng chỉ còn 2 cặp electron riêng chưa tham gia liên kết. 4 nguyên tử Cl còn lại chỉ tham gia vào 1 liên kết với Al, nên chúng còn 3 cặp electron riêng.
Câu 22 [706029]: Hydrogen peroxide, H2O2, là một chất khử trùng thông thường. Hydrogen peroxide tinh khiết là một chất oxi hóa rất mạnh, và do đó nó được pha loãng với nước để tạo thành dung dịch với phần trăm H2O2 thấp hơn trước khi được đóng chai và bán ra ngoài. Một phương pháp để xác định nồng độ chính xác của H2O2, trong một chai hydrogen peroxide là chuẩn độ bằng dung dịch potassium permanganate đã được acid hóa. Điều này gây ra các phản ứng oxy hóa khử sau đây:
• Khử: 8H+(aq) + MnO4–(aq) + 5e ⟶ Mn2+(aq) + 4H2O(l)
• Oxi hóa: H2O2(aq) ⟶ 2H+(aq) + O2(g) + 2e
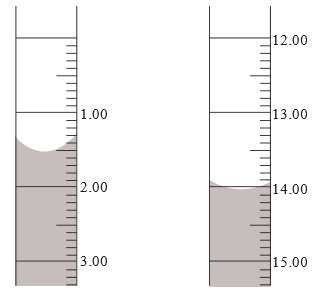
Trong quá trình chuẩn độ, một học sinh lấy 5,0 mL dung dịch hydrogen peroxide vào một bình tam giác, pha loãng nó thành 50,0 mL bằng nước cất. Sau đó, học sinh chuẩn độ dung dịch potassium permanganate 0,150 M vào bình trong khi khuấy liên tục.
Thể tích của dung dịch potassium permanganate trong burette trước và sau quá trình chuẩn độ được biểu diễn như sau:
• Khử: 8H+(aq) + MnO4–(aq) + 5e ⟶ Mn2+(aq) + 4H2O(l)
• Oxi hóa: H2O2(aq) ⟶ 2H+(aq) + O2(g) + 2e
Trong quá trình chuẩn độ, một học sinh lấy 5,0 mL dung dịch hydrogen peroxide vào một bình tam giác, pha loãng nó thành 50,0 mL bằng nước cất. Sau đó, học sinh chuẩn độ dung dịch potassium permanganate 0,150 M vào bình trong khi khuấy liên tục.
Thể tích của dung dịch potassium permanganate trong burette trước và sau quá trình chuẩn độ được biểu diễn như sau:

Phân tích các phát biểu:
✔️(a) – Đúng. Mức ban đầu ở vach 1,5 mL sau khi kết thúc chuẩn độ lượng KMnO4 ở vạch 14 mL tức lượng KMnO4 đã sửa dụng là 12,5 mL.
❌(b) – Sai.
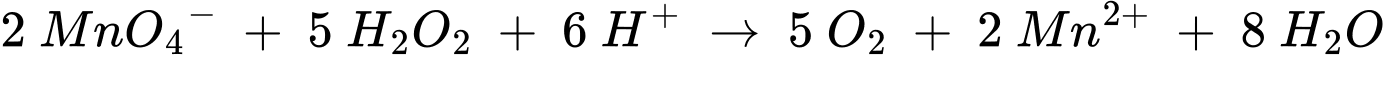
Đổi 12,5 mL = 0,0125 L; 5 mL = 0,005 L
Số mol của KMnO4 là nKMnO4 = 0,0125.0,15 = 0,001875 mol
Từ phương trình hóa học số mol của H2O2 là 0,0046875 mol
Nồng độ ban đầu của H2O2 là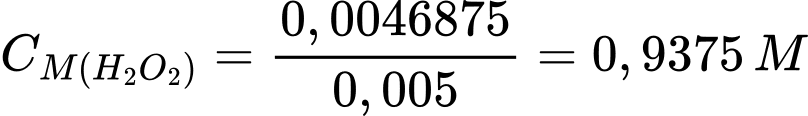
✔️(c) – Đúng. Khi nhỏ thêm KMnO4 vào thì dung dịch KMnO4 phản ứng với H2O2 tạo dung dịch trong suốt khi chưa đến điểm tương đương, Khi đến điểm tương đương thì dung dịch có màu hồng nhạt.
✔️(d) - Đúng .
Giả sử a mol H2O2 trong môi trường aicd => 0,4 mol KMnO4
a mol H2O2 trong môi trường base => 2 mol KMnO4
Vậy trong môi trường base cần dùng lượng lớn hơn.
✔️(a) – Đúng. Mức ban đầu ở vach 1,5 mL sau khi kết thúc chuẩn độ lượng KMnO4 ở vạch 14 mL tức lượng KMnO4 đã sửa dụng là 12,5 mL.
❌(b) – Sai.
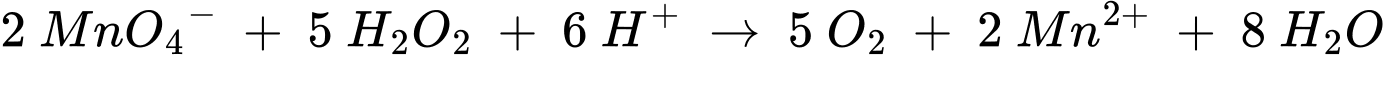
Đổi 12,5 mL = 0,0125 L; 5 mL = 0,005 L
Số mol của KMnO4 là nKMnO4 = 0,0125.0,15 = 0,001875 mol
Từ phương trình hóa học số mol của H2O2 là 0,0046875 mol
Nồng độ ban đầu của H2O2 là
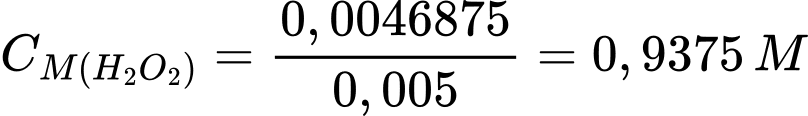
✔️(c) – Đúng. Khi nhỏ thêm KMnO4 vào thì dung dịch KMnO4 phản ứng với H2O2 tạo dung dịch trong suốt khi chưa đến điểm tương đương, Khi đến điểm tương đương thì dung dịch có màu hồng nhạt.
✔️(d) - Đúng .
Giả sử a mol H2O2 trong môi trường aicd => 0,4 mol KMnO4
a mol H2O2 trong môi trường base => 2 mol KMnO4
Vậy trong môi trường base cần dùng lượng lớn hơn.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705950]: Ở 20°C, độ tan của Ca(OH)2 trong nước là 0,173g trong 100g nước. Giả sử khối lượng riêng của dung dịch là 1g/mL. Tính nồng độ mol của dung dịch Ca(OH)2 bão hòa ở nhiệt độ 20°C (Làm tròn đến hàng phần trăm).
Khối lượng dung dịch Ca(OH)2 là mdd = 0,173 + 100 = 100,173 gam
Thể tích dung dịch Ca(OH)2 là Vdd = 100,173 mL = 0,100173 L
Số mol của Ca(OH)2 là nCa(OH)2 = 0,173 : 74 = 0,002334 mol
Nồng độ dung dịch Ca(OH)2 là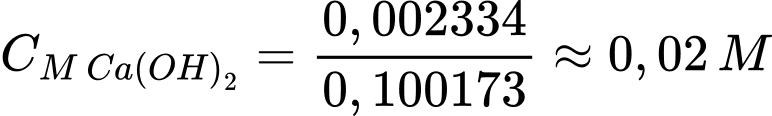
⟹Điền đáp án : 0,02
Thể tích dung dịch Ca(OH)2 là Vdd = 100,173 mL = 0,100173 L
Số mol của Ca(OH)2 là nCa(OH)2 = 0,173 : 74 = 0,002334 mol
Nồng độ dung dịch Ca(OH)2 là
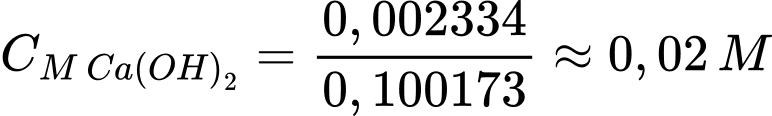
⟹Điền đáp án : 0,02
Câu 24 [973668]: [TN THPT 2020 – Đ2]: Hòa tan Fe3O4 bằng lượng vừa đủ dung dịch H2SO4 loãng, thu được dung dịch X. Có bao nhiêu chất khi cho vào X thì xảy ra phản ứng hóa học trong các chất: NaOH, Ag, Ba(NO3)2, NaCl?
HD: Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O.
Vừa đủ nên dung dịch X thu được gồm FeSO4 và Fe2(SO4)3.
Phân tích các chất trong dãy:
✔️ NaOH cung cấp OH– để tạo kết tủa Fe(OH)2↓ và Fe(OH)3.
❌ Ag không phản ứng được với cả FeSO4 và Fe2(SO4)3.
✔️ Ba(NO3)2 cung cấp Ba2+ tạo kết tủa BaSO4↓.
❌ NaCl không có phản ứng với cả FeSO4 và Fe2(SO4)3.
⇝ có 2/4 chất thỏa mãn yêu cầu .
Điền đáp án : 2
Vừa đủ nên dung dịch X thu được gồm FeSO4 và Fe2(SO4)3.
Phân tích các chất trong dãy:
✔️ NaOH cung cấp OH– để tạo kết tủa Fe(OH)2↓ và Fe(OH)3.
❌ Ag không phản ứng được với cả FeSO4 và Fe2(SO4)3.
✔️ Ba(NO3)2 cung cấp Ba2+ tạo kết tủa BaSO4↓.
❌ NaCl không có phản ứng với cả FeSO4 và Fe2(SO4)3.
⇝ có 2/4 chất thỏa mãn yêu cầu .
Điền đáp án : 2
Câu 25 [705951]: Một loại chất béo có chứa 70% triolein về khối lượng. Để sản xuất 3,6 triệu hộp kem dưỡng da (có chứa chất dưỡng ẩm glycerol) cần dùng tối thiểu a tấn loại chất béo trên cho phản ứng với dung dịch NaOH, đun nóng. Biết rằng trong mỗi hộp kem dưỡng da có chứa 10 gam glycerol. Giá trị của a là bao nhiêu (Làm tròn đến số nguyên)?
Khối lượng glycerol có trong 3,6 triệu hộp kem là
mglycerol = 3600000.10 = 36000000 gam = 36 tấn
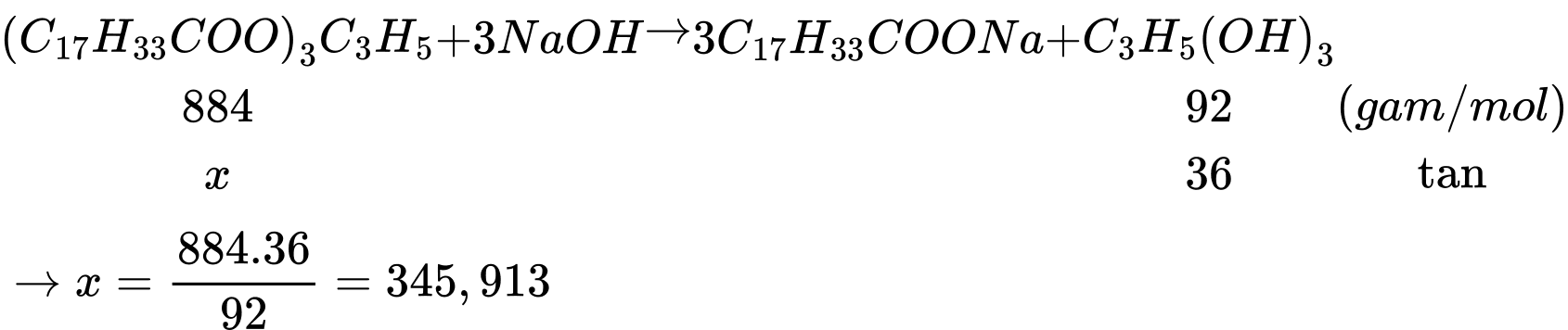
Khối lượng của chất béo là 345,913:70% ≈ 494 tấn
⟹Điền đáp án : 494
mglycerol = 3600000.10 = 36000000 gam = 36 tấn
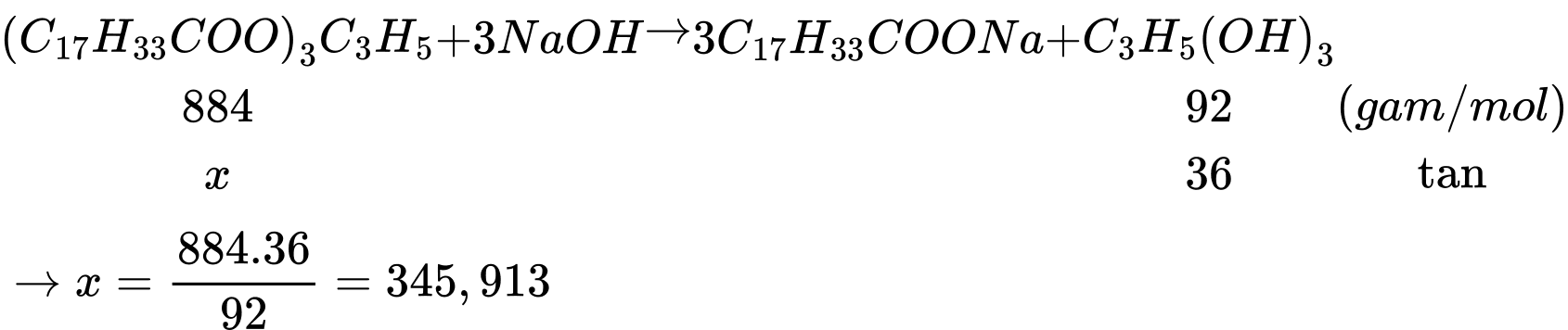
Khối lượng của chất béo là 345,913:70% ≈ 494 tấn
⟹Điền đáp án : 494
Câu 26 [705952]: Chlorogenic acid được tìm thấy trong thực vật, trái cây. Nó có khả năng bảo vệ trong các bệnh tim mạch, tiểu đường loại 2 và các tình trạng liên quan đến viêm.
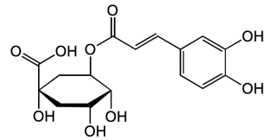
Một mol chlorogenic acid phản ứng được với tối đa bao nhiêu mol NaOH?

Một mol chlorogenic acid phản ứng được với tối đa bao nhiêu mol NaOH?
Chlorogenic acid có 1 nhóm chức ester, 1 nhóm chức carboxylic acid và 2 nhóm chức phenol nên 1 mol Chlorogenic acid sẽ phản ứng với 4 mol NaOH.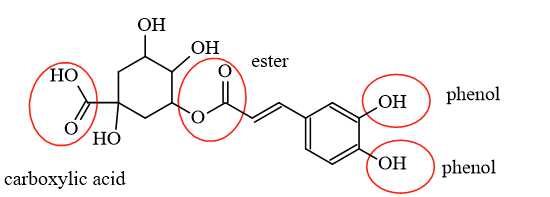
⟹Điền đáp án : 4
Câu 27 [705953]: Hợp chất A là một carboxylic acid đơn chức. Chuẩn bị một mẫu 250 mL dung dịch A bằng cách hòa tan 10,8 g A trong nước. Trong một phép chuẩn độ, 25,00 mL dung dịch NaOH 0,500 M được trung hòa bằng chính xác 21,40 mL dung dịch A. Phân tử khối của carboxylic acid A là bao nhiêu g/mol (Làm tròn đến số nguyên).
RCOOH + NaOH ⟶ RCOONa + H2O
nNaOH = 25 × 0,5 : 1000 = 0,0125 mol = n RCOOH
Trong 21,4 mL dung dịch A ⟶ 0,0125 mol
Trong 250 mL dung dịch A ⟶ 0,146028 mol.
MA = 10,8 : 0,146028 = 73,9 = 74 ( C2H5COOH )
⟹Điền đáp án : 74
nNaOH = 25 × 0,5 : 1000 = 0,0125 mol = n RCOOH
Trong 21,4 mL dung dịch A ⟶ 0,0125 mol
Trong 250 mL dung dịch A ⟶ 0,146028 mol.
MA = 10,8 : 0,146028 = 73,9 = 74 ( C2H5COOH )
⟹Điền đáp án : 74
Câu 28 [705954]: Muối ăn khi khai thác từ nước biển, mỏ muối, hồ muối thường có lẫn nhiều tạp chất như MgCl2, CaCl2, CaSO4 làm cho muối có vị đắng chát và dễ bị chảy nước gây ảnh hưởng xấu tới chất lượng muối. Một trong những phương pháp loại bỏ tạp chất ở muối ăn là dùng hỗn hợp A gồm Na2CO3, NaOH, BaCl2 tác dụng với dung dịch nước muối để loại tạp chất dưới dạng các chất kết tủa CaCO3, Mg(OH)2, BaSO4. Một mẫu muối thô thu được bằng phương pháp bay hơi nước biển có thành phần khối lượng như sau: 95,68% NaCl; 0,35% MgCl2; 1,68% CaSO4; 0,61% CaCl2; 1,68% H2O. Hỏi cần dùng bao nhiêu kg hỗn hợp A để loại bỏ hết tạp chất có trong 6 tấn muối nói trên (Làm tròn đến số nguyên).
A gồm : Na2CO3 , NaOH , BaCl2
⟶ CaCO3 , Mg(OH)2 , BaSO4
Các phản ứng xảy ra:
MgCl2 + 2NaOH ⟶ Mg(OH)2 + 2NaCl
CaCl2 + Na2CO3 ⟶ CaCO3 + 2NaCl
CaSO4 + BaCl2 ⟶ BaSO4 + CaCl2
m MgCl2 = 0,35 : 100 × 6000 = 21 g ⟶ n MgCl2 = 21/95 mol
⟶ n NaOH = 42/95 mol
m CaSO4 = 1.68 × 6000 = 100,8 g ⟶ n CaSO4 = 63/85 mol = n BaCl2
m CaCl2 = 36,6 g ⟶ n CaCl2 = 61/185 mol = n Na2CO3
mA = m Na2CO3+ m NaOH + m BaCl2
= 106 × 61/185 + 42/95 × 40 + 63/85 × 208 = 207 kg
⟹Điền đáp án : 207
⟶ CaCO3 , Mg(OH)2 , BaSO4
Các phản ứng xảy ra:
MgCl2 + 2NaOH ⟶ Mg(OH)2 + 2NaCl
CaCl2 + Na2CO3 ⟶ CaCO3 + 2NaCl
CaSO4 + BaCl2 ⟶ BaSO4 + CaCl2
m MgCl2 = 0,35 : 100 × 6000 = 21 g ⟶ n MgCl2 = 21/95 mol
⟶ n NaOH = 42/95 mol
m CaSO4 = 1.68 × 6000 = 100,8 g ⟶ n CaSO4 = 63/85 mol = n BaCl2
m CaCl2 = 36,6 g ⟶ n CaCl2 = 61/185 mol = n Na2CO3
mA = m Na2CO3+ m NaOH + m BaCl2
= 106 × 61/185 + 42/95 × 40 + 63/85 × 208 = 207 kg
⟹Điền đáp án : 207