PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705981]: “ Phương pháp thủy luyện thường được dùng để tách những kim loại hoạt động hoá học ..(1).. ra khỏi dung dịch ..(2).. của chúng bằng các kim loại có tính khử mạnh hơn. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, mạnh, muối.
B, yếu, acid.
C, trung bình, base.
D, yếu, muối.
Kim loại có hoạt động hóa học yếu thường được tách ra khỏi dung dịch.
Dung dịch chứa kim loại thường là muối của kim loại đó.
“ Phương pháp thủy luyện thường được dùng để tách những kim loại hoạt động hoá học yếu ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh hơn.
⟹Chọn đáp án D Đáp án: D
Dung dịch chứa kim loại thường là muối của kim loại đó.
“ Phương pháp thủy luyện thường được dùng để tách những kim loại hoạt động hoá học yếu ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh hơn.
⟹Chọn đáp án D Đáp án: D
Câu 2 [705982]: Các mỏ lớn sodium nitrate (diêm tiêu Chile) được tìm thấy nhiều ở Chile. Nó phân hủy ở khoảng 500°C với sự giải phóng muối X và khí oxygen. Công thức hóa học của X là
A, NaNO3.
B, NaNO2.
C, Na2CO3.
D, Na2O.
- Sodium nitrate là hợp chất hoá học có công thức NaNO3. Muối này còn được biết đến với cái tên diêm tiêu Chile hay diêm tiêu Peru (do hai nơi này có lượng trầm tích lớn nhất) để phân biệt với potasium nitrate, là một chất rắn màu trắng tan trong nước.
- Sodium nitrate được dùng trong phạm vi rộng như là một loại phân bón và nguyên liệu thô cho quá trình sản xuất thuốc súng vào cuối thế kỷ 19. Nó có thể kết hợp với iron(II) hydroxide để tạo nhựa thông.
NaNO3 ⟶ NaNO2 + O2
⟹Chọn đáp án B Đáp án: B
- Sodium nitrate được dùng trong phạm vi rộng như là một loại phân bón và nguyên liệu thô cho quá trình sản xuất thuốc súng vào cuối thế kỷ 19. Nó có thể kết hợp với iron(II) hydroxide để tạo nhựa thông.
NaNO3 ⟶ NaNO2 + O2
⟹Chọn đáp án B Đáp án: B
Câu 3 [705983]: Carbohydrate là hợp chất hữu cơ
A, đa chức, đa số có công thức chung là Cn(H2O)m.
B, tạp chức, đa số có công thức chung là Cn(H2O)m.
C, chứa nhiều nhóm hydroxy và nhóm carboxyl.
D, chứa nhiều nhóm hydroxy và nhiều nhóm carbonyl.
Phân tích các phát biểu :
❌A. Carbohydrate có nhiều nhóm chức như nhóm hydroxyl (-OH) và nhóm carbonyl (C=O), nhưng cách gọi "đa chức" không chính xác bằng "tạp chức".
✔️B. Carbohydrate là hợp chất tạp chức vì chứa nhiều nhóm chức khác nhau (hydroxyl, carbonyl).
❌C. Carbohydrate chủ yếu chứa nhóm hydroxyl (-OH) và nhóm carbonyl (C=O) (bao gồm nhóm aldehyde -CHO hoặc ketone >C=O), không phải nhóm carboxyl (-COOH)
❌D. Một phân tử carbohydrate chỉ có một nhóm carbonyl (ở dạng aldehyde hoặc ketone), không có "nhiều nhóm carbonyl"
⟹Chọn đáp án B Đáp án: B
❌A. Carbohydrate có nhiều nhóm chức như nhóm hydroxyl (-OH) và nhóm carbonyl (C=O), nhưng cách gọi "đa chức" không chính xác bằng "tạp chức".
✔️B. Carbohydrate là hợp chất tạp chức vì chứa nhiều nhóm chức khác nhau (hydroxyl, carbonyl).
❌C. Carbohydrate chủ yếu chứa nhóm hydroxyl (-OH) và nhóm carbonyl (C=O) (bao gồm nhóm aldehyde -CHO hoặc ketone >C=O), không phải nhóm carboxyl (-COOH)
❌D. Một phân tử carbohydrate chỉ có một nhóm carbonyl (ở dạng aldehyde hoặc ketone), không có "nhiều nhóm carbonyl"
⟹Chọn đáp án B Đáp án: B
Câu 4 [308734]: Đun nóng chất hữu cơ X trong dung dịch NaOH, thu được ethyl alcohol, NaCl, H2O và muối sodium của alanine. Công thức của X là
A, H2NC(CH3)2COOC2H5.
B, ClH3NCH(CH3)COOC2H5.
C, H2NCH(CH3)COOC2H5.
D, ClH3NCH2COOC2H5.
Phương trình phản ứng:
X + NaOH → H2NC2H4COONa + NaCl + C2H5OH + H2O
⇒ X có CTCT là: ClH3NCH(CH3)COOC2H5
⟹Chọn đáp án B Đáp án: B
X + NaOH → H2NC2H4COONa + NaCl + C2H5OH + H2O
⇒ X có CTCT là: ClH3NCH(CH3)COOC2H5
⟹Chọn đáp án B Đáp án: B
Câu 5 [705984]: Để bảo vệ đường ống dẫn nước ngầm làm bằng thép, người ta thường gắn thêm các thanh kẽm lên ống. Điều này được giải thích là vì
A, kẽm bị ăn mòn trước, bảo vệ thép.
B, kẽm làm tăng độ bền cơ học cho thép.
C, ngăn chặn thép tiếp xúc với nước.
D, tăng khả năng dẫn điện của đường ống.
Chống ăn mòn kim loại: Phương pháp điện hoá: Nối kim loại cần bảo vệ với một kim loại hoạt động hoá học mạnh hơn.
Kẽm có độ hoạt động hóa học mạnh hơn Fe (có trong ống thép) nên kẽm sẽ bị ăn mòn trước.
⟹Chọn đáp án A Đáp án: A
Kẽm có độ hoạt động hóa học mạnh hơn Fe (có trong ống thép) nên kẽm sẽ bị ăn mòn trước.
⟹Chọn đáp án A Đáp án: A
Câu 6 [705985]: Magnalium là hợp kim có độ bền cao, mật độ thấp và khả năng chống ăn mòn nên nó được sử dụng trong chế tạo máy bay và các bộ phận ô tô. Thành phần của hợp kim Magnalium là
A, Mg và Zn.
B, Mg và Al.
C, Cu và Zn.
D, Mg và Cu.
- Magnalium là một hợp kim được tạo thành từ Aluminium và magnessium, thường được sử dụng trong các ứng dụng công nghiệp nhờ vào tính nhẹ và bền của nó. Hợp kim này thường có đặc tính chống ăn mòn tốt, dễ gia công và có thể được sử dụng trong sản xuất các sản phẩm như máy bay, ô tô, cũng như các thiết bị thể thao.
⟹Chọn đáp án B Đáp án: B
⟹Chọn đáp án B Đáp án: B
Câu 7 [705986]: Đốt cháy hoàn toàn 1 mol ester X thu được tối đa 4 mol CO2 và 4 mol H2O. Công thức phân tử của X là
A, C4H8O2.
B, C5H10O2.
C, C6H12O2.
D, C3H6O2.
Ta có nCO2 = nH2O = 4 mol
→ ester X là ester no, đơn chức, mạch hở.
Gọi công thức chung của X là CnH2nO2
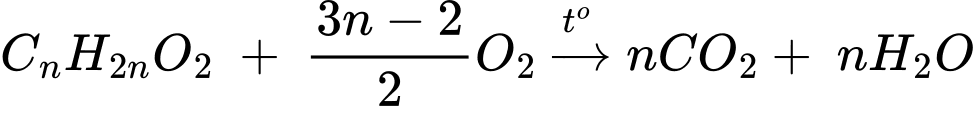
Ta có: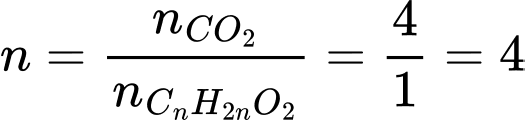
Công thức phân tử của X là C4H8O2
⟹Chọn đáp án A Đáp án: A
→ ester X là ester no, đơn chức, mạch hở.
Gọi công thức chung của X là CnH2nO2
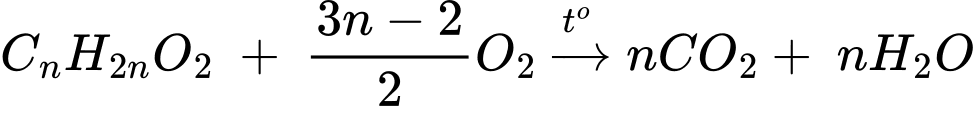
Ta có:
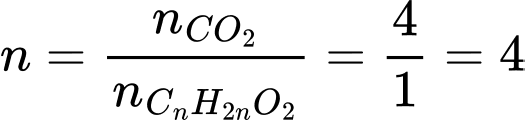
Công thức phân tử của X là C4H8O2
⟹Chọn đáp án A Đáp án: A
Câu 8 [705987]: Tiến hành thí nghiệm:
∎ Bước 1: Thêm hexane (chất lỏng không phân cực) vào dung dịch nước iodine, lắc đều rồi để yên.
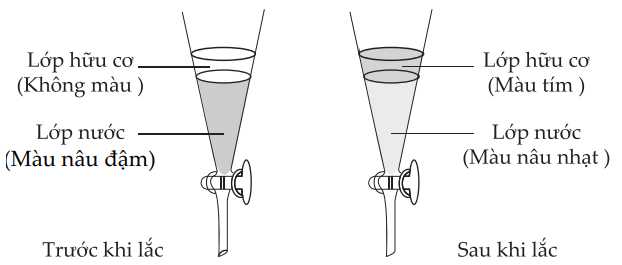
∎ Bước 2: Sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine.
Phát biểu nào sau đây không đúng?
∎ Bước 1: Thêm hexane (chất lỏng không phân cực) vào dung dịch nước iodine, lắc đều rồi để yên.

∎ Bước 2: Sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine.
Phát biểu nào sau đây không đúng?
A, Phương pháp chiết đã được sử dụng trong thí nghiệm trên.
B, Trước khi lắc, lớp hữu cơ không chứa iodine.
C, Sau khi lắc và để yên, toàn bộ iodine được chuyển lên lớp hữu cơ.
D, Để thu được lớp hữu cơ cần mở van và loại bỏ lớp nước ở bên dưới trước.
Phân tích các đáp án :
✔️A – Đúng. Chiết chất từ môi trường lỏng (chiết lỏng – lỏng): Cho dung dd chứa chất cần chiết vào phểu chiết, thêm dung môi cần dùng để chiết, lắc đều phểu chiết, để yên rồi dung dịch sẽ tách thành 2 lớp. Mở khóa phễu chiết sẽ thu được 2 chất lỏng riêng biệt.
✔️B – Đúng. Trước khi lắc, lớp hữu cơ không màu chứng tỏ chưa có iodine tan trong lớp hữu cơ.
❌C – Sai. Sau khi lắc và để yên, một phần iodine được chuyển lên lớp hữu cơ.
✔️D – Đúng. Khi mở van lớp nước ở dưới chảy ra trước và loại bỏ lớp nước còn lại lớp hữu cơ.
⟹Chọn đáp án C Đáp án: C
✔️A – Đúng. Chiết chất từ môi trường lỏng (chiết lỏng – lỏng): Cho dung dd chứa chất cần chiết vào phểu chiết, thêm dung môi cần dùng để chiết, lắc đều phểu chiết, để yên rồi dung dịch sẽ tách thành 2 lớp. Mở khóa phễu chiết sẽ thu được 2 chất lỏng riêng biệt.
✔️B – Đúng. Trước khi lắc, lớp hữu cơ không màu chứng tỏ chưa có iodine tan trong lớp hữu cơ.
❌C – Sai. Sau khi lắc và để yên, một phần iodine được chuyển lên lớp hữu cơ.
✔️D – Đúng. Khi mở van lớp nước ở dưới chảy ra trước và loại bỏ lớp nước còn lại lớp hữu cơ.
⟹Chọn đáp án C Đáp án: C
Câu 9 [186430]: Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là
A, chất xúc tác cho phản ứng.
B, tạo môi trường trung tính cho phản ứng.
C, làm tăng tốc độ phản ứng.
D, xác định thời điểm khi phản ứng đạt đến khoảng điểm tương đương.
Phân tích các đáp án :
❌A.Sai. Chất chỉ thị không tham gia vào phản ứng dưới vai trò là chất xúc tác. Nó chỉ giúp xác định điểm kết thúc của phản ứng mà không làm thay đổi tốc độ hoặc cơ chế phản ứng.
❌B. Sai. Môi trường của phản ứng phụ thuộc vào acid và base tham gia, không phải do chất chỉ thị quyết định. Chất chỉ thị chỉ thay đổi màu sắc khi môi trường thay đổi, giúp xác định điểm tương đương.
❌C. Sai. Chất chỉ thị không ảnh hưởng đến tốc độ phản ứng giữa acid và base. Phản ứng này diễn ra nhanh chóng mà không cần chất chỉ thị hỗ trợ.
✔️D.Đúng. Chất chỉ thị hoạt động bằng cách thay đổi màu sắc khi dung dịch đạt đến pH nhất định, giúp xác định điểm tương đương trong quá trình chuẩn độ. Đây là vai trò chính của chất chỉ thị trong chuẩn độ acid-base
⟹Chọn đáp án D Đáp án: D
❌A.Sai. Chất chỉ thị không tham gia vào phản ứng dưới vai trò là chất xúc tác. Nó chỉ giúp xác định điểm kết thúc của phản ứng mà không làm thay đổi tốc độ hoặc cơ chế phản ứng.
❌B. Sai. Môi trường của phản ứng phụ thuộc vào acid và base tham gia, không phải do chất chỉ thị quyết định. Chất chỉ thị chỉ thay đổi màu sắc khi môi trường thay đổi, giúp xác định điểm tương đương.
❌C. Sai. Chất chỉ thị không ảnh hưởng đến tốc độ phản ứng giữa acid và base. Phản ứng này diễn ra nhanh chóng mà không cần chất chỉ thị hỗ trợ.
✔️D.Đúng. Chất chỉ thị hoạt động bằng cách thay đổi màu sắc khi dung dịch đạt đến pH nhất định, giúp xác định điểm tương đương trong quá trình chuẩn độ. Đây là vai trò chính của chất chỉ thị trong chuẩn độ acid-base
⟹Chọn đáp án D Đáp án: D
Câu 10 [705988]: Cho các chất sau: C6H5OH, C6H5CH2OH, C2H5OH, HOC6H4OH, CH3C6H4OH, C6H5CH3, C6H5Cl. Có bao nhiêu chất vừa tác dụng với Na, vừa tác dụng với dung dịch NaOH?
A, 2.
B, 3.
C, 5.
D, 4.
Chất có nhóm -OH gắn vào vòng benzen (phenol) mới có thể tác dụng với cả Na và NaOH.
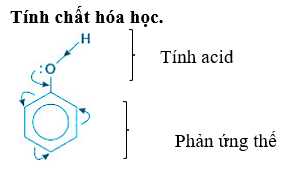
Tính acid của phenol: Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
→ Nên có khả năng tác dụng với Na và NaOH.
Các hợp chất vừa tác dụng với Na, vừa tác dụng với NaOH là C6H5OH, HOC6H4OH, CH3C6H4OH.
Các chất còn lại :
❌C6H5CH2OH (Benzyl alcohol) : Là ancol, không phải phenol → không có tính axit để tác dụng với NaOH.
❌C2H5OH (Ethanol - rượu etylic) : Là ancol → chỉ tác dụng với Na, không tác dụng với NaOH.
❌C6H5CH3 (Toluene); C6H5Cl (Chlorobenzene) : Không có nhóm -OH → không tác dụng với Na hay NaOH.
⟹Chọn đáp án B Đáp án: B

Tính acid của phenol: Phenol thể hiện tính acid yếu. Dung dịch phenol không làm đổi màu quỳ tím.
→ Nên có khả năng tác dụng với Na và NaOH.
Các hợp chất vừa tác dụng với Na, vừa tác dụng với NaOH là C6H5OH, HOC6H4OH, CH3C6H4OH.
Các chất còn lại :
❌C6H5CH2OH (Benzyl alcohol) : Là ancol, không phải phenol → không có tính axit để tác dụng với NaOH.
❌C2H5OH (Ethanol - rượu etylic) : Là ancol → chỉ tác dụng với Na, không tác dụng với NaOH.
❌C6H5CH3 (Toluene); C6H5Cl (Chlorobenzene) : Không có nhóm -OH → không tác dụng với Na hay NaOH.
⟹Chọn đáp án B Đáp án: B
Câu 11 [247277]: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
A, 1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1.
B, 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
C, 1s2 2s2 2p6 3s2 3p2 4s2 3d8.
D, 1s2 2s2 2p6 3s2 3p6 3d5 4s3.
ion R3+ có phân lớp cuối cùng là 3d5 cấu hình này R đã nhường đi 3e. Vậy cấu hình e của R: 1s2 2s2 2p6 3s2 3p6 3d6 4s2
⟹Chọn đáp án B Đáp án: B
⟹Chọn đáp án B Đáp án: B
Câu 12 [705989]: Cho bán phản ứng và giá trị thế điện cực chuẩn như sau:
Fe2+(aq) + 2e ⇌ Fe(s) Eo = –0,44 V
Cu2+(aq) + 2e ⇌ Cu(s) Eo = +0,34 V
Giá trị suất điện động của pin Fe-Cu là
Fe2+(aq) + 2e ⇌ Fe(s) Eo = –0,44 V
Cu2+(aq) + 2e ⇌ Cu(s) Eo = +0,34 V
Giá trị suất điện động của pin Fe-Cu là
A, +1,52 V.
B, +0,78 V.
C, –0,10 V.
D, –0,95 V.
Ta có:
Trong pin Fe - Cu, điện cực Fe đóng vai trò là Anode và Cu đóng vai trò là cathode
Anode (-) : Fe → Fe2+ + 2e
Cathode (+) : Cu2+ + 2e → Cu
→ EPin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V
⟹Chọn đáp án B Đáp án: B
Trong pin Fe - Cu, điện cực Fe đóng vai trò là Anode và Cu đóng vai trò là cathode
Anode (-) : Fe → Fe2+ + 2e
Cathode (+) : Cu2+ + 2e → Cu
→ EPin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V
⟹Chọn đáp án B Đáp án: B
Câu 13 [705990]: Cho các dung dịch sau: hồ tinh bột, methylamine, glucose và glycine được kí hiệu ngẫu nhiên là X1, X2, X3 và X4. Một học sinh tiến hành các thí nghiệm để phân biệt từng chất trong số các chất trên và có kết quả thí nghiệm sau:Cho các phát biểu sau:
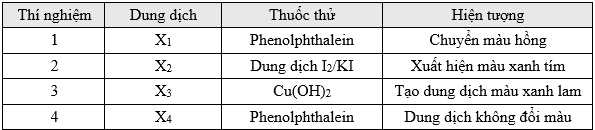
(a) X1 tan trong nước tạo môi trường acid.
(b) Thí nghiệm 2 có xảy ra phản ứng hóa học.
(c) X3 có thể có chứa các nhóm OH liền kề.
(d) X4 là glycine với số nhóm amino bằng nhóm carboxyl.
Các phát biểu đúng là

(a) X1 tan trong nước tạo môi trường acid.
(b) Thí nghiệm 2 có xảy ra phản ứng hóa học.
(c) X3 có thể có chứa các nhóm OH liền kề.
(d) X4 là glycine với số nhóm amino bằng nhóm carboxyl.
Các phát biểu đúng là
A, (a), (c).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu.
❌(a) – Sai. X1 tan trong nước tạo dung dịch kiềm, nguyên do làm phenolphtalein chuyển hồng.
✔️(b) – Đúng. Thí nghiệm 2 có 2 phản ứng : KI + I2 → KI3Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím.
✔️(c) – Đúng. X3 phản ứng với Cu(OH)2 tạo dung dịch màu xanh lam, chứng tỏ X3 có ít nhất 2 nhóm OH liền kề nhau.
✔️(d) – Đúng. Glycine có 1 nhóm NH2 và 1 nhóm COOH.
⟹Chọn đáp án D
Đáp án: D
❌(a) – Sai. X1 tan trong nước tạo dung dịch kiềm, nguyên do làm phenolphtalein chuyển hồng.
✔️(b) – Đúng. Thí nghiệm 2 có 2 phản ứng : KI + I2 → KI3Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím.
✔️(c) – Đúng. X3 phản ứng với Cu(OH)2 tạo dung dịch màu xanh lam, chứng tỏ X3 có ít nhất 2 nhóm OH liền kề nhau.
✔️(d) – Đúng. Glycine có 1 nhóm NH2 và 1 nhóm COOH.
⟹Chọn đáp án D
Đáp án: D
Câu 14 [705991]: “Khi đun poly(vinyl acetate) trong dung dịch NaOH thu được ..(1).. và sodium acetate. Khi đó xảy ra phản ứng ..(2).. mạch polymer”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, poly(vinyl alcohol), giảm mạch.
B, poly(vinyl alcohol), tăng mạch.
C, poly(vinyl alcohol), giữ nguyên.
D, poly(allyl alcohol), giảm mạch.
Các nhóm thế đính vào mạch Polymer có thể tham gia phản ứng mà không làm thay đổi mạch Polymer.
Thí dụ: Poly (vinyl acetate) bị thủy phân cho poly (vinyl ancohol).
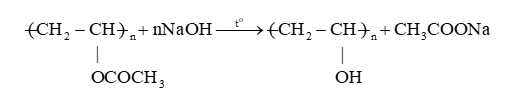
Những Polymer có liên kết đôi trong mạch có thể tham gia phản ứng cộng vào liên kết đôi mà không làm thay đổi mạch cacbon. Phản ứng có thể xảy ra ở nhóm thế đính vào mạch polymer.
“Khi đun poly(vinyl acetate) trong dung dịch NaOH thu được poly(vinyl alcohol) và sodium acetate. Khi đó xảy ra phản ứng giữ nguyên mạch polymer”
⟹Chọn đáp án C Đáp án: C
Thí dụ: Poly (vinyl acetate) bị thủy phân cho poly (vinyl ancohol).
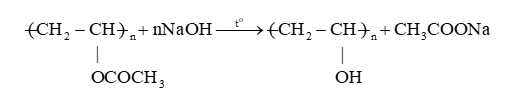
Những Polymer có liên kết đôi trong mạch có thể tham gia phản ứng cộng vào liên kết đôi mà không làm thay đổi mạch cacbon. Phản ứng có thể xảy ra ở nhóm thế đính vào mạch polymer.
“Khi đun poly(vinyl acetate) trong dung dịch NaOH thu được poly(vinyl alcohol) và sodium acetate. Khi đó xảy ra phản ứng giữ nguyên mạch polymer”
⟹Chọn đáp án C Đáp án: C
Câu 15 [705992]: Cho hai quá trình sau:
[Cu(OH2)6]2+(aq) + 2NH3(aq) [Cu(NH3)2(OH2)4]2+(aq) + 2H2O(l)
[Cu(OH2)6]2+(aq) + en(aq) [Cu(en)(OH2)4]2+(aq) + 2H2O(l)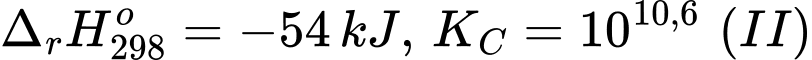
Trong đó, en là ethylenediamine. Phân tử này đã dùng tất cả các cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation Cu2+. Cho các phát biểu sau:
(a) Quá trình (II) thuận lợi hơn quá trình (I) về năng lượng.
(b) Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất bền hơn so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en.
(c) Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en)(OH2)4]2+ đều có 6 liên kết σ.
(d) Phản ứng diễn ra ở quá trình (I) và (II) đều có sự tạo thành phức chất không tan và có sự biến đổi màu sắc.Các phát biểu đúng là
[Cu(OH2)6]2+(aq) + 2NH3(aq) [Cu(NH3)2(OH2)4]2+(aq) + 2H2O(l)

[Cu(OH2)6]2+(aq) + en(aq) [Cu(en)(OH2)4]2+(aq) + 2H2O(l)
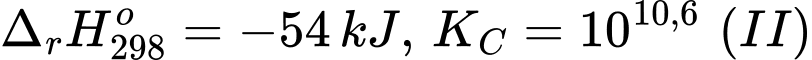
Trong đó, en là ethylenediamine. Phân tử này đã dùng tất cả các cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation Cu2+. Cho các phát biểu sau:
(a) Quá trình (II) thuận lợi hơn quá trình (I) về năng lượng.
(b) Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất bền hơn so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en.
(c) Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en)(OH2)4]2+ đều có 6 liên kết σ.
(d) Phản ứng diễn ra ở quá trình (I) và (II) đều có sự tạo thành phức chất không tan và có sự biến đổi màu sắc.Các phát biểu đúng là
A, (a), (c).
B, (b), (c).
C, (a), (b), (c).
D, (b), (c), (d).
Phân tích các phát biểu :
✔️(a) – Đúng. Quá trình (II) thuận lợi hơn quá trình (I) về mặt năng lượng do có lượng năng lượng tỏa ra lớn hơn và hằng số cân bằng lớn hơn.
❌(b) – Sai. Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất không bền so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en do có hằng số cân bằng 107,7 nhỏ hơn 1010,6 của quá trình (II)
✔️(c) – Đúng. Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en) (OH2)4]2+ đều có 6 liên kết σ, xung quanh nguyên tử trung tâm đều có 6 liên kết cho nhận, NH3 và H2O có dung lượng phối trí là 1 và en có dung lượng phối trí là 2.
❌(d) – Sai. Cả hai quá trình đều tạo ra phức chất tan trong dung dịch. Tuy nhiên, chúng có sự biến đổi màu sắc, do sự thay đổi phối tử xung quanh ion Cu2+
⟹ Có 2 phát biểu đúng là (a),(c)
⟹ Chọn đáp án A Đáp án: A
✔️(a) – Đúng. Quá trình (II) thuận lợi hơn quá trình (I) về mặt năng lượng do có lượng năng lượng tỏa ra lớn hơn và hằng số cân bằng lớn hơn.
❌(b) – Sai. Sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi NH3 tạo ra phức chất không bền so với sự thế H2O trong phức chất [Cu(OH2)6]2+ bởi en do có hằng số cân bằng 107,7 nhỏ hơn 1010,6 của quá trình (II)
✔️(c) – Đúng. Xung quanh nguyên tử trung tâm trong phức chất [Cu(NH3)2(OH2)4]2+ và trong phức chất [Cu(en) (OH2)4]2+ đều có 6 liên kết σ, xung quanh nguyên tử trung tâm đều có 6 liên kết cho nhận, NH3 và H2O có dung lượng phối trí là 1 và en có dung lượng phối trí là 2.
❌(d) – Sai. Cả hai quá trình đều tạo ra phức chất tan trong dung dịch. Tuy nhiên, chúng có sự biến đổi màu sắc, do sự thay đổi phối tử xung quanh ion Cu2+
⟹ Có 2 phát biểu đúng là (a),(c)
⟹ Chọn đáp án A Đáp án: A
Câu 16 [193301]: Xét sự thay đổi enthaly khi phản ứng xảy ra giữa Fe2O3 với kim loại aluminium theo phương trình:
Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(l).
Cho biết enthalpy tạo thành chuẩn của Fe2O3(s) là – 825,5 kJ/mol; của Al2O3(s) là – 1675,7 kJ/mol. Biến thiên enthalpy của phản ứng khi dùng 5,00 g Fe2O3 là
Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(l).
Cho biết enthalpy tạo thành chuẩn của Fe2O3(s) là – 825,5 kJ/mol; của Al2O3(s) là – 1675,7 kJ/mol. Biến thiên enthalpy của phản ứng khi dùng 5,00 g Fe2O3 là
A, – 21,8 kJ.
B, – 26,6 kJ.
C, – 52,4 kJ.
D, – 77,9 kJ.
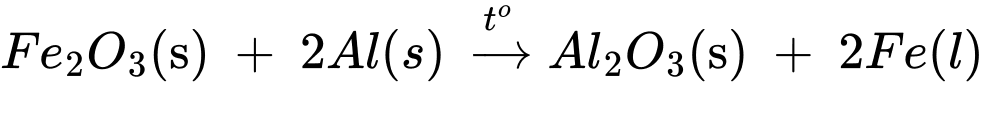
Biến thiên enthalpy của phản ứng trên là
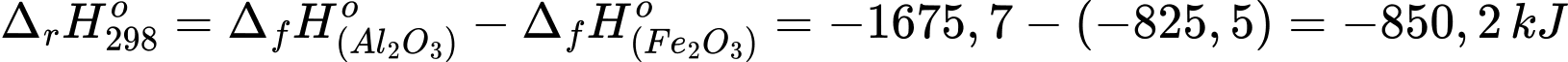
1 mol Fe2O3 khi tham gia phản ứng nhiệt lượng tỏa ra là 850,2 kJ
5 gam Fe2O3 khi tham gia phản ứng nhiệt lượng tỏa ra là
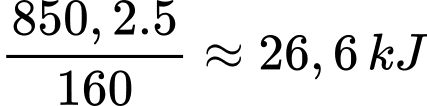
⟹Chọn đáp án B Đáp án: B
Sử dụng thông tin dưới đây, trả lời câu hỏi số 17, 18
Poly(vinyl alcohol) (viết tắt là PVA) được dùng làm chất kết dính, sợi vinylon, vật liệu ứng dụng trong y tế. PVA được tổng hợp theo phương trình
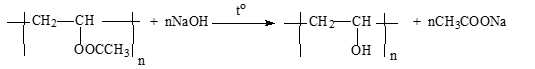

Câu 17 [705993]: Phương trình trên thuộc loại phản ứng
A, tăng mạch polymer.
B, giữ nguyên mạch polymer.
C, cắt mạch polymer.
D, phản ứng ester hóa.
Các nhóm thế đính vào mạch Polymer có thể tham gia phản ứng mà không làm thay đổi mạch Polymer.
Thí dụ: Poly (vinyl acetate) bị thủy phân cho poly (vinyl ancohol).
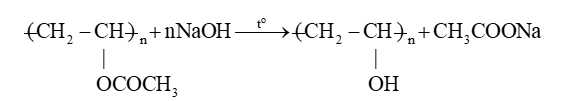
Những Polymer có liên kết đôi trong mạch có thể tham gia phản ứng cộng vào liên kết đôi mà không làm thay đổi mạch cacbon. Phản ứng có thể xảy ra ở nhóm thế đính vào mạch polymer.
⟹Chọn đáp án B Đáp án: B
Thí dụ: Poly (vinyl acetate) bị thủy phân cho poly (vinyl ancohol).
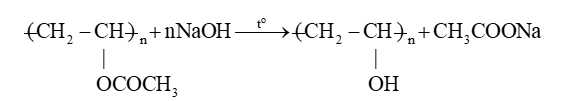
Những Polymer có liên kết đôi trong mạch có thể tham gia phản ứng cộng vào liên kết đôi mà không làm thay đổi mạch cacbon. Phản ứng có thể xảy ra ở nhóm thế đính vào mạch polymer.
⟹Chọn đáp án B Đáp án: B
Câu 18 [705994]: Một đoạn mạch PVA có phân tử khối trung bình là 352000. Số đơn vị mắt xích có trong đoạn mạch trên là
A, 8000.
B, 10000.
C, 6000.
D, 12000.
Số đơn vị mắt xích trong mạch trên là 352000: 44 = 8000
⟹Chọn đáp án A Đáp án: A
⟹Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705995]: Thuốc súng không khói có chứa thành phần cellulose trinitrate, hợp chất này được điều chế trong phòng thí nghiệm theo các bước sau:
∎ Bước 1: Cho 5 mL dung dịch HNO3 65 % vào một cốc khô có dung tích 50 mL rồi đặt cốc vào trong chậu nước đá. Sau khoảng 10 phút, khuấy và thêm từ từ 10 mL dung dịch H2SO4 98 % vào cốc.
∎ Bước 2: Cho một nhúm bông vào cốc, lấy đũa thuỷ tinh dầm cho bông thấm hoá chất. Lấy cốc ra khỏi chậu nước đá và để yên trong 30 phút.
∎ Bước 3: Dùng kẹp lấy miếng bông ra một cốc khác, rửa nhiều lần bằng nước cho đến hết acid (nước rửa không làm đổi màu quỳ tím). Tiếp tục rửa lại bằng dung dịch NaHCO3 loãng rồi lấy miếng bông ra, ép bằng hai tấm giấy lọc đến khô. Để miếng bông này trên đĩa sứ (1) và một miếng bông mới trên đĩa sứ (2). Đốt hai miếng bông.
∎ Bước 1: Cho 5 mL dung dịch HNO3 65 % vào một cốc khô có dung tích 50 mL rồi đặt cốc vào trong chậu nước đá. Sau khoảng 10 phút, khuấy và thêm từ từ 10 mL dung dịch H2SO4 98 % vào cốc.
∎ Bước 2: Cho một nhúm bông vào cốc, lấy đũa thuỷ tinh dầm cho bông thấm hoá chất. Lấy cốc ra khỏi chậu nước đá và để yên trong 30 phút.
∎ Bước 3: Dùng kẹp lấy miếng bông ra một cốc khác, rửa nhiều lần bằng nước cho đến hết acid (nước rửa không làm đổi màu quỳ tím). Tiếp tục rửa lại bằng dung dịch NaHCO3 loãng rồi lấy miếng bông ra, ép bằng hai tấm giấy lọc đến khô. Để miếng bông này trên đĩa sứ (1) và một miếng bông mới trên đĩa sứ (2). Đốt hai miếng bông.
Phân tích các phát biểu :
✔️(a) – Đúng. Ở bước 1 tỏa nhiệt mạnh nên cần phải giảm nhiệt độ thông qua ngâm cốc trong chậu nước đá.
✔️(b) – Đúng. Dung dịch NaHCO3 loãng có tác dụng trung hòa phần acid dư.
NaHCO3 + HNO3 → NaNO3 + H2O + CO2
❌(c) – Sai. Miếng bông trên đĩa sứ (1) cháy nhanh hơn miếng bông đĩa sứ (2) nguyên do miếng 1 có phản ứng tạo thuốc súng không khói
❌(d) – Sai. Phản ứng điều chế cellulose trinitrate sẽ thay thế 3 nguyên tử H trong nhóm OH bằng 3 nhóm nitro NO2.Cellulose tác dụng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tùy thuộc vào điều kiện phản ứng.
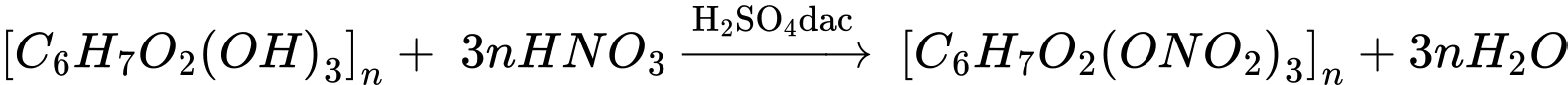
✔️(a) – Đúng. Ở bước 1 tỏa nhiệt mạnh nên cần phải giảm nhiệt độ thông qua ngâm cốc trong chậu nước đá.
✔️(b) – Đúng. Dung dịch NaHCO3 loãng có tác dụng trung hòa phần acid dư.
NaHCO3 + HNO3 → NaNO3 + H2O + CO2
❌(c) – Sai. Miếng bông trên đĩa sứ (1) cháy nhanh hơn miếng bông đĩa sứ (2) nguyên do miếng 1 có phản ứng tạo thuốc súng không khói
❌(d) – Sai. Phản ứng điều chế cellulose trinitrate sẽ thay thế 3 nguyên tử H trong nhóm OH bằng 3 nhóm nitro NO2.Cellulose tác dụng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tùy thuộc vào điều kiện phản ứng.
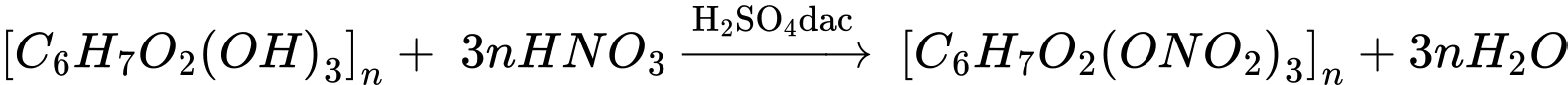
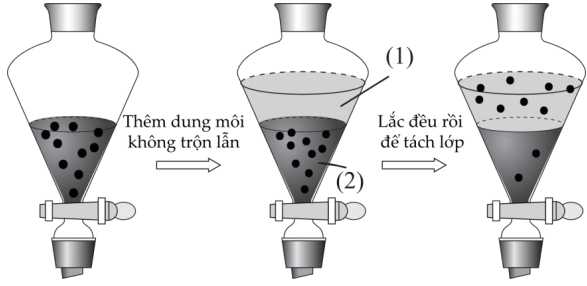
Câu 20 [705996]: Trong phòng thí nghiệm, phương pháp phổ biến nhất là chiết lỏng – lỏng, một quá trình diễn ra trong phễu tách. Một dung dịch chứa các thành phần hòa tan được đặt trong phễu và một dung môi không trộn lẫn được thêm vào, tạo thành hai lớp được lắc cùng nhau. Một lớp thường là nước và lớp còn lại là dung môi hữu cơ. Các thành phần được "chiết xuất" khi chúng di chuyển từ lớp này sang lớp kia. Hình dạng của phễu tách cho phép thoát nước và tách hai lớp hiệu quả.

Phân tích các phát biểu :
❌(a) – Sai. Tiến hành mở van thì lớp dung môi (2) sẽ chảy ra trước, lớp (2) ở phía dưới nên khí mở van sẻ chảy xuống dưới.
✔️(b) – Đúng. Dung môi không phân cực là chất lỏng không có momen lưỡng cực. Do đó, các dung môi này không chứa một phần điện tích dương hoặc âm. Chính vì lý do này, các dung môi phân cực sẽ không bao giờ có thể hòa tan được với những hợp chất phân cực vì không có điện tích trái dấu để thu hút hợp chất phân cực.Dung môi không phân cực trong hóa học có thể hòa tan được với những hợp chất không phân cực thông qua một lực đó là lực hút, chẳng hạn như lực Van der Waal. Một số ví dụ về dung môi không phân cực bao gồm pentane, hexane, benzene, toluene, v.v.
✔️(c) – Đúng. Sau khi chiết, mật độ chất tan ở lớp dung môi (1) lớn hơn lớp dung môi (2), chất tan trong dung dịch (2) sau khi lắc đã hòa tan lên dung dịch (1).
✔️(d) – Đúng.Nếu chất tan trong dung dịch nước là iodine thì lớp dung môi (1) là dung môi hữu cơ không phân cực. Iodine ít tan trong nước nhưng tan nhiều trong các dung môi hữu cơ như cồn, benzene, chloroform.
❌(a) – Sai. Tiến hành mở van thì lớp dung môi (2) sẽ chảy ra trước, lớp (2) ở phía dưới nên khí mở van sẻ chảy xuống dưới.
✔️(b) – Đúng. Dung môi không phân cực là chất lỏng không có momen lưỡng cực. Do đó, các dung môi này không chứa một phần điện tích dương hoặc âm. Chính vì lý do này, các dung môi phân cực sẽ không bao giờ có thể hòa tan được với những hợp chất phân cực vì không có điện tích trái dấu để thu hút hợp chất phân cực.Dung môi không phân cực trong hóa học có thể hòa tan được với những hợp chất không phân cực thông qua một lực đó là lực hút, chẳng hạn như lực Van der Waal. Một số ví dụ về dung môi không phân cực bao gồm pentane, hexane, benzene, toluene, v.v.
✔️(c) – Đúng. Sau khi chiết, mật độ chất tan ở lớp dung môi (1) lớn hơn lớp dung môi (2), chất tan trong dung dịch (2) sau khi lắc đã hòa tan lên dung dịch (1).
✔️(d) – Đúng.Nếu chất tan trong dung dịch nước là iodine thì lớp dung môi (1) là dung môi hữu cơ không phân cực. Iodine ít tan trong nước nhưng tan nhiều trong các dung môi hữu cơ như cồn, benzene, chloroform.
Câu 21 [705997]: Vôi tôi cũng được sử dụng rộng rãi trong các nhà máy xử lý nước để làm mềm nước cứng, bao gồm việc loại bỏ các ion như Ca2+ và Mg2+ cản trở hoạt động của chất tẩy rửa. Khi cho vôi vào nước sẽ tạo thành vôi tôi, phản ứng xảy ra là
CaO(s) + H2O(l) Ca(OH)2(aq)
Một mẫu nước cứng chứa các ion HCO3– và Ca2+ sẽ phản ứng với Ca(OH)2, từ đó hình thành kết tủa CaCO3 và giúp lại bỏ ion Ca2+ khỏi nguồn nước cứng.
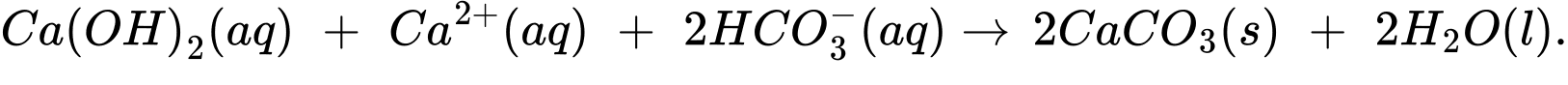 (Dạng nước cứng)
(Dạng nước cứng)
CaO(s) + H2O(l) Ca(OH)2(aq)
Một mẫu nước cứng chứa các ion HCO3– và Ca2+ sẽ phản ứng với Ca(OH)2, từ đó hình thành kết tủa CaCO3 và giúp lại bỏ ion Ca2+ khỏi nguồn nước cứng.
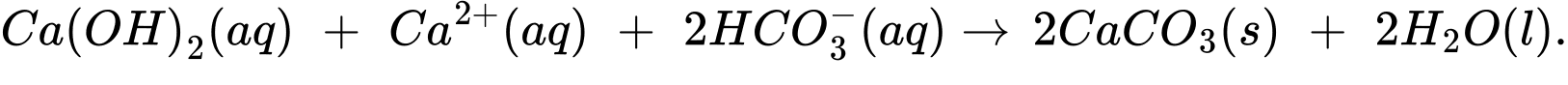 (Dạng nước cứng)
(Dạng nước cứng)
Phân tích các phát biểu :
❌(a) – Sai. Nước cứng trên thuộc loại nước cứng tạm thời do chứa ion Ca2+, Mg2+ và HCO3-.
✔️(b) – Đúng. Nước cứng là loại nước chứa hàm lượng chất khoáng cao, chủ yếu là hai ion calcium (Ca2+) và magnesium (Mg2+).
❌(c) – Sai. Phản ứng của HCl với HCO3- không loại bỏ được ion Ca2+ và Mg2+ làm cho nước cứng tạm thời thành nước cứng vĩnh cửu.
✔️(d) – Đúng. Cứ mỗi mol Ca(OH)2 được dùng thì có 1 mol Ca2+ được loại bỏ khỏi nước cứng.
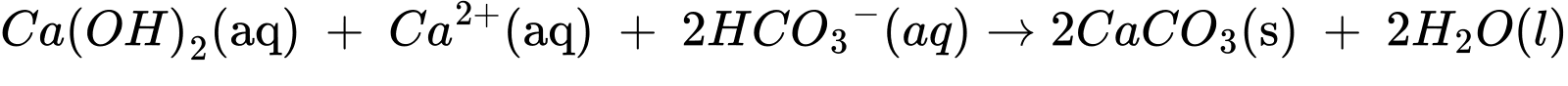
❌(a) – Sai. Nước cứng trên thuộc loại nước cứng tạm thời do chứa ion Ca2+, Mg2+ và HCO3-.
✔️(b) – Đúng. Nước cứng là loại nước chứa hàm lượng chất khoáng cao, chủ yếu là hai ion calcium (Ca2+) và magnesium (Mg2+).
❌(c) – Sai. Phản ứng của HCl với HCO3- không loại bỏ được ion Ca2+ và Mg2+ làm cho nước cứng tạm thời thành nước cứng vĩnh cửu.
✔️(d) – Đúng. Cứ mỗi mol Ca(OH)2 được dùng thì có 1 mol Ca2+ được loại bỏ khỏi nước cứng.
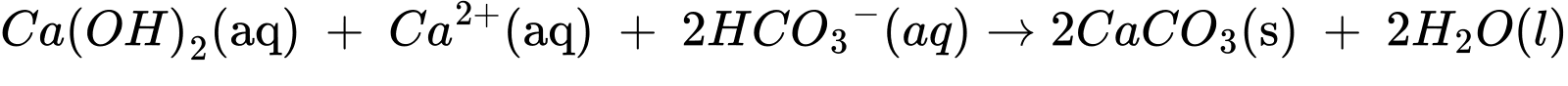
Câu 22 [705998]: Hai ống tiêm được lắp đặt như hình minh họa:
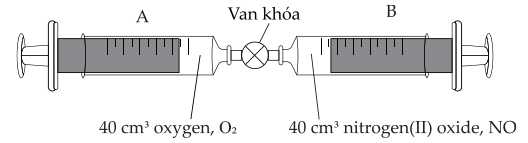
Các lượng nhỏ thể tích O2 được đẩy từ ống tiêm A vào ống tiêm B. Bên ống tiêm B, NO phản ứng với O2 tạo thành một sản phẩm là một khí oxide khác của nitrogen, NOy. Sau mỗi lần thêm O2, vòi được đóng lại và tổng thể tích khí được đo. Kết quả được hiển thị ở đây:
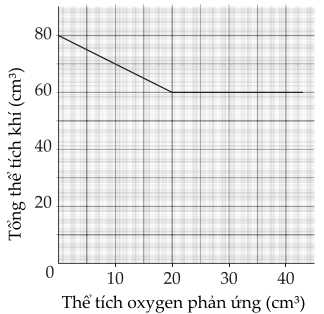

Các lượng nhỏ thể tích O2 được đẩy từ ống tiêm A vào ống tiêm B. Bên ống tiêm B, NO phản ứng với O2 tạo thành một sản phẩm là một khí oxide khác của nitrogen, NOy. Sau mỗi lần thêm O2, vòi được đóng lại và tổng thể tích khí được đo. Kết quả được hiển thị ở đây:

Phân tích các phát biểu :
❌(a) – Sai.
2NO + O2 → 2NO2
Thể tích O2 phản ứng tối đa với 40 cm3 NO là 20 cm3 .
❌(b) – Sai. Từ đồ thị thể tích O2 đã tham gia phản ứng là 20 cm3 , nên lượng NOy tạo thành là 40 cm3 .
✔️(c) – Đúng.
2NO + O2 → 2NO2
Công thức của sản phẩm NOy là NO2.
❌(d) – Sai.
2NO + O2 → 2NO2
Ban đầu có 40 cm3 O2 và 40 cm3 NO, sau phản ứng dư 20 cm3 O2 và 40 cm3 NO2.
Tổng thể tích khí ở cả hai ống tiêm khi phản ứng kết thúc là 60 cm3 .
❌(a) – Sai.
2NO + O2 → 2NO2
Thể tích O2 phản ứng tối đa với 40 cm3 NO là 20 cm3 .
❌(b) – Sai. Từ đồ thị thể tích O2 đã tham gia phản ứng là 20 cm3 , nên lượng NOy tạo thành là 40 cm3 .
✔️(c) – Đúng.
2NO + O2 → 2NO2
Công thức của sản phẩm NOy là NO2.
❌(d) – Sai.
2NO + O2 → 2NO2
Ban đầu có 40 cm3 O2 và 40 cm3 NO, sau phản ứng dư 20 cm3 O2 và 40 cm3 NO2.
Tổng thể tích khí ở cả hai ống tiêm khi phản ứng kết thúc là 60 cm3 .
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705999]: Độ hòa tan trong nước của muối khan barium chloride (BaCl2) phụ thuộc vào nhiệt độ được xác định bằng thực nghiệm và ghi lại kết quả như bảng sau:

Tiến hành làm lạnh 200 gam dung dịch BaCl2 bão hòa từ 100 oC xuống 20 oC. Phần dung dịch còn lại ở 20 oC có khối lượng 163 gam và chất rắn tách ra là BaCl2.nH2O. Giá trị của n là bao nhiêu (Làm tròn đến số nguyên)?

Tiến hành làm lạnh 200 gam dung dịch BaCl2 bão hòa từ 100 oC xuống 20 oC. Phần dung dịch còn lại ở 20 oC có khối lượng 163 gam và chất rắn tách ra là BaCl2.nH2O. Giá trị của n là bao nhiêu (Làm tròn đến số nguyên)?
Tại 100 oC
100 gam nước sẽ hòa tan tối đa là 59,4 gam BaCl2 thu được 159,4 gam dung dịch BaCl2
Vậy 200 gam dung dịch BaCl2 bão hoà sẽ chứa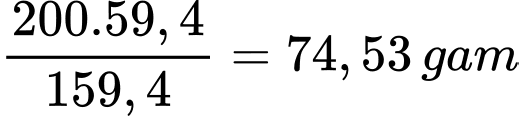
Tại 20oC
100 gam nước sẽ hòa tan tối đa là 35,8 gam BaCl2 thu được 135,8 gam dung dịch BaCl2
Vậy 163 gam dung dịch BaCl2 sẽ hòa tan tối đa là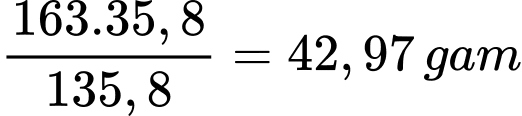
Khối lượng BaCl2 tách ra là 74,53 – 42,97 = 31,56 gam.
Khối lượng H2O tách ra là 200 – 163 – 31,56 = 5,44 gam.
→ Số mol BaCl2 tách ra là nBaCl2 = 31,65:208 = 0,1517 mol
Số mol H2O tách ra là nH2O = 5,44:18 = 0,3022 mol
Ta thấy: nH2O : nBaCl2 = 0,3022:0,1517 ≈ 2
Công thức chất rắn BaCl2. 2H2O.
⟹Điền đáp án : 2
100 gam nước sẽ hòa tan tối đa là 59,4 gam BaCl2 thu được 159,4 gam dung dịch BaCl2
Vậy 200 gam dung dịch BaCl2 bão hoà sẽ chứa
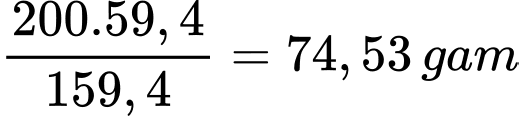
Tại 20oC
100 gam nước sẽ hòa tan tối đa là 35,8 gam BaCl2 thu được 135,8 gam dung dịch BaCl2
Vậy 163 gam dung dịch BaCl2 sẽ hòa tan tối đa là
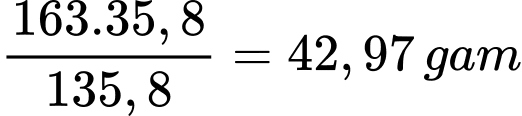
Khối lượng BaCl2 tách ra là 74,53 – 42,97 = 31,56 gam.
Khối lượng H2O tách ra là 200 – 163 – 31,56 = 5,44 gam.
→ Số mol BaCl2 tách ra là nBaCl2 = 31,65:208 = 0,1517 mol
Số mol H2O tách ra là nH2O = 5,44:18 = 0,3022 mol
Ta thấy: nH2O : nBaCl2 = 0,3022:0,1517 ≈ 2
Công thức chất rắn BaCl2. 2H2O.
⟹Điền đáp án : 2
Câu 24 [706000]: Cho dãy chất: Ca3(PO4)2, BaSO4, KNO3, CuO, Cr(OH)3, AgCl và BaCO3. Số chất trong dãy không tan trong dung dịch HNO3 loãng là
Các chất không tan trong dung dịch HNO3 loãng là BaSO4; AgCl.
BaSO4 : Đây là một muối sunfat không tan trong nước và hầu hết các acid, kể cả HNO3 loãng.
AgCl : là một muối kết tủa rất ít tan trong nước.
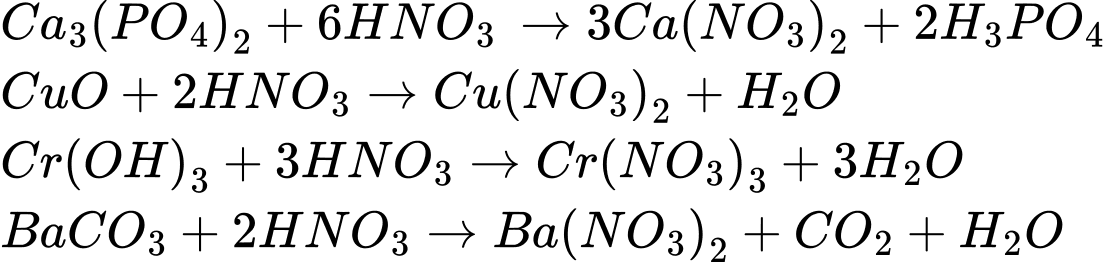
⟹Điền đáp án : 2
BaSO4 : Đây là một muối sunfat không tan trong nước và hầu hết các acid, kể cả HNO3 loãng.
AgCl : là một muối kết tủa rất ít tan trong nước.
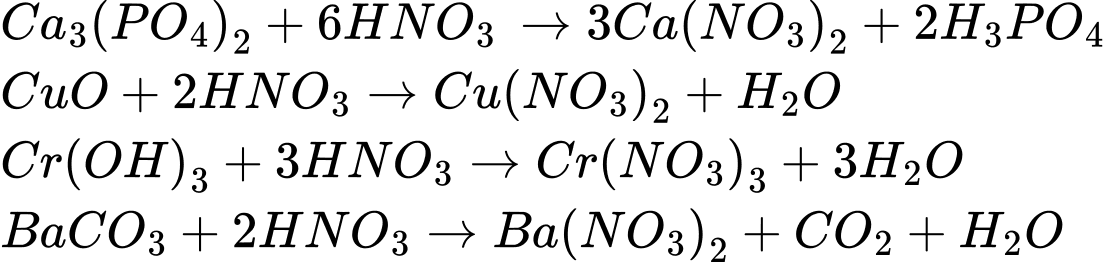
⟹Điền đáp án : 2
Câu 25 [706001]: Để tráng một số lượng gương soi có diện tích bề mặt 0,5 m2 với độ dày 0,1 μm người ta đun nóng dung dịch chứa 30,6 gam glucose với một lượng dung dịch silver nitrate trong ammonia. Biết khối lượng riêng của bạc là 10,49 g/cm3, hiệu suất phản ứng tráng gương là 85% (tính theo glucose). Số lượng gương soi tối đa sản xuất được là bao nhiêu (Làm tròn đến hàng đơn vị)?
Thể tích bạc cần cho 1 tấm gương là VAg = 0,5.0,1.10-6 = 5.10-8 m3 = 5.10-2 cm3
Khối lượng Ag cho 1 tấm gương là mAg = 5.10-2. 10,49 = 0,5245 gam
Số mol của glucose là nC6H12O6 = 30,6 : 180 = 0,17 mol
Số mol Ag = 0,17 × 85% × 2 = 0,289 mol
Khối lượng Ag = 31,212 g
Sơ đồ phản ứng: C6H12O6 → 2Ag
Số tấm gương tối đa được sản xuất là
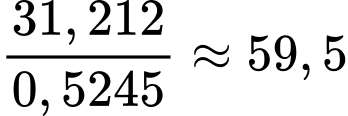
⟹Điền đáp án : 60
Khối lượng Ag cho 1 tấm gương là mAg = 5.10-2. 10,49 = 0,5245 gam
Số mol của glucose là nC6H12O6 = 30,6 : 180 = 0,17 mol
Số mol Ag = 0,17 × 85% × 2 = 0,289 mol
Khối lượng Ag = 31,212 g
Sơ đồ phản ứng: C6H12O6 → 2Ag
Số tấm gương tối đa được sản xuất là
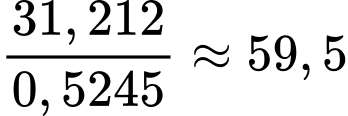
⟹Điền đáp án : 60
Câu 26 [706002]: Chitin có trong vỏ tôm được đun nóng trong dung dịch HCl đặc để điều chế glucosamine hydrochloride, một chất có tác dụng hỗ trợ xương khỏe mạnh.
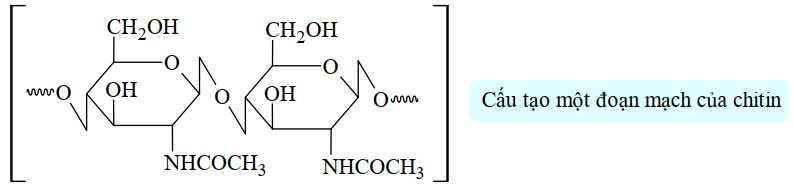
Công thức cấu tạo của glucosamine hydrochloride chứa bao nhiêu nhóm OH?

Công thức cấu tạo của glucosamine hydrochloride chứa bao nhiêu nhóm OH?
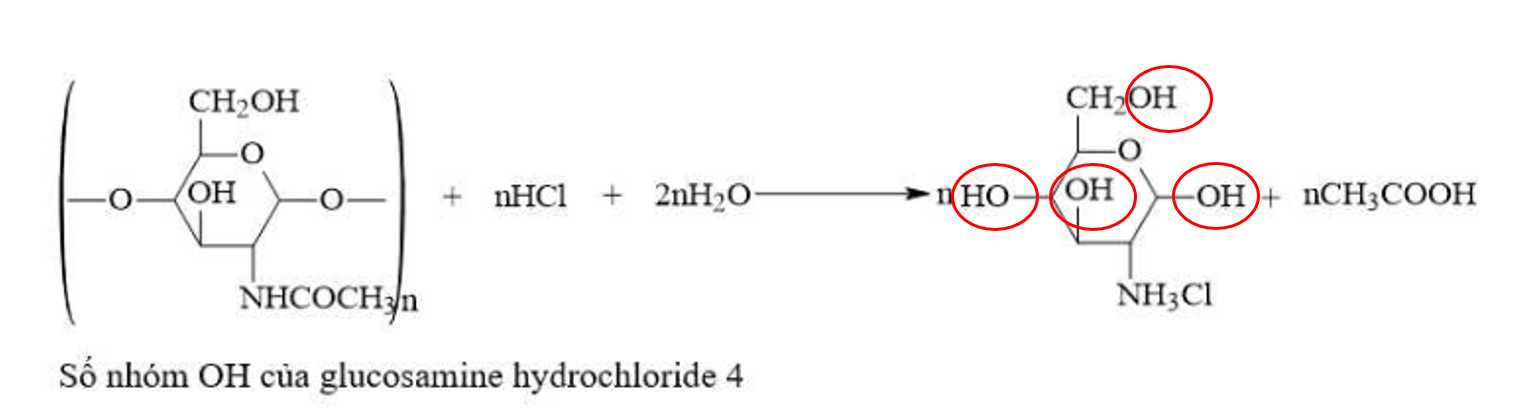
⟹Điền đáp án : 4
Câu 27 [706003]: Một mẫu 3,60 g malic acid, C2H4O(COOH)2, được hòa tan trong 20,0 mL nước cất. Dung dịch được chuẩn độ bằng dung dịch sodium hydroxide 0,125 M. Tính thể tích (mL) dung dịch sodium hydroxide đã dùng (Làm tròn đến hàng phần trăm).
Số mol của malic acid là nmalic acid = 3,6 : 134 = 9/335 mol
C2H4O(COOH)2 + 2NaOH → C2H4O(COONa)2 + 2H2O
Từ PTHH số mol của NaOH cần dùng là 18/335 mol
Thể tích sodium hydroxide cần dùng là
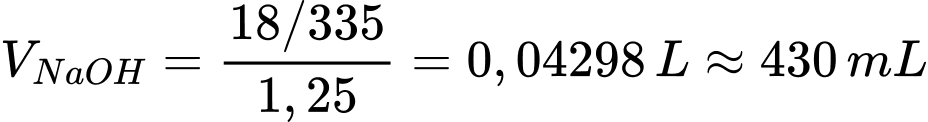
⟹Điền đáp án : 430
C2H4O(COOH)2 + 2NaOH → C2H4O(COONa)2 + 2H2O
Từ PTHH số mol của NaOH cần dùng là 18/335 mol
Thể tích sodium hydroxide cần dùng là
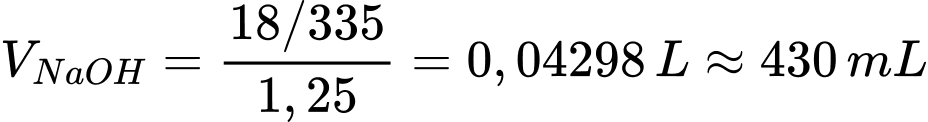
⟹Điền đáp án : 430
Câu 28 [706004]: Muối ngậm nước FeSO4.xH2O được sử dụng trong y tế để điều trị chứng thiếu sắt và cũng sử dụng cho các ứng dụng công nghiệp. Trong quá trình bảo quản, một mẫu muối FeSO4.xH2O (có khối lượng m gam) bị oxi hóa bởi oxygen không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y:Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25 ml dung dịch Y, thu được 4,66 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 13,5 ml.
Xác định giá trị củaphần trăm Fe bị oxi hóa?
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 13,5 ml.
Xác định giá trị củaphần trăm Fe bị oxi hóa?
TN1 : FeSO4.xH2O ⟶ X ⟶ dd Y ⟶ BaSO4
nH2SO4 = 0,0125 mol
nBaSO4 = 0,02 mol = nFeSO4.xH2O + nH2SO4
nFeSO4.xH2O = 0,0075 mol
TN2 : 10 FeSO4 + 2 KMnO4 + 8 H2SO4 ⟶ 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8H2O
nKMnO4 phản ứng = 13,5 : 1000 × 0,1 = 1,35× 10-3mol
nFeSO4 = 6,75× 10-3 mol
Số mol Fe3+ bị oxi hóa = 0,0075 - 6,75× 10-3 = 7,5 × 10 -4mol
%Fe đã bị oxi hóa = 7,5× 10-4 : 0,0075 × 100 = 10%
⟹ Điền đáp án : 10
nH2SO4 = 0,0125 mol
nBaSO4 = 0,02 mol = nFeSO4.xH2O + nH2SO4
nFeSO4.xH2O = 0,0075 mol
TN2 : 10 FeSO4 + 2 KMnO4 + 8 H2SO4 ⟶ 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8H2O
nKMnO4 phản ứng = 13,5 : 1000 × 0,1 = 1,35× 10-3mol
nFeSO4 = 6,75× 10-3 mol
Số mol Fe3+ bị oxi hóa = 0,0075 - 6,75× 10-3 = 7,5 × 10 -4mol
%Fe đã bị oxi hóa = 7,5× 10-4 : 0,0075 × 100 = 10%
⟹ Điền đáp án : 10