PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706030]: “Khi đốt nóng một đầu dây kim loại, các ..(1).. tự do ở vùng nhiệt độ cao có động năng lớn hơn di chuyển đến vùng có nhiệt độ thấp hơn trong tinh thể kim loại và truyền năng lượng cho các ..(2).. ở đây”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, proton hoá trị, anion phi kim.
B, electron hoá trị, anion gốc acid.
C, electron hoá trị, cation kim loại.
D, neutron hoá trị, cation ammonium.
- Khi đốt nóng một đầu dây kim loại, các hạt mang điện tích trong kim loại sẽ tham gia vào quá trình truyền nhiệt. Trong kim loại, các electron hóa trị là các hạt có thể di chuyển tự do và đóng vai trò quan trọng trong việc dẫn nhiệt.
- Các electron tự do này sẽ di chuyển từ vùng có nhiệt độ cao đến vùng có nhiệt độ thấp hơn, giúp truyền năng lượng cho các ion kim loại trong mạng tinh thể.
⟹Chọn đáp án C Đáp án: C
- Các electron tự do này sẽ di chuyển từ vùng có nhiệt độ cao đến vùng có nhiệt độ thấp hơn, giúp truyền năng lượng cho các ion kim loại trong mạng tinh thể.
⟹Chọn đáp án C Đáp án: C
Câu 2 [706031]: Mặt nạ thở phòng cháy chữa cháy có chứa KO2. Trong điều kiện thiếu khí, KO2 cũng có thể phản ứng với CO2 giúp tạo ra O2 để hỗ trợ hô hấp cho người đeo:
aKO2(s) + bCO2(g) → cK2CO3(s) + dO2(g)
Với a, b, c, d là các hệ số tỉ lượng ứng với các chất. Hệ số a và b lần lượt là
aKO2(s) + bCO2(g) → cK2CO3(s) + dO2(g)
Với a, b, c, d là các hệ số tỉ lượng ứng với các chất. Hệ số a và b lần lượt là
A, 5, 2.
B, 3, 2.
C, 4, 2.
D, 1, 3.
4KO2 + 2CO2 → 2K2CO3 + 3O2
Hệ số a, b, c, d lần lượt là 4; 2; 2; 3
Hệ số a và b lần lượt là 4 và 2
⟹Chọn đáp án C Đáp án: C
Hệ số a, b, c, d lần lượt là 4; 2; 2; 3
Hệ số a và b lần lượt là 4 và 2
⟹Chọn đáp án C Đáp án: C
Câu 3 [706032]: Trong công nghiệp thực phẩm, saccharose được sử dụng phổ biến làm nguyên liệu để sản xuất bánh kẹo, nước giải khát,... Phát biểu nào sau đây là không đúng?
A, Saccharose thuộc loại disaccharide.
B, Dung dịch saccharose hoà tan được Cu(OH)2.
C, Thuỷ phân saccharose chỉ thu được glucose.
D, Saccharose được tách từ cây mía, củ cải đường,...
Phân tích các đáp án :
✔️A – Đúng. Saccharose thuộc loại disaccharide.
✔️B – Đúng. Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
❌C – Sai. Saccharose bị thủy phân thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme.
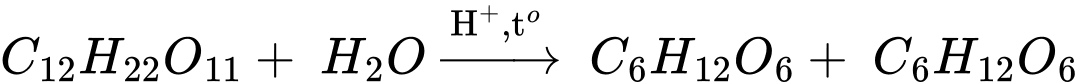
✔️D – Đúng. Saccharose là chất rắn, vị ngọt, tan tốt trong nước. Có nhiều trong cây mía, củ cải đường và hoa thốt nốt, đường mía, đường thốt nốt, … Làm chất tạo ngọt trong sản xuất thực phẩm như bánh, kẹo, nước giải khát.
⟹ Chọn đáp án C Đáp án: C
✔️A – Đúng. Saccharose thuộc loại disaccharide.
✔️B – Đúng. Saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O
❌C – Sai. Saccharose bị thủy phân thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme.
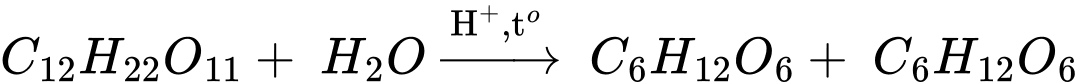
✔️D – Đúng. Saccharose là chất rắn, vị ngọt, tan tốt trong nước. Có nhiều trong cây mía, củ cải đường và hoa thốt nốt, đường mía, đường thốt nốt, … Làm chất tạo ngọt trong sản xuất thực phẩm như bánh, kẹo, nước giải khát.
⟹ Chọn đáp án C Đáp án: C
Câu 4 [706033]: Thuật ngữ “đàn hồi” có nghĩa là vật có thể trở lại hình dạng hoặc vị trí ban đầu sau khi bị uốn cong, nén, kéo căng. Giải thích tại sao quá trình lưu hóa làm cho cao su trở nên đàn hồi hơn?
A, Tạo liên kết chéo giữa các chuỗi polymer, giúp phục hồi hình dạng ban đầu.
B, Làm giảm khối lượng của cao su, giúp nhẹ hơn và dễ trở lại hình dạng ban đầu.
C, Giúp cao su tan tốt hơn trong các dung môi hữu cơ, làm tăng tính đàn hồi.
D, Làm mềm các chuỗi polymer, giúp cao su dẻo dai hơn khi kéo căng.
- Cao su lưu hóa là quá trình thay đổi tính chất của cao su bằng cách sử dụng các chất hóa học hoặc phương pháp vật lý để cải thiện đặc tính của nó. Mục đích chính của cao su lưu hóa là cải thiện các tính chất của cao su như độ bền, độ cứng, độ co giãn, độ bám dính, khả năng chống mài mòn, chịu nhiệt, chống cháy, chống tia UV, khả năng chống hóa chất và các tính chất khác. Quá trình lưu hóa có thể được áp dụng cho nhiều loại cao su, bao gồm cao su tự nhiên và cao su tổng hợp.
- Cao su lưu hóa có cấu trúc mạng không gian hay còn gọi là mạng lưới không gian ba chiều.
- Khi chưa lưu hóa, cao su có dạng chuỗi polyme dài, linh hoạt nhưng dễ bị biến dạng và chảy mềm khi gặp nhiệt độ cao.
- Sau khi lưu hóa, các liên kết ngang giữa các chuỗi cao su được hình thành, tạo nên cấu trúc mạng lưới không gian ba chiều, giúp vật liệu có độ bền cơ học cao hơn, ít bị biến dạng vĩnh viễn.
- Các liên kết ngang này chủ yếu được tạo ra bởi lưu huỳnh (S), nhưng cũng có thể là peroxit hữu cơ hoặc nhựa.
⟹Chọn đáp án A Đáp án: A
- Cao su lưu hóa có cấu trúc mạng không gian hay còn gọi là mạng lưới không gian ba chiều.
- Khi chưa lưu hóa, cao su có dạng chuỗi polyme dài, linh hoạt nhưng dễ bị biến dạng và chảy mềm khi gặp nhiệt độ cao.
- Sau khi lưu hóa, các liên kết ngang giữa các chuỗi cao su được hình thành, tạo nên cấu trúc mạng lưới không gian ba chiều, giúp vật liệu có độ bền cơ học cao hơn, ít bị biến dạng vĩnh viễn.
- Các liên kết ngang này chủ yếu được tạo ra bởi lưu huỳnh (S), nhưng cũng có thể là peroxit hữu cơ hoặc nhựa.
⟹Chọn đáp án A Đáp án: A
Câu 5 [906802]: Phát biểu nào sau đây đúng?
A, Kim loại Al không tác dụng với dung dịch H2SO4 đặc, nóng.
B, Kim loại K có độ cứng lớn hơn kim loại Cr.
C, Ở nhiệt độ thường, CO khử được Al2O3.
D, Cho Fe vào dung dịch Cu(NO3)2 có xảy ra ăn mòn điện hóa học.
Phân tích các đáp án :
❌A. sai vì Al bị thụ động hóa trong H2SO4 đặc nguội chứ không phải đặc nóng.
❌B. sai. Cr là kim loại cứng nhất, các kim loại kiềm mềm.
❌C. sai. CO, H2 không có khả năng khử các oxit kim loại kiềm, kiềm thổ và nhôm.
✔️D. đúng. Đầu tiên: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu. Kim loại đồng sinh ra bám vào thanh sắt sẽ tạo thành cặp điện cực Fe-Cu → tiếp đó xảy ra ăn mòn điện hóa học.
⟹Chọn đáp án D Đáp án: D
❌A. sai vì Al bị thụ động hóa trong H2SO4 đặc nguội chứ không phải đặc nóng.
❌B. sai. Cr là kim loại cứng nhất, các kim loại kiềm mềm.
❌C. sai. CO, H2 không có khả năng khử các oxit kim loại kiềm, kiềm thổ và nhôm.
✔️D. đúng. Đầu tiên: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu. Kim loại đồng sinh ra bám vào thanh sắt sẽ tạo thành cặp điện cực Fe-Cu → tiếp đó xảy ra ăn mòn điện hóa học.
⟹Chọn đáp án D Đáp án: D
Câu 6 [706034]: Trong phòng thí nghiệm, một lượng nhỏ hydrogen chloride có thể được điều chế bằng phản ứng trực tiếp giữa dung dịch sodium chloride và dung dịch sulfuric acid đặc như hình dưới đây:
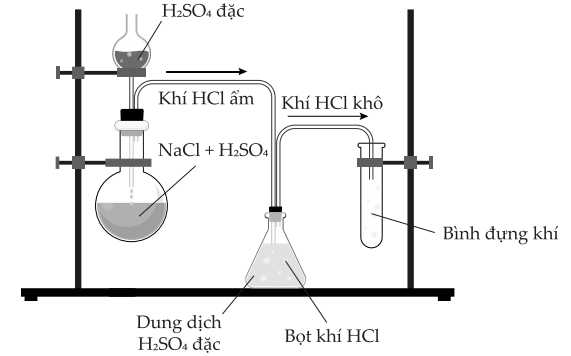
Tuy nhiên, phương pháp này không thể dùng để điều chế hydrogen bromide, do không thu được HBr từ phản ứng giữa NaBr và H2SO4 đặc:
2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g).
Cho các ohát biểu sau:
(a) Anion Cl– không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
(b) Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này.
(c) Trong thực tế, người ta điều chế HF cũng bằng thí nghiệm theo thiết kế ở hình trên.
(d) Tính khử của anion Br– yếu hơn anion Cl–.
Trong các phát biểu trên, những phát biểu đúng là

Tuy nhiên, phương pháp này không thể dùng để điều chế hydrogen bromide, do không thu được HBr từ phản ứng giữa NaBr và H2SO4 đặc:
2NaBr(s) + 3H2SO4(l) → 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g).
Cho các ohát biểu sau:
(a) Anion Cl– không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
(b) Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này.
(c) Trong thực tế, người ta điều chế HF cũng bằng thí nghiệm theo thiết kế ở hình trên.
(d) Tính khử của anion Br– yếu hơn anion Cl–.
Trong các phát biểu trên, những phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (c).
D, (c), (d).
Phân tích các đáp án :
✔️(a) – Đúng. Anion Cl- không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
✔️(b) – Đúng. Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này, ion I- có tính khử mạnh hơn Br- nên sử dụng H2SO4 đặc sẽ không thu được HI tương ứng.
8NaI + 5H2SO4 → H2S + 4I2 + 4Na2SO4 + 4H2O
❌(c) – Sai. Để điều chế HF, người ta dùng phương pháp sulfate. Đó là cho H2SO4 đặc tác dụng với muối floride, chloride vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF. Hay nói cách khác là HF có tính khử yếu, chúng không khử được H2SO4 đặc. Nhưng để điều chế HF, cần sử dụng phương pháp úp bình do HF nhẹ hơn không khí.
❌(d) - Sai . Br- có tính khử mạnh hơn Cl- vì brom có kích thước nguyên tử lớn hơn clo, lực hút giữa hạt nhân và electron ngoài cùng yếu hơn, nên Br- dễ nhường electron hơn Cl-
⟹Chọn đáp án A Đáp án: A
✔️(a) – Đúng. Anion Cl- không thể hiện tính khử khi tác dụng với sulfuric acid đặc nóng.
✔️(b) – Đúng. Tương tự HBr, HI cũng không thể điều chế bằng phương pháp này, ion I- có tính khử mạnh hơn Br- nên sử dụng H2SO4 đặc sẽ không thu được HI tương ứng.
8NaI + 5H2SO4 → H2S + 4I2 + 4Na2SO4 + 4H2O
❌(c) – Sai. Để điều chế HF, người ta dùng phương pháp sulfate. Đó là cho H2SO4 đặc tác dụng với muối floride, chloride vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF. Hay nói cách khác là HF có tính khử yếu, chúng không khử được H2SO4 đặc. Nhưng để điều chế HF, cần sử dụng phương pháp úp bình do HF nhẹ hơn không khí.
❌(d) - Sai . Br- có tính khử mạnh hơn Cl- vì brom có kích thước nguyên tử lớn hơn clo, lực hút giữa hạt nhân và electron ngoài cùng yếu hơn, nên Br- dễ nhường electron hơn Cl-
⟹Chọn đáp án A Đáp án: A
Câu 7 [186429]: Mục đích chính của chuẩn độ acid - base là
A, xác định xem phản ứng hóa học có xảy ra hay không.
B, xác định nồng độ của một chất bằng dung dịch chuẩn đã biết nồng độ.
C, kiểm tra lại nồng độ của dung dịch đã biết.
D, để kiểm tra chất lượng của chất phản ứng.
Mục đích chính của chuẩn độ acid - base là xác định nồng độ của một chất bằng dung dịch chuẩn đã biết nồng độ.
⟹Chọn đáp án B Đáp án: B
⟹Chọn đáp án B Đáp án: B
Câu 8 [190813]: C2H5COCH3 tham gia phản ứng với I2 trong môi trường kiềm tạo thành kết tủa có màu
A, tím.
B, đỏ gạch.
C, vàng.
D, trắng bạc.
C2H5COCH3 là hợp chất có chứa nhóm methyl ketone (CH3CO-) phản ứng với iodine trong môi trường kiềm tạo ra kết tủa iodoform (triiodomethane) màu vàng.
Phương trình hoá học:
CH3CHO + 3I2 + 4NaOH → CHI3 (kết tủa vàng) + HCOONa + 3NaI + 3H2O.
⟹Chọn đáp án C Đáp án: C
Phương trình hoá học:
CH3CHO + 3I2 + 4NaOH → CHI3 (kết tủa vàng) + HCOONa + 3NaI + 3H2O.
⟹Chọn đáp án C Đáp án: C
Câu 9 [575648]: Cấu hình electron của nguyên tử fluorine là 1s22s22p5. Vị trí của fluorine trong bảng tuần hoàn là
A, ô số 7, chu kì 3, nhóm VIA.
B, ô số 9, chu kì 2, nhóm VIIA.
C, ô số 5, chu kì 2, nhóm VIA.
D, ô số 7, chu kì 2, nhóm VIIA.
* Cấu hình electron của nguyên tử F là 1s2 2s2 2p5
F có 9 electron → F thuộc ô thứ 9 trong BTH
Có 2 lớp electron → F thuộc chu kì 2
* Electron cuối cùng được điền vào phân lớp p → F thuộc nguyên tố p → Nhóm A
Có 7 electron lớp ngoài cùng → F thuộc nhóm VII A trong bảng tuần hoàn.
⟹Chọn đáp án B Đáp án: B
F có 9 electron → F thuộc ô thứ 9 trong BTH
Có 2 lớp electron → F thuộc chu kì 2
* Electron cuối cùng được điền vào phân lớp p → F thuộc nguyên tố p → Nhóm A
Có 7 electron lớp ngoài cùng → F thuộc nhóm VII A trong bảng tuần hoàn.
⟹Chọn đáp án B Đáp án: B
Câu 10 [706035]: Các kim loại kiềm thổ có cấu hình electron lớp ngoài cùng là?
A, ns1.
B, ns2.
C, ns2np1.
D, ns2np2.
Cấu hình electron lớp ngoài cùng của nguyên tố nhóm IIA là ns2.
Kim loại nhóm IIA thể hiện tính khử mạnh:
M ⟶ M2+ + 2e
Trong hợp chất, nguyên tử nhóm IIA thể hiện số oxi hoá đặc trưng là +2.
⟹Chọn đáp án B Đáp án: B
Kim loại nhóm IIA thể hiện tính khử mạnh:
M ⟶ M2+ + 2e
Trong hợp chất, nguyên tử nhóm IIA thể hiện số oxi hoá đặc trưng là +2.
⟹Chọn đáp án B Đáp án: B
Câu 11 [706036]: Một pin điện hoá được thiết lập từ hai điện cực tạo bởi hai cặp oxi hoá khử là Mn+/M và Cu2+/Cu. Cho bảng sau:
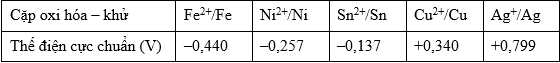
Nếu M là kim loại nào thì sức điện động chuẩn của pin tạo ra sẽ lớn nhất?

Nếu M là kim loại nào thì sức điện động chuẩn của pin tạo ra sẽ lớn nhất?
A, Fe.
B, Ni.
C, Sn.
D, Ag.
Phân tích các phát biểu :
✔️A. Fe
Pin Fe-Cu: Anode (-) Fe và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V
❌B. Ni
Pin Ni-Cu: Anode (-) Ni và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,257) = 0,597 V
❌C. Sn
Pin Sn-Cu: Anode (-) Sn và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,137) = 0,477 V
❌D. Ag
Pin Cu-Ag, Anode (-) Cu và cathode (+) Ag
Epin = E(+) – E(-) = 0,799 – 0,34 = 0,459 V
⟹Chọn đáp án A Đáp án: A
✔️A. Fe
Pin Fe-Cu: Anode (-) Fe và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,44) = 0,78 V
❌B. Ni
Pin Ni-Cu: Anode (-) Ni và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,257) = 0,597 V
❌C. Sn
Pin Sn-Cu: Anode (-) Sn và Cathode (+) Cu
E pin = E(+) – E(-) = 0,34 – (-0,137) = 0,477 V
❌D. Ag
Pin Cu-Ag, Anode (-) Cu và cathode (+) Ag
Epin = E(+) – E(-) = 0,799 – 0,34 = 0,459 V
⟹Chọn đáp án A Đáp án: A
Câu 12 [706037]: Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 24. Nung nóng X trong bình kín chứa xúc tác V2O5, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 30. Tính hiệu suất của phản ứng oxi hoá SO2 thành SO3.
A, 20 %.
B, 45 %.
C, 60 %.
D, 80 %.
Phân tử khối trung bình của hỗn hợp X là 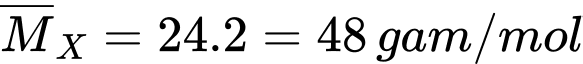
Ta có:
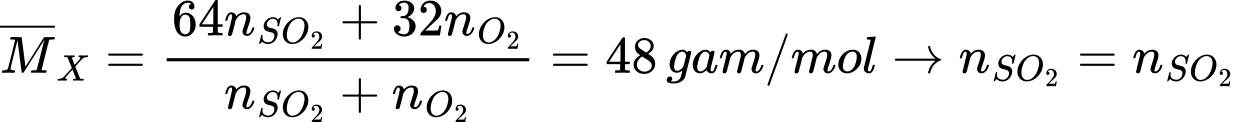
Giả sử hỗn hợp X ban đầu có 1 mol SO2 và 1 mol O2
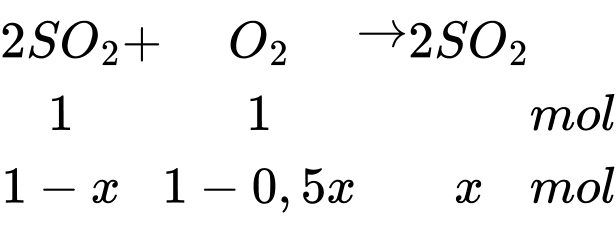
Phân tử khối trung bình của hỗn hợp sau phản ứng là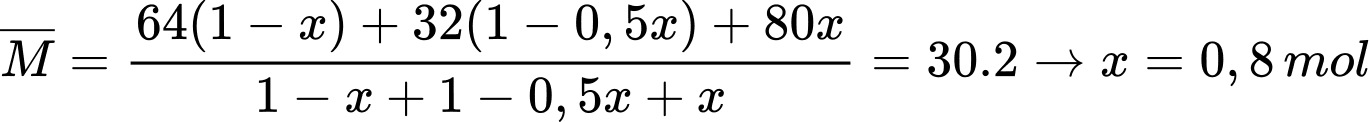
Hiệu suất của phản ứng là
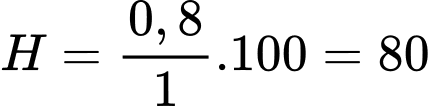
⟹Chọn đáp án D Đáp án: D
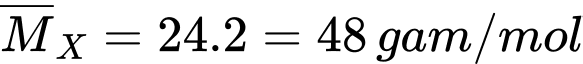
Ta có:
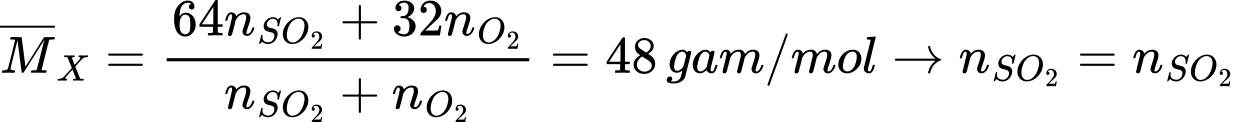
Giả sử hỗn hợp X ban đầu có 1 mol SO2 và 1 mol O2
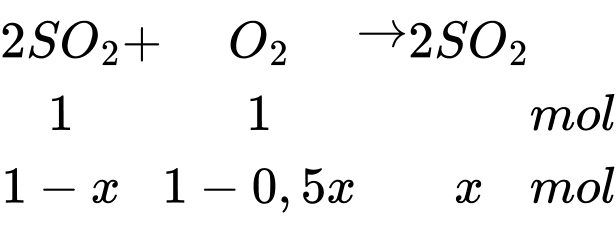
Phân tử khối trung bình của hỗn hợp sau phản ứng là
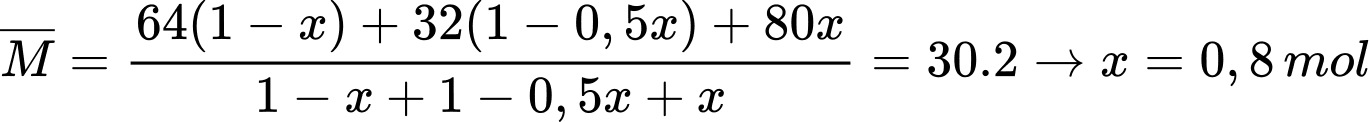
Hiệu suất của phản ứng là
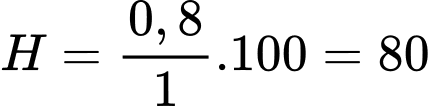
⟹Chọn đáp án D Đáp án: D
Câu 13 [304856]: Thủy phân hoàn toàn hỗn hợp ethyl propionate và ethyl formate trong dung dịch NaOH, thu được sản phẩm gồm
A, 1 muối và 1 alcohol.
B, 2 muối và 2 alcohol.
C, 1 muối và 2 alcohol.
D, 2 muối và 1 alcohol.
Phân tích phản ứng thủy phân các ester trong môi trường base:
• Ethyl propionate: CH3CH2COOCH2CH3 + NaOH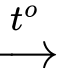 CH3CH2COONa + CH3CH2OH.
CH3CH2COONa + CH3CH2OH.
• Ethyl formate: HCOOCH2CH3 + NaOH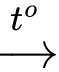 HCOONa + CH3CH2OH.
HCOONa + CH3CH2OH.
Ở 2 phản ứng: 2 muối khác nhau; 2 alcohol giống nhau ⇒ hỗn hợp sản phẩm thu được gồm 2 muối và chỉ có 1 alcohol ⟹ Chọn đáp án D.
► Khi đã quen, ta có thể nhìn nhanh các gốc trong tên gọi ester để có nhanh kết quả. Ví dụ ở câu này: 2 este khác gốc acid là propionate và formate nên sẽ cho 2 muối; còn 2 gốc hydrocarbon trong phần alcohol giống nhau (cùng là ethyl) nên sẽ cho cùng 1 alcohol. Đáp án: D
• Ethyl propionate: CH3CH2COOCH2CH3 + NaOH
 CH3CH2COONa + CH3CH2OH.
CH3CH2COONa + CH3CH2OH.• Ethyl formate: HCOOCH2CH3 + NaOH
 HCOONa + CH3CH2OH.
HCOONa + CH3CH2OH.Ở 2 phản ứng: 2 muối khác nhau; 2 alcohol giống nhau ⇒ hỗn hợp sản phẩm thu được gồm 2 muối và chỉ có 1 alcohol ⟹ Chọn đáp án D.
► Khi đã quen, ta có thể nhìn nhanh các gốc trong tên gọi ester để có nhanh kết quả. Ví dụ ở câu này: 2 este khác gốc acid là propionate và formate nên sẽ cho 2 muối; còn 2 gốc hydrocarbon trong phần alcohol giống nhau (cùng là ethyl) nên sẽ cho cùng 1 alcohol. Đáp án: D
Câu 14 [706038]: “Nhỏ mấy giọt nước bromine vào ống nghiệm đựng dung dịch aniline thấy xuất hiện kết tủa ..(1).., phản ứng này chứng minh aniline tham gia phản ứng thế ..(2).. benzene”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, xanh, khó hơn.
B, trắng, dễ hơn.
C, vàng, giống như.
D, đỏ, dễ hơn.
Aniline là một hợp chất thơm chứa nhóm amine có tính hoạt hóa vòng benzene, làm tăng khả năng phản ứng thế với bromine.
Khi nhỏ nước bromine vào dung dịch aniline, phản ứng thế xảy ra dễ dàng ở vị trí o-, p- trên vòng benzene, tạo ra kết tủa trắng của 2,4,6-tribromoaniline.
⟹Chọn đáp án B Đáp án: B
Khi nhỏ nước bromine vào dung dịch aniline, phản ứng thế xảy ra dễ dàng ở vị trí o-, p- trên vòng benzene, tạo ra kết tủa trắng của 2,4,6-tribromoaniline.
⟹Chọn đáp án B Đáp án: B
Câu 15 [706081]: Khi hoà tan zinc(II) chloride trong nước diễn ra một số quá trình cơ bản sau:
Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I)
[Zn(OH2)6]2+(aq) ⇌ [Zn(OH)(OH2)5]+(aq) + H+(aq); KC = 10–9 (II)
H+(aq) + H2O(l) → H3O+(aq) (III)
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Brønsted–Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Brønsted–Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Brønsted–Lowry.
Số phát biểu đúng là:
Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I)
[Zn(OH2)6]2+(aq) ⇌ [Zn(OH)(OH2)5]+(aq) + H+(aq); KC = 10–9 (II)
H+(aq) + H2O(l) → H3O+(aq) (III)
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Brønsted–Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Brønsted–Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Brønsted–Lowry.
Số phát biểu đúng là:
A, 2.
B, 3.
C, 4.
D, 5.
Phân tích các phát biểu :
❌(1) – Sai. vì quá trình (II) xảy ra không hoàn toàn (thuận nghịch)
✔️(2) – Đúng. Trong dung dịch [Zn(OH2)6]2+ phân li ra H+ nên coi là acid theo Arrhenius.
✔️(3) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H2O nhận H+ nên là base.
✔️(4) – Đúng. Từ quá trình (I), (II) và (III) suy ra "trong nước, cation Zn2+ là acid theo Bronsted-Lowry", Zn2+ là chất nhường proton (H+)
❌(5) – Sai. Hằng số cân bằng của quá trình phân li nhỏ 10-9 nên phân lí ra lượng H+ nhỏ tính acid yếu.
✔️(6) – Đúng. Trong dung dịch zinc (II) chloride, nước vừa là dung môi (môi trường điện li), vừa đóng vai trò base (chất nhận proton) theo Bronsted-Lowry.
Có 4 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
❌(1) – Sai. vì quá trình (II) xảy ra không hoàn toàn (thuận nghịch)
✔️(2) – Đúng. Trong dung dịch [Zn(OH2)6]2+ phân li ra H+ nên coi là acid theo Arrhenius.
✔️(3) – Đúng. Thuyết bronsted – Lowry: Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.H2O nhận H+ nên là base.
✔️(4) – Đúng. Từ quá trình (I), (II) và (III) suy ra "trong nước, cation Zn2+ là acid theo Bronsted-Lowry", Zn2+ là chất nhường proton (H+)
❌(5) – Sai. Hằng số cân bằng của quá trình phân li nhỏ 10-9 nên phân lí ra lượng H+ nhỏ tính acid yếu.
✔️(6) – Đúng. Trong dung dịch zinc (II) chloride, nước vừa là dung môi (môi trường điện li), vừa đóng vai trò base (chất nhận proton) theo Bronsted-Lowry.
Có 4 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
Câu 16 [706082]: Nước cứng là kết quả tự nhiên tạo ra từ các khoáng chất (calcium và magnesium) tích tụ trong chu trình của nước, chứa một hàm Ca2+ và Mg2+ cao vượt mức tiêu chuẩn. Sử dụng nước cứng lâu ngày sẽ dễ dẫn đến sỏi thận, sỏi tiết niệu hoặc làm tắc thành trọng của động mạch, tĩnh mạch do đóng cặn vôi gây nguy hiểm đến sức khỏe. Tóc khô xơ, mất độ mềm mại.
(a) Nước có chứa nhiều ion HCO3– được gọi là nước có tính cứng tạm thời.
(b) Có thể làm mềm nước có tính cứng tạm thời bằng cách đun sôi nước.
(c) Có thể loại bỏ một phần tính cứng của nước có tính cứng vĩnh cửu bằng cách dùng một lượng vừa đủ Ca(OH)2.
(d) Không thể dùng cách đun sôi để loại bỏ hoàn toàn tính cứng của nước có chứa nhiều các ion sau: Mg2+, Ca2+, Cl–, HCO3–, SO42–.
(e) Nước cứng có thể là nguyên nhân gây nổ nồi hơi.Số phát biểu đúng là
(a) Nước có chứa nhiều ion HCO3– được gọi là nước có tính cứng tạm thời.
(b) Có thể làm mềm nước có tính cứng tạm thời bằng cách đun sôi nước.
(c) Có thể loại bỏ một phần tính cứng của nước có tính cứng vĩnh cửu bằng cách dùng một lượng vừa đủ Ca(OH)2.
(d) Không thể dùng cách đun sôi để loại bỏ hoàn toàn tính cứng của nước có chứa nhiều các ion sau: Mg2+, Ca2+, Cl–, HCO3–, SO42–.
(e) Nước cứng có thể là nguyên nhân gây nổ nồi hơi.Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu :
❌(a) – Sai. Nước có chứa nhiều ion Mg2+, Ca2+, HCO3- được gọi là -nước có tính cứng tạm thời.
✔️(b) – Đúng. Có thể làm mềm nước có tính cứng tạm thời bằng cách đun sôi nước.
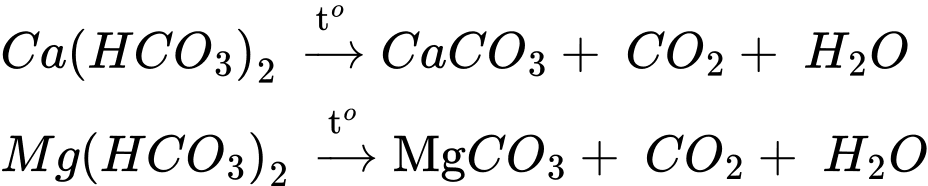
❌(c) – Sai. Không thể loại bỏ tính cứng của nước có tính cứng tạm thời bằng cách dùng một lượng vừa đủ Ca(OH)2.
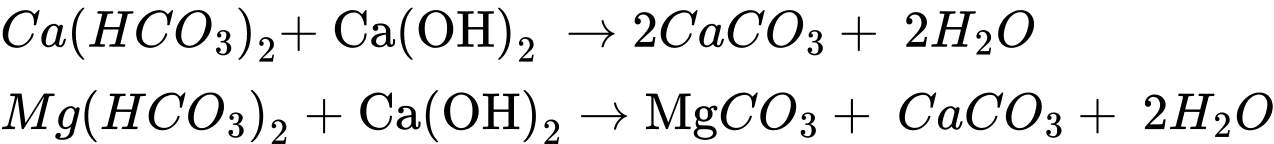
✔️(d) – Đúng. Không thể dùng cách đun sôi để loại bỏ hoàn toàn tính cứng của nước có chứa nhiều các ion sau: Mg2+, Ca2+, Сl-, НСО3- , SO42-. Chỉ loại bỏ được 1 phần Ca2+ và Mg2+ thông qua phản ứng phân hủy Ca(HCO3)2 và Mg(HCO3)2 làm nước cứng chuyển từ nước cứng toàn phần sang nước cứng vĩnh cữu.
✔️(e) – Đúng. nước cứng có thể gây đóng cặn CaCO3, MgCO3 trong nồi hơi tạo thành lớp cách nhiệt ngay dưới đáy nồi, làm cản trở quá trình dẫn nhiệt từ đó có thể gây hiện tượng nổ nồi hơi.
Có 3 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
❌(a) – Sai. Nước có chứa nhiều ion Mg2+, Ca2+, HCO3- được gọi là -nước có tính cứng tạm thời.
✔️(b) – Đúng. Có thể làm mềm nước có tính cứng tạm thời bằng cách đun sôi nước.
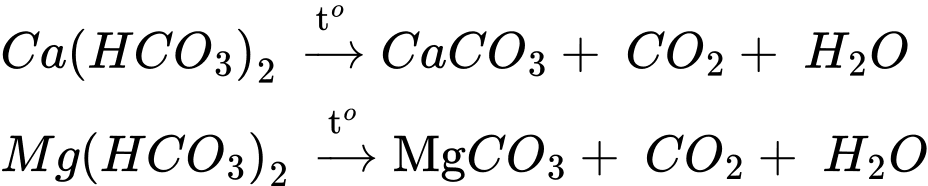
❌(c) – Sai. Không thể loại bỏ tính cứng của nước có tính cứng tạm thời bằng cách dùng một lượng vừa đủ Ca(OH)2.
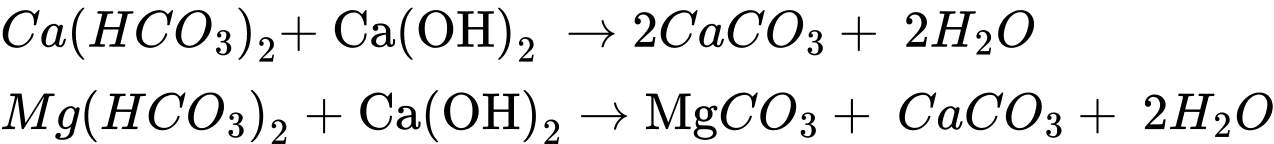
✔️(d) – Đúng. Không thể dùng cách đun sôi để loại bỏ hoàn toàn tính cứng của nước có chứa nhiều các ion sau: Mg2+, Ca2+, Сl-, НСО3- , SO42-. Chỉ loại bỏ được 1 phần Ca2+ và Mg2+ thông qua phản ứng phân hủy Ca(HCO3)2 và Mg(HCO3)2 làm nước cứng chuyển từ nước cứng toàn phần sang nước cứng vĩnh cữu.
✔️(e) – Đúng. nước cứng có thể gây đóng cặn CaCO3, MgCO3 trong nồi hơi tạo thành lớp cách nhiệt ngay dưới đáy nồi, làm cản trở quá trình dẫn nhiệt từ đó có thể gây hiện tượng nổ nồi hơi.
Có 3 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
Sử dụng thông tin dưới đây trả lời câu hỏi số 17, 18
Trong một nhà máy sản xuất cồn công nghiệp, người ta dùng nguyên liệu là mùn cưa chứa
50% cellulose để sản xuất ethyl alcohol, theo sơ đồ sau (biết hiệu suất toàn bộ quá trình là 35%).
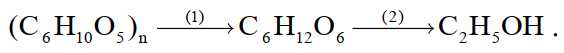
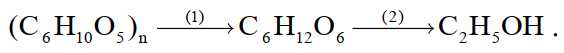
Câu 17 [706083]: Phản ứng xảy ra trong giai đoạn (1) là
A, Oxi hóa.
B, Lên men.
C, Xà phòng hóa.
D, Giảm mạch polymer.
Phản ứng cắt mạch polymer.
- Một số polymer có nhóm chức trong mạch có khả năng bị thủy phân cắt mạch như tinh bột, cellulose, capron, …
- Mạch polymer có thể bị phân hủy thành mạch ngắn hơn hoặc phân hủy hoàn toàn thành monomer tương ứng bởi nhiệt.
=> Phản ứng cắt mạch polymer làm giảm mạch polymer.
⟹Chọn đáp án D Đáp án: D
- Một số polymer có nhóm chức trong mạch có khả năng bị thủy phân cắt mạch như tinh bột, cellulose, capron, …
- Mạch polymer có thể bị phân hủy thành mạch ngắn hơn hoặc phân hủy hoàn toàn thành monomer tương ứng bởi nhiệt.
=> Phản ứng cắt mạch polymer làm giảm mạch polymer.
⟹Chọn đáp án D Đáp án: D
Câu 18 [706084]: Để sản xuất 10000 lít cồn 96° thì khối lượng mùn cưa cần dùng là bao nhiêu? Biết khối lượng riêng của ethyl alcohol là 0,8 gam/mL.
A, 77,28 tấn.
B, 43,28 tấn.
C, 38,64 tấn.
D, 51,18 tấn.
Thể tích C2H5OH trong 10000 lít cồn 96o là VC2H5OH = 10000.0,96 = 9600 L = 9,6.106 mL
Khối lượng C2H5OH là mC2H5OH = 9,6.106.0,8 = 7680000 gam = 7,68 tấn
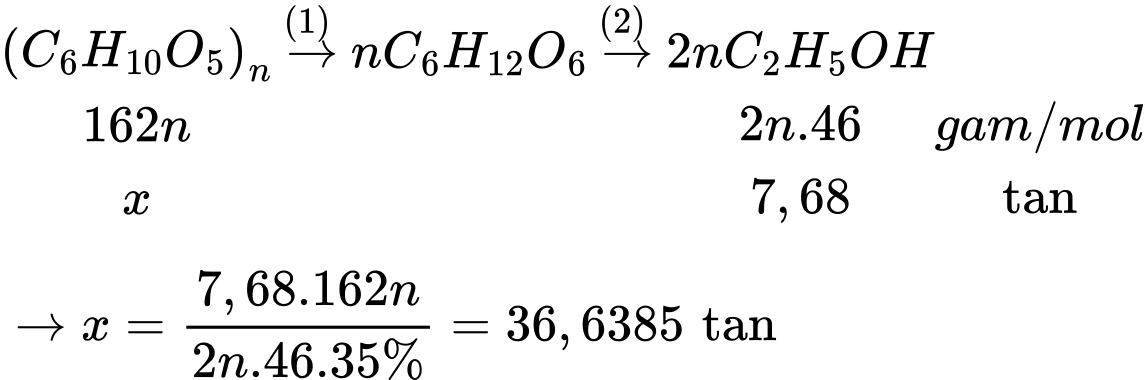
Khối lượng mùn cưa cần dùng là m = 36,6385:50% ≈ 77,28 tấn.
⟹Chọn đáp án A Đáp án: A
Khối lượng C2H5OH là mC2H5OH = 9,6.106.0,8 = 7680000 gam = 7,68 tấn
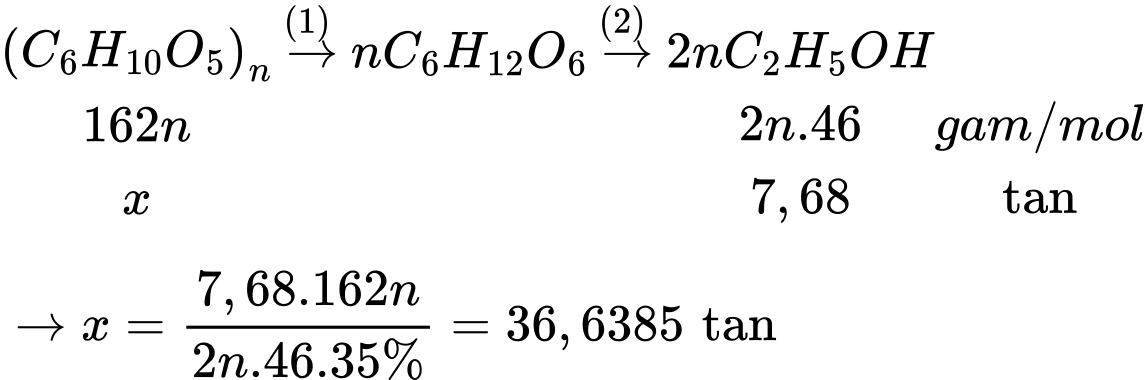
Khối lượng mùn cưa cần dùng là m = 36,6385:50% ≈ 77,28 tấn.
⟹Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [305831]: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào cốc thủy tinh chịu nhiệt khoảng 5 gam dầu dừa và 10 ml dung dịch NaOH 40%.
Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi. Để nguội hỗn hợp.
Bước 3: Rót vào hỗn hợp 15 - 20 ml dung dịch NaCl bão hòa, nóng, khuấy nhẹ rồi để yên.
Bước 1: Cho vào cốc thủy tinh chịu nhiệt khoảng 5 gam dầu dừa và 10 ml dung dịch NaOH 40%.
Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi. Để nguội hỗn hợp.
Bước 3: Rót vào hỗn hợp 15 - 20 ml dung dịch NaCl bão hòa, nóng, khuấy nhẹ rồi để yên.
HD: Dầu dừa chứa các chất béo không no như triolein, trilinolein, khi đun với dung dịch NaOH xảy ra phản ứng xà phòng hóa: (RCOO)3C3H5 + 3NaOH ––to→ 3RCOONa + C3H5(OH)3.
Sản phẩm thu được gồm muối acid béo và glycerol dễ tan trong dung dịch.
Ở bước 3 hòa tan thêm NaCl (muối ăn) vào ⇝ làm giảm độ tan của muối axit béo, thêm nữa khối lượng riêng của dung dịch lúc này cũng tăng lên ⇝ các muối acid béo bị tách ra khỏi dung dịch, nhẹ hơn dung dịch ⇝ tạo chất rắn màu trắng nổi lên trên dung dịch.
Xem xét các phát biểu:
❌ a. sai vì glycerol tan vô hạn trong dung dịch, chất rắn màu trắng là muối axit béo.
✔️ b. đúng vì như phân tích trên, NaCl bão hòa nóng để giúp thu được sản phẩm.
✔️ c. đúng. Phản ứng tiến hành trong thời gian dài (30 phút) sẽ làm bay hơi nước, mà phản ứng thủy phân, không có nước thì phản ứng sao có thể xảy ra ⇝ cần bổ sung nước để đảm bảo phản ứng. Ở đây, việc giữ thể tích không đổi thực chất là 1 phép đo áng chứng để kiểm soát; bởi dung dịch chứa nhiều chất, không biết bao giờ là nước cạn hết,...
✔️ d. đúng phản ứng thủy phân chất béo trong môi trường base gọi là phản ứng xà phòng hóa.
Sản phẩm thu được gồm muối acid béo và glycerol dễ tan trong dung dịch.
Ở bước 3 hòa tan thêm NaCl (muối ăn) vào ⇝ làm giảm độ tan của muối axit béo, thêm nữa khối lượng riêng của dung dịch lúc này cũng tăng lên ⇝ các muối acid béo bị tách ra khỏi dung dịch, nhẹ hơn dung dịch ⇝ tạo chất rắn màu trắng nổi lên trên dung dịch.
Xem xét các phát biểu:
❌ a. sai vì glycerol tan vô hạn trong dung dịch, chất rắn màu trắng là muối axit béo.
✔️ b. đúng vì như phân tích trên, NaCl bão hòa nóng để giúp thu được sản phẩm.
✔️ c. đúng. Phản ứng tiến hành trong thời gian dài (30 phút) sẽ làm bay hơi nước, mà phản ứng thủy phân, không có nước thì phản ứng sao có thể xảy ra ⇝ cần bổ sung nước để đảm bảo phản ứng. Ở đây, việc giữ thể tích không đổi thực chất là 1 phép đo áng chứng để kiểm soát; bởi dung dịch chứa nhiều chất, không biết bao giờ là nước cạn hết,...
✔️ d. đúng phản ứng thủy phân chất béo trong môi trường base gọi là phản ứng xà phòng hóa.
Câu 20 [706085]: Hàm lượng sắt trong các mẫu quặng có thể biến đổi đa dạng, tùy vào vị trí tìm thấy. Một nhóm học sinh tìm thấy một quặng sắt có thành phần chính là Fe2O3 và quan tâm đến việc có bao nhiêu sắt trong loại quặng đó. Nhóm học sinh tiến hành các bước phân tích như sau:
∎ Bước 1: Cân 7,50 g quặng, cho vào trong cốc rồi rót dung dịch nitric acid đậm đặc dư vào.
∎ Bước 2: Thêm một lượng phù hợp dung dịch sodium hydroxide vào dung dịch trên, thấy có kết tủa X màu nâu đỏ xuất hiện.
∎ Bước 3: Thu lấy toàn bộ kết tủa bằng phễu lọc. Nung nóng kết tủa ở 900 °C cho đến khi khối lượng không thay đổi thì thu được 3,19 g chất rắn Y.
Giả sử rằng các tạp chất trong mẫu quặng đã bị loại bỏ hoàn toàn trước khi kết tủa.
∎ Bước 1: Cân 7,50 g quặng, cho vào trong cốc rồi rót dung dịch nitric acid đậm đặc dư vào.
∎ Bước 2: Thêm một lượng phù hợp dung dịch sodium hydroxide vào dung dịch trên, thấy có kết tủa X màu nâu đỏ xuất hiện.
∎ Bước 3: Thu lấy toàn bộ kết tủa bằng phễu lọc. Nung nóng kết tủa ở 900 °C cho đến khi khối lượng không thay đổi thì thu được 3,19 g chất rắn Y.
Giả sử rằng các tạp chất trong mẫu quặng đã bị loại bỏ hoàn toàn trước khi kết tủa.
Bước 1: Cân 7,50 g quặng, cho vào trong cốc rồi rót dung dịch nitric acid đậm đặc dư vào.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Bước 2: Thêm một lượng phù hợp dung dịch sodium hydroxide vào dung dịch trên, thấy có kết tủa X màu nâu đỏ xuất hiện. Kết tủa X là Fe(OH)3
3NaOH + Fe(NO3)3 → 3NaNO3 + Fe(OH)3
Bước 3: Thu lấy toàn bộ kết tủa bằng phễu lọc. Nung nóng kết tủa ở 900 oC cho đến khi khối lượng không thay đổi thì thu được 3,19 g chất rắn Y.
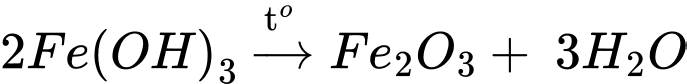
Số mol của Fe2O3 là nFe2O3 = 3,19 :160 = 0,0190375 mol
Phần trăm khối lượng Fe trong mẫu quặng là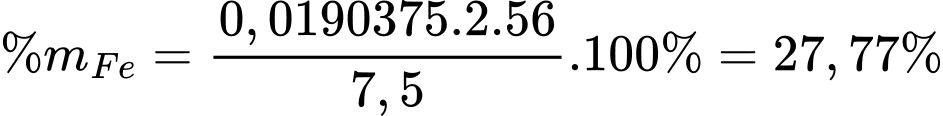
Phân tích các phát biểu:
✔️(a) – Đúng. Kết tủa X màu nâu đỏ là Fe(OH)3.
❌(b) – Sai. Dung dịch NaOH có tác dụng trung hòa acid dư và kết tủa ion Fe3+
✔️(c) – Đúng. Có thể thay dung dịch NaOH bằng dung dịch KOH ở bước 2 thì hiện tượng không đổi.
❌(d) – Sai. Hàm lượng sắt theo khối lượng trong mẫu quặng ban đầu là 27,77 %.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Bước 2: Thêm một lượng phù hợp dung dịch sodium hydroxide vào dung dịch trên, thấy có kết tủa X màu nâu đỏ xuất hiện. Kết tủa X là Fe(OH)3
3NaOH + Fe(NO3)3 → 3NaNO3 + Fe(OH)3
Bước 3: Thu lấy toàn bộ kết tủa bằng phễu lọc. Nung nóng kết tủa ở 900 oC cho đến khi khối lượng không thay đổi thì thu được 3,19 g chất rắn Y.
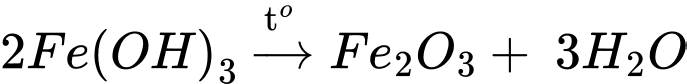
Số mol của Fe2O3 là nFe2O3 = 3,19 :160 = 0,0190375 mol
Phần trăm khối lượng Fe trong mẫu quặng là
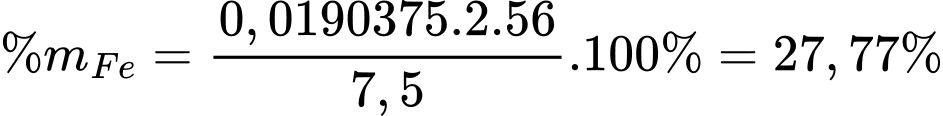
Phân tích các phát biểu:
✔️(a) – Đúng. Kết tủa X màu nâu đỏ là Fe(OH)3.
❌(b) – Sai. Dung dịch NaOH có tác dụng trung hòa acid dư và kết tủa ion Fe3+
✔️(c) – Đúng. Có thể thay dung dịch NaOH bằng dung dịch KOH ở bước 2 thì hiện tượng không đổi.
❌(d) – Sai. Hàm lượng sắt theo khối lượng trong mẫu quặng ban đầu là 27,77 %.
Câu 21 [706086]: Quá trình kết tinh có thể thực hiện được vì hầu hết các chất rắn có xu hướng hòa tan nhiều hơn trong dung môi khi nhiệt độ của chúng tăng. Để kết tinh tốt nhất, hợp chất phải rất hòa tan trong dung môi nóng và hòa tan tối thiểu (hoặc không hòa tan) trong dung môi lạnh. Đồ thị dữ liệu dưới đây cho thấy độ tan theo nhiệt độ của diphenylamine trong dung môi hexane:
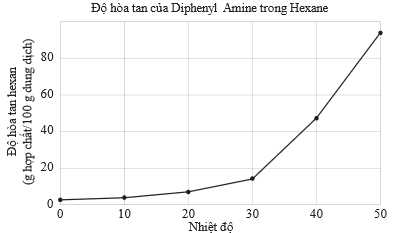

Phân tích các phát biểu :
❌(a) – Sai. Tại 10 oC, độ tan của diphenylamine thấp hơn tại 20 oC, từ độ thị khi tăng nhiệt độ thì độ tan tăng dần.
✔️(b) – Đúng. Từ đồ thị độ tan của diphenylamine trong hexane tăng trong khoảng nhiệt độ 0 – 50 oC.
✔️(c) – Đúng. Thực hiện kết tinh tại 0 oC sẽ thu được khối lượng chất kết tinh là lớn nhất, tại đấy độ tan của diphenylamine là nhỏ nhất nên kết tinh được nhiều diphenylamine nhất.
✔️(d) – Đúng. Từ kết quả của đồ thị có thể kết luận rằng diphenylamine có thể được kết tinh tốt trong dung môi hexane ở nhiệt độ khoảng 40 – 50 oC
❌(a) – Sai. Tại 10 oC, độ tan của diphenylamine thấp hơn tại 20 oC, từ độ thị khi tăng nhiệt độ thì độ tan tăng dần.
✔️(b) – Đúng. Từ đồ thị độ tan của diphenylamine trong hexane tăng trong khoảng nhiệt độ 0 – 50 oC.
✔️(c) – Đúng. Thực hiện kết tinh tại 0 oC sẽ thu được khối lượng chất kết tinh là lớn nhất, tại đấy độ tan của diphenylamine là nhỏ nhất nên kết tinh được nhiều diphenylamine nhất.
✔️(d) – Đúng. Từ kết quả của đồ thị có thể kết luận rằng diphenylamine có thể được kết tinh tốt trong dung môi hexane ở nhiệt độ khoảng 40 – 50 oC
Câu 22 [706087]: Ba buồng chứa đầy khí, được bịt kín và kết nối bằng nhiều ống như minh họa bên dưới.
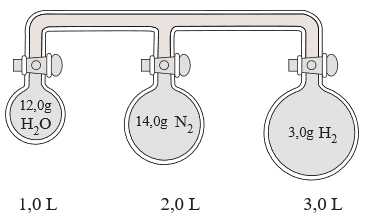
Hệ được giữ ở nhiệt độ không đổi trong suốt quá trình và các van ban đầu được đóng lại.

Hệ được giữ ở nhiệt độ không đổi trong suốt quá trình và các van ban đầu được đóng lại.
Phân tích các phát biểu :
❌(a) – Sai.
Số mol của H2O là nH2O = 12 : 18 = 0,667 mol
Số mol của N2 là nN2 = 14 : 28 = 0,5 mol
Số mol của H2 là nH2 = 3 : 2 = 1,5 mol
❌(b) – Sai. Khi van đóng, H2 gây ra áp suất là lớn nhất
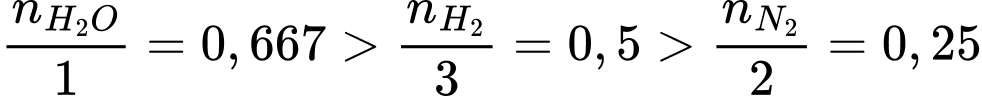 nguyên do có tỉ lệ mol khí trên tổng thể tích của bình là lớn nhất
nguyên do có tỉ lệ mol khí trên tổng thể tích của bình là lớn nhất
❌(c) – Sai. Cùng một số mol khí, thể tích hệ càng lớn thì áp suất của khí càng giảm.
❌(d) – Sai. Tiến hành mở van và cho phép các khí hòa trộn hoàn toàn, lúc này bình chứa H2O gây ra áp suất là lớn nhất nguyên do bình H2O có thể tích nhất.
❌(a) – Sai.
Số mol của H2O là nH2O = 12 : 18 = 0,667 mol
Số mol của N2 là nN2 = 14 : 28 = 0,5 mol
Số mol của H2 là nH2 = 3 : 2 = 1,5 mol
❌(b) – Sai. Khi van đóng, H2 gây ra áp suất là lớn nhất
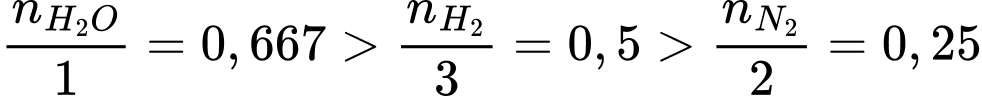 nguyên do có tỉ lệ mol khí trên tổng thể tích của bình là lớn nhất
nguyên do có tỉ lệ mol khí trên tổng thể tích của bình là lớn nhất ❌(c) – Sai. Cùng một số mol khí, thể tích hệ càng lớn thì áp suất của khí càng giảm.
❌(d) – Sai. Tiến hành mở van và cho phép các khí hòa trộn hoàn toàn, lúc này bình chứa H2O gây ra áp suất là lớn nhất nguyên do bình H2O có thể tích nhất.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706088]: Khi hạ nhiệt độ 1642 gam dung dịch bão hòa MgSO4 ở 80oC xuống 20oC thì thu được m gam tinh thể MgSO4.6H2O tách ra khỏi dung dịch. Biết rằng độ tan của MgSO4 ở 80oC là 64,2 gam và ở 20oC là 44,5 gam. Giá trị của m là bao nhiêu (Làm tròn đến số nguyên)?
- Ở 800C, độ tan S MgSO4= 64,2 gam
- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòa
a gam H2O hòa tan b gam MgSO4 tạo thành 1642 gam dung dịch bão hòa
→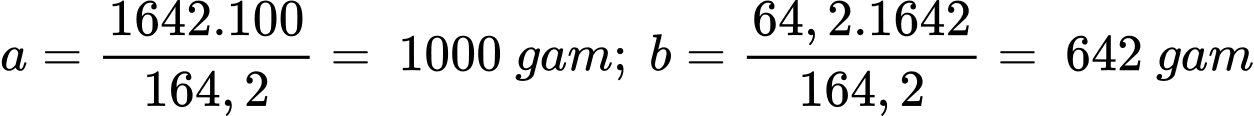
- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol
⟹ Khối lượng H2O tách ra: 108x (g)
Khối lượng MgSO4 tách ra: 120x (gam)
- Ở 200C, S MgSO4= 44,5 gam
- Ta có phương trình: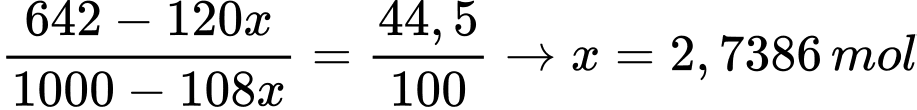
→ Khối lượng MgSO4.6H2O kết tinh: 228.2,7386 ≈ 624 gam.
⟹Điền đáp án : 624
- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòa
a gam H2O hòa tan b gam MgSO4 tạo thành 1642 gam dung dịch bão hòa
→
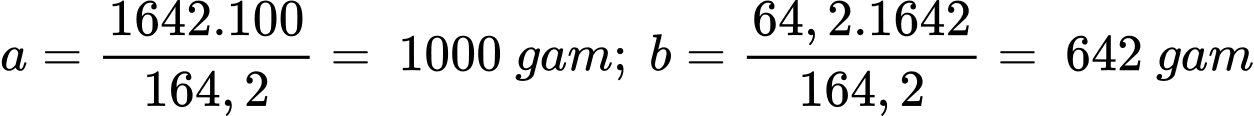
- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol
⟹ Khối lượng H2O tách ra: 108x (g)
Khối lượng MgSO4 tách ra: 120x (gam)
- Ở 200C, S MgSO4= 44,5 gam
- Ta có phương trình:
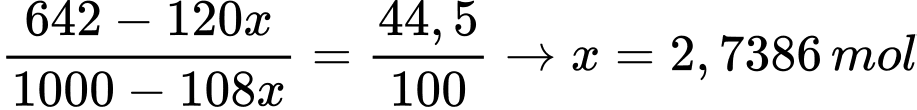
→ Khối lượng MgSO4.6H2O kết tinh: 228.2,7386 ≈ 624 gam.
⟹Điền đáp án : 624
Câu 24 [706089]: Cho các chất sau: CrO3, Fe, Cr(OH)3, Cr, Al, Al2O3, ZnO. Số chất tan được trong dung dịch NaOH đặc là
Số chất tan được trong dung dịch NaOH đặc là CrO3, Cr(OH)3, Al, Al2O3 và ZnO.
CrO3 + 2NaOH → Na2CrO4 + H2O
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
⟹Điền đáp án : 5
CrO3 + 2NaOH → Na2CrO4 + H2O
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
⟹Điền đáp án : 5
Câu 25 [706090]: Da nhân tạo (PVC) được điều chế từ khí thiên nhiên theo sơ đồ:
CH4 → C2H2 → CH2=CH-Cl → (-CH2-CHCl-)n.
Nếu hiệu suất của toàn bộ quá trình điều chế là 20%, muốn điều chế được 1 tấn PVC thì thể tích khí thiên nhiên (chứa 80% methane) ở điều kiện chuẩn cần dùng là bao nhiêu m3?
CH4 → C2H2 → CH2=CH-Cl → (-CH2-CHCl-)n.
Nếu hiệu suất của toàn bộ quá trình điều chế là 20%, muốn điều chế được 1 tấn PVC thì thể tích khí thiên nhiên (chứa 80% methane) ở điều kiện chuẩn cần dùng là bao nhiêu m3?
2CH4 ⟶ C2H2 ⟶ C2H3Cl ⟶ PVC
Đổi 1 tấn = 106 g
Số mol PVC là : nPVC = 106 : 62,5 mol
Theo phương trình, số mol nCH4 = 2nPVC = 106 : 62,5 × 2 : 20% = 16.104 mol
Vì khí thiên nhiên chứa 80% methane nên:
VCH4 = n × 24,79 = 16.104 × 24,79 = 3966,4 m3
V khí thiên nhiên = V CH4 : 80% = 4958 m3
⟹ Điền đáp án : 4958
Đổi 1 tấn = 106 g
Số mol PVC là : nPVC = 106 : 62,5 mol
Theo phương trình, số mol nCH4 = 2nPVC = 106 : 62,5 × 2 : 20% = 16.104 mol
Vì khí thiên nhiên chứa 80% methane nên:
VCH4 = n × 24,79 = 16.104 × 24,79 = 3966,4 m3
V khí thiên nhiên = V CH4 : 80% = 4958 m3
⟹ Điền đáp án : 4958
Câu 26 [706091]: Có bao nhiêu hợp chất có công thức phân tử C5H8 (chứa hai liên kết π) được tạo thành khi 1,4-dibromopentane phản ứng với NaOH trong ethanol?
Có 3 công thức cấu tạo của hợp chất C5H8 (chứa 2 liên kết ) được tạo thành khi 1,4-dibromopentane phản ứng với NaOH trong ethanol.
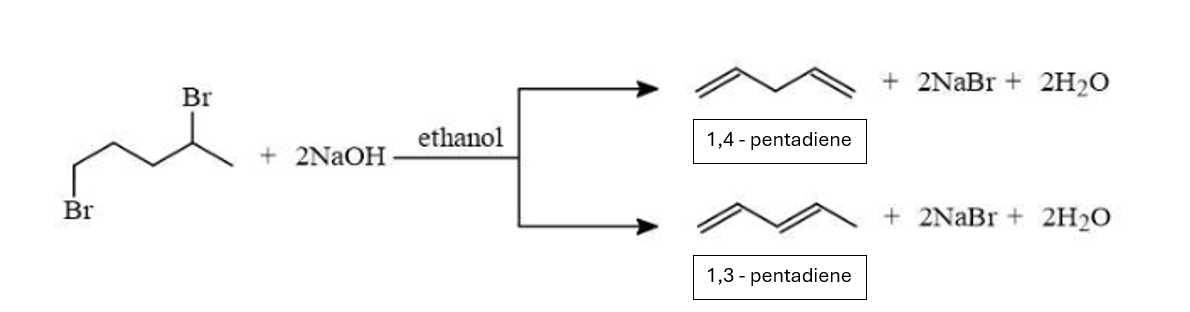
Sản phẩm 2 (1,3-pentadiene) có đồng phân hình học ( cis - trans ).
⟹ Có 1 + 2 = 3 công thức thỏa mãn.
⟹ Điền đáp án : 3

Sản phẩm 2 (1,3-pentadiene) có đồng phân hình học ( cis - trans ).
⟹ Có 1 + 2 = 3 công thức thỏa mãn.
⟹ Điền đáp án : 3
Câu 27 [706092]: 25 mL dung dịch hydroxide kim loại, X(OH)y nồng độ 0,0125 M được chuẩn độ bằng dung dịch hydrochloric acid 0,05 M. Cần 12,5 mL acid để trung hòa lượng hydroxide kim loại trên. Giá trị của y là
Phản ứng tổng quát: 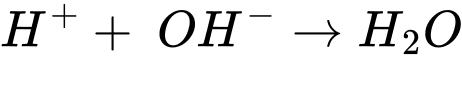
Đổi 25 mL = 0,025 L; 12,5 mL = 0,0125 L
Số mol của hydroxide kim loại là nX(OH)y = 0,025.0,0125 = 0,0003125 mol
Số mol của dung dịch acid cần chuẩn độ là nHCl = 0,0125.0,05 = 0,000625 mol
Từ PTHH số mol của OH- là nOH- = nH+ = 0,000625 mol
Giá trị của y là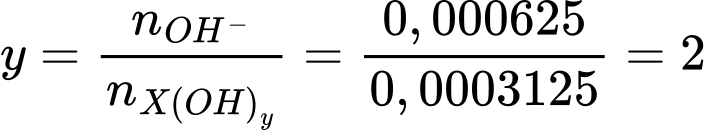
⟹Điền đáp án : 2
Đổi 25 mL = 0,025 L; 12,5 mL = 0,0125 L
Số mol của hydroxide kim loại là nX(OH)y = 0,025.0,0125 = 0,0003125 mol
Số mol của dung dịch acid cần chuẩn độ là nHCl = 0,0125.0,05 = 0,000625 mol
Từ PTHH số mol của OH- là nOH- = nH+ = 0,000625 mol
Giá trị của y là
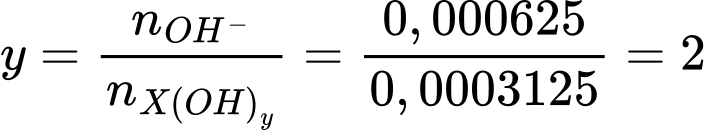
⟹Điền đáp án : 2
Câu 28 [706093]: Ion Ca2+cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường cho thấy dấu hiệu cơ thể đang bị bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
2KMnO4 + 5CaC2O4 + 8H2SO4 → 5CaSO4 + K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 1,95 mL dung dịch potassium permanganate (KMnO4) 4,98×10–4 M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca2+/100 mL máu (Làm tròn đến hàng phần trăm).
2KMnO4 + 5CaC2O4 + 8H2SO4 → 5CaSO4 + K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 1,95 mL dung dịch potassium permanganate (KMnO4) 4,98×10–4 M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca2+/100 mL máu (Làm tròn đến hàng phần trăm).
5CaC2O4 + 2KMnO4 + 8H2SO4 → 5CaSO4 + K2SO4 + 2MnSO4 + 8H2O + 10CO2
Đổi 1,95 mL = 0,00195 L
Số mol của KMnO4 là nKMnO4 = 0,00195,4,98.10-4 = 9,711.10-7 mol
Số mol Ca2+ trong 1 mL máu là nCa2+ = 9,711.10-7 × 5 ÷ 2 = 2,42775×10-6 gam
Nồng độ ion calcium trong máu là
mCa2+ (100mL) = 2,422775×10-6 × 40 × 100 = 9,711×10-3 (gam) ≈ 9,71
⟹Điền đáp án : 9,71
Đổi 1,95 mL = 0,00195 L
Số mol của KMnO4 là nKMnO4 = 0,00195,4,98.10-4 = 9,711.10-7 mol
Số mol Ca2+ trong 1 mL máu là nCa2+ = 9,711.10-7 × 5 ÷ 2 = 2,42775×10-6 gam
Nồng độ ion calcium trong máu là
mCa2+ (100mL) = 2,422775×10-6 × 40 × 100 = 9,711×10-3 (gam) ≈ 9,71
⟹Điền đáp án : 9,71