PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706094]: “Khi đốt các hợp chất của kim loại kiềm khác nhau trên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu ..(1).. với ..(2).. của Li có ngọn lửa màu đỏ tía; ..(2).. của Na có ngọn lửa có màu vàng; ..(2).. của K có ngọn lửa màu tím”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A, giống nhau, đơn chất.
B, khác nhau, hợp chất.
C, không xác định, hợp chất.
D, khác nhau, nguyên tố.
Khi đốt các hợp chất của kim loại kiềm khác nhau, ngọn lửa xuất hiện với màu đặc trưng của từng kim loại.
Các kim loại kiềm (Li, Na, K, ...) là nguyên tố khác nhau.
Các hợp chất của chúng là hợp chất khác nhau.
⟹Chọn đáp án B Đáp án: B
Các kim loại kiềm (Li, Na, K, ...) là nguyên tố khác nhau.
Các hợp chất của chúng là hợp chất khác nhau.
⟹Chọn đáp án B Đáp án: B
Câu 2 [706095]: Trong nhiều năm, Na2CO3 được sản xuất bằng quy trình Solvay. Một bước trong quy trình là NH3 được hòa tan trong dung dịch NaCl bão hòa, sau đó sục khí CO2 liên tục. Khi dung dịch muối sodium bicarbonate bão hòa, nó sẽ bị tách ra dưới dạng kết tủa. Công thức hóa học của sodium bicarbonate là
A, K2CO3.
B, Na2CO3.
C, NaHCO3.
D, NaHSO3.
Sodium bicarbonat : là một hợp chất vô cơ có công thức hóa học NaHCO3.
Theo quy trình Solvay :
NaCl + NH4HCO3 → NaHCO3 + NH4Cl
Đây là một phản ứng thuận nghịch và các chất tham gia lẫn sản phẩm đều tan trong nước, tuy nhiên NaHCO3 ít tan hơn ba chất còn lại, nên có thể lọc tách và nhiệt phân NaHCO3 để tạo thành Na2CO3
⟹Chọn đáp án C Đáp án: C
Theo quy trình Solvay :
NaCl + NH4HCO3 → NaHCO3 + NH4Cl
Đây là một phản ứng thuận nghịch và các chất tham gia lẫn sản phẩm đều tan trong nước, tuy nhiên NaHCO3 ít tan hơn ba chất còn lại, nên có thể lọc tách và nhiệt phân NaHCO3 để tạo thành Na2CO3
⟹Chọn đáp án C Đáp án: C
Câu 3 [706096]: Chất nào dưới đây là một disaccharide?
A, Aniline.
B, Potassium dichromate.
C, Saccharose.
D, Hexamethylenediamine.
Disaccharide: Thủy phân hoàn toàn mỗi phân tử tạo thành hai phân tử monosaccharide.
Phân tích các đáp án :
❌A. Aniline là một hợp chất hữu cơ thuộc nhóm amine thơm, không phải disaccharide.
❌B. Potassium dichromate (K2Cr2O7): Là một hợp chất vô cơ, không phải disaccharide.
✔️C. Saccharose: Là tên khoa học của đường mía, thuộc nhóm disaccharide.
❌D. Hexamethylenediamine: Là một hợp chất hữu cơ chứa nhóm amine, không phải disaccharide.
⟹ Chọn đáp án C Đáp án: C
Phân tích các đáp án :
❌A. Aniline là một hợp chất hữu cơ thuộc nhóm amine thơm, không phải disaccharide.
❌B. Potassium dichromate (K2Cr2O7): Là một hợp chất vô cơ, không phải disaccharide.
✔️C. Saccharose: Là tên khoa học của đường mía, thuộc nhóm disaccharide.
❌D. Hexamethylenediamine: Là một hợp chất hữu cơ chứa nhóm amine, không phải disaccharide.
⟹ Chọn đáp án C Đáp án: C
Câu 4 [310476]: Vật liệu nền nào sau đây được sử dụng trong vật liệu composite?
A, nhựa nhiệt rắn.
B, nhựa nhiệt dẻo.
C, keo dán.
D, Cả A và B.
Phân tích các đáp án:
✔️A. Nhựa nhiệt rắn: Khi được xử lý, chúng cứng lại và không thể tái nóng chảy, giúp composite có độ bền cơ học cao.
✔️B. Nhựa nhiệt dẻo: Có thể tái chế và gia công lại bằng nhiệt, được sử dụng trong một số ứng dụng đặc biệt.
❌C. Keo dán không phải là vật liệu nền mà chỉ là chất liên kết trong một số trường hợp.
⟹Chọn đáp án D Đáp án: D
✔️A. Nhựa nhiệt rắn: Khi được xử lý, chúng cứng lại và không thể tái nóng chảy, giúp composite có độ bền cơ học cao.
✔️B. Nhựa nhiệt dẻo: Có thể tái chế và gia công lại bằng nhiệt, được sử dụng trong một số ứng dụng đặc biệt.
❌C. Keo dán không phải là vật liệu nền mà chỉ là chất liên kết trong một số trường hợp.
⟹Chọn đáp án D Đáp án: D
Câu 5 [706097]: Khi để một con dao bằng thép không gỉ trong nước muối hai – ba ngày, con dao có thể bị vấn đề gì?
A, Ăn mòn hóa học.
B, Ăn mòn điện hóa.
C, Không xảy ra ăn mòn.
D, Gỉ sét nhẹ nhưng không ăn mòn.
- Trong nước muối, dao bằng thép không gỉ bị ăn mòn điện hóa. Sắt và carbon tròn gang tiếp xúc với dung dịch chất điện li tạo ra pin điện hóa.
Anode: Fe → Fe2+ + 2e
Cathode: O2(g) + 2H2O(l) + 4e → 4OH-
- Fe2+ tiếp tục bị oxi hóa bởi oxygen trong không khí tạo gỉ sắt Fe2O3.nH2O.
⟹Chọn đáp án B Đáp án: B
Anode: Fe → Fe2+ + 2e
Cathode: O2(g) + 2H2O(l) + 4e → 4OH-
- Fe2+ tiếp tục bị oxi hóa bởi oxygen trong không khí tạo gỉ sắt Fe2O3.nH2O.
⟹Chọn đáp án B Đáp án: B
Câu 6 [706098]: Để khử tính cứng của nước cứng tạm thời, có thể sử dụng hóa chất nào sau đây?
A, Ca(OH)2.
B, HCl.
C, NaHCO3.
D, CaSO4.
Dùng Ca(OH)2 với lượng vừa đủ để phản ứng với muối Ca(HCO3)2 và Mg(HCO3)2 tạo ra hợp chất không tan, làm mất tính cứng tạm thời của nước.
Ví dụ: Ca(HCO3)2(aq) + Ca(OH)2(aq) → 2CaCO3(s) + 2H2O(l).
⟹Chọn đáp án A Đáp án: A
Ví dụ: Ca(HCO3)2(aq) + Ca(OH)2(aq) → 2CaCO3(s) + 2H2O(l).
⟹Chọn đáp án A Đáp án: A
Câu 7 [186432]: Một học sinh đang tiến hành chuẩn độ bằng chất chỉ thị phenolphthalein. Màu đúng của chất chỉ thị này trong môi trường acid và môi trường kiềm loãng lần lượt là
A, màu hồng và không màu.
B, Không màu và màu hồng.
C, màu đỏ và màu vàng.
D, màu hồng và màu xanh.
Trong môi trường acid: Phenolphtalein không có màu.
Trong môi trường base: Phenolphtalein chuyển sang màu hồng.
Màu đúng của chất chỉ thị này trong môi trường acid và môi trường kiềm loãng lần lượt là : không màu và màu hồng.
⟹Chọn đáp án B
Đáp án: B
Trong môi trường base: Phenolphtalein chuyển sang màu hồng.
Màu đúng của chất chỉ thị này trong môi trường acid và môi trường kiềm loãng lần lượt là : không màu và màu hồng.
⟹Chọn đáp án B
Đáp án: B
Câu 8 [190837]: Chất phản ứng với thuốc thử Tollens, đun nóng tạo ra Ag là
A, ethyl alcohol.
B, acetic acid.
C, acetaldehyde.
D, glycerol.
Phản ứng oxi hóa (dung dịch silver nitrate trong ammonia, Cu(OH)2)
Aldehyde + AgNO3/NH3 → Muối ammonium + Ag↓ + NH4NO3
Chất phản ứng với thuốc thử Tollens tạo ra Ag là acctaldehyde
CH3CHO + 2AgNO3 + 2NH3 + H2O → CH3COOH + 2NH4NO3 + 2Ag
Aldehyde có phản ứng với AgNO3/NH3 (Thuốc thử Tollens)
⟹Chọn đáp án C Đáp án: C
Aldehyde + AgNO3/NH3 → Muối ammonium + Ag↓ + NH4NO3
Chất phản ứng với thuốc thử Tollens tạo ra Ag là acctaldehyde
CH3CHO + 2AgNO3 + 2NH3 + H2O → CH3COOH + 2NH4NO3 + 2Ag
Aldehyde có phản ứng với AgNO3/NH3 (Thuốc thử Tollens)
⟹Chọn đáp án C Đáp án: C
Câu 9 [706099]: Hydrogen fluoride là chất có độc tính cao. Với kích thước phân tử nhỏ, HF dễ dàng thấm qua da, đến các mô sâu bên trong cơ thể và phá huỷ chúng. HF phá huỷ các mô xương thông qua việc tạo thành các kết tủa với Ca2+ và Mg2+ có trong cấu tạo xương; anion F– từ HF sẽ làm vô hiệu hoá vai trò của một số enzyme trong cơ thể; khi lượng ion F– lớn, nồng độ calcium trong máu nhanh chóng sụt giảm có thể gây ngưng tim đột ngột.
Calcium gluconate là một chất đặc hiệu trong sơ cấp cứu khi cơ thể bị phơi nhiễm với HF. Chất này có thể được sử dụng bằng cách bôi lên vùng da đã tiếp xúc với HF, kết hợp tiêm dưới da, tiêm vào mạch tuỳ vào mức độ ngộ độc.
Trong các phát biểu sau:
(a) CaF2, MgF2 là những muối không tan trong nước.
(b) HCl cũng gây ngộ độc cho cơ thể theo cách tương tự như HF.
(c) Dung dịch có nồng độ NaF cao cũng có thể gây hại cho tim nếu uống phải.
(d) Calcium gluconate có thể làm giảm nồng độ fluoride trong cơ thể người ngộ độc.
Số phát biểu không đúng là
Calcium gluconate là một chất đặc hiệu trong sơ cấp cứu khi cơ thể bị phơi nhiễm với HF. Chất này có thể được sử dụng bằng cách bôi lên vùng da đã tiếp xúc với HF, kết hợp tiêm dưới da, tiêm vào mạch tuỳ vào mức độ ngộ độc.
Trong các phát biểu sau:
(a) CaF2, MgF2 là những muối không tan trong nước.
(b) HCl cũng gây ngộ độc cho cơ thể theo cách tương tự như HF.
(c) Dung dịch có nồng độ NaF cao cũng có thể gây hại cho tim nếu uống phải.
(d) Calcium gluconate có thể làm giảm nồng độ fluoride trong cơ thể người ngộ độc.
Số phát biểu không đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu :
✔️(a) – Đúng. CaF2, MgF2 là những muối không tan trong nước. HF phá huỷ các mô xương thông qua việc tạo thành các kết tủa với Ca2+ và Mg2+ có trong cấu tạo xương; anion F- từ HF sẽ làm vô hiệu hoá vai trò của một số enzyme trong cơ thể; khi lượng ion F- lớn, nồng độ calcium trong máu nhanh chóng sụt giảm có thể gây ngưng tim đột ngột.
❌(b) – Sai. HCl không gây ngộ độc cho cơ thể theo cách tương tự như HF. HCl là hợp chất khí độc hại, không màu, có tính ăn mòn cao, tiếp xúc với hơi ẩm sẽ hình thành khói trắng. Tiếp xúc HCl lâu ngày dễ gây ra các bệnh như viêm dạ dày, viêm phế quản, viêm da, nhiễm độc.
✔️(c) – Đúng. Khi lượng ion F- lớn, nồng độ calcium trong máu nhanh chóng sụt giảm có thể gây ngưng tim đột ngột.
✔️(d) – Đúng. Calcium gluconate là một chất đặc hiệu trong sơ cấp cứu khi cơ thể bị phơi nhiễm với HF. Chất này có thể được sử dụng bằng cách bôi lên vùng da đã tiếp xúc với HF, kết hợp tiêm dưới da, tiêm vào mạch tuỳ vào mức độ ngộ độc.
Có 1 phát biểu không đúng là (b)
⟹Chọn đáp án A Đáp án: A
✔️(a) – Đúng. CaF2, MgF2 là những muối không tan trong nước. HF phá huỷ các mô xương thông qua việc tạo thành các kết tủa với Ca2+ và Mg2+ có trong cấu tạo xương; anion F- từ HF sẽ làm vô hiệu hoá vai trò của một số enzyme trong cơ thể; khi lượng ion F- lớn, nồng độ calcium trong máu nhanh chóng sụt giảm có thể gây ngưng tim đột ngột.
❌(b) – Sai. HCl không gây ngộ độc cho cơ thể theo cách tương tự như HF. HCl là hợp chất khí độc hại, không màu, có tính ăn mòn cao, tiếp xúc với hơi ẩm sẽ hình thành khói trắng. Tiếp xúc HCl lâu ngày dễ gây ra các bệnh như viêm dạ dày, viêm phế quản, viêm da, nhiễm độc.
✔️(c) – Đúng. Khi lượng ion F- lớn, nồng độ calcium trong máu nhanh chóng sụt giảm có thể gây ngưng tim đột ngột.
✔️(d) – Đúng. Calcium gluconate là một chất đặc hiệu trong sơ cấp cứu khi cơ thể bị phơi nhiễm với HF. Chất này có thể được sử dụng bằng cách bôi lên vùng da đã tiếp xúc với HF, kết hợp tiêm dưới da, tiêm vào mạch tuỳ vào mức độ ngộ độc.
Có 1 phát biểu không đúng là (b)
⟹Chọn đáp án A Đáp án: A
Câu 10 [247341]: Cho các nguyên tố 4Be, 11Na, 12Mg, 19K. Tính bazơ của các hydroxide được xếp theo thứ tự:
A, Be(OH)2 > Mg(OH)2 > KOH > NaOH.
B, KOH < NaOH < Mg(OH)2 < Be(OH)2.
C, Be(OH)2 < Mg(OH)2 < NaOH < KOH.
D, Mg(OH)2 < Be(OH)2 < NaOH < KOH.
Cấu hình electron của các nguyên tố Be, Na, Mg, K:
Be (Z = 4): 1s22s2 → Chu kì 2, nhóm IIA
Na (Z = 11): 1s22s22p63s1→ Chu kì 3, nhóm IA
Mg (Z = 12): 1s22s22p63s2→ Chu kì 3, nhóm IIA
K (Z = 19): 1s22s22p63s23p64s1→ Chu kì 4, nhóm IA
Thứ tự tăng dần tính kim loại là Be < Mg < Na < K.
Tính base tăng dần của các hydroxide được hình thành từ các kim loại trên là
Be(OH)2 < Mg(OH)2 < NaOH < KOH.
⟹Chọn đáp án C
Đáp án: C
Be (Z = 4): 1s22s2 → Chu kì 2, nhóm IIA
Na (Z = 11): 1s22s22p63s1→ Chu kì 3, nhóm IA
Mg (Z = 12): 1s22s22p63s2→ Chu kì 3, nhóm IIA
K (Z = 19): 1s22s22p63s23p64s1→ Chu kì 4, nhóm IA
Thứ tự tăng dần tính kim loại là Be < Mg < Na < K.
Tính base tăng dần của các hydroxide được hình thành từ các kim loại trên là
Be(OH)2 < Mg(OH)2 < NaOH < KOH.
⟹Chọn đáp án C
Đáp án: C
Câu 11 [706100]: Cho các thế điện cực chuẩn: 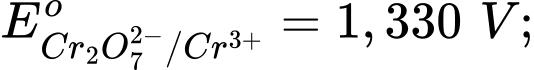
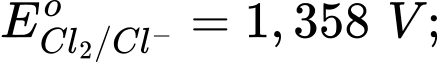
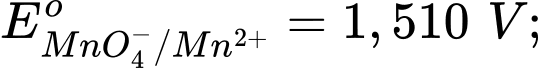
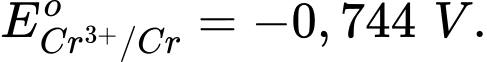 Chọn cách sắp xếp các ion và kim loại theo thứ tự tăng dần tính khử.
Chọn cách sắp xếp các ion và kim loại theo thứ tự tăng dần tính khử.
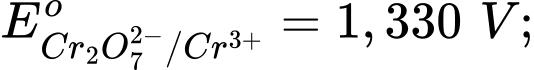
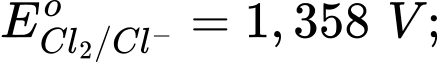
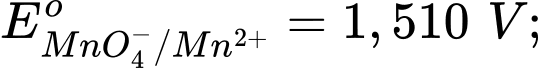
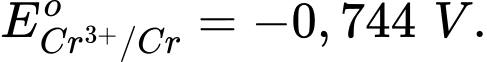 Chọn cách sắp xếp các ion và kim loại theo thứ tự tăng dần tính khử.
Chọn cách sắp xếp các ion và kim loại theo thứ tự tăng dần tính khử. A, Cr3+, Cl–, Mn2+, Cr.
B, Mn2+, Cl–, Cr3+, Cr.
C, Cr3+, Cl–, Cr2O72–, MnO4–.
D, Mn2+, Cr3+, Cl–, Cr.
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
Thứ tự tăng dần thế điện cực chuẩn là :
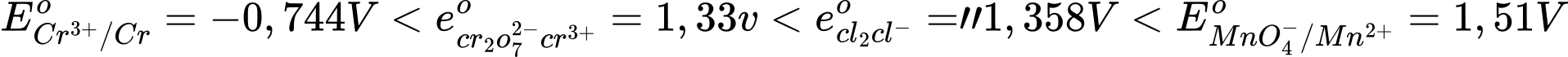 ""
"" Thứ tự tăng dần tính khử là: Mn2+ < Cl- < Cr3+ < Cr.
⟹Chọn đáp án B Đáp án: B
Thứ tự tăng dần thế điện cực chuẩn là :
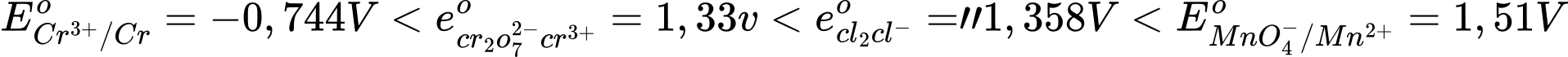 ""
"" ⟹Chọn đáp án B Đáp án: B
Câu 12 [706101]: Sulfur và quặng pyrite sắt là các nguyên liệu chính trong công nghiệp sản xuất sulfuric acid. Tại một nhà máy, cứ đốt cháy 1 tấn quặng pyrite sắt (chứa 84% khối lượng FeS2) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
A, 347 060 L.
B, 482 140 L.
C, 371 850 L.
D, 574 160 L.
Khối lượng FeS2 trong quặng pyrite sắt là mFeS2 = 1.0,84 = 0,84 tấn
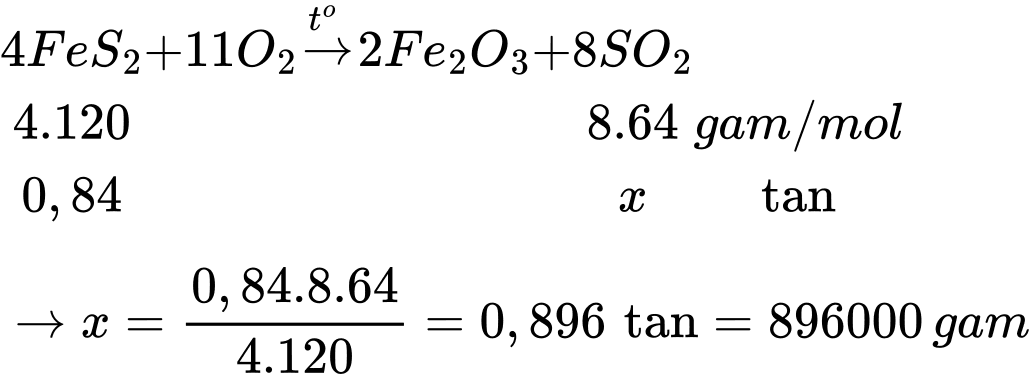
Thể tính khí SO2 tạo thành là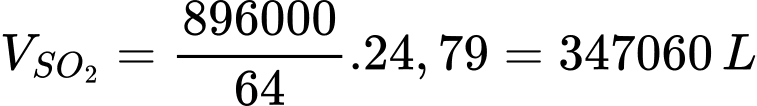
⟹Chọn đáp án A Đáp án: A
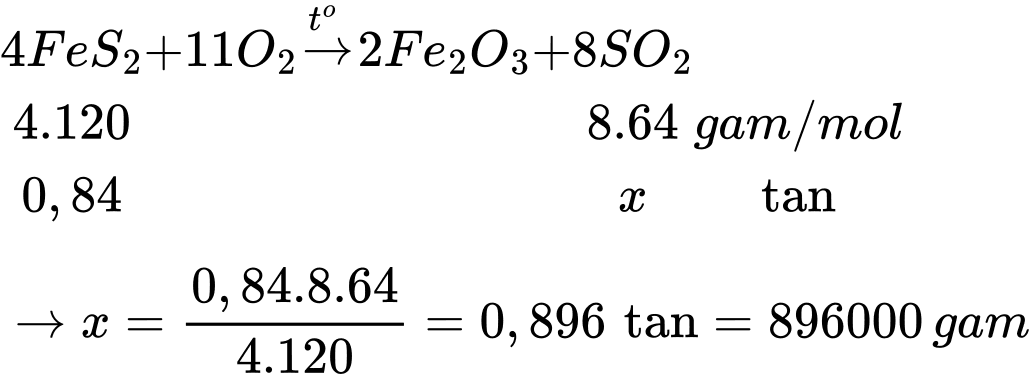
Thể tính khí SO2 tạo thành là
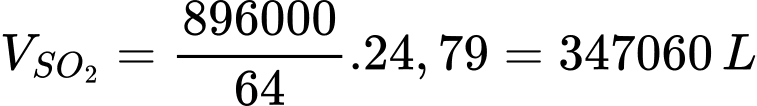
⟹Chọn đáp án A Đáp án: A
Câu 13 [304865]: Một ester có công thức phân tử là C4H6O2 khi thủy phân trong môi trường acid thu được dimethyl ketone. Công thức cấu tạo thu gọn của C4H6O2 là
A, HCOOC(CH3)=CH2.
B, CH3COOCH=CH2.
C, HCOOCH=CHCH3.
D, CH2=CHCOOCH3.
HD: Dimethyl ketone chính là acetone, có cấu tạo: CH3COCH3.
⇒ cấu tạo tương ứng của ester bất thường là HCOOC(CH3)=CH2. Phản ứng thủy phân như sau:
• HCOOC(CH3)=CH2 + H2O ––H+, to→ HCOOH + CH3COCH3.
Theo đó, đáp án đúng cần chọn là A.
Phân tích các đáp án còn lại:
❌ B. CH3COOCH=CH2 + H2O ––H+, to→ CH3COOH + CH3CHO (aldehyde acetic).
❌ C. HCOOCH=CHCH3 + H2O ––H+, to→ HCOOH + CH3CH2CHO (aldehyde propionic).
❌ D. CH2=CHCOOCH3 + H2O ––H+, to→ CH2=CHCOOH + CH3OH (methanol). Đáp án: A
⇒ cấu tạo tương ứng của ester bất thường là HCOOC(CH3)=CH2. Phản ứng thủy phân như sau:
• HCOOC(CH3)=CH2 + H2O ––H+, to→ HCOOH + CH3COCH3.
Theo đó, đáp án đúng cần chọn là A.
Phân tích các đáp án còn lại:
❌ B. CH3COOCH=CH2 + H2O ––H+, to→ CH3COOH + CH3CHO (aldehyde acetic).
❌ C. HCOOCH=CHCH3 + H2O ––H+, to→ HCOOH + CH3CH2CHO (aldehyde propionic).
❌ D. CH2=CHCOOCH3 + H2O ––H+, to→ CH2=CHCOOH + CH3OH (methanol). Đáp án: A
Câu 14 [706102]: “Cellulose là polymer mạch dài, không phân nhánh, tạo thành từ các đơn vị ..(1).. liên kết với nhau bằng liên kết ..(2)..”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A, β-glucose, β-1,4-glycoside.
B, β-fructose, β-1,2-glycoside.
C, α-glucose, α-1,4-glycoside.
D, α-fructose, α-1,4-glycoside.
Cellulose là một polymer mạch dài, không phân nhánh được tạo thành từ các đơn vị β-glucose.
Các đơn vị β-glucose liên kết với nhau bằng liên kết β-1,4-glycoside.
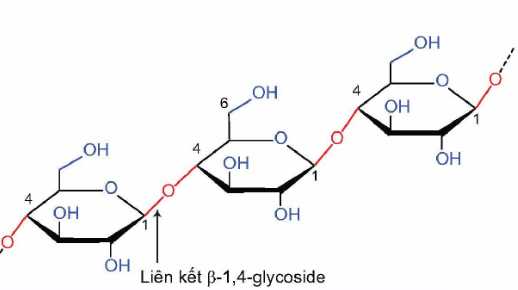
Phân tích các đáp án :
✔️A. β-glucose, β-1,4-glycoside. Đúng, vì cellulose được cấu tạo từ β-glucose và có liên kết β-1,4-glycoside.
❌B. β-fructose, β-1,2-glycoside. Sai, vì cellulose không chứa fructose và không có liên kết β-1,2-glycoside.
❌C. α-glucose, α-1,4-glycoside . Sai, vì α-glucose và liên kết α-1,4-glycoside thuộc về tinh bột, không phải cellulose
❌D. α-fructose, α-1,4-glycoside . Sai, vì cellulose không chứa fructose và không có liên kết α-1,4-glycoside.
⟹ Chọn đáp án A Đáp án: A
Các đơn vị β-glucose liên kết với nhau bằng liên kết β-1,4-glycoside.

Phân tích các đáp án :
✔️A. β-glucose, β-1,4-glycoside. Đúng, vì cellulose được cấu tạo từ β-glucose và có liên kết β-1,4-glycoside.
❌B. β-fructose, β-1,2-glycoside. Sai, vì cellulose không chứa fructose và không có liên kết β-1,2-glycoside.
❌C. α-glucose, α-1,4-glycoside . Sai, vì α-glucose và liên kết α-1,4-glycoside thuộc về tinh bột, không phải cellulose
❌D. α-fructose, α-1,4-glycoside . Sai, vì cellulose không chứa fructose và không có liên kết α-1,4-glycoside.
⟹ Chọn đáp án A Đáp án: A
Câu 15 [706103]: Một học sinh thực hiện các thí nghiệm để nhận biết hai dung dịch chất X và chất Y, thu được một số kết quả như sau:
Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
- Trộn X và Y thu được kết tủa màu trắng.
- Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X, Y đều chỉ chứa một loại cation và một loại anion. Cho các phát biểu sau:
(a) Chất X có chứa cation Ba2+, chất Y chứa cation K+.
(b) Chất X không thể là barium chloride.
(c) Chất Y phải là potassium carbonate.
(d) Kết tủa màu trắng phải là hợp chất của barium.
Số phát biểu đúng là
Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
- Trộn X và Y thu được kết tủa màu trắng.
- Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X, Y đều chỉ chứa một loại cation và một loại anion. Cho các phát biểu sau:
(a) Chất X có chứa cation Ba2+, chất Y chứa cation K+.
(b) Chất X không thể là barium chloride.
(c) Chất Y phải là potassium carbonate.
(d) Kết tủa màu trắng phải là hợp chất của barium.
Số phát biểu đúng là
A, 1.
B, 2.
C, 3.
D, 4.
Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
→ Dung dịch X và Y có tính kiềm.
Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
X là hợp chất chứa ion Ba2+, Y là hợp chất chứa ion K+.
Phân tích các phát biểu:
✔️(a) – Đúng. Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím. X là hợp chất chứa ion Ba2+, Y là hợp chất chứa ion K+.
✔️(b) – Đúng. X chuyển phenolphtalein sang màu hồng, BaCl2 không làm đổi màu dung dịch phenolphtalein do là muối trung tính ( gốc acid mạnh Cl- và gốc base mạnh Ba2+)
❌(c) – Sai. Y có thể là KHCO3, K2SO3, K3PO4…
✔️(d) – Đúng. Đúng vì các hợp chất của K (Y) tan trong nước.
Có 3 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
→ Dung dịch X và Y có tính kiềm.
Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
X là hợp chất chứa ion Ba2+, Y là hợp chất chứa ion K+.
Phân tích các phát biểu:
✔️(a) – Đúng. Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím. X là hợp chất chứa ion Ba2+, Y là hợp chất chứa ion K+.
✔️(b) – Đúng. X chuyển phenolphtalein sang màu hồng, BaCl2 không làm đổi màu dung dịch phenolphtalein do là muối trung tính ( gốc acid mạnh Cl- và gốc base mạnh Ba2+)
❌(c) – Sai. Y có thể là KHCO3, K2SO3, K3PO4…
✔️(d) – Đúng. Đúng vì các hợp chất của K (Y) tan trong nước.
Có 3 phát biểu đúng.
⟹Chọn đáp án C Đáp án: C
Câu 16 [706104]: Chuẩn độ Fe2+ bằng KMnO4 là một phương pháp phân tích định lượng dựa trên phản ứng oxi – hóa khử giữa ion Fe2+ và ion MnO4–. Phương pháp này thường được sử dụng để xác định nồng độ các ion Fe2+ trong dung dịch.
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Tiếp tục chuẩn độ cho đến khi màu hồng nhạt của dung dịch KMnO4 vẫn giữ ổn định trong 30 giây thì dừng lại. Trong số các phát biểu sau:
(a) Chất chuẩn được sử dụng trong thí nghiệm này là dung dịch thuốc tím đã biết trước nồng độ.
(b) Quá trình chuẩn độ cần phải sử dụng chất chỉ thị biến đổi màu theo pH của dung dịch phản ứng.
(c) Phản ứng diễn ra trong quá trình chuẩn độ chứng tỏ rằng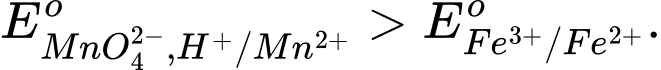
(d) Tại điểm tương đương, số mol FeSO4 trong dung dịch ban đầu bằng 5 lần số mol của KMnO4 đã phản ứng.
Các phát biểu đúng là
10FeSO4 + 2KMnO4 + 8H2SO4
 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2OTiếp tục chuẩn độ cho đến khi màu hồng nhạt của dung dịch KMnO4 vẫn giữ ổn định trong 30 giây thì dừng lại. Trong số các phát biểu sau:
(a) Chất chuẩn được sử dụng trong thí nghiệm này là dung dịch thuốc tím đã biết trước nồng độ.
(b) Quá trình chuẩn độ cần phải sử dụng chất chỉ thị biến đổi màu theo pH của dung dịch phản ứng.
(c) Phản ứng diễn ra trong quá trình chuẩn độ chứng tỏ rằng
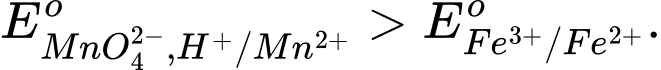
(d) Tại điểm tương đương, số mol FeSO4 trong dung dịch ban đầu bằng 5 lần số mol của KMnO4 đã phản ứng.
Các phát biểu đúng là
A, (a), (b).
B, (b), (c).
C, (a), (b), (c).
D, (a), (c), (d).
Phân tích các phát biểu :
✔️(a) – Đúng. Chất chuẩn được sử dụng trong thí ghiệm này là dung dịch thuốc tím đã biết trước nồng độ, từ phương pháp chuẩn độ xác định nồng độ Fe2+ thông qua KMnO4 đã phản ứng.
❌(b) – Sai. Phản ứng này không cần sử dụng thêm chất chỉ thị, tại điểm tương đương là dung dịch thu được có màu hồng nhạt của KMnO4 vẫn giữ ổn định trong 30 giây thì dừng lại.
✔️(c) – Đúng.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Quá trình oxi hóa: Fe2+ → Fe3+ + 1e
Quá trình khử: MnO4- + 8H+ + 5e → Mn2+ + 4H2O
Phản ứng diễn ra trong quá trình chuẩn độ chứng tỏ rằng
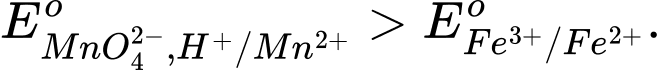
✔️(a) – Đúng. Chất chuẩn được sử dụng trong thí ghiệm này là dung dịch thuốc tím đã biết trước nồng độ, từ phương pháp chuẩn độ xác định nồng độ Fe2+ thông qua KMnO4 đã phản ứng.
❌(b) – Sai. Phản ứng này không cần sử dụng thêm chất chỉ thị, tại điểm tương đương là dung dịch thu được có màu hồng nhạt của KMnO4 vẫn giữ ổn định trong 30 giây thì dừng lại.
✔️(c) – Đúng.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Quá trình oxi hóa: Fe2+ → Fe3+ + 1e
Quá trình khử: MnO4- + 8H+ + 5e → Mn2+ + 4H2O
Phản ứng diễn ra trong quá trình chuẩn độ chứng tỏ rằng
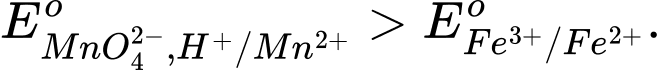
Sử dụng thông tin dưới đây trả lời câu hỏi số 17, 18
Người ta điều chế aniline theo sơ đồ sau:
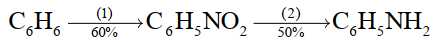
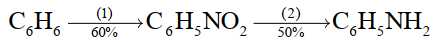
Câu 17 [706105]: Phản ứng xảy ra trong giai đoạn (1) là phản ứng
A, Oxi hóa.
B, Khử hóa.
C, Cộng
D, Thế.
Ở giai đoạn 1: Benzene tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc ở 60 oC tạo thành chất lỏng màu vàng là nitrobenzene theo phương trình:
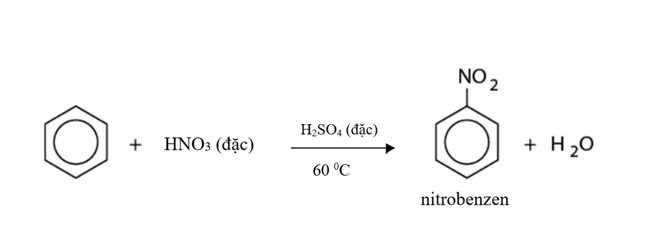
⟹Chọn đáp án D Đáp án: D

⟹Chọn đáp án D Đáp án: D
Câu 18 [706106]: Để điều chế được 18,6 kg aniline thì cần dùng tối thiểu bao nhiêu kg benzene?
A, 46,8.
B, 48.
C, 52.
D, 51,1.
Hiệu suất chung của cả quá trình là H = 60%.50% = 30%.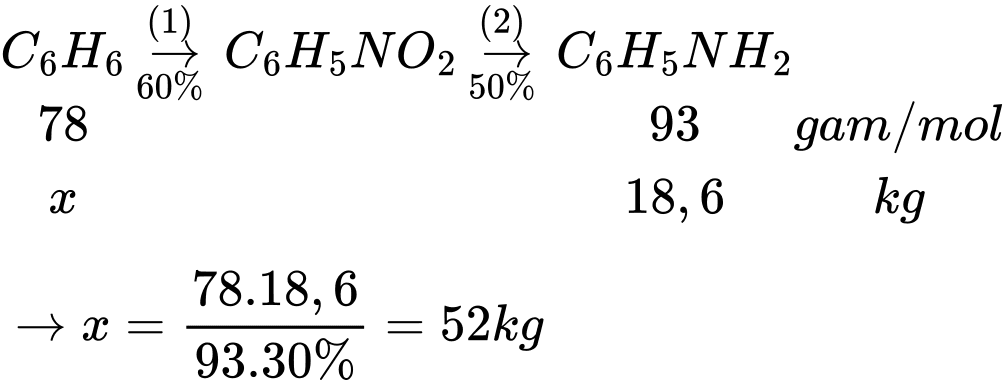
⟹Chọn đáp án C Đáp án: C
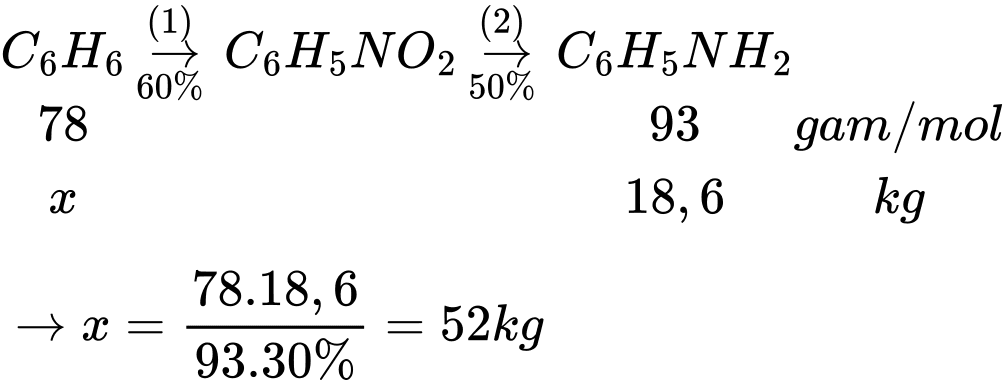
⟹Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706107]: Phản ứng thủy phân tinh bột được nghiên cứu theo các bước dưới đây:
∎ Bước 1: Cho vào ống nghiệm (1) khoảng 3 mL dung dịch hồ tinh bột 2 % và 1 mL dung dịch H2SO4 10 %, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (2) 1 mL dung dịch I2 trong dung dịch KI.
∎ Bước 2: Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (1) nhỏ vào ống nghiệm (2).
Nếu dung dịch thu được có màu vàng thì lấy ống nghiệm (1) ra khỏi nồi nước.
Nếu dung dịch có màu xanh tím thì để thêm khoảng 5 phút trong nồi nước nóng và tiếp tục thử màu với dung dịch I2 trong KI như trên.
∎ Bước 3: Lấy khoảng 1 mL dung dịch đã thuỷ phân sang ống nghiệm (3), thêm dần từng giọt dung dịch NaOH 10 % cho đến môi trường kiềm (thử bằng cách dùng đũa thuỷ tinh chấm dung dịch lên giấy quỳ tím sao cho quỳ tím chuyển thành màu xanh).
∎ Bước 4: Thêm tiếp vào ống nghiệm (3) vài giọt dung dịch CuSO4 5 %, lắc đều rồi đun nóng ống nghiệm
∎ Bước 1: Cho vào ống nghiệm (1) khoảng 3 mL dung dịch hồ tinh bột 2 % và 1 mL dung dịch H2SO4 10 %, lắc đều rồi đặt ống nghiệm trong nồi nước sôi. Cho vào ống nghiệm (2) 1 mL dung dịch I2 trong dung dịch KI.
∎ Bước 2: Sau khoảng 20 phút, hút lấy 1 – 2 giọt dung dịch trong ống nghiệm (1) nhỏ vào ống nghiệm (2).
Nếu dung dịch thu được có màu vàng thì lấy ống nghiệm (1) ra khỏi nồi nước.
Nếu dung dịch có màu xanh tím thì để thêm khoảng 5 phút trong nồi nước nóng và tiếp tục thử màu với dung dịch I2 trong KI như trên.
∎ Bước 3: Lấy khoảng 1 mL dung dịch đã thuỷ phân sang ống nghiệm (3), thêm dần từng giọt dung dịch NaOH 10 % cho đến môi trường kiềm (thử bằng cách dùng đũa thuỷ tinh chấm dung dịch lên giấy quỳ tím sao cho quỳ tím chuyển thành màu xanh).
∎ Bước 4: Thêm tiếp vào ống nghiệm (3) vài giọt dung dịch CuSO4 5 %, lắc đều rồi đun nóng ống nghiệm
Phân tích các đáp án :
✔️(a) – Đúng. I2 tan vừa phải trong KI nên dung dịch I2/KI có màu vàng đậm. I2 tan ít trong H2O (vì H2O là dung môi phân cực mạnh) nên dd I2/H2O có màu vàng nhạt
❌(b) – Sai. Ở bước 2 nếu dung dịch thu được có xanh tím thì chứng tỏ tinh bột đã chưa bị thủy phân hoàn toàn.
✔️(c) – Đúng. Dung dịch NaOH ở bước 3 dùng để trung hòa acid và tạo môi trường kiềm.
✔️(d) – Đúng. Khi thủy phân tinh bột không hoàn toàn thu được glucose.Glucose tác dụng với Cu(OH)2 trong môi trường kiềm sẽ xuất hiện kết tủa màu đỏ gạch
Cu2O. CH2OH[CHOH]4CHO + 2Cu(OH)2 + NaOH → CH2OH[CHOH]4COONa + Cu2O↓ + 3H2O
✔️(a) – Đúng. I2 tan vừa phải trong KI nên dung dịch I2/KI có màu vàng đậm. I2 tan ít trong H2O (vì H2O là dung môi phân cực mạnh) nên dd I2/H2O có màu vàng nhạt
❌(b) – Sai. Ở bước 2 nếu dung dịch thu được có xanh tím thì chứng tỏ tinh bột đã chưa bị thủy phân hoàn toàn.
✔️(c) – Đúng. Dung dịch NaOH ở bước 3 dùng để trung hòa acid và tạo môi trường kiềm.
✔️(d) – Đúng. Khi thủy phân tinh bột không hoàn toàn thu được glucose.Glucose tác dụng với Cu(OH)2 trong môi trường kiềm sẽ xuất hiện kết tủa màu đỏ gạch
Cu2O. CH2OH[CHOH]4CHO + 2Cu(OH)2 + NaOH → CH2OH[CHOH]4COONa + Cu2O↓ + 3H2O
Câu 20 [706108]: Sự khác biệt về điểm nóng chảy của các oxide chu kỳ 3 đều là do sự khác biệt về liên kết của chúng. Xu hướng về nhiệt độ nóng chảy của các oxide trong chu kỳ 3 được thể hiện trong hình dưới đây:
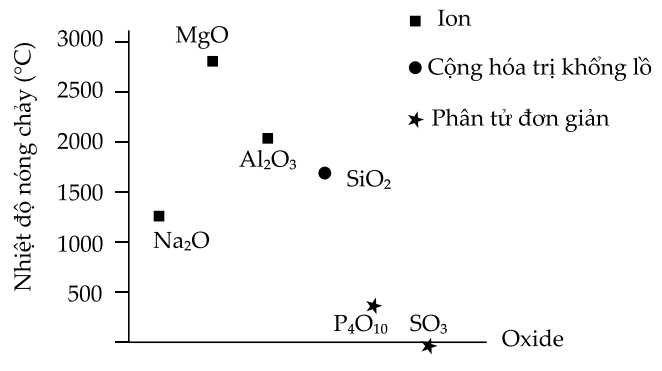

Phân tích các phát biểu :
✔️(a) – Đúng. Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn. Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
❌(b) – Sai. Nhiệt độ nóng chảy của hợp chất ion phụ thuộc vào lực hút tĩnh điện mạnh giữa các ion và cấu trúc mạng tinh thể.
✔️(c) – Đúng. Silicca là chất tồn tại ở dạng tinh thể nguyên tử, không tan trong nước. Đây là một chất rắn, màu xám, có vẻ sáng của kim loại, khó nóng chảy . Ngoài ra, SiO2 dẫn điện kém, tinh thể silic tinh khiết là chất bán dẫn. Với khối lượng riêng khoảng 2,2 đến 2,7 g/cm3 tùy vào cấu trúc tinh thể, nhiệt độ nóng chảy là 1713 độ C.
✔️(d) – Đúng. P4O10 và SO3 là các phân tử cộng hóa trị, giữa chúng tồn tại liên kết cộng hóa trị nên cần ít năng lượng để vượt qua.
✔️(a) – Đúng. Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn. Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
❌(b) – Sai. Nhiệt độ nóng chảy của hợp chất ion phụ thuộc vào lực hút tĩnh điện mạnh giữa các ion và cấu trúc mạng tinh thể.
✔️(c) – Đúng. Silicca là chất tồn tại ở dạng tinh thể nguyên tử, không tan trong nước. Đây là một chất rắn, màu xám, có vẻ sáng của kim loại, khó nóng chảy . Ngoài ra, SiO2 dẫn điện kém, tinh thể silic tinh khiết là chất bán dẫn. Với khối lượng riêng khoảng 2,2 đến 2,7 g/cm3 tùy vào cấu trúc tinh thể, nhiệt độ nóng chảy là 1713 độ C.
✔️(d) – Đúng. P4O10 và SO3 là các phân tử cộng hóa trị, giữa chúng tồn tại liên kết cộng hóa trị nên cần ít năng lượng để vượt qua.
Câu 21 [706109]: Để kiểm chứng giả thuyết: “Kim loại kẽm hoạt động hóa học mạnh hơn kim loại đồng”, một nhóm học sinh đã chuẩn bị hai thí nghiệm:
1. Thí nghiệm 1: Cho một lá kim loại kẽm vào dung dịch CuSO4 1 M.

2. Thí nghiệm 2: Cho một lá kim loại đồng vào dung dịch ZnSO4 1 M.

Sau cả hai thí nghiệm đều lấy lá kim loại ra ngoài, làm khô, rồi cân để xác định khối lượng của từng lá kim loại.
1. Thí nghiệm 1: Cho một lá kim loại kẽm vào dung dịch CuSO4 1 M.

2. Thí nghiệm 2: Cho một lá kim loại đồng vào dung dịch ZnSO4 1 M.

Sau cả hai thí nghiệm đều lấy lá kim loại ra ngoài, làm khô, rồi cân để xác định khối lượng của từng lá kim loại.
Phân tích các phát biểu :
❌(a) – Sai. Trong thí nghiệm 1, khối lượng của lá kẽm giảm.
Zn + CuSO4 → ZnSO4 + Cu
1 mol kẽm ứng với 65 gam tạo thành 1 mol Cu ứng với 64 gam
→ Khối lượng của thanh kẽm trong khí nghiệm 1 giảm.
✔️(b) – Đúng. Trong thí nghiệm 2, bề mặt lá đồng không có hiện tượng thay đổi nguyên nhân Cu không có khả năng phản ứng với dung dịch ZnSO4.
✔️(c) – Đúng. Thí nghiệm 1: Zn + CuSO4 → ZnSO4 + Cu Nồng độ của CuSO4 giảm dần ZnSO4 tăng dần. Thí nghiệm 2: Cu không phản ứng với ZnSO4Nồng đồng độ của ZnSO4 không đổi
✔️(d) – Sai. Có thể lược bỏ thí nghiệm số 2 mà vẫn kiểm chứng được giả thuyết ban đầu, có bao nhiêu mol CuSO4 mất đi thì có bấy nhiêu mol ZnSO4 hình thành.
❌(a) – Sai. Trong thí nghiệm 1, khối lượng của lá kẽm giảm.
Zn + CuSO4 → ZnSO4 + Cu
1 mol kẽm ứng với 65 gam tạo thành 1 mol Cu ứng với 64 gam
→ Khối lượng của thanh kẽm trong khí nghiệm 1 giảm.
✔️(b) – Đúng. Trong thí nghiệm 2, bề mặt lá đồng không có hiện tượng thay đổi nguyên nhân Cu không có khả năng phản ứng với dung dịch ZnSO4.
✔️(c) – Đúng. Thí nghiệm 1: Zn + CuSO4 → ZnSO4 + Cu Nồng độ của CuSO4 giảm dần ZnSO4 tăng dần. Thí nghiệm 2: Cu không phản ứng với ZnSO4Nồng đồng độ của ZnSO4 không đổi
✔️(d) – Sai. Có thể lược bỏ thí nghiệm số 2 mà vẫn kiểm chứng được giả thuyết ban đầu, có bao nhiêu mol CuSO4 mất đi thì có bấy nhiêu mol ZnSO4 hình thành.
Câu 22 [706110]: Công dụng phổ biến nhất của phương pháp chưng cất lôi cuốn hơi nước là chiết xuất các sản phẩm tự nhiên từ nguồn thực vật. Đây là phương pháp công nghiệp chính để thu được tinh dầu thực vật, được sử dụng trong nước hoa và các sản phẩm vệ sinh cá nhân. Vì có rất nhiều sản phẩm có thể được cô lập theo cách này, nên kỹ thuật này thường xuyên được thực hiện trong các phòng thí nghiệm giảng dạy.
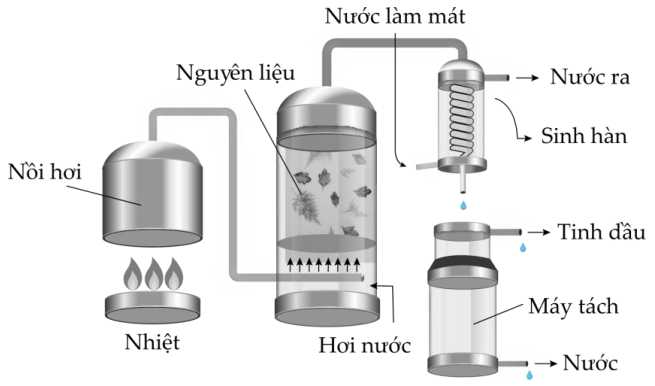

Phân tích các đáp án :
✔️(a) – Đúng. Các chất trong tinh dầu lá nguyệt quế có nhiệt độ sôi cao nguyên nhân khi chưng cất tinh dầu bị tách ra trước.
✔️(b) – Đúng. Nước bay hơi sẽ lôi cuốn theo một phần tinh dầu lá nguyệt quế.
✔️(c) – Đúng. Thiết bị sinh hàn hoặc bộ sinh hàn cũng có thể gọi là bộ trao đổi nhiệt, hoặc bộ làm mát, bộ gia nhiệt, bộ sấy (tùy theo mục đích sử dụng). Ở đó, các môi chất (lỏng hoặc khí -hơi) trao đổi nhiệt với nhau không tiếp xúc trực tiếp mà qua các ngăn, vách trung gian (được cấu tạo dạng tấm, hoặc dạng ống lồng, dạng ống chùm, dạng ống xoắn,...) mục đích ngưng tụ hơi tinh dầu.
✔️(d) – Đúng. Sau khi ngưng tụ, hỗn hợp lỏng thu được có thể tích tinh dầu lá nguyệt quế nhỏ thể tích nước nguyên do tinh dầu có nhiệt độ sôi cao nên bay hơi chậm hơn.
✔️(a) – Đúng. Các chất trong tinh dầu lá nguyệt quế có nhiệt độ sôi cao nguyên nhân khi chưng cất tinh dầu bị tách ra trước.
✔️(b) – Đúng. Nước bay hơi sẽ lôi cuốn theo một phần tinh dầu lá nguyệt quế.
✔️(c) – Đúng. Thiết bị sinh hàn hoặc bộ sinh hàn cũng có thể gọi là bộ trao đổi nhiệt, hoặc bộ làm mát, bộ gia nhiệt, bộ sấy (tùy theo mục đích sử dụng). Ở đó, các môi chất (lỏng hoặc khí -hơi) trao đổi nhiệt với nhau không tiếp xúc trực tiếp mà qua các ngăn, vách trung gian (được cấu tạo dạng tấm, hoặc dạng ống lồng, dạng ống chùm, dạng ống xoắn,...) mục đích ngưng tụ hơi tinh dầu.
✔️(d) – Đúng. Sau khi ngưng tụ, hỗn hợp lỏng thu được có thể tích tinh dầu lá nguyệt quế nhỏ thể tích nước nguyên do tinh dầu có nhiệt độ sôi cao nên bay hơi chậm hơn.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706111]: Hạ nhiệt độ 128,3 gam dung dịch Na2SO4 bão hòa ở 80°C xuống 10°C thấy có m gam tinh thể Na2SO4.10H2O tách ra. Biết độ tan của Na2SO4 ở 80°C là 28,3 gam và ở 10°C là 9,0 gam. Giá trị của m là bao nhiêu (Làm tròn đến hàng phần mười)?
- Ở 80oC, SNa2SO4= 28,3 gam
100 gam H2O hòa tan 28,3 gam Na2SO4 tạo thành 128,3 gam dung dịch bão hòa
- Gọi x là số mol Na2SO4. 10H2O tách ra → Số mol H2O tách ra là 10x mol
⟹ Khối lượng H2O tách ra: 180x (g)
Khối lượng Na2SO4tách ra: 142x (gam)
- Ở 10oC, SNa2SO4= 9 gam
- Ta có phương trình: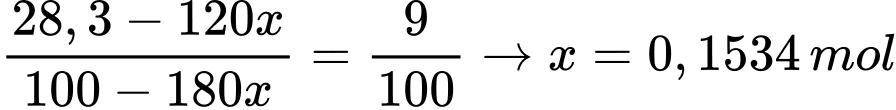
→ Khối lượng Na2SO4.10H2O kết tinh: 322.0,1534 ≈ 49,4 gam.
⟹Điền đáp án : 49,4
100 gam H2O hòa tan 28,3 gam Na2SO4 tạo thành 128,3 gam dung dịch bão hòa
- Gọi x là số mol Na2SO4. 10H2O tách ra → Số mol H2O tách ra là 10x mol
⟹ Khối lượng H2O tách ra: 180x (g)
Khối lượng Na2SO4tách ra: 142x (gam)
- Ở 10oC, SNa2SO4= 9 gam
- Ta có phương trình:
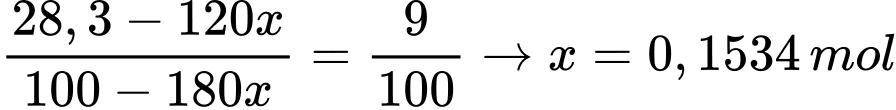
→ Khối lượng Na2SO4.10H2O kết tinh: 322.0,1534 ≈ 49,4 gam.
⟹Điền đáp án : 49,4
Câu 24 [706112]: Cho dãy gồm các kim loại: Na, Mg, Al, Fe, Ag, K, Au. Số kim loại khử được ion Cu2+ trong dung dịch là
- Na, K không khử được do sẽ tác dụng với H2O trong dung dịch.
- Ag, Au yếu hơn Cu nên không khử được Cu
- Các kim loại khử được ion Cu2+ trong dung dịch là Mg; Al, Fe.
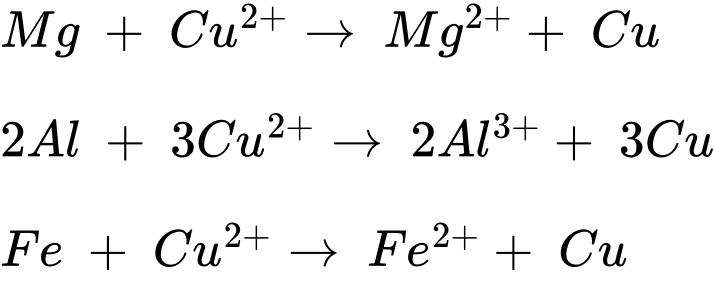
⟹Điền đáp án : 3
- Ag, Au yếu hơn Cu nên không khử được Cu
- Các kim loại khử được ion Cu2+ trong dung dịch là Mg; Al, Fe.
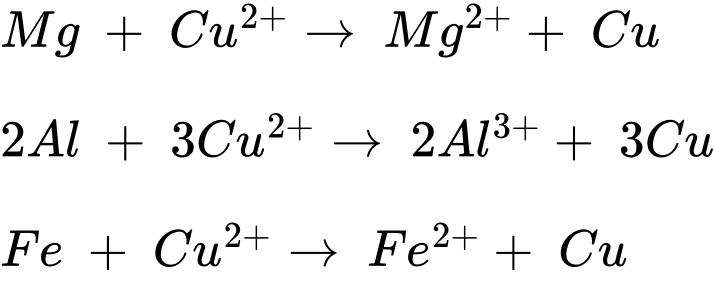
⟹Điền đáp án : 3
Câu 25 [706113]: Ngô khô chứa 40% khối lượng là tinh bột, còn lại là các chất không có khả năng lên men thành ethyl alcohol. Lên men 1,5 tấn ngô khô với hiệu suất cả quá trình là 84%. Toàn bộ lượng ethyl alcohol sinh ra để điều chế xăng E5 (có chứa 5% thể tích ethyl alcohol). Biết khối lượng riêng của ethyl alcohol là 0,8 g/mL, thể tích xăng E5 thu được sau pha trộn là bao nhiêu lít (Làm tròn đến số nguyên)?
Khối lượng tinh bột trong ngô khô là mtinh bột = 1,5.40% = 0,6 tấn
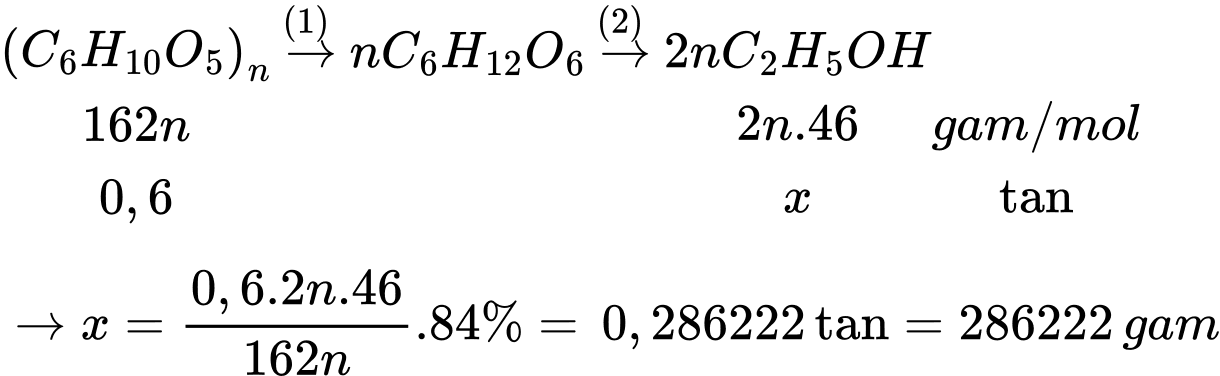
Thể tích xăng E5 thu được là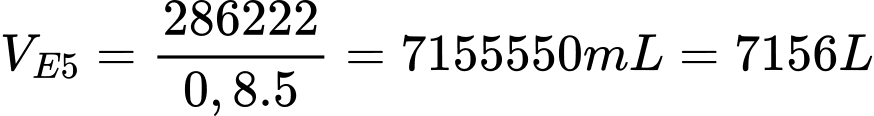
⟹Điền đáp án : 7156
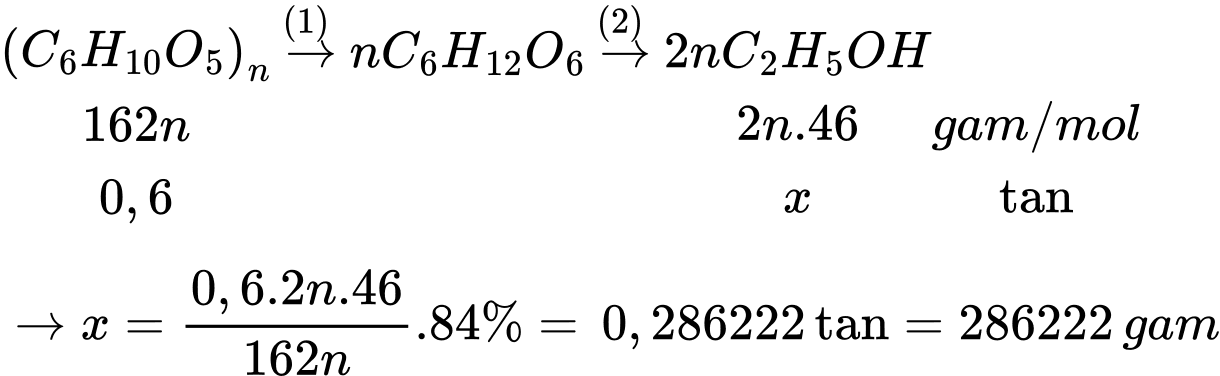
Thể tích xăng E5 thu được là
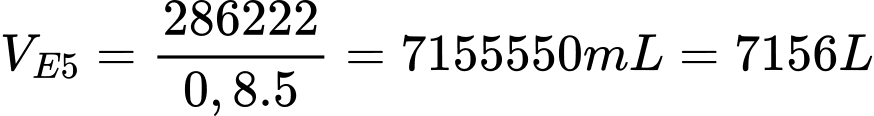
⟹Điền đáp án : 7156
Câu 26 [706114]: Zytel® là một polymer được sử dụng phổ biến trong công nghiệp ô tô và điện tử. Polymer này có công thức cấu tạo như sau:
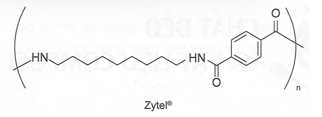
Tổng số nguyên tử carbon trong phân tử monomer có chứa vòng benzene là bao nhiêu?

Tổng số nguyên tử carbon trong phân tử monomer có chứa vòng benzene là bao nhiêu?
Các monomer cấu tạo nên polymer Zyter là
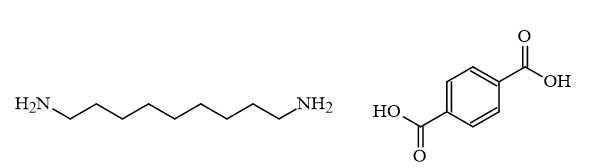
Tổng số nguyên tử carbon trong phân tử monomer chứa vòng benzene là 8.
⟹Điền đáp án : 8

Tổng số nguyên tử carbon trong phân tử monomer chứa vòng benzene là 8.
⟹Điền đáp án : 8
Câu 27 [706115]: 25,0 mL dung dịch acetic acid (CH3COOH) 0,2 M được chuẩn độ bằng chính xác 20,0 mL dung dịch NaOH. Tính giá trị pH của dung dịch NaOH đã được sử dụng trong phép chuẩn độ (Làm tròn đến hàng phần mười).
Phản ứng tổng quát: CH3COOH + NaOH → CH3COONa + H2O
Đổi 25 mL = 0,025 L
Số mol của acetic acid là nCH3COOH = 0,025.0,2 = 0,005 mol
Số mol của dung dịch sodium hydroxide cần chuẩn độ là nNaOH = 0,005 mol
Giá trị pH của dung dịch NaOH là
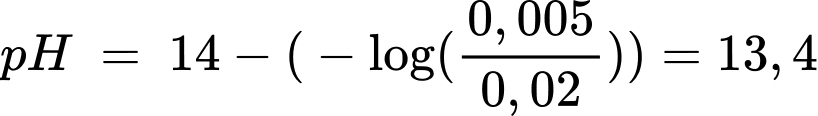
⟹Điền đáp án : 13,4
Đổi 25 mL = 0,025 L
Số mol của acetic acid là nCH3COOH = 0,025.0,2 = 0,005 mol
Số mol của dung dịch sodium hydroxide cần chuẩn độ là nNaOH = 0,005 mol
Giá trị pH của dung dịch NaOH là
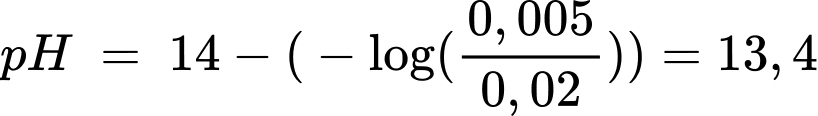
⟹Điền đáp án : 13,4
Câu 28 [706116]: Sử dụng vôi sữa là phương pháp phổ biến để xử lý khí thải SO2. Vôi sữa hấp thụ 90% khí SO2 theo phương trình hóa học:
Ca(OH)2 + SO2 → CaSO3 + H2O.
CaSO3 bị oxi hóa hoàn toàn thành CaSO4 dưới tác dụng của O2. Sau đó, CaSO4 được lọc tách, làm sạch, nung khô và thu hồi dưới dạng thạch cao thương phẩm (2CaSO4.H2O) với hiệu suất 80%. Một nhà máy trong một ngày thải ra 2000 m³ (đkc) khí thải chứa 1% về thể tích là SO2. Bằng phương pháp trên, tính khối lượng (kg) 2CaSO4.H2O thu được trong 30 ngày (Làm tròn đến số nguyên).
Ca(OH)2 + SO2 → CaSO3 + H2O.
CaSO3 bị oxi hóa hoàn toàn thành CaSO4 dưới tác dụng của O2. Sau đó, CaSO4 được lọc tách, làm sạch, nung khô và thu hồi dưới dạng thạch cao thương phẩm (2CaSO4.H2O) với hiệu suất 80%. Một nhà máy trong một ngày thải ra 2000 m³ (đkc) khí thải chứa 1% về thể tích là SO2. Bằng phương pháp trên, tính khối lượng (kg) 2CaSO4.H2O thu được trong 30 ngày (Làm tròn đến số nguyên).
Xét trong 1 ngày:
(1) Ca(OH)2 + SO2 → CaSO3 + H2O
(2) 2CaSO3 + O2 → 2CaSO4
Thể tích khí SO2 trong 2000 m3 là VSO2 = 2000.1% = 20 m3 = 20000 L
Số mol của khí SO2 trong 30 ngày là nSO2 = 20000 : 24,79 × 30 = 24203,307 mol
Từ PTHH (1) và (2) số mol của CaSO4 là 24203,307 : 2 × 80% × 90% = 8713,19083 mol
Khối lượng CaSO4. 2H2O thu được trong 30 ngày là mCaSO4. 2H2O = n.M = 8713,19083 × 290 ≈ 2526,8 kg
⟹Điền đáp án: 2527
(1) Ca(OH)2 + SO2 → CaSO3 + H2O
(2) 2CaSO3 + O2 → 2CaSO4
Thể tích khí SO2 trong 2000 m3 là VSO2 = 2000.1% = 20 m3 = 20000 L
Số mol của khí SO2 trong 30 ngày là nSO2 = 20000 : 24,79 × 30 = 24203,307 mol
Từ PTHH (1) và (2) số mol của CaSO4 là 24203,307 : 2 × 80% × 90% = 8713,19083 mol
Khối lượng CaSO4. 2H2O thu được trong 30 ngày là mCaSO4. 2H2O = n.M = 8713,19083 × 290 ≈ 2526,8 kg
⟹Điền đáp án: 2527