PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [705851]: Kim loại Na, K thường được bảo quản trong
A, dầu hoả khan.
B, phenol.
C, ethanol.
D, bình hút ẩm.
Phân tích các đáp án :
✔️A. Đúng. (Na) và (K) là kim loại kiềm, có tính khử mạnh và phản ứng mãnh liệt với nước cũng như oxygen trong không khí.
- Để tránh chúng phản ứng với nước và oxygen, chúng được bảo quản trong dầu hỏa khan hoặc paraffin lỏng.
❌B. Sai. Phenol là hợp chất hữu cơ có tính acid nhẹ và dễ bay hơi.
- Phenol không có tác dụng bảo vệ Na, K khỏi oxygen và nước, mà còn có thể phản ứng với chúng.
❌C. Sai. Ethanol là dung môi hữu cơ có nhóm (-OH), có khả năng hòa tan nhiều chất. Na, K phản ứng mạnh với ethanol tạo ra khí hydrogen dễ cháy nổ.
❌D. Bình hút ẩm thường chứa các chất hút ẩm như silica gel hoặc axit sulfuric để giữ mẫu khô ráo.
- Tuy nhiên, điều này không đủ để bảo vệ Na, K khỏi oxygen trong không khí.
⟹ Chọn đáp án A
Đáp án: A ⟹ Chọn đáp án A
Câu 2 [705852]: Trong tinh thể kim loại M, ... chuyển động tự do. Nội dung phù hợp điền vào ô trống là
A, cation Mn+.
B, anion Mn–.
C, nguyên tử M.
D, electron hóa trị.
Phân tích các đáp án :
❌A. Sai. Trong tinh thể kim loại, các nguyên tử kim loại mất electron hóa trị để tạo thành ion dương (cation).
Tuy nhiên, các cation này không chuyển động tự do mà nằm cố định trong mạng tinh thể kim loại.
❌B. Sai. Kim loại không tạo anion (ion âm) trong mạng tinh thể của nó.
❌C. Sai. Nguyên tử kim loại không tồn tại tự do mà liên kết trong mạng tinh thể.
✔️D. Đúng. Trong kim loại, các electron hóa trị tách khỏi nguyên tử và tạo thành " electron tự do", di chuyển linh hoạt trong mạng tinh thể kim loại.
⟹ Chọn đáp án D
Đáp án: D ⟹ Chọn đáp án D
Câu 3 [705853]: Phát biểu nào sau đây không đúng?
A, Tính chất hoá học đặc trưng của kim loại là tính khử.
B, Kim loại càng hoạt động hoá học thì tính khử càng mạnh.
C, Kim loại bạc có tính khử yếu trong khi cation Ag⁺ có tính oxi hoá mạnh.
D, Kim loại kém hoạt động hoá học như vàng không thể hiện tính khử.
Phân tích các đáp án :
✔️A. Đúng. Kim loại có xu hướng nhường electron để tạo ion dương, thể hiện tính khử.
✔️B. Đúng. Kim loại hoạt động mạnh (như Na, K, Ca) dễ nhường electron hơn, nghĩa là tính khử mạnh hơn.Kim loại kém hoạt động (như Au, Pt) ít nhường electron, tính khử yếu.
✔️C. Đúng. Cation Ag+ dễ nhận electron để tạo thành bạc kim loại, thể hiện tính oxi hóa mạnh.
❌D. Sai. Dù vàng (Au) là kim loại rất kém hoạt động nhưng vẫn có thể tham gia phản ứng trong điều kiện thích hợp, chẳng hạn phản ứng với nước cường toan. Vậy vàng vẫn có tính khử nhưng rất yếu.
⟹ Chọn đáp án D Đáp án: D
✔️A. Đúng. Kim loại có xu hướng nhường electron để tạo ion dương, thể hiện tính khử.
✔️B. Đúng. Kim loại hoạt động mạnh (như Na, K, Ca) dễ nhường electron hơn, nghĩa là tính khử mạnh hơn.Kim loại kém hoạt động (như Au, Pt) ít nhường electron, tính khử yếu.
✔️C. Đúng. Cation Ag+ dễ nhận electron để tạo thành bạc kim loại, thể hiện tính oxi hóa mạnh.
❌D. Sai. Dù vàng (Au) là kim loại rất kém hoạt động nhưng vẫn có thể tham gia phản ứng trong điều kiện thích hợp, chẳng hạn phản ứng với nước cường toan. Vậy vàng vẫn có tính khử nhưng rất yếu.
⟹ Chọn đáp án D Đáp án: D
Câu 4 [705854]: Thế điện cực chuẩn của cặp oxi hoá – khử Fe3+/Fe2+ và Cu2+/Cu lần lượt là 0,771 V và 0,340 V. Nhận định nào sau đây là đúng?
A, Tính khử của Cu yếu hơn tính khử của ion Fe2+.
B, Tính oxi hoá của ion Cu2+ mạnh hơn tính oxi hoá của ion Fe3+.
C, Ở điều kiện chuẩn, ion Fe2+ bị oxi hoá lên Fe3+ và có thể khử ion Cu2+ về Cu.
D, Ở điều kiện chuẩn, ion Fe3+ có thể bị khử về ion Fe2+ bởi kim loại Cu.
Ta có: 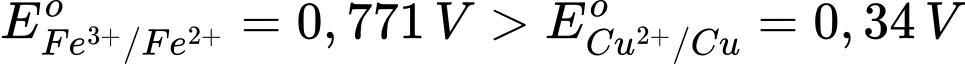
Dạng oxi hóa Fe3+ mạnh hơn Cu2+ và dạng khử Cu mạnh hơn Fe2+
2Fe3+ + Cu → 2Fe2+ + Cu2+
Phân tích các đáp án:
❌(a) – Sai. Tính khử của Cu mạnh hơn tính khử của ion Fe2+
❌(b) – Sai. Tính oxi hoá của ion Cu2+ yếu hơn tính oxi hoá của ion Fe3+.
❌(c) – Sai. Ở điều kiện chuẩn, ion Cu bị oxi hoá lên Cu2+ và có thể khử ion Fe3+ về Fe2+.
✔️(d) – Đúng. Ở điều kiện chuẩn, ion Fe3+ có thể bị khử về ion Fe2+ bởi kim loại Cu.
Ta có: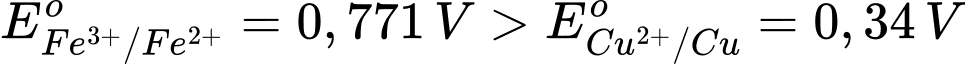
Dạng oxi hóa Fe3+ mạnh hơn Cu2+ và dạng khử Cu mạnh hơn Fe2+
2Fe3+ + Cu → 2Fe2+ + Cu2+
⟹ Chọn đáp án D Đáp án: D
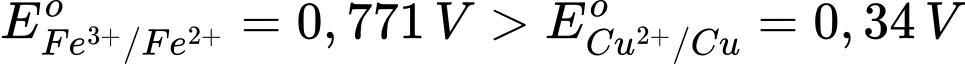
Dạng oxi hóa Fe3+ mạnh hơn Cu2+ và dạng khử Cu mạnh hơn Fe2+
2Fe3+ + Cu → 2Fe2+ + Cu2+
Phân tích các đáp án:
❌(a) – Sai. Tính khử của Cu mạnh hơn tính khử của ion Fe2+
❌(b) – Sai. Tính oxi hoá của ion Cu2+ yếu hơn tính oxi hoá của ion Fe3+.
❌(c) – Sai. Ở điều kiện chuẩn, ion Cu bị oxi hoá lên Cu2+ và có thể khử ion Fe3+ về Fe2+.
✔️(d) – Đúng. Ở điều kiện chuẩn, ion Fe3+ có thể bị khử về ion Fe2+ bởi kim loại Cu.
Ta có:
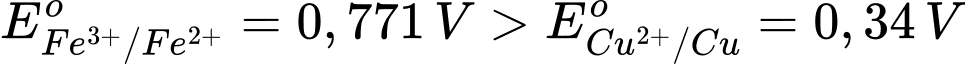
Dạng oxi hóa Fe3+ mạnh hơn Cu2+ và dạng khử Cu mạnh hơn Fe2+
2Fe3+ + Cu → 2Fe2+ + Cu2+
⟹ Chọn đáp án D Đáp án: D
Câu 5 [705855]: Nguyên tử nào có electron ngoài cùng nằm trong quỹ đạo có hình dạng như hình vẽ, với số lượng tử chính (n) là 3?
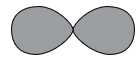

A, sodium.
B, chlorine.
C, calcium.
D, bromine.
Nguyên tử có electron ngoài cùng nằm trong quỹ đạo có hình dạng như hình vẽ, với số lượng tử chính (n) là 3
→ Như hình vẽ là AO p nên electron cuối cùng điền vào phân lớp p, số lượng tử chính là 3 nên có 3 lớp electron
→ Nguyên tử phù hợp là chlorine (Z = 17)
Cấu hình electron 1s2 2s2 2p6 3s2 3p5, thuộc nhóm VIIA chu kì 3 của bảng tuần hoàn.
⟹ Chọn đáp án B Đáp án: B
→ Như hình vẽ là AO p nên electron cuối cùng điền vào phân lớp p, số lượng tử chính là 3 nên có 3 lớp electron
→ Nguyên tử phù hợp là chlorine (Z = 17)
Cấu hình electron 1s2 2s2 2p6 3s2 3p5, thuộc nhóm VIIA chu kì 3 của bảng tuần hoàn.
⟹ Chọn đáp án B Đáp án: B
Câu 6 [705856]: Cho các phát biểu sau:
(a) Có cấu hình electron lớp ngoài cùng là ns¹ (n > 1).
(b) Có số oxi hoá là +1 hoặc +2 trong các hợp chất.
(c) Có tính khử mạnh.
(d) Có bán kính nguyên tử nhỏ.
(e) Còn được gọi là các kim loại kiềm.
Số phát biểu đúng về các nguyên tố nhóm IA là
(a) Có cấu hình electron lớp ngoài cùng là ns¹ (n > 1).
(b) Có số oxi hoá là +1 hoặc +2 trong các hợp chất.
(c) Có tính khử mạnh.
(d) Có bán kính nguyên tử nhỏ.
(e) Còn được gọi là các kim loại kiềm.
Số phát biểu đúng về các nguyên tố nhóm IA là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các đáp án:
✔️(a) – Đúng. Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hoá trị ở phân lớp ns1 và đứng đầu mỗi chu kì tương ứng.
❌(b) – Sai. trong các phản ứng hoá học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh: M ⟶ M+ + 1e .Trong hợp chất, nguyên tử kim loại nhóm IA chỉ thể hiện số oxi hoá +1.
✔️(c) – Đúng. Kim loại nhóm IA là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs.
❌(d) – Sai. Theo định luật tuần hoàn, trong 1 nhóm bán kính các nguyên tố giảm dần theo chiều tăng điện tích hạt, nên các nguyên tố kim loại kiềm đều đứng đầu nhóm nên có bán kính lớn
✔️(e) – Đúng. Các kim loại nhóm IA còn được gọi là kim loại kiềm.
Có 3 đáp án đúng.
⟹ Chọn đáp án C Đáp án: C
✔️(a) – Đúng. Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hoá trị ở phân lớp ns1 và đứng đầu mỗi chu kì tương ứng.
❌(b) – Sai. trong các phản ứng hoá học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh: M ⟶ M+ + 1e .Trong hợp chất, nguyên tử kim loại nhóm IA chỉ thể hiện số oxi hoá +1.
✔️(c) – Đúng. Kim loại nhóm IA là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs.
❌(d) – Sai. Theo định luật tuần hoàn, trong 1 nhóm bán kính các nguyên tố giảm dần theo chiều tăng điện tích hạt, nên các nguyên tố kim loại kiềm đều đứng đầu nhóm nên có bán kính lớn
✔️(e) – Đúng. Các kim loại nhóm IA còn được gọi là kim loại kiềm.
Có 3 đáp án đúng.
⟹ Chọn đáp án C Đáp án: C
Câu 7 [705857]: Đặc điểm nào sau đây là điểm chung của nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần?
A, Đều có thể làm mềm bằng Na3PO4.
B, Đều không chứa anion HCO3–.
C, Đều bị mất một phần tính cứng khi đun sôi nước.
D, Thành phần anion giống nhau.
Nước cứng toàn phần: Nước cứng thành phần hiểu đơn giản là loại nước cứng bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu. Do đó thành phần của nó sẽ là các muối Ca(HCO3)2, Mg(HCO3)2, MgCl2, CaCl2, MgSO4, CaSO4.
Nước cứng vĩnh cửu: Nước cứng vĩnh cửu là nước cứng chứa nồng độ cao của các anion, như anion sunfat (SO42-), clorua (Cl-) với thành phần là các muối như MgCl2, CaCl2, MgSO4, CaSO4.
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các cation Ca2+ và Mg2+ trong nước cứng. Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
Phân tích các đáp án:
✔️A. Cả nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần đều chứa các ion Ca2+,Mg2+. Muối Na3PO4 có thể tạo kết tủa với Ca2+,Mg2+ giúp làm mềm nước.
❌B.Nước có tính cứng vĩnh cửu không chứa HCO3−, nhưng nước có tính cứng toàn phần có thể chứa cả ion này.
❌C.Nước có tính cứng vĩnh cửu chứa ion SO42−,Cl−, không bị loại bỏ khi đun sôi.Chỉ nước có tính cứng tạm thời chứa HCO3− mới mất tính cứng khi đun sôi.
❌D.Nước có tính cứng vĩnh cửu chứa ion SO42−,Cl−, còn nước có tính cứng toàn phần có thể chứa cả HCO3−.Thành phần anion không hoàn toàn giống nhau.
⟹ Chọn đáp án A Đáp án: A
Nước cứng vĩnh cửu: Nước cứng vĩnh cửu là nước cứng chứa nồng độ cao của các anion, như anion sunfat (SO42-), clorua (Cl-) với thành phần là các muối như MgCl2, CaCl2, MgSO4, CaSO4.
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của các cation Ca2+ và Mg2+ trong nước cứng. Dùng Na2CO3 hoặc Na3PO4 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước.
Phân tích các đáp án:
✔️A. Cả nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần đều chứa các ion Ca2+,Mg2+. Muối Na3PO4 có thể tạo kết tủa với Ca2+,Mg2+ giúp làm mềm nước.
❌B.Nước có tính cứng vĩnh cửu không chứa HCO3−, nhưng nước có tính cứng toàn phần có thể chứa cả ion này.
❌C.Nước có tính cứng vĩnh cửu chứa ion SO42−,Cl−, không bị loại bỏ khi đun sôi.Chỉ nước có tính cứng tạm thời chứa HCO3− mới mất tính cứng khi đun sôi.
❌D.Nước có tính cứng vĩnh cửu chứa ion SO42−,Cl−, còn nước có tính cứng toàn phần có thể chứa cả HCO3−.Thành phần anion không hoàn toàn giống nhau.
⟹ Chọn đáp án A Đáp án: A
Câu 8 [705858]: Nguyên tố nào sau đây không phải là nguyên tố chuyển tiếp?
A, Mn.
B, Ni.
C, Cu.
D, Sr.
Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hoá trị thuộc phân lớp 3d và 4s nên kim loại chuyển tiếp dây thứ nhất thường tạo thành các hợp chất với nhiều số oxi hoá khác nhau.
Các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất.
Mn( Z = 25 ); Ni( Z = 28 ); Cu( Z = 29 ) là các kim loại chuyển tiếp dãy thứ nhất.
Sr( Z = 38 ) không là nguyên tố chuyển tiếp.
⟹ Chọn đáp án D Đáp án: D
Các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất.
Mn( Z = 25 ); Ni( Z = 28 ); Cu( Z = 29 ) là các kim loại chuyển tiếp dãy thứ nhất.
Sr( Z = 38 ) không là nguyên tố chuyển tiếp.
⟹ Chọn đáp án D Đáp án: D
Câu 9 [705859]: Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. 5,7-dimethyloctan-3-one có công thức cấu tạo như sau:
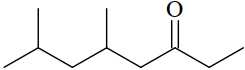
Kết quả phân tích phổ khối lượng cho thấy phân tử khối của 5,7-dimethyloctan-3-one có giá trị m/z bằng bao nhiêu?

Kết quả phân tích phổ khối lượng cho thấy phân tử khối của 5,7-dimethyloctan-3-one có giá trị m/z bằng bao nhiêu?
A, 92.
B, 118.
C, 130.
D, 156.
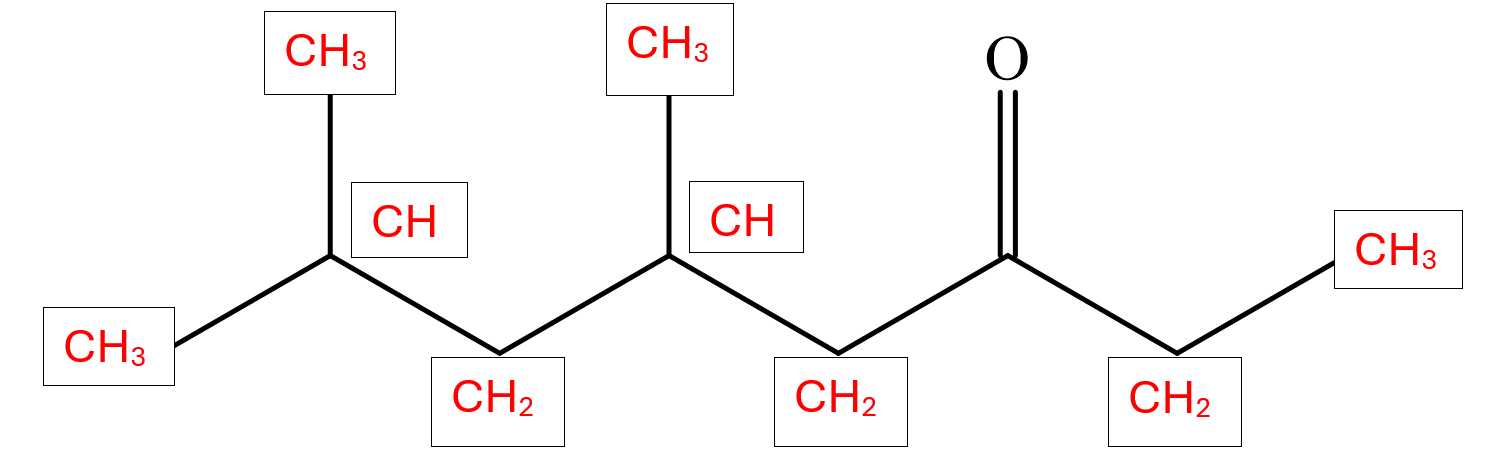
Phân tử khối của 5,7-dimethyloctan-3-one là 156.
⟹ Chọn đáp án D Đáp án: D
Câu 10 [304783]: Các hợp chất ester có sự phân cực nên vẫn có thể tạo được liên kết hydrogen với nước, tuy nhiên liên kết này yếu và số lượng không nhiều. Biễn diễn liên kết hydrogen (…………) của ester CH3COOCH3 với nước nào sau đây là đúng?
A, 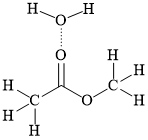

B, 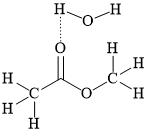

C, 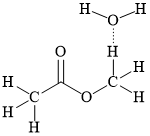

D, 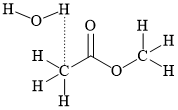

HD: Khái niệm: "liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử khác có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng."
Để gọi là liên phân tử thì phân tử đang xét phải chứa đồng thời "nguyên tử H" và "nguyên tử khác". Thêm một lưu ý nữa; carbon là nguyên tử có độ âm điện không lớn, nên các H mà liên kết với carbon không đủ điều kiện.
Quay lại với câu hỏi, quan sát cấu tạo các chất:


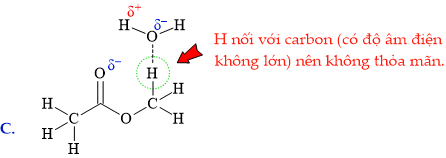
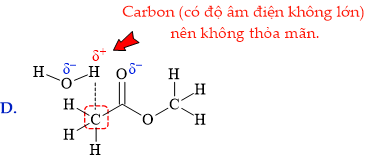
⇒ Biểu diễn ở đáp án B thỏa mãn ⇝ Chọn đáp án B. ♦ Đáp án: B
Để gọi là liên phân tử thì phân tử đang xét phải chứa đồng thời "nguyên tử H" và "nguyên tử khác". Thêm một lưu ý nữa; carbon là nguyên tử có độ âm điện không lớn, nên các H mà liên kết với carbon không đủ điều kiện.
Quay lại với câu hỏi, quan sát cấu tạo các chất:




⇒ Biểu diễn ở đáp án B thỏa mãn ⇝ Chọn đáp án B. ♦ Đáp án: B
Câu 11 [705861]: Công thức cấu tạo nào sau đây ứng với fructose ở dạng mạch hở?
A, 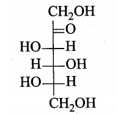

B, 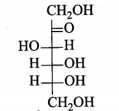

C, 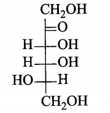

D, 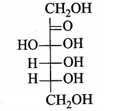

Fructose vòng 5 cạnh alpha-fructose và beta- fructose.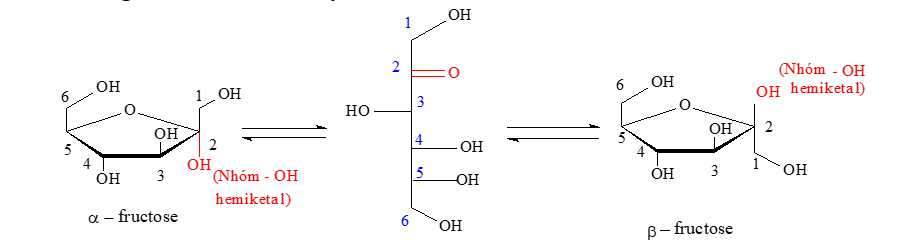
⟹ Chọn đáp án B
Đáp án: B

⟹ Chọn đáp án B
Đáp án: B
Câu 12 [705862]: Một số ester đơn chức mạch hở, đồng phân cấu tạo của nhau, phân tử có phần trăm khối lượng các nguyên tố C, H, O lần lượt là 54,54%; 9,10% và 36,36%. Trong số các ester, một đồng phân X thỏa mãn sơ đồ sau:
X + H2O ⇄ X1 + Y
Y + O2 ⇄ X1 + H2O
Phát biểu nào sau đây về các ester trên là không đúng?
X + H2O ⇄ X1 + Y
Y + O2 ⇄ X1 + H2O
Phát biểu nào sau đây về các ester trên là không đúng?
A, Có 4 ester đồng phân cấu tạo của nhau.
B, Công thức phân tử của các ester là C2H4O2.
C, Có ít nhất 1 ester tác dụng được với nước bromine.
D, Ester X là CH3COOC2H5.
Gọi công thức chung của Ester là CxHyOz
Phân tử khối của ester M là: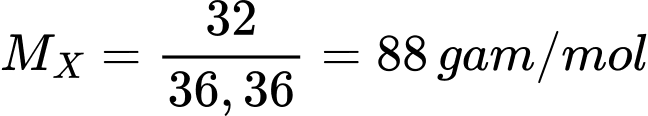
Ta có:
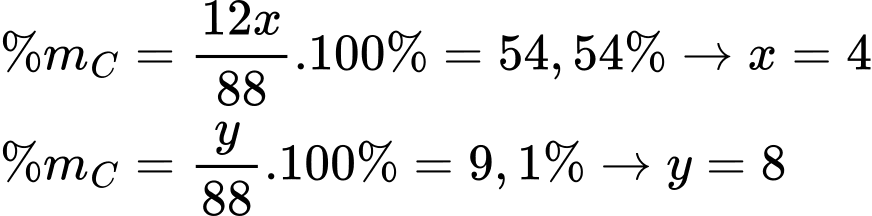
Công thức của ester là C4H8O2.
Công thức cấu tạo của X thỏa mãn phương trình là CH3COOC2H5
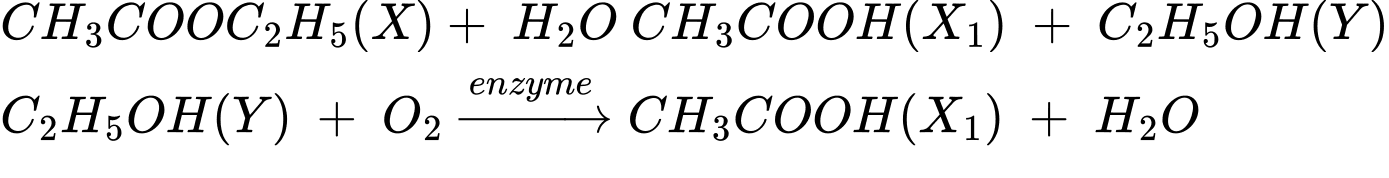
Phân tích các phát biểu:
✔️Đúng. a. Có 4 ester là đồng phân cấu tạo của nhau: HCOOCH2CH2CH3; HCOOCH(CH3)CH3; CH3COOC2H5; C2H5COOCH3.
❌Sai. b. Công thức phân tử của các ester là C4H8O2.
✔️Đúng. c. Có 2 ester tác dụng được với dung dịch bromine HCOOCH2CH2CH3; HCOOCH(CH3)CH3 đều chứa nhóm CHO nên phản ứng với dung dịch Br2. Nên có ít nhất 1 ester là đúng.
✔️Đúng. d. Công thức cấu tạo của X thỏa mãn phương trình là CH3COOC2H5.
⟹Chọn đáp án B
Đáp án: B
Phân tử khối của ester M là:
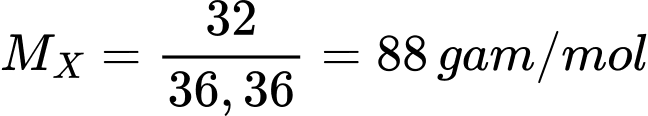
Ta có:
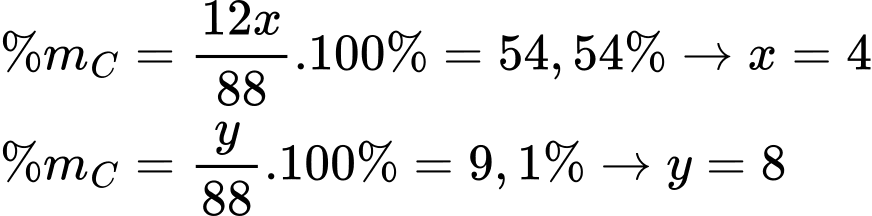
Công thức của ester là C4H8O2.
Công thức cấu tạo của X thỏa mãn phương trình là CH3COOC2H5
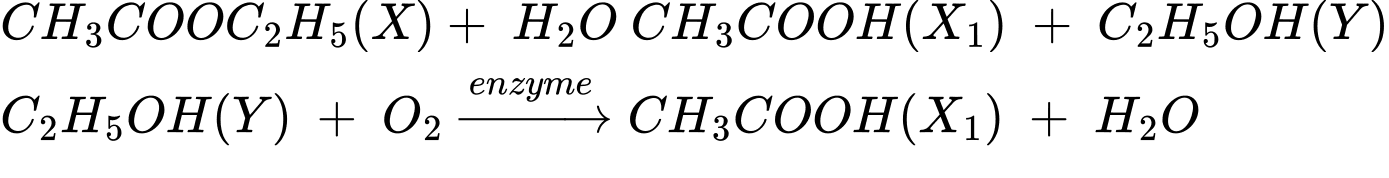
Phân tích các phát biểu:
✔️Đúng. a. Có 4 ester là đồng phân cấu tạo của nhau: HCOOCH2CH2CH3; HCOOCH(CH3)CH3; CH3COOC2H5; C2H5COOCH3.
❌Sai. b. Công thức phân tử của các ester là C4H8O2.
✔️Đúng. c. Có 2 ester tác dụng được với dung dịch bromine HCOOCH2CH2CH3; HCOOCH(CH3)CH3 đều chứa nhóm CHO nên phản ứng với dung dịch Br2. Nên có ít nhất 1 ester là đúng.
✔️Đúng. d. Công thức cấu tạo của X thỏa mãn phương trình là CH3COOC2H5.
⟹Chọn đáp án B
Đáp án: B
Câu 13 [308683]: Công thức của alanine là
A, C6H5NH2.
B, H2NCH2COOH.
C, CH3CH(NH2)COOH.
D, C2H5NH2.
Công thức phân tử của alanine là C3H7NO2.
Công thức cấu tạo thu gọn: NH2-CH(CH3)-COOH.
⇒ Chọn đáp án C Đáp án: C
Công thức cấu tạo thu gọn: NH2-CH(CH3)-COOH.
⇒ Chọn đáp án C Đáp án: C
Câu 14 [309505]: Quá trình kết hợp nhiều phân tử nhỏ (monomer) thành phân tử lớn (polymer) đồng thời giải phóng những phân tử nhỏ khác (thường là H2O) được gọi là phản ứng
A, Trùng hợp.
B, Thế.
C, Tách.
D, Trùng ngưng.
Quá trình kết hợp nhiều phân tử nhỏ (monomer) thành phần tử lớn (polymer) đồng thời giải phóng những phân từ nhỏ khác (ví dụ H2O) được gọi là phản ứng trùng ngưng.
Phân tích các đáp án :
❌A. Sai. Phản ứng trùng hợp là quá trình kết hợp nhiều monomer để tạo polymer mà không giải phóng phân tử nhỏ.
❌B. Sai. Phản ứng thế là phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử bị thay thế bởi nguyên tử hoặc nhóm nguyên tử khác.
❌C. Sai. Phản ứng tách là quá trình loại bỏ một phân tử nhỏ ra khỏi hợp chất lớn mà không hình thành polymer.
✔️D. Đúng. Phản ứng trùng ngưng là quá trình kết hợp nhiều monomer thành polymer đồng thời giải phóng một phân tử nhỏ.
⟹ Chọn đáp án D Đáp án: D
Phân tích các đáp án :
❌A. Sai. Phản ứng trùng hợp là quá trình kết hợp nhiều monomer để tạo polymer mà không giải phóng phân tử nhỏ.
❌B. Sai. Phản ứng thế là phản ứng trong đó một nguyên tử hoặc nhóm nguyên tử trong phân tử bị thay thế bởi nguyên tử hoặc nhóm nguyên tử khác.
❌C. Sai. Phản ứng tách là quá trình loại bỏ một phân tử nhỏ ra khỏi hợp chất lớn mà không hình thành polymer.
✔️D. Đúng. Phản ứng trùng ngưng là quá trình kết hợp nhiều monomer thành polymer đồng thời giải phóng một phân tử nhỏ.
⟹ Chọn đáp án D Đáp án: D
Câu 15 [705863]: Khi cho sulfuric acid đậm đặc tác dụng với sodium bromide rắn, tạo thành khí bromine cùng một số sản phẩm khác. Tuy nhiên, khi cho sulfuric acid đậm đặc tác dụng với sodium chloride rắn thì chỉ thấy tạo thành hydrochloride và sodium hydrogenslfate. Lí do của sự khác biệt này là gì?
A, Bromine ít bay hơi hơn chloride.
B, Hydrochloric acid là một acid yếu.
C, Sulfuric acid đậm đặc không phải là chất oxi hóa.
D, Ion bromide có tính khử mạnh hơn ion chloride.
Điều chế HF, HCl bằng cách cho H2SO4 đặc tác dụng với muối floride, cloride vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H2SO4đặc
CaF2 + H2SO4 → CaSO4 + 2HF
NaCl + H2SO4 → NaHSO4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H2SO4 đặc oxi hoá được những chất này thành Br2 và I2. Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H2SO4 → HBr + NaHSO4
2HBr + H2SO4 → Br2 + SO2+ 2H2O
NaI + H2SO4 → NaHSO4 + HI
2HI + H2SO4 → I2+ SO2 + 2H2O
Phân tích các đáp án :
❌A. Bromine ít bay hơi hơn chloride. Không liên quan đến sự tạo thành Br2 và Cl2.
❌B. Hydrochloric acid là một acid mạnh.
❌C. Sulfuric acid đậm đặc có tính oxi hóa mạnh.
✔️D. Ion bromide có tính khử mạnh hơn ion chloride.
⟹ Chọn đáp án D Đáp án: D
CaF2 + H2SO4 → CaSO4 + 2HF
NaCl + H2SO4 → NaHSO4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H2SO4 đặc oxi hoá được những chất này thành Br2 và I2. Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H2SO4 → HBr + NaHSO4
2HBr + H2SO4 → Br2 + SO2+ 2H2O
NaI + H2SO4 → NaHSO4 + HI
2HI + H2SO4 → I2+ SO2 + 2H2O
Phân tích các đáp án :
❌A. Bromine ít bay hơi hơn chloride. Không liên quan đến sự tạo thành Br2 và Cl2.
❌B. Hydrochloric acid là một acid mạnh.
❌C. Sulfuric acid đậm đặc có tính oxi hóa mạnh.
✔️D. Ion bromide có tính khử mạnh hơn ion chloride.
⟹ Chọn đáp án D Đáp án: D
Câu 16 [705864]: Bảng sau đây hiển thị tỉ lệ phần trăm khối lượng của các nguyên tố trong một phân tử sinh học nhất định:
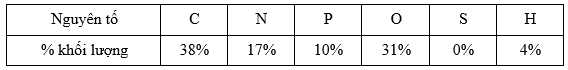
Câu nào sau đây mô tả tốt nhất về phân tử sinh học?

Câu nào sau đây mô tả tốt nhất về phân tử sinh học?
A, Phân tử này là một loại ester.
B, Phân từ này là một nucleic acid.
C, Phân tử này là một loại carbohydrate.
D, Phân tử này là một loại amino acid.
Phân tích các đáp án :
❌A – Sai. Phân tử ester chứa 3 nguyên tố C, H, O.
✔️B – Đúng. Acid nucleic được cấu tạo bởi các đơn phân gọi là nucleotide, chúng được cấu tạo bởi 3 thành phần: đường 5-carbon, nhóm gốc phosphate và nhóm gốc base chứa nitrogen. Có hai loại Acid nucleic chính là deoxyribonucleic acid (DNA) và ribonucleic acid (RNA). Các nguyên tố cấu thành lên nucleic acid là C, H, O, N, P.
❌C – Sai. Phân tử carbohydrate chứa 3 nguyên tố C, H, O.
❌D – Sai. Phân tử amino acid chứa 4 nguyên tố C, H, O, N.
⟹ Chọn đáp án B Đáp án: B
❌A – Sai. Phân tử ester chứa 3 nguyên tố C, H, O.
✔️B – Đúng. Acid nucleic được cấu tạo bởi các đơn phân gọi là nucleotide, chúng được cấu tạo bởi 3 thành phần: đường 5-carbon, nhóm gốc phosphate và nhóm gốc base chứa nitrogen. Có hai loại Acid nucleic chính là deoxyribonucleic acid (DNA) và ribonucleic acid (RNA). Các nguyên tố cấu thành lên nucleic acid là C, H, O, N, P.
❌C – Sai. Phân tử carbohydrate chứa 3 nguyên tố C, H, O.
❌D – Sai. Phân tử amino acid chứa 4 nguyên tố C, H, O, N.
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Khi hydrochloric acid đặc được thêm vào dung dịch đồng(II) sulfate, ion Cl– sẽ phá hủy phức chất aqua để tạo thành phức chất mới [CuCl4]2–.
[Cu(H2O)6]2+(aq) + Cl–(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
xanh lam vàng
Dung dịch nước thu được được tạo thành chứa các ion phức hợp [CuCl4]2− và [Cu(H2O)6]2+.
[Cu(H2O)6]2+(aq) + Cl–(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
xanh lam vàng
Dung dịch nước thu được được tạo thành chứa các ion phức hợp [CuCl4]2− và [Cu(H2O)6]2+.
Câu 17 [705865]: Dung dịch nước sau phản ứng chứa hỗn hợp hai phức chất có màu
A, xanh lam.
B, xanh lục.
C, vàng.
D, đỏ.
Sau phản ứng có hình thành phức chất [CuCl2]2-(aq), phức chất ban đầu là [Cu(H2O)6]2+ màu xanh sau phản ứng dung dịch chuyển sang màu xanh lục do phản ứng là phản ứng thuận nghịch, chưa cả [CuCl2]2- màu vàng và [Cu(H2O)6]2+ màu xanh lam.
⟹ Chọn đáp án B Đáp án: B
⟹ Chọn đáp án B Đáp án: B
Câu 18 [705866]: Sự trao đổi các phối tử diễn ra từng bước khi các phối tử lần lượt được thay thế. Ví dụ, bước thứ hai trong quá trình trao đổi phối tử H2O với phối tử Cl– được thể hiện bằng phương trình này:
[Cu(H2O)5Cl]+(aq) + Cl–(aq) ⇄ Cu(H2O)4Cl2(aq) + H2O(l)
Người ta thấy rằng đối với phản ứng này, với nồng độ đầu của phức chất [(Cu(H2O)5Cl]+ là 0,15 M và HCl là 0,15 M thì tại thời điểm cân bằng, nồng độ của phức Cu(H2O)4Cl2(aq) là 0,10 M. Hằng số cân bằng KC của phản ứng trên là
[Cu(H2O)5Cl]+(aq) + Cl–(aq) ⇄ Cu(H2O)4Cl2(aq) + H2O(l)
Người ta thấy rằng đối với phản ứng này, với nồng độ đầu của phức chất [(Cu(H2O)5Cl]+ là 0,15 M và HCl là 0,15 M thì tại thời điểm cân bằng, nồng độ của phức Cu(H2O)4Cl2(aq) là 0,10 M. Hằng số cân bằng KC của phản ứng trên là
A, 4,4.
B, 8,8.
C, 40,0.
D, 84,4.
Phương trình phản ứng:
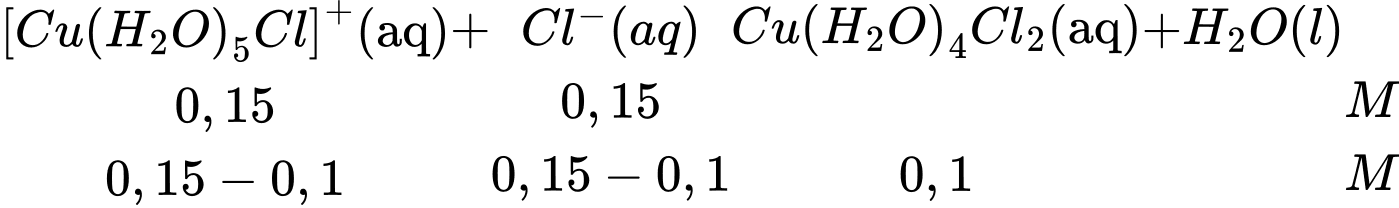
Hằng số cân bằng KC của phản ứng trên là:
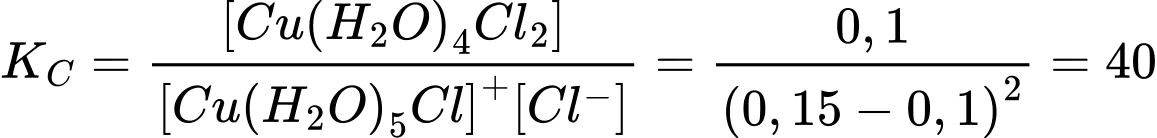
⟹Chọn đáp án C Đáp án: C
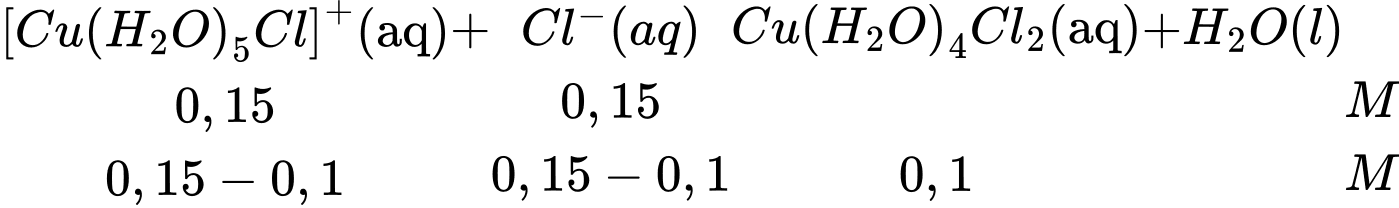
Hằng số cân bằng KC của phản ứng trên là:
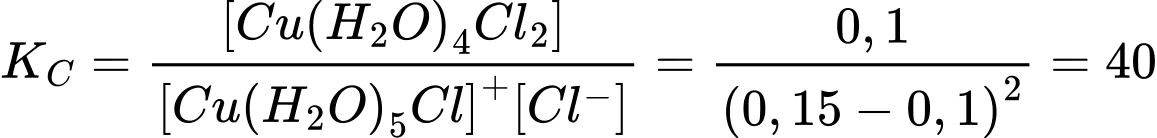
⟹Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [705867]: Khi thực hành thí nghiệm phản ứng của hexane với bromine. Cần tiến hành các bước:
• Bước 1: Cho vào ống nghiệm khô khoảng 1 mL hexane và nhỏ thêm vào ống nghiệm khoảng 1 mL nước bromine. Quan sát màu sắc sau đó lắc nhẹ hỗn hợp rồi để yên 10 phút.
• Bước 2: Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH rồi nhúng phần đáy ống nghiệm vào cốc nước nóng 50 oC (đã chuẩn bị trước) hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời.
Chú ý an toàn: Hexane, bromine và hydrogen bromine dễ bay hơi, có mùi xốc, độc.
• Bước 1: Cho vào ống nghiệm khô khoảng 1 mL hexane và nhỏ thêm vào ống nghiệm khoảng 1 mL nước bromine. Quan sát màu sắc sau đó lắc nhẹ hỗn hợp rồi để yên 10 phút.
• Bước 2: Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH rồi nhúng phần đáy ống nghiệm vào cốc nước nóng 50 oC (đã chuẩn bị trước) hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời.
Chú ý an toàn: Hexane, bromine và hydrogen bromine dễ bay hơi, có mùi xốc, độc.
Phân tích các đáp án :
✔️(a) – Đúng. Br2 tan trong hexane tốt hơn tan trong H2O nên Br2 sẽ di chuyển từ dung dịch nước sang dung môi mới là hexane.
✔️(b) – Đúng. Phần nổi là dung dịch Br2/Hexane có màu vàng nâu có khối lượng riêng nhỏ hơn, phần dưới là H2O nên phần trên có màu đậm hơn phần dưới.
✔️(c) – Đúng. Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH là để hạn chế các khí độc bay ra ngoài. Bước 2 xảy ra phản ứng giữa hexane với Br2 tạo khí HBr gây độc
C6H14 + Br2 → C6H13Br + HBr
❌(d) – Sai. Cl2 phản ứng với hexane để tạo ra các dẫn xuất chloro, các dẫn xuất này đều tan trong hexane → tạo thành dung dịch đồng nhất.
✔️(a) – Đúng. Br2 tan trong hexane tốt hơn tan trong H2O nên Br2 sẽ di chuyển từ dung dịch nước sang dung môi mới là hexane.
✔️(b) – Đúng. Phần nổi là dung dịch Br2/Hexane có màu vàng nâu có khối lượng riêng nhỏ hơn, phần dưới là H2O nên phần trên có màu đậm hơn phần dưới.
✔️(c) – Đúng. Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH là để hạn chế các khí độc bay ra ngoài. Bước 2 xảy ra phản ứng giữa hexane với Br2 tạo khí HBr gây độc
C6H14 + Br2 → C6H13Br + HBr
❌(d) – Sai. Cl2 phản ứng với hexane để tạo ra các dẫn xuất chloro, các dẫn xuất này đều tan trong hexane → tạo thành dung dịch đồng nhất.
Câu 20 [705868]: Chuyển động của các ion đến các điện cực trong quá trình điện di sẽ bị ảnh hưởng bởi độ pH. Hãy xem xét một mẫu bao gồm hỗn hợp ba amino acid ở độ pH là 7.
• Amino acid A+: lysine, dạng tồn tại mang điện tích dương.
• Amino acid B: glycine, dạng tồn tại ion lưỡng cực.
• Amino acid C–: glutamic acid, dạng tồn tại mang điện tích âm.
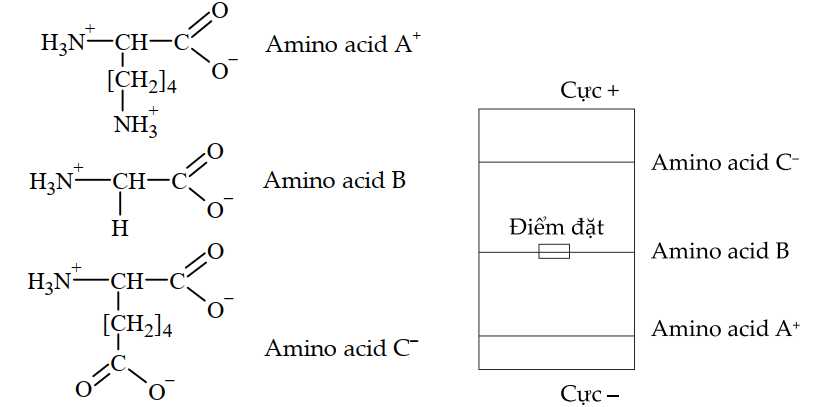
• Amino acid A+: lysine, dạng tồn tại mang điện tích dương.
• Amino acid B: glycine, dạng tồn tại ion lưỡng cực.
• Amino acid C–: glutamic acid, dạng tồn tại mang điện tích âm.

Phân tích các phát biểu :
❌(a) – Sai. Amino acid A+ di chuyển về phía cực âm.
✔️(b) – Đúng. Amino acid B tổng điện tích là 0 nên hầu như không di chuyển trong điện trường.
✔️(c) – Đúng. Khi pH tăng dần, amino acid C sẽ mất dần H+, chuyển về dạng anion
✔️(d) – Đúng. Amino acid nào có phân tử khối càng lớn thì di chuyển càng chậm. Glutamic acid có phân tử khối bằng 147 lớn hơn lysine có phân tử khối bằng 146 nên sẽ di chuyển tốc độ chậm hơn.
❌(a) – Sai. Amino acid A+ di chuyển về phía cực âm.
✔️(b) – Đúng. Amino acid B tổng điện tích là 0 nên hầu như không di chuyển trong điện trường.
✔️(c) – Đúng. Khi pH tăng dần, amino acid C sẽ mất dần H+, chuyển về dạng anion
✔️(d) – Đúng. Amino acid nào có phân tử khối càng lớn thì di chuyển càng chậm. Glutamic acid có phân tử khối bằng 147 lớn hơn lysine có phân tử khối bằng 146 nên sẽ di chuyển tốc độ chậm hơn.
Câu 21 [705869]: Nghiên cứu thành phần của hai mẫu soda (Na2CO3) kết tinh hydrate là A và B như sau:
• Thí nghiệm 1: Cho một mẫu (A) nặng 1,287 g phản ứng với lượng dư hydrochloric acid thì có 111,555 mL khí giải phóng (đo ở điều kiện chuẩn).
• Thí nghiệm 2: Phân hủy một mẫu (B) khác nặng 0,715 g bởi 50 mL sulfuric acid 0,2 M. Sau khi phân hủy hoàn toàn, cần 150 mL dung dịch sodium hydroxide 0,1 M để trung hòa acid dư.
• Thí nghiệm 1: Cho một mẫu (A) nặng 1,287 g phản ứng với lượng dư hydrochloric acid thì có 111,555 mL khí giải phóng (đo ở điều kiện chuẩn).
• Thí nghiệm 2: Phân hủy một mẫu (B) khác nặng 0,715 g bởi 50 mL sulfuric acid 0,2 M. Sau khi phân hủy hoàn toàn, cần 150 mL dung dịch sodium hydroxide 0,1 M để trung hòa acid dư.
⭐Thí nghiệm 1: Phương trình phản ứng:
Na2CO3.xH2O + 2HCl ⟶ 2NaCl + H2O + CO2
Đổi 111,555 mL = 0,111555L
Số mol của CO2 là: nCO2 = 0,111555 ÷ 24,79 =0,0045 mol
Theo phương trình: nNa2CO3 = nCO2 = 0,0045 mol.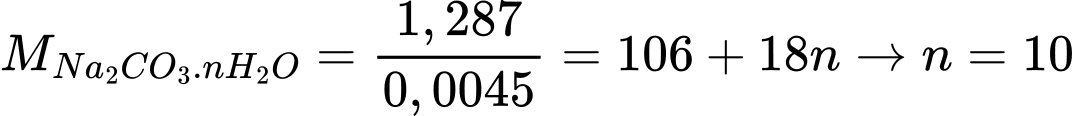
⭐Thí nghiệm 2: Phương trình phản ứng:
Đổi 50 mL = 0,05 L; 150 mL = 0,15 L
(1) Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O
Số mol của H2SO4 là nH2SO4 = 0,2 × 0,05 = 0,01 mol
Số mol của NaOH phản ứng với H2SO4 dư là:
nH2SO4 = 0,15 × 0,1 = 0,015 mol
Số mol H2SO4 phản ứng với NaOH là nH2SO4 = 0,0075 mol
Số mol H2SO4 phản ứng với Na2CO3 là nH2SO4 = 0,01 – 0,0075 = 0,0025 mol
Số mol của Na2CO3 là nNa2CO3 = 0,0075 mol
Phân tích các phát biểu:
✔️Đúng. a. Số phân tử nước trên mỗi phân tử Na2CO3 trong A là 10.
✔️Đúng. b. Mẫu B cũng là muối kết tinh của Na2CO3 nên khi phản ứng với H2SO4 sẽ tạo ra bọt khí.
Phương trình phản ứng:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
✔️Đúng. c. Tăng nồng độ NaOH lên hai lần thì thể tích cần dùng giảm 2 lần thì số mol cần dùng của NaOH không đổi
✔️Đúng. d. Hai mẫu soda A và B có thành phần muối kết tinh giống nhau.
Na2CO3.xH2O + 2HCl ⟶ 2NaCl + H2O + CO2
Đổi 111,555 mL = 0,111555L
Số mol của CO2 là: nCO2 = 0,111555 ÷ 24,79 =0,0045 mol
Theo phương trình: nNa2CO3 = nCO2 = 0,0045 mol.
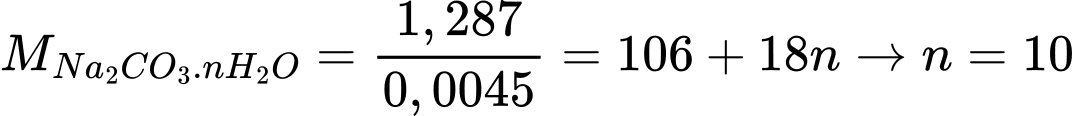
⭐Thí nghiệm 2: Phương trình phản ứng:
Đổi 50 mL = 0,05 L; 150 mL = 0,15 L
(1) Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O
Số mol của H2SO4 là nH2SO4 = 0,2 × 0,05 = 0,01 mol
Số mol của NaOH phản ứng với H2SO4 dư là:
nH2SO4 = 0,15 × 0,1 = 0,015 mol
Số mol H2SO4 phản ứng với NaOH là nH2SO4 = 0,0075 mol
Số mol H2SO4 phản ứng với Na2CO3 là nH2SO4 = 0,01 – 0,0075 = 0,0025 mol
Số mol của Na2CO3 là nNa2CO3 = 0,0075 mol
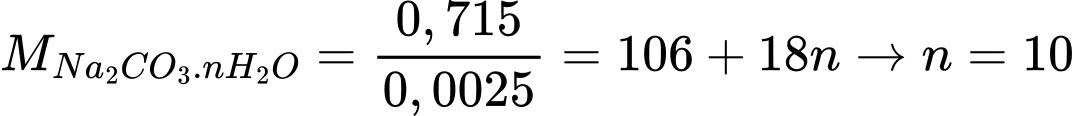
Phân tích các phát biểu:
✔️Đúng. a. Số phân tử nước trên mỗi phân tử Na2CO3 trong A là 10.
✔️Đúng. b. Mẫu B cũng là muối kết tinh của Na2CO3 nên khi phản ứng với H2SO4 sẽ tạo ra bọt khí.
Phương trình phản ứng:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
✔️Đúng. c. Tăng nồng độ NaOH lên hai lần thì thể tích cần dùng giảm 2 lần thì số mol cần dùng của NaOH không đổi
✔️Đúng. d. Hai mẫu soda A và B có thành phần muối kết tinh giống nhau.
Câu 22 [705870]: Dung dịch đệm có khả năng chống lại sự thay đổi pH đột ngột, giúp nó được dùng phổ biến trong các quá trình hoá học và các chu trình hoá sinh. Dung dịch đệm được tạo thành từ hỗn hợp của acid H và dạng base liên hợp của nó là A–. Một học sinh tiến hành tạo ra một dung dịch đệm như sau:
• Bước 1: Chuẩn bị bình tam giác chứa 10 mL dung dịch hydrofluoric acid (HF) với nồng độ 0,656 M.
• Bước 2: Thêm từ từ x mL dung dịch NaOH 0,1 M vào bình tam giác. Lúc này thành phần trong bình tam giác sẽ chứa HF dư và F–. Từ đó hình thành một dung dịch đệm.
• Bước 3: Đo pH của dung dịch đệm thì giá trị thu được là 4,14.
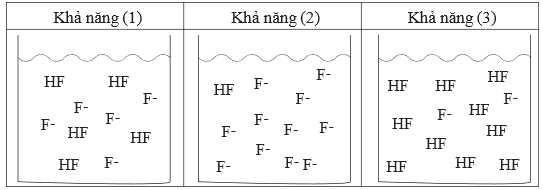
Ngoài ra, bạn học sinh còn đưa ra 3 khả năng có thể có về thành thành phần của dung dịch đệm như sau:
Bỏ qua sự biểu diễn của các phân tử nước và ion Na+. Biết hằng số phân li acid Ka của HF như sau:
HF(aq) ⇄ F–(aq) + H+(aq);
Ka = 7,2 × 10–4.
• Bước 1: Chuẩn bị bình tam giác chứa 10 mL dung dịch hydrofluoric acid (HF) với nồng độ 0,656 M.
• Bước 2: Thêm từ từ x mL dung dịch NaOH 0,1 M vào bình tam giác. Lúc này thành phần trong bình tam giác sẽ chứa HF dư và F–. Từ đó hình thành một dung dịch đệm.
• Bước 3: Đo pH của dung dịch đệm thì giá trị thu được là 4,14.
Ngoài ra, bạn học sinh còn đưa ra 3 khả năng có thể có về thành thành phần của dung dịch đệm như sau:

Bỏ qua sự biểu diễn của các phân tử nước và ion Na+. Biết hằng số phân li acid Ka của HF như sau:
HF(aq) ⇄ F–(aq) + H+(aq);
Ka = 7,2 × 10–4.
Phân tích các phát biểu:
✔️A. Đúng. Dung dịch HF 0,656M có giá trị pH là 1,67.
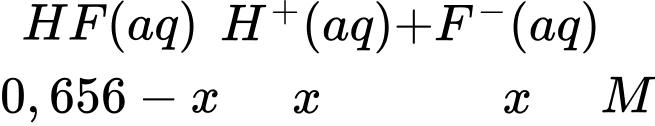
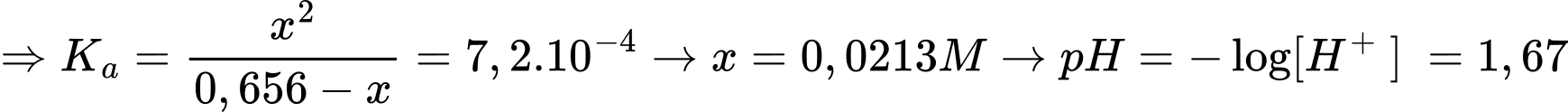
✔️B. Đúng. Giá trị x càng lớn thì nồng độ F- phân li tạo thành càng lớn.
✔️C. Đúng.Dung dịch đệm là một dạng dung dịch lỏng chứa đựng trong đó một hỗn hợp acid yếu và base liên hợp của nó hoặc base yếu và acid liên hợp.
Dung dịch đệm trên được tạo thành từ hỗn hợp của acid HF và base liên hợp F¯.
✔️D. Đúng. Thành phần dung dịch đệm trong khả năng (1) phù hợp với giá trị pH bằng 4,14. Khả năng (1) chứa cân bằng HF và F- phù hợp với pH = 4,14.
✔️A. Đúng. Dung dịch HF 0,656M có giá trị pH là 1,67.
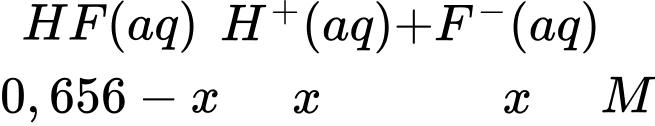
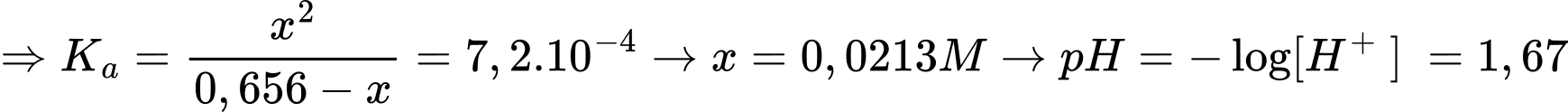
✔️B. Đúng. Giá trị x càng lớn thì nồng độ F- phân li tạo thành càng lớn.
✔️C. Đúng.Dung dịch đệm là một dạng dung dịch lỏng chứa đựng trong đó một hỗn hợp acid yếu và base liên hợp của nó hoặc base yếu và acid liên hợp.
Dung dịch đệm trên được tạo thành từ hỗn hợp của acid HF và base liên hợp F¯.
✔️D. Đúng. Thành phần dung dịch đệm trong khả năng (1) phù hợp với giá trị pH bằng 4,14. Khả năng (1) chứa cân bằng HF và F- phù hợp với pH = 4,14.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [705871]: Dùng 301,25 gam hỗn hợp tecmit (Al và Fe2O3 theo tỉ lệ mol tương ứng 3 : 1) để hàn vết nứt trên đường ray tàu hỏa có thể tích V cm3. Giả thiết lượng Fe cần hàn cho vết nứt bằng 79% lượng Fe sinh ra; khối lượng riêng của sắt là 7,9 gam/cm3; chỉ xảy ra phản ứng khử Fe2O3 thành Fe với hiệu suất của phản ứng bằng 96%. Tính giá trị của V? ( làm tròn đến hàng phần mười )
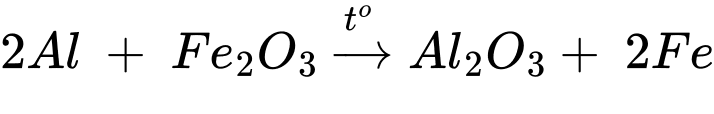
Đặt số mol của Al và Fe2O3 lần lượt là 3x và x mol
mthermite = 3x.27 + 160x = 301,25 gam → x = 1,25 mol
→ nAl = 3,75 mol; nFe2O3 = 1,25 mol
Theo lí thuyết số mol Fe tạo ra tối đa là nFe = 2,5 mol
Khối lượng Fe cần thiết cho hàn đường ray là mFe = 2,5.56.96%.79% =106,176 gam
Thể tích Fe cần để hàn đương ray là VFe = 106,176:7,9 = 13,44 cm3 ≈ 13,4 cm3
⟹Điền đáp án: 13,4
Câu 24 [705872]: Trong phòng thí nghiệm có 4 lọ hóa chất có dán nhãn tên hóa chất là: ethyl acetate, ethanol, acetic acid và methyl formate và 4 tờ đề can có ghi sẵn nhiệt độ sôi là: 77 oC; 32 oC, 117,9 oC; 78,3 oC. Có một số phương án điền các giá trị nhiệt độ sôi tương ứng với các chất được trình bày trong bảng sau:
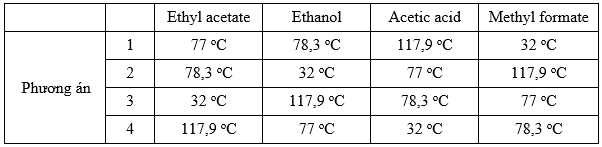
Phương án phù hợp nhất tương ứng với nhiệt độ sôi của các chất là

Phương án phù hợp nhất tương ứng với nhiệt độ sôi của các chất là
Thứ tự giảm dần nhiệt độ sôi: Carboxylic acid > alcohol > ester
- Carboxylic acid và alcohol có thể tạo liên kết hydrogen nên có nhiệt độ sôi cao hơn so với ester. Nhiệt độ sôi của carboxylic acid lớn hơn alcohol do tạo liên kết hydrogen mạnh hơn so với alcohol
- Giữa các ester khi so sánh nhiệt độ sôi, chất nào có khối lượng phân tử lớn hơn thì tương tác val deer waals tăng dẫn đến nhiệt độ sôi cao hơn
- Thứ tự tăng dần nhiệt độ sôi của các chất là : methyl formate < ethyl acetate < ethanol < acetic acid
⟹ Phương án đúng là 1
⟹Điền đáp án : 1
- Carboxylic acid và alcohol có thể tạo liên kết hydrogen nên có nhiệt độ sôi cao hơn so với ester. Nhiệt độ sôi của carboxylic acid lớn hơn alcohol do tạo liên kết hydrogen mạnh hơn so với alcohol
- Giữa các ester khi so sánh nhiệt độ sôi, chất nào có khối lượng phân tử lớn hơn thì tương tác val deer waals tăng dẫn đến nhiệt độ sôi cao hơn
- Thứ tự tăng dần nhiệt độ sôi của các chất là : methyl formate < ethyl acetate < ethanol < acetic acid
⟹ Phương án đúng là 1
⟹Điền đáp án : 1
Câu 25 [705873]: Alliin là một amino acid có trong tỏi tươi, khi đập dập hay nghiền, enzyme alliinase sẽ chuyển hoá alliin thành allicin, tạo ra mùi đặc trưng của tỏi. Cấu trúc phân tử của alliin được mô tả dưới đây:
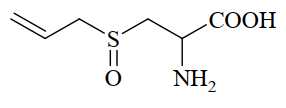
Phân tử khối của alliin là

Phân tử khối của alliin là
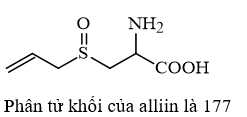
⟹Điền đáp án : 177
Câu 26 [705874]: Cumene (isopropylbenzene) thuộc nhóm có thể gây ung thư ở người. Cumene thải ra ngoài môi trường từ quá trình đốt cháy không hoàn toàn nhiên liệu hóa thạch từ các phương tiện giao thông, do dầu tràn, vận chuyển và phân phối nhiên liệu hóa thạch. Bảng sau đây thống kê một số nguồn sản sinh cumene trong đời sống sinh hoạt và sản xuất:
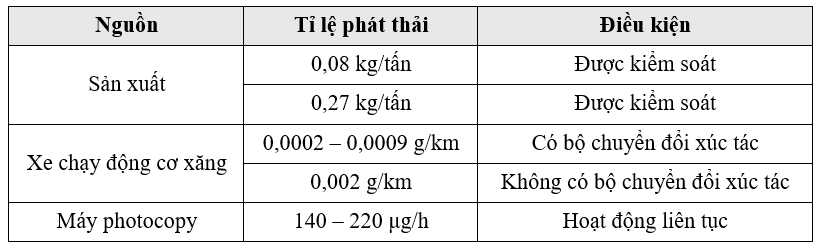
Một cửa hàng có 3 máy photocopy. Bình quân mỗi máy hoạt động liên tục 12 giờ/ngày. Trong một tháng (30 ngày), có bao nhiêu gam cumene tối đa phát thải từ 10 000 cửa hàng có quy mô như trên?

Một cửa hàng có 3 máy photocopy. Bình quân mỗi máy hoạt động liên tục 12 giờ/ngày. Trong một tháng (30 ngày), có bao nhiêu gam cumene tối đa phát thải từ 10 000 cửa hàng có quy mô như trên?
Máy photocopy mỗi giờ phát thải tối đa cumene
Trong (1 ngày) lượng cumene tối đa được phát thải trong 1 cửa hàng là
m = 10-6.3.12.220 = 7,92.10-3 gam
Trong một tháng (30 ngày) lượng cumene tối đa được phát thải trong 10 000 cửa hàng là
m = 30.10000.7,92.10-3 = 2376 g
⟹ Điền đáp án : 2376
Trong (1 ngày) lượng cumene tối đa được phát thải trong 1 cửa hàng là
m = 10-6.3.12.220 = 7,92.10-3 gam
Trong một tháng (30 ngày) lượng cumene tối đa được phát thải trong 10 000 cửa hàng là
m = 30.10000.7,92.10-3 = 2376 g
⟹ Điền đáp án : 2376
Câu 27 [705875]: Thực vật sử dụng quá trình quang hợp để chuyển đổi năng lượng ánh sáng từ mặt trời thành năng lượng hóa học. Trong quá trình quang hợp xảy ra phản ứng giữa khí carbonic và nước theo phương trình hóa học:
6CO2(g) + 6H2O(l)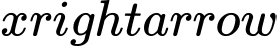 C6H12O6(aq) + 6O2(g).
C6H12O6(aq) + 6O2(g).
Biến thiên enthalpy chuẩn của phản ứng có giá trị là bao nhiêu kJ? (Cho enthalpy tạo thành chuẩn của CO2(g) bằng −394 kJ/mol; H2O(l) bằng −286 kJ/mol và C6H12O6(aq) bằng −1271 kJ/mol).
6CO2(g) + 6H2O(l)
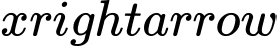 C6H12O6(aq) + 6O2(g).
C6H12O6(aq) + 6O2(g).Biến thiên enthalpy chuẩn của phản ứng có giá trị là bao nhiêu kJ? (Cho enthalpy tạo thành chuẩn của CO2(g) bằng −394 kJ/mol; H2O(l) bằng −286 kJ/mol và C6H12O6(aq) bằng −1271 kJ/mol).

6CO2(g) + 6H2O(l) → C6H12O6(aq) + 6O2(g)
Biến thiên enthalpy của phản ứng là
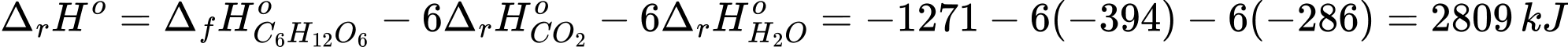
⟹Điền đáp án : 2809
Biến thiên enthalpy của phản ứng là
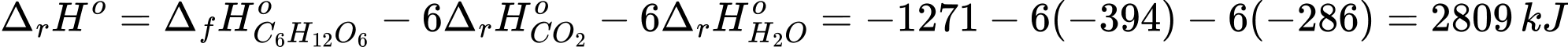
⟹Điền đáp án : 2809
Câu 28 [705876]: Potassium iodate (KIO3) là một hợp chất dạng tinh thể màu trắng, không mùi, và có tính chất oxy hóa mạnh. Nó được sử dụng rộng rãi trong việc bổ sung iodine vào muối ăn để ngăn ngừa bệnh do thiếu iodine như bướu cổ. Để xác định hàm lượng iodine (trong KIO3) của một mẫu “muối i-ốt”. Một sinh viên tiến hành như sau:
Bước 1: Cân 30 gam “muối i-ốt” rồi hòa tan trong nước cất thu được 100 mL dung dịch X đựng trong bình nón 250 mL (có nút nhám) thêm dung dịch KI 1 M (dư), dung dịch H2SO4 1 M.
5KIO3 + KI + 3H2SO4 3K2SO4 + 3I2 + 3H2O
3K2SO4 + 3I2 + 3H2O
Bước 2: Đậy nắp và lắc nhanh mẫu, để mẫu yên tĩnh nơi tối 5 phút. Sau 5 phút, thêm 1 mL dung dịch hồ tinh bột 1%, rồi đem chuẩn độ chậm (4 giây một giọt) bằng dung dịch Na2S2O3 0,005 M tới khi mất màu thì thể tích dung dịch Na2S2O3 đã dùng là 11,0 mL.
I2 + 2Na2S2O3 2NaI + Na2S4O6
2NaI + Na2S4O6
Tính hàm lượng iodine (mg/kg muối) trong KIO3 của mẫu “muối i-ốt” trên (làm tròn đến số nguyên).
Bước 1: Cân 30 gam “muối i-ốt” rồi hòa tan trong nước cất thu được 100 mL dung dịch X đựng trong bình nón 250 mL (có nút nhám) thêm dung dịch KI 1 M (dư), dung dịch H2SO4 1 M.
5KIO3 + KI + 3H2SO4
 3K2SO4 + 3I2 + 3H2O
3K2SO4 + 3I2 + 3H2OBước 2: Đậy nắp và lắc nhanh mẫu, để mẫu yên tĩnh nơi tối 5 phút. Sau 5 phút, thêm 1 mL dung dịch hồ tinh bột 1%, rồi đem chuẩn độ chậm (4 giây một giọt) bằng dung dịch Na2S2O3 0,005 M tới khi mất màu thì thể tích dung dịch Na2S2O3 đã dùng là 11,0 mL.
I2 + 2Na2S2O3
 2NaI + Na2S4O6
2NaI + Na2S4O6Tính hàm lượng iodine (mg/kg muối) trong KIO3 của mẫu “muối i-ốt” trên (làm tròn đến số nguyên).
(1) KI + 5KIO3 + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O
(2) 2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Đổi 11 mL = 0,011 L
Số mol Na2S2O3 đã phản ứng là nNa2S2O3 = 0,011.0,005 = 5,5.10-5 mol
Số mol I2 = nNa2S2O3 : 2 = 2,75×10−5 mol
Từ PTHH (1) và (2) số mol của KIO3 là 4,583×10−5 mol
Hàm lượng iodine trong muối trên là:
⟹Điền đáp án : 194
(2) 2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Đổi 11 mL = 0,011 L
Số mol Na2S2O3 đã phản ứng là nNa2S2O3 = 0,011.0,005 = 5,5.10-5 mol
Số mol I2 = nNa2S2O3 : 2 = 2,75×10−5 mol
Từ PTHH (1) và (2) số mol của KIO3 là 4,583×10−5 mol
Hàm lượng iodine trong muối trên là:
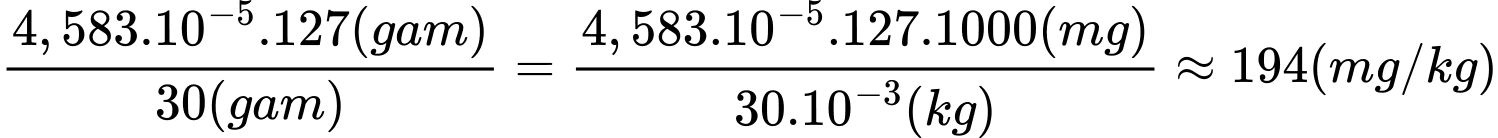
⟹Điền đáp án : 194