PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
❌A. Đồng chủ yếu được khai thác từ các quặng như chalcopyrit (CuFeS2), malachite (Cu2CO3(OH)2), và bornite (Cu5FeS4). Sphalerite không phải là nguồn chính để sản xuất đồng.
✔️B. Sphalerite (ZnS) là khoáng vật chứa kẽm phổ biến nhất và là nguồn chính để sản xuất kẽm.
❌C. Sắt chủ yếu được khai thác từ các quặng như hematite (Fe2O3) và magnetite (Fe3O4), không liên quan đến sphalerite.
❌D. Nhôm được sản xuất từ quặng bauxite, không phải từ sphalerite.
⟹ Chọn đáp án B Đáp án: B
❌A. Mang điện tích dương: Trong kim loại, các nguyên tử kim loại liên kết với nhau bằng liên kết kim loại. Các ion dương (cation) nằm trong "biển electron" tự do, nhưng tổng thể tinh thể kim loại không mang điện tích dương vì số lượng electron vẫn đủ để cân bằng với ion dương.
❌B. Mang điện tích âm: Dù có các electron tự do di chuyển, tinh thể kim loại không bị thừa electron đến mức mang điện tích âm.
✔️C. Trung hòa về điện: Trong trạng thái tự nhiên, tinh thể kim loại có tổng điện tích bằng 0 do số proton trong hạt nhân cân bằng với số electron trong hệ thống.
❌D. Không xác định: Điện tích của tinh thể kim loại đã được xác định rõ ràng là trung hòa về điện, nên đáp án này không chính xác.
⟹ Chọn đáp án C Đáp án: C
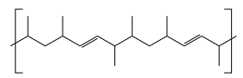
Biết rằng một monomer là propene. Monomer còn lại có công thức cấu tạo là gì?
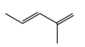
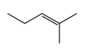
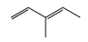
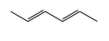
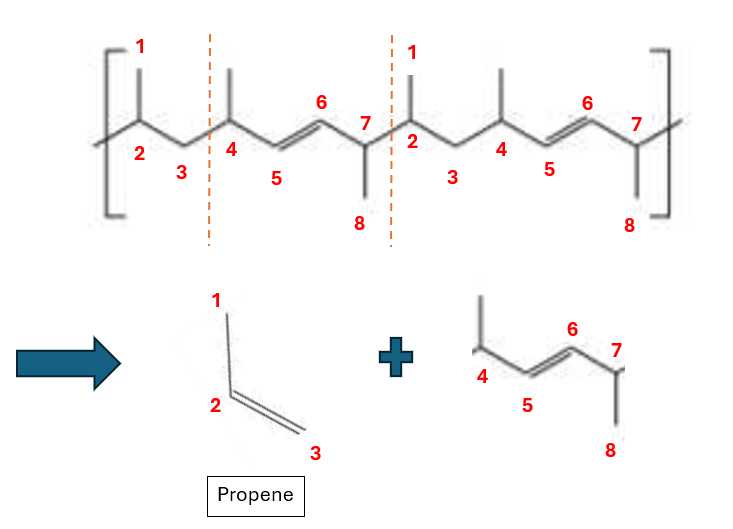
Monomer có dạng propene. Monomer còn lại có dạng
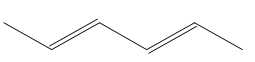
⟹ Chọn đáp án D
Đáp án: DBảng thế điện cực chuẩn của kim loại có thể được sắp xếp thành một dãy như sau (còn được gọi là dãy điện hóa của kim loại):
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu, tính oxi hóa của dạng oxi hóa càng mạnh và ngược lại.
⟹ Chọn đáp án A
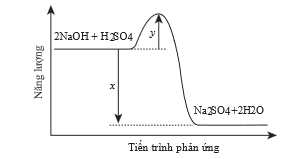
Giá trị biến thiên enthalpy của quá trình trung hòa bên trên là bao nhiêu?
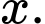
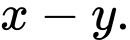
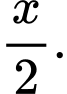
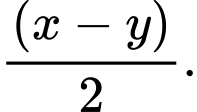
Từ sơ đồ biến thiên enthalpy của quá trình trung hòa trên là x
⇒ Chọn đáp án A Đáp án: A
⭒ Al2O3 bền nhiệt hơn rất nhiều nên có thể tồn tại ở dạng nóng chảy
❌A sai: Nhiệt độ nóng chảy của AlCl3 thấp hơn Al2O3.
❌C sai: Điện phân AlCl3 nóng chảy vẫn tạo ra Cl2, nhưng đây không phải là lý do chính khiến người ta không sử dụng nó để điều chế Al.
❌D sai: Điện phân Al2O3 nóng chảy tạo ra Al có độ tinh khiết cao, nhưng đây không phải là yếu tố quyết định duy nhất. Tính chất thăng hoa của AlCl3 mới là lý do chính.
⟹ Chọn đáp án B Đáp án: B
(a) Kim loại M trong cặp oxi hoá – khử M+/M có thể điện cực chuẩn
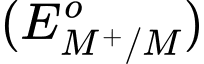 rất âm.
rất âm.(b) Mềm và dễ nóng chảy.
(c) Có nhiều electron hoá trị nên dễ dàng nhường electron.
(d) Lực hút của hạt nhân đối với electron hoá trị trong kim loại kiềm yếu hơn so với lực hút tương ứng ở các kim loại nhóm khác.
(e) Có cấu trúc tinh thể rỗng.
Số đặc điểm chung có thể giúp dự đoán các kim loại kiềm (M) đều có tính khử mạnh?
✔️(a) – Đúng. Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử.
❌(b) – Sai. Mềm và dễ nóng chảy là tính chất vật lí
❌(c) – Sai. Nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hoá trị ở phân lớp ns1 và đứng đầu mỗi chu kì tương ứng. Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử. Vì vậy, trong các phản ứng hoá học, chúng dễ nhường 1 electron, thể hiện tính khử rất mạnh: M ⟶ M+ + 1e
✔️(d) – Đúng. Lực hút của hạt nhân đối với electron hoá trị trong kim loại kiềm yếu hơn so với lực hút tương ứng ở các kim loại nhóm khác.
❌(e) – Sai. Có cấu trúc tinh thể rỗng nói về cấu tạo của kim loại kiềm chỉ ảnh hưởng đến tính chất vật lí của kim loại không ảnh hưởng đến tính khử.
Có 2 phát biểu đúng.
⟹ Chọn đáp án B Đáp án: B
❌ A. (Apatite) → Sai, vì đây là thành phần chính của quặng photphorit, dùng để sản xuất phân lân.
❌ B. (Thạch cao sống) → Sai, vì đây là thành phần chính của thạch cao, không phải dolomite.
✔️ C. (Dolomite) → Đúng, vì đây là công thức chính xác của dolomite, thành phần chính của vôi đen.
❌ D. Sai. vì CaO là vôi sống, được tạo ra từ nung đá vôi, không phải vôi đen.
⟹ Chọn đáp án C Đáp án: C
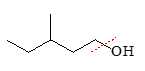
Khi đo phổ khối lượng, một số phân tử bị phá vỡ. Một trong những dạng phân mảnh phổ biến là mất nhóm hydroxyl (-OH, 17 u)
→ Khối lượng còn lại sau khi mất nhóm OH : 102 - 17 = 85u.
Khi mảnh OH- bị tách ra sẽ hình thành mảnh ion CH3CH2CH(CH3)CH2CH2+ có giá trị m/z là 85.
⟹ Chọn đáp án C Đáp án: C

⟹ Chọn đáp án B Đáp án: B
ester < alcohol < carboxylic acid.
Trong nhóm acid thì số carbon tăng, nhiệt độ sôi tăng. Theo đó:
methyl acetate (T) = CH3COOCH3 < propyl alcohol (Z) = CH3CH2CH2OH < acetic acid (Y) = CH3COOH < propionic acid (X) = CH3CH2COOH.
Vậy, thứ tự ký hiệu các chất chiều nhiệt độ sôi tăng: T, Z, Y, X
⇝ Chọn đáp án A Đáp án: A
+) Lysine: H2N[CH2]4CH(NH2)COOH → 2 nhóm NH2, 1 nhóm COOH
+) Glycine: H2NCH2COOH → 1 nhóm NH2, 1 nhóm COOH
+) Glutamic acid: HOOC[CH2]2CH(NH2)COOH → 1 nhóm NH2, 2 nhóm COOH
+) Alanine: CH3CH(NH2)COOH → 1 nhóm NH2, 1 nhóm COOH
⟹ Chọn đáp án C Đáp án: C
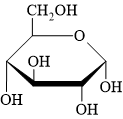
• β = bê (bờ) = bần cùng ⇒ nhóm OH đính vào C1 cùng phía với CH2OH.
• ⇒ α có nhóm OH đính vào C1 khác phía với nhóm CH2OH.
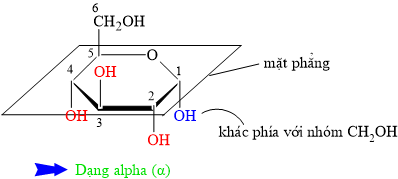
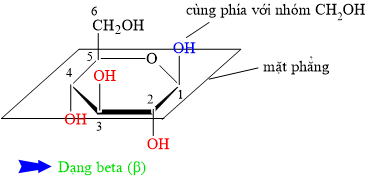
⇒ Quan sát lại cấu tạo chất đã cho ⇒ Phân tử carbohydate đang ở dạng alpha (α) ⇝ Chọn đáp án A. ♥ Đáp án: A
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 14 – 16
[Đề 11 - Cuốn 25 Đề V-ACT] Phản ứng của ethylene với H2O tạo thành ethanol như sau:
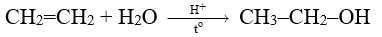
Phản ứng của ethylene với nước được xúc tác bằng acid. Phản ứng xảy ra theo cơ chế sau:
* Giai đoạn 1: Quá trình proton hoá liên kết đôi C=C của ethylene tạo thành carbocation.
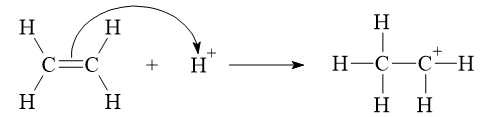
* Giai đoạn 2: Quá trình nước cộng hợp vào carbocation.
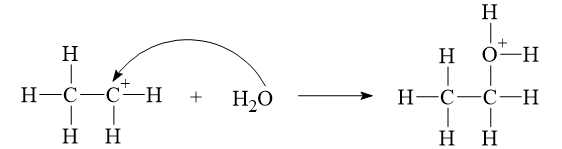
* Giai đoạn 3: Quá trình tách proton để tạo ra alcohol.
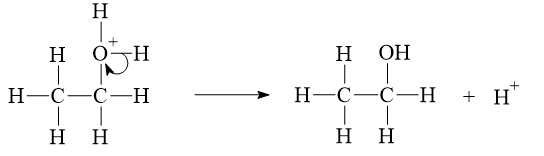
Thầy Minh xin lỗi các em, cuốn sách có sự nhầm lẫn, trùng lặp ID câu hỏi và sẽ được sửa trong lần tái bản sau!
[Đề 42 - Cuốn 50 Đề Minh hoạ 2025] Đối với dẫn xuất halogen bậc một, phản ứng xảy ra theo cơ chế SN2 là chủ yếu: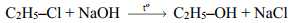
Cơ chế của phản ứng như sau: NaOH ⟶ Na+ + OH–.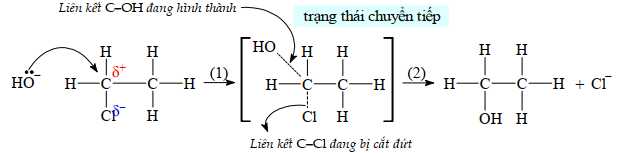
Phát biểu nào sau đây không đúng?
A. Phản ứng dẫn xuất halogen bậc 1 tác dụng NaOH là phản ứng thế.
B. Tác nhân OH– sẽ cộng vào C có mật độ điện tích dương cao nhất.
C. Trạng thái chuyển tiếp có sự tạo thành 5 liên kết σ.
D. Trước và sau phản ứng, hóa trị của nguyên tử C không thay đổi.
[Đề 11 - Cuốn 25 Đề V-ACT] Trong các phát biểu sau:
(a) Trong giai đoạn 1, có sự phá vỡ liên kết π.
(b) Trong giai đoạn 2, số liên kết σ tăng thêm 1.
(c) Trong giai đoạn 3, phân tử ethanol tạo thành có 6 liên kết σ.
(d) Sau phản ứng, một nguyên tử C trong nối đôi nhận một nguyên tử H và nguyên tử C còn lại sẽ nhận một nhóm OH.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
→ ID video chữa câu hỏi: [842459].
Phân tích các đáp án:
✔️Đúng. A. Phản ứng dẫn xuất halogen bậc 1 tác dụng NaOH là phản ứng thế. Phản ứng thế xảy ra theo cơ chế SN2 ở đây Cl đã bị thế bởi lưỡng phân tử OH-.
✔️Đúng. B. Tác nhân OH– sẽ cộng vào C có mật độ điện tích dương cao nhất.
❌Sai. C. Trạng thái chuyển tiếp có sự tạo thành 2 liên kết σ giữa C-O và O-H.
✔️Đúng. D. Trước và sau phản ứng, hóa trị của nguyên tử C không thay đổi. Trong các hợp chất hữu cơ C có 4 liên kết vì C có hóa trị IV ngoài liên kết với các nguyên tử khác C còn có thể tự liên kết với nhau để tạo thành liên kết carbon.
⟹ Chọn đáp án C
[Giải Đề 11 - Cuốn 25 Đề V-ACT]
Phân tích các phát biểu:
(a) Đúng. Trong giai đoạn 1, có sự phá vỡ liên kết π trong liên kết đôi C=C.
Giai đoạn 1: Quá trình proton hóa liên kết đôi C=C của ethylene thành carbocation:
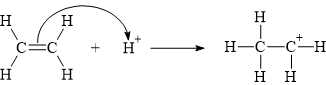
(b) Sai. Trong giai đoạn 2, số liên kết σ tăng thêm 3:
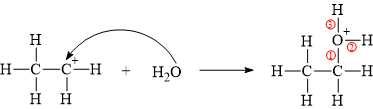
(c) Sai. Phân tử ethanol tạo thành có 8 liên kết σ (của liên kết đơn) bao gồm 5 liên kết C–H, 1 liên kết C–C, 1 liên kết C–O và 1 liên kết C–H.
(d) Đúng. Sau phản ứng, một nguyên tử C trong nối đôi nhận một nguyên tử H và nguyên tử C còn lại nhận một nhóm OH.
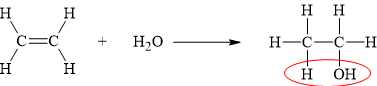
Các phát biểu đúng là (a) (d)
⇒ Chọn đáp án B Đáp án: B
[Đề 42 - Cuốn 50 Đề Minh hoạ 2025] Đối với dẫn xuất halogen bậc ba, phản ứng xảy ra theo cơ chế SN1 là chủ yếu
(CH3)3C–Cl + NaOH ⟶ (CH3)3C–OH + NaCl
Cơ chế của phản ứng như sau: NaOH ⟶ Na+ + OH–.
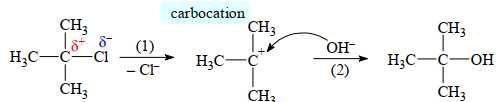
Phát biểu nào sau đây không đúng?
A. Cl có độ âm điện lớn nên sẽ hút cặp electron trên liên kết C–Cl.
B. Giai đoạn 1 xảy ra quá trình mất một liên kết σ.
C. Ion OH– sẽ cộng vào carbon nằm giữa ba nhóm CH3.
D. Trước và sau phản ứng, tổng số liên kết σ trong hợp chất hữu cơ không đổi.
→ ID video chữa câu hỏi: [706015].
[Đề 11 - Cuốn 25 Đề V-ACT] Trong giai đoạn 3, tại sao quá trình tách H+ còn được gọi là tách proton?
A. Vì ion H+ không chứa electron và chỉ có proton.
B. Vì ion H+ không chứa proton và chỉ có electron.
C. Vì hạt nhân nguyên tử O mất proton trong quá trình tách H+.
D. Vì liên kết σ bị cắt đứt sẽ hình thành thêm hạt proton cho ion H+.
→ ID video chữa câu hỏi: [842460].
Phân tích các đáp án:
✔️Đúng. A. Cl có độ âm điện lớn nên sẽ hút electron dùng chung ở trên liên kết C-Cl về phía nó làm cho liên kết C-Cl phân cực giúp C dễ dàng mất đi Cl- để tạo thành carboncation.
✔️Đúng. B. Giai đoạn 1 là quá trình cắt đứt liên kết C-Cl mà liên kết C-Cl là liên kết đơn nó là một liên kết σ. Giai đoạn 1 xảy ra quá trình mất một liên kết σ.
✔️Đúng. C. Ion OH– sẽ cộng vào carbon nằm giữa ba nhóm CH3 chính là carbon mang điện tích dương để tái tạo lại sản phẩm tạo thành (CH3)3C-OH.
❌Sai. D. Bản chất của phản ứng trên là cắt đứt liên kết C-Cl và thế liên kết C-OH. Khi cắt đứt liên kết C-Cl là cắt đứt 1 liên kết σ khi thế liên kết C-OH vào thì có thêm 2 liên kết σ . Vậy trước và sau phản ứng sẽ có nhiều hơn 1 liên kết σ.
⟹ Chọn đáp án D
[Giải Đề 11 - Cuốn 25 Đề V-ACT]
Không giống như những nguyên tố khác trong hạt nhân ngoài proton còn có thêm neutron, hydrogen được cấu tạo chỉ gồm bởi 1 proton va 1 electron, do đó khi nó bị mất electron để chuyển thành ion dưong thì ion đó chính là proton.
⇒ Chọn đáp án A Đáp án: A
[Đề 42 - Cuốn 50 Đề Minh hoạ 2025] Trong các dẫn xuất halogen sau:
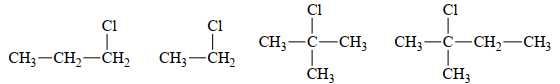
Số dẫn xuất halogen phản ứng với NaOH xảy ra chủ yếu theo cơ chế SN1 là
A. 1.
B. 2.
C. 3.
D. 4.
→ ID video chữa câu hỏi: [706016].
[Đề 11 - Cuốn 25 Đề V-ACT] Khi các alkene có cấu tạo bất đối xứng như propene CH2=CH–CH3 cộng H2O thì phản ứng sẽ tạo thành hai sản phẩm khác nhau:
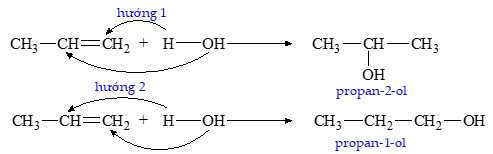
Trong cơ chế của phản ứng, sản phẩm propan-2-ol (hướng 1) được tạo ra do hình thành carbocation nào sau đây?

→ ID video chữa câu hỏi: [842464].
Các dẫn xuất có halogen bậc 1 sẽ xảy ra theo cơ chế SN2.
Các dẫn xuất có halogen bậc 3 sẽ xảy ra theo cơ chế SN1.
Các dẫn xuất có halogen bậc 2 sẽ xảy ra theo cơ chế SN1 hoặc SN2.
- Bậc Halogen là bậc của nguyên tử Carbon liên kết với nguyên tử halogen.
Phân tích các đáp án:
❌Sai. A. Halogen bậc 1⟶ dẫn xuất halogen bậc 1 xảy ra theo cơ chế SN2.
❌Sai. B. Halogen bậc 1⟶ dẫn xuất halogen bậc 1 xảy ra theo cơ chế SN2.
✔️Đúng. C. Halogen bậc 3 ⟶ dẫn xuất halogen bậc 3 xảy ra theo cơ chế SN1.
✔️Đúng. D. Halogen bậc 3 ⟶ dẫn xuất halogen bậc 3 xảy ra theo cơ chế SN1.
Các halogen bậc 3 xảy ra theo cơ chế SN1 sẽ phản ứng với NaOH .
Có 2 phát biểu đúng.
⟹ Chọn đáp án B
[Giải Đề 11 - Cuốn 25 Đề V-ACT]
Liên kết đôi trong propene tấn công H+, tạo ra carbocation.
Theo quy tắc Markovnikov, H+ sẽ ưu tiên cộng vào carbon có nhiều hydrogen hơn (C1), dẫn đến hình thành carbocation bậc cao hơn (bậc 2) ở C2.
Khi H+ tấn công vào C1 của propene, carbocation bậc 2 (CH3C+HCH3) sẽ hình thành tại C2:
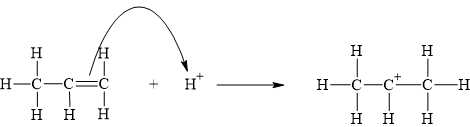
⇒ Chọn đáp án A Đáp án: A
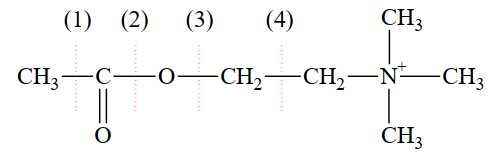
Liên kết nào sẽ bị cắt đứt khi thủy phân cation acetylcholine?
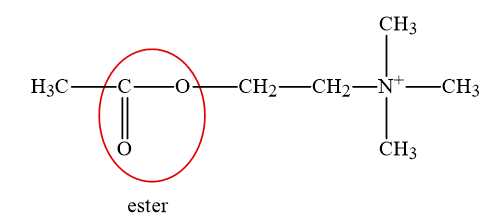
⟹ Chọn đáp án B Đáp án: B
✔️A – Đúng. Tạo điều kiện cho nước trong ao, hồ được lưu thông giúp làm loãng nồng độ chất dinh dưỡng và tăng cường lượng oxygen hòa tan, góp phần hạn chế phú dưỡng.
✔️B – Đúng. Sử dụng phân bón hóa học hợp lý là một giải pháp quan trọng để hạn chế nguồn cung cấp chất dinh dưỡng cho ao, hồ. Việc sử dụng phân bón quá mức là một trong những nguyên nhân chính gây ra phú dưỡng.
❌C – Sai. Sử dụng chlorine để diệt vi khuẩn gây phân hủy tảo là một giải pháp có thể làm giảm số lượng tảo trong ngắn hạn. Tuy nhiên, chlorine cũng có thể gây hại cho các sinh vật khác trong ao, hồ và không giải quyết được nguyên nhân gốc rễ của hiện tượng phú dưỡng.
✔️D – Đúng. Xử lý nước thải sinh hoạt trước khi cho chảy vào ao, hồ là biện pháp cần thiết để loại bỏ chất dinh dưỡng và các chất ô nhiễm khác trong nước thải, ngăn chặn chúng gây phú dưỡng.
⟹ Chọn đáp án C Đáp án: C
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
• Bước 1: Cho vào hai khác nhau ống nghiệm khoảng 1 mL dung dịch I2 trong KI và khoảng 1 mL dung dịch NaOH 10%.
• Bước 2: Nhỏ từ từ 5-7 giọt acetaldehyde vào một ống nghiệm, ghi nhãn (1) và 5-7 giọt acetone vào ống nghiệm còn lại, ghi nhãn (2). Lắc đều.
✔️(a) – Đúng. KI + I2 → KI3 phản ứng này giúp chuyển iodine (I2, ít tan trong nước) thành ion triodine (I3-, tan tốt trong nước) phân tán dễ dàng vào dung dịch. Dung dịch này có tính sát khuẩn.
❌(b) – Sai. Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm (phản ứng iodoform).
❌(c) – Sai. Cả 2 ống nghiệm đều xuất hiện kết tủa vàng, 2 chất đều có phản ứng iodoform tạo kết tủa màu vàng.
CH3CHO + 3I2 + 4NaOH → CHI3 + HCOONa + 3NaI + 3H2O
CH3COCH3 + 3I2 + 4NaOH → CH3COONa + CHI3 + 3H2O + NaI
✔️(d) – Đúng. Các hợp chất aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl có thể phản ứng với I2 trong môi trường kiềm (phản ứng iodoform) hiện tượng xuất hiện kết tủa vàng.
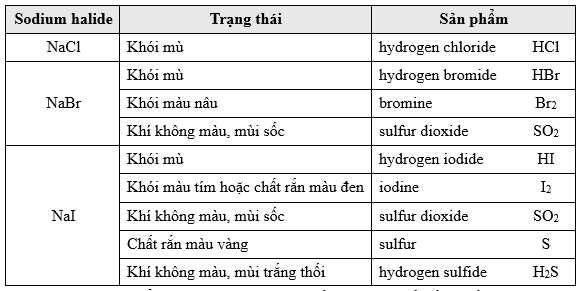
Tuy nhiên, các sản phẩm không có màu thường rất khó nhận biết bằng mắt thường. Ngược lại, các sản phẩm có màu thì sẽ nổi trội hơn. Thí nghiệm và màu sắc quan sát được khi cho sulfuric acid đậm đặc vào ba loại sodium halide như sau:
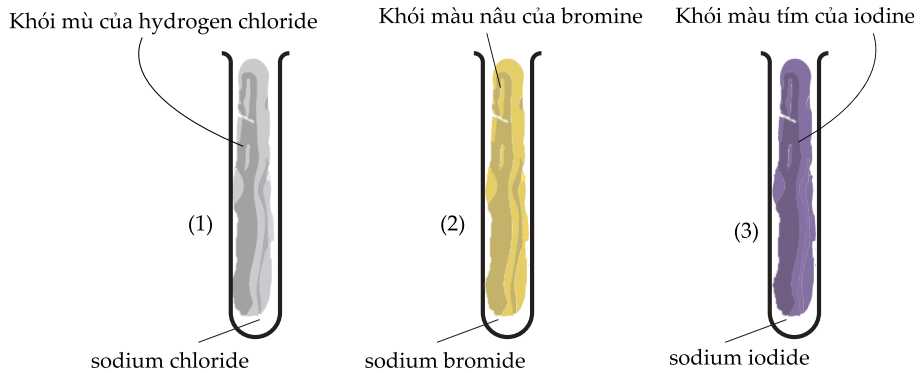
❌(a) – Sai. Phản ứng trong ống nghiệm (1) thuộc loại phản ứng trao đổi, sản phẩm sau phản ứng không có sự thay đổi số oxi hóa.
NaCl + H2SO4 → NaHSO4 + HCl
✔️(b) – Đúng. Từ kết quả trong ống nghiệm (1) và (2) có thể kết luận tính khử của ion CI yếu hơn ion Br-H2SO4 đặc là chất có tính oxi hóa mạnh, phản ứng với NaBr thu được Br2, SO2 và một phần HBr, số oxi hóa của Br thay đổi từ -1 thành 0 nên có Br- có tính khử mạnh Cl-
- Phản ứng trong ống nghiệm (1) thuộc loại phản ứng trao đổi, sản phẩm sau phản ứng không có sự thay đổi số oxi hóa
2NaBr + 2H2SO4 → Br2 + SO2 + 2H2O + Na2SO4
✔️(c) – Đúng. Khí H2S không màu trong sản phẩm ở ống nghiệm (3) có thể được nhận ra bằng dung dịch Pb(NO3)2 sau phản ứng thấy xuất hiện kết tủa đen.
Pb(NO3)2 + H2S → PbS + 2HNO3
✔️(d) – Đúng. Dựa vào hiện tượng trong 3 ống nghiệm có thể phân biệt được 3 muối sodium halide.
Ống nghiệm chứa NaCl xuất hiện khói mù
Ống nghiệm chứa NaBr xuất hiện khói màu nâu
Ống nghiệm chứa NaI xuất hiện khói màu tím, chất rắn màu đen và vàng.
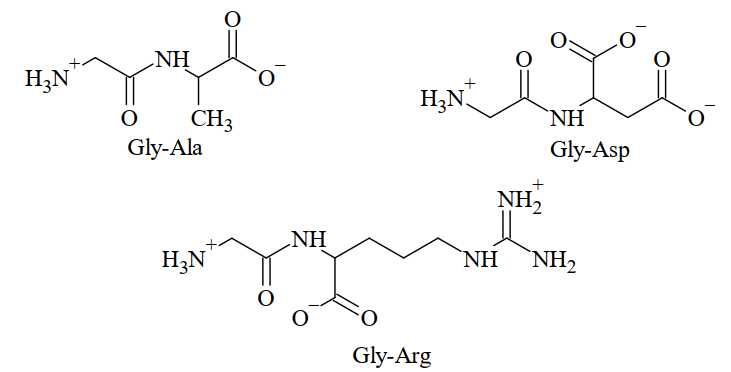
✔️(a) – Đúng. Với pH = 6, peptide gần vị trí của ban đầu là peptide Gly-Ala, peptide gly-ala có tổng điện tích là 0 nên hầu như không di chuyển trong điện trường.
❌(b) – Sai. Peptide Gly-Arg có tổng điện tích bằng +1 tại pH = 6.
✔️(c) – Đúng. Với pH = 6, peptide Gly-Asp có tổng điện tích là -1 di chuyển về phía cực cực dương.
❌(d) – Sai. Peptide Gly-Arg sẽ di chuyển về cực âm chậm hơn so với amino acid Arg nguyên do là Gly-Arg có kích thước lớn hơn nên sẽ di chuyển chậm hơn.
• Bước 1: Dùng pipette lấy 5,0 mL dung dịch FeSO4 cho vào bình tam giác; thêm tiếp khoảng 5 mL dung dịch H2SO4 10% (lấy bằng ống đong).
• Bước 2: Cho dung dịch KMnO4 vào burette, điều chỉnh thể tích dung dịch trong burette về mức 0. Mở khoá burette, nhỏ từng giọt dung dịch KMnO4 xuống bình tam giác, lắc đều.
✔️(a) – Đúng. Phương pháp được sử dụng trong thí nghiệm trên là phương pháp chuẩn độ. Chuẩn độ là một phương pháp định lượng phổ biến trong hóa học phân tích dùng để xác định nồng độ của một chất phân tích đã biết tên nhưng chưa biết nồng độ.
✔️(b) – Đúng. Sau điểm tương đương của phản ứng chuẩn độ chỉ cần 1 giọt dung dịch KMnO4 dư cũng đủ làm cho dung dịch chuyển từ không màu sang màu hồng
❌(c) – Sai. Không thể sử dụng HCl vì HCl phản ứng với KMnO4 tạo ra Cl2 ảnh hưởng đến kết quả chuẩn độ.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
❌(d) – Sai. Nếu được kiềm hóa thì 1 mol FeSO4 cần 1 mol KMnO4
2KMnO4 + 6NaOH + 2FeSO4 → 2Fe(OH)3 + 2Na2SO4 + Na2MnO4 + K2MnO4
Nếu được acid hóa thì 5 mol FeSO4 mới cần 1 mol KMnO4
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Nên khi kiềm hóa sẽ sử dụng nhiều KMnO4 hơn.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
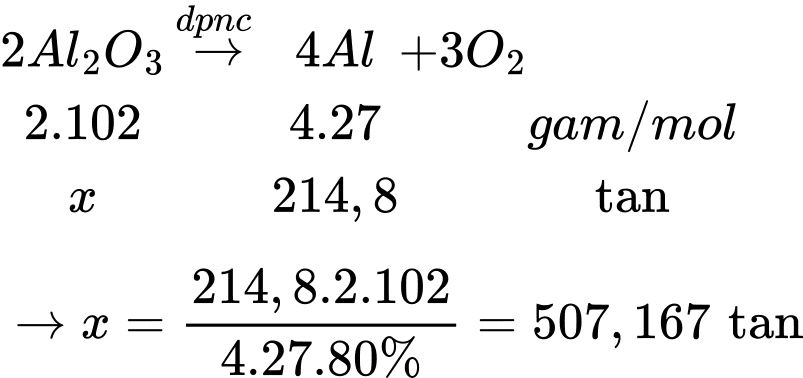
Khối lượng quặng bauxite là mquặng = 507,167 : 45% ≈ 1127
⟹Điền đáp án : 1127
(1) CH3COOH + CH3CH(CH3)CH2CH2OH ⇄ CH3COOCH2CH2CH(CH3)CH3 +H2O
(2) CH3CH2CH2CH2COOH + C2H5OH ⇄ CH3CH2CH2CH2COOC2H5 + H2O
(3) CH3COOH + CH3C(CH3)=CH[CH2]2CH=C(CH3)CH2OH ⇄ CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 + H2O
(4) CH3COOH + C6H5CH2OH ⇄ CH3COOCH2C6H5 + H2O
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các ester sau: mùi chuối chín; mùi dứa; mùi hoa nhài; mùi hoa hồng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Phản ứng (2) điều chế CH3CH2CH2COOC2H5 – ethyl butirate mùi dứa
Phản ứng (3) điều chế CH3COOCH2C(CH3)=CH[CH2]2CH=C(CH3)CH3 – geranyl acetate mùi hoa hồng
Phản ứng (4) điều chế CH3COOCH2C6H5 – benzyl acetate mùi hoa nhài
Thứ tự đúng 1243
⟹Điền đáp án : 1243
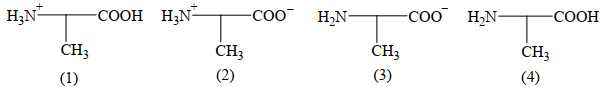
Khi pH = 12 thì alanine sẽ tồn tại chủ yếu ở dạng số mấy?
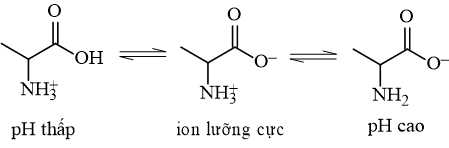
Tại pH = 12, alanin tồn tại chủ yếu dạng CH3CH(NH2)COO-.
Điền đáp án: 3
Thể tích ethylene có trong phòng ủ là VC2H4 = 150000.120.10-6 = 18 L
Khối lượng ethylene có trong phòng ủ là
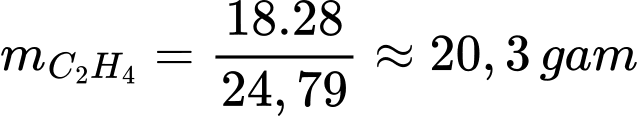
⟹Điền đáp án : 20,3
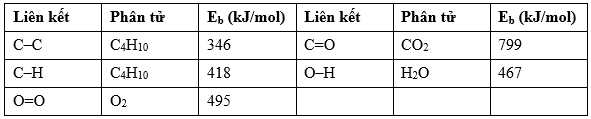
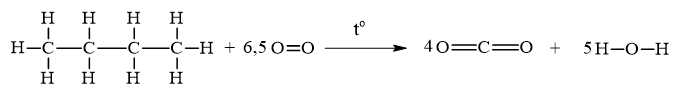
C4H10(g) + O2(g)
 4CO2(g) + 5H2O(g)
4CO2(g) + 5H2O(g)Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
Giả thiết mỗi ấm nước chứa 2 L nước ở 25 oC, nhiệt dung của nước là 4,2 J.g–1.K–1), có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường). Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước (làm tròn đến hàng đơn vị)?
Biến thiên enthalpy của phản ứng là
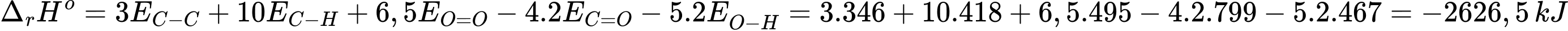
Đổi 12 kg = 12000 gam; 2 L = 2000 gam
Số mol của butane là nC4H10 = 12000:58 = 206,8966 mol
Nhiệt lượng cần đun sôi 1 ấm nước chứa 2 L nước là
Q = 2000.4,2.(100-25) = 630000 J = 630 kJ
Số ấm nước tối đa mà bình gas có thể đun sôi là
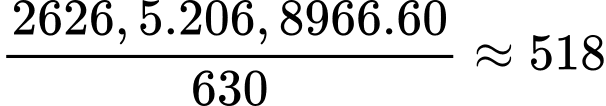
⟹Điền đáp án : 518
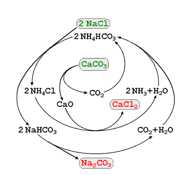
- Giai đoạn 1: Hòa tan bão hòa NaCl trong dung dịch NH3 đặc.
- Giai đoạn 2: Nung CaCO3 ở 950°C - 1100°C rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3 đặc ở trên, thu được NaHCO3 và NH4Cl. Các khí CO2, NH3 dư bay lên được tuần hoàn trở lại.
- Giai đoạn 3: Tách NaHCO3 khỏi dung dịch nhờ tính tan. Nung NaHCO3 ở nhiệt độ 450°C - 500°C thu được Na2CO3.
Cho biết hiệu suất của toàn bộ quá trình là 85%. Từ nguyên liệu ban đầu là 50 kg NaCl thu được tối đa bao nhiêu kg Na2CO3 (làm tròn đến hàng phần mười)?
Giai đoạn 2: Nung CaCO3 ở 950 - 1100 oC rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3, thực tế trong công nghiệp người ta sử dụng các phản ứng này[1]:
CaCO3 → CaO + CO2
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Giai đoạn 3: Tách NaHCO3 khỏi dung dịch nhờ tính tan. Nung NaHCO3 ở nhiệt độ 450 - 500 oC thu được soda:
2NaHCO3 → Na2CO3 + CO2 + H2O
Đổi 50 kg = 50000 gam
Số mol của NaCl là nNaCl = 50000 : 58,5 = 854,7 mol
Từ PTHH số mol của Na2CO3 là 427,35 mol
Khối lượng Na2CO3 thu được thực tế là
mNa2CO3 = 427,35 × 106 × 85% = 38504,235 gam ≈ 38,5 kg
⟹Điền đáp án : 38,5