PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706039]: Các khoáng vật tạo bởi hợp chất của vàng rất hiếm trong tự nhiên. Đó là do
A, vàng là nguyên tố hiếm.
B, vàng có độ hoạt động hoá học yếu và giá trị thế điện cực dương.
C, vàng dễ bị oxi hoá bởi các chất trong môi trường.
D, vàng có độ hoạt động hoá học mạnh và giá trị thế điện cực dương.
Phân tích các đáp án :
❌A. Sai, vì vàng không phải là nguyên tố quá hiếm, mà do nó tồn tại chủ yếu ở dạng tự do, không kết hợp thành hợp chất.
✔️B. Đúng, vì vàng có tính trơ, khó phản ứng với các chất khác và có thế điện cực rất dương, khiến nó ít bị oxy hóa.
❌C. Sai, vì vàng rất khó bị oxy hóa, do đó nó thường tồn tại ở dạng tự do.
❌D. Sai, vì vàng có độ hoạt động hóa học yếu, không phải mạnh.
⟹ Chọn đáp án B Đáp án: B
❌A. Sai, vì vàng không phải là nguyên tố quá hiếm, mà do nó tồn tại chủ yếu ở dạng tự do, không kết hợp thành hợp chất.
✔️B. Đúng, vì vàng có tính trơ, khó phản ứng với các chất khác và có thế điện cực rất dương, khiến nó ít bị oxy hóa.
❌C. Sai, vì vàng rất khó bị oxy hóa, do đó nó thường tồn tại ở dạng tự do.
❌D. Sai, vì vàng có độ hoạt động hóa học yếu, không phải mạnh.
⟹ Chọn đáp án B Đáp án: B
Câu 2 [706040]: Phát biểu nào sau đây là không đúng?
A, Ở điều kiện thường, tất cả các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể.
B, Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
C, Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử.
D, Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
Phân tích các đáp án :
❌A – Sai. Ở điều kiện thường, hầu như các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể ngoại trừ Hg ở trạng thái lỏng ở dk thường.
✔️B – Đúng. Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
✔️(c) – Đúng. Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử, vì ở lớp ngoài cùng cách xa hạt nhân nhất nên ít chịu ảnh hưởng bởi hạt nhân.
✔️(d) – Đúng. Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
⟹ Chọn đáp án A Đáp án: A
❌A – Sai. Ở điều kiện thường, hầu như các kim loại đều tồn tại ở thể rắn và có cấu tạo tinh thể ngoại trừ Hg ở trạng thái lỏng ở dk thường.
✔️B – Đúng. Các cation kim loại và nguyên tử kim loại được sắp xếp trật tự trong tinh thể kim loại.
✔️(c) – Đúng. Electron hoá trị của nguyên tử kim loại chịu lực hút yếu của hạt nhân nguyên tử, vì ở lớp ngoài cùng cách xa hạt nhân nhất nên ít chịu ảnh hưởng bởi hạt nhân.
✔️(d) – Đúng. Giống như liên kết ion, liên kết kim loại cũng được hình thành từ tương tác tĩnh điện.
So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
⟹ Chọn đáp án A Đáp án: A
Câu 3 [706041]: Trong quá trình Solvay, ở giai đoạn tạo thành NaHCO3 tồn tại cân bằng sau:
NaCl(aq) + NH3(aq) + CO2(g) + H2O(l) ⇄ NaHCO3(s) + NH4Cl(aq)
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
NaCl(aq) + NH3(aq) + CO2(g) + H2O(l) ⇄ NaHCO3(s) + NH4Cl(aq)
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
A, NaHCO3.
B, NH4Cl.
C, NaCl.
D, NH4HCO3.
Giai đoạn 1: Hòa tan bão hòa NaCl trong dung dịch NH3 đặc.
Giai đoạn 2: Nung CaCO3 ở 950 - 1100 oC rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3, thực tế trong công nghiệp người ta sử dụng các phản ứng này:
CaCO3 → CaO + CO2
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Giai đoạn 3: Tách NaHCO3 khỏi dung dịch nhờ tính tan.
⟹ Chọn đáp án A Đáp án: A
Giai đoạn 2: Nung CaCO3 ở 950 - 1100 oC rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3, thực tế trong công nghiệp người ta sử dụng các phản ứng này:
CaCO3 → CaO + CO2
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Giai đoạn 3: Tách NaHCO3 khỏi dung dịch nhờ tính tan.
⟹ Chọn đáp án A Đáp án: A
Câu 4 [706042]: Ion kim loại nào sau đây không bị khử bởi Zn?
A, Cu2+.
B, Ag+.
C, Al3+.
D, Hg2+.
Kim loại hoạt động mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của nó.
Bảng thế điện cực chuẩn của kim loại có thể được sắp xếp thành một dãy như sau (còn được gọi là dãy điện hóa của kim loại):

→ Zn không thể phản ứng với Al3+.
⟹ Chọn đáp án C Đáp án: C
Bảng thế điện cực chuẩn của kim loại có thể được sắp xếp thành một dãy như sau (còn được gọi là dãy điện hóa của kim loại):

→ Zn không thể phản ứng với Al3+.
⟹ Chọn đáp án C Đáp án: C
Câu 5 [706043]: Cho những lĩnh vực sau:
(a) xây dựng, công nghiệp ô tô, luyện kim.
(b) sản xuất pháo hoa.
(c) sản xuất phân bón.
(d) chế biến thực phẩm.
(e) pin, đồng hồ nguyên tử.
Số lĩnh vực mà kim loại nhóm IA và các hợp chất của chúng được ứng dụng nhiều là
(a) xây dựng, công nghiệp ô tô, luyện kim.
(b) sản xuất pháo hoa.
(c) sản xuất phân bón.
(d) chế biến thực phẩm.
(e) pin, đồng hồ nguyên tử.
Số lĩnh vực mà kim loại nhóm IA và các hợp chất của chúng được ứng dụng nhiều là
A, 1.
B, 2.
C, 3.
D, 4.
Phân tích các phát biểu :
❌(a) Xây dựng, công nghiệp ô tô, luyện kim → Không phổ biến. Kim loại kiềm có độ bền cơ học thấp, dễ bị oxy hóa nên ít dùng trong xây dựng, ô tô hay luyện kim.
✔️(b) Sản xuất pháo hoa → Có sử dụng. Các hợp chất như KNO3, NaNO3, Li2CO3 được dùng để tạo màu sắc trong pháo hoa (đỏ - Li, vàng - Na, tím - K).
✔️(c) Sản xuất phân bón → Có sử dụng nhiều. KCl, K2SO4, KNO3 là các loại phân bón phổ biến cung cấp K cho cây trồng.
✔️(d) Chế biến thực phẩm → Có sử dụng. NaCl, NaHCO3, Na2CO3, KCl được dùng nhiều trong bảo quản thực phẩm, làm muối ăn, chất tạo xốp trong bánh kẹo.
✔️(e) Pin, đồng hồ nguyên tử → Có sử dụng. Li là loại pin phổ biến trong điện thoại, laptop. Cs được dùng trong đồng hồ nguyên tử có độ chính xác cao.
Có 4 lĩnh vực ứng dụng kim loại kiềm và hợp chất của chúng: (b), (c), (d), (e).
⟹ Chọn đáp án D Đáp án: D
❌(a) Xây dựng, công nghiệp ô tô, luyện kim → Không phổ biến. Kim loại kiềm có độ bền cơ học thấp, dễ bị oxy hóa nên ít dùng trong xây dựng, ô tô hay luyện kim.
✔️(b) Sản xuất pháo hoa → Có sử dụng. Các hợp chất như KNO3, NaNO3, Li2CO3 được dùng để tạo màu sắc trong pháo hoa (đỏ - Li, vàng - Na, tím - K).
✔️(c) Sản xuất phân bón → Có sử dụng nhiều. KCl, K2SO4, KNO3 là các loại phân bón phổ biến cung cấp K cho cây trồng.
✔️(d) Chế biến thực phẩm → Có sử dụng. NaCl, NaHCO3, Na2CO3, KCl được dùng nhiều trong bảo quản thực phẩm, làm muối ăn, chất tạo xốp trong bánh kẹo.
✔️(e) Pin, đồng hồ nguyên tử → Có sử dụng. Li là loại pin phổ biến trong điện thoại, laptop. Cs được dùng trong đồng hồ nguyên tử có độ chính xác cao.
Có 4 lĩnh vực ứng dụng kim loại kiềm và hợp chất của chúng: (b), (c), (d), (e).
⟹ Chọn đáp án D Đáp án: D
Câu 6 [239359]: Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là:
A, HCl, NaOH, Na2CO3.
B, NaOH, Na3PO4, Na2CO3.
C, KCl, Ca(OH)2, Na2CO3.
D, HCl, Ca(OH)2, Na2CO3.
Ta dùng dãy các chất NaOH, Na3PO4; Na2CO3 có thể làm mất tính cứng tạm thời của nước
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + H2O
3Mg(HCO2)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
⟹ Chọn đáp án B
Đáp án: B
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + H2O
3Mg(HCO2)2 + 2Na3PO4 → Mg3(PO4)2↓ + 6NaHCO3
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
⟹ Chọn đáp án B
Đáp án: B
Câu 7 [706044]: Chất hữu cơ G được dùng phổ biến trong lĩnh vực mĩ phẩm và phụ gia thực phẩm. Khi thuỷ phân hoàn toàn bất kì chất béo nào đều thu được G. Xác định chất G?
A, Ethanol.
B, Ethylene glycol.
C, Glycerol.
D, Methanol.
Phản ứng thủy phân trong môi trường acid:
(C15H31COO)3C3H5 + 3H2O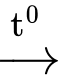 3C15H31COOH + C3H5(OH)3
3C15H31COOH + C3H5(OH)3
Phản ứng xà phòng hoá:
(C17H35COO)3C3H5 + 3NaOH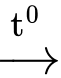 3C17H35COONa + C3H5(OH)3
3C17H35COONa + C3H5(OH)3
Phản ứng thủy phân chất béo luôn thu được glycerol
Glycerol là một thành phần dược chất thường xuất hiện trong các sản phẩm chăm sóc sức khỏe, mỹ phẩm hay thậm chí trong chế phẩm thực phẩm.
⟹ Chọn đáp án C Đáp án: C
(C15H31COO)3C3H5 + 3H2O
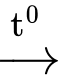 3C15H31COOH + C3H5(OH)3
3C15H31COOH + C3H5(OH)3Phản ứng xà phòng hoá:
(C17H35COO)3C3H5 + 3NaOH
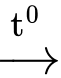 3C17H35COONa + C3H5(OH)3
3C17H35COONa + C3H5(OH)3Phản ứng thủy phân chất béo luôn thu được glycerol
Glycerol là một thành phần dược chất thường xuất hiện trong các sản phẩm chăm sóc sức khỏe, mỹ phẩm hay thậm chí trong chế phẩm thực phẩm.
⟹ Chọn đáp án C Đáp án: C
Câu 8 [706045]: Biểu đồ dưới đây cho thấy mức tiêu thụ năng lượng của Hoa Kỳ theo từng nguồn từ năm 1990 đến năm 2050 (dựa trên dự đoán). Mức tiêu thụ được đo bằng nghìn tỷ BTU (Quadrillion British thermal units) hoặc quad (1 quad = 1,055 × 1018 J).

Hiện tượng nóng lên toàn cầu là sự gia tăng nhiệt độ trung bình toàn cầu do nồng độ của một số loại khí nhất định, được gọi là khí nhà kính, trong đó có CO2 được sinh ra chủ yếu trong quá trình tiêu thụ dầu mỏ, than đá và khí thiên nhiên.
C(s) + O2(g) CO2(g)
CO2(g)
2CO(g) + O2(g) 2CO2(g)
2CO2(g)
CxHy(g/l) + O2(g) CO2(g) + H2O(l)
CO2(g) + H2O(l)
Các đại dương trên Trái đất, có nhiệt dung riêng cao, hấp thụ nhiệt và do đó có tác dụng làm chậm quá trình nóng lên toàn cầu. Giả sử thể tích nước trong các đại dương trên Trái đất là 137×107 km3; khối lượng riêng của nước bằng nước biển là 1,03 g/cm3 và nhiệt dung riêng của nước là 4184 J/kg.K.(a) Ba nguồn năng lượng được sử dụng nhiều nhất của Hoa Kỳ trong năm 1990 là dầu mỏ, than đá và khí thiên nhiên.
(b) Hai nguồn năng lượng thủy điện và hạt nhân giảm từ năm 1990 đến năm 2050 tính theo phần trăm tổng mức sử dụng năng lượng.
(c) Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 oC là 5,73×1024 J.
(d) Nếu tổng năng lượng do dầu mỏ, than đá và khí thiên nhiên trong năm 2020 là 75 quad thì lượng nhiệt tỏa ra chưa đủ để làm ấm các đại dương trên Trái đất thêm 1,0 oC.
Các phát biểu đúng là

Hiện tượng nóng lên toàn cầu là sự gia tăng nhiệt độ trung bình toàn cầu do nồng độ của một số loại khí nhất định, được gọi là khí nhà kính, trong đó có CO2 được sinh ra chủ yếu trong quá trình tiêu thụ dầu mỏ, than đá và khí thiên nhiên.
C(s) + O2(g)
 CO2(g)
CO2(g)2CO(g) + O2(g)
 2CO2(g)
2CO2(g)CxHy(g/l) + O2(g)
 CO2(g) + H2O(l)
CO2(g) + H2O(l)Các đại dương trên Trái đất, có nhiệt dung riêng cao, hấp thụ nhiệt và do đó có tác dụng làm chậm quá trình nóng lên toàn cầu. Giả sử thể tích nước trong các đại dương trên Trái đất là 137×107 km3; khối lượng riêng của nước bằng nước biển là 1,03 g/cm3 và nhiệt dung riêng của nước là 4184 J/kg.K.(a) Ba nguồn năng lượng được sử dụng nhiều nhất của Hoa Kỳ trong năm 1990 là dầu mỏ, than đá và khí thiên nhiên.
(b) Hai nguồn năng lượng thủy điện và hạt nhân giảm từ năm 1990 đến năm 2050 tính theo phần trăm tổng mức sử dụng năng lượng.
(c) Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 oC là 5,73×1024 J.
(d) Nếu tổng năng lượng do dầu mỏ, than đá và khí thiên nhiên trong năm 2020 là 75 quad thì lượng nhiệt tỏa ra chưa đủ để làm ấm các đại dương trên Trái đất thêm 1,0 oC.
Các phát biểu đúng là
A, (a), (b).
B, (a), (d).
C, (a), (c), (d).
D, (b), (c), (d).
Phân tích các phát biểu :
✔️(a) – Đúng. Từ đồ thị ba nguồn năng lượng được sử dụng nhiều nhất của Hoa Kỳ trong năm 1990 là dầu mỏ, than đá và khí thiên nhiên.
❌(b) – Sai. Hai nguồn năng lượng than và hạt nhân giảm từ năm 1990 đến năm 2050 tính theo phần trăm tổng mức sử dụng năng lượng.
✔️(c) – Đúng.
Đổi 137.107 km3 = 1,37.1024 cm3
Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 °C là 1,37.1024.1,03.4,184 ≈ 5,9.1024 J
✔️(d) – Đúng.
Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 °C là 1,37.1024.1,03.4,184 ≈ 5,9.1024 J
Tổng năng lượng từ 75 quad là 75.1,055.1018 = 7,9125.1019 J < 5,9.1024 J
⟹ Tổng năng lượng do dầu mỏ, than đá và khí thiên nhiên trong năm 2020 là 75 quad thì lượng nhiệt tỏa ra chưa đủ để làm ấm các đại dương trên Trái đất thêm 1,0 °C.
Các phát biểu đúng là (a), (c), (d).
⟹ Chọn đáp án C Đáp án: C
✔️(a) – Đúng. Từ đồ thị ba nguồn năng lượng được sử dụng nhiều nhất của Hoa Kỳ trong năm 1990 là dầu mỏ, than đá và khí thiên nhiên.
❌(b) – Sai. Hai nguồn năng lượng than và hạt nhân giảm từ năm 1990 đến năm 2050 tính theo phần trăm tổng mức sử dụng năng lượng.
✔️(c) – Đúng.
Đổi 137.107 km3 = 1,37.1024 cm3
Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 °C là 1,37.1024.1,03.4,184 ≈ 5,9.1024 J
✔️(d) – Đúng.
Nhiệt lượng cần dùng để làm ấm các đại dương trên Trái đất thêm 1,0 °C là 1,37.1024.1,03.4,184 ≈ 5,9.1024 J
Tổng năng lượng từ 75 quad là 75.1,055.1018 = 7,9125.1019 J < 5,9.1024 J
⟹ Tổng năng lượng do dầu mỏ, than đá và khí thiên nhiên trong năm 2020 là 75 quad thì lượng nhiệt tỏa ra chưa đủ để làm ấm các đại dương trên Trái đất thêm 1,0 °C.
Các phát biểu đúng là (a), (c), (d).
⟹ Chọn đáp án C Đáp án: C
Câu 9 [561014]: Cấu hình electron biểu diễn theo ô orbital của lớp sát ngoài cùng và ngoài cùng của ion Fe2+ (Z = 26) là
A, 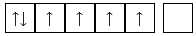

B, 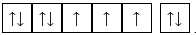

C, 

D, 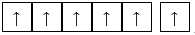

Ion Fe2+ không còn electron trên phân lớp 4s => obital trống, 6 electron ở lớp 3d phân bố đều vào các obital phân lớp 3d.
⟹ Chọn đáp án A
Câu 10 [706046]: Hình dưới đây cho thấy phổ khối của một hợp chất ketone X có 5C.
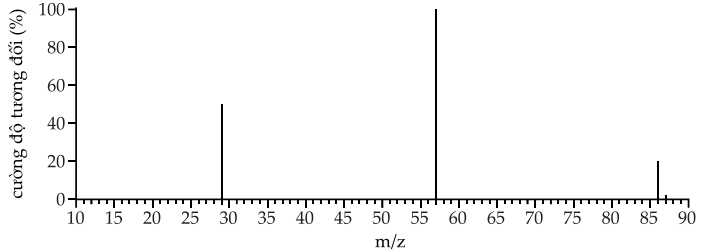
Biết rằng X có cấu tạo mạch nhánh. X có thể là

Biết rằng X có cấu tạo mạch nhánh. X có thể là
A, 3-methylbut-2-one.
B, 1-methylpent-2-one.
C, pent-3-one.
D, 2-methylbut-3-one.
Từ phổ khối lượng phân tử khối của hchc cần tìm là 86 amu
Biết phân tử X có cấu tạo mạch phân nhánh
Công thức cấu tạo phù hợp của X là
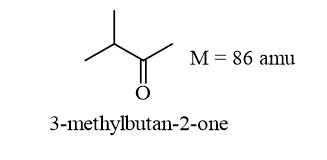
⟹ Chọn đáp án A Đáp án: A
Biết phân tử X có cấu tạo mạch phân nhánh
Công thức cấu tạo phù hợp của X là

⟹ Chọn đáp án A Đáp án: A
Câu 11 [304785]: Chất nào sau đây có nhiệt độ sôi thấp nhất?
A, C3H7OH.
B, CH3COOH.
C, C4H10.
D, HCOOCH3.
Các chất so sánh có phân tử khối tương đương:
C3H7OH (M = 60); CH3COOH (M = 60); C4H10 (M = 58) và HCOOCH3 (M = 60).
⇒ Thứ tự tổng quát: hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ C4H10 < HCOOCH3 < C3H7OH < CH3COOH.
⇒ Chất có nhiệt độ sôi nhỏ nhất trong dãy là C4H10
⟹Chọn đáp án C. Đáp án: C
C3H7OH (M = 60); CH3COOH (M = 60); C4H10 (M = 58) và HCOOCH3 (M = 60).
⇒ Thứ tự tổng quát: hydrocarbon < ether < aldehyde, ketone, ester < alcohol < carboxylic acid.
⇒ C4H10 < HCOOCH3 < C3H7OH < CH3COOH.
⇒ Chất có nhiệt độ sôi nhỏ nhất trong dãy là C4H10
⟹Chọn đáp án C. Đáp án: C
Câu 12 [308296]: Mắt xích nào tồn tại trong cấu trúc carbohydrate sau đây?
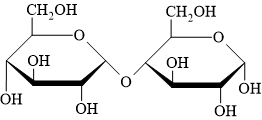

A, α-Glucose.
B, β-Fructose.
C, α-Glucose và β-fructose.
D, β-Glucose và α-fructose.
Quan sát + phân tích cấu tạo:
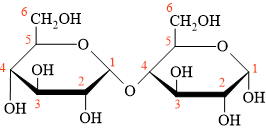
• 1. Hai mắt xích đều giống nhau.
• 2. nhóm OH ở carbon số 1 nằm phía dưới mặt phẳng, khác phía so với nhóm CH2OH ⇒ dạng alpha (α).
⇒ Hai mắt xích đều là dạng α-glucose.
⟹ Chọn đáp án A.
Đáp án: A
Câu 13 [308693]: Ở điều kiện thường, chất hữu cơ nào sau đây là chất rắn, tan tốt trong nước?
A, Triolein.
B, Aniline.
C, Methylamine.
D, Alanine.
+ Alanine thuộc loại amino acid, ở điều kiện thường nó là chất rắn, tan cực tốt trong nước.
+ Methylamine tan tốt trong nước nhưng ở điều kiện thường methylamine là chất khí.
+ Triolein là chất béo, không tan trong nước.
+ Aniline là amine thơm, ít tan trong nước.
⟹ Chọn đáp án D Đáp án: D
+ Methylamine tan tốt trong nước nhưng ở điều kiện thường methylamine là chất khí.
+ Triolein là chất béo, không tan trong nước.
+ Aniline là amine thơm, ít tan trong nước.
⟹ Chọn đáp án D Đáp án: D
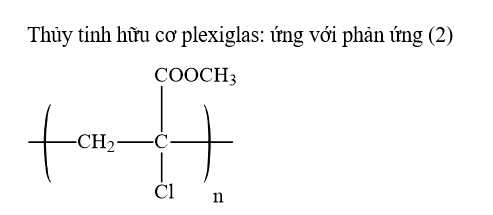
Câu 14 [309516]: Thủy tinh hữu cơ (hay thủy tinh plexiglas) là một vật liệu quan trong, được sử dụng làm kính lúp, thấu kính, kính chống đạn,… Thủy tinh hữu cơ được tổng hợp từ phản ứng trùng hợp monomer nào sau đây?
A, CH2=CHCOOCH3.
B, CH2=C(CH3)COOCH3.
C, CH3COOCH=CH2.
D, CH2=CHCN.
Thủy tinh hữu cơ là loại thủy tinh được cấu tạo từ CH2=C(CH3)COOCH3, tên gọi khác là Poly (methyl methacrylate)
Phân tích các đáp án khác:
❌A. Methyl acrylate : là monomer của poly(methyl acrylate), không phải PMMA.
❌C. Vinyl acetate (Axit etanoic vinyl ester) : là monomer dùng để tổng hợp polyvinyl acetate (PVA), một loại polymer ứng dụng trong keo dán và sơn.
❌D. Acrylonitrile (vinyl cyanide) : được dùng để tổng hợp polyacrylonitrile (PAN), một loại polymer dùng trong sản xuất sợi tổng hợp (Olon, Acrilan).
⟹ Chọn đáp án B Đáp án: B
Phân tích các đáp án khác:
❌A. Methyl acrylate : là monomer của poly(methyl acrylate), không phải PMMA.
❌C. Vinyl acetate (Axit etanoic vinyl ester) : là monomer dùng để tổng hợp polyvinyl acetate (PVA), một loại polymer ứng dụng trong keo dán và sơn.
❌D. Acrylonitrile (vinyl cyanide) : được dùng để tổng hợp polyacrylonitrile (PAN), một loại polymer dùng trong sản xuất sợi tổng hợp (Olon, Acrilan).
⟹ Chọn đáp án B Đáp án: B
Câu 15 [186807]: Trong khí thải của một nhà máy có nhiều khí SO2, khí này là nguyên nhân chính gây ra hiện tượng mưa acid làm ô nhiễm môi trường. Để loại bỏ khí SO2 trong khí thải trên với chi phí thấp có thể dùng dung dịch nào sau đây?
A, Nước vôi trong.
B, NaOH.
C, Br2.
D, KMnO4.
Phân tích các đáp án
✔️A. Nước vôi trong được sản xuất từ nguyên liệu đầu là đá vôi nên chi phí sản xuất thấp nhất.
Trong thực tế thường dùng Ca(OH)2 rắn để xử lý khí thải SO2.
❌B. NaOH đắt hơn nước vôi trong, nên không phải lựa chọn tối ưu về chi phí.
❌C. Br2 không có phản ứng trực tiếp để loại bỏ SO2 trong khí thải.
❌D. Dung dịch KMnO4 đắt tiền, không kinh tế để xử lý khí thải.
⟹ Chọn đáp án A Đáp án: A
✔️A. Nước vôi trong được sản xuất từ nguyên liệu đầu là đá vôi nên chi phí sản xuất thấp nhất.
Trong thực tế thường dùng Ca(OH)2 rắn để xử lý khí thải SO2.
❌B. NaOH đắt hơn nước vôi trong, nên không phải lựa chọn tối ưu về chi phí.
❌C. Br2 không có phản ứng trực tiếp để loại bỏ SO2 trong khí thải.
❌D. Dung dịch KMnO4 đắt tiền, không kinh tế để xử lý khí thải.
⟹ Chọn đáp án A Đáp án: A
Câu 16 [706047]: Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử.
Các phần tử đó là
Các phần tử đó là
A, tất cả các cation kim loại.
B, nguyên tử hoặc cation của một số kim loại.
C, các nguyên tử nguyên tố chuyển tiếp dãy thứ nhất.
D, các cation kim loại của nguyên tố chuyển tiếp dãy thứ nhất.
Phân tích các đáp án :
❌A. Sai. vì không phải tất cả cation kim loại đều có khả năng tạo phức chất. Ví dụ Na+, K+, Ca2+ rất ít khi tạo phức mạnh do chúng không có orbital d trống để tiếp nhận electron từ phối tử.
✔️B. Đúng . Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử là nguyên tử hoặc cation kim loại.
❌C. Sai. Không phải tất cả nguyên tử nguyên tố chuyển tiếp đều tham gia tạo phức. Ví dụ: Fe, Cu, Zn ở trạng thái trung hòa không tạo phức mạnh, nhưng cation của chúng thì có thể.
❌D. Đúng. Các cation kim loại chuyển tiếp (Fe2+, Cu2+, Zn2+...) có obital d trống, giúp chúng nhận cặp electron từ phối tử để tạo phức. Ngoài ra có các nguyên tử kim loại.
⟹ Chọn đáp án B Đáp án: B
❌A. Sai. vì không phải tất cả cation kim loại đều có khả năng tạo phức chất. Ví dụ Na+, K+, Ca2+ rất ít khi tạo phức mạnh do chúng không có orbital d trống để tiếp nhận electron từ phối tử.
✔️B. Đúng . Phần tử có thể trở thành nguyên tử trung tâm trong phức chất khi chúng sử dụng các orbital trống để nhận cặp electron hoá trị riêng từ phối tử là nguyên tử hoặc cation kim loại.
❌C. Sai. Không phải tất cả nguyên tử nguyên tố chuyển tiếp đều tham gia tạo phức. Ví dụ: Fe, Cu, Zn ở trạng thái trung hòa không tạo phức mạnh, nhưng cation của chúng thì có thể.
❌D. Đúng. Các cation kim loại chuyển tiếp (Fe2+, Cu2+, Zn2+...) có obital d trống, giúp chúng nhận cặp electron từ phối tử để tạo phức. Ngoài ra có các nguyên tử kim loại.
⟹ Chọn đáp án B Đáp án: B
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
Phản ứng giữa propene với HBr tạo thành hai sản phẩm khác nhau là 1-bromoproane và 2-bromoproane. Các giai đoạn xảy ra phản ứng như sau:
• Giai đoạn 1 của phản ứng là quá trình H+ phản ứng với C=C, tạo carbocation trung gian.
• Giai đoạn 2 là quá trình kết hợp giữa carbocation với tác nhân Br–:
a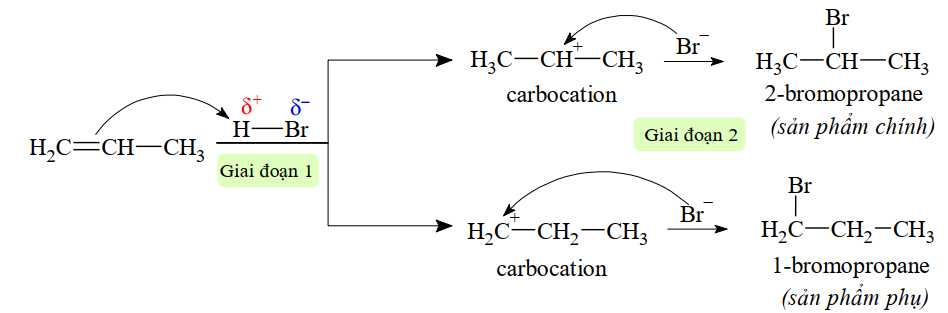
Biết rằng carbocation có điện tích dương tồn tại trên C có bậc cao hơn thì bền hơn và sẽ tạo thành lượng sản phẩm nhiều hơn (sản phẩm chính).
• Giai đoạn 1 của phản ứng là quá trình H+ phản ứng với C=C, tạo carbocation trung gian.
• Giai đoạn 2 là quá trình kết hợp giữa carbocation với tác nhân Br–:
a

Biết rằng carbocation có điện tích dương tồn tại trên C có bậc cao hơn thì bền hơn và sẽ tạo thành lượng sản phẩm nhiều hơn (sản phẩm chính).
Câu 17 [706048]: Nếu cho but-1-ene tác dụng với HBr thì sản phẩm chính là
A, 1-bromobutane.
B, 2-bromobutane.
C, 3-bromobutane.
D, 1-bromo-1-methylpropane.
Quy tắc Markovnikov: Phản ứng cộng một tác nhân không đối xứng HX như HBr, HCl, HOH,..vào liên kết bội, nguyên tử hydrogen sẽ ưu tiên cộng vào nguyên tử carbon có nhiều hydrogen hơn và X sẽ cộng vào nguyên tử carbon có ít hydrogen hơn.
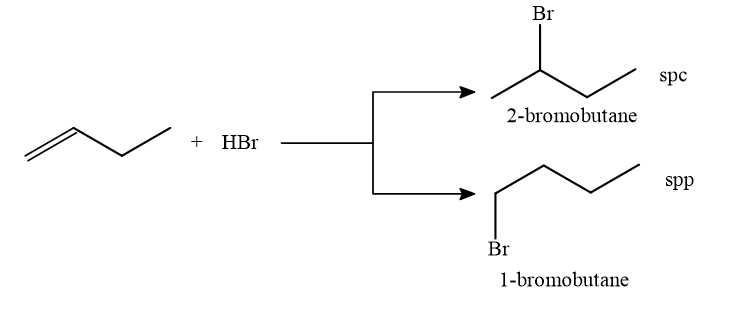
⟹ Chọn đáp án B Đáp án: B

⟹ Chọn đáp án B Đáp án: B
Câu 18 [706049]: Phản ứng cộng HBr (hoặc tổng quát cộng HX) vào alkene bất đối xứng ưu tiên xảy ra theo hướng tạo carbocation bền hơn. Cho các carbocation sau:
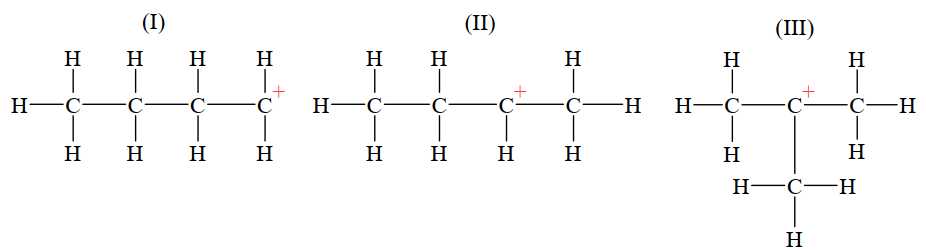
So sánh độ bền của carbocation theo thứ tự giảm dần là

So sánh độ bền của carbocation theo thứ tự giảm dần là
A, (I) > (II) > (III).
B, (III) > (II) > (I).
C, (II) > (I) > (III).
D, (III) > (I) > (II).
Carbocation là tiểu phân trung gian kém bền. Độ bền tương đối của carbocation thường tăng khi bậc của nguyên tử carbon mang điện tích dương tăng.
Thự tự giảm dần độ bền của carbocation là (III), (II), (I)
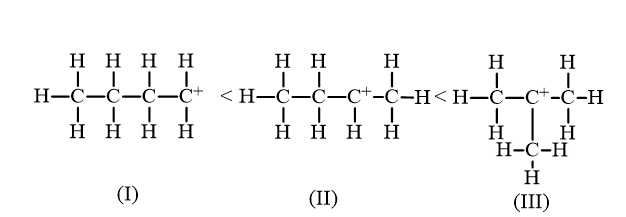
⟹ Chọn đáp án B Đáp án: B
Thự tự giảm dần độ bền của carbocation là (III), (II), (I)

⟹ Chọn đáp án B Đáp án: B
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706050]: Iodine phản ứng với potassium hydroxide khi đun nóng tương tự chlorine. Tiến hành thí nghiệm sau:
• Bước 1: Lấy 20 gam dung dịch KOH 42% (đặc) cho vào bình nón, đặt bình trên lưới amiang rồi đun nóng, vừa đun vừa thêm thật từ từ tinh thể iodine vào khuấy thật kỹ đến khi xuất hiện màu vàng rơm nhạt thì ngừng thêm iodine.
• Bước 2: Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
Biết các phản ứng xảy ra hoàn toàn, 99% potassium iodate và 2% potassium iodide (về khối lượng) bị kết tinh và được giữ lại trên phễu lọc.
• Bước 1: Lấy 20 gam dung dịch KOH 42% (đặc) cho vào bình nón, đặt bình trên lưới amiang rồi đun nóng, vừa đun vừa thêm thật từ từ tinh thể iodine vào khuấy thật kỹ đến khi xuất hiện màu vàng rơm nhạt thì ngừng thêm iodine.
• Bước 2: Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
Biết các phản ứng xảy ra hoàn toàn, 99% potassium iodate và 2% potassium iodide (về khối lượng) bị kết tinh và được giữ lại trên phễu lọc.
Phân tích các đáp án :
❌(a) – Sai. Phản ứng ở bước 1 thuộc phản ứng tự oxi hoá, tự khử . Trong phản ứng I2 có số oxi hoá vừa tăng lên +5 vừa giảm xuống -1 .
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Số oxi hóa của I tăng lên +5 và giảm xuống -1
✔️(b) – Đúng. Màu vàng rơm nhạt xuất hiện ở bước 1 cho biết I2 bắt đầu dư. Dung dịch I2 có màu vàng nhạt.
✔️(c) – Đúng. Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
→ potassium iodide có độ tan kém hơn nên bị tách ra trước
❌(d) – Sai.
Số mol của KOH là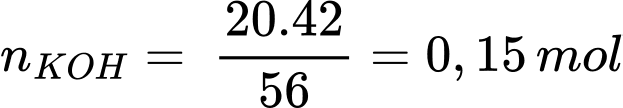
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Theo phương trình số mol của KI và KIO3 là nKI = 0,125 mol và
nKIO3 = 0,025 mol 99% KIO3 và 2% KI bị kết tinh và được giữ lại trên phễu.
Khi lọc thu được phần nước lọc còn lại 1% KIO3 và 98% KI
Cô cạn nước lọc được:
mKIO3 = 1% × 0,025 × 214 = 0,0535 gam
mKI = 98% × 0,125 × 166 = 20,335
Độ tinh khiết = 20,335 ÷ (20,335 + 0,0535) = 99,74% ≈ 99%
❌(a) – Sai. Phản ứng ở bước 1 thuộc phản ứng tự oxi hoá, tự khử . Trong phản ứng I2 có số oxi hoá vừa tăng lên +5 vừa giảm xuống -1 .
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Số oxi hóa của I tăng lên +5 và giảm xuống -1
✔️(b) – Đúng. Màu vàng rơm nhạt xuất hiện ở bước 1 cho biết I2 bắt đầu dư. Dung dịch I2 có màu vàng nhạt.
✔️(c) – Đúng. Để nguội rồi ngâm bình nón trong nước đá ở 3 oC trong vòng 15 – 20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thì thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
→ potassium iodide có độ tan kém hơn nên bị tách ra trước
❌(d) – Sai.
Số mol của KOH là
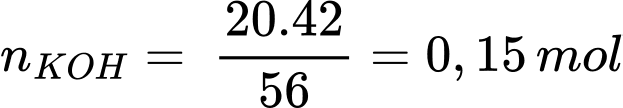
3I2 + 6KOH → KIO3 + 3H2O + 5KI
Theo phương trình số mol của KI và KIO3 là nKI = 0,125 mol và
nKIO3 = 0,025 mol 99% KIO3 và 2% KI bị kết tinh và được giữ lại trên phễu.
Khi lọc thu được phần nước lọc còn lại 1% KIO3 và 98% KI
Cô cạn nước lọc được:
mKIO3 = 1% × 0,025 × 214 = 0,0535 gam
mKI = 98% × 0,125 × 166 = 20,335
Độ tinh khiết = 20,335 ÷ (20,335 + 0,0535) = 99,74% ≈ 99%
Câu 20 [706051]: Tiến hành phản ứng thủy phân bromoethane, theo các bước sau:
Bước 1: Cho khoảng 1 mL bromoethane vào ống nghiệm (1), thêm khoảng 3 mL nước cất rồi lắc đều. Để hỗn hợp tách thành hai lớp, lấy phần trên của hỗn hợp nhỏ vào ống nghiệm có chứa sẵn 1 mL dung dịch AgNO3. Nếu thấy có kết tủa cần lặp lại đến khi không còn kết tủa.
Bước 2: Thêm 2 mL dung dịch NaOH 10% vào ống nghiệm (1).
Bước 3: Lắc nhẹ ống nghiệm rồi ngâm vào cốc nước nóng khoảng 5 phút, thỉnh thoảng lắc đều ống nghiệm, để nguội rồi lấy khoảng 1 mL chất lỏng ở phần trên ống nghiệm (1) và chuyển sang ống nghiệm (2).
Bước 4: Thêm dung dịch HNO3 vào ống nghiệm thứ (2) để trung hòa (thử môi trường của dung dịch bằng giấy chỉ thị pH) rồi nhỏ thêm vài giọt dung dịch AgNO3 1%, quan sát thấy có kết tủa vàng nhạt xuất hiện.
Bước 1: Cho khoảng 1 mL bromoethane vào ống nghiệm (1), thêm khoảng 3 mL nước cất rồi lắc đều. Để hỗn hợp tách thành hai lớp, lấy phần trên của hỗn hợp nhỏ vào ống nghiệm có chứa sẵn 1 mL dung dịch AgNO3. Nếu thấy có kết tủa cần lặp lại đến khi không còn kết tủa.
Bước 2: Thêm 2 mL dung dịch NaOH 10% vào ống nghiệm (1).
Bước 3: Lắc nhẹ ống nghiệm rồi ngâm vào cốc nước nóng khoảng 5 phút, thỉnh thoảng lắc đều ống nghiệm, để nguội rồi lấy khoảng 1 mL chất lỏng ở phần trên ống nghiệm (1) và chuyển sang ống nghiệm (2).
Bước 4: Thêm dung dịch HNO3 vào ống nghiệm thứ (2) để trung hòa (thử môi trường của dung dịch bằng giấy chỉ thị pH) rồi nhỏ thêm vài giọt dung dịch AgNO3 1%, quan sát thấy có kết tủa vàng nhạt xuất hiện.
Phân tích các phát biểu :
❌(a) – Sai. Ban đầu hỗn hợp tách thành hai lớp do bromoethane không tan trong nước. Trong đó, bromoethane ở lớp dưới do nặng hơn nước.
❌(b) – Sai. Không thể thay acid HNO3 bằng acid HBr để trung hòa ở bước 4 nguyên do sẽ có phản ứng với AgNO3 tạo kết tủa vàng không thể phân biệt được kết tủa thu được từ phản ứng của NaBr hay HBr với AgNO3 tạo kết tủa
AgNO3 + HBr → AgBr + HNO3
✔️(c) – Đúng. Từ kết quả ở bước 3 có thể kết luận phản ứng thủy phân bromoethane vẫn chưa xảy ra hoàn toàn vì sau phản ứng chưa thu được dung dịch đồng nhất vẫn có sự phân tách 2 lớp chất lỏng khác nhau.
✔️(d) – Đúng. Kết tủa AgBr xuất hiện chứng tỏ nguyên tử Br trong halogenalkane đã bị thay thế bởi nhóm nguyên tử OH.
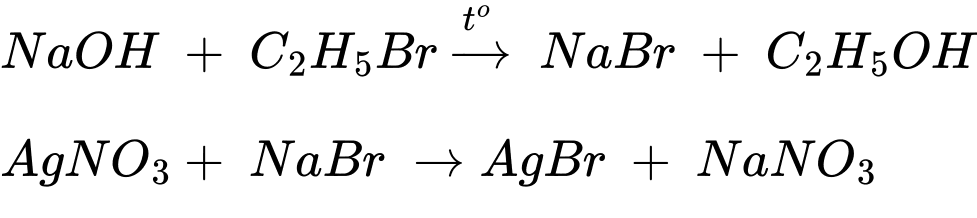
❌(a) – Sai. Ban đầu hỗn hợp tách thành hai lớp do bromoethane không tan trong nước. Trong đó, bromoethane ở lớp dưới do nặng hơn nước.
❌(b) – Sai. Không thể thay acid HNO3 bằng acid HBr để trung hòa ở bước 4 nguyên do sẽ có phản ứng với AgNO3 tạo kết tủa vàng không thể phân biệt được kết tủa thu được từ phản ứng của NaBr hay HBr với AgNO3 tạo kết tủa
AgNO3 + HBr → AgBr + HNO3
✔️(c) – Đúng. Từ kết quả ở bước 3 có thể kết luận phản ứng thủy phân bromoethane vẫn chưa xảy ra hoàn toàn vì sau phản ứng chưa thu được dung dịch đồng nhất vẫn có sự phân tách 2 lớp chất lỏng khác nhau.
✔️(d) – Đúng. Kết tủa AgBr xuất hiện chứng tỏ nguyên tử Br trong halogenalkane đã bị thay thế bởi nhóm nguyên tử OH.
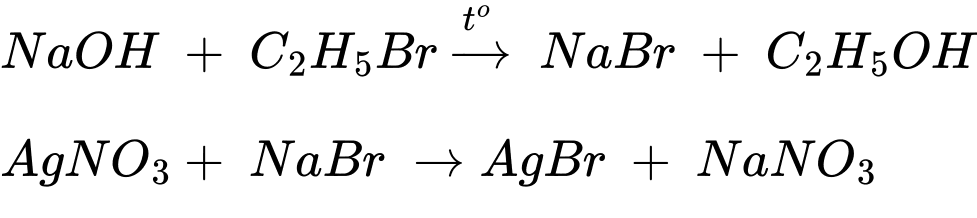
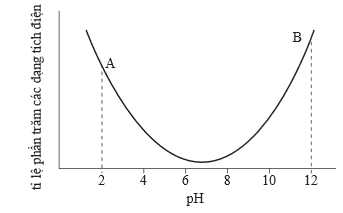
Câu 21 [706052]: Glycine là một loại amino accid chứa 1 nhóm COOH và 1 nhóm NH2. Hình dưới đây cho thấy tỉ lệ phần trăm các dạng tích điện của glycine ở các giá trị pH khác nhau:

Phân tích các phát biểu :
✔️(a) – Đúng. Tại điểm A trên đồ thị, tại pH = 2 glycine chủ yếu ở dạng cation HOOCCH2NH3+.
❌(b) – Sai. Dạng tồn tại chủ yếu của glycine tại điểm B có pH = 12 nên dạng tồn tại chut yếu ở dạng anion có tổng điện tích là -1.
✔️(c) – Đúng. Mỗi amino acid có một giá trị pH cụ thể mà tại đó amino acid tồn tại trong dung dịch ở dạng ion lưỡng cực, giá trị pH đó gọi là pH đẳng điện (pI). Tại giá trị pI của nó, amino acid trung hòa về điện, tổng điện tích dương bằng tổng điện tích âm. Từ đồ thị điểm đẳng điện gần đúng của glycine là trong khoảng pH = 6 đến 8 nguyên nhân tại khoảng pH có tổng điện tích bằng 0.
✔️(d) – Đúng. Khi pH tăng, điện tích của dạng tồn tại sẽ có điện tích chuyển từ dương sang âm, pH thấp glycine tồn tại chủ yếu dạng cation khi chuyển sang pH cao tồn tại dạng anion.
✔️(a) – Đúng. Tại điểm A trên đồ thị, tại pH = 2 glycine chủ yếu ở dạng cation HOOCCH2NH3+.
❌(b) – Sai. Dạng tồn tại chủ yếu của glycine tại điểm B có pH = 12 nên dạng tồn tại chut yếu ở dạng anion có tổng điện tích là -1.
✔️(c) – Đúng. Mỗi amino acid có một giá trị pH cụ thể mà tại đó amino acid tồn tại trong dung dịch ở dạng ion lưỡng cực, giá trị pH đó gọi là pH đẳng điện (pI). Tại giá trị pI của nó, amino acid trung hòa về điện, tổng điện tích dương bằng tổng điện tích âm. Từ đồ thị điểm đẳng điện gần đúng của glycine là trong khoảng pH = 6 đến 8 nguyên nhân tại khoảng pH có tổng điện tích bằng 0.
✔️(d) – Đúng. Khi pH tăng, điện tích của dạng tồn tại sẽ có điện tích chuyển từ dương sang âm, pH thấp glycine tồn tại chủ yếu dạng cation khi chuyển sang pH cao tồn tại dạng anion.
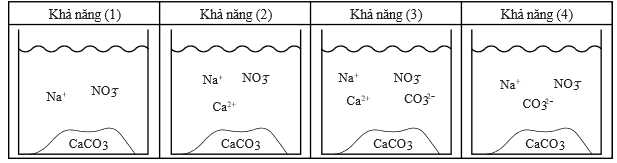
Câu 22 [706053]: Cho 20,0 mL dung dịch Na2CO3 1,0 M vào cốc thủy tinh và chuẩn độ bằng dung dịch Ca(NO3)2 1,0 M, thu được kết tủa trắng CaCO3. Tại điểm tương đương, thành phần của dung dịch có thể là một trong bốn khả năng dưới đây:

Phân tích các đáp án :
❌(a) – Sai. Cần sử dụng 20 mL dung dịch Ca(NO3)2 để đạt điểm tương đương.
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3
Đổi 20 mL = 0,02 L
Số mol của Na2CO3 là nNa2CO3 = 0,02.1 = 0,02 mol
Từ PTHH số mol của Ca(NO3)2 là 0,02 mol
Thể tích dung dịch Ca(NO3)2 cần là VCa(NO3)2 = 0,02 L = 20 mL
❌(b) – Sai. Thành phần của dung dịch tại điểm tương đương ứng với khả năng (1), tại điểm tương đương toàn bộ CO32- đã bị kết tủa bởi Ca2+.
✔️(c) – Đúng. Khi quá trình chuẩn độ diễn ra đến điểm tương đương, nồng độ anion CO32- giảm dần do hình thành kết tủa trắng với Ca2+.
❌(d) – Sai. Nếu dung dịch Na2CO3 được pha loãng thành 40,0 mL, thể tích dung dịch Ca(NO3)2 1,0 M cần thiết để đạt được điểm tương đương tăng không đổi. Khi pha loãng thì nồng độ thay đổi nhưng không thay đổi mol ban đầu nên lượng Ca(NO3)2 cần để chuẩn độ vẫn không đổi.
❌(a) – Sai. Cần sử dụng 20 mL dung dịch Ca(NO3)2 để đạt điểm tương đương.
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3
Đổi 20 mL = 0,02 L
Số mol của Na2CO3 là nNa2CO3 = 0,02.1 = 0,02 mol
Từ PTHH số mol của Ca(NO3)2 là 0,02 mol
Thể tích dung dịch Ca(NO3)2 cần là VCa(NO3)2 = 0,02 L = 20 mL
❌(b) – Sai. Thành phần của dung dịch tại điểm tương đương ứng với khả năng (1), tại điểm tương đương toàn bộ CO32- đã bị kết tủa bởi Ca2+.
✔️(c) – Đúng. Khi quá trình chuẩn độ diễn ra đến điểm tương đương, nồng độ anion CO32- giảm dần do hình thành kết tủa trắng với Ca2+.
❌(d) – Sai. Nếu dung dịch Na2CO3 được pha loãng thành 40,0 mL, thể tích dung dịch Ca(NO3)2 1,0 M cần thiết để đạt được điểm tương đương tăng không đổi. Khi pha loãng thì nồng độ thay đổi nhưng không thay đổi mol ban đầu nên lượng Ca(NO3)2 cần để chuẩn độ vẫn không đổi.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706054]: Muốn mạ đồng một tấm sắt có diện tích tổng cộng 200 cm2, người ta dùng tấm sắt làm cathode của một bình điện phân đựng dung dịch CuSO4 và anode là một thanh đồng nguyên chất, rồi cho dòng điện có cường độ I = 10 A chạy qua trong thời gian 2 giờ 40 phút 50 giây. Cho biết đồng có khối lượng riêng D = 8,9 g/cm3. Bề dày lớp đồng bám trên mặt tấm sắt là bao nhiêu mm (làm tròn đến hàng phần trăm)?
Đổi 2giờ 40 phút 50 giây = 9650 giây
Khối lượng đồng thu được sau điện phân là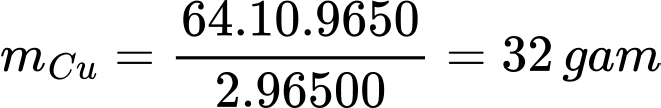
Thể tích đồng được mạ lên tấm sắt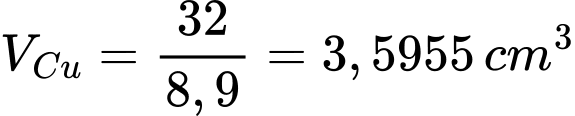
Bề dày của lớp đồng bám trên tấm sắt là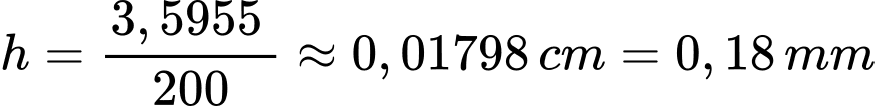
⟹ Điền đáp án : 0,18
Khối lượng đồng thu được sau điện phân là
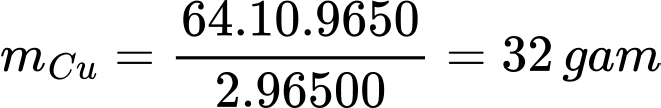
Thể tích đồng được mạ lên tấm sắt
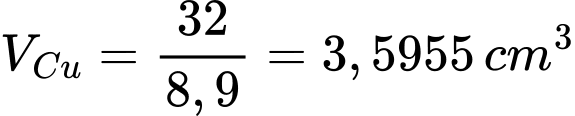
Bề dày của lớp đồng bám trên tấm sắt là
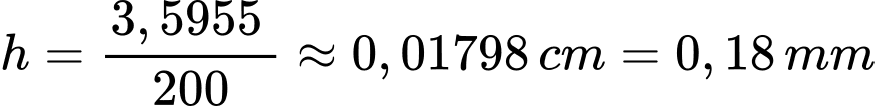
⟹ Điền đáp án : 0,18
Câu 24 [706055]: Cho phương trình hóa học của các phản ứng đánh số thứ tự từ 1 đến 4 dưới đây:
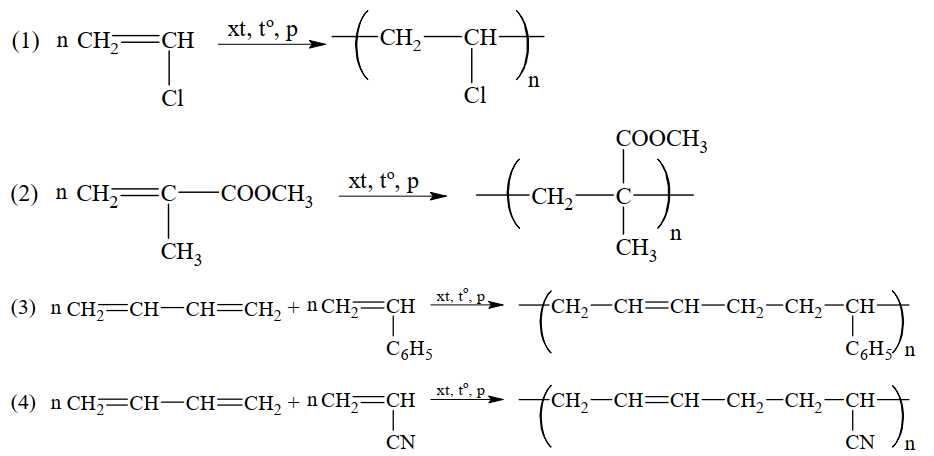
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các chất sau: cao su buna–S; cao su buna–N; nhựa PVC; thủy tinh hữu cơ plexiglas và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi điều chế các chất sau: cao su buna–S; cao su buna–N; nhựa PVC; thủy tinh hữu cơ plexiglas và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
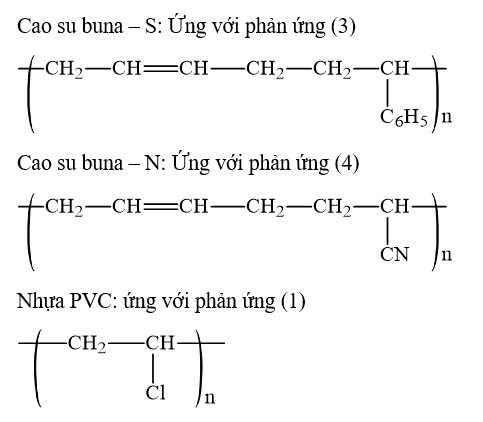
Trình tự dãy số là 3412
⟹ Điền đáp án : 3412
Câu 25 [304188]: Aspirin, hay acetylsalicylic acid, là một dẫn xuất được điều chế từ acid salicylic; có tác dụng giảm đau, hạ sốt, chống viêm. Quá trình điều chế aspirin được cho như sau:
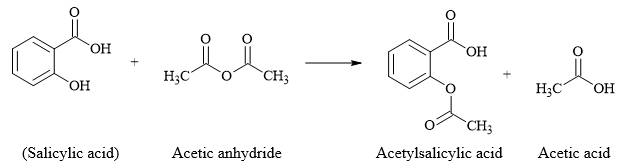
Tính giá trị độ bất bão hoà k của aspirin.
Điền đáp án: [..........]

Tính giá trị độ bất bão hoà k của aspirin.
Điền đáp án: [..........]
HD: Phân tích cấu tạo của aspirin:

► Độ bất bão hòa k là tổng số liên kết π và vòng có trong cấu tạo của hợp chất.
☆ Cách 1: đếm k dựa vào cấu tạo, ở đây kaspirin = 3πC=C + 2πC=O + 1vòng = 6.
☆ Cách 2: dựa vào công thức phân tử aspirin là C9H8O4 và công thức tính tổng quát k:
Đối với phân tử chỉ chứa carbon, hydro, halogen, nitơ và oxy, công thức:
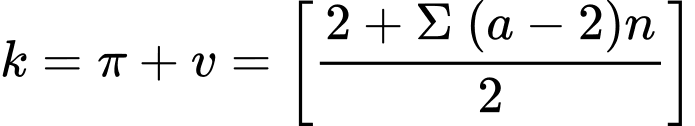
Trong đó a là hóa trị của nguyên tố, n là số nguyên tử của nguyên tố đó.
Áp dụng: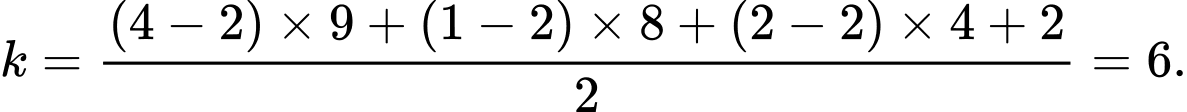
⟹ Điền đáp án: 6.

► Độ bất bão hòa k là tổng số liên kết π và vòng có trong cấu tạo của hợp chất.
☆ Cách 1: đếm k dựa vào cấu tạo, ở đây kaspirin = 3πC=C + 2πC=O + 1vòng = 6.
☆ Cách 2: dựa vào công thức phân tử aspirin là C9H8O4 và công thức tính tổng quát k:
Đối với phân tử chỉ chứa carbon, hydro, halogen, nitơ và oxy, công thức:
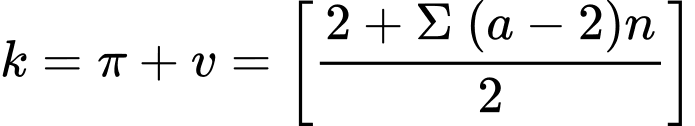
Trong đó a là hóa trị của nguyên tố, n là số nguyên tử của nguyên tố đó.
Áp dụng:
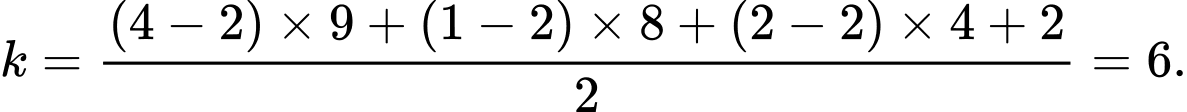
⟹ Điền đáp án: 6.
Câu 26 [706056]: Trong các chất sau: glycerol, glucose, Gly-Ala-Gly, Gly-Ala, propan-1,2-diol và albumin. Số chất tác dụng được với Cu(OH)2 trong NaOH cho màu tím đặc trưng là
❌Glycerol: Alcohol đa chức, không có liên kết peptide, không có phản ứng biuret.
❌Glucose: Là monosaccharide (đường đơn), không có liên kết peptit, không có phản ứng biure.
✔️Gly-Ala-Gly: Là tripeptide, có 3 liên kết peptide, phản ứng biuret tạo màu tím.
❌Gly-Ala: Là đipeptide, có 2 liên kết peptide, không phản ứng biuret (cần từ tripeptide trở lên).
❌Propan-1,2-diol: Alcohol hai chức, không có liên kết peptide, không phản ứng biuret.
✔️Albumin: Là protein, có nhiều liên kết peptide, phản ứng biuret tạo màu tím.
Các chất có phản ứng màu biuret là: Gly-Ala-Gly, Albumin.
⟹ Điền đáp án: 2
❌Glucose: Là monosaccharide (đường đơn), không có liên kết peptit, không có phản ứng biure.
✔️Gly-Ala-Gly: Là tripeptide, có 3 liên kết peptide, phản ứng biuret tạo màu tím.
❌Gly-Ala: Là đipeptide, có 2 liên kết peptide, không phản ứng biuret (cần từ tripeptide trở lên).
❌Propan-1,2-diol: Alcohol hai chức, không có liên kết peptide, không phản ứng biuret.
✔️Albumin: Là protein, có nhiều liên kết peptide, phản ứng biuret tạo màu tím.
Các chất có phản ứng màu biuret là: Gly-Ala-Gly, Albumin.
⟹ Điền đáp án: 2
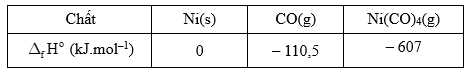
Câu 27 [706057]: Quy trình Mond được sử dụng vào cuối thế kỷ 19 và đầu thế kỷ 20 để tinh chế kim loại nickel khỏi các tạp chất như iron và cobalt. Quá trình này dựa trên phản ứng của nickel với carbon monoxide để tạo thành nickel tetracarbonyl dễ bay hơi, có thể được tách ra khỏi các tạp chất rắn: Ni(s) + 4CO(g)  Ni(CO)4(g).
Ni(CO)4(g).
Tính của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
 Ni(CO)4(g).
Ni(CO)4(g).
Tính
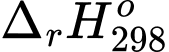 của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
của phản ứng tạo thành Ni(CO)4(g) theo quy trình Mond (đơn vị kJ).
Ni(s) + 4CO(g) → Ni(CO)4(g)
Biến thiên enthalpy của phản ứng trên là
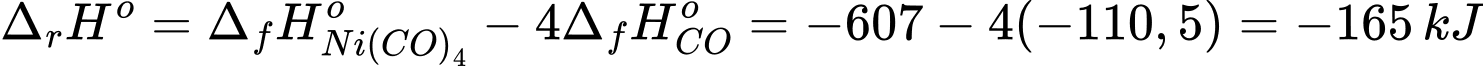
⟹ Điền đáp án : 165
Biến thiên enthalpy của phản ứng trên là
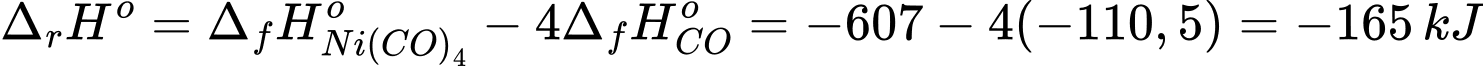
⟹ Điền đáp án : 165
Câu 28 [706058]: Trong nước thải của một nhà máy, hàm lượng ion amonium là 192 mg/L. Để xử lí ion amonium, tiến hành xử lí nước thải theo phương pháp Anammox (Anaerobic Ammonium Oxidation). Phương pháp này gồm 2 giai đoạn:
Giai đoạn 1: Oxi hóa ion amonium thành ion nitrite theo phản ứng sau: (HCO3– dùng dư 10% so với lượng cần thiết):
2NH4+ + 3O2 + 4HCO3– 2NO2– + 4CO2 + 6H2O
2NO2– + 4CO2 + 6H2O
Giai đoạn 2: Diễn ra trong điều kiện yếm khí, ion amonium sẽ được oxi hoá trực tiếp thành khí nitrogen theo phản ứng:
NH4+ + NO2– N2 + 2H2O
N2 + 2H2O
Biết các phản ứng xảy ra hoàn toàn. Tính khối lượng (kg) NaHCO3 tối thiểu cần dùng để xử lí 10 000 m³ nước thải của nhà máy trên (làm tròn đến hàng đơn vị).
Giai đoạn 1: Oxi hóa ion amonium thành ion nitrite theo phản ứng sau: (HCO3– dùng dư 10% so với lượng cần thiết):
2NH4+ + 3O2 + 4HCO3–
 2NO2– + 4CO2 + 6H2O
2NO2– + 4CO2 + 6H2OGiai đoạn 2: Diễn ra trong điều kiện yếm khí, ion amonium sẽ được oxi hoá trực tiếp thành khí nitrogen theo phản ứng:
NH4+ + NO2–
 N2 + 2H2O
N2 + 2H2OBiết các phản ứng xảy ra hoàn toàn. Tính khối lượng (kg) NaHCO3 tối thiểu cần dùng để xử lí 10 000 m³ nước thải của nhà máy trên (làm tròn đến hàng đơn vị).
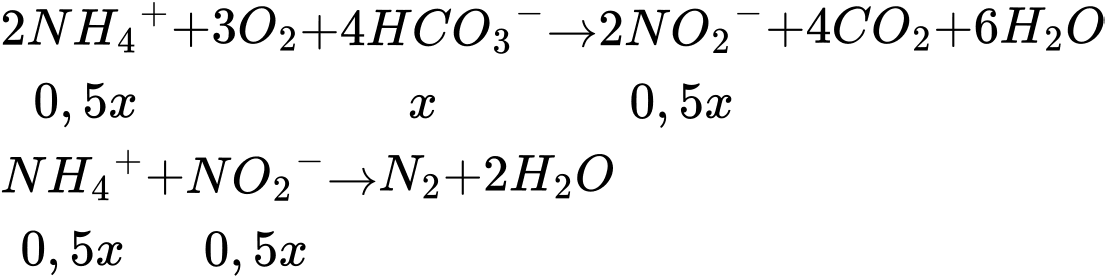
Đổi 10000 m3 = 10000000 L
Khối lượng ammonium có trong 10000 m3 nước thải là
nNH4+ = 10000000.192 = 1920000000 mg = 1920000 gam
Số mol của ammonium là nNH4+ = 1920000:18 = 106666,67 mol
⟹ 0,5x + 0,5x = 106666,67 (mol)
⟹ x = 106666,67 (mol)
Khối lượng NaHCO3 tối thiểu là
mNaHCO3 = 106666,67.84.110% = 9856000 gam ≈ 9856 kg
⟹ Điền đáp án : 9856