PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Phân tích các đáp án :
❌ A. Đúng. Phản ứng khử oxide kim loại bằng carbon là thu nhiệt.
❌B. Sai. Phản ứng này có sự thay đổi số oxi hóa: Zn trong ZnO có số oxi hóa +2, sau phản ứng trở thành Zn (0) ; C trong C (0) bị oxi hóa thành CO (+2).
❌C. Sai. Thủy luyện là phương pháp dùng dung dịch để hòa tan kim loại hoặc hợp chất của kim loại, còn phản ứng này thuộc phương pháp nhiệt luyện.
✔️D. Sai. Zn sinh ra là kim loại ở thể hơi.
⟹ Chọn đáp án D Đáp án: D
Phân tích các đáp án :
❌B. Sai. Dù Cu và Al có độ dẫn điện cao (Al thấp hơn Cu), nhưng Hg (thủy ngân) có độ dẫn điện kém hơn nhiều so với các kim loại khác do nó ở trạng thái lỏng.
❌C. Sai. Dù các kim loại kiềm (Li, Na, K) có tính dẫn điện khá tốt, nhưng không thể so sánh với Ag, Cu, Au. Chúng có tính dẫn điện thấp hơn do cấu trúc mạng tinh thể yếu hơn.
❌D. Sai. Cu có độ dẫn điện cao, nhưng Fe (sắt) và Zn (kẽm) có độ dẫn điện kém hơn đáng kể.
⟹ Chọn đáp án A Đáp án: A
2H2O + 2e ⟶ H2 + 2OH-
H2O nhận e để tạo thành H2 ⟶ H2O chất oxi hóa.
H2 nhường e để tạo OH⁻ ⟶ H2 là chất khử.
Phân tích các đáp án:
❌ A. Sai. OH⁻ không phải là dạng khử, mà là sản phẩm của quá trình oxi hóa
✔️ B. Đúng. H2 là chất khử vì nó có thể bị oxi hóa thành OH-
❌ C. Sai. H2 không phải chất oxi hóa, mà là chất khử
❌ D. Sai. OH⁻ không phải chất oxi hóa, vì nó không thể nhận thêm electron.
⟹ Chọn đáp án B Đáp án: B
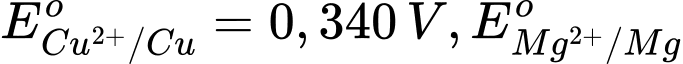 là
là Với pin Mg - Cu, phản ứng xảy ra :
Anode : Mg ⟶ Mg2+ + 2e
Cathode : Cu2+ + 2e ⟶ Cu
Eo pin = Eo Cu2+/Cu - Eo Mg2+/Mg
2,696 = 0,340 - Eo Mg2+/Mg
⟶ Eo Mg2+/Mg = -2,356 V
⟹ Chọn đáp án B Đáp án: B
Hg: Chu kỳ 6 → Kim loại chuyển tiếp, có nhiệt độ nóng chảy thấp nhất ( do ở thể lỏng ở nhiệt độ phòng).
Cs: Nhóm 1 (Kim loại kiềm), chu kỳ 6 → Kim loại kiềm có nhiệt độ nóng chảy thấp nhất .
K : Nhóm 1, chu kỳ 4 → Kim loại kiềm có nhiệt độ nóng chảy thấp hơn Na.
Na : Nhóm 1, chu kỳ 3 → Kim loại kiềm có nhiệt độ nóng chảy cao hơn K .
Fe : Nhóm 8, chu kỳ 4 → Kim loại chuyển tiếp, nhiệt độ nóng chảy cao hơn nhiều so với kim loại kiềm .
W : Nhóm 6, chu kỳ 6 → Kim loại có nhiệt độ nóng chảy cao nhất trong tất cả các kim loại .
Phân tích các đáp án:
✔️ A. Sắp xếp đúng theo thứ tự nhiệt độ nóng chảy từ thấp đến cao.
❌ B. Trong nhóm kim loại kiềm, thứ tự đúng phải là Cs < K < Na.
❌ C. Hg phải đứng đầu, nhưng trong đáp án này lại bị xếp sau Na, K và Cs
❌ D. Sai vị trí của Na và K, đúng phải là K < Na.
⟹ Chọn đáp án A Đáp án: A
✔️ A. Ca(OH)2 là một base mạnh, có thể dùng để trung hòa đất chua. Dù không phổ biến trong điều trị acid dạ dày, nhưng vẫn có khả năng trung hòa acid.
❌ B. BaSO4 Không tan trong nước, không phản ứng với acid nên không thể dùng để trung hòa acid dạ dày. Không có tác dụng trung hòa đất chua, vì nó không tạo base.
✔️ C. Mg(OH)2 Được dùng trong thuốc kháng acid dạ dày và dùng để trung hòa đất chua.
✔️ D. CaCO3 Được dùng trong thuốc kháng acid dạ dày (Tums, Rolaids); dùng để cải tạo đất chua.
⟹ Chọn đáp án B Đáp án: B
❌ A. Nguyên tố có nhiều electron hóa trị, nhưng điều quan trọng là độ âm điện nhỏ mới giúp chúng dễ mất electron và có nhiều số oxi hóa.
✔️ B. Có nhiều electron hóa trị (do phân lớp d chưa bão hòa). Có độ âm điện nhỏ, nên dễ mất nhiều electron và tồn tại ở nhiều mức oxi hóa khác nhau.
❌ C. Nếu độ âm điện lớn, nguyên tử có xu hướng giữ electron thay vì mất electron, nên không thể có nhiều số oxi hóa dương.
❌ D. Bán kính nguyên tử không phải yếu tố quyết định số oxi hóa.
⟹ Chọn đáp án B Đáp án: B
Phối tử thường là: Anion (ion âm) ; Phân tử trung hòa có cặp electron hóa trị riêng.
Phân tích các đáp án :
✔️A. Anion hoặc phân tử trung hòa có cặp electron hóa trị riêng.
❌ B. Kích thước lớn không quyết định khả năng làm phối tử.
❌ C. Phối tử cần có cặp electron hóa trị riêng để tạo liên kết phối trí.
❌ D. Cation kim loại trung tâm nhận cặp electron chứ không phải phối tử.
⟹ Chọn đáp án A Đáp án: A

Vùng hấp thụ đặc trưng : (2) N-H: Dao động kéo giãn của N-H, xuất hiện ở vùng 3300-3500 cm-1
2. CH3CHO (Acetaldehyde): Nhóm chức aldehyde (-CHO)
Vùng hấp thụ đặc trưng: (6) C=O: Dao động kéo giãn của C=O, xuất hiện ở vùng 1700-1750 cm-1.
3. CH3CH2CH2OH (Propanol): Nhóm chức hydroxyl (-OH)
Vùng hấp thụ đặc trưng: (3) O-H: Dao động kéo giãn của O-H, xuất hiện ở vùng 3200-3600 cm-1.
Thứ tự là : (2); (6); (3).
⟹ Điền đáp án 263
ester < alcohol < carboxylic acid.
Trong cùng nhóm, số carbon càng tăng thì ngược nhiệt độ sôi khi độ tan lại càng giảm.
Theo đó: CH3COOCH3 < HCOOCH3 < C2H5OH < CH3COOH < HCOOH.
Tương ứng ký hiệu: (2) < (1) < (3) < (5) < (4)
⟹Chọn đáp án B. Đáp án: B
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3
Phân tích các đáp án :
❌A. Sai. Glycerol là một chất lỏng, không phải chất rắn, và nó tan tốt trong nước muối bão hòa.
❌B. Sai. Lớp dưới gồm glycerol, NaCl bão hòa.
✔️C. Sai. Glycerol có nhiều nhóm -OH kề nhau nên có khả năng hòa tan Cu(OH)2 có khả năng tạo phức
❌D. Đúng. Lớp xà phòng nằm ở bên trên.
⟹ Chọn đáp án C Đáp án: C
Hợp chất carbohydrate (hydrate của carbon) có dạng Cn(H2O)m ⇒ tư duy đơn giản, H2SO4 đặc háo nước, lấy mất nước là H2O; mất hết nước là mất mH2O thì phần còn lại chỉ có Cn hay nC chính là carbon:
Cn(H2O)m ––H2SO4 đặc→ nC + mH2O.
⇝ thí nghiệm quan sát được chât rắn có màu đen được hình thành.

⟹ Chọn đáp án A.
Đáp án: ASố electron hóa trị của n nguyên tử C bằng 4, của 1 nguyên tử N bằng 3
Giữa n nguyên tử C và 1 nguyên tử N hình thành n liên kết σ bằng 2n electron hóa trị.
⇒ Tổng số electron hóa trị dùng để tạo liên kết C-C và C-N là 2n
⟹ Chọn đáp án B Đáp án: B
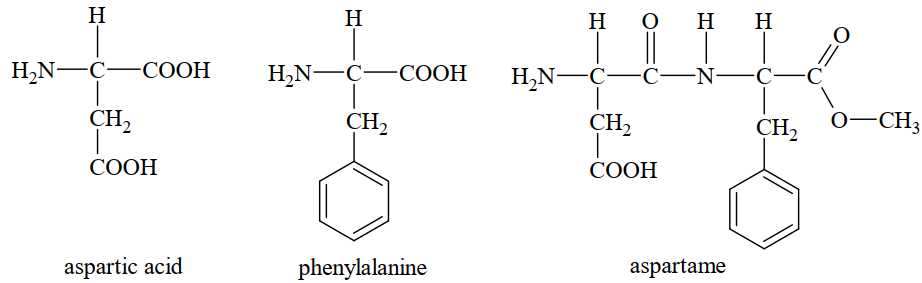
Aspartame có vị ngọt và được sử dụng trong nước giải khát và thực phẩm không đường dành cho người bị tiểu đường. Thủy phân aspartame ban đầu tạo thành methanol. Sau một thời gian dài hơn, liên kết peptide bị phá vỡ để tạo thành các amino acid tự do. Không có amino acid nào trong số này có vị ngọt.
Cho các nhận định sau:
(a) Tổng số nguyên tử trong phân tử aspartame là 34.
(b) Tên thay thế của aspartic acid là 2-aminobutane-1,4-dioic.
(c) Thuỷ phân hoàn toàn aspartame trong môi trường acid, đun nóng thu được hỗn hợp 3 sản phẩm.
(d) Có thể sử dụng chất tạo ngọt aspartame để thay thế đường saccharose trong làm bánh.
(e) Số liên kết sigma trong phân tử aspartame là 43.
(f) Ở pH = 7, có thể tách riêng aspartic acid và phenylalanine bằng phương pháp điện di trong dòng điện một chiều.
Số phát biểu đúng là
❌(a). Sai. Tổng số nguyên tử trong phân tử aspartame là :
12 C + 18 H + 5 O + 2 N = 39
✔️(b). Đúng. Aspartic acid có 4 nguyên tử carbon, 2 nhóm carboxyl (-COOH) và 1 nhóm amino (-NH2) ở vị trí carbon thứ 2.
✔️(c). Đúng. Thủy phân hoàn toàn aspartame trong môi trường acid, đun nóng thu được hỗn hợp 3 sản phẩm như sau:
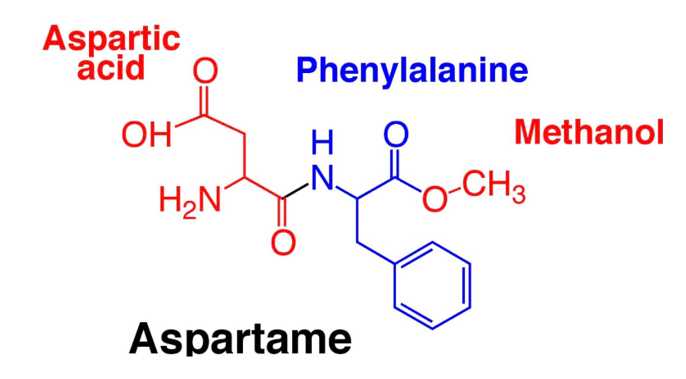
❌(d). Sai. Aspartame không bền ở nhiệt độ cao. Khi đun nóng, nó bị phân hủy và mất vị ngọt. Do đó, không nên dùng aspartame để thay thế đường saccharose trong làm bánh.
❌(e). Sai. Số liên kết sigma trong phân tử aspartame là 39.
✔️(f) Đúng. Aspartic acid có 2 nhóm carboxyl, có tính acid mạnh hơn phenylalanine. Ở pH = 7, aspartic acid sẽ mang điện tích âm nhiều hơn phenylalanine. Do đó, khi điện di, aspartic acid sẽ di chuyển về cực dương nhanh hơn phenylalanine.
Có 3 phát biểu đúng là (b), (c), (f)
⟹ Chọn đáp án B Đáp án: B
❌ A. glucose là monosaccharide nên không tham gia thủy phân.
❌ B. Acetic acid: CH3COOH không bị thủy phân.
❌ C. Ethanol: C2H5OH cũng không bị thủy phân.
⇒ chỉ có đáp án D. saccharose, chất béo gồm 2 chất đều có khả năng thủy phân:
• saccharose + H2O ––H+→ glucose + fructose.
• chất béo + H2O ––H+→ acid béo + glycerol.
⟹ Chọn đáp án D Đáp án: D
✔️A – Đúng. Hộp bã mía là một loại hộp đựng thực phẩm thân thiện với môi trường, được làm từ bã mía – phần còn lại sau khi ép mía lấy nước.
✔️B – Đúng. Hộp bã mía làm từ sợi thực vật tự nhiên nên có thể phân huỷ nhờ vi sinh vật, không gây ô nhiễm, giúp giảm rác thải nhựa, vì vậy thân thiện với môi trường.
❌C – Sai. Hộp xốp đựng thức ăn nhanh làm từ chất dẻo PS không phải là vật liệu dễ phân huỷ sinh học.
✔️D – Đúng. Hộp bã mía làm từ cellulose – polymer có sẵn trong tự nhiên. Hộp xốp làm từ polystyren – polymer do con người tổng hợp từ hóa dầu.
⟹ Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 17 – 18:
N2(g) + O2(g) ⟶ 2NO(g): (I)
Sau đó, NO bị oxi hóa trong khí quyền để tạo thành NO2
2NO(g) + O2(g) ⟶ 2NO2(g); (II)
NO2 là một loại khí màu nâu chủ yếu gây ra lớp sương mù màu nâu đồ có thể nhìn thấy ở một số thành phố đồng dân cư. NO2 trong khi quyền phản ứng với nước để tạo thành nitric acid và nitrous acid:
2NO2(g) + H2O(l) ⇌ HNO3(aq) + HNO2(aq); (IIII)
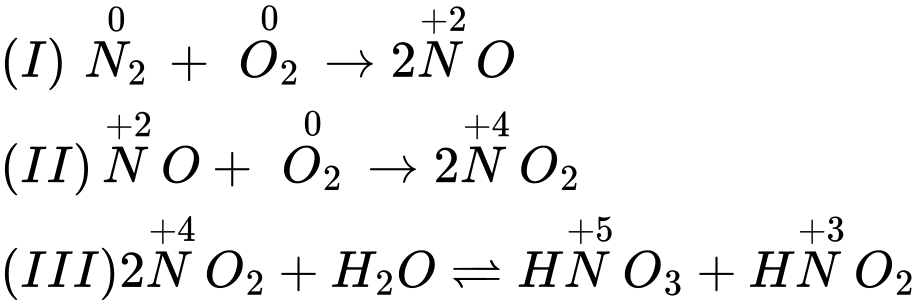
Phân tích các đáp án:
❌ A. O2 trong phản ứng (I) và (II) đóng vai trò là chất oxi hóa.
✔️ B. Phản ứng (III) thuộc loại phản ứng tự oxi hóa khử.
❌ C. Số oxi hóa cao nhất của N trong cả ba phản ứng là +6.
❌ D. Phản ứng thuận nghịch hiệu suất không đạt 100%.
⟹ Chọn đáp án B Đáp án: B
Số mol của NO2 là nNO2 = 5:46 = 0,1087 mol
Từ PTHH số mol của HNO3 và HNO2 lần lượt là 0,0543 mol
Đổi 1355 mL = 1,355 L
Nồng độ của HNO3 và HNO2 lần lượt là
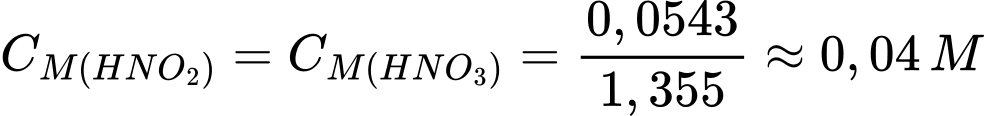
Do HNO2 không bền, bị phân hủy nên nồng độ < 0,04M
⟹ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
• Bước 1: Thu thập mẫu nước biển, lọc để loại bỏ các chất rắn không tan trong mẫu nước.
• Bước 2: Pha chế 250,0 mL dung dịch chuẩn AgNO3 0,25 М.
• Bước 3: Lấy chính xác 10,0 mL mẫu nước biển chuyển vào bình tam giác, sau đó thêm tiếp 1,0 mL dung dịch K2CrO4 vào bình.
• Bước 4: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch chuẩn AgNO3 0,25 М. Lặp lại thêm 2 lần, kết quả được cho trong bảng sau:
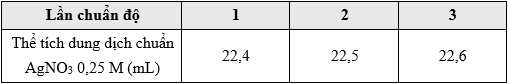
(Giả sử ngoài ion Cl–, các thành phần khác trong nước biển không tham gia phản ứng với ion Ag+).
✔️(a) – Đúng. Khối lượng chất tan trong dung dịch AgNO3 chuẩn là 10,625 gam.
Đổi 250 mL = 0,25 L
Khối lượng AgNO3 trong dung dịch là mAgNO3 = 0,25.0,25.170 = 10,625 g
✔️(b) – Đúng. Silver nitrate có tính chất rất nhạy cảm với ánh sáng mặt trời hoặc nguồn ánh sáng chói, phản ứng thủy phân sẽ xảy ra khi hóa chất này tiếp xúc với ánh sáng và dẫn đến sự hình thành hợp chất bạc oxide và nitric acid có màu đen hoặc nâu. Do đó, AgNO3 cần được bảo quản trong bao bì tối màu và tránh tiếp xúc với ánh sáng trực tiếp để hạn chế ảnh hưởng chất lượng của sản phẩm.
✔️(c) – Đúng. Điểm dừng chuẩn độ là khi xuất hiện kết tủa màu nâu đỏ bền của Ag2CrO4.
✔️(d) – Đúng. Lấy thể tích trung bình của dung dịch chuẩn AgNO3 từ đó xác định nồng độ của ion CI trong nước biển là khoảng 0,563 Μ
Thể tích trung bình AgNO3 dùng để chuẩn độ là
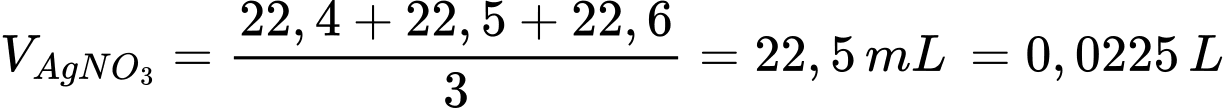
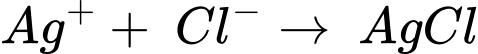
Số mol của AgNO3 là nAgNO3 = 0,0225.0,25 = 0,005625 mol
Đổi 10 mL = 0,01 M
Nồng độ Cl- trong nước biển là
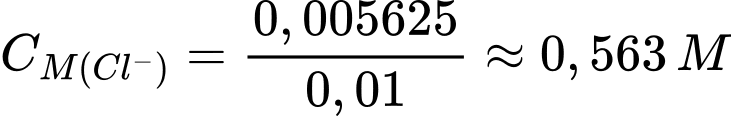
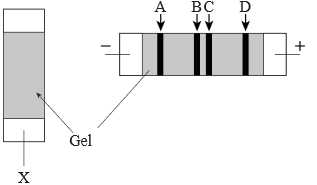
✔️(a) – Đúng. Tất cả các chất đều di chuyển về phía cực dương, tại môi trùng pH cao các amino acid tồn tại chủ yếu ở dạng điện tích âm nên di chuyển sang cực dương.
✔️(b) – Đúng. Vị trí đưa protein vào gel là ở chính giữa của tấm gel.
✔️(c) – Đúng. Có 4 chất đã bị tách ra khỏi hỗn hợp ban đầu, từ hình minh họa có thể thấy có 4 chất.
❌(d) – Sai. Chất A có tỉ lệ điện tích nhỏ nhất nhất và có thể có khối lượng lớn nhất trong tất cả các chất nguyên do là di chuyển chậm nhất trong các chất.
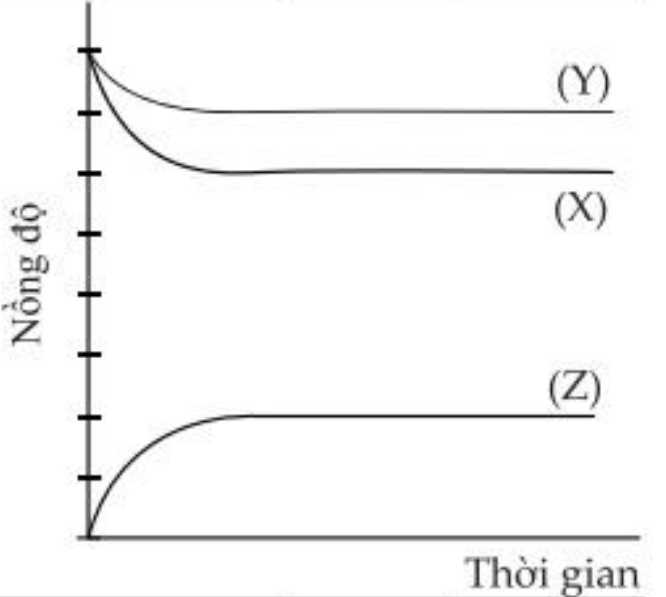
❌(a) – Sai. Phản ứng trên thuộc loại phản ứng thuận nghịch, từ đồ thị có thể thấy rằng sau phản thì nồng độ của các chất tham gia không giảm xuống 0 và không đổi sau thời gian, lúc đó phản ứng đạt trạng thái cân bằng.
✔️(b) – Đúng. Đường số (1) và (2) biểu diễn nồng độ của X và Y, nguyên nhân sau phản ứng nồng độ của X và Y giảm.
✔️(c) – Đúng. Theo phương trình phản ứng, tổng hệ số (a + b) là 3.
Từ đồ thị thấy rằng nồng độ X và Y giảm lần lượt là 1 và 2M, nồng độ Z tăng lên 2M
PTHH: X + 2Y → 2Z
Tổng a + b = 1 + 2 = 3.
❌(d) – Sai.
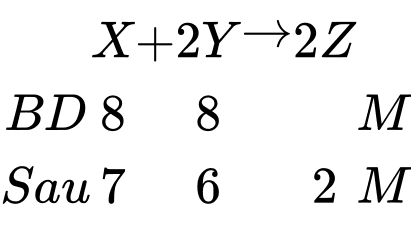
Tổng nồng độ các chất sau phản ứng là 7 + 6 + 2 ≠ 8 + 8
Bước 1: Thêm 2-3 giọt dung dịch NaOH 10%, sau đó thêm 3 – 4 giọt dung dịch CuSO4 2% vào cả hai ống nghiệm.
Bước 2: Thêm 2-3 giọt glycerol vào một ống nghiệm; 2 – 3 giọt ethanol vào ống nghiệm còn lại. Quan sát hiện tượng.
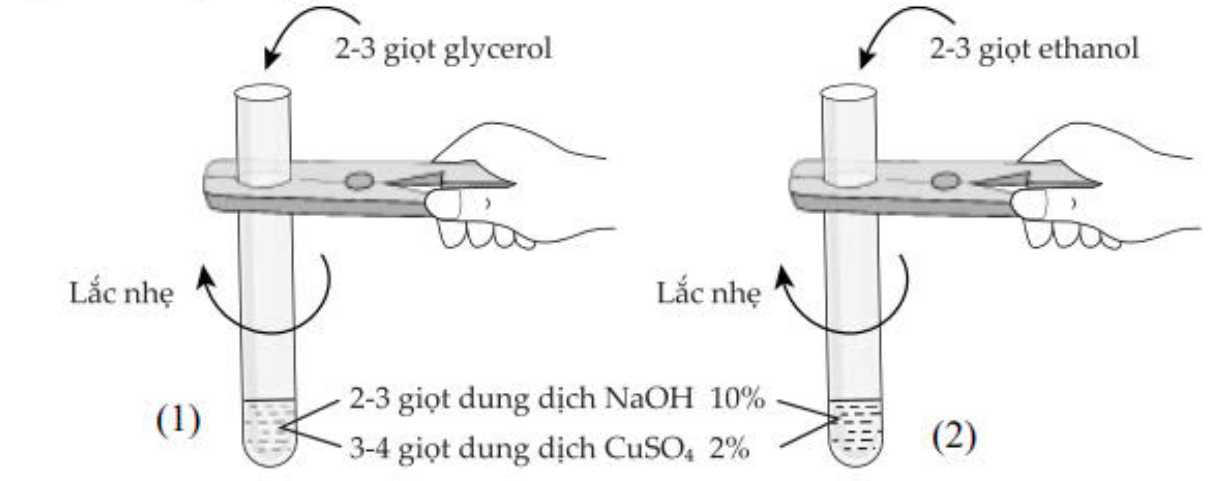
✔️(a) – Đúng. Sau bước 1 đều xuất hiện kết tủa Cu(OH)2 màu xanh trong cả 2 ống nghiệm
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
✔️(b) – Đúng. Các polyalcohol có các nhóm -OH liền kề nhau như ethylenee glycol, glycerol có thể tác dụng với copper (II) hydroxide tạo thành dung dịch màu xanh lam đậm.
C3H5(OH)3 + Cu(OH)2 → Cu(C3H5(OH)2O)2 + 2H2O
❌(c) – Sai. C2H5OH không có tính base.
✔️(d) – Đúng. Phản ứng chứng minh các alcohol có nhóm OH liền kề nhau sẽ hòa tan kết tủa Cu(OH)2
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
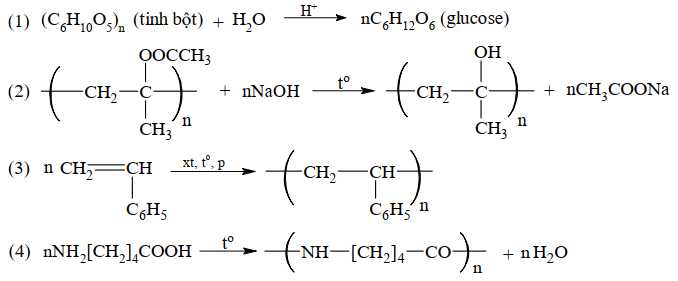
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi: phản ứng giữ nguyên mạch polymer, phản ứng cắt mạch polymer, phản ứng trùng hợp, phản ứng trùng ngưng và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
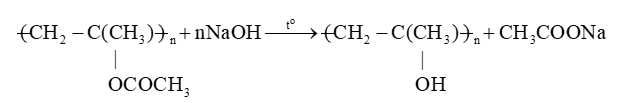
Phản ứng cắt mạch – Phản ứng số (1)
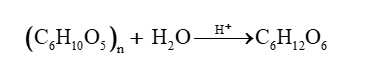
Phản ứng trùng hợp – Phản ứng số (3)
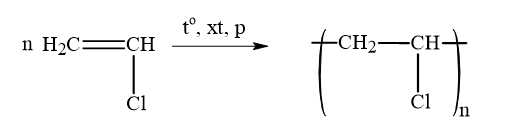
Phản ứng trùng ngưng – Phản ứng số (4)
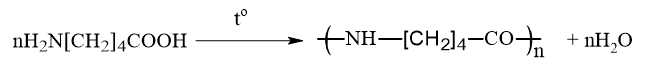
Thứ tự sắp xếp : 2134
⟹ Điền đáp án : 2134

Thể tích tấm huy chương trước khi mạ có V = π.42.0,3 = 15,072 cm3
Thể tích tấm huy chương sau khi mạ có:
V, = π.(4 + 0,001)².(0,3 + 0,001.2) = 15,18 cm3
Khối lượng bạc trên tấm huy chương là mAg = 10,8(15,18 – 15,072) = 1,1664 gam
Ta có:
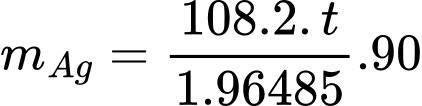
⟹ Điền đáp án : 10
(a) Hydrogen hóa hoàn toàn glucose tạo ra gluconic acid.
(b) Ở điều kiện thường, glucose và saccharose đều là những chất rắn, dễ tan trong nước.
(c) Cellulose trinitrate là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
(d) Amylopectin trong tinh bột chỉ có các liên kết α-1,4-glycoside.
(e) Saccharose bị hóa đen trong H2SO4 đặc.
(g) Trong công nghiệp dược phẩm, saccharose được dùng để pha chế thuốc.
Trong các phát biểu trên, số phát biểu đúng là
❌(a) – Sai. Hydrogen hóa hoàn toàn glucose tạo ra sobitol.
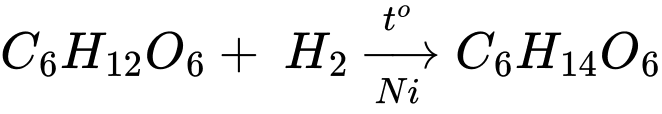
✔️(b) – Đúng. Ở điều kiện thường, glucose và saccharose đều là những chất rắn, dễ tan trong nước.
❌(c) – Sai. Cellulose trinitrate là nguyên liệu để chế tạo thuốc súng không khói.
❌(d) – Sai. Amylopectin phân nhánh, xoắn có liên kết
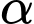 -1,4-glycoside và
-1,4-glycoside và 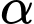 -1,6-glycoside (tạo nhánh).
-1,6-glycoside (tạo nhánh).✔️(e) – Đúng. Lúc đầu: C12H22O11 + H2SO4 → 12C(đen) + H2SO4.11H2O
Sau đó: C12H22O11 + 24H2SO4 → 12CO2↑ + 24SO2↑ + 35H2O
Khi nhỏ H2SO4 đặc vào saccharose, ta thấy đường nhanh chóng hóa đen, sau đó khối rắn tăng thể tích rất nhanh và thoát khí mùi hắc (SO2).
✔️(g) – Đúng.
Saccharose là chất rắn, vị ngọt, tan tốt trong nước. Có nhiều trong cây mía, củ cải đường và hoa thốt nốt, đường mía, đường thốt nốt, … Làm chất tạo ngọt trong sản xuất thực phẩm như bánh, kẹo, nước giải khát.
Có 3 phát biểu đúng.
⟹ Điền đáp án :3
- Để phân hủy 1 kg đá vôi (chứa CaCO3 và 4% tạp chất trơ) cần cung cấp một lượng nhiệt là 1800 kJ.
- Đốt cháy hoàn toàn 1 kg than đá giải phóng ra một lượng nhiệt là 27 000 kJ và có 30% lượng nhiệt bị thất thoát trong quá trình phân hủy đá vôi. Khối lượng (tính theo đơn vị tấn) than đá mà lò nung vôi đã sử dụng mỗi ngày là bao nhiêu (làm tròn đến hàng phần mười)?
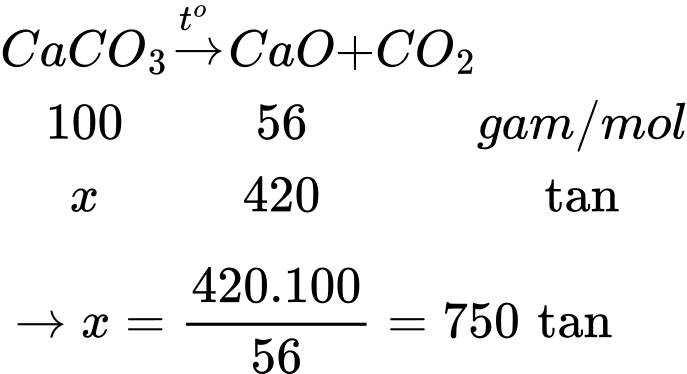
Khối lượng đá vôi là m = 750 ÷ 96% = 781,25 tấn =781250 kg
Phân hủy 1 kg đá vôi cần 1800 kJ
1 kg than đá tỏa ra 27000 kJ
Khối lượng than đá cần để sản xuất 420 tấn vôi sống là
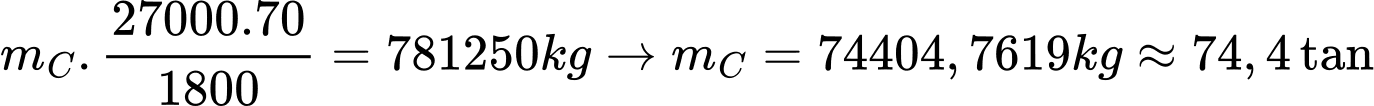
⟹ Điền đáp án : 74,4
HCOOCH3; CH3CHO; CH3OH; CH3COOC2H5; (CH3)2NH; CH3COOH; HCOOCH3; C2H6.
Số hợp chất có thể tạo liên kết hydrogen liên phân tử là
Điền đáp án: [...........]
HD: Khái niệm: "liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử khác có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng."
Để gọi là liên phân tử thì phân tử đang xét phải chứa đồng thời "nguyên tử H" và "nguyên tử khác". Thêm một lưu ý nữa; carbon là nguyên tử có độ âm điện không lớn, nên các H mà liên kết với carbon không đủ điều kiện.
Một cách trực quan, phân tử xét phải vừa chứa phần δ+ và δ–.
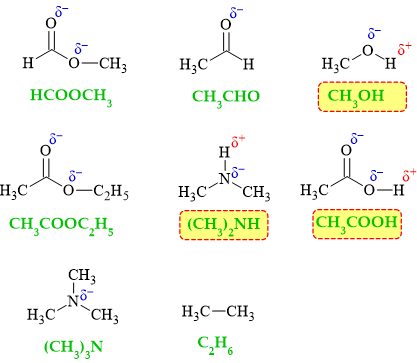
⇒ Có 3chất trong dãy thỏa mãn yêu cầu
⟹ Điền đáp án: 3
CH4(g) + 2H2O(g)
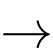 CO2(g) + 4H2(g) (1)
CO2(g) + 4H2(g) (1)Phản ứng tổng hợp ammonia:
N2(g) +3H2(g) ⇌ 2NH3(g) (2)
Để sản xuất một tấn khí ammonia cần lấy 842 m3 không khí (chứa 21,03% O2; 78,02% N2; còn lại là khí hiếm). Giả thiết phản ứng (1) xảy ra hoàn toàn và các thể tích khí xét ở cùng điều kiện. Hỏi cần phải lấy bao nhiêu m3 hơi nước để có đủ lượng hydrogen và nitrogen theo tỉ lệ 3 : 1 về thể tích dùng cho phản ứng tổng hợp ammonia (làm tròn đến hàng đơn vị).
Các khí được xét ở cùng điều kiện, thể tích khí tỉ lệ thuận với số mol
Thể tích khí N2 là VN2 = 842 × 78,02% = 656,8284 m3
Thể tích khí H2 cần thiết VH2 = 656,8284 × 3 = 1970,7852 m3
Từ PTHH thể tích hơi nước cần thiết là VH2O = 1970,7852 ÷ 2 ≈ 985 m3
⟹ Điền đáp án : 985