PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1 [706125]: So với nhiệt độ cần nung chảy phế liệu thép thì nhiệt độ cần nung chảy phế liệu nhôm
A, cao hơn.
B, thấp hơn.
C, xấp xỉ bằng.
D, cao hơn nhiều.
Phân tích các đáp án:
❌ A. Sai. Nhôm có nhiệt độ nóng chảy thấp hơn thép.
✔️ B. Đúng. Nhôm có nhiệt độ nóng chảy khoảng 660°C, trong khi thép có nhiệt độ nóng chảy khoảng 1375 -1540°C
❌ C. Sai. Nhiệt độ nóng chảy của nhôm và thép khác nhau rất nhiều.
❌ D. Sai. Nhôm có nhiệt độ nóng chảy thấp hơn thép.
⟹Chọn đáp án B Đáp án: B
❌ A. Sai. Nhôm có nhiệt độ nóng chảy thấp hơn thép.
✔️ B. Đúng. Nhôm có nhiệt độ nóng chảy khoảng 660°C, trong khi thép có nhiệt độ nóng chảy khoảng 1375 -1540°C
❌ C. Sai. Nhiệt độ nóng chảy của nhôm và thép khác nhau rất nhiều.
❌ D. Sai. Nhôm có nhiệt độ nóng chảy thấp hơn thép.
⟹Chọn đáp án B Đáp án: B
Câu 2 [706126]: Phát biểu nào sau đây là không đúng?
A, Kim loại dẻo là nhờ lực hút tĩnh điện giữa các cation kim loại và các electron hoá trị tự do.
B, Ở điều kiện thường, thuỷ ngân không có cấu trúc tinh thể nên tồn tại dạng lỏng.
C, Nhôm là kim loại có khối lượng riêng nhỏ, vừa dẫn điện tốt vừa dẫn nhiệt tốt.
D, Kim loại có vẻ sáng là do các cation phản xạ phần lớn các tia sáng nhìn thấy được.
Phân tích các đáp án:
✔️ A. Đúng. Tính dẻo của kim loại được giải thích bằng mô hình "biển electron tự do". Các electron tự do di chuyển tự do giữa các ion kim loại, tạo ra lực hút tĩnh điện giữ cho các ion liên kết với nhau. Khi có lực tác động, các lớp ion có thể trượt lên nhau mà không làm phá vỡ cấu trúc mạng tinh thể.
✔️ B. Đúng. Thủy ngân là kim loại duy nhất tồn tại ở trạng thái lỏng ở điều kiện thường. Điều này là do lực liên kết kim loại trong thủy ngân rất yếu, khiến cho các nguyên tử thủy ngân dễ dàng di chuyển và không tạo thành cấu trúc mạng tinh thể rắn.
✔️ C. Đúng. Nhôm có khối lượng riêng nhỏ (2,7 g/cm3), chỉ bằng khoảng 1/3 so với thép (7,85 g/cm3). Nhôm cũng là một chất dẫn điện và dẫn nhiệt tốt, chỉ sau bạc và đồng.
❌ D. Sai. Vẻ sáng của kim loại là do các electron tự do phản xạ phần lớn các tia sáng nhìn thấy được, không phải các cation.
⟹Chọn đáp án D Đáp án: D
✔️ A. Đúng. Tính dẻo của kim loại được giải thích bằng mô hình "biển electron tự do". Các electron tự do di chuyển tự do giữa các ion kim loại, tạo ra lực hút tĩnh điện giữ cho các ion liên kết với nhau. Khi có lực tác động, các lớp ion có thể trượt lên nhau mà không làm phá vỡ cấu trúc mạng tinh thể.
✔️ B. Đúng. Thủy ngân là kim loại duy nhất tồn tại ở trạng thái lỏng ở điều kiện thường. Điều này là do lực liên kết kim loại trong thủy ngân rất yếu, khiến cho các nguyên tử thủy ngân dễ dàng di chuyển và không tạo thành cấu trúc mạng tinh thể rắn.
✔️ C. Đúng. Nhôm có khối lượng riêng nhỏ (2,7 g/cm3), chỉ bằng khoảng 1/3 so với thép (7,85 g/cm3). Nhôm cũng là một chất dẫn điện và dẫn nhiệt tốt, chỉ sau bạc và đồng.
❌ D. Sai. Vẻ sáng của kim loại là do các electron tự do phản xạ phần lớn các tia sáng nhìn thấy được, không phải các cation.
⟹Chọn đáp án D Đáp án: D
Câu 3 [706127]: Magnesium là kim loại có độ hoạt động hoá học mạnh hơn nhôm (aluminium) thì
A, 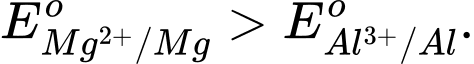
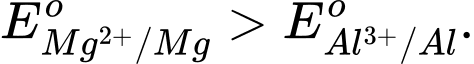
B, 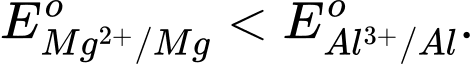
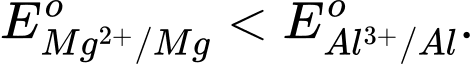
C, 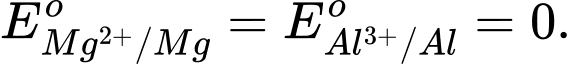
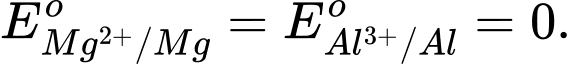
D, 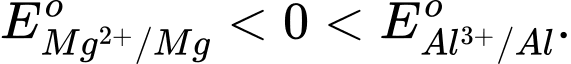
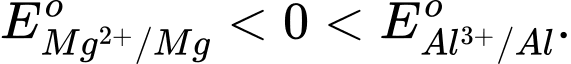
Phân tích các đáp án:
❌ A. Sai. Vì Mg hoạt động hóa học mạnh hơn Al nên thế điện cực chuẩn của Mg phải nhỏ hơn Al.
✔️ B. Đúng. Mg hoạt động hóa học mạnh hơn Al nên thế điện cực chuẩn của Mg nhỏ hơn Al.
❌ C. Sai. Thế điện cực chuẩn của Mg và Al khác 0.
❌ D. Sai. Mặc dù đúng là Mg có tính khử mạnh hơn Al, điều này không có nghĩa là thế điện cực chuẩn của Al luôn dương.
⟹Chọn đáp án B Đáp án: B
❌ A. Sai. Vì Mg hoạt động hóa học mạnh hơn Al nên thế điện cực chuẩn của Mg phải nhỏ hơn Al.
✔️ B. Đúng. Mg hoạt động hóa học mạnh hơn Al nên thế điện cực chuẩn của Mg nhỏ hơn Al.
❌ C. Sai. Thế điện cực chuẩn của Mg và Al khác 0.
❌ D. Sai. Mặc dù đúng là Mg có tính khử mạnh hơn Al, điều này không có nghĩa là thế điện cực chuẩn của Al luôn dương.
⟹Chọn đáp án B Đáp án: B
Câu 4 [706128]: Cho 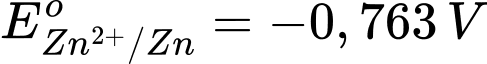 và
và 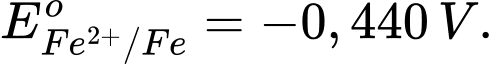 Sức điện động chuẩn của một pin Galvani được tạo thành từ hai cặp oxi hoá – khử Zn2+/Zn và Fe2+/Fe là
Sức điện động chuẩn của một pin Galvani được tạo thành từ hai cặp oxi hoá – khử Zn2+/Zn và Fe2+/Fe là
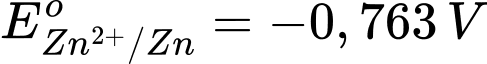 và
và 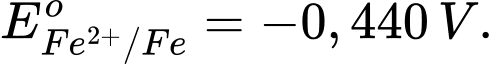 Sức điện động chuẩn của một pin Galvani được tạo thành từ hai cặp oxi hoá – khử Zn2+/Zn và Fe2+/Fe là
Sức điện động chuẩn của một pin Galvani được tạo thành từ hai cặp oxi hoá – khử Zn2+/Zn và Fe2+/Fe là A, –0,323 V.
B, –1,170 V.
C, 0,323 V.
D, 1,170 V.
Phản ứng tại các điện cực:
Tại cathode (khử) : Fe2+ + 2e → Fe
Tại anode (oxi hóa) : Zn → Zn2+ + 2e
Eopin = Eo cathode - Eo anode
= (-0,440 V) - (-0,763 V) = 0,323 V
⟹Chọn đáp án C Đáp án: C
Tại cathode (khử) : Fe2+ + 2e → Fe
Tại anode (oxi hóa) : Zn → Zn2+ + 2e
Eopin = Eo cathode - Eo anode
= (-0,440 V) - (-0,763 V) = 0,323 V
⟹Chọn đáp án C Đáp án: C
Câu 5 [706129]: Cho một mẩu sodium nhỏ vào cốc nước có chứa vài giọt phenolphthalein.
Phát biểu nào sau đây không đúng?
Phát biểu nào sau đây không đúng?
A, Sodium bị hoà tan nhanh chóng là do hiện tượng ăn mòn điện hoá.
B, Cốc nước chuyển từ không màu sang màu hồng.
C, Khí thoát ra trong thí nghiệm là một khí dễ cháy.
D, Nếu thay mẩu sodium bằng mẩu lithium cùng kích thước thì phản ứng diễn ra chậm hơn.
Phân tích các đáp án :
❌ A. Sai. Sodium phản ứng mạnh với nước theo phản ứng hóa học trực tiếp, không phải là ăn mòn điện hóa. Ăn mòn điện hóa thường xảy ra khi có sự tiếp xúc giữa hai kim loại khác nhau trong môi trường điện ly.
✔️ B. Đúng. Phản ứng của sodium với nước tạo ra NaOH, làm tăng pH của dung dịch. Phenolphthalein là chất chỉ thị pH, chuyển màu hồng trong môi trường kiềm.
✔️ C. Đúng. Khí thoát ra là hydrogen (H2), một khí dễ cháy.
✔️ D. Đúng. Lithium phản ứng với nước chậm hơn sodium do tính hoạt động hóa học của lithium yếu hơn sodium.
⟹Chọn đáp án A Đáp án: A
❌ A. Sai. Sodium phản ứng mạnh với nước theo phản ứng hóa học trực tiếp, không phải là ăn mòn điện hóa. Ăn mòn điện hóa thường xảy ra khi có sự tiếp xúc giữa hai kim loại khác nhau trong môi trường điện ly.
✔️ B. Đúng. Phản ứng của sodium với nước tạo ra NaOH, làm tăng pH của dung dịch. Phenolphthalein là chất chỉ thị pH, chuyển màu hồng trong môi trường kiềm.
✔️ C. Đúng. Khí thoát ra là hydrogen (H2), một khí dễ cháy.
✔️ D. Đúng. Lithium phản ứng với nước chậm hơn sodium do tính hoạt động hóa học của lithium yếu hơn sodium.
⟹Chọn đáp án A Đáp án: A
Câu 6 [706130]: Khi nấu nước lâu ngày sẽ hiện tượng có mảng bám trắng bám vào ấm đun, nguyên nhân đó chính là do nước bị cứng đã tạo ra lớp cặn đó. Để làm tan bớt lớp cặn trong các dụng cụ đun và chứa nước, người ta thường sử dụng dung dịch nào sau đây?
A, Muối sinh lí.
B, Nước oxi già.
C, Giấm ăn.
D, Cồn 90 °.
Phân tích các đáp án :
❌A. Sai. Muối sinh lí là dung dịch NaCl 0,9%, có tính trung tính. Muối sinh lí không có khả năng hòa tan cặn (CaCO3) hoặc (MgCO3), là những thành phần chính của cặn trong ấm đun nước.
❌B. Sai. Nước oxi già (H2O2) là chất oxi hóa mạnh, có thể phân hủy một số chất hữu cơ, nhưng không có khả năng hòa tan cặn.
✔️C. Đúng. Giấm ăn là dung dịch (CH3COOH) loãng. Acid có khả năng phản ứng với cặn, hòa tan chúng thành các muối tan.
❌D. Sai. Cồn (ethanol) là dung môi hữu cơ, không có khả năng hòa tan cặn.
⟹Chọn đáp án C Đáp án: C
❌A. Sai. Muối sinh lí là dung dịch NaCl 0,9%, có tính trung tính. Muối sinh lí không có khả năng hòa tan cặn (CaCO3) hoặc (MgCO3), là những thành phần chính của cặn trong ấm đun nước.
❌B. Sai. Nước oxi già (H2O2) là chất oxi hóa mạnh, có thể phân hủy một số chất hữu cơ, nhưng không có khả năng hòa tan cặn.
✔️C. Đúng. Giấm ăn là dung dịch (CH3COOH) loãng. Acid có khả năng phản ứng với cặn, hòa tan chúng thành các muối tan.
❌D. Sai. Cồn (ethanol) là dung môi hữu cơ, không có khả năng hòa tan cặn.
⟹Chọn đáp án C Đáp án: C
Câu 7 [706131]: Theo thuyết liên kết hoá trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là
A, Liên kết ion.
B, Liên kết cộng hoá trị theo kiểu cho - nhận.
C, Tương tác van der Waals.
D, Liên kết hydrogen.
Phân tích các đáp án :
❌ A. Sai. Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Trong phức chất, tương tác giữa phối tử và nguyên tử trung tâm không phải là liên kết ion
✔️ B. Đúng. Theo thuyết liên kết hóa trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là liên kết cộng hóa trị theo kiểu cho - nhận. Phối tử cung cấp cặp electron không chia cho nguyên tử trung tâm.
❌ C. Sai. Tương tác Vander Waals là tương tác yếu giữa các phân tử, không phải là tương tác chính trong phức chất.
❌ D. Sai. Liên kết hydrogen là liên kết giữa nguyên tử hydrogen liên kết với nguyên tử có độ âm điện lớn (như O, N, F) và nguyên tử có độ âm điện lớn khác. Liên kết hydrogen không phải là tương tác chính trong phức chất.
⟹Chọn đáp án B Đáp án: B
❌ A. Sai. Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Trong phức chất, tương tác giữa phối tử và nguyên tử trung tâm không phải là liên kết ion
✔️ B. Đúng. Theo thuyết liên kết hóa trị, tương tác giữa phối tử và nguyên tử trung tâm trong phức chất là liên kết cộng hóa trị theo kiểu cho - nhận. Phối tử cung cấp cặp electron không chia cho nguyên tử trung tâm.
❌ C. Sai. Tương tác Vander Waals là tương tác yếu giữa các phân tử, không phải là tương tác chính trong phức chất.
❌ D. Sai. Liên kết hydrogen là liên kết giữa nguyên tử hydrogen liên kết với nguyên tử có độ âm điện lớn (như O, N, F) và nguyên tử có độ âm điện lớn khác. Liên kết hydrogen không phải là tương tác chính trong phức chất.
⟹Chọn đáp án B Đáp án: B
Câu 8 [706132]: M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
• Nguyên tử M có 1 electron ở lớp ngoài cùng.
• Trong hợp chất, số oxi hoá phổ biến của nguyên tố M là +2.
M là nguyên tố nào sau đây?
• Nguyên tử M có 1 electron ở lớp ngoài cùng.
• Trong hợp chất, số oxi hoá phổ biến của nguyên tố M là +2.
M là nguyên tố nào sau đây?
A, Fe.
B, Ni.
C, Mn.
D, Cu.
- Kim loại chuyển tiếp dãy thứ nhất: Điều này giới hạn các nguyên tố M trong dãy từ Sc (Z=21) đến Zn (Z=30).
- Nguyên tử M có 1 electron ở lớp ngoài cùng: Điều này thường gặp ở các kim loại nhóm IB và một số kim loại nhóm VIB.
- Số oxi hóa phổ biến của M là +2: Điều này loại trừ một số kim loại như Mn (số oxi hóa phổ biến +2, +4, +7), Fe (số oxi hóa phổ biến +2, +3), Ni (số oxi hóa phổ biến +2, +3).
Phân tích các đáp án:
❌ A. Cấu hình electron: [Ar] 3d64s2. Fe có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Fe là +2 và +3.
❌ B. Cấu hình electron: [Ar] 3d84s2. Ni có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Ni là +2 và +3.
❌ C. Cấu hình electron: [Ar] 3d54s2. Mn có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Mn là +2, +4, +7.
✔️ D. Cấu hình electron: [Ar] 3d104s1. Cu có 1 electron ở lớp ngoài cùng , thỏa mãn điều kiện. Số oxi hóa phổ biến của Cu là +1 và +2.
⟹Chọn đáp án D Đáp án: D
- Nguyên tử M có 1 electron ở lớp ngoài cùng: Điều này thường gặp ở các kim loại nhóm IB và một số kim loại nhóm VIB.
- Số oxi hóa phổ biến của M là +2: Điều này loại trừ một số kim loại như Mn (số oxi hóa phổ biến +2, +4, +7), Fe (số oxi hóa phổ biến +2, +3), Ni (số oxi hóa phổ biến +2, +3).
Phân tích các đáp án:
❌ A. Cấu hình electron: [Ar] 3d64s2. Fe có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Fe là +2 và +3.
❌ B. Cấu hình electron: [Ar] 3d84s2. Ni có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Ni là +2 và +3.
❌ C. Cấu hình electron: [Ar] 3d54s2. Mn có 2 electron ở lớp ngoài cùng , không thỏa mãn điều kiện. Số oxi hóa phổ biến của Mn là +2, +4, +7.
✔️ D. Cấu hình electron: [Ar] 3d104s1. Cu có 1 electron ở lớp ngoài cùng , thỏa mãn điều kiện. Số oxi hóa phổ biến của Cu là +1 và +2.
⟹Chọn đáp án D Đáp án: D
Câu 9 [575735]: Sulfur được sử dụng trong quá trình lưu hoá cao su, làm chất diệt nấm và có trong thuốc nổ đen. Sulfur là nguyên tố nhóm VIA. Công thức oxide cao nhất của sulfur là
A, SO2.
B, SO3.
C, SO6.
D, SO4.
Sulfur là nguyên tố nhóm VIA, có 6 electron lớp ngoài cùng.
Số oxi hóa cao nhất của nguyên tố nhóm VIA là +6.
Oxide cao nhất của sulfur phải có số oxi hóa của S là +6.
Phân tích các đáp án :
❌A. Sai. SO2 là một oxide của sulfur, nhưng không phải là oxide cao nhất. Số oxi hóa của S trong SO2 là +4.
✔️B. Đúng. SO3 là oxide cao nhất của sulfur. Số oxi hóa của S trong SO3 là +6, bằng với số oxi hóa cao nhất của nguyên tố nhóm VIA.
❌C, D. Sai. SO6 và SO4 không tồn tại ở dạng phân tử.
⟹Chọn đáp án B Đáp án: B
Số oxi hóa cao nhất của nguyên tố nhóm VIA là +6.
Oxide cao nhất của sulfur phải có số oxi hóa của S là +6.
Phân tích các đáp án :
❌A. Sai. SO2 là một oxide của sulfur, nhưng không phải là oxide cao nhất. Số oxi hóa của S trong SO2 là +4.
✔️B. Đúng. SO3 là oxide cao nhất của sulfur. Số oxi hóa của S trong SO3 là +6, bằng với số oxi hóa cao nhất của nguyên tố nhóm VIA.
❌C, D. Sai. SO6 và SO4 không tồn tại ở dạng phân tử.
⟹Chọn đáp án B Đáp án: B
Câu 10 [304804]: Mùi thơm trong nhiều loại hoa quả, tinh dầu thực vật, ... là mùi của ester. Để có ester dùng làm nguyên liệu - hương liệu, trước hết người ta thu hái, đem thái nhỏ và ngâm với nước. Cần sử dụng phương pháp nào sau đây để tách riêng ester ra khỏi hỗn hợp?
A, Chưng cất.
B, Chiết.
C, Kết tinh.
D, Lọc.
Ester tan rất ít hoặc không tan trong nước nên hỗn hợp sẽ tách làm hai lớp. Lớp trên chứa ester vì ester có khối lượng riêng nhỏ hơn, còn lớp bên dưới gồm nước và các chất tan trong nước nếu có. ⇝ Đưa hỗn hợp vào trong phễu chiết, tiến hành loại bỏ lớp phía dưới sẽ thu được lớp ester phía bên trên.
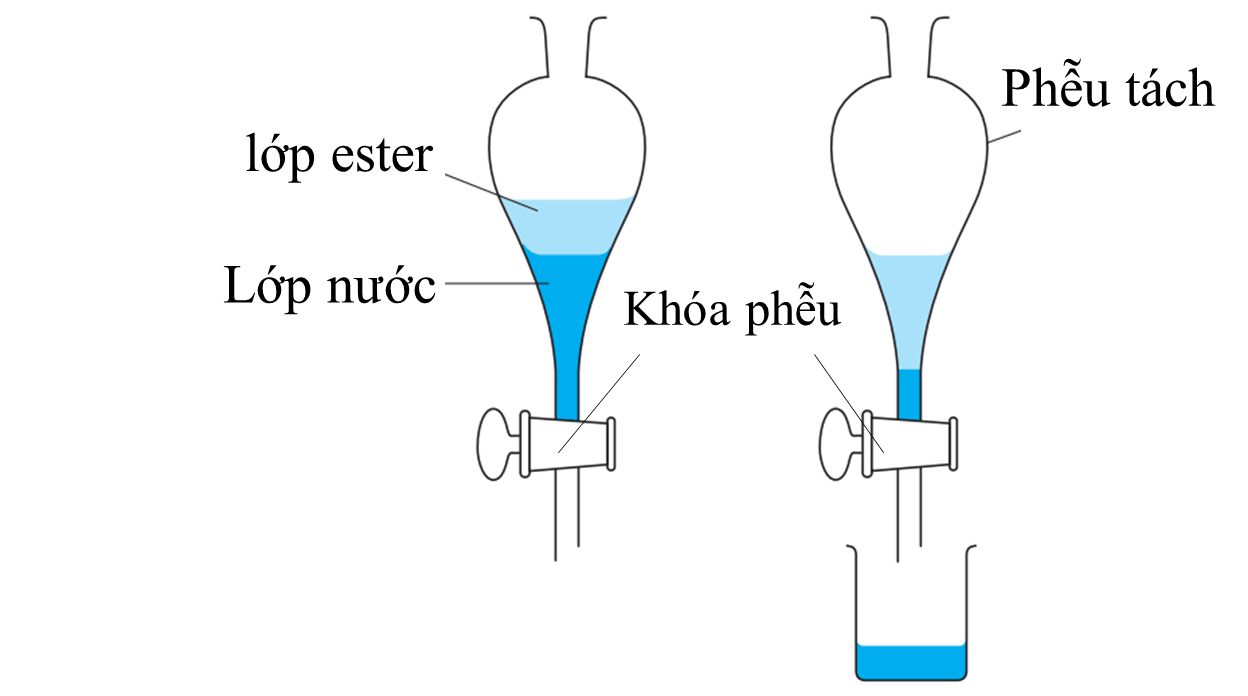
☆ Các phương pháp còn lại có thể dùng để:
✨ Chưng cất: tách 2 chất lỏng hòa tan vào nhau nhưng có nhiệt độ sôi khác nhau, ví dụ chưng cất rượu.
✨ Kết tinh: có thể tách các chất kết tinh ở những nhiệt độ khác nhau.
✨ Lọc để loại bỏ chất rắn ra khỏi dung dịch...
⟹ Chọn đáp án B Đáp án: B

☆ Các phương pháp còn lại có thể dùng để:
✨ Chưng cất: tách 2 chất lỏng hòa tan vào nhau nhưng có nhiệt độ sôi khác nhau, ví dụ chưng cất rượu.
✨ Kết tinh: có thể tách các chất kết tinh ở những nhiệt độ khác nhau.
✨ Lọc để loại bỏ chất rắn ra khỏi dung dịch...
⟹ Chọn đáp án B Đáp án: B
Câu 11 [706133]: Xà phòng là hỗn hợp các muối sodium hoặc potassium của acid béo và có thể thêm vào các chất phụ gia. Chất nào sau đây không nên thêm vào?
A, sodium hydroxide.
B, chất độn.
C, chất tạo màu và chất tạo hương.
D, chất dưỡng da và chất diệt khuẩn.
- Xà phòng là muối của acid béo và kim loại kiềm (sodium hoặc potassium).
- Xà phòng có tính kiềm, nhưng độ pH phải được kiểm soát để không gây kích ứng da.
- Việc thêm NaOH vào xà phòng sẽ làm tăng độ pH quá mức, gây hại cho da.
- Các chất phụ gia khác như chất độn, chất tạo màu, chất tạo hương, chất dưỡng da, chất diệt khuẩn có thể được thêm vào xà phòng, nhưng phải đảm bảo an toàn cho da.
Phân tích các đáp án :
❌A. Sai. Sodium hydroxide (NaOH) là một chất kiềm mạnh. Nếu thêm NaOH vào xà phòng, nó sẽ làm tăng độ pH của xà phòng, khiến xà phòng trở nên quá kiềm và gây kích ứng da.
✔️B. Đúng. Chất độn (như talc, đất sét) có thể được thêm vào xà phòng để tăng khối lượng và giảm giá thành. Tuy nhiên, nếu thêm quá nhiều chất độn, xà phòng sẽ giảm khả năng tạo bọt và làm sạch.
✔️C. Đúng. Chất tạo màu và chất tạo hương thường được thêm vào xà phòng để tăng tính thẩm mỹ và tạo mùi thơm.
✔️D. Đúng. Chất dưỡng da (như glycerin, dầu thực vật) và chất diệt khuẩn (như triclosan) có thể được thêm vào xà phòng để tăng khả năng dưỡng ẩm và diệt khuẩn.
⟹Chọn đáp án A Đáp án: A
- Xà phòng có tính kiềm, nhưng độ pH phải được kiểm soát để không gây kích ứng da.
- Việc thêm NaOH vào xà phòng sẽ làm tăng độ pH quá mức, gây hại cho da.
- Các chất phụ gia khác như chất độn, chất tạo màu, chất tạo hương, chất dưỡng da, chất diệt khuẩn có thể được thêm vào xà phòng, nhưng phải đảm bảo an toàn cho da.
Phân tích các đáp án :
❌A. Sai. Sodium hydroxide (NaOH) là một chất kiềm mạnh. Nếu thêm NaOH vào xà phòng, nó sẽ làm tăng độ pH của xà phòng, khiến xà phòng trở nên quá kiềm và gây kích ứng da.
✔️B. Đúng. Chất độn (như talc, đất sét) có thể được thêm vào xà phòng để tăng khối lượng và giảm giá thành. Tuy nhiên, nếu thêm quá nhiều chất độn, xà phòng sẽ giảm khả năng tạo bọt và làm sạch.
✔️C. Đúng. Chất tạo màu và chất tạo hương thường được thêm vào xà phòng để tăng tính thẩm mỹ và tạo mùi thơm.
✔️D. Đúng. Chất dưỡng da (như glycerin, dầu thực vật) và chất diệt khuẩn (như triclosan) có thể được thêm vào xà phòng để tăng khả năng dưỡng ẩm và diệt khuẩn.
⟹Chọn đáp án A Đáp án: A
Câu 12 [706134]: Bromelain là một nhóm các enzyme có tác dụng thuỷ phân protein. Trong Bromelain có một enzymer thành phần (kí hiệu là X), nó được sử dụng trong mỹ phẩm, làm thuốc bôi ngoài da và làm thuốc. X có công thức cấu tạo như hình vẽ bên dưới:
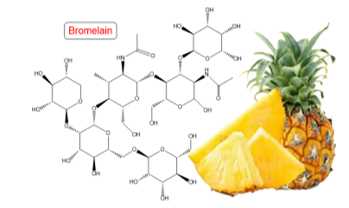
Phát biểu nào dưới đây không đúng?

Phát biểu nào dưới đây không đúng?
A, Thịt bò ướp với nước ép dứa khi nấu sẽ nhanh mềm hơn.
B, a mol X tác dụng với 2a mol NaOH trong dung dịch.
C, Phân tử X có chứa liên kết peptide (–CO–NH).
D, Cho 1 mol phân tử X phản ứng với kim loại Na thì thu được 8 mol H2.
Phân tích các đáp án:
✔️ A. Đúng. Bromelain là enzyme thủy phân protein, có trong dứa. Khi ướp thịt bò với nước ép dứa, bromelain sẽ phân giải protein trong thịt, làm thịt mềm hơn.
✔️ B. Đúng. X có chứa 2 liên kết amide nên sẽ phản ứng được với dung dịch NaOH. Vậy a mol X tác dụng với 2a mol NaOH trong dung dịch.
❌ C. Sai. công thức cấu tạo của X, có liên kết amide (-CO-NH-).
✔️ D. Đúng. X có 16 nhóm -OH , tương ứng với 8 mol H2 .
⟹Chọn đáp án C Đáp án: C
✔️ A. Đúng. Bromelain là enzyme thủy phân protein, có trong dứa. Khi ướp thịt bò với nước ép dứa, bromelain sẽ phân giải protein trong thịt, làm thịt mềm hơn.
✔️ B. Đúng. X có chứa 2 liên kết amide nên sẽ phản ứng được với dung dịch NaOH. Vậy a mol X tác dụng với 2a mol NaOH trong dung dịch.
❌ C. Sai. công thức cấu tạo của X, có liên kết amide (-CO-NH-).
✔️ D. Đúng. X có 16 nhóm -OH , tương ứng với 8 mol H2 .
⟹Chọn đáp án C Đáp án: C
Câu 13 [308360]: Khi đun nóng dung dịch đường saccharose có xúc tác acid vô cơ ta được dung dịch chứa
A, glucose và maltose.
B, glucose và glycogen.
C, fructose và maltose.
D, glucose và fructose.
Saccharose cấu tạo từ glucose và fructose nên thủy phân ta thu được tương ứng sản phẩm là glucose và fructose.
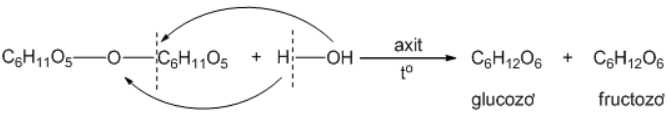
⟹Chọn đáp án D. Đáp án: D

⟹Chọn đáp án D. Đáp án: D
Câu 14 [310491]:
Polymer dùng để sản xuất tơ lapsan có cấu tạo như sau: 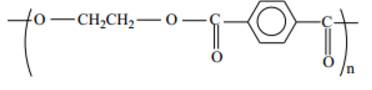
Tên gọi của polymer trên là
A, polyacrylonitrile.
B, poly(hexamethylene adipamide).
C, poly(ethylene terephthalate).
D, polycaproamide.
- Khi tiến hành đồng trùng ngưng ethylene glycol và terephthalic acid thu được polymer dùng để sản xuất tơ lapsan (poly(ethylene terephthalate))
- Polyethylene terephthalate, viết tắt là PET, PETE hay PETP, PET-P, là loại nhựa polymer nhiệt nhôm phổ biến nhất của polyester và được sử dụng trong sợi may quần áo, hộp đựng chất lỏng và thực phẩm, khuôn đúc nhựa và kết hợp với sợi thủy tinh sản xuất nhựa kỹ thuật.
⟹Chọn đáp án C Đáp án: C
- Polyethylene terephthalate, viết tắt là PET, PETE hay PETP, PET-P, là loại nhựa polymer nhiệt nhôm phổ biến nhất của polyester và được sử dụng trong sợi may quần áo, hộp đựng chất lỏng và thực phẩm, khuôn đúc nhựa và kết hợp với sợi thủy tinh sản xuất nhựa kỹ thuật.
⟹Chọn đáp án C Đáp án: C
Sử dụng thông tin ở bảng dưới đây để trả lời các câu 15 – 16:
Cho bảng tín hiệu đặc trưng của các nhóm chức trên phổ hồng ngoại IR:
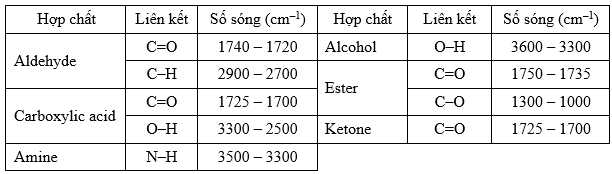

Câu 15 [706135]: Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không có hấp thụ ở vùng 1750 – 1700 cm–1?
A, Alcohol.
B, Ketone.
C, Ester.
D, Aldehyde.
Phân tích các đáp án:
❌ A. Alcohol có nhóm chứa OH, liên kết O-H số sóng hấp thụ đặc trưng 3650 - 3200 cm-1
✔️ B. Keton có nhóm chứa C=O, liên kết C=O số sóng hấp thụ đặc trưng 1740 - 1670 cm-1
✔️ C. Ester có nhóm chứa - COO, liên kết C=O và C-O số sóng hấp thụ đặc trưng 1750-1715 cm-1 và 1300-1000 cm-1
✔️ D. Aldehyde có nhóm chứa - CHO, liên kết C=O và C-H số sóng hấp thụ đặc trưng 1740-1700cm-1 và 2900-2700 cm-1
⟹ Chọn đáp án A Đáp án: A
❌ A. Alcohol có nhóm chứa OH, liên kết O-H số sóng hấp thụ đặc trưng 3650 - 3200 cm-1
✔️ B. Keton có nhóm chứa C=O, liên kết C=O số sóng hấp thụ đặc trưng 1740 - 1670 cm-1
✔️ C. Ester có nhóm chứa - COO, liên kết C=O và C-O số sóng hấp thụ đặc trưng 1750-1715 cm-1 và 1300-1000 cm-1
✔️ D. Aldehyde có nhóm chứa - CHO, liên kết C=O và C-H số sóng hấp thụ đặc trưng 1740-1700cm-1 và 2900-2700 cm-1
⟹ Chọn đáp án A Đáp án: A
Câu 16 [706136]: Tiến hành đo phổ MS và phổ IR của một hợp chất X, kết quả được cho như sau:
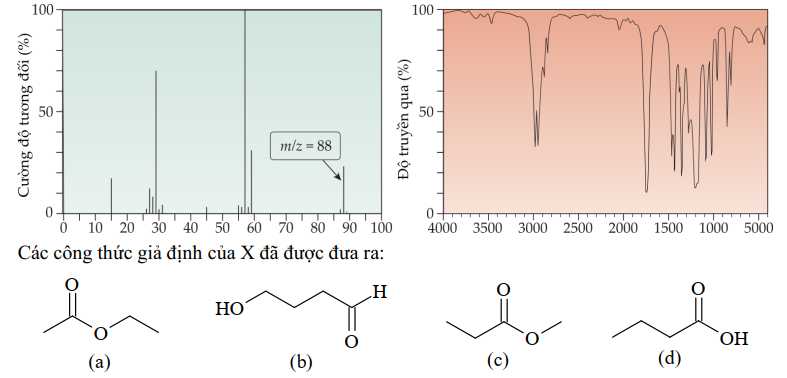
Từ các kết quả đo phổ MS và phổ IR của một hợp chất X, có thể loại bỏ đi được trường hợp giả định nào sau đây?

Từ các kết quả đo phổ MS và phổ IR của một hợp chất X, có thể loại bỏ đi được trường hợp giả định nào sau đây?
A, (a), (b).
B, (b), (d).
C, (a), (b), (c).
D, (a), (c), (d).
Từ phổ khối lượng, phân tử khối của X là 88 amu.
Từ phổ IR, có tín hiệu được trưng trong khoảng 1700 cm-1 cho liên kết C=O
Không có tín hiệu đặc trưng cho liên kết OH (alcohol) 3600 – 3300 cm-1 và OH (carboxylic acid) 3300 – 2500 cm-1
Các trường hợp giả định có thể bỏ qua là
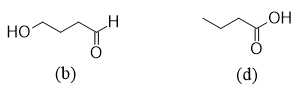
⟹ Chọn đáp án B Đáp án: B
Từ phổ IR, có tín hiệu được trưng trong khoảng 1700 cm-1 cho liên kết C=O
Không có tín hiệu đặc trưng cho liên kết OH (alcohol) 3600 – 3300 cm-1 và OH (carboxylic acid) 3300 – 2500 cm-1
Các trường hợp giả định có thể bỏ qua là
⟹ Chọn đáp án B Đáp án: B
Câu 17 [308298]: Để chứng minh trong phân tử của glucose có nhiều nhóm hydroxy, người ta cho dung dịch glucose phản ứng với
A, Kim loại Na.
B, Cu(OH)2 ở nhiệt độ thường.
C, AgNO3 (hoặc Ag2O) trong dung dịch NH3, đun nóng.
D, Cu(OH)2 trong NaOH, đun nóng.
Phân tích các đáp án:
❌ A. với kim loại Na: chỉ cần 1 nhóm OH + Na → ONa + ½H2↑ nên không chứng minh nó có nhiều nhóm được.
✔️ B. Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam đặc trưng thì yêu cầu cần có ít nhất 2 nhóm OH liền kề.
❌ C. AgNO3/NH3: thuốc thử Tollens - chứng minh nhóm chức aldehyde CHO bằng kết tủa Ag trắng bạc.
❌ D. Cu(OH)2 đun nóng tạo kết tủa Cu2O màu đỏ gạch cũng chứng minh nhóm chức CHO.
⟹ Chọn đáp án B Đáp án: B
❌ A. với kim loại Na: chỉ cần 1 nhóm OH + Na → ONa + ½H2↑ nên không chứng minh nó có nhiều nhóm được.
✔️ B. Cu(OH)2 ở nhiệt độ thường tạo dung dịch màu xanh lam đặc trưng thì yêu cầu cần có ít nhất 2 nhóm OH liền kề.
❌ C. AgNO3/NH3: thuốc thử Tollens - chứng minh nhóm chức aldehyde CHO bằng kết tủa Ag trắng bạc.
❌ D. Cu(OH)2 đun nóng tạo kết tủa Cu2O màu đỏ gạch cũng chứng minh nhóm chức CHO.
⟹ Chọn đáp án B Đáp án: B
Câu 18 [308567]: Nhúng giấy quỳ tím vào dung dịch methylamine, màu quỳ tím chuyển thành
A, xanh.
B, đỏ.
C, vàng.
D, tím.
Methylamine có tính base yếu nên sẽ làm quỳ tím chuyển thành màu xanh.
⟹ Chọn đáp án A Đáp án: A
⟹ Chọn đáp án A Đáp án: A
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai
Câu 19 [706137]: Dạng tồn tại và quá trình phân li ion H+ của amino acid alanine được biểu diễn như sau:
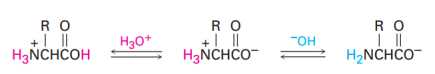
Tại các giá trị pH sẽ tồn tại các dạng tương ứng của amino acid như sơ đồ dưới đây:
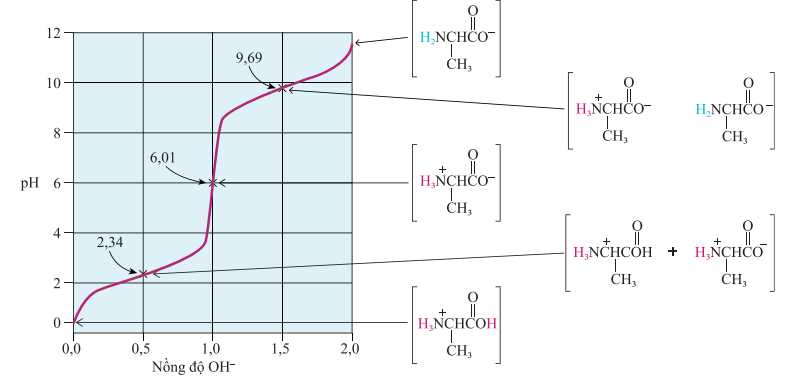
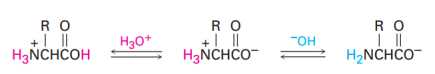
Tại các giá trị pH sẽ tồn tại các dạng tương ứng của amino acid như sơ đồ dưới đây:

Phân tích các phát biểu:
✔️Đúng. a. Tại pH = 0 môi trường acid mạnh, nhóm COOH và NH2 đều bị proton hoá, tạo thành dạng:
✔️Đúng. b. Đối với các amino acid chứa chuỗi bên trung tính, chúng có hai giá trị pKa tương ứng với nhóm carboxyl (pKa1) và nhóm amino (pKa2). Trong trường hợp này, điểm đẳng điện là giá trị trung bình số học của hai giá trị pKa này, được tính theo công thức:
pI = (pKa1 + pKa2) / 2.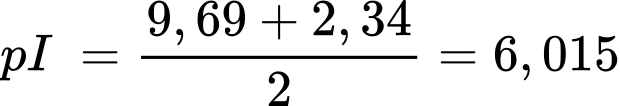
❌Sai. c. Tại pH = 9,69, điện tích trung bình của tất cả các dạng tồn tại luôn nhỏ hơn +1 chủ yếu tồn tại dạng anion.
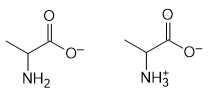
❌Sai. d. Khi pH tăng, dạng tồn tại của alanine có xu hướng chuyển từ điện tích dương sang điện tích âm.
✔️Đúng. a. Tại pH = 0 môi trường acid mạnh, nhóm COOH và NH2 đều bị proton hoá, tạo thành dạng:

✔️Đúng. b. Đối với các amino acid chứa chuỗi bên trung tính, chúng có hai giá trị pKa tương ứng với nhóm carboxyl (pKa1) và nhóm amino (pKa2). Trong trường hợp này, điểm đẳng điện là giá trị trung bình số học của hai giá trị pKa này, được tính theo công thức:
pI = (pKa1 + pKa2) / 2.
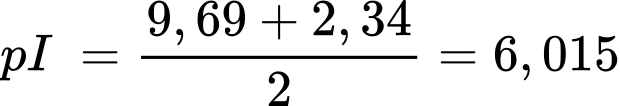
❌Sai. c. Tại pH = 9,69, điện tích trung bình của tất cả các dạng tồn tại luôn nhỏ hơn +1 chủ yếu tồn tại dạng anion.

❌Sai. d. Khi pH tăng, dạng tồn tại của alanine có xu hướng chuyển từ điện tích dương sang điện tích âm.
Câu 20 [706138]: Một sinh viên tiến hành phản ứng tráng bạc giữa formic acid với thuốc thử Tollens (dung dịch AgNO3 trong NH3) như sau:
• Bước 1: Rửa ống nghiệm bằng nước xà phòng hay dung dịch NaOH loãng, đun nóng. Rửa lại ống nghiệm nhiều lần bằng nước nóng.
• Bước 2: Cho 3 - 4 mL dung dịch AgNO3 2 % vào ống nghiệm. Thêm vài giọt dung dịch NaOH loãng, sau đó cho ammonia loãng 3 % cho đến khi tan hết kết tủa (vừa cho vừa lắc đều).
• Bước 3: Rót nhẹ tay khoảng 1 mL dung dịch formic acid 5 - 8 % theo thành ống nghiệm. Đặt cố định ống nghiệm vào cốc nước nóng già (khoảng 60 oC). Chú ý không để ống nghiệm bị rung lắc.
• Bước 1: Rửa ống nghiệm bằng nước xà phòng hay dung dịch NaOH loãng, đun nóng. Rửa lại ống nghiệm nhiều lần bằng nước nóng.
• Bước 2: Cho 3 - 4 mL dung dịch AgNO3 2 % vào ống nghiệm. Thêm vài giọt dung dịch NaOH loãng, sau đó cho ammonia loãng 3 % cho đến khi tan hết kết tủa (vừa cho vừa lắc đều).
• Bước 3: Rót nhẹ tay khoảng 1 mL dung dịch formic acid 5 - 8 % theo thành ống nghiệm. Đặt cố định ống nghiệm vào cốc nước nóng già (khoảng 60 oC). Chú ý không để ống nghiệm bị rung lắc.
Phân tích các phát biểu:
✔️ a. Đúng. Rửa sạch ống nghiệm bằng nước xà phòng hay dung dịch NaOH là bước quan trọng để loại bỏ các tạp chất có thể ảnh hưởng đến phản ứng tráng bạc. Bề mặt sạch sẽ giúp lớp bạc bám đều và sáng bóng.
✔️ b.Đúng. Ở bước 2, kết tủa tan tạo thành phức chất [Ag(NH3)2]OH.
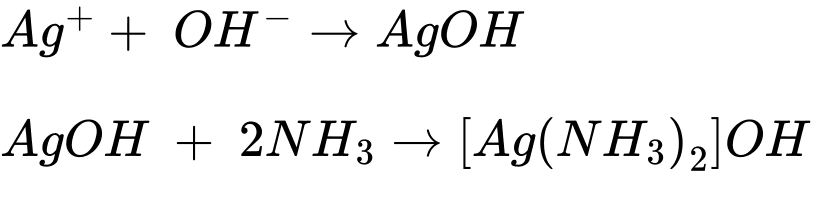
✔️c. Đúng. Có thể bỏ qua việc thêm vài giọt dung dịch NaOH loãng ở bước 2. Cho NH3 tạo thuốc thử Tollens, mục đích của thêm NaOH vào để kết tủa hoàn toàn Ag+.
✔️ d. Đúng. Nếu ống nghiệm bị rung lắc, quá trình tráng bạc sẽ không xảy ra đều trên thành ống nghiệm mà sẽ hình thành chất rắn màu đen là bạc vô định hình, và Ag sẽ không bám đều trong thành ống nghiệm.
✔️ a. Đúng. Rửa sạch ống nghiệm bằng nước xà phòng hay dung dịch NaOH là bước quan trọng để loại bỏ các tạp chất có thể ảnh hưởng đến phản ứng tráng bạc. Bề mặt sạch sẽ giúp lớp bạc bám đều và sáng bóng.
✔️ b.Đúng. Ở bước 2, kết tủa tan tạo thành phức chất [Ag(NH3)2]OH.
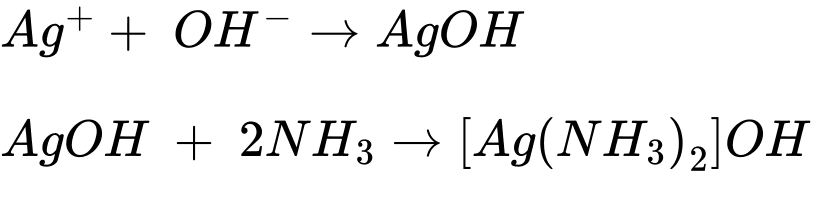
✔️c. Đúng. Có thể bỏ qua việc thêm vài giọt dung dịch NaOH loãng ở bước 2. Cho NH3 tạo thuốc thử Tollens, mục đích của thêm NaOH vào để kết tủa hoàn toàn Ag+.
✔️ d. Đúng. Nếu ống nghiệm bị rung lắc, quá trình tráng bạc sẽ không xảy ra đều trên thành ống nghiệm mà sẽ hình thành chất rắn màu đen là bạc vô định hình, và Ag sẽ không bám đều trong thành ống nghiệm.
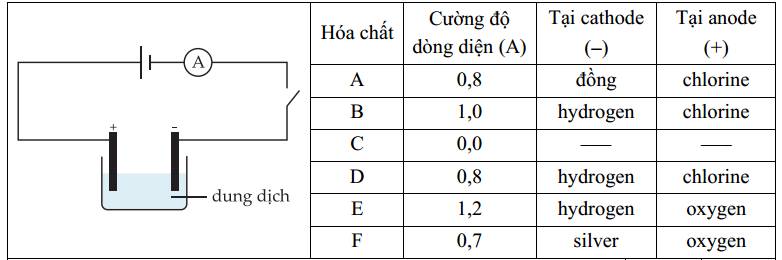
Câu 21 [560570]: Có 6 hóa chất từ A đến F được hòa tan trong nước và lần lượt nối vào mạch điện bên dưới. A đại diện cho một ampe kế, được sử dụng để đo dòng điện. Bảng hiển thị kết quả.

Phân tích các phát biểu sau:
✔️a. Đúng. Tại cathode thu được kim loại Cu, anode thu được khí chlorine => hóa chất A có thể là CuCl2.
Cathode ( - ) : Cu2+ + 2e ⟶ Cu
Anode ( + ) : 2Cl- ⟶ Cl2 + 2e
✔️ b. Đúng. Vì cường độ dòng điện bằng 0 nên chất C không dẫn diện, không có khả năng phân li thành ion trong dung dịch => Saccharose là đúng.
❌ c. Sai. Tại anode (+) thu được khí oxygen (nước bị điện phân) nên anion trong dung dịch không bị điện phân. Tuy nhiên có nhiều loại anion không bị điện phân như SO42-, NO3-, ClO4-,... => Dung dịch E và F có thể chứa khác loại anion.
Anode (+) 2H2O ⟶ 4H+ + O2 + 4e
❌d. Sai. Điện phân dung dịch B, D, E tại cathode có thể là điện phân nước và H+ để tạo H2
✔️a. Đúng. Tại cathode thu được kim loại Cu, anode thu được khí chlorine => hóa chất A có thể là CuCl2.
Cathode ( - ) : Cu2+ + 2e ⟶ Cu
Anode ( + ) : 2Cl- ⟶ Cl2 + 2e
✔️ b. Đúng. Vì cường độ dòng điện bằng 0 nên chất C không dẫn diện, không có khả năng phân li thành ion trong dung dịch => Saccharose là đúng.
❌ c. Sai. Tại anode (+) thu được khí oxygen (nước bị điện phân) nên anion trong dung dịch không bị điện phân. Tuy nhiên có nhiều loại anion không bị điện phân như SO42-, NO3-, ClO4-,... => Dung dịch E và F có thể chứa khác loại anion.
Anode (+) 2H2O ⟶ 4H+ + O2 + 4e
❌d. Sai. Điện phân dung dịch B, D, E tại cathode có thể là điện phân nước và H+ để tạo H2
Câu 22 [706139]: Đơn chất A phản ứng với nước, giải phóng một chất khí không màu, không mùi và dung dịch B. Khi dẫn CO2 qua B sẽ thu được kết tủa trắng C, kết tủa này bị hòa tan nếu tiếp tục dẫn CO2 qua. Khi hòa tan kết tủa C vào dung dịch HCl loãng thì xuất hiện bọt khí và thu được dung dịch cho màu đỏ cam với ngọn lửa đèn Bunsen. Khi đun nóng C sẽ thu được hợp chất D màu trắng, là chất ăn da và khi đun nóng D với carbon ở 1000 °C thì tạo thành chất rắn E, chất này được dùng để sản xuất công nghiệp acetylene và cyanamide, một loại phân bón chứa nitrogen.
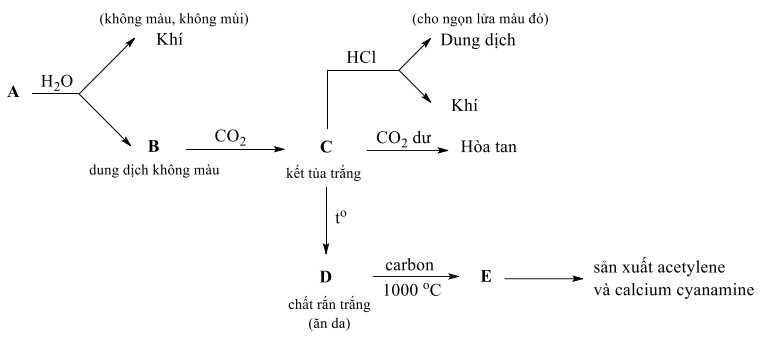

Dung dịch đốt trên ngọn đèn Bunsen có ngọn lửa màu đỏ cam cho biết dấu hiệu của hợp chất calcium.
→ Chất rắn A là Ca
Dung dịch B là Ca(OH)2, chất rắn C là CaCO3
Khi nung C thu được rắn D là CaO
⭐Các phương trình hoá học thoả mãn:
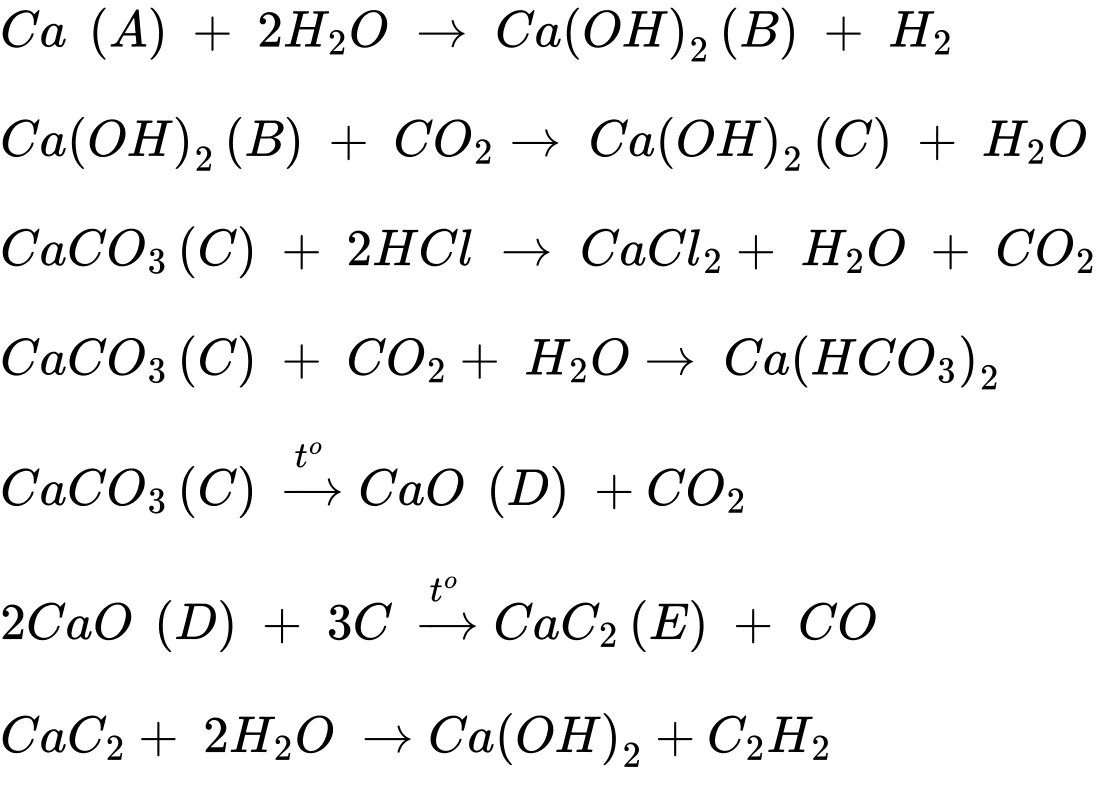
Phân tích các phát biểu:
✔️Đúng. a. Dung dịch đốt trên ngọn đèn Bunsen có ngọn lửa màu đỏ cam cho biết dấu hiệu của hợp chất calcium.
✔️Đúng. b. Hợp chất C là calcium carbonate.
✔️Đúng. c. Khi nung C thu được chất rắn D là CaO.
❌Sai. d. Hợp chất E calcium carbide là hợp chất vô cơ
→ Chất rắn A là Ca
Dung dịch B là Ca(OH)2, chất rắn C là CaCO3
Khi nung C thu được rắn D là CaO
⭐Các phương trình hoá học thoả mãn:
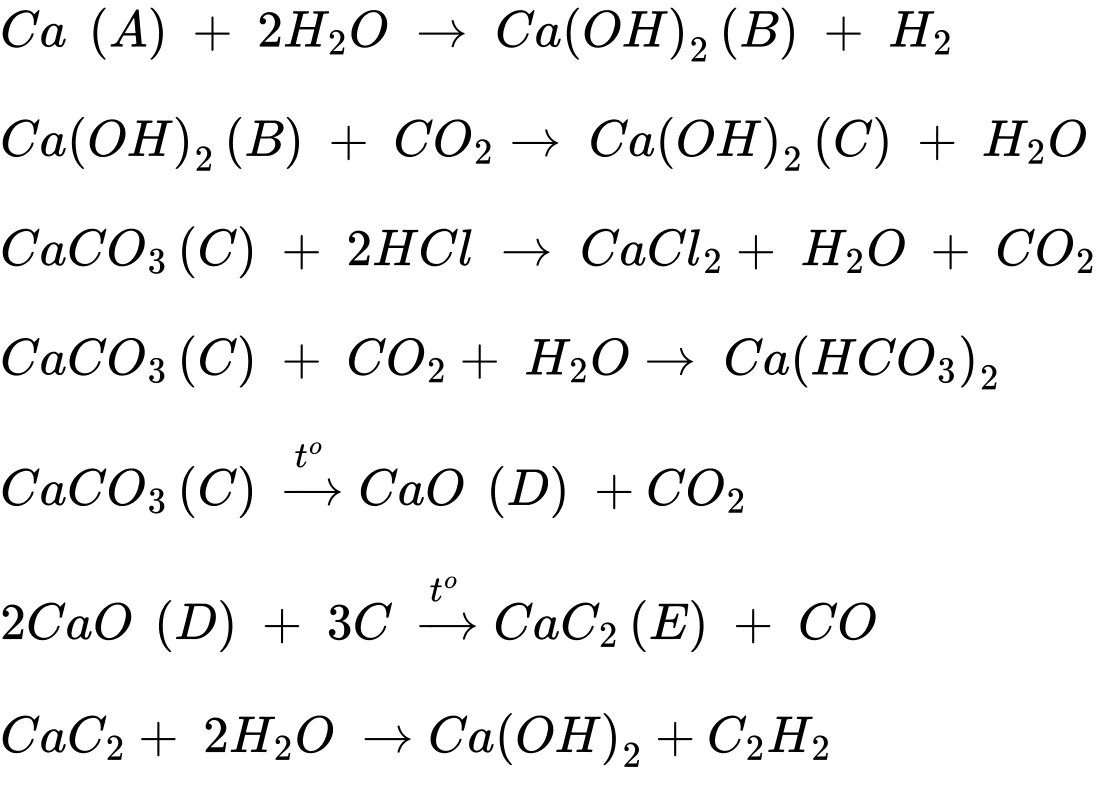
Phân tích các phát biểu:
✔️Đúng. a. Dung dịch đốt trên ngọn đèn Bunsen có ngọn lửa màu đỏ cam cho biết dấu hiệu của hợp chất calcium.
✔️Đúng. b. Hợp chất C là calcium carbonate.
✔️Đúng. c. Khi nung C thu được chất rắn D là CaO.
❌Sai. d. Hợp chất E calcium carbide là hợp chất vô cơ
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 23 [706140]: Gắn Zn vào vỏ tàu thành phần chính là Fe sẽ tạo thành cặp điện cực Zn – Fe. Hai điện cực này tiếp xúc trực tiếp với nhau và cùng tiếp xúc với dung dịch điện li nên xảy ra hiện tượng ăn mòn điện hóa. Trong đó, Zn đóng vai trò cực âm, bị ăn mòn nên vỏ tàu biển được bảo vệ. Cho một tấm kẽm có dạng hình hộp kích thước (dài × rộng × cao) là 80 × 14 × 6 (cm) được gắn trên tàu biển. Sau 30 ngày, lấy vật liệu ra làm khô và cân được 40,04 kg. Biết khối lượng riêng của Zn là 7,13 g/cm3.
Tính tốc độ ăn mòn trung bình của tấm kẽm theo đơn vị g/ngày (làm tròn đến hàng đơn vị).
Tính tốc độ ăn mòn trung bình của tấm kẽm theo đơn vị g/ngày (làm tròn đến hàng đơn vị).
Thể tích khối kẽm là: VZn = 80 × 14 × 6 = 6720 cm3
Khối lượng của khối kẽm là mZn = 6720 × 7 × 13 = 47913,6 gam
Đổi 40,04 kg = 40040 gam
Khối lượng kẽm mất đi trong 30 ngày là 47913,6 – 40040 = 7873,6 gam
Tốc độ ăn mòn trung bình của tấm kẽm là v = 7873,6 ÷ 30 ≈ 262 gam/ngày
⟹ Điền đáp án: 262
Khối lượng của khối kẽm là mZn = 6720 × 7 × 13 = 47913,6 gam
Đổi 40,04 kg = 40040 gam
Khối lượng kẽm mất đi trong 30 ngày là 47913,6 – 40040 = 7873,6 gam
Tốc độ ăn mòn trung bình của tấm kẽm là v = 7873,6 ÷ 30 ≈ 262 gam/ngày
⟹ Điền đáp án: 262
Câu 24 [706141]: Cho các kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 dưới đây:
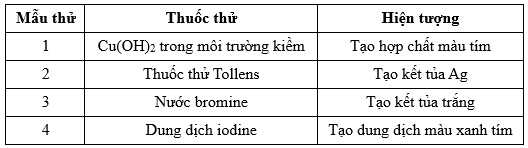
Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).

Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
⭐Mẫu thử 1: Trừ các dipeptide, các peptide còn lại có khả năng hoà tan Cu(OH)2 trong môi trường kiềm tạo thành phức chất tan trong nước có màu tím đặc trưng.Phản ứng này được gọi là phản ứng màu biuret.→ Mẫu thử 1 là Gly – Gly – Ala.
⭐Mẫu thử 2: Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
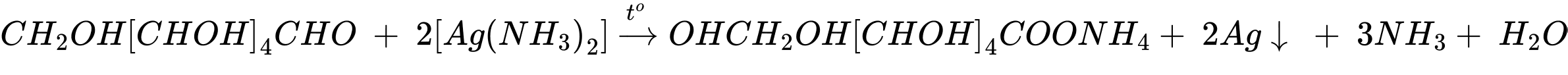
⭐Mẫu thử 3: Aniline + nước bromine
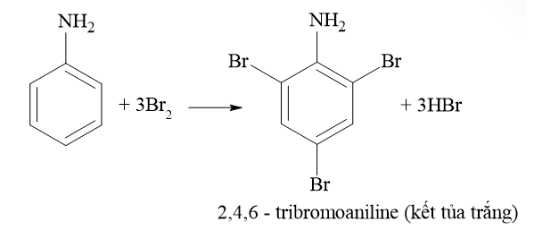
=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
⭐Mẫu thử 4: Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine.
⟹ Điền đáp án: 1423
⭐Mẫu thử 2: Tính chất của aldehyde: glucose tham gia phản ứng với thuốc thử Tollens tạo kết tủa bạc kim loại (phản ứng tráng gương).
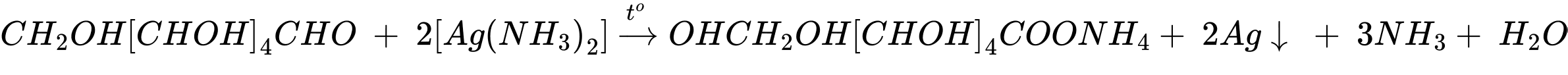
⭐Mẫu thử 3: Aniline + nước bromine

=> Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine
⭐Mẫu thử 4: Phân tử tinh bột hấp phụ iodine tạo thành hợp chất màu xanh tím. Phản ứng được sử dụng nhận biết tinh bột hoặc iodine.
⟹ Điền đáp án: 1423
Câu 25 [309553]: Thầy Minh xin lỗi các em, cuốn sách có sự nhầm lẫn, trùng lặp ID câu hỏi và sẽ được sửa trong lần tái bản sau!
[Đề 45 - Cuốn 50 Đề Minh hoạ 2025/ Bài Khái niệm – danh pháp – tính chất vật lí – điều chế POLYMER - Cuốn Tổng ôn Hoá Học Phần 1]
Trong công nghiệp, PVC dùng làm chất dẻo được sản xuất từ ethylene với hiệu suất giả định cho từng bước theo sơ đồ sau:
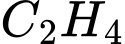
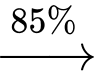
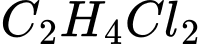
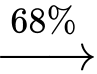
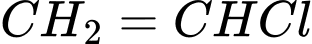
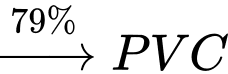
Cần bao nhiêu tấn ethylene để sản xuất 1 tấn PVC theo sơ đồ và hiệu suất trên?
(làm tròn đến hai chữ số thập phân)
Điền đáp án: [..........]
→ ID video chữa câu hỏi: [706014].
[Bài 38 - Cuốn Cấp tốc THPT Môn Hoá Học] Cho kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 sau:
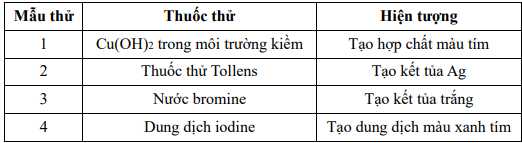
Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và
sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Điền đáp án: [..........]
→ ID video chữa câu hỏi: [861085].
[Đề 45 - Cuốn 50 Đề Minh hoạ 2025/ Bài Khái niệm – danh pháp – tính chất vật lí – điều chế POLYMER - Cuốn Tổng ôn Hoá Học Phần 1]
Trong công nghiệp, PVC dùng làm chất dẻo được sản xuất từ ethylene với hiệu suất giả định cho từng bước theo sơ đồ sau:
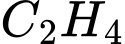
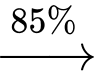
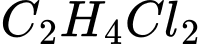
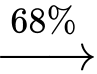
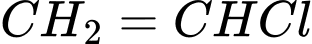
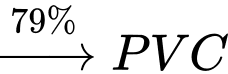
Cần bao nhiêu tấn ethylene để sản xuất 1 tấn PVC theo sơ đồ và hiệu suất trên?
(làm tròn đến hai chữ số thập phân)
Điền đáp án: [..........]
→ ID video chữa câu hỏi: [706014].
[Bài 38 - Cuốn Cấp tốc THPT Môn Hoá Học] Cho kết quả thí nghiệm của các mẫu thử được đánh số thứ tự từ 1 đến 4 sau:

Gán số thứ tự các mẫu thử trên ứng vơi các chất: Gly–Gly–Ala, hồ tinh bột, glucose, aniline và
sắp xếp theo trình tự dãy bốn số (ví dụ: 1234; 4231;…).
Điền đáp án: [..........]
→ ID video chữa câu hỏi: [861085].
[Giải Đề 45 - Cuốn 50 Đề Minh hoạ 2025/ Bài Khái niệm – danh pháp – tính chất vật lí – điều chế POLYMER - Cuốn Tổng ôn Hoá Học Phần 1]
Đổi: 1 tấn = 1000 kg
Xét 1 mắt xích PVC, ta có sơ đồ sau:
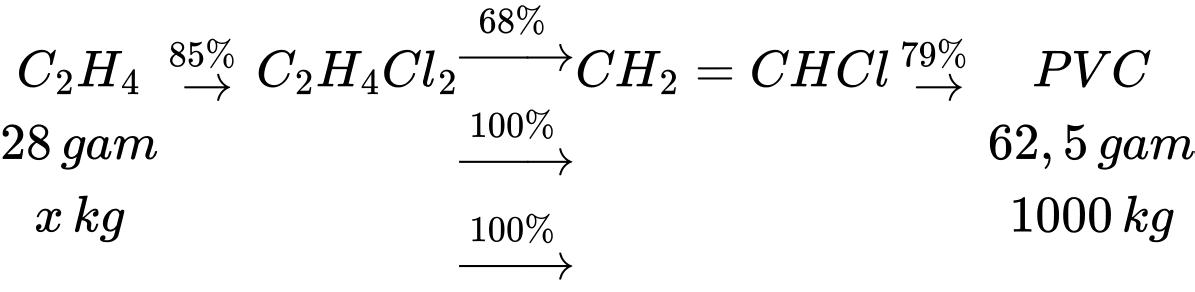
Theo tỉ lệ ta có: n ethylene theo lý thuyết = x =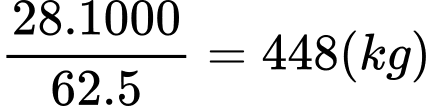
→ Hiệu suất toàn bộ quá trình là: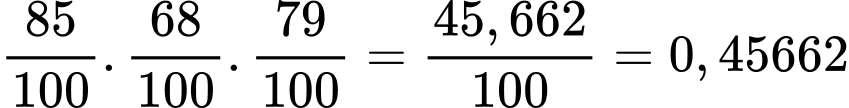
→ Khối lượng ethylene thực tế cần dùng là: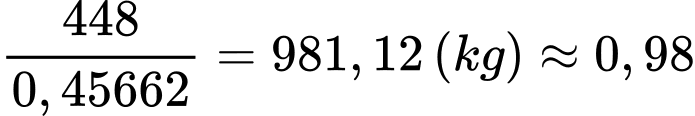 (tấn)
(tấn)
⇒Điền đáp án: 0,98
[Giải Bài 38 - Cuốn Cấp tốc THPT Môn Hoá Học]
Mẫu thử 1: Tác dụng với Cu(OH)2 tạo hợp chất màu tím . Phản ứng màu biuret.
⟶ Mẫu thử 1 là: Gly–Gly–Ala.
Mẫu thử 2: Glucose phản ứng với thuốc thử Tollens thu được kết tủa Ag.
Phương trình phản ứng:
C6H12O6 + 2[Ag(NH3)2]OH CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
Mẫu thử 3: Aniline tác dụng với nước Bromine tạo kết tủa trắng.
a.
Mẫu thử 4: Hồ tinh bột tác dụng với dung dịch iodine tạo dung dịch mãu xanh tím đặc trưng.
Số thứ tự các mẫu thử trên ứng với các chất là: (1)Gly–Gly–Ala; (3) Glucose, (4) aniline, (2) hồ tinh bột.
⟹ Điền đáp án 1342
Đổi: 1 tấn = 1000 kg
Xét 1 mắt xích PVC, ta có sơ đồ sau:
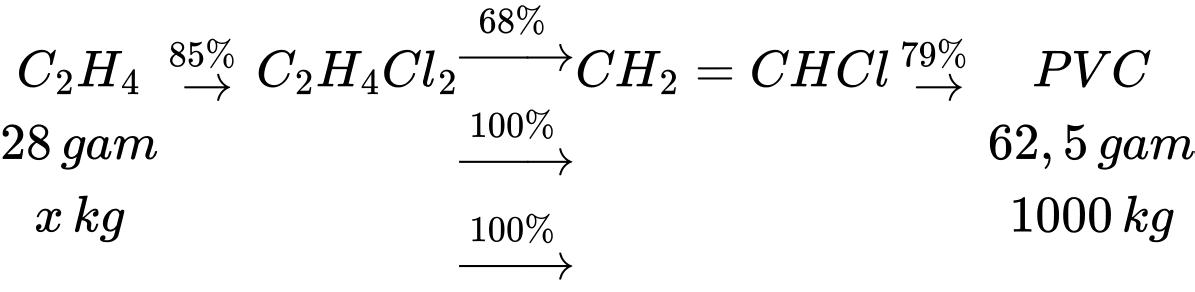
Theo tỉ lệ ta có: n ethylene theo lý thuyết = x =
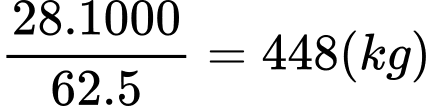
→ Hiệu suất toàn bộ quá trình là:
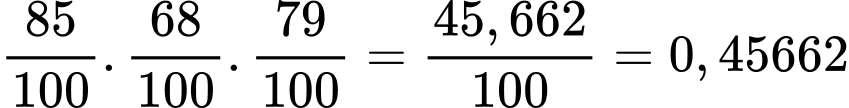
→ Khối lượng ethylene thực tế cần dùng là:
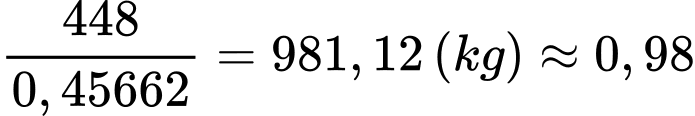 (tấn)
(tấn)⇒Điền đáp án: 0,98
[Giải Bài 38 - Cuốn Cấp tốc THPT Môn Hoá Học]
Mẫu thử 1: Tác dụng với Cu(OH)2 tạo hợp chất màu tím . Phản ứng màu biuret.
⟶ Mẫu thử 1 là: Gly–Gly–Ala.
Mẫu thử 2: Glucose phản ứng với thuốc thử Tollens thu được kết tủa Ag.
Phương trình phản ứng:
C6H12O6 + 2[Ag(NH3)2]OH
 CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O.
CH2OH(CHOH)4 + 2Ag + 2NH3 + H2O. Mẫu thử 3: Aniline tác dụng với nước Bromine tạo kết tủa trắng.
a.
Mẫu thử 4: Hồ tinh bột tác dụng với dung dịch iodine tạo dung dịch mãu xanh tím đặc trưng.
Số thứ tự các mẫu thử trên ứng với các chất là: (1)Gly–Gly–Ala; (3) Glucose, (4) aniline, (2) hồ tinh bột.
⟹ Điền đáp án 1342
Câu 26 [706142]: Cho các phát biểu sau:
(a) Ethylamine và dimethylamine đều là những chất khí ở điều kiện thường.
(b) Methylamine có khả năng làm dung dịch phenolphtalein chuyển màu hồng.
(c) Aniline có khả năng làm xanh giấy quỳ tím.
(d) Nhỏ vài giọt aniline vào nước, lắc kĩ thấy xuất hiện kết tủa.
(e) Khế chua có thể làm mất mùi tanh của cá đồng (gây ra do một số amine).
(g) Alanin là amine thơm, không làm quỳ tím ẩm đổi màu.
Số phát biểu đúng là
(a) Ethylamine và dimethylamine đều là những chất khí ở điều kiện thường.
(b) Methylamine có khả năng làm dung dịch phenolphtalein chuyển màu hồng.
(c) Aniline có khả năng làm xanh giấy quỳ tím.
(d) Nhỏ vài giọt aniline vào nước, lắc kĩ thấy xuất hiện kết tủa.
(e) Khế chua có thể làm mất mùi tanh của cá đồng (gây ra do một số amine).
(g) Alanin là amine thơm, không làm quỳ tím ẩm đổi màu.
Số phát biểu đúng là
Phân tích các phát biểu:
✔️Đúng. a. Trạng thái: Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của cá hoặc mùi khai tương ammonia tự (tuỳ nồng độ), các amine còn lại là chất lỏng hoặc rắn.
✔️Đúng. b. Trong phân tử amine: N còn một cặp e chưa liên kết ⟹ có thể tạo ra liên kết cho nhận (giống NH3) do đó các amine có tính chất hóa học tương tự ammonia.
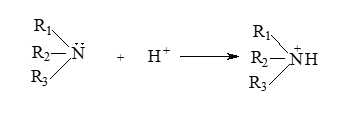
Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh hoặc phenolphthalein hóa hồng, còn dung dịch aniline không làm đổi màu quỳ tím hoặc phenolphthalein hóa hồng.
❌Sai. c. Aniline không cod khả năng làm đổi màu quỳ tím. Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh hoặc phenolphthalein hóa hồng.
❌Sai. d. Aniline là chất lỏng, ít tan trong nước.
✔️Đúng. e. Trong cá có các loại amin như: dimethyl amine, trimethyl amine là những chất tạo ra mùi tanh của cá. Khi cho thêm chất chua tức là cho thêm acid để chúng tác dụng với amine trên tạo muối làm giảm độ tanh cho cá.
RN + H+ → RNH+
❌Sai. Alanin là amino acid không làm quỳ tím đổi màu.
Số phát biểu đúng là: (a), (b), (e)
⟹ Điền đáp án: 3
✔️Đúng. a. Trạng thái: Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của cá hoặc mùi khai tương ammonia tự (tuỳ nồng độ), các amine còn lại là chất lỏng hoặc rắn.
✔️Đúng. b. Trong phân tử amine: N còn một cặp e chưa liên kết ⟹ có thể tạo ra liên kết cho nhận (giống NH3) do đó các amine có tính chất hóa học tương tự ammonia.
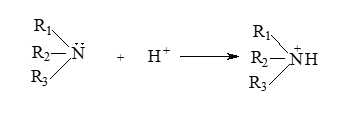
Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh hoặc phenolphthalein hóa hồng, còn dung dịch aniline không làm đổi màu quỳ tím hoặc phenolphthalein hóa hồng.
❌Sai. c. Aniline không cod khả năng làm đổi màu quỳ tím. Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh hoặc phenolphthalein hóa hồng.
❌Sai. d. Aniline là chất lỏng, ít tan trong nước.
✔️Đúng. e. Trong cá có các loại amin như: dimethyl amine, trimethyl amine là những chất tạo ra mùi tanh của cá. Khi cho thêm chất chua tức là cho thêm acid để chúng tác dụng với amine trên tạo muối làm giảm độ tanh cho cá.
RN + H+ → RNH+
❌Sai. Alanin là amino acid không làm quỳ tím đổi màu.
Số phát biểu đúng là: (a), (b), (e)
⟹ Điền đáp án: 3
Câu 27 [706143]: Quá trình chuyển hóa ammonium chloride từ dạng khan sang dạng dung dịch (bằng cách hòa tan vào nước) là một quá trình thu nhiệt.
NH4Cl(s) NH4Cl(aq);
NH4Cl(aq); 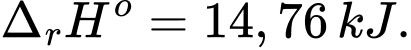
Sự giảm nhiệt độ khi phản ứng hòa tan ammonium chloride vào nước giúp nó được ứng dụng trong các túi chườm giúp giảm đau, giảm viêm một cách tạm thời. Nếu mỗi túi chườm lạnh chứa 20 gam muối và 100 mL nước cất (có D = 1 g/mL) thì khi hoạt động, nhiệt độ của túi chườm hạ xuống là t2 (oC). Biết nhiệt lượng cần để nâng nhiệt độ của 1,0 gam sản phẩm lên 1 oC là 4,184 J. Xác định giá trị của t2 (làm tròn đến hàng phần mười).
NH4Cl(s)
 NH4Cl(aq);
NH4Cl(aq); 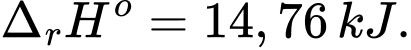
Sự giảm nhiệt độ khi phản ứng hòa tan ammonium chloride vào nước giúp nó được ứng dụng trong các túi chườm giúp giảm đau, giảm viêm một cách tạm thời. Nếu mỗi túi chườm lạnh chứa 20 gam muối và 100 mL nước cất (có D = 1 g/mL) thì khi hoạt động, nhiệt độ của túi chườm hạ xuống là t2 (oC). Biết nhiệt lượng cần để nâng nhiệt độ của 1,0 gam sản phẩm lên 1 oC là 4,184 J. Xác định giá trị của t2 (làm tròn đến hàng phần mười).
Số mol của NH4Cl là n NH4Cl = 20 ÷ 53,5 mol
⟶ Lượng nhiệt tạo ra : 20 ÷ 53,5 × 14,76 × 1000 (J)
Nhiệt lượng NH4Cl hấp thụ khi hòa tan vào nước là:
20 ÷ 53,5 × 14,76 × 1000 = 100 × 4,184 × (t2 - 25 )
→ t2 = 11,8oC.
⟹ Điền đáp án: 11,8
⟶ Lượng nhiệt tạo ra : 20 ÷ 53,5 × 14,76 × 1000 (J)
Nhiệt lượng NH4Cl hấp thụ khi hòa tan vào nước là:
20 ÷ 53,5 × 14,76 × 1000 = 100 × 4,184 × (t2 - 25 )
→ t2 = 11,8oC.
⟹ Điền đáp án: 11,8
Câu 28 [706144]: Trong công nghiệp chlorine-kiềm, dung dịch sodium chloride (NaCl) bão hoà có nồng độ khoảng 300 g.L–1 chỉ được điện phân một phần thành “nước muối nghèo” có nồng độ 220 g.L–1. “Nước muối nghèo" sau đó được dẫn ra khỏi bể điện phân, trong khi nước muối bão hoà mới được bơm vào. Từ x lít dung dịch NaCl bão hoà điện phân thành “nước muối nghèo” sẽ sản xuất được một thùng 10 lít xút 50% thương phẩm có khối lượng riêng là 1,52 g.mL–1. Biết lượng xút trong quá trình điều chế thất thoát 20% và trong quá trình điện phân, thể tích dung dịch thay đổi không đáng kể. Tính giá trị của x (làm tròn đến hàng đơn vị).
Đổi 10 L = 10000 mL
Khối lượng dung dịch NaOH là mdd NaOH = 10000 × 1,52 = 15200 gam
Khối lượng NaOH là mNaOH = 15200 × 50% = 7600 gam
Số mol của NaOH là nNaOH = 7600 ÷ 40 = 190 mol
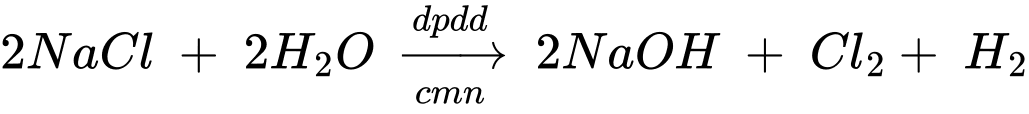
Theo phương trình số mol của NaCl là 190 mol
Khối lượng của NaCl là: x.(300 – 220) = 190 × 58,5 : 80% → x ≈ 173,67
⟹ Điền đáp án: 174
Khối lượng dung dịch NaOH là mdd NaOH = 10000 × 1,52 = 15200 gam
Khối lượng NaOH là mNaOH = 15200 × 50% = 7600 gam
Số mol của NaOH là nNaOH = 7600 ÷ 40 = 190 mol
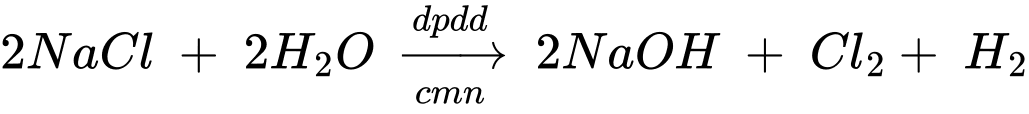
Theo phương trình số mol của NaCl là 190 mol
Khối lượng của NaCl là: x.(300 – 220) = 190 × 58,5 : 80% → x ≈ 173,67
⟹ Điền đáp án: 174